In Teil 1 unserer Reihe „Evolution for IDiots“ befassten wir uns mit der Evolution des Kreationismus. Dabei lernten wir die modernste Version des Kreationismus, das „Intelligent Design“ kennen. Intelligent Design unterscheidet sich von den anderen „klassischeren“ Formen des Kreationismus dadurch, dass sie – zumindest in der Öffentlichkeit – die religiösen Bekundungen des Schöpfungsglaubens auslassen. Weiterhin erkennen sie das hohe Alter der Erde an. Stattdessen haben sei einen anderen Schwerpunkt, nämlich den „Design“ in der Natur. Die Komplexität des Lebens könne nicht durch blinden Zufall entstanden sein. Außerdem sind die komplexen Strukturen irreduzierbar komplex, d. h., wenn man einzelne Teile aus einem System entfernt, so ist dieses System nicht mehr funktionsfähig. Diese komplexen Dinge können nicht einfach so entstanden sein, viel mehr war ein intelligenter Designer am Werk. Diese Argumentation geht auf William Paley zurück, einem berühmten Naturtheologen, der 1802 „Natural Theology“ schrieb. Paleys berühmteste Metapher ist die des Uhrmachers. Wenn man an einem Strand entlangläuft und eine Uhr findet, dann weiß man, dass diese Uhr nicht durch Zufall entstanden sein kann, sondern, dass diese designt wurde, die also jemand gemacht habe. Dasselbe gilt auch für das Leben. In Teil 1 hatten wir den philosophischen Fehler des Intelligent Designs auseinandergenommen. In diesen Teil befassen wir uns mit einem der Lieblingsbeispiele des Intelligent Designs und erörtern, dass diese nicht durch einen Intelligenten Designer, sondern durch Evolution entstanden sind.
Perfektes Design?
Stephen Jay Gould (1980) gibt in seinem Buch „Der Daumen des Panda – Betrachtungen zur Naturgeschichte“ einige Beispiele für diese Unvollkommenheit der Natur („Bad Design“ statt Intelligent Design“). Sein Lieblingsbeispiel ist der Pseudodaumen des Großen Panda (Abb. 1)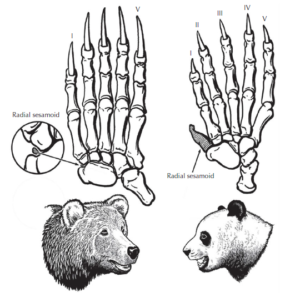
Abb. 1: Der Große Panda bildet aus einen seiner Handwurzelknochen einen Pseudodaumen, um Bambus zu umgreifen (Abbildung nach Prothero 2017)
Der Große Panda hat, wie alle Vertreter der Ordnung Carnivora (hierzu gehören Vertreter der Hunde- du Katzenartigen, inklusive Bären, Marder etc.), 5 Finger, die eine Tatze bilden. Aber anders als andere Carnivora ernährt sich der Große Banda ausschließlich von Bambus. Einer seiner Handwurzelknochen, das radiale Sesambein der Vorderpfote, bildet einen Pseudodaumen zum Umgreifen von Bambus. Dieser Pseudodaumen ist nicht sehr beweglich und nicht sehr stark. Aber er reicht aus, damit Pandas den Bambus greifen und fressen können.
Ein weiteres Beispiel für schlechtes Design sind die höhlenbewohnenden Fische, die trotzdem während der Embryonalentwicklung Augen entwickeln, mit denen sie aber nicht sehen können.
Noch merkwürdiger ist der Verlauf des Rückläufigen Kehlkopfnervs (Nervus laryngeus recurrens), der das Gehirn mit dem Kehlkopf verbindet und das Sprechen ermöglicht. Bei Säugetieren vermeidet dieser Nerv den direkten Weg zwischen Gehirn und Kehlkopf und verläuft stattdessen hin zur Brust, umschlingt die Aorta in der Nähe des Herzens und kehrt dann zum Kehlkopf zurück (Abb. 2). Das macht diesen Nerv siebenmal länger als er sein muss! Für ein Tier wie die Giraffe durchquert es den gesamten Hals zweimal, ist also 4,5 m lang! Dieses Design ist nicht nur verschwenderisch und alles andere als intelligent, sondern macht ein Tier auch anfälliger für Verletzungen.
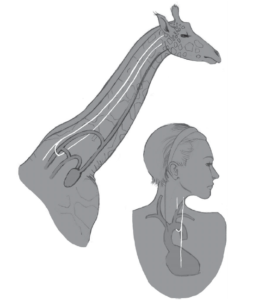
Abb. 2: Verlauf des rückläufigen Kehlkopfnervs: Alles andere als ein intelligentes Design. (Abbildung nach Prothero 2017)
Natürlich macht der bizarre Verlauf dieses Nervs evolutionär absolut Sinn. Bei Fischen und frühen Säugetierembryonen ist der Vorläufer des Rückläufigen Kehlkopfnervs tief im Hals- und Körperbereich am sechsten Kiemenbogen befestigt. Fische behalten dieses Muster immer noch bei. Während der späteren Embryonalentwicklung bei Säugetieren werden diese Kiemenbögen jedoch umgewandelt und bilden das Gewebe unserer Halsregionen und des Rachenraumes. Teile des alten fischartigen Kreislaufsystems wurden neu angeordnet, sodass die Aorta (ebenfalls Teil des sechsten Kiemenbogens) in die Brust zurückkehrte und den Rückläufigen Kehlkopfnerv (der sich um die Aorta schlang) ebenfalls in den Brustraum mitführte.
Zu kompliziert für Evolution?
Das Argument der irreduzierbaren Komplexität ist auch nicht überzeugend. Vertreter des Intelligent Design haben einige Lieblingsbeispiele, z. B. das Auge oder – Michael Behes Lieblingsbeispiel – das Flagellum von Bakterien. Sie behaupten, dass diese Strukturen so kompliziert sind, dass sie unmöglich durch Evolution entstanden sein können. Jedes Einzelteil, z. B. des Auges, erfülle wichtige Funktionen und wenn man diese entfernt, kann das System nicht mehr funktionieren. Die Wahrscheinlichkeit, dass solche Systeme entstehen können, sei extrem gering. Gerne wird dabei die Analogie des Astronomen Fred Hoyle benutzt, die von der Entstehung einer Boeing 747 auf dem Schrottplatz handelt. Die Wahrscheinlichkeit, dass Leben auf der Erde entstehe, sei so wahrscheinlich wie ein Wirbelsturm, der über einen Schrottplatz fegt und rein zufällig eine Boeing 747 zusammenbaut. Dieses Argument wird auf die Evolution angewendet. Die Wahrscheinlichkeit, dass durch zufälliges Durcheinanderwirbeln der Einzelteile ein funktionsfähiges Auge oder gar Lebewesen entstehe, liege im gleichen Bereich wie die des zufälligen Entstehens einer Boeing 747. Das ist, kurz zusammengefasst, das Lieblingsargument der Kreationisten – ein Argument, das man allerdings nur dann vertreten kann, wenn man den wichtigsten Aspekt der natürlichen Selektion nicht begriffen hat (übrigens gilt das Beispiel der Boeing 747 auch nicht für die Entstehung des Lebens). Natürliche Selektion ist ein additiver Prozess, der das Problem der Unwahrscheinlichkeit in viele kleine Teile zerlegt. Richard Dawkins hat dies in seinem Buch „Climbing Mount Improbable“ (Gipfel des Unwahrscheinlichen) schön dargestellt (Dawkins 1999). Auf einer Seite des Berges ist eine Felswand, die man unmöglich besteigen kann, aber auf der anderen Seite führt eine sanfte Böschung zum Gipfel. Auf dem Gipfel steht ein komplexes Gebilde, beispielsweise ein Auge oder der Flagellenmotor der Bakterien. Kreationisten haben die absurde Vorstellung, dass solche komplexen Gebilde wie das Auge in einem Schritt entstanden sind, ohne Zwischenstufen. Der Kreationismus symbolisiert also den Sprung vom Fuß der Felswand zum Gipfel. Die Evolution dagegen begibt sich auf die andere Seite des Berges und kriecht über die sanfte Steigung zum Gipfel (vgl. Abb. 3)
Die Evolution des Auges
Wenn man sich das Tierreich anschaut, so ist gerade das Auge, welche die Vertreter des Intelligent Design für so unmöglich halten, ein wunderbares Beispiel für diese sanfte Steigung zum Gipfel (Abb. 3).
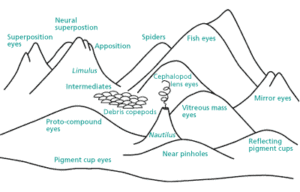
Abb. 3: Das Auge ist ein gutes Beispiel für den „Gipfel des Unwahrscheinlichen“ (Abbildung aus Dawkins 1999)
Es gibt im Tierreich eine ganze Reihe unterschiedlicher Augentypen. Wirbeltiere, damit inklusive uns Menschen, besitzen kameraähnliche Augen mit einer einzigen Linse (sogenanntes Linsenauge). Gliederfüßer (Arthropoden) wie Krebse und Insekten besitzen sog. Komplexaugen. Viele unabhängige Einzelaugen sammeln gemeinsam die visuellen Informationen. Tintenfische, die mit uns nicht näher verwandt sind, verfügen ebenfalls über ein kameraähnliches Linsenauge, dass bei der genauen Betrachtung jedoch anders konstruiert ist, als das der Wirbeltiere (Abb. 4). Augen der Wirbeltiere und Kopffüßer sind unabhängig voneinander zu einer ähnlichen Lösung gekommen visuelle Informationen aufzunehmen und zu verarbeiten, man spricht von konvergenter Evolution. Die einzelnen Strukturen der beiden Augen sind teilweise auch aus anderen embryonalen Geweben entstanden. Was uns viel mehr interessiert, besonders im Hinblick eines „intelligenten Designers“ ist die verblüffende Feststellung, dass das Auge der Tintenfische viel intelligenter konstruiert ist, als das der Wirbeltiere. Bei den Kopffüßern richten sich die Sehzellen der Netzhaut (Retina; photoreceptor cells in Abb. 4) nach der dem Licht zugewandten Seite (everses Auge), sodass die Nervenbahnen hinter den Sehzellen als Sehnerv austreten. Da sich die Retina vom hinteren Teil einer von der Epidermis abgeschnürten Blase bildet, ist diese Anordnung so möglich. Anders hingegen beim Wirbeltierauge. Die Retina und das diese umgebende Pigmentepithel entwickeln sich als becherförmige Vorstülpung des Zwischenhirns (also aus einer anderen Zellschicht als bei den Kopffüßern). Deswegen sind die Sehzellen dem Pigmentepithel zugekehrt und damit vom einfallenden Licht abgewandt sind (inverses Auge). Die Nervenfasern verlaufen daher in Richtung Licht zugewandter Seite aus, machen einen Umweg durch das „innere“ des Augen und treten durch den sogenannten „Blinden Fleck“ (bei dem sich keine Sehzellen befinden) als Sehnerv aus dem Auge Richtung Gehirn aus. Die umgekehrte Ausrichtung der Sehzellen, die Umwege der Nervenfasern und der Blinde Fleck sind, da Kreationisten und als perfektes Abbild Gottes sehen, sind keineswegs ein Zeichen für intelligentes Design – es sei denn Gott ist ein Tintenfisch. Für die Evolution des Linsenauges gibt es offensichtlich mehrere Lösungswege, die Kopffüßer und Wirbeltiere auf ihre unterschiedliche Weise gelöst haben.
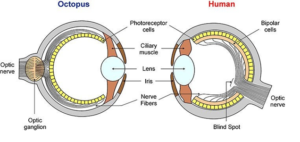
Abb. 4: Aufbau des Auges bei Tintenfisch und Mensch im Vergleich.
Doch die Frage bleibt offen: wie können solch komplexe Gebilde wie das Linsenauge entstanden sein? Welchen Nutzen hat ein „halbes Auge“? Nun ist zumindest sonnenklar, dass der Einäugige unter den Blinden König ist und das trifft im Prinzip auch auf die Evolution der Augen zu. Es gibt nämlich eine Reihe unterschiedlicher, einfacher gebauten Augentypen. Das kann z. B. bei einer Gruppe von Tieren wunderbar gezeigt werden – den Mollusken. Zu den Mollusken zählen Kopffüßer, Muscheln und Schnecken. Diese Tiere haben die verschiedensten Augentypen: von einfachen Pigmentzellen, die zwischen dunkel und hell unterscheiden können, bis zu den komplexen Linsenaugen der Tintenfische, die wir eben kennengelernt haben (Abb. 5).
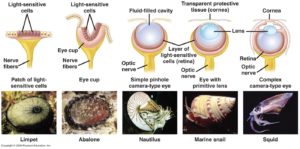
Abb. 5: Augentypen bei Mollusken
Zwischen diesen beiden Extremen finden sich verschiedene Übergangsformen. Ein Auge, so komplex wie das Linsenauge, muss also nicht in einem Schritt entstanden sein, sondern über verschiedene Zwischenstufen; der Gipfel (Auge) wird also durch eine sanfte Steigung erreicht. Tatsächlich ist die Entstehung komplexer Augentypen aus einfachen Pigmentzellen, die nur hell/dunkel unterscheiden können, gar nicht so kompliziert. Schon Darwin schrieb in Kapitel 6 in Entstehung der Arten:
„Das einfachste Organ, welches ein Auge genannt werden kann, besteht aus einem von Pigmentzellen umgebenen und von durchscheinender haut bedeckten Sehnerv, aber noch ohne Linse oder andere lichtbrechende Körper.“ Quelle
Alle Augen bestehen aus lichtempfindlichen Zellen (Lichtrezeptoren) und Pigmentzellen, die den Winkel des einfallenden Lichts so beeinflussen, dass es die Lichtrezeptoren erreicht. Die primitivsten Augen bestehen also aus diesen zwei Zelltypen und man findet diese tatsächlich bei vielen Lebewesen (Abb. 6), so auch bei den Larven bestimmter Tiere, so bei dem Wurm Platynereis dumerilii. Einen Tag nach der Entwicklung aus einer befruchteten Eizelle verfügt die Larve über zwei Augen aus jeweils zwei Zellen. Die Entwicklung der größeren, becherförmigen Augen des heranwachsenden Wurms ist mit der Erhöhung der Anzahl der Lichtrezeptor- und Pigmentzellen verbunden (Arendt et al. 2002). Die Augenzellen des gleichen Typs vermehren sich und ordnen sich dreidimensional an – gleiche Bausteine, andere Organisation.
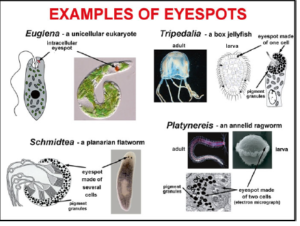
Abb. 6: Unterschiedliche „Augenflecken“ bei einfach gebauten Lebewesen. Bildquelle: Ellis (2010)
Unterschiedliche Lichtsinnesorgane sind also das Produkt unterschiedlicher Evolutionswege aus einfachen Strukturen. Ausgehend von einfachen Veränderungen kam es nach und nach zu geringfügigen Veränderungen, die die Funktionsleistungen der Augen verbesserten. Nilsson & Pelger (1994) stellten sich die Frage, wie lange die natürliche Selektion brauchen würde um komplexe Strukturen wie Linsenaugen entstehen zu lassen und entwarfen ein mathematisches Modell. Sie erlaubten den Strukturen sich zufällig zu verändern und begrenzten die Veränderungen für jeden Schritt auf 1% (z. B. durfte die Größe die Augen nur um 1% zunehmen). Dabei konnten sich nur die veränderten Strukturen weiterentwickeln, die die Sehleistungen verbessern. Ihren – konservativen & pessimistischen – Berechnungen zufolge waren nur 1.829 Schritte notwendig um aus einer einfachen Pigmentschicht ein Linsenauge entstehen zu lassen. Sie berechneten auch, wie lange solch eine Umwandlung dauern würde – dabei wurden nur eine moderate genetische Vielfalt und eine schwache Wirkung der natürlichen Selektion zugelassen. Aber selbst unter diesen konservativen Berechnungen würde es nur 400.000 Jahre dauern, bis solch eine Struktur entstehen kann (Abb. 7).

Abb. 7: Evolutionsschritte zur Entstehung des Linsenauges nach Nilsson & Pelger (1994), n = Zahl der Veränderungen
Die Genetik der Augenkonstruktion
Die Evolution der Augen ist also im Prinzip erklärbar und stellt kein „Dilemma“ für Evolutionsbiologen dar. Biologen diskutieren jedoch, wie häufig Augen im Verlauf der Evolution entstanden sind. Salvini-Plawen & Mayr (1977) äußerten aufgrund der Morphologie der Augentypen im Tierreich, dass Augen über 40-mal unabhängig voneinander entstanden sind. Neuere Erkenntnisse, die in Kürze vorgestellt werden, werfen neues Licht auf diese Frage auf. Es geht im Prinzip darum, wie häufig Augen immer wieder von Grund auf neu erfunden wurden oder ob an ihrer Evolution gemeinsame Bestandteile wirken, die bei einem oder mehreren gemeinsamen Vorfahren vorhanden waren. Neueste Entdeckungen geben darüber Auskunft, dass unterschiedliche gebaute Augen aus unterschiedlichen Tiergruppen mehr Gemeinsamkeiten haben, als angenommen. Quiring et al. (1994) befassten sich mit einem Gen, das bei der Fliege Drosophila an der Entstehung für Komplexaugen beteiligt ist. Wird dieses Gen durch eine Mutation funktionslos gemacht, bleibt die Augenentwicklung aus. Daher trägt das Gen den Namen „eyeless“. Als die Wissenschaftler das eyeless-Gen isolierten, stellten sie fest, dass das von eyeless codierte Protein zwei anderen Proteinen ähnelt, die von einem Gen des Menschen und einem der Maus codiert werden. Diese Proteine (bei der Maus „small eye“, beim Menschen „Aniridia“) sind an der Entwicklung der Linsenaugen beteiligt. Bei allen drei Arten haben wir es mit dem gleichen Protein zu tun, weshalb es heute den Namen Pax-6 trägt. Das Pax-6-Gen ist an der Entwicklung der Augen beteiligt.
Weitere Experimente bestätigten, dass die Pax-6-Gene von Maus und Fliege austauschbar sind. Das Pax-6-Gen der Fliege wurde beim Fliegen-Embryo an unterschiedliche Stellen gebracht, z. B. an den Beinen, Flügeln und Antennen. Auch an diesen Stellen wurde die Bildung von Augengewebe in Gang gesetzt (Abb. 8). Das Pax-6-Gen von Mäusen wurde auch bei Fliegen eingesetzt und sorgte auch dort für die Ausbildung von Fliegen-Augengewebe (Halder, Callaerts & Gehring 1995).
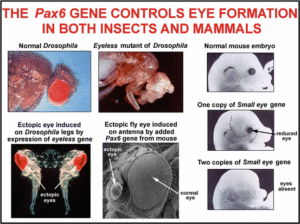
Abb. 8: Wirkungen des Pax-6-Gens. Bildquelle: Ellis (2010)
Diese Befunde weisen darauf hin, dass nicht nur die Sequenzen dieser Proteine einander ähneln, sondern auch dieselbe Funktion haben: die Beteiligung an der Ausbildung der Augen. Weil Fliegen (Stamm Arthropoda) und Mäuse (Stamm Chordata) dieselben Gene zur Entwicklung von Augen nutzen, musste auch ihr gemeinsamer Vorfahre diese besitzen. Evolutionsbiologisch sind beide Gruppen sehr entfernt miteinander verwandt, aus dem auch andere Tierstämme hervorgegangen sind. Tatsächlich fand man das Pax-6-Gen u.a. bei Tintenfischen (Stamm Molluska), Strudel- und Bandwürmern (Stamm Plathelminthes). Offensichtlich hatte mindestens der Vorfahre aller sog. „Bilateria“ (alle Tiere, die über eine linke und rechte Körperhälfte verfügen – das sind im Prinzip alles Tierstämme außer den Schwämmen und Nesseltieren; zu letzteren gehören die Quallen und Korallen), wenn nicht sogar aller mehrzelligen Tiere das Pax-6-Gen für die Ausbildung der Augen genutzt (Gehring & Ikeo 1999).
Aber unser molekulares Wissen zur Evolution der Augen reduziert sich nicht nur auf das Gen Pax-6. Von den Rezeptorzellen, die für die Lichtwahrnehmung verantwortlich sind, gibt es zwei Zelltypen: den Rhabdomertyp, der sich u. a. bei Insekten und Mollusken findet und der Cilientyp, der sich bei Wirbeltieren wiederfindet (Abb.9). Der Unterschied hat damit zu tun, dass die Membran der Zellen vergrößert wird, um mehr Opsine aufnehmen zu können. Zur Lichtwahrnehmung in den Rezeptorzellen dienen sog. Opsinproteine. Ein bekanntes Rezeptormolekül der Augen der Wirbeltiere ist z. B. das Rhodopsin. Es befindet sich in den Stäbchen-Zellen der Netzhaut und ist an der Hell-Dunkel-Wahrnehmung beteiligt (für das Farbensehen in den Zapfen-Zellen der Netzhaut sind andere Opsine verantwortlich). Untersuchungen am Wurm Platynereis dumerilii konnten auch dieses Rätsel lösen. Im Gehirn dieser Würmerbefinden sich während der Embryonalentwicklung cilienbesetzte Zellen, die den Lichtrezeptorzellen der Wirbeltiere ähneln. Diese Zellen produzieren auch ein Opsin, welches eine größere Ähnlichkeit mit den Opsinen der Wirbeltiere haben als mit den Opsinen der Lichtrezeptorzellen im Auge der Würmer. Dieses „cililäre Opsin“ wirkt nicht am Sehvorgang mit, sondern bei der Steuerung der biologischen Uhr. Damit besitzt der Wurm beide Typen von Lichtrezeptoren und Opsinen. Auch diese Entdeckung lässt darauf schließen, dass die Vorfahren der Ringelwürmer (Stamm Annelida), Kopffüßer (Stamm Mollusca) und Wirbeltiere (Stamm Chordata) ebenfalls beide Versionen von Lichtrezeptorzellen und Opsinen besaßen. Ins Sehzentrum der Mollusken, Anneliden und Arthropoden wurde dann der Rhabdomerentyp aufgenommen, während der Cilientyp bei den Wirbeltieren als Lichtrezeptortyp fungierte (Arendt 2003, Arendt et al. 2004).
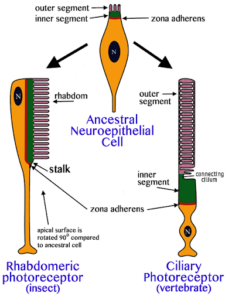
Abb. 9: Zwei Typen der Lichtsinneszellen
Literatur
Arendt, D. (2003): Evolution of eyes and photoreceptor cell types. Int J Dev Biol. 47(7-8):563-71
Arendt, D. et al. (2002): Development of pigment-cup eyes in the polychaete Platynereis dumerilii and evolutionary conservation of larval eyes in Bilateria. Development 129: 1143-1154
Arendt, D. et al. (2004): Ciliary photoreceptors with a vertebrate-type opsin in an invertebrate brain. Science 306: 869-871
Dawkins, R. (1999): Gipfel des Unwahrscheinlichen. Reinbek: Rowohlt
Ellis, J. (2010): How Science Works: Evolution. 2nd. Edition. Springer Verlag
Gehring, W. & Ikeo, K. (1999): Pax 6: mastering eye morphogenesis and eye evolution. Trends Genet. 15 (9): 371-7
Gould, S. J. (1980): Der Daumen des Panda – Betrachtungen zur Naturgeschichte
Halder, G., Callaerts, P. & Gehring, W. (1995): Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science 267: 1788-1792
Nilsson, D.-E., and S. Pelger. (1994): A pessimistic estimate of the time required for an eye to evolve. Proc. Roy. Soc. Lond. B 256:53-58.
Prothero, D. (2017): Evolution – What the Fossils say and why it matters. Second edition. New York: Columbia University Press
Salvini-Plawen, L. V. & Mayr, E. (1977): On the Evolution of Photoreceptors and Eyes. Evol Biol. 10: 207-263
Quiring, R. et al. (1994): Homology of the eyeless gene of Drosophila to the Small eye gene in mice and Aniridia in humans.. Science 265: 785-789


