Valentinstag ist der Tag der Blumen. Am liebsten verschenkt werden natürlich rote Rosen oder rote Nelken. Die Farbe Rot – eine magisch schöne Rote Farbe. Dass wir diese Farbe erkennen können, verdanken wir unseren Vorfahren. Dies ist eine kleine Geschichte der Evolution des Farbfernsehens bei den Primaten.
Farbensehen
Einige Lebewesen, so auch wir Menschen, sind in der Lage Farben zu unterscheiden. Doch was sind Farben eigentlich? Farbe ist die individuelle visuelle Wahrnehmung, die durch Licht, das in dem für das menschliche Auge sichtbaren Bereich liegt, hervorgerufen wird. Die für den Menschen wahrnehmbaren Farbreize liegen im Bereich zwischen 380 Nanometern und 780 Nanometern des elektromagnetischen Spektrums. Licht ist eine Form der elektromagnetischen Strahlung (Abb. 1). 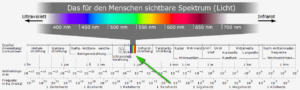
Abb.1: das sichtbare Licht ist Teil der elektromagnetischen Wellen
Im engeren Sinne sind vom gesamten elektromagnetischen Spektrum nur die Anteile als Licht definiert, die für das menschliche Auge sichtbar sind. Im weiteren Sinne werden auch elektromagnetische Wellen kürzerer Wellenlänge (Ultraviolett) und größerer Wellenlänge (Infrarot) dazu gezählt. Weißes Licht ist eine Mischung der Farben aus dem sichtbaren Spektrum das von Violett über Blau, Grün, Gelb und Rot reicht. Diese Farben haben unterschiedliche Wellenlängen zwischen etwa 400 Nanometern beim Violett und 700 Nanometern beim Rot (Abb. 1). Wissenschaftlich gesprochen heißt das: Außerhalb des Auges gibt es keine Farben, sondern lediglich Strahlungen; gelangen diese auf die Netzhaut des Auges, werden sie von den spezifischen Sinneszellen in Nervenimpulse umgewandelt. Diese Impulse werden ans Gehirn weitergeleitet und lösen dort eine Farbempfindung aus.
Die Voraussetzungen für eine solche Farbempfindung sind zum einen physikalische Ursachen (Strahlung), die den Farbreiz auslösen, zum anderen funktions- und empfindungsfähige Sinneszellen (Netzhaut), die einem lebenden Organismus angehören. Dank dieser physikalischen und biologischen Voraussetzungen, können wir Farben empfinden, es handelt sich also hierbei um eine Form der Widerspiegelung der objektiven Welt.
Die Farbe der Gegenstände hängt davon ab, welche Lichtwellen sie absorbieren oder reflektieren, was wiederrum abhängig ist von der molekularen Zusammensetzung. Gras erscheint uns z. B. grün, weil das Licht aller Wellenlängen mit Ausnahme von grün absorbiert wird. Dieses grüne Licht wird mit einer Wellenlänge von ca. 520 Nanometern reflektiert. Das Farbensehen beginnt, wenn Licht einer bestimmten Wellenlänge auf die Sehpigmente auf unsere Netzhaut trifft. Diese Sehpigmente gehören zur der schon in „Evolution for Idiots – Teil 2“ erwähnten Gruppe der Opsine. Ein bekanntes Rezeptormolekül der Augen der Wirbeltiere ist z. B. das Rhodopsin. Es befindet sich in den Stäbchen-Zellen der Netzhaut (Abb. 2) und ist an der Hell-Dunkel-Wahrnehmung beteiligt. Zur Farbwahrnehmung sind die sog. Zapfenzellen (oder Zäpfchen), die sich ebenfalls in der Netzhaut befinden, befähigt. Die Opsine der Zäpfchen gehören zu den Iodopsinen. Wir verfügen über drei Zapfentypen, die unterschiedliche Opsine haben, die auf die Farben der Wellenlänge Rot, Grün und Blau reagieren (Abb. 2).
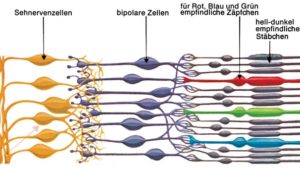
Abb. 2: Feinbau der Netzhaut
In der menschlichen Netzhaut existieren ca. 7 Mio. Zäpfchen (also Vergleich: 120 Mio. Stäbchen). Die Zapfen erreichen ihre höchste Dichte im Bereich der Fovea centralis (Sehgrube im Gelben Fleck, nicht zu verwechseln mit dem Blinden Fleck, den Austritt des Sehnervs aus dem Auge). Sie enthält ungefähr 10% aller in der Netzhaut befindlichen Zapfen. Der chemische Prozess, den die aufgenommene Lichtenergie in den Zäpfchen anstößt, wandelt das optische Signal in einen elektrischen Nervenimpuls um. Anschließend setzen die so genannten Ganglienzellen diesen elektrischen Reiz in ein neuronales Signal um, der das Gehirn über unterschiedliche Schaltstellen und Leitungswege erreicht.
Damit wir andere Farben (z. B. Gelb) wahrnehmen, werden die Signale aller drei zapfentypen kombiniert und vom Gehirn verarbeitet. Z. B. werden bei der Farbe gelb die roten und grünen Zäpfchen gleich stark angeregt. Je nachdem, wie fest welche Zapfentypen angeregt werden, werden also pro Zapfentyp mehr oder weniger Signale ans Gehirn gesendet (zur Physiologie des Farbensehens siehe: Penzlin 2009, Müller 1998).
Evolution der Opsingene
Über die Lichtempfindlichkeit eines Opsins bestimmt seine genaue Proteinsequenz und seine Wechselwirkung mit der sog. Chromophore. Hierbei handelt es sich um die gesamte farbgebende Atom- oder Ionengruppierung einer chemischen Verbindung. Wenn Licht auf die Chromophore trifft, setzt es eine Abfolge schneller Veränderungen in Gang (z. B. Elektronenübertragungen). Das Pigment ist „angeregt“ und sorgt in diesem Zustand dafür, dass die Lichtrezeptorzelle einen Impuls abgibt, die schließlich ins Gehirn gelangen. Die Netzhaut des Menschen hat drei verschiedene Opsine, die auf unterschiedliche Wellenlängen des sichtbaren Lichts reagieren: blau, grün und rot.
Die drei Opsine des Menschen, die das Farbensehen ermöglichen, werden jeweils von einem eigenen Gen codiert. Sie finden sich auch bei unseren nächsten Verwandten, den Menschenaffen. Andere Säugetierarten besitzen nur ein oder zwei Opsine, Vögel und Fische vier oder mehr. In der Evolution der Tiere hat sich also offensichtlich die Zahl der Opsingene verändert. Diese Veränderung beruht auf dem Mechanismus der Genverdoppelung. Dabei verdoppelt sich ein vorhandenes Gen und die beiden Kopien gehen durch unterschiedliche Mutationen und Selektionsdrücke verschiedene Wege mit jeweils eigener Funktion. Wie hat sich aber die Evolution dieser Opsingene abgespielt?
Alle sogenannten Altweltaffen (Schmalnasenaffen; Catarrhini, Abb. 3) verfügen über drei Opsingene (Opsine für Blau, Grün, Rot) und sind somit trichromatisch. Zu den Altweltaffen gehören alle Affenarten, die sich in der „Alten Welt“ (Europa, Afrika, Asien) entwickelt haben – neben und Menschen und den Menschenaffen gehören hierzu z. B. die afrikanischen Meerkatzen und Paviane und die asiatischen Makaken. Die meisten Neuweltaffen (Breitnasenaffen; Platyrrhini- die Affenarten Südamerikas wie Brüllaffen, Totenkopfaffen, Klammeraffen) sowie andere Säugetiergruppen haben hingegen nur die Fähigkeit zum dichromatischen Sehen, weil sie nur über zwei Opsine verfügen. Das trichromatische Sehen hat sich bei Säugetieren also bei den Altweltaffen entwickelt, nachdem die Abstammungslinien von Altwelt- und Neuweltaffen sich trennten. Das dritte Opsingen muss also nach dieser Abspaltung bei den Affen Afrikas und Asiens entstanden sein; es wurde also nicht unabhängig voneinander bei Meerkatzen, Makaken, Schimpansen und Menschen erfunden.
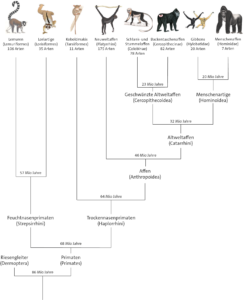
Abb. 3: Stammbaum der Primaten
Wenn wir uns andere Tiergruppen anschauen, erkennen wir, dass frühere Abstammungslinien weitere Opsine entwickelt hatten, bevor sich die Säugetiere entwickelt hatten. Vögel haben beispielsweise vier Opsine und die Neunaugen sogar fünf. Das ist ein Indiz dafür, dass sich das Farbensehen in der Evolution der Wirbeltiere sehr früh entwickelte. Die Vorfahren der Säugetiere haben, bis auf zwei, diese Opsine verloren. Dies hat aller Wahrscheinlichkeit damit zu tun, dass die frühen Säugetiere nachtaktiv waren, wo das Erkennen von Farben keine große Rolle spielt. Bei den Altweltaffen entstand ein zusätzliches Opsingen, weil sie tagaktiv sind und bei ihrer Ernährung auf reife Früchte angewiesen sind, die oft auffällige Farben haben. Doch wie entstand dieses zusätzliche Opsingen bei den Altweltaffen?
Nagetiere und andere Säugetiere haben zwei Opsingene. Eines dieser Opsingene codiert für ein Protein mit einem Absorptionsmaximum bei einer Wellenlänge von 510-550 Nanomentern. Dieses Spektrum schwankt zwischen rot und grün, sodass Säugetiere mit diesem Gen nicht zwischen den Farben rot und grün unterscheiden können. Bei Menschen (und Altweltaffen allgemein) hat sich dieses Gen verdoppelt (Abb.4). Beide Kopien liegen hintereinander auf dem X-Chromosom (das Opsin, welches für Licht im blauen Spektrum empfindlich ist, liegt auf einem Autosom) und unterscheiden sich nur in 12 Aminosäuren. Ihre Lage und Ähnlichkeit sprechen dafür, dass diese zwei Kopien durch eine Verdoppelung – man schätzt auf Basis der Mutationsrate von Genen bei Wirbeltieren vor etwa 40 Mio. Jahren – entstanden sind. Die kleinen Veränderungen bewirken, dass die Absorptionsspektren der beiden Opsine variieren. Das eine Opsin hat ein Absorptionsmaximum von 530 (Grün) Nanometern, das zweite bei 560 (Rot). Die Genverdoppelung bewirkte, dass Altweltaffen die Farbe Rot unterscheiden können (Hanna et al. 1997, Dulai et al. 1999). Dies hat für Primaten, die sich von reifen Früchten ernähren, einen entscheidenden Vorteil, weil sie so aus der Entfernung im grünen Blätterdach die roten und reifen Früchte erkennen können. Aber auch die blattfressenden Stummelaffen Afrikas haben durch das trichromatische Farbensehen einen Selektionsvorteil. Diese Affen mit trichromatischer Sehfähigkeit haben eine Vorliebe für rote Blätter (in den Tropen haben junge, frische Blätter meist eine rötliche Farbe), weil diese weniger Giftstoffe, dafür mehr Nährstoffe enthalten (Domini & Lucas 2001, Osorio & Vorobyev 1996). Zur Evolution und Genetik der Opsine bei Wirbeltieren siehe: Yokoyama & Radlwimmer (1998, 1999, 2001), Yokoyama & Shi (2000), Yokoyama (2000 a, b, 2002), Zusammenfassung auch bei Carroll (2006).
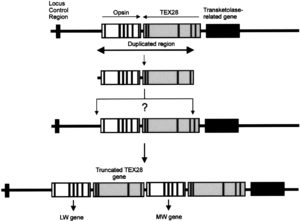
Abb. 4: Verdoppelung der Opsingene auf dem X-Chromosom bei Altweltaffen. Abb. nach Hanna et al. (1997), vgl. auch Dulai et al. (1999)
Im Auge des Brüllaffen
Weiter oben haben wir festgestellt, dass trichromatisches Farbensehen sich bei den in Afrika und Asien lebenden Altweltaffen entwickelt hat. Weil sich ein Gen bei den Ahnen dieser Gruppe verdoppelt hat, sind sie in der Lage zwischen den Farben Rot und Grün zu unterscheiden. Doch wie schaut es bei ihren südamerikanischen Verwandten, den Neuweltaffen, aus? Einige Arten innerhalb der Neuweltaffen, z. B. die Nachtaffen, sind monochromatisch und farbenblind, da sie als nachtaktive Lebewesen ohnehin keine Farben unterscheiden müssen. Die meisten anderen Neuweltaffen verfügen jedoch über eine Art des trichromatischen Farbensehens – jedoch auf eine andere Weise als bei den Altweltaffen. Diese Affen haben nur zwei Opsin-Gene, eines für blaues und eines für grünes Licht, sind also dichromatisch. Wie bei den Altweltaffen liegt das „grüne Opsin“ auf dem X-Chromosom, hat sich aber bei den Neuweltaffen nicht verdoppelt. Von diesem Gen existieren jedoch zwei Variationen, sogenannte Allele. Eines dieser Allele ist für grünes Licht empfindlicher, das andere für rotes Licht. Ein Individuum, dass für diese Allele heterozygot ist (also eine Kopie des grünen und eine andere Kopie des roten Opsingens auf den homologen Chromosomenpaar hat) kann trichromatisch sehen. Weil aber beide Allele dieses Opsingens nur auf dem X-Chromosom vorkommen, können nur Weibchen der Neuweltaffen trichromatisch sehen, da nur sie zwei X-Chromosomen verfügen. Männliche Primaten verfügen nur über ein X-Chromosom, können also nur eines dieser Opsin-Allele haben und sind somit ausschließlich funktionell dichromatisch. Weibliche Neuweltaffen können, je nachdem ob sie beide Allele haben oder nur eines di- oder trichromatisch sein (Jacobs 1996, Neitz & Neitz 2000, vgl. Abb. 5).
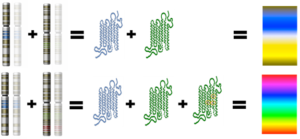
Abb. 5: je nach Verteilung der Opsingene können weibliche Neuweltaffen dichromatisch oder trichromatisch sein.
Aber eine Gruppe der Neuweltaffen, die Brülllaffen (Abb. 6), sind zum vollständigen, trichchromatischen Farbensehen in der Lage. Brüllaffen ernähren sich, wie die afrikanischen Stummelaffen und die asiatischen Languren, zu einem großen Teil aus Blättern. Wir haben auch festgestellt, dass frische, nährstoffreiche und giftstoffarme Blätter in den Tropen eine rötliche Farbe haben. Folgerichtig hat sich bei den Brüllaffen das trichromatische Farbensehen unabhängig von den Affen der Alten Welt entwickelt. Woher wissen wir also, dass Brüllaffen die Fähigkeit des trichromatischen Farbensehen unabhängig von den Altweltaffen entwickelt haben? Genverdoppelungen hinterlassen Spuren in der DNA. Betrachtet an die Anordnung der Opsingene in der DNA von Altweltaffen, Brüllaffen und anderen Neuweltaffen, so findet man aufschlussreiche Anhaltspunkte für einzelne Evolutionsereignisse. Die Opsingene der Altweltaffen und Brüllaffen haben sich durch unterschiedliche Ereignisse verdoppelt. So ist der verdoppelte Abschnitt bei beiden Gruppen unterschiedlich lang. Bei Altweltaffen haben die verdoppelten Gene außerhalb ihrer codierten Region (= der Bereich, der die Informationen für die Aminosäurenabfolge der Opsin-Proteine enthält) 236 Basenpaare ihre DNA-Textes gemeinsam. Bei Brüllaffen ist dieser Bereich viel länger. Weiterhin unterscheiden sich das „grüne“ und „rote“ Opsin bei den Brüllaffen um nur 8 Aminosäuren, es gibt also weniger Unterschiede als bei den Opsinen der Altweltaffen (Kainz, Neitz & Neitz 1998).

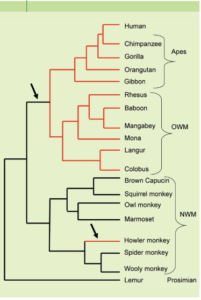
Abb. 6: Brüllaffen haben das trichromatische Farbensehen parallel zu den Altweltaffen entwickelt
Die Evolution des trichromatischen Farbensehens, bei dem beide Geschlechter trichromatisch sind, hat sich bei den Primaten also zweimal unabhängig voneinander entwickelt: einmal bei den Vorfahren aller Altweltaffen und bei den Brüllaffen.
Ich kann dich nicht riechen!
Es gibt aber noch ein weiteres Indiz für die zunehmende Bedeutung des Farbensehens bei Primaten. Denn die Fähigkeit mehr Farben zu erkennen geht immer mit dem Verlust des Geruchsinns einher. Zur Grundausstattung der Säugetiere zählen mehr als 1000 Erbanlagen für Geruchsrezeptoren, die somit die größte Gen-Familie im Erbgut bilden. Doch längst nicht alle olfaktorischen Gene sind intakt. Vielmehr hat sich ein Teil durch Mutationen in Pseudogene verwandelt – fehlerhafte DNA-Sequenzen, die als Überbleibsel von einst funktionsfähigen Erbanlagenzeugen. Die Geruchsrezeptorgene bei Menschen sind eingehend untersucht worden und man hat herausgefunden, dass über 50% unserer Geruchsrezeptorgene funktionslose Pseudogene sind. Solch ein hoher Anteil funktionsloser Gene legt nahe, dass wir auf unseren Geruchssinn nicht mehr so stark angewiesen sind wie unsere Vorfahren. Dabei fanden Forscher auch einen auffälligen Zusammenhang zwischen dem Anteil funktionsloser Geruchsrezeptorgene und der Fähigkeit zum vollständigen Farbensehen. Bei Mäusen, Lemuren und Neuweltaffen, die nicht über eine umfassende Fähigkeit zur Farbwahrnehmung verfügen, liegen etwa 18% der Geruchsrezeptorgene als Pseudogene vor. Bei Altweltaffen, die nicht zu den Menschenaffen gehören, liegt der Anteil bei 29%, bei Menschenaffen (Gorilla, Schimpanse, Orang-Utan) bei 33%. Der Anteil der Pseudogene ist bei den Arten höher, die die Fähigkeit zum trichromatischen Farbensehen haben (Zhang et al. 2004, Nimura & Nei 2003, 2007, Malnic, Godfrey & Buck 2004, Gilad et al. 2004).
Bei Landwirbeltieren dient das sog. Jacobson’sche Organ, welches sich im vorderen Bereich der Nasenhöhle befindet, zur Wahrnehmung von Pheromonen. Bei Altweltaffen ist dieses Organ stark verkümmert. Ein Gen, das sog. TRPC2 spielt bei der Funktion des Jacobson’schen Organs eine entscheidende Rolle. Dessen Genprodukt steuert die Ionenwanderung der Sinneszellen des Jacobson’schen Organs (eine wichtige Eigenschaft, damit Sinneszellen etwas wahrnehmen können). Dieses Gen ist bei den Altweltaffen ein funktionsloses Pseudogen (Liman & Innan 2003).
Literatur
Carroll, S. B. (2006): The making of the fittest. DANN and the ultimate forensic record of Evolution. New York/London: WW. Norton & Company
Domini, N. J. & Lucas, P. W. (2001): Ecological importance of trichromatic vision to primates. Nature.;410(6826):363-6.
Dulai, K. S. et al. (1999): The Evolution of Trichromatic Color Visionby Opsin Gene Duplication in New Worldand Old World Primates. Genome Res. 1999. 9: 629-638
Gilad Y, Wiebe V, Przeworski M, Lancet D, Pääbo S (2004) Loss of olfactory receptor genes coincides with the acquisition of full trichromatic vision in primates. PLoS Biol 2: E5.
Hanna, M.C., J.T. Platts, and E.F. Kirkness. 1997. Identification of a gene within the tandem array of red and green color pigment genes. Genomics43:384–386
Jacobs, G. H. (1999): Primate photopigments and primate color vision. Proc. Natl. Acad. Sci. USA Vol.93, pp.577-581 https://www.pnas.org/content/pnas/93/2/577.full.pdf
Kainz, P. M., Neitz, J., Neitz, M. (1998): Recent evolution of uniform trichromacy in a New World monkey. Vision Research Volume 38, Issue 21, Pages 3315-3320 https://www.sciencedirect.com/science/article/pii/S0042698998000789?via%3Dihub
Liman, E. R. Innan, H. (2003): Relaxed selective pressure on an essential component of pheromone transduction in primate evolution. Proc Natl Acad Sci U S A.;100(6):3328-32
Müller, W. A. (1998): Tier- und Humanphysiologie. Heidelberg: Springer-Verlag
Neitz, M., Neitz, J. (2000): Molecular genetics of color vision and color vision defects. Arch Ophthalmol.; 118(5):691-700
Niimura Y, Nei M (2007) Extensive Gains and Losses of Olfactory Receptor Genes in Mammalian Evolution. PLoS ONE 2(8): e708. https://doi.org/10.1371/journal.pone.0000708
Osorio, D. & Vorobyev, M. (1996): Colour vision as an adaptation to frugivory in primates. 263 Proc. R. Soc. B http://doi.org/10.1098/rspb.1996.0089
Penzlin, H. (2009): Lehrbuch der Tierphysiologie, 7. Auflage von 2007, unveränderter Nachdruck. Heidelberg: Spektrum Akademischer Verlag
Yokoyama, S., 2000a. Molecular evolution of vertebrate visual pigments.Prog. Ret. Eye Res. 19, 385–419.
Yokoyama, S., 2000b. Phylogenetic analysis and experimental approachesto study color vision in vertebrates. Methods Enzymol. 315, 312–325.
Yokoyama, S., 2002: Molecular evolution of color vision in vertebrates. Gene;300(1-2):69-78.
Yokoyama, S., Radlwimmer, F.B., 1998. The‘five-sites’rule and theevolution of red and green color vision in mammals. Mol. Biol. Evol.15, 560–567.
Yokoyama, S., Radlwimmer, F.B., 1999. Molecular genetics of red andgreen color vision in mammals. Genetics 153, 919–932.
Yokoyama, S., Radlwimmer, F.B., 2001. The molecular genetics andevolution of red and green color vision in vertebrates. Genetics 158,1697–1710.
Yokoyama, S., Shi, Y., 2000. Genetics and evolution of ultraviolet vision invertebrates. FEBS Lett. 486, 167–172.
Zhang, X. et al. (2004): Odorant and vomeronasal receptor genes in two mouse genome assemblies. Genomics; 83(5): 802-11.



