Eine Besonderheit der Vögel ist ihre Fortbewegungsweise. Ihre Anatomie ist im Wesentlichen auf einen effizienteren Flug.
Für das Fliegen ist eines notwendig: Flügel. Die Flugfähigkeit hat sich in der Evolution bei vier Gruppen entwickelt: Insekten, Flugsaurier, Vögel und Fledermäuse. Bei den flugfähigen Wirbeltieren kam es vor allem zu Veränderungen der Proportionen der einzelnen Elemente der Vordergliedmaßen. Bei den Vögeln trat vor allem eine Reduktion der Finger und eine Fusion der Mittelhandknochen zum Carpometacarpus. Besonders die Reduktion der Finger wurde in einer anderen Episode behandelt.
Text als pdf
Propatagium
Doch es gibt noch eine weitere Struktur des Flügels, welche beachtet werden sollte: das sog. Propatagium, die Halsflughaut (Abb. 1). Ohne dieses Merkmal könnten Vögel nicht fliegen; es verleiht dem Flügel eine Vorderkante, erzeugt Auftrieb und hilft beim Flügelschlagen. Sie enthält einen Muskel, der die Schulter und das Handgelenk verbindet, der den Flügelschlag unterstützt und den Vogelflug ermöglicht. Er kommt bei anderen Wirbeltieren nicht vor und ist auch bei flugunfähigen Vögeln verschwunden oder hat seine Funktion verloren, was einer der Gründe ist, warum wir wissen, dass er für den Flug unerlässlich ist. Um also zu verstehen, wie sich der Flug bei Vögeln entwickelt hat, müssen wir wissen, wie sich das Propatagium entwickelt hat. Theropoden, wie Tyrannosaurus rex und Velociraptor, hatten Arme, keine Flügel. Wenn die Wissenschaftler Beweise für ein frühes Beispiel des Propatagiums bei diesen Dinosauriern finden könnten, würde dies helfen zu erklären, wie der moderne Vogelzweig von Armen zu Flügeln übergegangen ist. Das ist jedoch nicht so einfach, denn das Propatagium besteht aus weichem Gewebe, das sich nicht oder nur schlecht versteinern lässt, so dass ein direkter Nachweis nicht möglich ist. Stattdessen mussten die Forscher einen indirekten Weg finden, um das Vorhandensein oder Fehlen eines Propatagiums in einem Exemplar festzustellen.
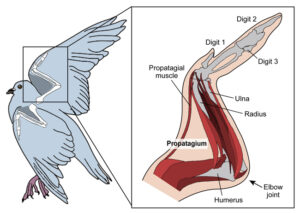
Abb. 1: Das Propatagium bei Vögeln
Die Lösung, um das Vorhandensein eines Propatagiums zu beurteilen, bestand darin, Daten über die Winkel der Gelenke entlang des Arms oder Flügels eines Dinosauriers oder Vogels zu sammeln (Abb. 2). Bei modernen Vögeln können die Flügel aufgrund des Propatagiums nicht vollständig ausgefahren werden, was den Bereich der möglichen Winkel zwischen den Verbindungsabschnitten einschränkt. Wenn wir eine ähnlich spezifische Reihe von Winkeln zwischen den Gelenken bei Dinosaurier-Exemplaren finden, können wir ziemlich sicher sein, dass auch sie ein Propatagium besaßen. Das Ergebnis: Ein solches Propatagium findet sich bei den Maniraptoren, so bei Velociraptor, Deinonychus, Caudipteryx und Microraptor. Wahrscheinlich besaßen alle Maniraptoren bereits vor der Entstehung des Vogelfluges eine Halsflughaut (Uno & Hirasawa 2023). Die Frage, warum diese speziellen Theropodenarten eine solche Struktur brauchten, um sich besser an ihre Umwelt anpassen zu können, ist möglicherweise schwieriger zu beantworten. Das Team hat bereits damit begonnen, mögliche Verbindungen zwischen den fossilen Beweisen und der Embryonalentwicklung moderner Wirbeltiere zu erforschen, um zu sehen, ob das Licht auf diese Frage werfen kann. Das Team glaubt auch, dass einige Theropoden das Propatagium nicht aufgrund des Drucks, fliegen zu lernen, entwickelt haben könnten, da ihre Vorderbeine zum Greifen von Gegenständen und nicht zum Fliegen gedacht waren.
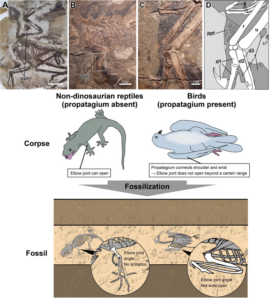
Abb. 2: Oben: Weichteilkonserven von mutmaßlichen Propatagien bei nicht-avischen Theropoden. A Microraptor gui (IVPP V 13352). B-D, Caudipteryx sp. (IVPP V 12430). C und D stellen die vergrößerte Abbildung bzw. die Linienzeichnung des Bereichs des weißen Kastens in B dar. Gestrichelte Linien in D zeigen fehlende Ränder der Weichteile an. d1-3, Ziffern 1-3; f, Feder; g, Gastralium; ppt, Propatagium; r, Radius; u, Ulna. Unten: Die Art und Weise, wie die Armgelenke in Fossilien positioniert sind, verrät das Vorhandensein oder Nichtvorhandensein des Propatagiums.
Experimente und Computersimulationen zeigen, dass übrigens nicht die Federn, sondern das Propatagium den Großteil des Auftriebs erzeugt. Entfernt man die Sekundärfedern, sodass nur sechs distale Primärfedern und ein intaktes Propatagium verbleiben, hat dies keinen nennenswerten Einfluss auf das Flugvermögen von Sperlingen (Brown & Cogley 1996). Selbst dann, wenn die Vögel bis auf die sechs Primärfedern alle Schwungfedern verlören und das Propatagium 50% seiner Fläche sowie sein spezifisch aerodynamisches Profil einbüßen würde, wäre noch immer ein (wenn auch ineffektiver) Schlagflug möglich (Alexander 2015).
Evolution des Vogelschwanzes
Es fand aber im Verlauf der Vogelevolution noch eine weitere Reduktion statt: der Schwanz.
Die Schwänze der heute lebenden Vögel sind eine evolutionäre Neuheit. Sie sind entscheidend für den motorisierten Flug, sichern den Fortpflanzungserfolg, indem sie Partner anlocken, und schützen Verwandte, indem sie Warnsignale übermitteln.
Die Schwänze der heutigen Vögel bestehen aus einer kleinen Reihe nicht miteinander verbundener Schwanzwirbel, die einen großen Bewegungsspielraum haben. Diese sind gelenkig mit einem distalen, stabförmigen Pygostyl verbunden, der aus mehreren miteinander verschmolzenen Schwanzwirbeln besteht und den Schwanzbuckel sowie die zugehörigen Muskeln und Federn zur Steuerung der Schwanzfächer trägt (Abb. 3). Dieser spezialisierte Schwanz ist bei allen lebenden Vögeln zu finden, wenn auch mit zahlreichen Modifikationen, die auf das Verhalten der einzelnen Vogelarten zurückzuführen sind. Fossile Funde dokumentieren den evolutionären Wandel vom ursprünglich langen „Reptilienschwanz“ zum kurzen, distal verwachsenen Schwanz (Chiappe 2007, Chiappe & Witmer 2002).
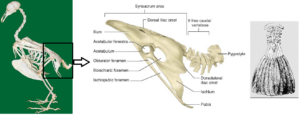
Abb. 3: Pygostyl moderner Vögel
Die Entstehung des abgeleiteten Vogelschwanzes vollzog sich in einem bemerkenswert kurzen evolutionären Intervall, was durch das kurzlebige gemeinsame Auftreten von Vögeln mit langem und kurzem Schwanz in räumlich-zeitlich gleichen Fossilienformationen belegt wird (Abb. 4). Nahezu alle Nicht-Vogel-Theropoden hatten lange, reptilienartige Schwänze. Diese Taxa waren zweibeinig, so dass der Schwanz wahrscheinlich dem Gleichgewicht diente. Außerdem besaßen sie robuste Querfortsätze an den proximalen Schwanzwirbeln, die als Ansatzpunkte für die großen Caudofemoralis-Muskeln dienten (Gatesy 1990).
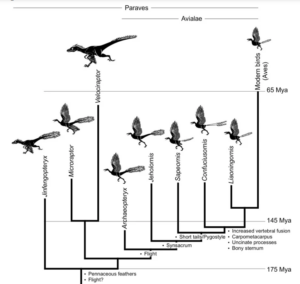
Abb. 4: Evolutionsbaum von Paraves mit wichtigen evolutionären Veränderungen. Obwohl mehrere andere Dinosauriergruppen unabhängig voneinander ein Pygostyl (verschmolzene hintere Schwanzwirbel) entwickelt haben, ist zu beachten, dass die ersten Vögel lange Schwänze hatten und dass die Fossilienaufzeichnungen eine kurze Zeitspanne dokumentieren, in der es sowohl Vögel mit langen als auch mit kurzen Schwänzen gab, gefolgt von Vögeln mit verkürzten, distal verschmolzenen Schwänzen.
Der älteste bekannte Vogel, Archaeopteryx (Chiappe 1997, Padian 1997, Sereno 1997, Gauthier 1986) hatte neben einigen typischen Vogelmerkmalen viele typische Nicht-Vogel-Theropodenmerkmale, inklusive eines langen knöchernen Schwanzes (Abb. 5). Die Paraves, einschließlich Archaeopteryx, zeichnen sich generell durch lange Schwänze (De Beer 1954, Zhou & Zhang 2002), eine gewisse Verschmelzung der Synsakralwirbel und eine unterschiedliche Flugfähigkeit aus. Die meisten Deinonychosaurier hatten zwischen 20 und 30 Schwanzwirbel. Aber es gab einige Gruppen außerhalb der Paraves, so z. B. bei einigen Oviraptorsauriern und den Scansoriopterygidae, die kürzere Schwänze hatten (Persons 2013, Barsold et al. 2000, He et al. 2008, Xu et al. 2010, Zhang et al. 2008).
Bei den Paraves gab es aber innerhalb der Avialae einen deutlichen Trend zur Reduktion der Schwanzwirbel: Archaeopteryx hatte 20 bis 23 Schwanzwirbel (Wellnhofer 2009). Der nächstbasale Vogel, Jeholornis aus China (He et al. 2004), war ebenfalls langschwänzig und hatte 22 Schwanzwirbel, die mit denen von Archaeopteryx nahezu identisch sind (Zhou & Zhang 2002). In derselben Formation ist auch der nächstbasale Vogel, Sapeornis, erhalten (Zhou & Zhang 2002a, 2003). Dieses Taxon ist der erste Vogel, der einen verkürzten Schwanz mit nur sechs bis sieben freien Schwanzwirbeln und einen verlängerten Pygostyl aufweist. Alle Taxa, die vom letzten gemeinsamen Vorfahren von Sapeornis und den heute lebenden Vögeln abstammen, haben einen verkürzten Schwanz, der in einem Pygostyl endet, was darauf hindeutet, dass diese evolutionäre Veränderung äußerst anpassungsfähig und für die Physiologie der Vögel notwendig ist (Abb. 5).
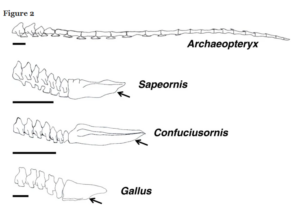
Abb. 5: Vergleich der Schwanzskelette von Archaeopteryx, Sapeornis, Confuciusornis und Huhn (Gallus gallus).
Ein einzelnes Exemplar, Zhongornis, liegt phylogenetisch möglicherweise zwischen den Langschwanz- und Kurzschwanzvögeln (Abb. 6). Von Zhongornis ist nur ein einziges Exemplar bekannt, bei dem es sich um ein Jungtier handelt, das entweder flügge oder fast flügge war (Gao et al. 2008). Da es sich bei diesem Taxon um ein Jungtier handelt, ist eine phylogenetische Einordnung unsicher (siehe auch O’Connor & Sullivan 2014 und Cau et al. 2015), aber es hat eine einzigartige Schwanzmorphologie, die entweder ein phylogenetisches oder ontogenetisches Signal sein könnte. Sein Schwanz bestand aus 13 Schwanzwirbeln, von denen die letzten vier teilweise miteinander verschmolzen waren und eine Art partiellen Pygostyl bildeten.
Abb. 6: Zhongornis
Die Verkürzung des Schwanzes und die zahlreichen Knochenfusionen führten zu Fortschritten in der Flugmechanik bei Confuciusornis, Gegenvögeln und den Ornithurae, inklusive der modernen Vögel (Abb. 5). Einige dieser Fortschritte im Flug können dem Pygostyl zugeschrieben werden, teilweise durch seinen Beitrag zur Steuerung der Schwanzfedern (Gatesy & Dial 1996). Fächerförmige Federanordnungen spielen bei modernen Vögeln zudem eine wichtige Rolle bei der sexuellen Selektion und hatten wahrscheinlich ähnliche Funktionen bei ihren primitiveren Vorfahren mit kurzen Schwänzen (Hasson 1991).
Die Verkürzung des Vogelschwanzes ging auch mit einer Verkleinerung und Verkürzung des großen Caudofemoralis-Muskels (CML, Abb. 7) einher. Die Verkleinerung dieses Muskels ist nicht nur bei Vögeln zu beobachten, sondern bei allen Untergruppen der Maniraptoren, wie das Fehlen eines deutlich erkennbaren vierten Trochanters, dem Ansatzpunkt des CML, vermuten lässt (Abb. 8). Tiefgreifendere CML-Reduktionen werden jedoch bei frühen Vögeln mit verkürzten Schwänzen vorhergesagt (Gatesy 1990).
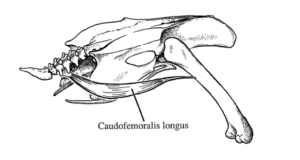
Abb. 7: Vierter Trochanter und CML-Muskeln beim Perlhuhn. Quelle: Gatesy (1990)
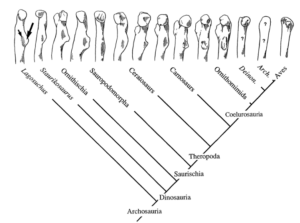
Abb. 8: Reduktion des vierten Trochanters bei Theropoden. Quelle: Gatesy (1990).
Veränderungen des Caudofemoralis-Muskels und andere Veränderungen innerhalb des Schwanzes könnten den abrupten Übergang zu kurzschwänzigen Vögeln durch die Entkopplung der Funktionen erleichtert haben. Die Entkopplung der Bewegungsstrukturen voneinander ist ein Kennzeichen für die Entstehung der Vögel und des motorisierten Flugs und fand vor allem an den Vordergliedmaßen und am Schwanz statt (Gatesy 1990, Gatesy & Dial 1996a, Dececchi & Larsson 2013, Abb. 9). Der Schwanz der heutigen Vögel dient beispielsweise als Auftriebs-, Brems- und Wendefläche für den kontrollierten Flug (Gatesy & Dial 1993, Thomas 1996, Thomas & Balmford 1995, Maybury & Rayner 2001, Maybury et al. 2001) ist aber von der Hinterextremität entkoppelt und hat seinen ursprünglichen Beitrag zur Fortbewegung auf dem Boden (im Gegensatz zur Fortbewegung in der Luft) verloren (Abb. 10). Das komplexe Funktionsrepertoire der Schwänze der heutigen Vögel wird also durch eine primäre Abkopplung des Schwanzes von den Hintergliedmaßen und zusätzliche Fluganpassungen innerhalb des Schwanzes erreicht.
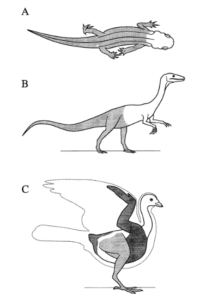
Abb. 9: Die Evolution von Bewegungsmodulen und Vögeln. A. Bei den primitiven Tetrapoden wirkten die Körperachse und alle vier Gliedmaßen bei der Fortbewegung an Land als eine integrierte Einheit. Dieses einzelne Fortbewegungsmodul (Schattierung) ist auch heute noch bei Salamandern zu finden. B. Basale Dinosaurier und Theropoden waren obligate Zweibeiner. Die Hinterbeine und der Schwanz bildeten ein einziges, reduziertes Bewegungsmodul (Schattierung). C. Vögel verfügen über drei Bewegungsmodule. Während der Evolution der Vögel erhielt die Vorderextremität ihre Bewegungsfunktion als Flügel zurück. Der Schwanz entkoppelte sich von der Hintergliedmaße und spezialisierte sich auf die Steuerung der Schwanzfedern. Die neuartige Zugehörigkeit der Brust- und Schwanzmodule bildete den Flugapparat (dunkle Schattierung). Die unabhängige Hintergliedmaße bleibt als Überbleibsel des primitiven terrestrischen Moduls erhalten (Schattierung). Quelle: Gatesy & Dial 1996a).
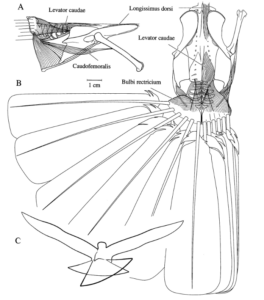
Abb. 10: Anatomie der Schwanzregion der Taube, Columba livia. A. Rechte Seitenansicht und B. Dorsalansicht von Becken und Schwanz. Die Schwanzmuskeln sind transparent, um die Schwanzwirbel und den Pygostil zu zeigen. Das Schwanzskelett ist im Vergleich zum Becken zwar winzig, trägt aber die 12 Schwanzfedern, die den großen Schwanzfächer bilden. C. Während des Fluges kann die Größe und Ausrichtung des Schwanzfächers verändert werden, um Auftrieb unterschiedlicher Stärke und Richtung zu erzeugen. Quelle: Gatesy & Dial 1996a).
Die Mechanismen, die das Schwanzwachstum steuern, sind bei allen Wirbeltieren ähnlich und haben sich seit der Zeit vor den Dinosauriern evolutionär erhalten. Die Schwänze von Wirbeltierembryonen sind aus denselben Grundelementen aufgebaut und nach demselben Muster angeordnet (Abb. 11). Alle Wirbeltierembryonen verfügen über ein Neuralrohr, aus dem Gehirn und Rückenmark hervorgehen. Weiterhin findet sich unter dem Neuralrohr die Chorda dorsalis, der Achsenstab auf der Rückenseite eine Struktur, die der Vorläufer des Nucleus pulposus in den Bandscheiben ist. Hinzu kommen die Somiten, paarige Segmente, die das Neuralrohr flankieren und die Entwicklungsvorläufer der Wirbel und Skelettmuskulatur sind. Weiterhin sind die Zellen der Neuralleiste zu nennen, die für die frühe Entwicklung unerlässlich sind und aus denen u. a. Teile des peripheren Nervensystems werden (Choi et al. 2008, Davidson & Keller 1999, Le Douarin 2001, Huang et al. 2003, Schoenwolf et al. 1985, Gilbert 2006, Wolpert et al. 2007). All diese embryonalen Strukturen werden auch im Schwanz der Wirbeltiere ausgebildet, bei der sich undifferenzierte Vorläuferzellen ausdifferenzieren, wandern und Zellsignale für weitere Differenzierungsschritte aussenden (Tenin et al. 2010, McGrew et al. 2008, Handrigan 2003, Gruneberg 1956, Gajovic & Kostovic-Knezevic 1995, Maroto & Bone 2012, Saga 2012, Freitas et al. 2001, Gilbert 2006, Wolpert et al. 2007).
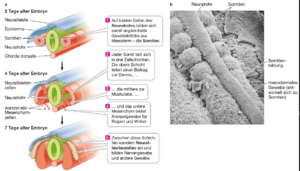
Abb. 11: Die Entwicklung der Körpersegmentierung beim Hühnerembryo. a Auf beiden Seiten des Neuralrohrs bilden sich seriell angeordnete Gewebeblöcke aus, die man als Somiten bezeichnet. Muskeln, Knorpel, Knochen und die Unterhaut entstehen aus Somiten. b In dieser rasterelektronenmikroskopischen Aufnahme der Somitenbildung in einem Hühnerembryo wurde das darüberliegende Ektoderm entfernt, und man sieht von oben auf das Neuralrohr und die Somiten. Quelle: Sadava et al. (2017: S. 1336)
Insbesondere spielen die Wnt/Fgf-Gradienten und Retinsäuregradienten bei der Ausdifferenzierung der Zellen Schwanz eine bedeutende Rolle (Dubrulle et al. 2001, Sawada et al. 2001, Aluehla et al. 2003, 2008, Aluleha & Pourquie 2010, del Corral & Storey 2004, Abb. 12).
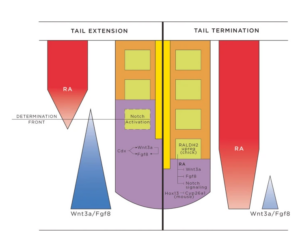
Abb. 12: Schematische Darstellung der Schwanzverlängerung und des axialen Endes. Während der Schwanzverlängerung (links dargestellt) schreitet die Somitogenese aktiv voran, wobei sich neue Somiten aus dem PSM an der Bestimmungsfront bilden. Die Aktivitäten von Cdx-Proteinen, Wnts und Fgfs etablieren einen posterioren Wnt3a/Fgf8-Gradienten, der einem anterioren RA-Gradienten entgegenwirkt. Diese gegenläufigen Gradienten ermöglichen die Entstehung der Determinationsfront und die Aktivierung des Notch-Signalwegs. Die zyklischen Expressionsmuster der Wnt-, Fgf- und Notch-Signalwege folgen einem Wellenfrontmodell, das die Somiteninduktion, -segmentierung und -differenzierung in aufeinanderfolgenden Wellen fördert, so dass die Somiten nacheinander von rostral nach kaudal entlang der Wirbeltierachse entstehen. Während des Schwanzendes (rechts) ist der RA-Gradient aufgrund der progressiv abnehmenden Konzentrationen von Wnts und Fgfs ungebremst. Beiträge von RA (bei Küken über RALDH2 erhöht), Hox-Genen, verringerten Konzentrationen von Cyp26a1 (Maus), Wnts und Fgfs, Hemmung des Notch-Signalwegs, Apoptose und Verlust der Zellteilung und Zellrekrutierung im CNH wirken auf das Ende des Schwanzes ein. Abkürzungen: CNH, chordoneurales Scharnier; RA, Retinsäure.
Die Ausbildung der Somiten verläuft dabei einer oszillierenden Uhr ähnlich, wodurch sich die einzelnen Somiten abschnüren und ausdifferenzieren können (Cooke & Zeeman 1976, Cooke 1998 Julianella et al. 2003, Kulesa & Fraser 2002, Sato et al. 2002, Oates et al. 2012, Baker et al. 2006, Gomez et al. 2008, Schröter & Oates 2010, Aoyama & Asamoto 2000, Morin-Kensicki et al. 2002; Abb. 13 als Beispiel wird die Entwicklung der Somiten bei Schlangen im Vergleich zu Mäusen dargestellt). Die Anzahl der Somiten wird von der Geschwindigkeit und dem Rhythmus dieser sozillierenden Uhr bestimmt, bei der Gene der Wnt-, Fgf- und Notsch-Signalwege beteiligt sind (Aluehla et al. 2003, Palmeirim et al. 1997, Ishikawa et al. 2004, Dale et al. 2003, 2006, Dequeant et al. 2006, Niwa et al. 2007, Bessho et al. 2003, Oates et al. 2012, Rida et al. 2004, Saga 2007, Oginuma et al. 2008 Takahashi et al. 2010, Sasaki et al. 2011). Anzumerken ist hier, dass trotz des konservierten Mechanismus dieser embryonalen Differenzierung bei verschiedenen Wirbeltiertaxa verschiedene Gene der Fgf, Wnt- und Notsch-Signalwege beteiligt sind, was eine hohe evolutionäre Plastizität bei der Merkmalsausbildung ermöglicht (Krol et al. 2011).

Abb. 13: Wie die Schlange zusätzliche Wirbel bildet. Das hier dargestellte Uhr- und Wellenfrontmodell für die Somitenmusterung bei Wirbeltieren wurde 1976 vorgeschlagen (Cooke & Zeeman 1976) [443] und 1998 bestätigt (Cooke 1998). Im Jahr 2008 wurde gezeigt, dass der Oszillator der Schlange viermal schneller tickt als der der Maus (Gomez et al. 2008, Vonk & Richardson 2008), was zu viermal so vielen Wirbeln führt. Schlangen- und Mäuseembryonen werden zu unterschiedlichen Zeitpunkten verglichen und wie Einzelbilder in einem Film gezeichnet (0 bis 8). Der Einfachheit halber werden die Wellenformen der Oszillatoren so gezeichnet, als ob sie statisch wären, obwohl sie in Wirklichkeit schwanken. Die Abstände zwischen den Bildern entsprechen der Hälfte eines Maussomitenzyklus. Somiten (s) sind die Vorläufer der Wirbel. Sie werden aus einem Stück präsomitischen Mesoderms (durchgezogenes Rechteck) „herausgeschnitten“ (Julianella et al. 2003, Kulesa & Fraser 2002 ,Sato et al. 2002), und zwar als Ergebnis von Begegnungen zwischen (1) einer induktiven Wellenfront (vertikale Linie mit Pfeilspitze) und (2) Zellen in einer bestimmten Phase des Oszillatorzyklus (Tiefpunkt der Sinuswelle) (Oates et al. 2012), wobei die offene Grenzdifferenzierung im Vergleich zur verdeckten Grenzbestimmung verzögert ist (Baker et al. 2006). Tiefpunkte sind durch die graue Schattierung der präsomitischen Platte gekennzeichnet, und das Eintreffen der Wellenfront an einem Tiefpunkt ist durch eine Schere markiert (Abschneidestelle). N.B.: Die Somiten der Schlange sind relativ kürzer, wie hier gezeigt (obwohl die dargestellten Formen verzerrt sind), wachsen dann aber zu normal geformten Wirbeln (Hoffstetter & Gasc 1969) heran, wodurch sich die Wirbelsäule stark verlängert. Oszillationen treten in der Zeit auf, obwohl viele Gene (z. B. Lunatic fringe bei Schlangen) auch eine gebänderte Expression im Raum zeigen (Gomez et al. 2008, Oates et al. 2012). Die Platte wächst nach hinten (nicht dargestellt), bis der Prozess endet. Die Regionalisierung (Zuweisung von Gebietscodes) erfolgt getrennt von der Somitenbildung und stützt sich auf Hox-Gene (Schröter & Oates 2010). Die Resegmentierung wird ausgelassen (Aoyama & Asamoto 2000, Morin-Kensicki et al. 2002).
Die regionale Identität der einzelnen Somiten wird dann durch die Expression von Hox-Genen bestimmt (Abb. 14). Hierbei handelt es sich um ein Cluster von Genen, welche zuerst bei Drosophila entdeckt wurde, mittlerweile aber bei allen Tierstämmen nachgewiesen wurde. Haben Drosophila und andere Wirbeltiere ein Cluster mit bis zu 14 Genen, kam es bei den Wirbteltieren zu einer zweifachen Verdoppelung der Hox-Gencluster. D. h. Wirbeltiere haben vier Cluster, die mit A-D nummeriert sind, wobei nicht jedes Gen in jedem Cluster aktiv ist. Hox-Gene spielen bei der Orientierung der Körperachsen eine wesentliche Rolle und sind im Genom so verteilt, dass Hox1 am Kopfende (rostral) und Hox 13 am Schwanzende (caudal) exprimiert wird (Mallo et al. 2009, 2010, Heffer & Pick 2013, Dressler & Gruss 1989, Duboule & Dolle 1989, Graham et al. 1989, Izpisua-Belmonte et al. 1991, Gaunt & Strachan 1996, Iimura & Pourquie 2006, Amores et al. 1998, Forlani 2003, Young et al. 2009, Gilbert 2006, Wolpert et al. 2007).
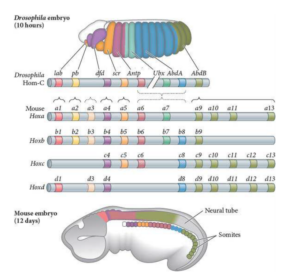
Abb.14: Die evolutionäre Erhaltung der homöotischen Genorganisation und der transkriptionellen Expression bei Fruchtfliegen und Mäusen zeigt sich in der Ähnlichkeit zwischen dem Hom-C-Cluster auf Drosophila-Chromosom 3 und den vier Hox-Genclustern im Mausgenom. Gene mit ähnlichen Strukturen besetzen die gleichen relativen Positionen auf jedem der vier Chromosomen, und paraloge Gengruppen zeigen ähnliche Expressionsmuster. Die Mausgene in den Gruppen mit den höheren Nummern werden später in der Entwicklung und weiter hinten exprimiert. Der Vergleich der Transkriptionsmuster der Hom-C- und Hoxb-Gene von Drosophila und Mäusen ist oberhalb bzw. unterhalb der Chromosomen dargestellt.
Auch andere Gene spielen bei der Ausdifferenzierung des Schwanzes eine Rolle: so Gdf11, Cdx-Gene und andere (Jurberg et a. 2013, Brooke et al. 1998, van Rooijen et al. 2012). Die Kontrolle der Cdx- und Hox-Gene wird durch die Fgf-, Notch-, RA- und Wnt-Signalwege vermittelt, was den entscheidenden Beitrag dieser Wege zur Verlängerung und Formung der Wirbelsäule unterstreicht [Mallo et al. 2009, Mallo & Alonso 2013, Ikeya & Takada 2001).
Die Zusammenhänge zwischen den Expressionsmustern der Hox-Gene und der Spezifizierung der Wirbel sind nicht einfach, und funktionelle Redundanzen sind weit verbreitet. Sowohl bei Küken als auch bei Mäusen markiert die anteriore Expressionsgrenze von Hoxd12 den Übergang zwischen Sakral- und Schwanzwirbeln (Burke et al. 1995). Aber neben Hoxd12 spielen auch Hoxb13 und Hoxb8 bei der Identität der Schwanzwirbel eine Rolle (Knezevic et al. 1997, Economides et al. 2003, van den Akker et al. 1999, Young et al. 2009, Abb. 15).
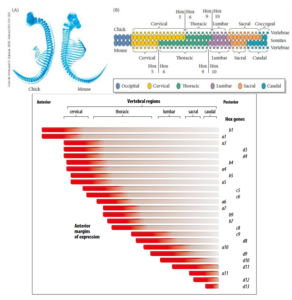
Abb. 15: oben Schematische Darstellung des Wirbelsäulenmusters von Küken und Mäusen entlang der anterior-posterioren Achse. (A) Mit Alcianblau gefärbte Axialskelette in vergleichbaren Entwicklungsstadien. Das Küken hat doppelt so viele Halswirbel wie die Maus. (B) Die Grenzen der Expression von bestimmter paraloger Gruppen von Hox-Genen (Hox5/6 und Hox9/10) wurden auf die Wirbeltyp-Domänen abgebildet. Eine Zusammenfassung der Hox-Genexpression entlang der antero-posterioren Achse des Mausmesoderms. Die anteriore Grenze der Expression jedes Gens ist durch die roten Blöcke dargestellt. Die Expression erstreckt sich in der Regel über eine gewisse Distanz nach hinten, aber der hintere Rand der Expression kann schlecht definiert sein. Das Muster der Hox-Genexpression gibt die regionale Identität der Gewebe an verschiedenen Positionen an. Diese Abbildung zeigt ein Gesamtbild der Hox-Genexpression und ist keine Momentaufnahme der Genexpression zu einem bestimmten Zeitpunkt.
Variationen in den Expressionsmustern all dieser Gene sorgen für eine Variation der Schwanzlänge. Eine Forschungsgruppe untersuchte anhand von Mutationen bei Mäusen, welche Mutationen bei Kandidatengenen für eine Verkürzung des Schwanzes sorgen. Man hat 23 Mutationen identifiziert, und diese waren hauptsächlich auf Gene beschränkt, die an der Achsenverlängerung beteiligt sind. Mindestens die Hälfte der Mutationen, die zu kurzen, fusionierten Schwänzen führen, liegen im Notch/Wnt-Weg der Somitengrenzbildung oder -differenzierung und führen zu Veränderungen der Somitenzahl oder -größe. Mehrere der Mutationen führen auch zu zusätzlichen Knochenfusionen im Rumpfskelett, wie sie bei primitiven und modernen Vögeln zu beobachten sind. Vergleichbare Morphologien lassen sich schon experimentell (!) durch ektopische Überexpression von Hoxb13 oder Veränderungen des Retinsäure-Gradienten hervorrufen (Rashid et al. 2014, Abb. 16). Natürlich ist nicht eindeutig klar, welche oder wie viele Mutationen in der frühen Evolution der Vögel auftraten, die den Schwanz verkürzten. Natürlich muss man auch bedenken, dass ein Rückschluss von Mutationen bei modernen Mäusen nicht zu 100% auf Vögel übertragbar ist, auch wenn die Grundlagen der Ausbildung des Schwanzes sowohl embryologisch als auch genetisch ähnlich sind.
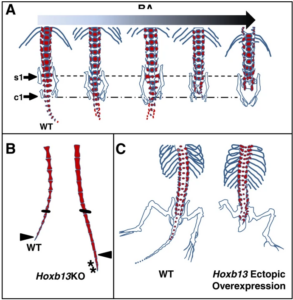
Abb. 16: Experimentelle Manipulationen, die sich auf die Länge des Wirbeltierschwanzes auswirken. (A) Zunehmende RA-Exposition bei Mäuseembryonen führt zu einem fortschreitenden Verlust von Schwanz- und Kreuzbeinwirbeln. s1 bezeichnet den ersten Kreuzbeinwirbel und c1 den ersten Schwanzwirbel. Die Daten wurden von Shum et al. (1999) übernommen. (B) Hoxb13-Knockout (Hoxb13 KO) in der Maus erhöht die Anzahl der kaudalen Wirbel um 2 und verursacht mehr tonnenförmige statt sanduhrförmige Wirbel. Die Balken zeigen die experimentelle Markierung der äquivalent nummerierten Wirbel an; Pfeilspitzen zeigen den Schwanzwirbel Nr. 30 sowohl bei Wildtyp (WT) als auch bei Hoxb13 KO; Sternchen zeigen zwei zusätzliche Schwanzwirbel an. Die Daten wurden von Economides et al. (2003) übernommen. (C) Die frühzeitige ektopische Überexpression von Hoxb13 in der Maus führt zu vorzeitig verkürzten Schwänzen. Daten angepasst aus Young et al. (2009). RA, Retinolsäure.
Unabhängig davon ist anzumerken, dass von untersuchten Mutanten, bei denen die hinteren Wirbelkörper verschmolzen sind, die meisten durch einzelne Mutationen verursacht wurden und dass sie erhebliche phänotypische Veränderungen nicht nur am Schwanz, sondern auch an anderen Teilen des Skeletts aufweisen. Andererseits ist zu beachten, dass die meisten Mutanten, die für diese Studie in Betracht gezogen wurden, Mutationen in den genkodierenden Regionen aufweisen. Mutationen in CREs hätten wahrscheinlich sowohl bei Mäusen als auch bei frühen Vögeln zu weniger pleiotropen Effekten geführt. Die Art der potenziellen pleiotropen Effekte sollte jedoch dennoch berücksichtigt werden, wenn es um die Frage der evolutionären morphologischen Veränderung geht. In diesem Fall spiegeln die pleiotropen Effekte der Wirbelkörpermutationen eine Reihe von Veränderungen wider, die bei frühen Vögeln beobachtet wurden, und diese zusätzlichen Veränderungen traten im selben Zeitrahmen auf wie der Übergang zu verkürzten Schwänzen. Da zu diesen pleiotropen Effekten (zumindest bei der Maus) verschmolzene Wirbel gehören, und zwar nicht nur im Schwanz, sondern auch in den vorderen Regionen, könnten die bei den Konfuziusornithiden, Enantiornithinen und Ornithurinen beobachteten umfangreicheren Synsakralfusionen durch eine Wirbelkörpermutation (oder konvergent durch eine ähnliche Mutation) begünstigt worden sein. Eine zusätzliche Fusion von Rippen oder Dornfortsätzen oder sogar von Fingern könnte ebenfalls stattgefunden haben, was zusammen mit den anderen Phänotypen der Knochenfusion und der Schwanzverkürzung das relativ plötzliche Auftreten dieser kurzschwänzigen Vögel im Fossilbericht erklären könnte. Jeholornis und Confuciusornis waren wahrscheinlich Zeitgenossen (Zhou & Zhang 2007), und Jeholornis wies Flugstrukturen auf, die denen von Confuciusornis sehr ähnlich waren, sich aber in der hinteren Körperhälfte erheblich unterschieden (Zhou & Zhang 2003a). Wenn bei einem primitiven Vogel wie Jeholornis eine Wirbelfusionsmutation auftrat, bei der zusätzliche Wirbel in seinem Synsakrum verschmolzen, der Schwanz gestutzt und einige Rippen verschmolzen wurden, hätte das daraus resultierende Lebewesen eine große Ähnlichkeit mit Confuciusornis gehabt. Sobald die Mutation(en) aufgetreten war(en), wurde(n) sie wahrscheinlich in der Population durch die Vorteile, die sich aus dem Flug und möglicherweise aus der sexuellen Selektion ergaben, fixiert (Abb. 17).
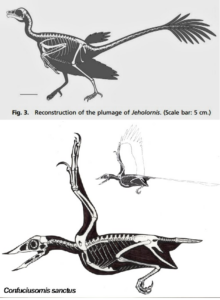
Abb. 17: Jeholornis, Confuciusornis
Wenn wir auf der Grundlage der Daten über die Mausmutanten Vermutungen über die wahrscheinliche Art der Mutation anstellen, die bei einem gefiederten Dinosaurier aus der Gattung der Maniraptoren auf dem Weg zum Vogel auftrat, würden wir annehmen, dass eine oder mehrere Mutationen Gene veränderten, die an der Achsenverlängerung beteiligt waren. Es könnte eine beliebige Anzahl von Achsenverlängerungsgenen betroffen sein, aber bei der Maus liegen die meisten Mutationen, die distal verschmolzene Schwanzwirbel und verkürzte Schwänze verursachen, im Notch/Wnt-Signalweg, in der Somitensegmentierung, der Differenzierung oder der Somitengrenzbildung. Künftige vergleichende Studien der Signalkaskaden zwischen Vögeln, Langschwanzreptilien und Mäusen sollten dazu beitragen, diese lange verschollenen Mutationen aufzudecken und unser Verständnis der Evolution der Vögel aus den Maniraptoren zu erweitern.
Wie ein Vogel laufen
Vögel und Dinosaurier haben natürlich noch eine weitere Gemeinsamkeit: beide laufen auf zwei Beinen, jedoch laufen sie unterschiedlich. Damit ein Zweibeiner in der Mitte des Standes das Gleichgewicht halten kann, müssen die Füße direkt unter der Mitte des Massenschwerpunkts platziert sein, so dass dessen Lage ein wichtiger Faktor ist, der die Ausrichtung der Gliedmaßen beeinflusst (Clarke et al 2006, Alexander 2006).
Lebende Vögel haben eine ungewöhnlich geduckte Haltung der Hinterbeine und eine Fortbewegung, die sich von jenen der Nicht-Vogel-Theropoden unterscheidet (Abb. 18).
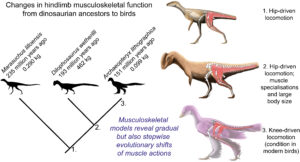
Abb. 18: Unterschiede in der Fortbewegung bei Vögeln und Nicht-Vogel-Theropoden.
Die Fortbewegung der Vögel wird häufig als „kniegetrieben“ charakterisiert, d. h. der größte Teil der Bewegung der Hinterbeine wird durch die Beugung des Knies erreicht, die durch starke „Hamstring“-Muskeln angetrieben wird. Die Hamstrings befinden sich an der Rückseite der Oberschenkel und sind für die Streckung der Oberschenkel und das Beugen des Knies zuständig (Gatesy 1990, 1999). Folglich haben Vögel eine ungewöhnlich gebeugte Körperhaltung mit einer stark gebeugten Hüfte und einem waagerechten Oberschenkelknochen, wobei die Füße kranial, also in Kopfrichtung, zur Hüfte platziert sind.
Nicht-Vogel-Theropoden haben eine aufrechtere Körperhaltung und eine Bewegung der Gliedmaßen, die durch das Zurückziehen des Oberschenkels angetrieben wird. Die Bewegung war eher hüftbetrieben, hauptsächlich mithilfe des Musculus caudofemoralis longus, ein großer Muskel, der sich vom Schwanz bis zum proximalen Oberschenkelknochen und zum Knie erstreckt und den Oberschenkelknochen kraftvoll zurückzieht. Man geht davon aus, dass er bei ausgestorbenen Dinosauriern einen größeren Bewegungsumfang des Oberschenkels ermöglichte als bei Vögeln (Gatesy 1990, 1995, Hutchinson & Allen 2009). Ihr Massenschwerpunkt ist weiter nach hinten gelegen und haben vertikalere Oberschenkelknochen (Abb. 19). Dieser funktionelle Unterschied in der Beinbewegung hat mit der Verlagerung des Massenschwerpunktes zu tun: Vögel haben außer dem Pygostyl keine Schwanzwirbelsäule, wodurch Körperhaltung und Beinbewegung sich von denen der geschwänzten Theropoden unterscheiden. Weiterhin ist die Verlagerung des Massenschwerpunkts nach vorne bei Vögeln vor allem durch das größere Brustbein bedingt (Allen et a. 2013).
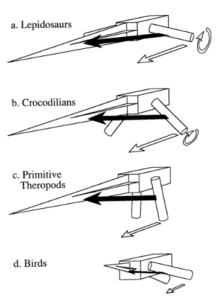
Abb. 19: Schematische Darstellung des Beckens, des Schwanzes und der Oberschenkelknochen von vier Archosauriern in der posterolateralen Ansicht der rechten Seite. Die schwarzen Pfeile, die vom Oberschenkelknochen zum Schwanz verlaufen, stellen den Kraftvektor des Caudofemoralis longus (CFL) dar. Offene Pfeile zeigen die Wirkung des CFL auf den Oberschenkelknochen. a, Bei Echsen mit stark abduzierten Oberschenkeln zieht der CFL den Oberschenkelknochen während der Fortbewegung zurück und dreht ihn. Er ist auch an der seitlichen Beugung des Schwanzes beteiligt. b, Bei Krokodilen sind die Oberschenkelknochen während des hohen Ganges weiter adduziert. Der CFL fungiert nach wie vor als Hauptretraktor des Oberschenkels und ist auch an der leichten Rotation des Oberschenkels beteiligt. Seitliche Wellenbewegungen werden bei niedrigen Geschwindigkeiten reduziert. c, Vorschlag für einen CFL-Retraktionsmechanismus bei Theropoden mit vollständig adduzierten Gliedmaßen. Der kräftige Schwanz dient als Gegengewicht zur vorderen Körperhälfte. Die Oberschenkelknochen sind anteroventral ausgerichtet und werden während der Fortbewegung durch die CFL zurückgezogen. Die Rotation der Oberschenkelknochen um die Längsachse ist gering und die Wellenbildung wird minimiert, da der CFL den Schwanz nach unten und nicht zur Seite zieht. d, Bei den heutigen Vögeln ist der Schwanz reduziert und der CFL ist klein oder nicht vorhanden. Der Massenschwerpunkt liegt anterior, was die Oberschenkelknochen zwingt, sich mehr horizontal auszurichten. Der Oberschenkelrückzug ist reduziert und wird durch die Kniebeugung als die primäre Fortbewegungsart.
Trotz Studien, die auf eine starke Korrelation zwischen morphologischen Veränderungen und Haltungs- und Bewegungsmerkmalen bei Vögeln hindeuten, sind jedoch direkte, experimentelle Beweise selten (Gatesy 1990, 1991, 1995, Allen et al. 2013, Hutchinson 2006, Hutchinson & Allen 2009, Hutchinson & Gatesy 2000).
Eine Studie von Carrano & Biewener im Jahr 1999 brachte künstliche Schwänze an Hühnern an, wodurch der Massenschwerpunkt nach hinten verlagert wurde, in der Hoffnung, eine theropodenähnliche Haltung und Fortbewegung der Gliedmaßen zu erreichen. Ihre Studie lieferte jedoch unerwartete Ergebnisse: Vögel mit angebrachten Schwänzen zeigten noch stärker horizontal ausgerichtete Oberschenkel, während bei der Fortbewegung keine qualitativen Veränderungen im Vergleich zu nicht manipulierten Hühnern beobachtet wurden (Carrano & Biewener 1999, Abb. 20).
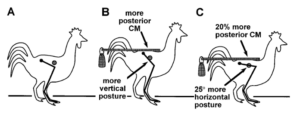
Abb. 20: Versuchsanordnung von Carrano & Biewener (1999). Versuchsaufbau und Ergebnisse der Haltungsänderung. A: Kontroll-Vogel, mit Angabe der Position der Hintergliedmaßen und Massenschwerpunkt (CM Kreis). B: Experiment-Vogel, mit zusätzlichem Gewichtsapparat, der die beabsichtigte Veränderung der CM und der Position der Hintergliedmaßenknochen zeigt. C: Experiment-Vogel, der die tatsächlichen Veränderungen der Position der Hintergliedmaßen und des CM zeigt. Alle Vögel in linker Seitenansicht.
Eine weitere Arbeit aus dem Jahr 2014 von Grossi et al. (Grossi et al. 2014) modifizierte diese Versuchsanordnung, in der den Hühnern schon kurz nach dem Schlüpfen ein künstlicher Schwanz angesetzt wurde und den Tieren während der Ontogenese eine angemessene Bewegung ermöglicht wurde. anders als bei der Studie von Carrano & Biewener (1999) hatten die Hühner größere Gehege und mehr Bewegungsmöglichkeiten. Außerdem waren die künstlichen Schwänze leichter gebaut. Während der Evolution der Vögel kam es zu einem Verlust des Schwanzes und damit einer Umstrukturierung der Beckenmuskulatur. Daher könnten die Vögel zu schwere Schwänze nicht tragen, was zu den unerwarteten Ergebnissen bei Carrano & Biewener (1990) führte. In der neuen Studie wurden diese Punkte beachtet und trotz der Limitationen, dass es bei Vögeln zu Umbauten in der Beckenmuskulatur kam, konnte hier eine Veränderung der Körperhaltung und Fortbewegung gemessen werden, die auch für nicht-Vogel-Theropoden angenommen werden (Abb. 21, 22). Die Verschiebung des Massenschwerpunktes nach Hinten führte zu einer vertikaleren Ausrichtung des Oberschenkelknochens beim Stehen und einer geringeren Kniebeugung beim Gehen (vgl. Gatesy 1990, 1991, 1995, Hutchinson & Gatesy 2000).
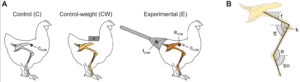
Abb. 21: Versuchsbedingungen und gemessene kinematische Parameter. (A) Schema der Kontrolltiere (C, graue Hintergliedmaßen), der Tiere mit Kontrollgewicht (CW, gelbe Hintergliedmaßen) und der Versuchstiere (E, orangefarbene Hintergliedmaßen). Kontrollgewichtige Versuchstiere wurden mit einem zusätzlichen Gewicht über dem Becken aufgezogen. Versuchstiere wurden mit einem Holzstab aufgezogen, der in Knetmasse gesteckt und am Beckengürtel befestigt war. Abgebildet sind Schätzungen des Massenschwerpunkts des Schwanzgerüsts (tCOM) sowie eines Kontrolltieres (cCOM) und eines Versuchstiers (eCOM). (B) Diagramm der in dieser Studie verwendeten Segmentwinkel (f, Femur; tt, Tibio-Tarsus; tm, Tarso-Metatarsus) und Gelenkwinkel (k, Knie; a, Knöchel).
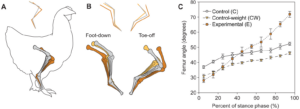
Abb. 22: Auswirkungen der zusätzlichen Masse und des experimentellen Schwanzes auf die Haltung und Kinematik der Gliedmaßen. (A) Diagramm mit der durchschnittlichen Haltung der Gliedmaßen im Stehen von Kontroll- (C), Kontrollgewicht- (CW) und Versuchstieren (E). Das Strichmännchen oben zeigt die Ausrichtung der Gliedmaßensegmente zwischen den Gruppen, um Haltungsunterschiede zwischen den Behandlungen zu veranschaulichen. Die Knochen der Hintergliedmaßen und die Ausrichtung der Segmente sind wie in Abb. 21 farbkodiert. (B) Diagramm der durchschnittlichen Haltung der Gliedmaßen beim Aufsetzen (Beginn der Stützphase) und beim Abheben (Ende der Stützphase) von Kontroll-, Kontrollgewicht- und Versuchstieren. (C) Femurwinkel während der Stützphase bei Kontroll-, Kontrollgewicht- und Versuchstieren. Die Daten sind als Mittelwert ± s.e.m. angegeben.
Diese Ergebnisse deuten auf eine Verschiebung von der standardmäßigen, kniegetriebenen bipedalen Fortbewegung der Vögel zu einer mehr hüftgetriebenen Fortbewegung hin, die typisch für zweibeinige Nicht-Vogel-Theropoden ist.
Eine neure Studie (Allen et al. 2021) konnte nun mittels biomechanischer Computermodelle zeigen, wie sich die Funktionen von 35 Beinmuskeln bei Dinosauriern im Laufe der Evolution entwickelt haben. Die Forscher scannten Dinosaurierfossilien ein und erzeugten von ihnen digitale 3D-Modelle. Anschließend fügten sie Muskeln an den Hinterbeinen hinzu, wobei sie sich auf umfangreiche Vorarbeiten stützten, bei denen sie anhand der Narben auf den Fossilien und durch Vergleiche mit lebenden Tieren herausfanden, wo diese Muskeln ansetzten. Die Computermodelle berechneten dann die Hebelwirkung (mechanische Vorteile) der Muskeln um die Gelenke herum, und statistische Analysen zeichneten die Veränderungen dieser Funktionen im Laufe der Evolution der Dinosaurier auf. Die Fähigkeit der Hüftmuskulatur bei Nicht-Vogel-Dinosauriern den Körper aufrecht zu stützen und zu bewegen veränderte sich während des Übergangs zu den Vögeln hin zu der charakteristischen gebückten Haltung moderner Vögel. Auch die Kniemuskeln spiegeln diese Veränderungen wider: von einer hüftgesteuerten frühen Fortbewegungsweise – wie bei lebenden Krokodilen – zu einer eher kniegesteuerten, wie sie heute bei Vögeln zu beobachten ist. Die überraschendste Entdeckung war, dass relativ großwüchsige, fleischfressende Dinosaurier, die während der frühen Jurazeit (vor etwa 200 Millionen Jahren) ihre Hinterbeine zum Laufen benutzten, eine ungewöhnlich spezialisierte Reihe von Muskelfunktionen entwickelten, die mit beweglicheren Beingelenken korrelierten, die möglicherweise mit der Aufnahme größerer Beute zusammenhingen – anders als bei der späteren Vogelstammlinie. Bei der Vogelstammlinie wurde die vorherrschende Vorstellung über die Entwicklung der Fortbewegung der Dinosaurier bestätigt: In dem Maße wie diese Dinosaurier ihre Schwänze reduzierten und ihre Vordergliedmaßen veränderten, war die Haltung der Beine allmählich weniger aufrecht und mehr gebückt und wechselte von einem hüftgelenkgetriebenen zu einem kniegelenkgetriebenen Geh- und Laufmechanismus. Die Computermodelle zeigen, dass die einzelnen Muskeln im Großen und Ganzen in dieses Muster der allmählichen Entwicklung passen (Abb. 23).
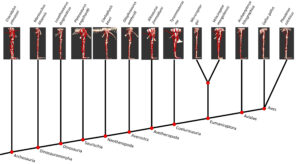
Abb. 23: Kladogram der Dinosaurier und ihrer Verwandten, wie er in der Studie verwendet wurde, mit allen 13 Modellen, Artnamen und Namen der Gruppen am unteren Rand (rote Knoten) des Baums. Averostra und Avetheropoda waren Vorfahren der theropoden Dinosaurier, die der Studie zufolge eine besondere Spezialisierung der Hintergliedmaßen aufwiesen.
Der Vogelflug: nicht-reduzierbar komplex?
Wie ein Vogel zu Laufen ist das eine, wie einer zu fliegen aber was anderes. Die Debatten über den Ursprung des Vogelflugs sind fast so alt wie die Idee, dass sich die Vögel aus den Dinosauriern entwickelt haben. Zwei Theorien haben die Diskussion seither beherrscht: die „Bodentheorie“ (Cursorialtheorie) und die „Baumtheorie“ (Arborealtheorie). Nach der Bodentheorie haben sich die Vögel aus kleinen, schnellen am Boden laufenden Raubsauriern entwickelt. Die Baumtheorie besagt, dass sich der Schlagflug aus dem Gleitflug von arborealen (baumkletternden) Tieren entwickelte.
Doch bevor wir die einzelnen Theorien näher vorstellen, sei die Frage erlaubt, wie wahrscheinlich ist es, dass Dinosaurier überhaupt fliegen konnten? Um zu suggerieren, die Evolution des Vogelflugs sei extrem unwahrscheinlich, wird von Kreationisten gern behauptet, die Evolution hätte unzählige Merkmalsänderungen und Feinheiten im Bau des Gefieders, der Muskulatur, der Gliedmaßen, des Skeletts, des Verhaltens, der Datenverarbeitung im Gehirn usw. gleichzeitig berücksichtigen müssen, um eine Flugfähigkeit zu erreichen. Die Fähigkeit zum Fliegen wird dabei als nicht-reduzierbar komplex eingestuft und stelle daher ein klares Desing-Indiz dar (vgl. Junker & Widenmeyer 2021).
Merkmale eines hochgradig spezialisierten Bewegungsapparats aufzulisten, mit denen heutige Vögel ihren Schlagflug perfektionieren, ist das eine. Zu folgern, all diese Merkmale seien für einen rudimentären Flug unentbehrlich und hätten nicht unabhängig voneinander entstehen können, das andere. Betrachten wir uns doch mal zwei Gattungen: Anchiornis und Archaeopteryx (Abb.24 und 25).

Abb. 24: Anchiornis und Archaeopteryx
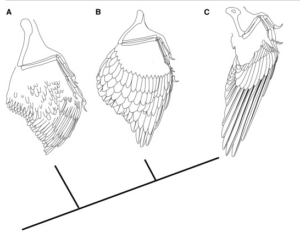
Abb. 25: (A) Morphologie des Urflügels (am Beispiel von Anchiornis), dessen Flügel aus schlanken, symmetrischen und wenig differenzierten Flugfedern besteht. (B) Flügel der frühen Avialae (am Beispiel von Archaeopteryx), bei denen die Federn länglich, breit und asymmetrisch sind. (C) Flügel der Pygostylia (hier Confuciusornis), bei denen die primären Remigien weiter verlängert und die Deckfedern verkürzt sind. Quelle: Longrich et al. 2012).
Anchiornis besaß zwar schon einige der aufgelisteten Merkmale. Doch ihm fehlten noch zahlreiche Komponenten: Die Federn bestanden zu einem hohen Anteil noch aus alpha-Keratin (Pan et al. 2019), weswegen ihnen die „besonderen“ biomechanischen Eigenschaften heutiger Federn (Flexibilität, Knickfestigkeit) nicht zukamen. Ihre Struktur wich auch deutlich vom „zweckmäßigen Feinbau“ moderner Federn ab. So gibt es Hinweise darauf, dass die Federfahnen nicht geschlossen waren (Saitta et al. 2017, S. 276). Zudem besaß Anchiornis, verglichen mit heutigen Vögeln, viel kürzere Schwungfedern im Verhältnis zur Länge des Oberarmknochens. Die Federn waren symmetrisch, die Primär- und Sekundärfedern schmal und schwach (Longrich et al. 2012) und die verdeckten Federn noch nicht in gestaffelten Reihen angeordnet, was auf eine geringe Differenzierung der Federn im Gefieder hinweist (Wang et al. 2017). Zudem befanden sich die längsten Flügelfedern am Handgelenk, was den Flügel an der Spitze zu einem wenig flugangepassten Profil verjüngte (Hu et al. 2009).
Ob Archaeopteryx wirklich fliegen konnte ist umstritten. Studien haben gezeigt, dass Archaeopteryx die Gehirnstrukturen und die Gleichgewichtssensoren im Innenohr besaß, die Vögel zur Steuerung ihres Fluges verwenden (Alonso et al. 2004). Archaeopteryx hatte auch eine Flügelfederanordnung wie moderne Vögel und ähnlich asymmetrische Flugfedern an seinen Flügeln und seinem Schwanz. Allerdings fehlte dem Archaeopteryx der Schultermechanismus, mit dem die Flügel moderner Vögel schnelle, kräftige Aufwärtsschläge erzeugen; dies könnte bedeuten, dass er und andere frühe Vögel nicht zum Schlagflug fähig waren und nur gleiten konnten (Senter 2006). Einer aktuelleren Studie zur Folge konnte zwar Archaeopteryx aktiv fliegen, die sich aber von der moderner Vögel unterscheidet (Voeten et al. 2018).
Die Entdeckung zahlreicher gefiederter Dinosaurier seit den frühen 1990er Jahren bedeutet jedoch, dass der Archaeopteryx nicht mehr die Schlüsselfigur in der Evolution des Vogelflugs ist. Andere kleine gefiederte Coelurosaurier aus der Kreidezeit und dem späten Jura zeigen mögliche Vorläufer des Vogelflugs. Dazu gehören Rahonavis, ein Bodenläufer mit einer Velociraptor-ähnlichen, erhobenen Sichelklaue an der zweiten Zehe, von dem einige Paläontologen annehmen, dass er besser an den Flug angepasst war als Archaeopteryx (Chiappe 2007), Scansoriopteryx, ein auf Bäume kletternder Dinosaurier, der die Baumtheorie unterstützen könnte (Zhang et al. 2002), und Microraptor, ebenfalls zum Klettern fähig und möglicherweise zum aktiven Flug fähig war, aber auch gut entwickelte Federn an den Beinen hatte, also quasi vier Flügel besaß (Chatterjee & Templin 2007). Bereits 1915 vertraten einige Wissenschaftler die Ansicht, dass die Evolution des Vogelflugs möglicherweise ein vierflügeliges Stadium durchlaufen hat (Beebe 1915, Abb. 26). Hartman et al. (2019) stellten fest, dass sich der Flug bei den Paravianen wahrscheinlich fünfmal und nicht nur einmal entwickelt hat. Yi, Archaeopteryx, Rahonavis und Microraptor wurden daher als Beispiele für konvergente Evolution und nicht als Vorläufer des Vogelflugs angesehen (Abb. 27). Die angebliche Konvergenzproblematik haben wir an anderer Stelle schon geklärt.
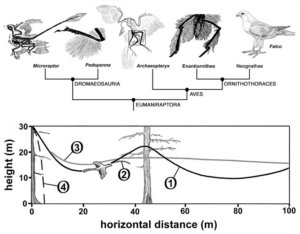
Abb. 26: oben: Ein einfaches Kladogramm der der Eumaniraptora, das die Verteilung der Beinfedern ausgewählter Taxa zeigt (modifiziert aus Holtz 2007, Xu & Zhang 2005 und Zhang & Zhou 2004). Bei Microraptor sind die Konturfedern an Femur, Tibia und Metatarsus vorhanden, aber nur die Metatarsalfedern sind asymmetrisch und bilden den ventralen Flügel des Doppeldeckers; die Federn an Femur und Tibia sind symmetrisch (Xu et al. 2003). Bei Pedopenna sind lange Metatarsalfedern vorhanden, die den ventralen Flügel des Doppeldeckers bilden, aber sie scheinen symmetrisch zu sein (Xu & Zhang 2005). Bei Archaeopteryx sind lange Konturfedern an den Oberschenkeln und Schienbeinen vorhanden, aber am Mittelfuß scheinen sie verloren gegangen zu sein (Longrich 2006). In diesem Stadium fand wahrscheinlich die Entwicklung des Eindeckers statt. Bei einem unbenannten Enantiornithes-Vogel sind lange Konturfedern an Femur und Tibia vorhanden, aber im Bereich des Mittelfußes fehlen sie (Zhang & Zhou 2004). Bei modernen Greifvögeln wie dem Falken Falco sind ähnliche Konturfedern an Oberschenkel und Schienbein vorhanden, um den Körper stromlinienförmig zu gestalten, aber die Mittelfußfedern sind im Allgemeinen reduziert oder fehlen. Unten: Gleitflug von Microraptor. Kurve 1 zeigt den phugoiden Gleitflug. Kurve 2 zeigt einen schnellen Endanflug mit hohem Widerstand. Kurve 3 zeigt den Gleitpfad mit eingeschaltetem Pitch-Dämpfer. Kurve 4 zeigt eine Fallschirmflugbahn.
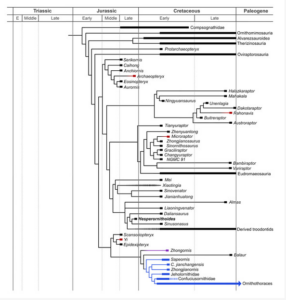
Abb. 27: Kladen, die potenziell flugfähige Taxa (rot) enthalten, sind erweitert, um ihre Position innerhalb der flugunfähigen Taxa (schwarz) zu zeigen. Taxa, die sich in der Luft fortbewegen und direkt mit der Kronengruppe der Aves verbunden sind, sind blau gefärbt. Zhongornis ist violett eingefärbt, um die Ungewissheit zu verdeutlichen, die sich um dieses juvenile Exemplar rankt. Gestrichelte Linien weisen auf Unsicherheiten hinsichtlich des Alters (Xiaotingia) oder der zugehörigen Taxa hin (Koparion zu den Troodontiden und Nicht-Jehol-Taxa zu den Confuciusornithiformes).
Wir sehen also auf der einen Seite, dass ursprünglichen flugfähigen Theropoden etliche der oben angeführten Passungen fehlten oder fehlen konnten. Das heißt, es handelt sich um nachgelagerte, sukzessive Optimierungsschritte höherer Vögel. Andererseits lassen sich die evolutionären Wurzeln unzähliger Charakteristika, die heute den Vögeln das Fliegen ermöglichen, bis zu den Nichtvogel-Dinosauriern zurückverfolgen. Der Fachmann spricht von günstigen Exaptationen, die rückblickend der Evolution des Flugs überhaupt erst den Weg bahnten. Hier einige Beispiele (Brusatte et al. 2015, Abb. 28): Die Bildung luftgefüllter Hohlknochen und eines vogelähnlichen Lungen-Luftsacksystems nahm bei den ersten Echsenbecken-Dinosauriern ihren Anfang. 100 Mio. Jahre vor dem Erscheinen der Vögel bahnte sich eine rasante Zunahme der Stoffwechsel- und Wachstumsraten sowie die Entwicklung der typischen „Durchflusslungen“ an, womit die Vögel heute ihren Sauerstoffbedarf decken. Auch dies war eine günstige Voranpassung, die mit dem Fliegen nichts zu tun hatte. Die langen Beine der späteren Vögel und ihre drei dünnen Hauptzehen entstanden erstmals vor mehr als 230 Millionen Jahren. Dies ging mit der Umgestaltung des „Reptilien“-Körpers in aufrecht gehende Theropoden einher. Etwa 50 Mio. Jahre vor dem Auftreten der Vögel verwuchsen die paarigen Schlüsselbeine zum Gabelbein. Vermutlich stabilisierten die wolfsgroßen Raptoren damit den Schultergürtel beim Zerreißen ihrer Beute. Bei ihren fliegenden Nachfahren hilft die Neuerung, beim Flügelschlag Energie einzusparen.

Abb. 28: oben: Die Phylogenie zeigt, wie sich die Vögel in den größeren Stammbaum der Wirbeltiere einfügen und welche Beziehungen zwischen den frühesten Vögeln und ihren engsten Verwandten, den Dinosauriern, bestehen (basierend auf Brusatte et al. 2014 und anderen dort zitierten Studien). Die Zeitskala ist in Millionen von Jahren angegeben; die dicke rote Linie kennzeichnet das Massenaussterben an der Kreidezeit-Paläogen-Grenze, das durch einen Asteroideneinschlag verursacht wurde (gekennzeichnet durch den Feuerball auf der rechten Seite); die Pfeile bezeichnen Linien, die das Aussterben überlebt haben; die Kreise stellen Arten dar, die von einem bestimmten Zeitpunkt an bekannt sind; die dicken Linienabschnitte der Zweige zeigen direkte fossile Belege und die dünnen Linien sind zeitliche Verteilungen, die durch phylogenetische Geisterlinien impliziert werden; Cz, känozoisches Intervall nach dem Aussterben am Ende der Kreidezeit. Die anatomischen Merkmale im unteren Teil der Abbildung sind ungefähr dort eingezeichnet, wo sie sich in der Phylogenie entwickeln. Unten: Montage von vogelähnlichen Merkmalen bei Nicht-Vogel-Theropoden. (A) Einfache fadenförmige „Protofedern“ am Kopf des Compsognathiden Sinosauropteryx. (B) Große, verzweigte Federn, die einen Flügel an den Armen des Dromaeosauriers Zhenyuanlong suni bilden. (C) Elterntier eines Oviraptorosauriers, das sein Nest mit großen Eiern ausbrütet. (D) Furcula des Dromaeosauriers Bambiraptor feinbergorum. (E) Hohle Innenhöhle im Schienbein des Tyrannosauriden Alioramus altai. (F,G) Pneumatische Foramina (durch Pfeile gekennzeichnet), wo Luftsäcke die Knochen durchdrangen, in einem Halswirbel (F) und einer Rippe (G) des Tyrannosauriden Alioramus altai. (H) Das rekonstruierte Gehirn des Troodontiden Zanabazar junior (orange, Riechkolben; grün, Telencephalon; blau, Kleinhirn; rot, Mittelhirn; gelb, Hinterhirn). (I) Das Gehirn des modernen Spechtes Melanerpes.
Generell sind auch Federn nicht zum Fliegen entwickelt worden. Federn sind bei Coelurosauriern (einschließlich des frühen Tyrannosauroiden Dilong) sehr häufig (Prum 1999, Prum & Brush 2002, 2003, Roy et al. 2020, Benton et al. 2019, Neukamm & Beyer 2023) und wie wir bereits in den vorherigen Beiträgen mehrmals verdeutlicht haben, sind moderne Vögel eine Untergruppe der Coelurosaurier. Zu den am weitesten verbreiteten ursprünglichen Funktionen der Federn gehören die Wärmeisolierung und das Imponiergehabe, wie bei den modernen Vögeln, sie sind also weit vor dem Vogelflug entstanden. Zudem zeigen neuere Hinweise, dass Vogelfedern homolog zu den Reptilienschuppen sind (Musser et al. 2015).
Von den Bäumen herunter oder vom Boden hinauf?
Ob der Vogelflug vom Boden aus oder über einen Fallschirm- und Gleitflug in den Bäumen seinen Anfang nahm, ist eine bislang offene Frage (Abb. 29). Die Boden-Theorie über den Ursprung des Fliegens wurde erstmals von Samuel Wendell Williston vorgeschlagen und von Baron Nopcsa weiter ausgearbeitet. Eine mögliche Hypothese besagt, dass die Vorfahren der Vögel, kleine gefiederte, am Boden laufende Raubsaurier waren, die bei der Verfolgung von Beutetieren ihre Vorderbeine für das Gleichgewicht nutzten, und dass sich die Vorderbeine und Federn später so entwickelten, dass sie den Gleitflug und später den Schlagflug ermöglichten (Lockley et al. 2007, Fowler et al. 2011). Biomechanische Untersuchungen zeigen außerdem, dass flugunfähige Tiere mit Konturfedern auch vom Boden aus, also laufend, einen dynamischen Auftrieb erzeugen können (Heers 2016). Mit ihrer Hilfe lassen sich Hindernisse und kurze Distanzen gleitend oder flatternd überwinden. Zudem ermöglicht der Auftrieb ein schnelleres, wendigeres Laufen. Körpergröße, Bein-Flügel-Koordination, Muskelkapazität, Flügellänge und das Verhalten können so sukzessive an die Erfordernisse eines immer ausdauernderen Flugs angepasst worden sein (Heers et al. 2018).
Die meisten Versionen der Baumhypothese besagen, dass die Vorfahren der Vögel sehr kleine Dinosaurier waren, die in Bäumen lebten und von Ast zu Ast sprangen. Diese kleinen Dinosaurier besaßen bereits Federn, die von der Evolution übernommen wurden, um längere, steifere Formen zu entwickeln, die für die Aerodynamik nützlich waren und schließlich zu Flügeln führten. Die Flügel hätten sich dann weiterentwickelt und wären zunehmend verfeinert worden, um dem Springer mehr Kontrolle zu geben, Fallschirme zu bauen, zu gleiten und schrittweise zu fliegen. Diese Hypothese besagt auch, dass die Aerodynamik von solchen baumlebenden Tieren weitaus energieeffizienter ist, da diese Tiere einfach fallen, um eine minimale Gleitgeschwindigkeit zu erreichen (Chatterjee & Templin 2004, Tarsitano et al. 2000). Mehrere kleine befiederte Theropoden wurden als mögliche baumbewohnende und/oder aerodynamische Anpassungen interpretiert. Dazu gehören Scansoriopteryx, Microraptor oder Anchiornis. Die Analyse der Proportionen der Zehenknochen von Archaeopteryx und Confuciusornis im Vergleich zu denen der bodenlebenden Arten legt nahe, dass sie sowohl auf dem Boden als auch auf Bäumen gelebt haben könnten (Hopson 2001). Eine andere Studie (Glenn & Bennett 2007) legt nahe, dass die frühesten Vögel und ihre unmittelbaren Vorfahren nicht auf Bäume kletterten. In dieser Studie wurde festgestellt, dass die Krümmung der Zehenkrallen der frühen Vögel eher der von modernen bodenlebenden Vögeln als der von Baumvögeln gleicht.
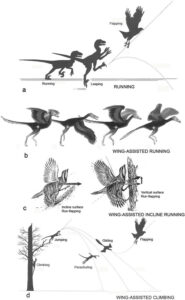
Abb. 29: Hypothesen zur Entstehung des Vogelfluges.
Beide Hypothesen müssen sich aber nicht ausschließen. Neuere biophysikalische Berechnungen zeigen, dass Aufwinde an Hängen, Bergflanken oder Steilküsten ausreichten, um kleine gefiederte Paravianer vom Boden aus bis in die Bäume zu tragen (Shahid et al. 2019, Abb. 30). Der meteorologische Aspekt beseitigt die bis dato bestehenden Schwachstellen in beiden Szenarien und bringt die scheinbaren Gegensätze zwischen der „Bodentheorie“ und der „Baumtheorie“ zum Verschwinden: Je nach Windbedingungen glitten die Paravianer sowohl aufwärts als auch abwärts und benötigten weder Kletterhilfen noch eine ausgeprägte Lauf- und Flugmuskulatur.

Abb. 30: oben: Mechanismus des Windes: (a) hangaufwärts; (b) hangabwärts. Unten: Prozess des Baumgleitens: (a) Ein Theropode, der mit dem Fallschirm vom Ast eines Baumes auf den Boden springt; (b) Versuch, von einem Baum zu einem anderen zu gleiten; (c) Der Theropode konnte von der höheren Position eines Baumes zur niedrigeren Position eines anderen gleiten; (d) Der Theropode konnte seine Flugbahn ändern, indem er seine Ausrichtung während des Gleitens so anpasste, dass die resultierende Kraft ihn an eine bestimmte Position heben konnte.
Eine dritte Theorie ist die „wing-assisted incline running“, kurz WAIR, die eine Variante der Bodentheorie ist und besagt, dass die Flügel ihre aerodynamischen Funktionen aufgrund der Notwendigkeit entwickelten, sehr steile Hänge wie Bäume schnell hinaufzulaufen, was kleinen gefiederten Dinosauriern helfen würde, vor Raubtieren zu entkommen. Solche Verhaltensweisen wurden bei Chukarhuhn-Küken beobachtet (Dial 2003, Bundle & Dial 2003, Tobalske& Dial 2007, Abb. 31). Sie wurde später auch bei anderen Hühnervögeln und Tauben beobachtet (Jackson et al. 2011, Dial & Jackson 2010).
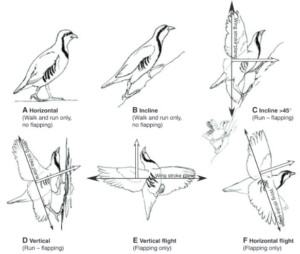
Abb. 31: Überblick über die Flügelbewegungen während des WAIR und die vorgeschlagenen Übergänge, die mit der Hypothese des WAIR-Ursprungs des Fluges einhergehen. (A und B) Vögel, die über ebene Untergründe oder flache Steigungen laufen, setzen ihre Flügel nicht zur Unterstützung des Laufens ein. Doch selbst eine teilweise Flügelentwicklung unterstützt die Individuen bei der Fortbewegung in Hanglagen (45°) (C). (C und D) Ein Teil des Flügelschlagzyklus (bis zu 30 %) beinhaltet aerodynamische oder Trägheitskräfte, die auf die geneigte Oberfläche und nicht in den Himmel gerichtet sind, was ausreicht, um die Traktion der Hintergliedmaßen beim WAIR zu verstärken. (D bis F) Bei der Bewältigung vertikaler Steigungen erreichen die Vögel eine transversale (dorsoventrale) Flügelbewegung, die die für den Luftflug erforderlich ist. Quelle: Dial (2003).
Diese Hypothese besagt, dass die sich entwickelnden Flügel der Theropoden-Dinosaurier dazu dienten, das Tier auf ähnliche Weise wie moderne Vögel an Hängen oder Bäumen hinaufzutreiben, und dass sich daraus schließlich der Schlagflug entwickelte (Bicudo 2010, Dial 2003). Bei der Aufstellung der Hypothese wurde vorgeschlagen, dass WAIR möglicherweise von gefiederten Theropoden wie Caudipteryx zur Entwicklung des Flugs genutzt wurde. Das Modell stand eine Zeit lang im Rampenlicht, da es eine gute Erklärung dafür zu liefern schien, wie Maniraptoren ihre ersten Flugversuche unternommen haben könnten. Die Dinge gerieten ins Wanken, als klar wurde, wie sehr ein Vogel auf das Fliegen spezialisiert sein muss, damit WAIR funktioniert.
Ein mögliches Problem mit der WAIR-Hypothese ist, dass den frühen Vögeln, einschließlich des Archaeopteryx, der Schultermechanismus fehlte, mit dem die Flügel der modernen Vögel schnelle, kräftige Aufwärtsschläge erzeugen (Senter 2006).
Ist ein Übergang von Gleitflug zum Schlagflug möglich?
Kreationisten argumentieren jedoch, unabhängig davon welche Hypothese nun die richtige zur Entstehung des Vogelflugs sei, dass die Entwicklung des aktiven Flugs (Schlagflugs) aus dem Gleitflug problematisch sei, da für den Übergang unüberwindbare Hürden vorhanden seien. Der Übergang sei also zu kompliziert und die Selektionsbedingungen seien zu unterschiedlich und die Kontrollmechanismen zu aufwändig (vgl. Junker 2019).
Diese Argumente stützen sich meist auf veraltete Quellen, denn biomechanische Studien haben schon längst gezeigt, dass es zwischen Gleit- und Schlagflug ein funktionelles Kontinuum mit graduellen Anpassungsmöglichkeiten gibt.
Theoretische Modelle wie auch Experimente mit Schlagflugrobotern zeigen, dass selbst ein schwaches Schlagen mit niedriger Amplitude genug Schub erzeugen kann, um einen Nutzen daraus zu ziehen, selbst wenn ein solches Schlagen zu schwach ist, um einen Horizontalflug aufrechtzuerhalten. Diese Ergebnisse bedeuten, dass wir das Gleiten im Vergleich zum Flug mit voller Kraft – den Schlagflug, wie er von lebenden Vögeln, Fledermäusen und Insekten praktiziert wird – als zwei Extreme in einem Kontinuum betrachten müssen. Zwischen diesen Extremen könnten die Tiere das Schlagen mit einer Reihe von Vorteilen verbinden – angefangen von schwachem Flattern, um den Gleitflug etwas zu verlängern, bis hin zu stärkerem Schlagen, um die Gleitstrecke um das Fünf- oder Zehnfache zu erhöhen (Alexander 2015).
Anders gesagt, bei der „stark abgewandelten“ Physiologie der aktiven Flieger kann es sich durchaus um graduelle Optimierungen von zuvor bestehenden Skelett- und Federstrukturen handeln. Archaeopteryx etwa besaß noch keinen Brustbeinkamm, an dem bei Vögeln die kräftige Muskulatur für den Schlagflug ansetzt. Auch der starre Schultergürtel ließ noch keinen ausdauernden Schlagflug zu. Trotzdem gibt es Hinweise, dass er kein reiner Gleiter mehr war, sondern schon zeitweise aktiv flog (Voeten et al. 2018). Anchiornis besaß ein noch geringeres Schlagflug-Potenzial als Archaeopteryx (Pittman et al. 2022) und Eosinopteryx (Godefroit et al. 2013a), Aurornis (Godefroit et al. 2013b) sowie Xiaotingia (Xu et al. 2011) ein nochmals geringeres (Abb. 32).
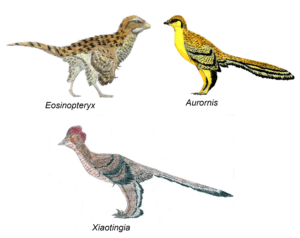
Abb. 32: einige Vertreter der Familie der Anchiornithidae, die ein geringeres Schlagflugpotenzial haben als Archaeopteryx.
Zudem geht die Forschung davon aus, dass der Flugapparat mesozoischer Paravianer inklusive Archaeopteryx von Natur aus stabil war; erst die hochgradig manövrierfähigen Systeme moderner Vögel erfordern aktive Kontrollmechanismen (Maynard Smith 1952, Alexander 2015). Mit anderen Worten: Eingebaute Stabilität und hohe Manövrierfähigkeit sind gegensätzliche Eigenschaften. Die aktiven Kontrollmechanismen im Nervensystem moderner Vögel erweisen sich als evolutionär neue und stark abgeleitete Spezialisierungen. Im Übrigen zeigen schon diverse Ameisen, die keinerlei aerodynamische Anpassungen zeigen, Kontrollmechanismen in rudimentärster Form (Alexander 2015). Fallen sie vom Baum, behalten sie die Orientierung über ihre Position und können beim Sturz in die Tiefe ihre Fallrichtung beeinflussen. Was bedeutet das für die Evolution der Vögel? Wenn zahlreiche auf Bäumen lebende Tiere solche Fähigkeiten besitzen und wenn einige dieser Tiere einem Selektionsdruck ausgesetzt waren, Stürze in einen Gleitflug zu verwandeln, dann hatten sie einen Vorsprung in der Evolution eines noch effektiveren Gleitfluges. (Alexander 2015)
Abschluss
Die Behauptung, die einzelnen Module des „Vogelbauplans“ könnten nicht isoliert voneinander entstanden sein, ist also Unsinn: Die Theropoden-Fossilien lassen sich in eine Reihenfolge bringen, in der sich die „nichtreduzierbar komplexe“ „Gesamtorganisation“ der Vögel in einer Serie von Merkmals-Additionen auflöst. Man findet keine Vögel, die sich wesensmäßig von Dinosauriern unterscheiden würden, sondern nur abgestufte Ähnlichkeiten innerhalb der Dinosaurier-Klade. Diese abgestuften Ähnlichkeiten deuten darauf hin, dass die Evolution von so charakteristischen Vogelmerkmalen wie Federn und Flügeln nicht von der Selektion auf aerodynamische Eigenschaften hin geprägt war.
Vielmehr entwickelten sie sich aus anderen Gründen wie Balz, Imponier- oder Brutverhalten (Brusatte 2017). Die Evolution scherte sich nicht um die „irreduzible Komplexität“ eines (noch nicht existenten) Flugapparats. Sie addierte in der Dinosaurierlinie einfach ein Merkmal nach dem anderen und befand die Ergebnisse in wechselnden Kontexten für tauglich. Dabei wurden ganz beiläufig die Voraussetzungen für einen rudimentären Flug geschaffen, ohne dass dies intendiert oder absehbar war.
Eigentlich haben wir es jetzt: die meisten Argumente, warum Vögel Dinosaurier sind, sind ausreichend dokumentiert und das in sieben Episoden. Eigentlich könnten wir hier aufhören, doch noch eine Bonus-Episode ist in Planung. Denn nicht jeder Paläontologe ist von den Argumenten überzeugt: eine kleine Minderheit, die sich um Alan Feduccia schart lehnt es vehement ab, Vögel als eine Untergruppe der Dinosaurier zu betrachten. Das ein oder andere Mal wurde er und einige seiner Argumente angesprochen. Es gibt aber noch einige Kleinigkeiten, die wir uns in der letzten Episode nochmal näher anschauen wollen.
Literatur
Alexander, D. E. (2015): On the wing: insects, pterosaurs, birds, bats, and the evolution of animal flight. New York: Oxford University Press.
Alexander RM (2006): Dinosaur biomechanics. Proceedings of the Royal Society B 273: 1849–1855.
Allen V, Bates KT, Li Z, Hutchinson JR (2013): Linking the evolution of body shape and locomotor biomechanics in bird-line archosaurs. Nature 497: 104–107.
Allen VR, Kilbourne BM, Hutchinson JR (2021): The evolution of pelvic limb muscle moment arms in bird-line archosaurs. Sci. Adv. 7, eabe2778.
Alonso, P.D., Milner, A.C., Ketcham, R.A., Cokson, M.J. and Rowe, T.B. (2004): The avian nature of the brain and inner ear of Archaeopteryx. Nature 430 (7000): 666–9.
Amores A, Force A, Yan YL, Joly L, Amemiya C, Fritz A, Ho RK, Langeland J, Prince V, Wang YL, Westerfield M, Ekker M, Postlethwait JH (1998): Zebrafish hox clusters and vertebrate genome evolution. Science 282: 1711-1714.
Aoyama, H., Asamoto, K. (2000): The developmental fate of the rostral/caudal half of a somite for vertebra and rib formation: experimental confirmation of the resegmentation theory using chick-quail chimeras. Mechs. Dev. 99, 71–82.
Aulehla A, Pourquie O (2010): Signaling gradients during paraxial mesoderm development. Cold Spring Harb Perspect Biol 2: a000869-
Aulehla A, Wehrle C, Brand-Saberi B, Kemler R, Gossler A, Kanzler B, Herrmann BG (2003): Wnt3a plays a major role in the segmentation clock controlling somitogenesis. Dev Cell 4: 395-406.
Aulehla A, Wiegraebe W, Baubet V, Wahl MB, Deng C, Taketo M, Lewandoski M, Pourquie O (2008): A beta-catenin gradient links the clock and wavefront systems in mouse embryo segmentation. Nat Cell Biol 10: 186-193.
Baker, R.E., Schnell, S., Maini, P.K. (2006): A clock and wavefront mechanism for somite formation. Dev. Biol. 293, 116–126.
Barsbold R, Currie PJ, Myhrvold NP, Osmolska H, Tsogtbaatar K, Watabe M (2000): A pygostyle from a non-avian theropod. Nature 403: 155-156.
Beebe, C. W. A. (1915): Tetrapteryx stage in the ancestry of birds. Zoologica. 2: 38–52.
Benton, M. J., Dhouailly, D., Jiang, B., McNamara, M. (2019): The Early Origin of Feathers. Trends in Ecology & Evolution. 34 (9): 856–869.
Bessho Y, Hirata H, Masamizu Y, Kageyama R (2003): Periodic repression by the bHLH factor Hes7 is an essential mechanism for the somite segmentation clock. Genes Dev 17: 1451-1456.
Bicudo, J. E. (2010): Ecological and Environmental Physiology of Birds. Oxford University Press.
Brooke NM, Garcia-Fernandez J, Holland PW (1998): The ParaHox gene cluster is an evolutionary sister of the Hox gene cluster. Nature 392: 920-922.
Brown, R. E., Cogley, A. C. (1996): Contributions of the propatagium to avian flight. Journal of Experimental Zoology, 276, 112–124.
Brusatte, S. L. (2017): A Mesozoic aviary. Science, 355, 792–794.
Brusatte SL, Lloyd GT, Wang SC, Norell MA (2014): Gradual assembly of avian body plan culminated in rapid rates of evolution across the dinosaur-bird transition. Curr Biol 24 (20): 2386-92.
Brusatte, S. L., O’Connor, J. K., Jarvis, E. D. (2015): The origin and diversification of birds. Current Biology, 25, R888–R898.
Bundle, M.W. & Dial, K.P. (2003): Mechanics of wing-assisted incline running (WAIR). The Journal of Experimental Biology. 206 (Pt 24): 4553–64.
Burke AC, Nelson CE, Morgan BA, Tabin C (1995): Hox genes and the evolution of vertebrate axial morphology. Development 121: 333-346.
Carrano MT, Biewener AA (1999): Experimental alteration of limb posture in the chicken (Gallus gallus) and its bearing on the use of birds as analogs for dinosaur locomotion. Journal of Morphology 240: 237–249.
Cau, A., Brougham, T., Naish, D. (2015): The phylogenetic affinities of the bizarre Late Cretaceous Romanian theropod Balaur bondoc(Dinosauria, Maniraptora): Dromaeosaurid or flightless bird?. PeerJ. 3: e1032.
Chatterjee, S, Templin, RJ (2004): Feathered coelurosaurs from China: new light on the arboreal origin of avian flight. pp. 251-281. In Feathered Dragons: Studies on the Transition from Dinosaurs to Birds (P. J. Currie, E. B. Koppelhus, M. A. Shugar, and J. L. Wright (eds.). Indiana University Press, Bloomington.
Chatterjee, S, Templin, RJ (2007): Biplane wing planform and flight performance of the feathered dinosaur Microraptor gui. Proceedings of the National Academy of Sciences. 104 (5): 1576–80.
Chiappe LM (1997): Aves. Encyclopedia of Dinosaurs. Edited by: Currie PJ, Padian K. San Diego: Academic Press, 32-38.
Chiappe LM (2007): Glorified Dinosaurs: The Origin and Early Evolution of Birds. Sydney, Australia or Hoboken. NJ USA: University of New South Wales or John Wiley & Sons, Inc.
Chiappe LM, Witmer LM (2002): Mesozoic Birds: Above the Heads of Dinosaurs. Berkeley, Los Angeles, and London: University of California Press
Choi KS, Cohn MJ, Harfe BD (2008): Identification of nucleus pulposus precursor cells and notochordal remnants in the mouse: implications for disk degeneration and chordoma formation. Dev Dyn 237: 3953-3958.
Clarke, J. A., Zhou, Z., Zhang, F. (2006): Insight into the evolution of avian flight from a new clade of Early Cretaceous ornithurines from China and the morphology of Yixianornis grabaui. Journal of Anatomy. 208 (3): 287–308.
Cooke, J. (1998): A gene that resuscitates a theory: somitogenesis and a molecular oscillator. Trends Genet. 14, 85–88.
Cooke, J., Zeeman, E.C. (1976): A clock and wavefront model for control of the number of repeated structures during animal morphogenesis. J. Theor. Biol. 58, 455–476
Dale JK, Malapert P, Chal J, Vilhais-Neto G, Maroto M, Johnson T, Jayasinghe S, Trainor P, Herrmann B, Pourquie O (2006): Oscillations of the snail genes in the presomitic mesoderm coordinate segmental patterning and morphogenesis in vertebrate somitogenesis. Dev Cell 10: 355-366.
Dale JK, Maroto M, Dequeant ML, Malapert P, McGrew M, Pourquie O (2003): Periodic notch inhibition by lunatic fringe underlies the chick segmentation clock. Nature 421: 275-278.
Davidson LA, Keller RE (1999): Neural tube closure in Xenopus laevis involves medial migration, directed protrusive activity, cell intercalation and convergent extension. Development 126: 4547-4556.
De Beer G (1954): Archaeopteryx lithographica. British Museum of Natural History London Publ. 1-68.
Dececchi TA, Larsson HC (2013): Body and limb size dissociation at the origin of birds: uncoupling allometric constraints across a macroevolutionary transition. Evolution 67: 2741-2752.
del Corral DR, Storey KG (2004): g switch that controls differentiation and patterning onset in the extending vertebrate body axis. BioEssays 26: 857-869.
Dequeant ML, Glynn E, Gaudenz K, Wahl M, Chen J, Mushegian A, Pourquie O (2006): A complex oscillating network of signaling genes underlies the mouse segmentation clock. Science 314: 1595-1598.
Dial, K.P. (2003): Wing-Assisted Incline Running and the Evolution of Flight. Science. 299 (5605): 402–4.
Dial, K. P., Jackson, B. E. (2010): When hatchlings outperform adults: locomotor development in Australian brush turkeys (Alectura lathami, Galliformes). Proceedings of the Royal Society B: Biological Sciences. 278 (1712): 1610–1616.
Dressler GR, Gruss P (1989): Anterior boundaries of Hox gene expression in mesoderm-derived structures correlate with the linear gene order along the chromosome. Differentiation 41: 193-201.
Duboule D, Dolle P (1989): The structural and functional organization of the murine HOX gene family resembles that of Drosophila homeotic genes. EMBO J 8: 1497-1505.
Dubrulle J, McGrew MJ, Pourquie O (2001): FGF signaling controls somite boundary position and regulates segmentation clock control of spatiotemporal Hox gene activation. Cell 106: 219-232.
Economides KD, Zeltser L, Capecchi MR (2003): Hoxb13 mutations cause overgrowth of caudal spinal cordand tail vertebrae. Dev Biol 256: 317-330.
Forlani S (2003): Acquisition of Hox codes during gastrulation and axial elongation in the mouse embryo. Development 130: 3807-3819.
Fowler, Denver W., Freedman, Elizabeth A., Scannella, John B., Kambic, Robert E. (2011): The Predatory Ecology of Deinonychus and the Origin of Flapping in Birds. PLOS ONE. 6 (12): e28964.
Freitas C, Rodrigues S, Charrier JB, Teillet MA, Palmeirim I (2001): Evidence for medial/lateral specification and positional information within the presomitic mesoderm. Development 128: 5139-5147.
Gajovic S, Kostovic-Knezevic L (1995): Ventral ectodermal ridge and ventral ectodermal groove: two distinct morphological features in the developing rat embryo tail. Anat Embryol 192: 181-187.
Gao C, Chiappe LM, Meng Q, O’Connor JK, Wang X, Cheng X, Liu J (2008): A new basal lineage of early Cretaceous birds from China and its implications on the evolution of the avian tail. Palaeontology 51: 775-791.
Gatesy SM (1990): Caudofemoral musculature and the evolution of theropod locomotion. Paleobiology. 16: 170-186.
Gatesy SM (1991) Hind limb scaling in birds and other theropods: implications for terrestrial locomotion. Journal of Morphology 209: 83–96.
Gatesy SM (1995): Functional evolution of the hindlimb and tail from basal theropods to birds. In: Thomason JJ, editor. Functional morphology in vertebrate paleontology. New York: Cambridge University Press. pp. 219–234.
Gatesy SM (1999): Guineafowl hind limb function: II. Electromyographic analysis and motor pattern evolution. Journal of Morphology 240: 127–142.
Gatesy SM, Dial KP (1993): Tail muscle activity patterns in walking and flying pigeons (Columba livia). J Expl Biol 176: 55-76.
Gatesy SM, Dial KP (1996): From frond to fan: Archaeopteryx and the evolution of short-tailed birds. Evolution 50: 2037-2048.
Gatesy SM, Dial KP (1996a): Locomotor modules and the evolution of avian flight. Evolution 50: 331-340.
Gaunt SJ, Strachan L (1996): Temporal colinearity in expression of anterior Hox genes in developing chick embryos. Dev Dyn 207: 270-280.
Gauthier J (1986): Saurischian monophyly and the origin of birds. Memoirs of the California Academy of Sciences. 8: 1-55
Gilbert, S. (2006): Developmental Biology. 8th Edition. Sinauer Associations
Glen, C.L., Bennett, M.B. (2007): Foraging modes of Mesozoic birds and non-avian theropods. Current Biology. 17 (21): R911–2.
Godefroit, P., Demuynck, H., Dyke, G. et al. (2013a): Reduced plumage and flight ability of a new Jurassic paravian theropod from China. Nat Commun 4, 1394.
Godefroit, Pascal, Cau, Andrea, Hu, Dong-Yu, Escuillié, François, Wu, Wenhao, Dyke, Gareth (2013b): A Jurassic avialan dinosaur from China resolves the early phylogenetic history of birds. Nature 498 (7454): 359–362.
Gomez, C., Özbudak, E.M., Wunderlich, J., Baumann, D., Lewis, J., Pourquie´, O. (2008): Control of segment number in vertebrate embryos. Nature 454, 335–339.
Graham A, Papalopulu N, Krumlauf R (1989): The murine and Drosophila homeobox gene complexes have common features of organization and expression. Cell 57: 367-378.
Grossi B, Iriarte-Díaz J, Larach O, Canals M, Vásquez RA (2014): Walking Like Dinosaurs: Chickens with Artificial Tails Provide Clues about Non-Avian Theropod Locomotion. PLoS ONE 9(2): e88458.
Gruneberg H (1956): A ventral ectodermal ridge of the tail in mouse embryos. Nature 177: 787-788.
Handrigan GR (2003): Concordia discors: duality in the origin of the vertebrate tail. J Anat 202: 255-267.
Hartman, Scott, Mortimer, Mickey, Wahl, William R., Lomax, Dean R., Lippincott, Jessica, Lovelace, David M. (2019): A new paravian dinosaur from the Late Jurassic of North America supports a late acquisition of avian flight. PeerJ 7: e7247.
Hasson O (1991): Sexual displays as amplifiers: practical examples with an emphasis on feather decorations. Behav Ecol 2: 189-197.
He HY, Wang XL, Zhou ZH, Wang F, Boven A, Shi GH, Zhu RX (2004): Timing of the Jiufotang Formation (Jehol Group) in Liaoning, northeastern China, and its implications. Geophys Res Lett 31: L12605-
He T, Wang X-L, Zhou Z-H (2008): A new genus and species of caudipterid dinosaur from the Lower Cretaceous Jiufotang Formation of western Liaoning, China. Vertebrate PalAsiatica 46: 178-189.
Heers, AM (2016): New Perspectives on the Ontogeny and Evolution of Avian Locomotion, Integrative and Comparative Biology 56 (3): 428–441
Heers, A. M., Rankin, J. W., Hutchinson, J. R. (2018): Building a bird: musculoskeletal modeling and simulation of wing-assisted incline running during avian ontogeny. Frontiers in Bioengineering and Biotechnology, 6, 1–25.
Heffer A, Pick L (2013): Conservation and variation in Hox genes: how insect models pioneered the evo-devo field. Annu Rev Entomol 58: 161-179.
Hoffstetter, R., Gasc, J.-P. (1969): Vertebrae and ribs of modern reptiles. In Biology of the Reptilia, Vol. 1: Morphology, Part A (C. Gans, A.D. Bellairs, and T.S. Parsons, eds.). Academic Press, New York, NY, pp. 201–310.
Holtz, T. R. (2005): All in the family. NATURAL HISTORY, 114(4), 40-41.
Hopson, J. A. (2001): Ecomorphology of avian and nonavian theropod phalangeal proportions:Implications for the arboreal versus terrestrial origin of bird flight. From New Perspectives on the Origin and Early Evolution of Birds: Proceedings of the International Symposium in Honor of John H. Ostrom. J. Gauthier and L. F. Gall, eds. New Haven: Peabody Mus. Nat. Hist., Yale Univ. Peabody Museum of Natural History, Yale University.
Hu, D., Hou, L., Zhang, L., et al. (2009): A pre-Archaeopteryx troodontid theropod from China with long feathers on the metatarsus. Nature, 461, 640–643.
Huang R, Stolte D, Kurz H, Ehehalt F, Cann GM, Stockdale FE, Patel K, Christ B (2003): Ventral axial organs regulate expression of myotomal Fgf-8 that influences rib development. Dev Biol 255: 30-47.
Hutchinson JR (2006): The evolution of locomotion in archosaurs. Comptes Rendus Palevol 5: 519–530.
Hutchinson JR, Allen V (2009): The evolutionary continuum of limb function from early theropods to birds. Naturwissenschaften 96: 423–448.
Hutchinson JR, Gatesy SM (2000): Adductors, abductors, and the evolution of archosaur locomotion. Paleobiology 26: 734–751.
Iimura T, Pourquie O (2006): Collinear activation of Hoxb genes during gastrulation is linked to mesoderm cell ingression. Nature 442: 568-571.
Ikeya M, Takada S (2001): Wnt-3a is required for somite specification along the anteroposterior axis of the mouse embryo and for regulation of cdx-1 expression. Mech Dev 103: 27-33.
Ishikawa A, Kitajima S, Takahashi Y, Kokubo H, Kanno J, Inoue T, Saga Y (2004): Mouse Nkd1, a Wnt antagonist, exhibits oscillatory gene expression in the PSM under the control of Notch signaling. Mech Dev 121: 1443-1453.
Iulianella, A., Melton, K.R., Trainor, P.A. (2003): Somitogenesis: breaking new boundaries. Neuron 40, 11–14.
Izpisua-Belmonte JC, Falkenstein H, Dolle P, Renucci A, Duboule D (1991): Murine genes related to the Drosophila AbdB homeotic genes are sequentially expressed during development of the posterior part of the body. EMBO J 10: 2279-2289.
Jackson, B. E., Tobalske, B. W. and Dial, K. P. (2011): The broad range of contractile behaviour of the avian pectoralis: functional and evolutionary implications. The Journal of Experimental Biology. 214 (Pt 14): 2354–2361.
Junker, R. (2019): Sind Vögel Dinosaurier? Eine kritische Analyse fossiler Befunde. https://www.tinyurl.com/msw952vh (Kurzversion), https://www.tinyurl.com/4eutmru7 (Langfassung).
Junker, R., Widenmeyer, M. (Eds., 2021): Schöpfung ohne Schöpfer? Eine Verteidigung des Design-Arguments in der Biologie. Holzgerlingen: SCM-Verlag.
Jurberg AD, Aires R, Varela-Lasheras I, Novoa A, Mallo M (2013): Switching axial progenitors from producing trunk to tail tissues in vertebrate embryos. Dev Cell 25: 451-462.
Knezevic V, De Santo R, Schughart K, Huffstadt U, Chiang C, Mahon KA, Mackem S (1997): Hoxd-12 differentially affects preaxial and postaxial chondrogenic branches in the limb and regulates Sonic hedgehog in a positive feedback loop. Development 124: 4523-4536.
Krol AJ, Roellig D, Dequeant ML, Tassy O, Glynn E, Hattem G, Mushegian A, Oates AC, Pourquie O (2011): Evolutionary plasticity of segmentation clock networks. Development 138: 2783-2792.
Kulesa, P.M., Fraser, S.E. (2002): Cell dynamics during somite boundary formation revealed by time-lapse analysis. Science 298, 991–995.
Le Douarin NM (2001): Early neurogenesis in Amniote vertebrates. Int J Dev Biol 45: 373-378.
Lockley MG, Li R, Harris JD, Matsukawa M, Liu M. (2007): Earliest zygodactyl bird feet: evidence from early Cretaceous roadrunner-like tracks. Naturwissenschaften 94(8):657-65.
Longrich N.(2006): Structure and function of hindlimb feathers in Archaeopteryx lithographica. Paleobiology 32 (3): 417-431
Longrich, N. R., Vinther, J., Meng, Q., et al. (2012): Primitive wing feather arrangement in Archaeopteryx lithographica and Anchiornis huxleyi. Current Biology, 22, 2262–2267.
Mallo M, Alonso CR (2013): The regulation of Hox gene expression during animal development. Development 140: 3951-3963.
Mallo M, Vinagre T, Carapuco M (2009): The road to the vertebral formula. Int J Dev Biol 53: 1469-1481.
Mallo M, Wellik DM, Deschamps J (2010): Hox genes and regional patterning of the vertebrate body plan. Dev Biol 344: 7-15.
Maroto M, Bone RA, Dale JK (2012): Somitogenesis. Development 139: 2453-2456.
Maybury WJ, Rayner JM (2001): The avian tail reduces body parasite drag by controlling flow separation and vortex shedding. Proc Biol Sci/The Royal Society 268: 1405-1410.
Maybury WJ, Rayner JM, Couldrick LB (2001): Lift generation by the avian tail. Proc Biol Sci / The Royal Society 268: 1443-1448.
Maynard Smith, J. (1952): The importance of the nervous system in the evolution of animal flight. Evolution, 6, 127–129.
McGrew MJ, Sherman A, Lillico SG, Ellard FM, Radcliffe PA, Gilhooley HJ, Mitrophanous KA, Cambray N, Wilson V, Sang H (2008): Localised axial progenitor cell populations in the avian tail bud are not committed to a posterior Hox identity. Development 135: 2289-2299.
Morin-Kensicki, E.M., Melancon, E., Eisen, J.S. (2002): Segmental relationship between somites and vertebral column in zebrafish. Development 129, 3851–3860.
Musser, JM Wagner, GP Prum, RO (2015): Nuclear β-catenin localization supports homology of feathers, avian scutate scales, and alligator scales in early development: Feather and scale developmental homology. Evolution & Development. 17 (3): 185–194.
Neukamm, M., Bayer, A. (2023): Woher wissen wir, dass Vögel lebende Dinosaurier sind? Eine kritische Analyse kreationistischer Argumentation. https://www.ag-evolutionsbiologie.net/pdf/2023/evolution-warum-voegel-dinosaurier-sind.pdf
Niwa Y, Masamizu Y, Liu T, Nakayama R, Deng CX, Kageyama R (2007): The initiation and propagation of Hes7 oscillation are cooperatively regulated by Fgf and notch signaling in the somite segmentation clock. Dev Cell 13: 298-304.
Oates AC, Morelli LG, Ares S (2012): Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development 139: 625-639.
O’Connor, JK, Sullivan, C (2014): Reinterpretation of the Early Cretaceous maniraptoran (Dinosauria: Theropoda) Zhongornis haoae as a scansoriopterygid-like non-avian, and morphological resemblances between scansoriopterygids and basal oviraptorosaurs. Vertebrata PalAsiatica. 52 (1): 3–30.
Oginuma M, Niwa Y, Chapman DL, Saga Y (2008): Mesp2 and Tbx6 cooperatively create periodic patterns coupled with the clock machinery during mouse somitogenesis. Development 135: 2555-2562.
Padian K (1997): Avialae. Encyclopedia of Dinosaurs. Edited by: Currie PJ, Padian K. San Diego: Academic Press, 39-40.
Palmeirim I, Henrique D, Ish-Horowicz D, Pourquie O (1997): Avian hairy gene expression identifies a molecular clock linked to vertebrate segmentation and somitogenesis. Cell 91: 639-648.
Pan, Y., Zheng, W., Sawyer, R. H., et al. (2019): The molecular evolution of feathers with direct evidence from fossils. PNAS, 116, 3018–3023.
Persons S (2013): Oviraptorosaur tail forms and functions. Acta Palaeontol Pol.
Pittman, M., Bell, P.R., Miller, C.V. et al. (2022): Exceptional preservation and foot structure reveal ecological transitions and lifestyles of early theropod flyers. Nat Commun 13, 7684.
Prum, R. O. (1999): Development and evolutionary origin of feathers. Journal of Experimental Zoology, 285, 291–306.
Prum, R., Brush, A.H. (2002): The evolutionary origin and diversification of feathers. The Quarterly Review of Biology. 77 (3): 261–95.
Prum, R. O., Brush, A. H. (2003): Which came first, the feather or the bird? Scientific American, 288, 84–93.
Rashid, D.J., Chapman, S.C., Larsson, H.C. et al. (2014): From dinosaurs to birds: a tail of evolution. EvoDevo 5, 25.
Rida PCG, Le Minh N, Jiang Y-J (2004): A Notch feeling of somite segmentation and beyond. Dev Biol 265: 2-22.
Roy, A., Miller, C. V., Pittmann, M., et al. (2020): Three-dimensionally preserved ‘Stage IIIb’ fossil down feather supports developmental modularity in feather evolution. BioRxiv, preprint, 1–5
Sadava D., Hillis D. M., Heller H. C., Berenbaum M. R., Markl J. (Hrsg. 2017: Purves Biologie. 10. Aufl. Spektrum Akademischer Verlag, Heidelberg
Saga Y (2007): Segmental border is defined by the key transcription factor Mesp2, by means of the suppression of Notch activity. Dev Dyn 236: 1450-1455.
Saga Y (2012): The mechanism of somite formation in mice. Curr Opin Genet Dev 22: 331-338.
Saitta, E. T., Gelernter, R., Vinther, J. (2017): Additional information on the primitive contour and wing feathering of paravian dinosaurs. Palaeontology, 61, 273–288.
Sasaki N, Kiso M, Kitagawa M, Saga Y (2011): The repression of Notch signaling occurs via the destabilization of mastermind-like 1 by Mesp2 and is essential for somitogenesis. Development 138: 55-64.
Sato, Y., Yasuda, K., Takahashi, Y. (2002): Morphological boundary forms by a novel inductive event mediated by Lunatic fringe and Notch during somitic segmentation. Development 129, 3633–3644.
Sawada A, Shinya M, Jiang YJ, Kawakami A, Kuroiwa A, Takeda H (2001): Fgf/MAPK signalling is a crucial positional cue in somite boundary formation. Development 128: 4873-4880.
Schoenwolf GC, Chandler NB, Smith JL (1985): Analysis of the origins and early fates of neural crest cells in caudal regions of avian embryos. Dev Biol 110: 467-479.
Schröter, C., Oates, A.C. (2010): Segment number and axial identity in a segmentation clock period mutant. Curr. Biol. 20, 1254–1258.
Senter, P. (2006): Scapular orientation in theropods and basal birds, and the origin of flapping flight. Acta Palaeontologica Polonica. 51 (2): 305–313.
Sereno PC (1997): The origin and evolution of dinosaurs. Ann Rev Earth Planetary Sci. 25: 435-489.
Shahid, F., Zhao, J., Godefroit, P. (2019): Aerodynamics from Cursorial Running to Aerial Gliding for Avian Flight Evolution. Appl. Sci. 9, 649.
Shum AS, Poon LL, Tang WW, Koide T, Chan BW, Leung YC, Shiroishi T, Copp AJ (1999): Retinoic acid induces down-regulation of Wnt-3a, apoptosis and diversion of tail bud cells to a neural fate in the mouse embryo. Mech Dev 84: 17-30.
Takahashi J, Ohbayashi A, Oginuma M, Saito D, Mochizuki A, Saga Y, Takada S (2010): Analysis of Ripply1/2-deficient mouse embryos reveals a mechanism underlying the rostro-caudal patterning within a somite. Dev Biol 342: 134-145.
Tarsitano, S. F., Russell, A. P., Horne, F., Plummer, C., Millerchip, K. (2000): On the Evolution of Feathers from an Aerodynamic and Constructional View Point. American Zoologist. 40 (4): 676–686.
Tenin G, Wright D, Ferjentsik Z, Bone R, McGrew MJ, Maroto M (2010): The chick somitogenesis oscillator is arrested before all paraxial mesoderm is segmented into somites. BMC Dev Biol 10: 24-
Thomas ALR (1996): Why do birds have tails? The tail as a drag reducing flap, and trim control. J Theor Biol 183: 247-253.
Thomas ALR, Balmford A (1995): How natural selection shapes birds’ tails. Am Nat 146: 848-868.
Tobalske, B. W., Dial, K. P. (2007): Aerodynamics of wing-assisted incline running in birds. The Journal of Experimental Biology. 210 (Pt 10): 1742–1751.
Uno, Y., Hirasawa, T. (2023): Origin of the propatagium in non-avian dinosaurs. Zoological Lett 9, 4.
van den Akker E, Reijnen M, Korving J, Brouwer A, Meijlink F, Deschamps J (1999): Targeted inactivation of Hoxb8 affects survival of a spinal ganglion and causes aberrant limb reflexes. Mech Dev 89: 103-114.
van Rooijen C, Simmini S, Bialecka M, Neijts R, van de Ven C, Beck F, Deschamps J (2012): Evolutionarily conserved requirement of Cdx for post-occipital tissue emergence. Development 139: 2576-2583.
Voeten, Dennis F.A.E., et al. (2018): Wing bone geometry reveals active flight in Archaeopteryx. Nature Communications. 9 (923): 923.
Vonk, F.J., Richardson, M.K. (2008): Serpent clocks tick faster. Nature 454, 282–283.
Wang, X., Pittman, M., Zheng, X. et al. (2017): Basal paravian functional anatomy illuminated by high-detail body outline. Nat Commun 8, 14576.
Wellnhofer P (2009): Archaeopteryx: Icon of Evolution. Munich: Verlag Dr. Friedrich Pfeil
Wolpert, L., Jessell, T., Lawrence, P., Meyerowitz, E., Robertson, E., Smith, J. (2007): Principles of Development. Das Original mit Übersetzungshilfen. Third Edition. Spektrum-Verlag Berlin Heidelberg
Xu, X., You, H., Du, K. et al. (2011): An Archaeopteryx-like theropod from China and the origin of Avialae. Nature 475, 465–470.
Xu X, Zhang F. (2005): A new maniraptoran dinosaur from China with long feathers on the metatarsus. Naturwissenschaften 92 (4): 173-7.
Xu X, Zhou Z, Wang X, Kuang X, Zhang F, Du X. (2003): Four-winged dinosaurs from China. Nature 421 (6921): 335-40.
Xu X, Zheng X, You H (2010): Exceptional dinosaur fossils show ontogenetic development of early feathers. Nature 464: 1338-1341.
Young T, Rowland JE, van de Ven C, Bialecka M, Novoa A, Carapuco M, van Nes J, de Graaff W, Duluc I, Freund JN, Beck F, Mallo M, Deschamps J (2009): Cdx and Hox genes differentially regulate posterior axial growth in mammalian embryos. Dev Cell 17: 516-526.
Zhang F, Zhou Z. (2004): Palaeontology: leg feathers in an Early Cretaceous bird. Nature 431 (7011): 925.
Zhang, F., Zhou, Z., Xu, X. & Wang, X. (2002): A juvenile coelurosaurian theropod from China indicates arboreal habits. Naturwissenschaften. 89 (9): 394–8.
Zhang F, Zhou Z, Xu X, Wang X, Sullivan C (2008): A bizarre Jurassic maniraptoran from China with elongate ribbon-like feathers. Nature 455: 1105-1108.
Zhou Z, Zhang F (2002): A long-tailed, seed-eating bird from the Early Cretaceous of China. Nature 418: 405-409.
Zhou Z, Zhang F (2002a): Largest Bird from te Early Cretaceous and Its Implications for the Earliest Avian Ecological Diversification. Die Naturwissenschaften 89: 34-38.
Zhou Z, Zhang F (2003): Anatomy of the primitive bird Sapeornis chaoyangensis from the Early Cretaceous of Liaoning, China. Can J Earth Sci 40: 731-747.
Zhou Z, Zhang F (2003a): Jeholornis compared to Archaeopteryx, with a new understanding of the earliest avian evolution. Naturwissenschaften 90: 220-225.
Zhou Z, Zhang F (2007): Mesozoic birds of China-a synoptic review. Front Biol (Beijing) 2: 1-14.



