Vögel haben eine Reihe anatomischer Merkmale mit ihren Dinosauriervorfahren gemeinsam. Der reichhaltige Fossilbeleg, welchen wir kennengelernt haben, zeigt, dass die morphologischen Veränderungen sukzessiv in der Ahnenlinie der Vögel, ausgehend von Nicht-Vogel-Dinosauriern, auftraten. Erwartungsgemäß sind die Gruppen hierarchisch ineinander verschachtelt. Haben wir uns im letzten Beitrag die morphologischen Umwandlungen einiger Vogelmerkmale, wie des Schnabels und der Hand angeschaut, soll es in diesem Beitrag mit einer Reihe weiterer Merkmale weitergehen.
Text als pdf
Thermoregulation
Fliegen ist ein sehr energieraufwendiger Prozess, weshalb die Flugmuskulatur mit ausreichend Sauerstoff versorgt werden muss. Vögel zeichnen sich durch eine sehr hohe Stoffwechselleistung aus, gelten, genauso wie Säugetiere, als endotherm; sie können also ihre Körpertemperatur aufrechterhalten. Im Volksmund spricht man auch von gleichwarm oder Warmblütigkeit. Reptilien gelten allgemein als ektotherm, oder auch wechselwarm bzw. kaltblütig, sie können ihre Körpertemperatur nicht selbst regulieren (Vgl. Penzlin 2005, Kapitel 12, Müller 1998, Kapitel 10, Grigg et al. 2004; Abb. 1). Wie sieht es aber mit Dinosauriern aus? Die Frage nach der Temperaturregulation der Dinosaurier ist eine der ältesten und umstrittensten Fragen der Paläontologie.
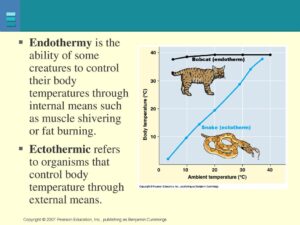
Abb. 1: endotherme Tiere, wie Säugetiere und Vögel, können ihre Temperatur unabhängig von der Außentemperatur konstant halten. Bei ektothermen Tieren wie Reptilien entspricht die Körpertemperatur der Umgebungstemperatur.
Generell herrscht das Vorurteil, dass das Klima während des Dinosaurierzeitalters im Vergleich zu heute warm war, weswegen einige, wie der berüchtigte Kritiker Alan Feduccia, der die Abstammung der Vögel von den Dinosauriern abstreitet, behaupten, dass Dinosaurier keine Notwendigkeit für Warmblütigkeit haben. Nach der Ansicht Feduccias waren Dinosaurier Kaltblüter. Zum einen seien Pythons und Alligatoren trotz ihrer wechselwarmen Physiologie zu bemerkenswertem Verhalten in der Lage, was dann auch für Dinosaurier gegolten habe. Zum anderen habe während des Mesozoikums durchgehend ein globales Treibhausklima geherrscht. Er behauptet dies mit bedauernswerter Regelmäßigkeit und beschreibt die Kreidezeit mehrfach als “eintönig heiß”. In der Tat waren lange Abschnitte des Mesozoikums sehr warm. Aber das galt nicht für das gesamte Mesozoikum: Dinosaurier und ihre Zeitgenossen lebten, als das Klima gemäßigt, kühl oder sogar kalt war (Cavalheiro et al. 2021; Abb. 2).
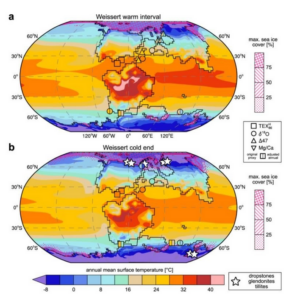
Abb. 2: Die globalen Temperaturkarten für das Valanginium in der frühen Kreidezeit von Cavalheiro et al. (2021) zeigen, dass in weiten Teilen Nordamerikas und Eurasiens wohl Temperaturen von weniger als 12°C herrschten. Aus dieser Epoche sind zahlreiche Dinosaurierfossilien überliefert, die aus kühlen bis kalten Gebieten stammen. Zu beachten ist auch das für die Polarregionen angezeigte Meereis. Sicher, es gab lange Wärmeperioden im Mesozoikum. Aber die Zeiten sind vorbei, als noch angenommen wurde, dass im gesamten Mesozoikum (oder sogar noch in der Kreidezeit) ein Treibhausklima geherrscht habe. Bild: Cavalheiro et al. (2021).
Die Ablagerungen der Unterkreide aus der Provinz Liaoning, berühmt für ihre zahlreichen gefiederten Nichtvogel-Maniraptoren und archaische Vögel, scheinen in kühlen, alpinen Lebensräumen entstanden zu sein. Hier macht ein Federkleid als Thermoregulation durchaus Sinn.
In der Kreidezeit herrschte zwar ein Treibhausklima, trotzdem war es in der Arktis auch damals wenig komfortabel: Die Temperaturen sanken im Winter unter den Gefrierpunkt und es blieb monatelang dunkel. Dennoch belegen Funde von tausenden Fußabdrücken und Fossilien in Alaska, dass sich dort vor rund 70 Millionen Jahren ganze Herden von pflanzenfressenden Dinosauriern tummelten. Bisher gingen Paläontologen aber davon aus, dass diese Dinos sich nur im Sommer dort aufhielten und im Winter nach Süden zogen, wo sie auch ihre Jungen bekamen. Diese Annahme widerlegen jetzt neue Fossilfunde aus dem Norden Alaskas. In den Ablagerungen entdeckten die Forscher zahlreiche winzige Zähne und Knochenstücke, die von frisch geschlüpften oder sogar noch ungeschlüpften Baby-Dinosauriern aus der Zeit vor rund 70 Millionen Jahren stammten. Unter den neugeborenen oder noch im Ei steckenden Dinosauriern waren Vertreter kleiner, vogelähnlicher Arten, aber auch Jungtiere der gewaltigen Tyrannosaurier, Entenschnabeldinosaurier und Horndinosaurier. Die Entdeckung der arktischen Dino-Kinderstube weckt Zweifel an der Theorie, nach der die Dinosaurier den Winter weiter im Süden verbrachten. Denn biochemische Analysen legen nahe, dass diese Dinosaurierarten ihre Eier drei bis sechs Monate lang ausbrüten mussten. Die arktischen Sommer hatten 24 Stunden lang Sonnenlicht und gute Bedingungen für einen heranwachsenden Dinosaurier – wenn er sich schnell genug entwickelte bis der Winter kam. Aber die Sommer in der Arktis waren auch damals schon kurz. Selbst wenn die Dinosaurier ihre Eier zeitig im arktischen Frühjahr gelegt hätten, wären die geschlüpften Jungtiere daher im Herbst wahrscheinlich noch nicht fit genug, um eine längere Wanderung zu absolvieren. Nach Ansicht der Wissenschaftler liegt es daher nahe, dass diese Dinosaurier-Arten auch im hohen Norden überwinterten (Druckenmiller et al. 2021, Abb. 3).
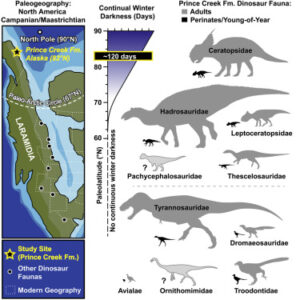
Abb. 3: Die unerwartete Entdeckung von Nicht-Vogel-Dinosauriern in der Arktis und Antarktis hat zu erheblichen Diskussionen darüber geführt, ob sie die Fähigkeit hatten, sich in hohen Breitengraden fortzupflanzen – insbesondere die größeren, hypothetisch wandernden Taxa. Beweise für die polare Fortpflanzung von Dinosauriern sind nach wie vor sehr selten, insbesondere für Arten, die in den höchsten Paläolatitudes (>75°) lebten. Die Abbildung zeigt die Entdeckung von perinatalen und sehr jungen Dinosauriern aus der höchsten bekannten Paläolatitude für die Gruppe – der Prince Creek Formation (PCF) aus der Kreidezeit im Norden Alaskas. Diese Daten belegen die arktische Fortpflanzung in einer vielfältigen Ansammlung von groß- und kleinkörperigen Ornithischia- und Theropodenarten. Was die Gesamtvielfalt betrifft, so sind 70 % der bekannten Dinosaurier-Familien sowie der Avialanen (Vögel) in der PCF durch perinatale Individuen vertreten, der höchste Prozentsatz für eine nordamerikanische Kreideformation. Diese Ergebnisse in Verbindung mit den langen Inkubationszeiten, der geringen Größe der Neugeborenen und den kurzen Fortpflanzungszeitfenstern deuten darauf hin, dass die meisten, wenn nicht sogar alle PCF-Dinosaurier ganzjährig in der Arktis lebten und nicht wanderten. Saisonale Ressourcenbeschränkungen aufgrund ausgedehnter Perioden winterlicher Dunkelheit und eisiger Temperaturen schränkten die Fortpflanzung, Entwicklung und Aufrechterhaltung der Dinosaurier stark ein, was darauf hindeutet, dass diese Taxa polarspezifische Lebensstrategien, einschließlich Endothermie, zeigten.
Tatsächlich legen Wachstumsringe von fossilen Knochen und Isotopenanalysen nahe, dass Raubdinosaurier, aber auch einige Langhalssaurier, schon eine relativ hohe, von ihrer Umgebung unabhängige Körpertemperatur besaßen. Körper und Blut von pflanzenfressenden Riesen wie dem Brachiosaurus könnten sogar 36 bis 38 Grad warm gewesen sein (Eagle et al. 2011, siehe auch Eagle et al. 2015, Legendre et al. 2016, Aminot et al. 2006, Bakker 1972; Abb. 4). Strittig war allerdings, ob diese hohen Körpertemperaturen schon auf eine aktive Thermoregulation zurückgingen, wie sie Säugetiere und Vögel besitzen.
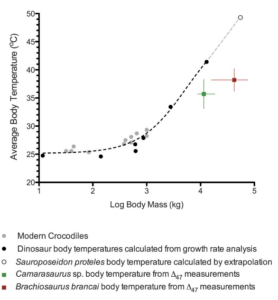
Abb. 4: Vergleich der gemessenen Körpertemperaturen von Dinosauriern mit einem zuvor veröffentlichten Modell, das eine Skalierung der Körpertemperaturen mit dem Körpergewicht vorsieht (nach Gillolly et al. 2006). Die Daten für Krokodile wurden von modernen Arten abgeleitet. Die Bestimmung der Körpertemperatur von Dinosauriern anhand der Modellierung erfolgte für die folgenden Taxa (in absteigender Reihenfolge der Masse in dieser Grafik): Sauroposeidon proteles, Apatosaurus excelsius, Tyrannosaurus rex, Daspletosaurus torosus, Gorgosaurus libratus, Albertosaurus sarcophagus, Massospondylus carinatus und Psittacosaurus mongoliensis. Die Körpertemperatur von S. proteles wurde von Gillooly et al. durch Extrapolation ihres Modells und nicht direkt aus den Wachstumsraten berechnet. Die Körpertemperaturen von Camarasaurus sp. und Brachiosaurus brancai (grünes bzw. rotes Quadrat) nach Eagle et al. (2011). Die Körpermassenschätzungen stammen aus der Zusammenstellung von Sander et al. (2011). Die Fehlerbalken auf der horizontalen Achse stellen den Bereich der in der Literatur angegebenen Schätzungen der Körpermasse dar. Bildquelle: Eagle et al. (2011).
Denn es wäre auch denkbar, dass allein schon die enorme Körpergröße und Masse der Dinosaurier für einen Heizeffekt gesorgt hat. Weil Riesen wie Tyrannosaurus oder Brachiosaurus ein großes Körpervolumen im Verhältnis zu ihrer Oberfläche haben, geht ihnen nur wenig Wärme nach außen verloren. Sie könnten ihre Körpertemperatur durch diesen als Gigantothermie bezeichneten Effekt daher auch ohne echte Warmblütigkeit gehalten haben (Paladino et al. 1990, Grady et al 2014, Abb. 5).
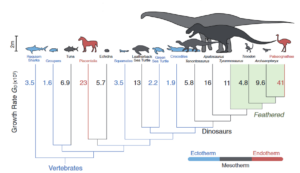
Abb. 5: ältere Studien stellten die Hypothese auf, dass Dinosaurier aufgrund ihrer Körpergröße hohe Temperaturen hatten, jedoch keine echten Warmblüter waren. Bildquelle: Grady et al. (2014).
Eine relativ neue Studie bringt hier aber Klarheit, um den Stoffwechsel der Dinosaurier zu rekonstruieren (Wiemann et al. 2022). Dafür wurden chemische Relikte von Molekülen analysiert, die bei der aktiven Fett- und Zuckerverbrennung in den Zellen anfallen (Grigg et al. 2004, Walter & Seebacher 2009, Pamplona 2011, Miyata et al. 2000, Vistoli et al. 2013, Abb. 6). Diese sogenannten Lipoxidations-Endprodukte sind ringförmige organische Moleküle mit Aminosäureresten, die wasserunlöslich sind und selbst die Fossilisation überdauern (Wiemann et al. 2018, 2020).
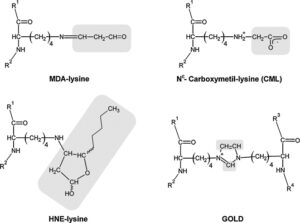
Abb. 6: Lipoxidationsendprodukte, die in Gewebeproteinen nachgewiesen wurden.
Für ihre Studie untersuchte das Team die Oberschenkelknochen von 55 verschiedenen fossilen und heute lebenden Tierarten auf den Gehalt an diesen Lipoxidations-Endprodukten hin. Unter den analysierten Tiergruppen waren Dinosaurier aus allen großen Gruppen des Dino-Stammbaums sowie Flugsaurier, aber auch moderne Vögel, Reptilien und Säugetiere. Die Analysen enthüllten Überraschendes, denn innerhalb der Dinosaurier gab es extreme Unterschiede in den Stoffwechselraten. Demnach waren viele Vogelbeckensaurier (Ornithischia) wie die Pflanzenfresser Stegosaurus und Triceratops noch wechselwarm. Ihre Stoffwechselraten lagen deutlich unter denen von Säugetieren oder Vögeln. Im Gegensatz dazu waren die zweibeinig laufenden Theropoden bereits echte Warmblüter. Ihre Stoffwechselraten lagen auf dem Niveau heutiger Säugetiere. Auch die Langhalssaurier (Sauropoden) besaßen schon eine aktive Thermoregulation. Brachiosaurus und Co waren demnach echte Warmblüter – und nicht nur gigantotherm, wie früher diskutiert. Die Stoffwechselrate des Raubdinosauriers Allosaurus sowie einiger Sauropoden wie Brontosaurus, Apatosaurus oder Diplodocus lag höher als bei Säugetieren und ähnlich hoch wie die heutiger Vögel. Eher lauwarm war hingegen Tyrannosaurus rex: Seine Stoffwechselrate war die niedrigste von allen untersuchten Echsenbeckensauriern. Eine weitere wichtige Erkenntnis ist, dass auch kleine und mittelgroße Dinosaurierarten die Fähigkeit zur aktiven Regulation der Körpertemperaturen hatten. Die Ergebnisse liefern auch neue Einblicke in die evolutionäre Entwicklung der tierischen Thermoregulation: Ergänzende Stammbaumrekonstruktionen enthüllten, dass die Endothermie im Tierreich mindestens viermal unabhängig entstanden sein muss: beim Vorfahren der Säugetiere, bei den Waranen, bei den wasserlebenden Plesiosauriern und beim gemeinsamen Vorfahren der Flugsaurier und Dinosaurier (Abb. 7).
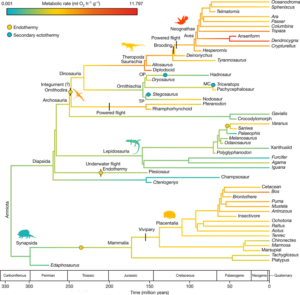
Abb. 7: Die Rekonstruktion des Vorfahrenstatus der Stoffwechselsignale basiert auf Spektraldaten von Wiemann et al. (2022). Die Farben der Äste und Knoten entsprechen den berechneten Stoffwechselraten. Orangefarbene Punkte kennzeichnen die evolutionären Ursprünge der Endothermie und blaue Punkte die Umkehrung zur Ektothermie. Die metabolische Endothermie entwickelte sich mindestens viermal unabhängig voneinander und kehrte in den drei Hauptzweigen der Ornithischia zur sekundären Ektothermie zurück. n = 55 moderne und fossile Amnioten. MC, Marginocephalia; OP, Ornithopoda; TP, Thyreophora.
Innerhalb der Dinosaurier ging die Warmblütigkeit dann bei einem Großteil der Vogelbeckendinosaurier wieder verloren – möglicherweise war es für wehrhafte, massige Dinos wie Triceratops vorteilhafter, wechselwarm und dafür sparsamer unterwegs zu sein. In allen anderen Dinosauriergruppen blieb die Warmblütigkeit jedoch erhalten. Das bedeutet: Die Warmblütigkeit und hohe Stoffwechselrate der Vögel entwickelte sich schon lange bevor sich die ersten Urvögel in die Luft erhoben – die Vögel haben ihre Warmblütigkeit von ihren Theropodenvorfahren geerbt.
Das Atmungssystem der Dinosaurier
Federn sind ein effektives System der Wärmeisolierung, aber warmblütige Lebewesen müssen nicht nur jederzeit ein Absinken der Körpertemperatur zu verhindern wissen, sie kämpfen auch mit der Gefahr einer möglichen Überhitzung. Gemeint ist nicht die Hitze von außen, sondern die selbst produzierte Körperwärme. Die mangelhafte Durchlässigkeit der Vogelhaut macht den Vögeln eine Kühlung ihres Organismus nach Art der Säugetiere unmöglich. Diese verhindern eine Überhitzung hauptsächlich, indem sie fortwährend Körperflüssigkeit über ihre Hautoberfläche, oft auch über Zunge und Mundschleimhaut verdunsten. Vögel können jedoch nicht schwitzen. Sie verfügen stattdessen über ein viel effizienteres System, weil sie die Kühlung nicht mit kostbarem Wasser, sondern ganz einfach mit Luft erreichen und das bei jedem Atemzug. Der Wirkungsgrad der Vogellunge ist übrigens doppelt so hoch wie das der Säugetiere. Die Säugerlunge, so leistungsfähig sie auch sein mag, stellt letzten Endes für den Luftstrom eine Sackgasse dar. Nur während der Einatmung kann die Lunge tatsächlich frischen Sauerstoff tanken, während beim Ausatmen die mit CO2 angereicherte Luft wieder entsorgt wird. Bei den Vögeln hingegen wird die eingeatmete Luft nicht einfach über die Luftröhre und Bronchien in die Lungenflügel hinein und aus demselben Weg wieder heraustransportiert, sondern sie strömt durch ein weitverzweigtes System von Luftsäcken. So wandert die Atemluft zunächst in die als Zwischenspeicher fungierenden hinteren Luftsäcke, dann erst in die Lunge, von dort in die vorderen Luftsäcke und schließlich über die Luftröhre wieder hinaus. Während aus der Lunge verbrauchte Luft in eine Richtung abfließt, wird sie von der anderen Seite her schon wieder mit Frischluft aufgefüllt (Penzlin 2005, Kapitel 6; Abb. 8). Durch dieses mehrkammerige fungierende System kann eine Vogellunge praktisch ohne Zwischenpausen den kostbaren Sauerstoff aufnehmen. Das Gesamtvolumen der verschiedenen Luftsäcke, die über den ganzen Körper verteilt sind und die großen Hohlräume in den Vogelknochen füllen, übertrifft das Volumen der eigentlichen Vogellunge. Über dieses weitverzweigte System wird nun, wie nebenbei, auch überschüssige Wärme abtransportiert.
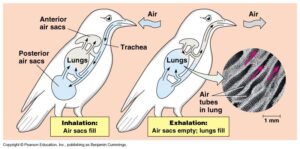
Abb. 8: Lungen-Luftsacksystem der Vögel
Wie atmeten Dinosaurier? Es gibt eine Reihe an Studien, die die Art und Weise der Atmung der Dinosaurier durchaus rekonstruieren können, denn durch die Untersuchung der Atmung der Vögel und Krokodile, können wir Einblicke in die Zusammenhänge zwischen Form und Funktion des Atmungssystems gewinnen, die wir dann auf die Fossilien übertragen können.
Die inneren Strukturen der Lungen von Vögeln und Krokodilen sind erstaunlich ähnlich: ein einziger primärer Bronchus mit mehreren sekundären Bronchien, die alle durch ein Netz kleinerer Röhren, die Parabronchi, miteinander verbunden sind. In diesen Parabronchien findet der meiste Gasaustausch statt. Das Muster des Luftstroms in den Lungen von Vögeln und Krokodilen ist ebenfalls sehr ähnlich. Messungen ergaben beim Ein- und Ausatmen stets den gleichen Luftstrom: Er war bauchseits in Richtung Schwanz und rückenseits immer zum Kopf hingerichtet. Computertomografischen Aufnahmen der Lungen zufolge scheinen Krokodile wie die Vögel über ein System klappenloser Ventile zu verfügen: Stark abknickende Verzweigungen führen den Luftstrom im Kreis durch die verschiedenen Lungenteile und wieder zur Luftröhre zurück – d. h. sowohl bei Krokodilen als auch bei Vögeln ist der Luftstrom unidirektional (Farmer 2015, Sanders & Farmer 2012, Abb. 9).
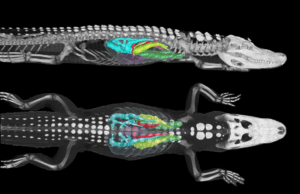
Abb. 9: Das Alligator-Atmungssystem | In den großen ventralen Bronchien (hier grün) strömt Atemgas dabei stets von Kopf- in Schwanzrichtung – egal, ob das Tier gerade ein- oder ausatmet. Genau entgegengesetzt verhält es sich in den dorsalen Bronchien (blau) – hier strömt die Luft nur kopfwärts. So genannte Parabronchien verbinden die beiden Hauptäste zu einem komplexen Gesamtsystem.
Angesichts der Tatsache, dass die nächsten lebenden Verwandten der Dinosaurier beide parabronchiale Lungen mit unidirektionalem Luftstrom haben, können wir ziemlich sicher sein, dass auch die Dinosaurier solche Lungen hatten. Danach werden die Dinge jedoch etwas komplizierter.
Die Hauptfunktion der Lunge ist der Gasaustausch: der Transport von Sauerstoff aus der Luft in die Blutbahn (und von CO2 aus der Blutbahn in die Luft). Während der Atmung dehnen sich die Lungen der meisten Tiere aus und ziehen sich zusammen, um frische Luft in die Lunge zu befördern und verbrauchte Luft auszustoßen. Dieser Vorgang wird als Ventilation bezeichnet.
Krokodile haben “nachgiebige” Lungen, die sich während der Atmung zur Belüftung ausdehnen und zusammenziehen – ähnlich wie bei Eidechsen, Schlangen, Schildkröten und Säugetieren, aber anders als bei Vögeln. Allerdings sind die oberen Teile der Krokodillunge, in denen der größte Teil des Gasaustauschgewebes stattfindet, weniger beweglich als die unteren Teile. Vögel sind unter den luftatmenden Wirbeltieren insofern einzigartig, als die Lungen im oberen Teil des Brustkorbs starr sind und sich weder ausdehnen noch zusammenziehen: Sie dienen ausschließlich dem Gasaustausch. Die Belüftung der Lungen erfolgt, wie erwähnt, über ein System von Luftsäcken (Claessens 2015, Farmer 2006, Carrier & Farmer 2000). Es stellt sich die Frage, ob auch Dinosaurier ein solches Lungen-Luftsacksystem hatten oder eher den Krokodilen ähnelten.
Im Lungen-Luftsacksystem der Vögel ist das Vorhandensein von Luftsäcken damit verbunden, dass das Skelett ausgehöhlt und mit Luft gefüllt (pneumatisiert) wird (Abb. 10). In den Knochen entstehen Taschen des Atmungssystems, die Divertikel genannt werden. Dies hinterlässt verräterische Spuren, die als pneumatische Foramina bezeichnet werden – Löcher im Knochen, die mit den luftgefüllten inneren Kammern verbunden sind. Diese pneumatischen Foramina wurden auch in den Knochen von Theropoden und Sauropoden gefunden, was ein starkes Indiz für das Vorhandensein von Luftsäcken in diesen Gruppen ist (Claessens 2015, Farmer 2006). Schon in den 1980ern hatte Robert Bakker (Bakker 1986) als einer der ersten dafür plädiert, dass Dinosaurier ein System von Luftsäcken hatten. Solche Hohlräume finden sich nicht nur bei den großen Gattungen, sondern auch bei den kleinen Raubsauriern (Sereno et al. 2008, Martill et al. 2000, O’Connor & Claessens 2005, Wedel 2009, Benson et al. 2012, Schachner et al. 2009, 2011, Codd et al. 2008, Currie & Chen 2001, Britt et al. 1998).
Außerdem werden bei lebenden Vögeln bestimmte Knochen in der Regel durch bestimmte Luftsäcke pneumatisiert. Das Muster der Pneumatizität des Skeletts gibt Aufschluss darüber, welche Luftsäcke Dinosaurier besaßen (Wedel 2009). Es stellt sich heraus, dass Sauropoden und Theropoden Luftsäcke sowohl vor als auch hinter der Lunge besaßen, die zur Erzeugung einer unidirektionalen Strömung genutzt werden konnten – wie bei Vögeln. Unter den Dinosauriern sind die Ornithischia die einzigen, die keine pneumatischen Skelette haben.
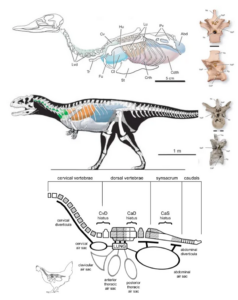
Abb. 10: Oben: Luftsäcke einer Ente und pneumatische Merkmale (einschließlich pneumatischer Foramina) von Entenwirbeln. Mitte: Rekonstruierte Luftsäcke des theropoden Dinosauriers Majungsaurus, basierend auf pneumatischen Merkmalen, die in den fossilen Knochen erhalten sind. Abkürzungen: Abd, Bauchluftsack; Cdth, kaudaler Brustluftsack; CeP, zentrales pneumatisches Foramen; Cl, Schlüsselbeinluftsack; Crth, kranialer Brustluftsack; Cv, zervikaler Luftsack; Fu, Furcula; Hu, Humerus; Lu, Lunge; Lvd, laterale Wirbeldivertikel; NaP, pneumatisches Foramen des Neuralbogens; Nc, Neuralkanal; Ns, Neuralwirbelsäule; Pp, Parapophyse. Pv, Becken; Tr, Luftröhre. Unten: pneumatischer Hiatus beim Huhn und Haplocanthosaurus. Aus O’Connor und Claessens (2005) und Wedel (2009).
Die Konzentration auf die Pneumatizität hat einige Kritiker auf den Plan gerufen. Skelettpneumatik und Luftsäcke sind nicht immer zusammen zu finden; so haben Pinguine feste Knochen, um den Auftrieb unter Wasser zu unterstützen, aber sie haben trotzdem ein Lungen-Luftsacksystem. Problematisch ist auch, dass die Lunge selbst auch Knochen pneumatisieren kann. Ein bestimmtes Merkmal ist jedoch ein untrügliches Zeichen für ein Lungen-Luftsacksystem bei Dinosauriern, nämlich ein pneumatischer Hiatus: eine Lücke in der Pneumatisierung der Wirbelsäule, die darauf hindeutet, dass die Divertikel an verschiedenen Stellen entstanden sind. Dies wurde bei einigen Dinosaurier-Exemplaren, wie dem Sauropoden Haplocanthosaurus, festgestellt und ist ein weiteres Indiz für eine vogelähnliches Lungen-Luftsacksystem (Wedel 2009, Abb. 10).
Sowohl Vögel als auch Krokodile haben zweiköpfige Rippen, die an zwei verschiedenen Stellen mit den Wirbeln verbunden sind – ein unteres Gelenk am Wirbelkörper und ein oberes Gelenk an den Querfortsätzen. Bei Vögeln sind diese beiden Gelenke vertikal ausgerichtet – eines liegt höher als das andere – und sind sehr gut voneinander getrennt. Bei den Krokodilen sind die ersten beiden rippentragenden Wirbel ähnlich wie bei den Vögeln, aber bei den nachfolgenden Wirbeln beginnt das untere der beiden Gelenke nach oben und nach außen zu wandern, weg von seiner Position am Wirbelkörper und hin zum oberen Gelenk am Ende des Querfortsatzes (Schachner et al. 2009, 2011, Abb. 11).
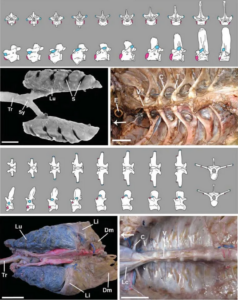
Abb. 11: Obere drei Tafeln, Strauß. Oben: Schematische Darstellung der Wirbelsäule von vorne und von der Seite, zwei Gelenke sind rosa und blau markiert. Links: Blick auf die Lunge (Lu), die Luftröhre (Tr) und die Sulci (S – Rillen, wo die Rippen in die Lunge einschneiden). Rechts: Innenansicht des Brustkorbs ohne innere Organe, mit Wirbeln (V) und Rippenköpfen (C, capitulum; T, tuberculum). Untere drei Tafeln, Alligator. Oben: Schematische Darstellung der Wirbel von oben, von der Seite und von vorne (nur die letzten beiden). Links, Blick auf Lunge (Lu), Luftröhre (Tr), Leber (Li) und Zwerchfellmuskel (Dm, Schnitt). Rechts, Innenansicht des Brustkorbs ohne innere Organe mit Wirbeln (V) und Rippenköpfen (C, Capitulum). Der Pfeil zeigt auf den Kopf. Abgeändert von Schachner et al. (2011).
Bei Archosauriern ist die Lunge physisch mit den Wirbeln und Rippenköpfen verbunden, so dass die Anatomie des Rippen-Wirbel-Gelenks die Struktur der Lunge direkt beeinflusst. Der vertikale Abstand zwischen den beiden Rippengelenken bei Vögeln in Verbindung mit den im Allgemeinen kurzen Querfortsätzen führt zu einer gerillten “Brustkorbdecke”, wo die Rippenköpfe tatsächlich in das Lungengewebe einschneiden. Dies trägt zur strukturellen Unterstützung der starren Vogellunge bei. Bei Krokodilen liegen die beiden Rippengelenke nach der Bewegung des unteren Gelenks auf einer flachen horizontalen Ebene. In Verbindung mit den langen Querfortsätzen entsteht so eine glatte Brustkorbdecke, die es der Lunge ermöglicht, sich bei der Beatmung auszudehnen und zusammenzuziehen (Schachner et al. 2009, 2011).
Die Dinosaurier weisen eine Vielzahl von Formen ihrer Rippenwirbelgelenke auf, aber alle ähneln eher denen der Vögel als denen der Krokodile. Die krokodilähnlichsten Wirbel finden sich bei den frühen Ornithischia, spätere Vertreter dieser Gruppe ähneln eher den Vögeln. Sowohl Sauropoden als auch Theropoden haben vogelähnliche Wirbel und Rippen. In Verbindung mit den Daten über die Pneumatizität dieser Gruppen deutet dies darauf hin, dass sie ein vogelähnliches Atmungssystem mit einer unbeweglichen, durch Luftsäcke belüfteten Lunge hatten (Schachner et al. 2009, 2011).
Einige Forscher bezweifeln jedoch eine vogelähnliche Funktion der Lunge und sehen Dinosaurier eher als ektotherm an, mit krokodilähnlichen Lungen und Ventilationssystem (Ruben et al. 1997, 1999). Auf welche Indizien stützen sie sich dabei?
Bei lebenden Krokodilen ist die Bewegung des Brustkorbs nicht die einzige Möglichkeit, die Lunge zu erweitern. Krokodile besitzen eine Bindegewebskapsel um die Leber, die eine Trennwand zwischen Brust- und Bauchhöhle bildet (Claessens 2015, Carrier & Farmer 2000, Farmer 2006). Die Form der Belüftung wird als Leberkolbenmechanismus bezeichnet. Dieses wird durch die Kontraktion des Zwerchfells angetrieben: ein langer, bandförmiger Muskel, der vom Becken bis zur Leber verläuft. Wenn sich der Zwerchfellmuskel zusammenzieht, werden die Leber und andere innere Organe nach hinten gezogen, wodurch sich das Volumen der Lungenhöhle vergrößert und der Atem eingezogen wird. Dies steht im Zusammenhang mit anderen Merkmalen der Krokodile, wie dem Fehlen von Rippen an der unteren Wirbelsäule – ähnlich wie bei den Säugetieren, die ebenfalls ein Zwerchfell besitzen (das sich unabhängig davon entwickelt hat) – und der glatten Brustkorbdecke, die es den Lungen ermöglicht, sich von hinten nach vorne auszudehnen und zusammenzuziehen (Abb. 12).
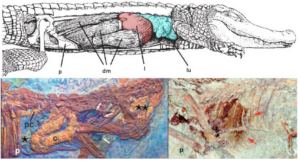
Abb. 12: Oben: Anatomie von Zwerchfell (dm), Leber (l), Lunge (lu) und Schambein (p) bei lebenden Krokodilen. Unten: Fossile Dinosaurier, die angeblich Reste der Leber (mit Pfeilen markiert), Weichteile (pc, hinterer Dickdarm, c, Dickdarm) und andere Anpassungen an einen krokodilischen “Leberkolben”-Belüftungsmechanismus (ein Sternchen markiert “Zwerchfellmuskeln”) bei Scipionyx (links) und Sinosauropteryx (rechts) aufweisen. Aus Ruben et al. (1997, 1999).
Die Vermutung, dass Theropoden auf diese Weise geatmet haben, beruht vor allem auf der Interpretation einiger außergewöhnlich gut erhaltener Exemplare. Sinosaruopteryx und Scipionyx zeigen mögliche Spuren der Leber, die die Körperhöhle vertikal in einen Thorax (mit Herz und Lunge) und ein Abdomen (mit den anderen inneren Organen) zu unterteilen scheint, ähnlich wie bei Krokodilen (Ruben et al. 1999). Bei Scipionyx sind auch Strukturen erhalten, die ursprünglich als Stränge der Zwerchfellmuskulatur interpretiert wurden (Abb. 12).
Doch was einige Forscher als klare Umrisse der Leber bei Sinosauropteryx bezeichneten, sahen andere als Ergebnis von Beschädigungen und anschließenden Reparaturen an einem Exemplar (Currie & Chen 2001). Die “Muskelspuren” von Scipionyx wurden ebenfalls als Merkmale des Gesteins umgedeutet, in dem das Fossil gefunden wurde, so dass es sich nicht um die Überreste eines Zwerchfells handelte. Außerdem fehlen den Dinosauriern andere krokodilartige Merkmale, die mit der Leber-Kolben-Atmung in Verbindung gebracht werden, wie z. B. eine rippenfreie untere Wirbelsäule. Die Vorstellung, dass die Dinosaurier ihre Lungen mit Hilfe einer krokodilähnlichen Zwerchfellanordnung belüfteten, wird daher von den meisten Forschern abgelehnt. Wie die Vögel belüfteten auch die Dinosaurier ihre Lungen mit ziemlicher Sicherheit durch die Bewegung der Rippen und des Brustbeins (Browne 1999, dal Sasso & Maganuco 2011)
Gastralia oder “Bauchrippen” sind Knochen, die sich in der Bauchwand moderner Krokodile und vieler fossiler Gruppen, einschließlich Theropoden und Sauropoden, bilden. Die Ornithischia sind wieder einmal die Sonderlinge, weil sie keine Gastralia haben. Bei den modernen Krokodilen versteifen die Bauchrippen die Bauchwand und tragen dazu bei, dass der Bauch nicht kollabiert, d. h., dass sich die inneren Organe und die Bauchwand beim Atmen nach innen bewegen, wodurch sich das verfügbare Volumen für die Lungen verringert (Claessens 2004, 2015, Farmer 2006, Carrier & Farmer 2000). Die Gastralia der Sauropoden und insbesondere der Theropoden unterscheiden sich von denen der modernen Krokodile dadurch, dass sie gelenkig sind und der Brustkorb durch die kombinierte Wirkung des Interkostalmuskels, der die Rippen bewegt, und des Beckenmuskels, der die Gastralia bewegt, geweitet oder verengt werden konnte. Die Bewegung der Gastralia hätte das Gesamtvolumen des Luftstroms und die Belüftung der hinteren Luftsäcke erhöht (Kürassieratmung). Bei frühen fossilen Vögeln wie dem Archaeopteryx sind die Gastralia noch vorhanden, aber bei fortgeschritteneren fossilen Vögeln sind sie verloren gegangen. Dies fällt mit der Ausdehnung des Brustbeins nach hinten zusammen, das bei modernen Vögeln die Gastralia als Ventilator der hinteren Luftsäcke ersetzt hat (Carrier & Farmer 2000; Abb. 13).
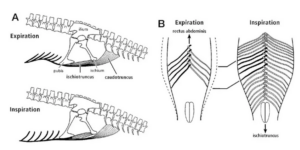
Abb. 13: Schematische Darstellung der Kürassieratmung bei Theropoden. Beim Ausatmen (Exspiration) zieht der Musculus rectus abdominis die Gastralia nach vorne, wodurch die Enden der Gastralia nach innen geschwenkt werden und die Bauchwand zusammengedrückt wird. Beim Einatmen zieht die Kontraktion der Beckenmuskeln (z. B. des Ischiotruncus) die Gastralia nach hinten, wodurch sie nach außen schwingen und die Körperhöhle erweitern. Die Diagramme zeigen auch die Beckenknochen (Darmbein, Sitzbein und Schambein) und andere Muskeln (z. B. Caudotruncus). Aus Carrier und Farmer, (2000).
Fast alle modernen Vögel haben an ihren Rippen nach hinten ragende Fortsätze, die so genannten Uncinate (Codd et al. 2008, Abb. 14). Diese fungieren als skelettale Hebel und machen die Atemmuskulatur effizienter. Die Länge dieser Fortsätze bei Vögeln hängt mit der Art der Fortbewegung – kurz bei Laufvögeln, mittelmäßig bei Flugvögeln und lang bei Tauchvögeln – und mit der Stoffwechselrate zusammen.
Uncinate sind auch von einigen Theropoden wie Velociraptor und Oviraptor sowie von fossilen Vögeln bekannt. Eine rätselhafte Eigenschaft der Dinosaurier-Uncinate ist, dass sie sehr lang sind und in ihrer Länge denen moderner Tauchvögel viel näherkommen als denen von Laufvögeln. Dies ist möglicherweise auf die Art und Weise zurückzuführen, wie die Fortsätze an den Rippen befestigt sind. Während sie bei Vögeln fest mit der knöchernen Rippe verschmolzen sind, waren sie bei den Dinosauriern möglicherweise durch Knorpel verbunden. Dies hätte die Effizienz der Kraftübertragung von den Atemmuskeln auf den Rest des Brustkorbs verringert, und um den gleichen Effekt zu erzielen, wäre ein längerer Hebel erforderlich gewesen.
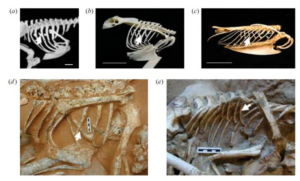
Abb. 14: Uncinate Fortsätze (durch Pfeile gekennzeichnet) bei (a) einem laufenden Kasuar, (b) einem fliegenden Uhu und (c) einem tauchenden Tordalk. (d) und (e) zeigen Uncinate in Fossilien; ein Oviraptor (d) und Velociraptor (e). Aus Codd et al. (2008).
Zusammenfassend lässt sich sagen, dass das Atmungssystem der Dinosaurier wahrscheinlich in der Lage war, ein ziemlich hohes Aktivitätsniveau und eine hohe Stoffwechselrate aufrechtzuerhalten, was mit den Beweisen aus Knochen und anderen Quellen übereinstimmt. Auch dies ist ein weiteres Indiz für die Warmblütigkeit der Dinosaurier.
Dinosaurierherzen
Eine effiziente Lunge zur Sauerstoffaufnahme reicht aber noch nicht aus, um den Sauerstoff im Körper zu transportieren. Das ist die Aufgabe des Herz- und Kreislaufsystems. Vögel und Säugetiere haben ein vierkammeriges Herz, bei dem der Kreislauf mit sauerstoffreichem und sauerstoffarmem Blut voneinander getrennt ist (Abb. 15). Unter den heutigen Reptilien haben nur Krokodile ein vierkammeriges Herz. Doch es gibt bei ihnen zwischen den vom Herzen ausgehenden Hauptschlagadern eine Verbindung, über die sich sauerstoffreiches und sauerstoffarmes Blut vermischen. Welches Herz hatten Dinosaurier?
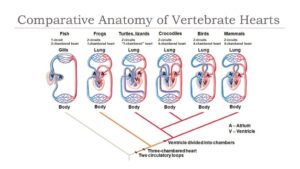
Abb. 15: Wirbeltierherzen
Computertomografische Aufnahmen (CT), die im Jahr 2000 von der Brusthöhle eines Exemplars des Ornithopoden Thescelosaurus durchgeführt wurden, ergaben die offensichtlichen Überreste eines komplexen Herzens mit vier Kammern, ähnlich wie bei den heutigen Säugetieren und Vögeln (Fisher et al. 2000; Abb. 16). Die Idee ist aber in der wissenschaftlichen Gemeinschaft umstritten und wird als schlechte anatomische Wissenschaft oder einfach als Wunschdenken kritisiert (Rowe et al. 2001).
Abb. 16: Möglicher Fund eines vierkammerigen Herzens beim Dinosaurier Thescelosaurus?
In einer 2011 veröffentlichten Studie wurden mehrere Untersuchungsmethoden auf die Frage nach der Identität des Objekts angewandt, darunter modernere CT-Scans, Histologie, Röntgenaufnahmen und Rasterelektronenmikroskopie. Mit diesen Methoden fanden die Autoren heraus, dass die innere Struktur des Objekts keine Kammern enthält, sondern aus drei unverbundenen Bereichen mit Material geringerer Dichte besteht und nicht mit der Struktur eines Vogelherzens vergleichbar ist; die “Wände” bestehen aus Sedimentmineralien, von denen nicht bekannt ist, dass sie in biologischen Systemen gebildet werden, wie Goethit, Feldspatmineralien, Quarz und Gips; Kohlenstoff, Stickstoff und Phosphor, chemische Elemente, die für das Leben wichtig sind, fehlten in ihren Proben; und herzförmige Zellstrukturen waren nicht vorhanden (Cleland et al. 2011).
Wir sollten hier zudem nicht vergessen, Ornithopoden gehören zu den Orinithischia, einer phylogenetisch anderen Gruppe als die Theropoden und wie wir bereits wissen, ist es sehr wahrscheinlich, dass beide Gruppen eine unterschiedliche Stoffwechselleitung haben. Zudem muss ein ähnlich gebautes Herz nicht repräsentativ für die Stoffwechselleitung sein, da Krokodile z. B. ein vogelähnliches Herz, aber eine niedrigere Stoffwechselrate haben. Die Tatsache, dass sowohl Vögel als auch Krokodile ein vierkammeriges Herz haben, spricht dafür, dass dies bei Dinosauriern auch so war. Die Gründe für eine mögliche Warmblütigkeit bei Dinosauriern können, wie vorhin erläutert, auch ohne die Kenntnis des Aufbaus des Herzens erschlossen werden.
Knochenhistologie
Spezifischere Forschungsbereiche haben ihre eigenen empirischen Beiträge geleistet, die das Erbe der Vögel aus der Zeit der Dinosaurier unterstützen. Studien über die Wachstumsraten von Dinosauriern, die sich auf Details im versteinerten Gewebe ihrer Knochen stützen, haben gezeigt, dass diese Tiere, von denen man einst annahm, dass sie langsam wachsen, tatsächlich mit einer Geschwindigkeit wuchsen, die mit der vieler lebender Vögel vergleichbar ist (Erickson et al. 2001).
Durch die Entdeckung einiger juveniler Tyrannosaurus rex-Exemplare konnten Wissenschaftler Rückschlüsse auf die Individualentwicklung (Ontogenese), Lebenserwartung und Wachstumsraten ziehen. Es wurden dazu auch knochenhistologische Studien gemacht. D. h. die Knochen wurden in dünne Scheiben geschnitten und unter einem Mikroskop untersucht. So konnten Wachstumskurven ermittelt werden, welche das Lebensalter eines Individuums zu seiner Größe in Bezug setzen. Die Wachstumskurve von T. rex ist „S“-förmig und zeigt, dass Jungtiere ein Gewicht von 1800 kg nicht überschritten. Ab dem 14. Lebensjahr setzte eine rasante Wachstumsphase ein und bis zum 18. Lebensjahr legte T. rex etwa 600-800 kg im Jahr zu. Mit 18 Jahren flacht sich die Kurve wieder ab, was ein dramatisches Verlangsamen des Wachstums innerhalb von kurzer Zeit anzeigt. Diese plötzliche Verlangsamung des Wachstums könnte auf das Erreichen der Geschlechtsreife hindeuten (Erickson et al. 2004, Brusatte et al. 2010, Abb. 17).
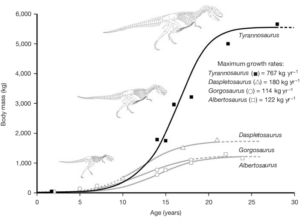
Abb. 17: Wachstumskurve von T. rex und verwandter Gattungen.
Das Gewebe fossiler Knochen lässt sich anhand von Hohlräumen und der Anordnung von Mineralien in den Knochen rekonstruieren, inklusive der Blutgefäße und Kollagenfasern. Untersuchungen an der Titanosaurier-Gattung Janenschia aus dem Jahr 2000 ergaben, dass die Tiere ihre Geschlechtsreife mit 11 Jahren und ihre maximale Größe mit 26 Jahren erreichten. Die Lebenserwartung dieser Gattung betrug demnach 38 Jahre (Sander 2000).
Man kann also anhand der Fossilien die Gewebestruktur der Knochen nachvollziehen. Doch wie sieht es mit dem Erhalt organischer Moleküle aus?
Während der Fossilisierung zerfallen die meisten biologischen Gewebe bald nach dem Tod. Nur in seltenen Fällen bleiben Weichteile wie Haut, Muskeln und innere Organe erhalten, was in der Regel mit einer Bedeckung durch Wasser und Sediment und dem Ausschluss von Sauerstoff einhergeht. Wenn auch diese Strukturen mineralisieren, bleibt er Umriss dieser Organe erhalten. Die organischen Anteile verschwinden dann aber in den meisten Fällen, da sie neben dem biologischen Abbau den hohen Drücken und Temperaturen nicht standhalten. Unter günstigen Umständen können aber organische Moleküle erhalten bleiben.
Zu den Molekülen, die überleben, gehören Lignin, Chitin und Melanin (Abb. 18). Lignin ist ein Strukturmolekül, aus dem das Holz von Bäumen besteht, und kann Hunderte von Millionen Jahren überleben. Das Gleiche gilt für Chitin, ein Kohlenhydrat, aus dem die zähe Kutikula von Gliederfüßern wie Insekten und Spinnen besteht. Melanin ist ein Pigment, das im Allgemeinen eine schwarze oder dunkelbraune Farbe verleiht und u. a. in Federn, Haut und Haaren vorkommt (Schweitzer & Marshall 2012).
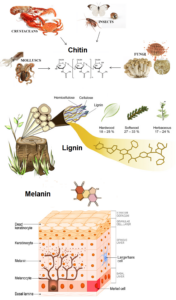
Abb. 18: Chitin, Lignin und Melanin
In letzter Zeit mehren sich aber auch berichte darüber, dass Proteine in Fossilien erhalten bleiben (Embery et al. 2003, San Antonio et al. 2011, Armitage & Anderson 2013), darunter auch Hämoglobin (Cleland & Schröter 2015, Schweitzer et a. 1997) und Kollagen. Im Jahr 2023 wurden Beta-Protein-Strukturen in den Federn des Dinosauriers Sinornithosaurus und des frühen Vogels Confuciusornis nachgewiesen (Slater et al. 2023) Dies bestätigt, dass die Federn der Urzeit eine ähnliche Zusammensetzung hatten wie die der modernen Vögel (Abb. 19).

Abb. 19: Entdeckung von Melanin in den Federn von Confuciusornis und Sinornithosaurus
Wie könnte ein Protein wie Kollagen (Abb. 20), das Hauptprotein im Knochen (Miller 1984, Nair et al. 2013, Wang et al. 2017), in Fossilien überdauern? Die Struktur des Kollagens ähnelt einem eng gewickelten, dreifädigen Seil, bei dem jeder Strang über Wechselwirkungen zwischen den einzelnen Aminosäuren mit den anderen verbunden ist. Wenn der Knochen zu verkalken beginnt, reihen sich die Kristalle des Knochenminerals Hydroxylapatit entlang der Länge der Fibrillen des sich bildenden Kollagens auf und umhüllen in einigen Fällen sogar vollständig das Proteinmolekül (Weiner et al. 1989; Glimcher et al. 1990; Salamon et al. 2005; Sykes et al. 2000). Da Kollagen eine hohe Affinität zum Apatitmineral hat, sorgt diese Wechselwirkung für eine weitere Resistenz gegen den Abbau. Schließlich ist Kollagen wenig wasserlöslich, und erst wenn der Abbau begonnen hat und es in kleine Fragmente zerlegt ist, kann es durch eindringendes Wasser abtransportiert werden. All diese Faktoren machen Kollagen zu einem langlebigen Protein, das über lange Zeiträume hinweg erhalten bleibt.
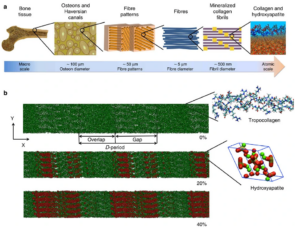
Abb. 20: (a) Hierarchische Struktur des Knochens vom makroskaligen Skelett bis zum nanoskaligen Kollagen (grün) und HAP (rot). (b) Modell der Kollagen-Mikrofibrillen mit 0 % Mineralisierung (Einschub zeigt die Kollagen-Dreifachhelix-Struktur), 20 % Mineralgehalt (Einschub zeigt eine HAP-Einheitszelle) und 40 % Mineralgehalt. Die HAP-Kristalle sind so angeordnet, dass die c-Achse des Kristalls mit der Fibrillenachse fluchtet. Die Ca-Atome sind in Grün, die OH-Gruppen in Rot und Weiß aufgetragen, und die Tetraederstruktur visualisiert die PO4-Gruppe.
Trocknung, Luftausschluss, niedrige Temperaturen, die Gegenwart von Mineralien oder der Einschluss in eine geeignete Hilfsstoffmatrix können die thermodynamische Stabilität von Proteinen deutlich erhöhen. Zudem kann die Adsorption bestimmter Ionen (durch Ausbildung stabilisierender Wasserstoff- und Salzbrücken) die Stabilität der Protein-Konformation erhöhen oder gar zur Proteinkristallisation führen (Schweitzer et al. 2014). Bereits eine zusätzliche hydrophobe Wechselwirkung oder mehrere polare Kontakte können die Halbwertszeit der Denaturierung um mehrere Größenordnungen erhöhen. Laboruntersuchungen, die den schnellen Abbau von Proteinen belegen, wurden meist in wässriger Lösung untersucht – das entspricht jedoch nur kaum Fossilisationsbedingungen.
Soweit die Theorie – und die Praxis? 2005 machten Forscher um Mary Schweitzer bekannt, dass in der Markhöhle eines 68 Millionen Jahre alten Beinknochens von T. rex weiches Gewebe entdeckt wurde. Die Forscher fanden flexible, sich gabelnde Blutgefäße und faseriges, aber elastisches Knochengewebe (Schweitzer et al. 2005a, Abb. 21).
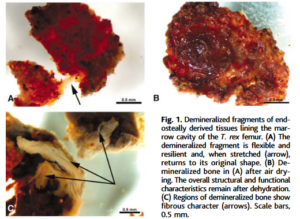
Abb. 21: Demineralisierte Fragmente von Geweben, die die Markhöhle des T. rex-Oberschenkelknochens auskleiden. (A) Das demineralisierte Fragment ist flexibel und elastisch und nimmt bei Dehnung (Pfeil) seine ursprüngliche Form wieder an. (B) Demineralisierter Knochen in (A) nach Lufttrocknung. Die allgemeinen strukturellen und funktionellen Merkmale bleiben nach der Dehydrierung erhalten. (C) Bereiche des demineralisierten Knochens weisen faserige Merkmale auf (Pfeile). Skalenbalken: 0,5 mm.
Die sieben Kollagenarten, die aus den Knochenfragmenten gewonnen wurden, deuten im Vergleich zu Kollagendaten von lebenden Vögeln (insbesondere einem Huhn) darauf hin, dass Theropoden und Vögel eng miteinander verwandt sind. Das weiche Gewebe ermöglichte einen molekularen Vergleich der zellulären Anatomie und der Proteinsequenzierung von Kollagengewebe, die 2007 veröffentlicht wurden und die beide darauf hindeuteten, dass T. rex und Vögel enger miteinander verwandt sind als beide mit dem Alligator (Schweitzer 2007a, b, Asara et al. 2007a, b, Asara & Schweitzer 2008a, b, Organ et al. 2008, Abb. 22) Eine zweite molekulare Studie untermauerte die Verwandtschaft der Vögel mit den Dinosauriern. In dieser Studie wurden acht zusätzliche Kollagensequenzen verwendet, die aus einem Oberschenkelknochen des „mumifizierten“ Brachylophosaurus, einem Hadrosaurier, extrahiert wurden (Schweitzer et al. 2009).
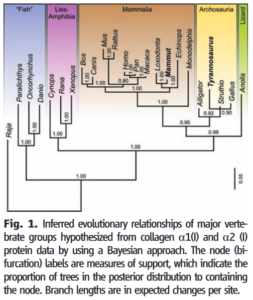
Abb. 22: Abgeleitete evolutionäre Beziehungen der wichtigsten Wirbeltiergruppen, die aus den Daten der Kollagenproteine a1(I) und a2 (I) mit Hilfe eines Bayes’schen Ansatzes abgeleitet wurden. Die Beschriftung der Knoten (Bifurkation) ist ein Maß für die Unterstützung, das den Anteil der Bäume in der Posterior-Verteilung, die den Knoten enthalten den Knoten enthalten.
Diese Ergebnisse waren jedoch umstritten, bei dem es ein Hin und Her zwischen Kritikern und Verteidigern der Proteinfunde in den Dinosaurierknochen gab. Im Jahr 2008 wurde behauptet, dass es sich bei dem vermuteten weichen Gewebe in Wirklichkeit um einen bakteriellen Mikrofilm handelte (Kaye et al. 2008). Dem wurde entgegengehalten, dass genau diese Mikrofilme das weiche Gewebe schützten (Peterson et al. 2010). Ein weiterer Einwand war, dass die Ergebnisse durch Kontamination verursacht worden sein könnten (Bern et al. 2009).
Um dem Vorwurf der Kontamination zu begegnen, wiederholte Schweitzer ihre Analyse der Hadrosaurierknochen von 2009 an einem anderen unberührten Knochenexemplar (wobei ein Meter Sediment um das Fossil belassen wurde) unter sorgfältiger Ausschaltung möglicher Verunreinigungsmechanismen und fand acht Proteinfragmente, davon zwei, die schon in der Analyse zuvor gefunden worden waren (Schroeter et al. 2017).
Im Jahr 2015 wurden die Peptide unter kontrollierten Bedingungen, die eine Kontamination verhinderten, immer noch identifiziert (Cleeland et al. 2015). In einer 2017 veröffentlichten Arbeit zeigten Michael Buckley und Kollegen aus Manchester jedoch, dass das T. rex-Kollagen hauptsächlich aus Laborverunreinigungen, Bodenbakterien und vogelähnlichem Hämoglobin und Kollagen bestand (Buckley et al. 2017). Insbesondere stellten sie fest, dass die vermeintlichen Dinosaurierproteine mit modernen Straußensequenzen übereinstimmten – ein Fehler, der leicht passieren kann, wenn solche modernen Proben im selben Labor waren, das an den fossilen Materialien gearbeitet hat. Dann kam etwas Klarheit. In einer Arbeit aus dem Jahr 2018 führte Jasmina Wiemann, Doktorandin in Yale, eine Gruppe an, die sich erneut die Blutgefäße und andere bräunliche Materialreste ansah, die übrig geblieben waren, nachdem die fossilen Knochen bearbeitet worden waren, um alle mineralischen Bestandteile zu entfernen (Wiemann et al. 2018). Sie wandte ausgefeilte Tests an und stellte fest, dass die Gefäße und Gewebe zwar echt waren, aber nicht aus den ursprünglichen Proteinen bestanden, außer vielleicht aus Kollagen. Die anderen waren zu alternativen Formen zerfallen, die als N-heterozyklische Polymere bezeichnet wurden (Abb. 23) – Mary Schweitzer hatte also tatsächlich Recht, dass sie Blutgefäße, Hautzellen und Teile von Nervenenden gefunden hatte, aber die meisten Proteine waren während der Fossilisation erheblich umgewandelt worden. Die Ausnahme könnte das Kollagen sein, wobei allerdings darauf geachtet werden muss, dass es original und nicht verunreinigt ist.
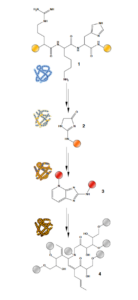
Abb. 23: Schematische Darstellung der vorgeschlagenen Umwandlungen von Proteinen während der Fossilisierung in Hartgeweben. 1 Unverändertes Tripeptid mit Arginin-, Lysin- und Histidinresten. Peptide bilden Proteine in frischem Gewebe. 2 Imidazolon ist ein frühes, nicht vernetzendes Produkt von Glykoxidations-/Lipoxidationsreaktionen und kann in veränderten Proteinen von experimentell gereiften und fossilen Proben gefunden werden. 3 Eine Pentosidin-Vernetzung, die häufig in fortgeschrittenen Glykoxidations-/Lipoxidationsendprodukten auf der Basis ursprünglicher proteinhaltiger Materie sowie in experimentell gereiften und fossilen Proben gefunden wird. 4 Ein hoch oxidiertes, polymeres Abbauprodukt, das einem Melanoidin ähnelt. Die Struktur kann variieren. Die farbigen Kugeln stellen einen proteinhaltigen Kontext (gelb), einen oxidativ veränderten proteinhaltigen Kontext (orange), ein nicht-proteinhaltiges N-reiches heterozyklisches Polymer als Produkt der Proteintransformation (rot) und ein nicht-proteinhaltiges, peroxidiertes, polymeres Gerüst (grau) dar. Die Proteinsymbole neben den Strukturen veranschaulichen den entsprechenden Grad der Gewebeverfärbung, der durch die Anreicherung mit der jeweiligen Verbindung verursacht wird.
Mehrere Möglichkeiten können eine Kontamination reduzieren: Proteine, die für Wirbeltiere spezifisch sind, können sowohl anhand von Sequenzdaten als auch durch Antikörperreaktivität von mikrobiellen oder anderen potenziellen Verunreinigungen unterschieden werden. Die Anwendung mehrerer Analysetechniken kann auch eine Kontamination als Signalquelle ausschließen. So können beispielsweise Antikörper gegen ein bestimmtes Protein, wie Kollagen, auf alte Proben aufgetragen werden, um auf Kreuzreaktivität zu testen. Bei positivem Befund können Extrakte desselben fossilen Materials zur Herstellung von Antikörpern wie oben beschrieben verwendet werden. Diese Antikörper können dann gegen eine Reihe gereinigter Proteine von lebenden Tieren getestet werden. Tritt eine Kreuzreaktivität auf, ist dies ein Hinweis auf das Ausgangsprotein in den fossilen Geweben, gegen das die Antikörper gebildet wurden. Wenn diese Experimente mit analytischen Tests an den Knochenextrakten, wie z. B. Massenspektroskopie, gekoppelt werden, wird das Vorhandensein von Proteinfragmenten oder aus Proteinen gewonnenen Verbindungen unabhängig bestätigt (Schweitzer & Marshall 2012).
Dinosaurier, zumindest die Theropoden, waren also endotherme befiederte Organismen mit hohlen Knochen, einem effizienten Herz-Kreislaufsystem, effizienten vogelähnlichen Lungen und hatten ein schnelles Wachstum. Damit liefern theropode Dinosaurier wichtige Voraussetzungen für die wohl bemerkenswerteste Eigenschaft der Vögel: die Fähigkeit zu fliegen.
Eier und Nistverhalten
Übrigens haben auch die Eier der Maniraptora Gemeinsamkeiten mit jenen der Vögel (Mikhailov 1992, Zelenitsky 2006, Varricchio & Jackson 2004, Varricchio et al. 2018, Grellet-Tinner et al. 2006, Chiappe 2009). Einige dieser Merkmale sind das Vorhandensein von mehr als einer ausgeprägten kristallinen Schicht in der Eierschale, die Verringerung der Anzahl von Luftlöchern in der Eierschale, eine relative Zunahme des Volumens des Eies (in Bezug auf die Größe des erwachsenen Tieres) und die Entwicklung von asymmetrischen Eiern, bei denen ein Pol schmaler ist als der andere (Abb. 24). Momentaufnahmen alter Verhaltensweisen, die von einer Handvoll außergewöhnlicher Fossilien enthüllt wurden, haben auch die Hypothese gestützt, dass sich Vögel aus Dinosauriern der Gruppe der Maniraptoren entwickelt haben. Die Entdeckung eines trächtigen Oviraptoriden-Weibchens, das ein Paar Eier mit Schale in seinem Beckenkanal trug (Sato et al. 2005, Abb. 25), hat frühere Interpretationen bestätigt, die auf der räumlichen Anordnung der Eier in den Gelegen der Maniraptoren basierten. Diese Gelege – besonders gut bekannt bei den Oviraptoriden – zeigen, dass die Eier paarweise angeordnet waren, im Gegensatz zu den typischen Gelegen der Reptilien (Schildkröten, Krokodile und andere Dinosaurier), bei denen die Eier keinerlei räumliche Anordnung aufweisen (Grellet-Tinner et al. 2006, Abb. 24). Dies deutet darauf hin, dass die Nicht-Vogel-Maniraptoren wie die Vögel ihre Eier nacheinander und in diskreten Zeitabständen ablegten. Wahrscheinlich brauchte ein Nicht-Vogel-Maniraptoren-Weibchen mehrere Tage, um sein Gelege zu legen (Varricchio & Jackson 2004; Grellet-Tinner et al. 2006), eine Bedingung, die es mit Vögeln teilt.
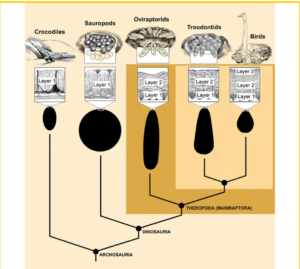
Abb. 24: Merkmale der Eier und Gelege mehrerer nichtavischer Maniraptoriden sprechen für die Zugehörigkeit der Vögel zu diesen theropoden Dinosauriern. So lassen sich beispielsweise das Vorhandensein von mindestens zwei unterschiedlichen kristallinen Schichten in der Eierschale und die Existenz eines asymmetrischen Eies (weniger asymmetrisch bei den Oviraptoriden) bis zur Divergenz der Maniraptoriden zurückverfolgen. Die Verteilung der Eier innerhalb eines Geleges bei den Oviraptoriden deutet darauf hin, dass diese Dinosaurier ihre Eier nacheinander legten (andere Hinweise deuten darauf hin, dass sie, wie bei den Vögeln, ihr Gelege auch ausbrüteten). Bildquelle: Chiappe (2009).
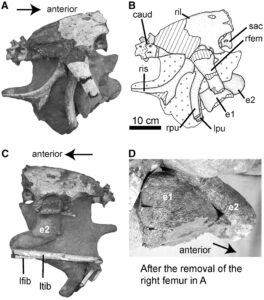
Abb. 25: Das Oviraptorosaurier-Exemplar im National Museum of Natural Science in Taiwan (Exemplarnummer NMNS-VPDINO-2002-0901) wurde aus der oberkreidezeitlichen Nanxiong-Formation des Hongcheng-Beckens in der Nähe der Stadt Ganzhou in der südlichen Provinz Jiangxi, China, ausgegraben. Es besteht aus sechs Sakralwirbeln, den ersten beiden Schwanzwirbeln, den Darmbeinen, Schamhügeln, Sitzbeinen und Oberschenkeln, dem unteren Teil des linken Beins und einem Paar Eier im Becken. Die Schambeine und Sitzbeinhöcker sind leicht disartikuliert, aber ansonsten behalten diese Knochen ihre ursprünglichen anatomischen Beziehungen bei. Die Eier befinden sich dorsal der Schambeinfuge, etwa eine Eilänge vor der Kloakenregion. Sie liegen nebeneinander und eng beieinander, wobei das rechte Ei etwas weiter ventral positioniert war als das linke. (A und B) Rechte Seitenansicht. (C) Linke seitliche Ansicht. (D) Eine Nahaufnahme der beiden Eier von rechts. Caud, Schwanzwirbel; e, Ei; lfib, linkes Wadenbein; lpu, linkes Schambein; ltib, linkes Schienbein; rfem, rechter Oberschenkelknochen; ril, rechtes Darmbein; ris, rechtes Sitzbein; rpu, rechtes Schambein; sac, Kreuzbein. Bildquelle: Sato et al. (2005).
Andere außergewöhnliche Entdeckungen haben Licht auf das Nistverhalten dieser Dinosaurier geworfen. Skelette von Oviraptoriden (Norell et al. 1995, Clark et al. 1999) und Troodontiden (Varricchio & Jackson 2004) wurden über ihren Gelegen entdeckt. Die Fossilien zeigen, dass diese Tiere eine Haltung einnahmen, die der von brütenden Vögeln ähnelt. Bei den Oviraptoriden steckte das erwachsene Tier seine Beine in einen offenen Raum in der Mitte des Geleges und umarmte den Rand des Geleges mit seinen langen Vorderbeinen; bei den leichter gebauten Troodontiden saß das erwachsene Tier oben auf den vertikal vergrabenen Eiern. Diese Entdeckungen deuten darauf hin, dass unabhängig von der spezifischen Rolle (Schutz, Ausbrüten) typische Nistverhaltensweisen von Vögeln (Erwachsene sitzen oben auf ihren Nestern) bei Nicht-Vogel-Maniraptoren weit verbreitet waren (Abb. 26).
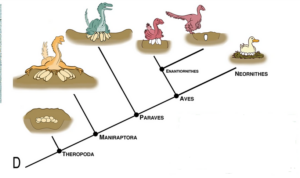
Abb. 26: Phylogenie, die die vermuteten Brutmethoden der Theropoden-Dinosaurier zeigt, wobei das Vergraben der Gelege bei den Theropoden und wahrscheinlich bei den meisten Dinosauriern die primitivste Form ist; das Ausbrüten abgeleiteter und teilweise freiliegender Gelege bei den Maniraptoren-Dinosauriern wie den Oviraptorosauriern und den Troodontiden und vielleicht bei einigen Enantiornithes des Mesozoikums, und schließlich das Ausbrüten der Eier ohne Vergraben im Sediment bei den Neornithes.
Weitere Beweise belegen die Ähnlichkeit des Verhaltens mit dem der Vögel. Fossilien von Troodontiden, wie Mei long, deren Skelett so angeordnet ist, dass die Hinterbeine unter dem Bauch gebeugt sind, der Hals nach hinten gedreht ist und der Kopf zwischen Flügel und Körper eingeklemmt ist, belegen, dass zumindest einige der Vorläufer der Vögel bereits stereotype Ruhepositionen entwickelt hatten, die vielen Vögeln vertraut sind (Xu & Norell 2004, Abb. 27).

Abb. 27: Schlafposition von Mei long.
Bei der Eiablage wächst den weiblichen Vögeln eine besondere Art von Knochen in ihren Gliedmaßen. Dieser Markknochen bildet eine kalziumreiche Schicht innerhalb des harten äußeren Knochens und wird als Kalziumquelle für die Bildung der Eierschalen verwendet. Das Vorhandensein von Knochengewebe, das aus dem Knochenmark stammt und die inneren Markhöhlen von Teilen der Hintergliedmaße eines Tyrannosaurus rex auskleidet, deutet darauf hin, dass T. rex ähnliche Fortpflanzungsstrategien anwandte (Schweitzer et al. 2005b). Weitere Forschungen haben Markknochen beim Theropoden Allosaurus und beim Ornithopoden Tenontosaurus gefunden. Da sich die Dinosaurierlinie, zu der Allosaurus und Tyrannosaurus gehören, schon sehr früh in der Evolution der Dinosaurier von der Linie, die zu Tenontosaurus führte, trennte, deutet dies darauf hin, dass Dinosaurier im Allgemeinen Markgewebe produzierten (Lee & Werning 2008).
Literatur
Amiot, R. et al. (2006): Oxygen isotopes from biogenic apatites suggest widespread endothermy in Cretaceous dinosaurs. Earth Planet. Sci. Lett. 246, 41–54.
Armitage, M. H., Anderson, K. L. (2013): Soft sheets of fibrillar bone from a fossil of the supraorbital horn of the dinosaur Triceratops horridus. Acta Histochemica. 115 (6): 603–8.
Asara, J. M., Schweitzer, M. H. (2008a): Response to comment on Protein sequences from mastodon and Tyrannosaurus rex revealed by mass spectrometry.” Science 319: 33d.
Asara, J. M., Schweitzer, M. H., Cantley, L. C., Cottrell, S. J. (2008b): Response to comment on Protein sequences from mastodon and Tyrannosaurus rex revealed by mass spectrometry.”Science 321: 1040c.
Asara, JM, Schweitzer MH, Freimark LM, Phillips M, Cantley LC (2007a): Protein Sequences from Mastodon and Tyrannosaurus Rex Revealed by Mass Spectrometry. Science. 316 (5822): 280–5.
Asara, J. M., J. S. Garavelli, D. A. Slatter, M. H. Schweitzer, L. M. Freimark, M. Phillips, and L. C. Cantley. (2007b): Interpreting sequences from mastodon and Tyrannosaurus rex. Science 317: 1324–1325.
Bakker, R. T. (1972): Anatomical and ecological evidence of endothermy in dinosaurs. Nature 238, 81–85.
Bakker, R. T. (1986): The dinosaur heresies. Morrow, Zebra, Penguin, Longman, Scientific & Technical & Kensington, New York, London, Harlow 1986-93.
Benson, R. B. J., Butler, R. J., Carrano, M. T., O’Connor, P. M. (2012): Air-filled postcranial bones in theropod dinosaurs: physiological implications and the ‘reptile’–bird transition. Biological Reviews 87, 168–193.
Bern, M, Phinney, BS, Goldberg, D (2009): Reanalysis of Tyrannosaurus rex mass spectra. Journal of Proteome Research. 8 (9): 4328–4332.
Britt, B. B. et al. (1998): Postcranial pneumatization in Archaeopteryx. In: Nature. 395, 374–376.
Browne, M. W. (1999): Spectacular fossil reveals dinosaur soft part anatomy and supports cold-blooded dinos not related to birds, New York Times
Brusatte, S., Norell, M., Carr, T., Erickson, G., Hutchinson, J., Balanoff, A., Bever, G., Choiniere, J., Makovicky, P., Xu, X. (2010): Tyrannosaur Paleobiology: New Research on Ancient Exemplar Organisms. Science 329, 1481-5.
Buckley, M., Warwood, S., van Dongen, B., Kitchener, A. C., Manning, P. L. (2017): A fossil protein chimera, difficulties in discriminating dinosaur peptide sequences from modern cross-contamination. Proceedings of the Royal Society B. 284 (1855): 20170544.
Carrier, D. R., Farmer, C. G. (2000): The evolution of pelvic aspiration in archosaurs. Paleobiology 26, 271–293.
Cavalheiro, L., Wagner, T., Steinig, S. et al. (2021): Impact of global cooling on Early Cretaceous high pCO2 world during the Weissert Event. Nature Communications 12: 5411.
Chiappe, L.M. (2009): Downsized Dinosaurs: The Evolutionary Transition to Modern Birds. Evo Edu Outreach 2, 248–256.
Claessens, L. P. A. M. (2004): Dinosaur gastralia: origin, morphology, and function. In: Journal of Vertebrate Paleontology. 24(1), 89–106.
Claessens, L. P. A. M. (2015): Anatomical transformations and respiratory innovations of the archosaur trunk. In: Great Transformations in Vertebrate Evolution (eds Dial, K. P., Shubin, N. & Brainerd, E. L.) 91–106 (University of Chicago Press).
Clark JM, Norell MA, Chiappe LM. (1999): An oviraptorid skeleton from the Late Cretaceous of Ukhaa Tolgod, Mongolia, preserved in an avian-like brooding position over an oviraptorid nest. Am Mus Novit. 3265: 1–36.
Cleland, T. P., Schroeter, E. R. (2015): Mass Spectrometry and Antibody-Based Characterization of Blood Vessels from Brachylophosaurus Canadensis. Journal of Proteome Research. 14 (12): 5252–5262.
Cleland, T. P., Stoskopf, M. K., Schweitzer, M. H. (2011): Histological, chemical, and morphological reexamination of the heart of a small Late Cretaceous Thescelosaurus. Naturwissenschaften. 98 (3): 203–211.
Codd, J. R., Manning, P. L., Norell, M. A., Perry, S. F. (2008): Avian-like breathing mechanics in maniraptoran dinosaurs. Proceedings of the Royal Society of London B: Biological Sciences 275, 157–161.
Currie, P. J., Chen, P. (2001): Anatomy of Sinosauropteryx prima from Liaoning, northeastern China. Canadian Journal of Earth Sciences 38, 1705–1727.
dal Sasso, C. & Maganuco, S. (2011): Scipionyx samniticus (Theropoda: Compsognathidae) from the Lower Cretaceous of Italy — Osteology, ontogenetic assessment, phylogeny, soft tissue anatomy, taphonomy and palaeobiology, Memorie della Società Italiana de Scienze Naturali e del Museo Civico di Storia Naturale di Milano XXXVII(I): 1-281
Druckenmiller PS, Erickson GM, Brinkman D, Brown CM, Eberle JJ. (2021): Nesting at extreme polar latitudes by non-avian dinosaurs. Curr Biol. 31(16):3469-3478.e5.
Eagle, R. A. et al. (2011): Dinosaur Body Temperatures Determined from Isotopic (13C-18O) Ordering in Fossil Biominerals. Science 333:443-445
Eagle, R. A. et al. (2015): Isotopic ordering in eggshells reflects body temperatures and suggests differing thermophysiology in two Cretaceous dinosaurs, Nature Communications 6
Embery, G, Milner, AC, Waddington, RJ, Hall, RC, Langley, MS, Milan, AM (2003): Identification of proteinaceous material in the bone of the dinosaur Iguanodon. Connective Tissue Research. 44 (Suppl 1): 41–6.
Erickson GM, Curry-Rogers K, Yerby SA. (2001): Dinosaurian growth patterns and rapid avian growth rates. Nature 412, 429–33.
Erickson, G. M., Makovicky, P. J., Currie, P. J., Norell, M. A., Yerby, S. A., Brochu, C. A. (2004): Gigantism and comparative life-history parameters of tyrannosaurid dinosaurs. In: Nature. Bd. 430(7001), 772–775.
Farmer, C. G. (2006): On the origin of avian air sacs. Respiratory Physiology & Neurobiology 154, 89–106.
Farmer, C. G. (2015): Similarity of crocodilian and avian lungs indicates unidirectional flow is ancestral for archosaurs. Integrative & Comparative Biology 55, 962–971.
Fisher, P. E., Russell, D. A., Stoskopf, M. K., Barrick, R. E., Hammer, M., Kuzmitz, A. A. (2000): Cardiovascular evidence for an intermediate or higher metabolic rate in an ornithischian dinosaur. Science. 288 (5465): 503–5.
Gillooly JF, Allen AP, Charnov EL. (2006): Dinosaur fossils predict body temperatures. PLoS Biol. 4(8): e248.
Glimcher, M. J., L. Cohen-Solala, D. Kossiva, and A. de Ricqles. (1990): Biochemical analyses of fossil enamel and dentin. Paleobiology 16 (2): 219–232.
Grady, J. M., Enquist, B. J., Dettweiler-Robinson, E., Wright, N. A., Smith, F. A. (2014): Evidence for mesothermy in dinosaurs. Science 344, 1268–1272.
Grellet-Tinner G, Chiappe LM, Norell M, Bottjer D. (2006): Dinosaur eggs and nesting behaviors: their paleobiological inferences. Palaeogeogr Palaeoclimatol Palaeoecol. 232: 294–321.
Grigg, G. C., Beard, L. A., Augee, M. L. (2004): The evolution of endothermy and its diversity in mammals and birds. Physiol. Biochem. Zool. 77, 982–997.
Kaye, TG, Gaugler, G, Sawlowicz, Z (2008): Dinosaurian soft tissues interpreted as bacterial biofilms. PLOS ONE. 3 (7): e2808.
Lee, A. H., Werning, S. (2008): Sexual maturity in growing dinosaurs does not fit reptilian growth models. Proceedings of the National Academy of Sciences. 105 (2): 582–7.
Legendre, L. J., Guénard, G., Botha-Brink, J., Cubo, J. (2016): Palaeohistological evidence for ancestral high metabolic rate in archosaurs. Syst. Biol. 65, 989–996.
Martill, D. M. et al. (2000): Skeletal remains of a small theropod dinosaur with associated soft structures from the Lower Cretaceous Santana Formation of northeastern Brazil. Canadian Journal of Earth Sciences. 37(6): 891-900.
Miller, A. (1984): Collagen: the organic matrix of bone. Philosophical Transactions of the Royal Society of London B 304: 455–477
Mikhailov KE. (1992): The microstructure of avian and dinosaurian eggshell: phylogenetic implications. Nat Hist Mus Los Angeles Cty. 36:361–73.
Miyata, T., Kurokawa, K., van Ypersele de Strihou, C. (2000): Advanced glycation and lipoxidation end products: role of reactive carbonyl compounds generated during carbohydrate and lipid metabolism. J. Am. Soc. Nephrol. 11, 1744–1752.
Müller, W. A. (1998): Tier- und Humanphysiologie ein einführendes Lehrbuch. Springer-Verlag
Nair, A.K., Gautieri, A., Chang, S.W., Buehler, M.J. (2013): Molecular mechanics of mineralized collagen fibrils in bone”. Nature Commun. 4, 1724.
Norell MA, Clark JM, Chiappe LM, Dashzeveg D. (1995): A nesting dinosaur. Nature 378: 774–6.
O’Connor, P. M., Claessens, L. P. A. M. (2005): Basic avian pulmonary design and flow-through ventilation in non-avian theropod dinosaurs. Nature 436, 253–256.
Organ, CL, Schweitzer, MH, Zheng, W, Freimark, LM, Cantley, LC, Asara, JM (2008): Molecular phylogenetics of mastodon and Tyrannosaurus rex. Science. 320 (5875): 499.
Paladino, F. V., O’Connor, M. P., Spotila, J. R. (1990): Metabolism of leatherback turtles, gigantothermy, and thermoregulation of dinosaurs. Nature 344, 858–860.
Pamplona, R. (2011): Advanced lipoxidation end-products. Chem. Biol. Interact. 192, 14–20.
Penzlin, H. (2005): Lehrbuch der Tierphysiologie, 7. Auflage. Spektrum Verlag
Peterson, JE, Lenczewski, ME, Scherer, RP (2010): Influence of microbial biofilms on the preservation of primary soft tissue in fossil and extant archosaurs. PLOS ONE. 5 (10): e13334.
Rowe, T., McBride, E. F., Sereno, P. C., Russell, D. A., Fisher, P. E., Barrick, R. E., Stoskopf, M. K. (2001): Dinosaur with a Heart of Stone. Science. 291 (5505): 783.
Ruben, J. A. et al. (1997): Lung Structure and Ventilation in Theropod Dinosaurs and Early Birds. Science 278, 1267–1270.
Ruben, J. A. et al. (1999): Pulmonary function and metabolic physiology of theropod dinosaurs. Science 283, 514–516
Salamon, M., et al. (2005): Relatively well preserved DNA is preserved in the crystal aggregates
of fossil bones. Proceedings of the National Academy of Sciences of the United States of America 102 (30): 13783–13788.
San Antonio, J. D., Schweitzer, M. H., Jensen, S. T., Kalluri, R., Buckley, M., Orgel, J. P. R. O. (2011): Dinosaur Peptides Suggest Mechanisms of Protein Survival. PLOS ONE. 6 (6): e20381.
Sander, P. M. (2000): Longbone histology of the Tendaguru sauropods: implications for growth and biology. Paleobiology. 26(3), 466–488.
Sander PM, Christian A, Clauss M, Fechner R, Gee CT, Griebeler EM, Gunga HC, Hummel J, Mallison H, Perry SF, Preuschoft H, Rauhut OW, Remes K, Tütken T, Wings O, Witzel U. (2011): Biology of the sauropod dinosaurs: the evolution of gigantism. Biol Rev Camb Philos Soc. 86(1):117-55.
Sanders, K., Farmer, CG. (2012): The pulmonary anatomy of Alligator mississippiensis and its similarity to the avian respiratory system. Anat Rec 295: 699– 714.
Sato T, Cheng Y, Wu X, Zelenitsky DK, Hsiao Y. (2005): A pair of shelled eggs inside a female dinosaur. Science 308:375.
Schachner, E. R., Farmer, C. G., McDonald, A. T., Dodson, P. (2011): Evolution of the dinosauriform respiratory apparatus: New evidence from the postcranial axial skeleton. The Anatomical Record 294, 1532–1547.
Schachner, E. R., Lyson, T. R., Dodson, P. (2009): Evolution of the respiratory system in nonavian theropods: Evidence from rib and vertebral morphology. The Anatomical Record 292, 1501–1513.
Schroeter, E. R., Schweitzer, M. H. et al. (2017): Expansion for the Brachylophosaurus canadensis Collagen I Sequence and Additional Evidence of the Preservation of Cretaceous Protein, J. Proteome Res. 16, 920–932.
Schweitzer, M. H., Marshall, M. (2012): Claws, Scales, Beaks, and Feathers: Molecular Traces in the Fossil Record. In Brett-Surman, M. K., Holtz, T. R., Farlow, J. O. (eds): The Complete Dinosaur, second edition, S. 307-320
Schweitzer, MH, Marshall, M, Carron, K, Bohle, DS, Busse, SC, Arnold, EV, Barnard, D, Horner, JR, Starkey, JR (1997): Heme compounds in dinosaur trabecular bone. Proceedings of the National Academy of Sciences of the United States of America. 94 (12): 6291–6.
Schweitzer MH, Suo Z, Avci R, Asara JM, Allen MA, Arce FT & Horner JR (2007a): Analyses of Soft Tissue from Tyrannosaurus rex Suggest the Presence of Protein: Science 316, 277-280.
Schweitzer, M.H., Wittmeyer, J.L., and Horner, J.R. (2005b): Gender-specific reproductive tissue in ratites and Tyrannosaurus rex. Science 308 (5727): 1456–60.
Schweitzer MH, Wittmeyer JL, Horner JR (2007b): Soft tissue and cellular preservation in vertebrate skeletal elements from the Cretaceous to the present. Proc. R. Soc. London Ser. B 274, 183-197.
Schweitzer, MH, Wittmeyer, JL, Horner, JR, Toporski, JK (2005a). Soft-Tissue Vessels and Cellular Preservation in Tyrannosaurus rex. Science. 307 (5717): 1952–5.
Schweitzer, M. H., Zheng, W., Cleland, T. P., Goodwin, M. B., Boatman, E., Theil, E., Marcus, M. A., Fakra, S. C. (2014): A role for iron and oxygen chemistry in preserving soft tissues, cells and molecules from deep time. Proc. R. Soc. B. 281 (1775): 20132741.
Schweitzer, M. H., Zheng W., Organ C. L., Avci R., Suo Z., Freimark L. M., Lebleu V. S., Duncan M. B., Vander Heiden M. G., Neveu J. M., Lane W. S., Cottrell J. S., Horner J. R., Cantley L. C., Kalluri R., Asara J. M. (2009): Biomolecular Characterization and Protein Sequences of the Campanian Hadrosaur B. canadensis. Science. 324 (5927): 626–31.
Sereno, P. C. et al. (2008): Evidence for Avian Intrathoracic Air Sacs in a New Predatory Dinosaur from Argentina. PLOS ONE. 3 (9): e3303.
Slater, T. S., Edwards, Ni. P., Webb, S. M., Zhang, F., McNamara, M. E. (2023): Preservation of corneous β-proteins in Mesozoic feathers. Nature Ecology & Evolution: 1–8.
Sykes, G. A., et al. (2000): The significance of a geochemically isolated intracrystalline organic fraction within biominerals. Organic Geochemistry 23: 1059–1065.
Varricchio DV, Jackson F. (2004): Two eggs sunny-side up: reproductive physiology in the dinosaur Troodon formosus. In: Currie PJ, Koppelhus EB, Shugar MA, Wright JL, editors. Feathered dragons: studies on the transition from dinosaurs to birds. Bloomington: Indiana University Press, 215–33.
Varricchio, D.J., Kundrát, M., Hogan, J. (2018): An Intermediate Incubation Period and Primitive Brooding in a Theropod Dinosaur. Sci Rep 8, 12454.
Vistoli, G. et al. (2013): Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): an overview of their mechanisms of formation. Free Radic. Res. 47, 3–27.
Walter, I., Seebacher, F. (2009): Endothermy in birds: underlying molecular mechanisms. J. Exp. Biol. 212, 2328–2336.
Wang, W., Yeung, K.W.K. (2017): Bone grafts and biomaterials substitutes for bone defect repair: A review”. Bioactive Materials, 2, 224-247.
Wedel, M. J. (2009): Evidence for bird-like air sacs in saurischian dinosaurs. Journal of Experimental Zoology 311A, 611–628.
Weiner, S., et al. (1989): The molecular structure of bone and its relation to diagenesis. Applied Geochemistry 4: 231–232.
Wiemann, J. et al. (2018): Fossilization transforms vertebrate hard tissue proteins into N-heterocyclic polymers. Nat. Commun. 9, 4741.
Wiemann, J., Crawford, J. M., Briggs, D. E. G. (2020): Phylogenetic and physiological signals in metazoan fossil biomolecules. Sci. Adv. 6, eaba6883.
Wiemann, J., Menéndez, I., Crawford, J.M. et al. (2022): Fossil biomolecules reveal an avian metabolism in the ancestral dinosaur. Nature 606, 522–526.
Xu X, Norell MA. (2004): A new troodontid dinosaur from China with avian-like sleeping posture. Nature 431:838–41.
Zelenitsky D. (2006): Reproductive traits of non-avian theropods. Journal of the Paleontological Society of Korea. 22: 209–16.



