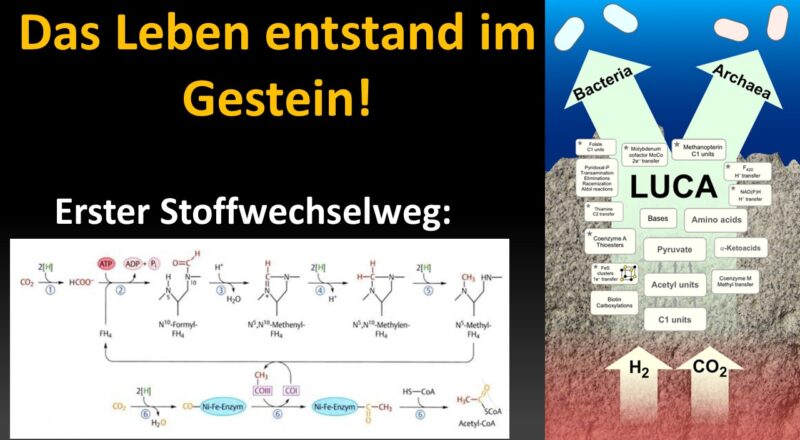
Im letzten Beitrag haben wir mithilfe der Phylogenetik ermitteln können, über welche Eigenschaften LUCA verfügte. LUCA war chemiosmotisch, mit einer ATP-Synthase, hatte aber weder eine moderne Membran noch einen der großen Atmungskomplexe, die moderne Zellen zum Pumpen von Protonen verwenden. LUCA verfügte tatsächlich über DNA und den universellen genetischen Code, Transkription, Translation und Ribosomen, aber hatte keine moderne Methode der DNA-Replikation entwickelt. Diese seltsame Phantomzelle lebte nicht im offenen Ozean, sondern in der Umgebung der alkalischen hydrothermalen Schlote. Der entscheidende Aspekt ist aber, wie LUCA seine Energie für den Stoffwechsel gewonnen hat. Phylogenetische Untersuchungen sind wegen des horizontalen Gentransfers schwierig, es gibt aber Hinweise darauf, dass LUCA aus CO2 und H2 organische Stoffe herstellte und dafür den reduktiven Acetyl-Coenzym-A-Weg nutzte.
Wie entstand der erste Stoffwechselweg?
Text als pdf
Obwohl alle Theorien über den Ursprung des Lebens eine Energiequelle voraussetzen, die die ursprünglichen chemischen Reaktionen antreibt, ist die Art der Energie, die die Entstehung des Stoffwechsels an den Ursprüngen vorantrieb, immer noch umstritten.
Eine Untersuchung von Jessica Wimmer und Kollegen (Wimmer et al. 2021b) konnte die Frage nach den Ursprüngen des Stoffwechsels einen Schritt näherbringen. Denn nehmen rein phylogenetischen Aspekten spielen auch thermodynamische eine wichtige Rolle.
Aus theoretischer Sicht bieten hier autokatalytische Netzwerke einen nützlichen Rahmen für die Untersuchung der Entstehung des Stoffwechsels (Kauffman 1986, Hordijk & Steel 2004). In autokatalytischen Netzwerken können Elemente des Netzwerks die Synthese anderer Elemente des Netzwerks katalysieren, was zu einer molekularen Selbstorganisation führen kann, vorausgesetzt, es wird eine Nahrungsquelle bereitgestellt, die das Netzwerk vorantreibt (Hordijk et al. 2010, Abb. 1). Autokatalytische Gruppen sind keine rein theoretischen Objekte, da sie sowohl im Stoffwechsel moderner Zellen als auch in dem ihrer Vorfahren nachweisbar sind (Sousa et al. 2015, Xavier et al. 2020).
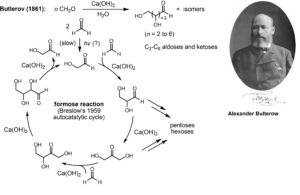
Abb. 1: Die Formose-Reaktion als Beispiel einer autokatalytischen Reaktion
Was einzelne Reaktionen betrifft, so ist seit langem bekannt, dass anorganische Katalysatoren viele Stoffwechselreaktionen unter Laborbedingungen katalysieren (Wächtershäuser 1992, Huber & Wächtershäuser 1997, Martin & Russell 2007, Sousa et al. 2018). In jüngerer Zeit wurde über komplexe Reaktionssätze berichtet, die sich biochemischen Pfaden annähern (Muchowska et al. 2019, 2020) und in einigen Fällen sogar biochemische Pfade exakt nachvollziehen (Preiner et al. 2020), wobei eine natürliche Tendenz zahlreicher Stoffwechselreaktionen zur Entfaltung in Gegenwart von Übergangsmetallkatalysatoren aufgedeckt wurde.
So konnten Muchowska et al. (2019) ein rein chemisches, durch Eisen gefördertes Reaktionsnetzwerk, in dem wässriges Pyruvat und Glyoxylat – zwei Produkte der abiotischen CO2-Reduktion (Varma et al. 2018, Eggins et al. 1988, Marin-Yaseli et al. 2016) – 9 der 11 Zwischenprodukte des biologischen Krebs- (oder Tricarbonsäure-) Zyklus aufbauen, einschließlich aller 5 universellen Stoffwechselvorstufen. Diese Zwischenprodukte wurden gleichzeitig zu CO2 abgebaut und zwar in einem lebensähnlichen System, das biologischen Stoffwechselvorgängen ähnelt (Goldford & Serge 2018, Abb. 2 & 3).
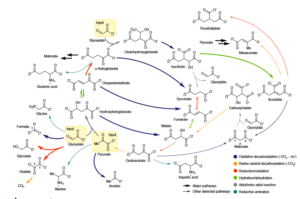
Abb. 2: Fe2+-geförderte Synthese und Abbau von Vorläufern des biologischen Stoffwechsels, die wichtigsten Wege sind durch fettgedruckte Reaktionspfeile dargestellt.
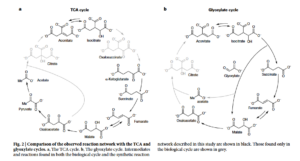
Abb. 3: Vergleich des beobachteten Reaktionsnetzwerks mit dem Krebs(TCA)- und dem Glyoxylat-Zyklus. a, Der TCA-Zyklus. b, Der Glyoxylat-Zyklus. Zwischenprodukte und Reaktionen, die sowohl im biologischen Zyklus als auch in dem in dieser Studie beschriebenen synthetischen Reaktionsnetzwerk vorkommen, sind in Schwarz dargestellt. Diejenigen, die nur im biologischen Zyklus vorkommen, sind grau dargestellt.
Gibt man Hydroxylamin, welches unter präbiotischen Bedingungen gebildet wurde (Canfield et al. 2010, Kalson et al. 2017, Sakuari & Yanagawa 1984) und Eisen in das System, werden vier biologische Aminosäuren in einer Weise erzeugt, die der Biosynthese ähnelt. Das beobachtete Netzwerk überschneidet sich weitgehend mit dem Krebs- und dem Glyoxylatzyklus (Muchowska et al. 2017, Zubay 2003) und könnte ein präbiotischer Vorläufer dieser zentralen Stoffwechselwege sein.
Vom rechnerischen Standpunkt aus betrachtet, wurden Simulationen in großem Umfang zur Untersuchung des metabolischen Ursprungs eingesetzt, insbesondere Algorithmen zur Netzwerkerweiterung. Diese haben gezeigt, dass sie kleine Molekülnetzwerke generieren können, die aus bis zu Hunderten von Verbindungen mit stoffwechselähnlichen Eigenschaften bestehen, mit dem Vorbehalt, dass die so generierten Netzwerke nicht als natürliche Pfade in modernen Zellen auftreten (Goldford et al. 2017, 2019, Tian et al. 2019).
Thermodynamische Studien in geochemischen Systemen deuten auf einen Ursprung des Stoffwechsels aus H2 und CO2 in einer hydrothermalen Umgebung hin, da die Synthese von Aminosäuren (Amend & Shock 1998) und sogar prokaryotischer Zellmasse (Amend & McCollom 2009) aus H2, CO2 und NH3 unter den chemischen Bedingungen, die für H2 produzierende hydrothermale Schlote typisch sind, exergonisch ist.
Aber solche Berechnungen der freien Energie (ΔG) für eine einstufige geochemische Reaktion, die H2, CO2 und NH3 in Aminosäuren umwandelt (Amend & Shock 1998, Amend et al. 2013) erfasst nicht ansatzweise die thermodynamische Landschaft des Stoffwechsels, da die Biosynthese von Aminosäuren und allen anderen Zellbestandteilen sehr spezifische mehrstufige Reaktionen beinhaltet; es gibt also eine Reihe an Zwischenstufen und Umwandlungen um aus H2 CO2 und NH3 organische Moleküle herzustellen. So sind beispielsweise über 20 verschiedene Reaktionen an der Synthese von Tryptophan oder Purinen aus H2, CO2 und NH3 beteiligt (Kanehisa & Goto 2000). Studien zur Thermodynamik des Stoffwechsels müssen sich idealerweise mit der Thermodynamik einzelner Stoffwechselreaktionen befassen, wie sie in modernen Zellen oder in deren Vorfahren ablaufen.
Eine vergleichende Physiologie kann hier Abhilfe verschaffen. So wurden über 400 universelle einzelne Reaktionen identifiziert, die von Bakterien und Archaeen zur Synthese der für das Wachstum erforderlichen Aminosäuren, Nukleotide und Vitamine verwendet werden (Wimmer et al. 2021a, Abb. 4 und 5).
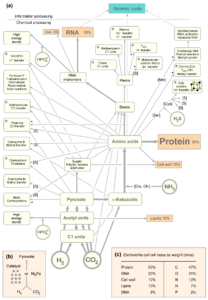
Abb. 4: (a) Eine allgemeine Karte des Kernstoffwechsels. Die Pfeile in der Karte decken nicht jedes Atom in jedem Cofaktor, jeder Aminosäure oder Base ab und zeigen stattdessen die wichtigsten Massenbeiträge. Ein Punkt zeigt an, dass radikale S-Adenosylmethionin (SAM)-Enzyme am Biosyntheseweg, der zum Produkt führt, beteiligt sind. Ein [S] zeigt an, dass Schwefel in den Biosyntheseweg eingebunden ist. (b) Die mit einem Sternchen gekennzeichneten Cofaktoren sind für den Weg von H2 und CO2 zu Pyruvat entweder in Acetogenen oder Methanogenen oder in beiden erforderlich. (c) Die Zusammensetzung der Zellen im Hinblick auf ihre Hauptbestandteile und die elementaren Beiträge zum Trockengewicht.
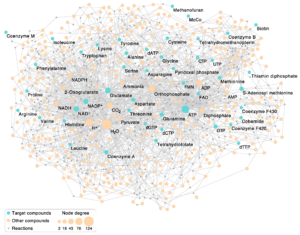
Abb. 5: Der autotrophe Kernstoffwechsel aus 404 Reaktionen, das Abb. 4 zugrunde liegt. Der ungerichtete zweistufige Graph besteht aus 404 Reaktionsknoten (dargestellt als graue Rauten) und 380 Verbindungsknoten (Kreise). Die 46 Zielverbindungen sind blau gefärbt; andere an den Reaktionen beteiligte Verbindungen erscheinen orange. Die Zielverbindungen entsprechen den Kernverbindungen in Abb. 4. Jede Verbindung, die an einer Reaktion beteiligt ist, ist mit dem entsprechenden Reaktionsknoten durch eine Kante verbunden. Die Größe der Verbindungen richtet sich nach dem Knotengrad (Anzahl der Reaktionen, an denen die Verbindung beteiligt ist). H2O tritt beispielsweise in 125 Reaktionen entweder als Reaktant oder als Produkt auf und ist die häufigste Verbindung in den 404 Reaktionen. In den ursprünglichen Stoffwechselprozessen, bevor es Enzyme gab, wurde ein begrenzteres Spektrum an Verbindungen als in Abb. 4 von der Umwelt bereitgestellt. Verbindungsknoten sind gekennzeichnet, wenn sie Ziele sind oder wenn der Knotengrad ≥20 ist. Beachten Sie, dass FeS-Cluster in dieser Abbildung nicht enthalten sind, da ihre Synthese mit KEGG nicht rekonstruiert werden kann. Das Netzwerk enthält nur L-Aminosäuren.
Nach Ansicht des Forschungsteams spricht das fast in allen untersuchten Organismen konservierte Netzwerk dieser 402 Reaktionen dafür, dass es auch schon beim letzten gemeinsamen Vorfahren allen Lebens (Last Universal Common Ancestor, LUCA) existierte (Abb. 6). Die Analysen ergaben zudem, dass diese Reaktionen auf grundlegenden Rohstoffen wie Wasserstoff, Kohlendioxid und Ammoniak aufbauen – Molekülen, die es beispielsweise an hydrothermalen Schloten reichlich gab. Allerdings wirft dies die Frage auf, woher die nötige Energie für die frühen Stoffwechselreaktionen stammte.

Abb. 6: LUCAs Stoffwechselwege
Dennoch müssen hier aus evolutionärer Sicht eine Reihe an Abstrichen gemacht werden.
Auch wenn diese chemischen Reaktionen nicht in allen Genomen vorkommen, sind sie als Primärproduktion universell. Der Begriff Primärproduktion bezeichnet in der Ökologie die Produktion von Biomasse durch autotrophe Stoffwechselwege (Hamilton et al. 2016, Martin et al. 2018). Auch die Enzyme, die diese Reaktionen katalysieren sind nicht universell – denn einige sind Abhängig von freiem Sauerstoff (O2) (Dailey et al. 2017, Jabłońska & Tawfik, 2021) und einige sind bei Bakterien und Archaeen konvergent oder durch horizontalen Gentransfer entstanden (Sousa et al. 2013, Williams et al. 2017, Xavier et al. 2021, Weiss et al. 2016).
Aktualisiert werden können diese Reaktionen durch den Acetyl-CoA-Weg, welcher von den Acetogenen und Methanogegen zur ATP-Synthese genutzt werden kann (Rother & Metcalf 2004). Aktuelle Untersuchungen gehen davon aus, dass dieser Acetyl-CoA-Weg den metabolischen Ursprung darstellt (Fuchs & Stupperich 1985, Fuchs 1986, 1989, 2011, Drake et al. 2008, Ljungdahl 1986, Ragsdale & Pierce 2008, Wood 1991, Daniels et al. 1977, Hügler & Sievert 2011, Taylor et al. 1976, Abb. 7 und 8).
Obwohl der Acetyl-CoA-Weg ebenfalls nicht universell ist und durch viele andere autotrophe (Berg et al. 2010, Fuchs 2011, Hügler & Sievert 2011, Steffens et al. 2021) und heterotrophe (Schönheit et al. 2016) Kohlenstoff-Assimilationswege während der Evolution ersetzt wurde, kann er auf LUCA zurückgeführt werden (Weiss et al. 2016) und er ist auch älter als die Enzyme, die LUCAS Reaktionen katalysieren (Martin 2020).
Doch wenn der Acetyl-CoA-Weg ebenfalls nicht universell ist, wie können wir sicher sein, dass dies der älteste Stoffwechselweg ist? Hier spielt nun die Thermodynamik eine wichtige Rolle.
Trotz vieler Unbekannter in Bezug auf den Prozess der Stoffwechselentstehung gibt es einen Faktor, der eine strenge Einschränkung darstellt: Die chemischen Reaktionen, die den Stoffwechsel von LUCA ausmachten und aus denen er hervorging, waren zwangsläufig exergonisch, denn ohne Energiefreisetzung finden keine Reaktionen statt. Es ist seit langem bekannt, dass zur Förderung der Reaktionen am Ursprung des Stoffwechsels Energie erforderlich ist, aber die Art dieser Energie ist umstritten. Es wurden viele mögliche Energiequellen aus der Umwelt vorgeschlagen, darunter Pyrophosphat (PPi; Schramm et al. 1962), zyklische Polyphosphate (Ozawa et al. 2004), reduzierte Phosphorminerale (Pasek 2020), ultraviolettes Licht (Patel et al. 2015), radioaktiver Zerfall (Ebisuzaki & Maruyama 2017), Blitze (Ducluzeau et al. 2009), geochemische Pyritsynthese (Wächtershäuser 1992), geochemische Ionengradienten (Russell & Cook 1995), geoelektrisches Potenzial (Kitadai et al. 2021), Einschläge von Asteroiden oder Kometen (Ferus et al. 2015) und Wärme (Muller 1995). Moderne Zellen in der Natur nutzen jedoch keine dieser Umweltenergiequellen, sondern nutzen stattdessen Redoxreaktionen (Mitchell 1961, Thauer et al. 1977, Müller et al. 2018) und konservieren Energie für den Stoffwechsel in Form des ATP (Decker et al. 1970) oder reduziertem Ferredoxin (Herrmann et al. 2008, Buckel & Thauer 2013, Müller et al. 2018).
Theorien über den autotrophen Ursprung gehen davon aus, dass die ersten frei lebenden Zellen aus CO2 und anorganischen Verbindungen ohne Hilfe von Licht entstanden sind (Fuchs & Stupperich 1985, Wächtershäuser 1992, Fuchs 2011). Damit solche chemolithoautotrophen Zellen an einem bestimmten Umweltstandort entstehen können, müssen die Reaktionen, die ihrer Entstehung zugrunde liegen, d. h. die Gesamtheit der Reaktionen, die die Zelle synthetisieren, exergonisch sein. Die Energiequelle, die diese Reaktionen ermöglicht, ist hier von Interesse.
Das Team um Jessica Wimmer (Wimmer 2021b) untersuchte mithilfe von Computermodellen die Energiebilanz der 402 Reaktionen anhand ihrer freien Energie, auch Gibbs-Energie genannt. Ob eine Reaktion spontan und ohne Aufnahme zusätzlicher Energie von außen abläuft, hängt allerdings von den Umweltbedingungen ab. Daher spielte das Forschungsteam die Reaktionen bei unterschiedlichen pH-Werten, Temperaturen und Konzentrationen der Ausgangsstoffe durch. Das Ergebnis: Die energetisch optimalen Bedingungen für die möglicherweise ersten Stoffwechselreaktionen lagen im Bereich eines alkalischen pH-Wertes um etwa pH 9 und bei einer Temperatur von rund 80 Grad Celsius. Außerdem muss Wasserstoff präsent sein, um bei der CO2-Fixierung zu helfen. Ohne Wasserstoff geht gar nichts, weil dieser benötigt wird, um das CO2 überhaupt in den Stoffwechsel einzuschleusen.
Sind diese Bedingungen jedoch erfüllt, läuft ein Großteil der untersuchten Reaktionen ohne weitere Energiezufuhr ab und setzt teilweise sogar noch Energie frei, die dann die nächstfolgenden Reaktionen anstößt. Das ist deshalb aufregend, weil der sonst so komplizierte Stoffwechsel auf einmal eine natürliche Tendenz offenbart, sich unter den richtigen Bedingungen von alleine zu entfalten. Der Urstoffwechsel selbst könnte demnach als interne Energiequelle für die ersten Anfänge des Lebens gedient haben. Es konnte gezeigt werden, dass die Energie am Ursprung des Lebens rein chemischer Natur ist. Wir brauchen kein Sonnenlicht, keine Meteoriten, kein UV-Licht: nur Wasserstoff und Kohlendioxid plus etwas Ammoniak und Salz. Unter diesen Bedingungen sind auch keine Membranproteine, Cytochrome oder Enzyme notwendig.
Und das sind genau die Zutaten, die die ersten Zellen an heißen, alkalischen Schloten der Tiefsee gefunden haben. Dieses Milieu entspricht genau der Umgebung, die man im Hydrothermalfeld ‚Lost City‘ im Atlantis-Massiv, einem unterseeischen Gebirge im Mittelatlantik, vorfindet. Damit stützen die Ergebnisse des Teams die Vermutung, dass solche heißen Quellen am Meeresgrund eine wichtige Rolle für die Entstehung des Lebens gespielt haben könnten.
Ihre Thermodynamik deutet darauf hin, dass die biosynthetischen Kernreaktionen des mikrobiellen Stoffwechsels aus löslichen (Martin & Russell 2007, Muchowska et al., 2019) und oberflächenkatalysierten (Wächtershäuser 1988, Preiner et al. 2020) Reaktionen im Dunkeln unter heißen, wässrigen, H2-haltigen geochemischen Umgebungen entstanden sein könnten, unabhängig von exponierten Landmassen (Licht) oder der Existenz von Wasser mit geringer Ionenstärke.
Und genau hier spielt der Acetyl-CoA-Weg eine besondere Rolle.
Evolution des Acetyl-CoA-Wegs
Bei dem reduktiven Acetyl-CoA-Weg handelt es sich um einen nichtzyklischen Weg der Fixierung von Kohlenstoffdioxid (CO2) bzw. verschiedenen C1-Verbindungen wie Formiat, Methanol, Kohlenmonoxid, Methylamin oder Methylether. Als Reduktionsmittel dient hierbei elementarer Wasserstoff (H2).
In der gesamten Welt des Lebendigen gibt es nur sechs unterschiedliche Wege, Kohlenstoff zu fixieren (Abb. 7), will sagen: anorganische Moleküle wie CO2 in organische Moleküle zu überführen.
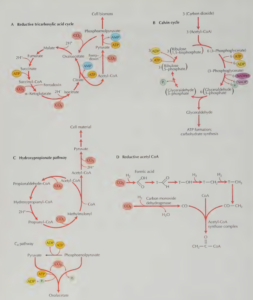
Abb. 7: Formen der CO2-Fixierung
Der wohl bekannteste Weg ist der Calvin-Zyklus der Fotosynthese, welcher nur in photosynthetischen Bakterien und Pflanzen stattfindet, nicht aber bei Archaeen. Hätte LUCA Photosynthese betrieben, hätte diese Eigenschaft bei allen Archaeen systematisch verschwinden müssen, was bei einer derart nützlichen Sache ziemlich unpraktisch wäre. Viel wahrscheinlicher ist es, dass der Calvin-Zyklus erst später entstand. Vier weitere Wege der Kohlenstofffixierung – der 3-Hydroxypropionatzyklus, der 3-Hydroxypropionat/4-Hydroxybutyratzyklus, der Dicarboxylat/4-Hydroxybutyratzyklus und der reduktive Citratzyklus – kommt nur bei einigen Bakterien oder Archaeen vor. Diese sind also ebenfalls wahrscheinlich erst entstanden, als sich Bakterien und Archaeen vom gemeinsamen Vorfahren getrennt haben. Nur ein einziger Reaktionsweg der Kohlenstofffixierung ist bei Bakterien und Archaeen zu finden und geht somit mit einiger Sicherheit auf deren gemeinsamen Vorfahren zurück – der reduktive Acetyl-Coenzym-A-Weg (Berg et al. 2010, Fuchs 2011, Weiss et al. 2016).
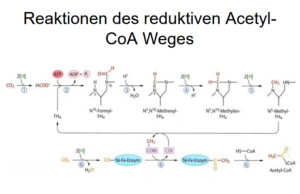
Abb. 8: reduktiver Acetyl-CoA-Weg
Der reduktive Acetyl-Coenzym-A-Weg setzt mit Wasserstoff und CO2 ein – denselben beiden Molekülen, die bei den weißen Rauchern massenhaft vorkommen. Methanogene und Acetogene treiben beide ihr Wachstum durch die alleinige Reaktion von H2 mit CO2 an: Diese Reaktion liefert alles an Kohlenstoff und Energie, was sie zum Wachsen brauchen. Während Methanogene zu den Archaeen gehören, zählen die Acetogenen zu den Bakterien. Für den Augenblick wollen wir kurz betrachten, warum dieser Reaktionsweg durchaus die Herleitung vom gemeinsamen Vorfahren für sich beanspruchen kann.
Wie wir bereits wissen setzt die Bildung von organischen Molekülen aus CO2 und H2 Energie frei: Im Prinzip müsste sie demnach spontan ablaufen. In der Praxis aber besteht eine energetische Barriere, die H2 und CO2 von einer raschen Reaktion miteinander abhält.
Das hebt den reduktiven Acetyl-Coenzym-A-Weg von den anderen fünf Reaktionswegen der Kohlenstofffixierung ab. Denn diese erfordern immer eine Zufuhr von Energie von außen: z. B. das Sonnenlicht bei der Photosynthese. Nicht so beim reduktiven Acetyl-Coenzym-A-Weg. Es ist quasi ein kostenloses Mittagessen. Seine exergonische Natur ermöglicht die Kopplung der H2 abhängigen CO2-Reduktion mit Ionenpumpen und ATP-Synthese, wie bei Acetogenen (Schuchmann & Müller 2014) und Methanogenen (Thauer et al. 2008), strengen Anaerobiern, die sowohl ihren Kohlenstoff als auch ihre Energie aus der Reduktion von CO2 mit H2 gewinnen.
Organismen, die den Acetyl-CoA-Weg nutzen, bewohnen immer noch H2 produzierende geochemische Systeme (Magnabosco et al. 2018, Smith et al. 2019), Lebensräume, die bereits auf der frühen Erde existierten (Sleep et al. 2011). Das erste Zwischenprodukt des Acetyl-CoA-Wegs, Formiat, wird geochemisch über abiotische Reaktionen in modernen hydrothermalen Systemen synthetisiert (Lang et al. 2010, Schrenk et al. 2013), ebenso wie die Endprodukte des Energiestoffwechsels über den Weg in Acetogenen (Acetat; Sherwood Lollar et al. 2021) und in Methanogenen (Methan; Proskurowski et al. 2008).
Und das ist noch nicht alles. Im Gegensatz zu den anderen Reaktionswegen ist der reduktive Acetyl-Coenzym-A-Weg kurz und geradlinig. Es braucht weniger Schritte von den einzelnen anorganischen Molekülen bis hin zum Dreh- und Angelpunkt des Stoffwechsels in allen Zellen, dem kleinen, aber reaktionsfreudigen Molekül Acetyl-Coenzym A (Acetyl-CoA, Abb. 9).
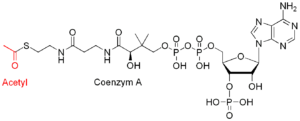
Abb. 9: Acetyl-Coenzym A
Das Coenzym A ist ein wichtiger und universeller chemischer „Haken“, an den kleine Moleküle gehängt werden können, sodass deren Verarbeitung durch Enzyme möglich ist.
Wichtig ist nicht so sehr der Haken, sondern das, was daran hängt, in diesem Fall eine Acetylgruppe. „Acetyl“- leitet sich vom lateinischen Wort acetum für Essig ab; die Essigsäure ist ein einfaches Molekül mit zwei Kohlenstoffatomen, das in der Biochemie aller Zellen eine wichtige Rolle einnimmt.
In Verbindung mit dem Coenzym A befindet sich die Acetylgruppe, also der Essigsäurerest, in einem aktivierten Zustand; so kann sie leicht mit anderen organischen Molekülen reagieren und die Biosynthese antreiben. In nur wenigen Schritten kann mit dem reduktiven Acetyl-Coenzym-A-Weg aus CO2 und H2 genügend Energie bereitgestellt werden, um komplexere organische Moleküle zu bilden.
Das Acetyl-Coenzym-A ist für sehr viele Stoffwechselprozesse von signifikanter Bedeutung, weil er an einer uralten Gabelung im Stoffwechselprozess auftaucht und auch heute noch in Organismen zu finden ist (Abb. 10). Wo CO2 mit einem Acetyl-Coenzym-A reagiert, nehmen wir eine Abzweigung, die uns zur Bildung komplexer organischer Moleküle führt. Bei dieser spontanen Reaktion wird Energie frei, bei der wiederrum ein Molekül mit drei C-Atomen gebildet werden kann: Pyruvat. Diese Verbindung stellt einen Einstiegspunkt in den Citratzyklus dar, einer wichtigen Drehscheibe im Zellstoffwechsel. Sind wir einmal im Citrat-Zyklus eingedrungen, brauchen wir nichts weiter als eine stetige Zufuhr von ATP, um diesen in Gang zu bringen.
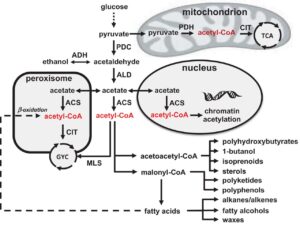
Abb. 10: Überblick über den Acetyl-CoA-Stoffwechsel bei Hefezellen. Glukose wird in der Glykolyse in Pyruvat umgewandelt und kann dann zur Atmung in die Mitochondrien gelangen. Hier wird Pyruvat durch den Pyruvat-Dehydrogenase-Komplex (PDH) in Acetyl-CoA umgewandelt, und Acetyl-CoA wird durch den Krebs-Zyklus (TCA) weiter oxidiert, wobei die Citrat-Synthase (CIT) die erste Reaktion katalysiert. Im Zytosol kann Pyruvat durch Pyruvat-Decarboxylase (PDC) in Acetaldehyd umgewandelt werden, und Acetaldehyd kann entweder durch Alkoholdehydrogenase (ADH) in Ethanol oder durch Aldehyddehydrogenase (ALD) in Acetat umgewandelt werden. Acetat kann sowohl in den Zellkern als auch in das Peroxisom gelangen, und in beiden Kompartimenten sowie im Zytosol kann es durch die Acetyl-CoA-Synthetase (ACS) in Acetyl-CoA umgewandelt werden. Im Zellkern wird Acetyl-CoA für die Histon-Acetylierung verwendet, während es im Peroxisom durch Reaktion mit CIT in den Glyoxylat-Zyklus gelangen kann. Acetyl-CoA aus dem Zytosol kann auch durch Reaktion mit der Malat-Synthase (MLS) in den Glyoxylat-Zyklus (GYC) gelangen. Das Nettoergebnis des Glyoxylatzyklus ist die Bildung von 1 Mol Malat aus 2 Mol Acetyl-CoA, und Malat kann zur Oxidation in die Mitochondrien transportiert werden. Dieser Weg ist für das Wachstum auf Acetat oder Ethanol unerlässlich. Cytosolisches Acetyl-CoA wird für die Biosynthese von Lipiden verwendet, d. h. entweder für Ergosterol über Acetoacetyl-CoA oder für Fettsäuren über Malonyl-CoA. Aus diesen beiden Zwischenprodukten können viele wertvolle biotechnologische Produkte gewonnen werden.
Im Kohlenstoffstoffwechsel erzeugt der Acetyl-CoA-Weg Pyruvat als Hauptprodukt (Fuchs 2011) über Reaktionen, für die 10 Enzyme und Cofaktoren erforderlich sind. Diese Enzyme können jedoch durch einfache hydrothermale Mineralien wie Awaruite (Ni3Fe) ersetzt werden, die H2 und CO2 über Nacht bei 100 °C in Wasser in Formiat, Acetat und Pyruvat umwandeln (Preiner et al. 2020).
Die Enzyme, welche die ersten Schritte katalysieren, enthalten anorganische Eisen-, Nickel- und Schwefelcluster, die physikalisch für die Übertragung von Elektronen auf CO2 und somit die Bildung reaktiver Acetylgruppen verantwortlich sind. Diese anorganischen Cluster sind im Grunde Minerale und in ihrer Struktur mehr oder weniger identisch mit den FeS-Mineralen, die in hydrothermalen Schloten ausfallen (Martin 2020).
Das größte Plus des reduktiven Acetyl-Coenzym-A-Wegs aber ist vielleicht, dass er einen Schnittpunkt des Kohlenstoff- und des Energiestoffwechsels bildet. Acetyl-CoA treibt nicht nur die Synthese von organischen Molekülen an, sondern kann auch direkt mit Phosphat zu Acetylphosphat reagieren. Dieses hat zwar heute als Energiewährung nicht dieselbe Bedeutung wie das ATP, ist aber bis in die Gegenwart bei vielen Lebewesen in Gebrauch und erfüllt fast dieselben Aufgaben wie ATP.
Acetylphosphat kann in Laborversuchen genau die gleiche Aufgabe erfüllen, da seine Chemie im Grunde gleichwertig ist. Das bedeutet, dass der frühe Kohlenstoff- und Energiestoffwechsel durch denselben einfachen Thioester, Acetyl-CoA, angetrieben werden könnte.
Die Acetylgruppe mit ihren zwei Kohlenstoffatomen mag einfach sein, aber das Coenzym A ist jedoch ein komplexes Molekül, zweifellos das Ergebnis natürlicher Selektion und somit ein späteres Produkt der Evolution (Abb. 9). Es gibt aber wirklich einfache “abiotische” Äquivalente zu Acetyl-CoA.
Dieses verdankt seine Reaktivität seiner sogenannten „Thioester-Bindung“, die nichts weiter ist als ein Schwefelatom, das an ein Kohlenstoffatom gebunden ist, das an ein Sauerstoffatom gebunden ist. Das Ganze lässt sich folgendermaßen darstellen: R-S-CO-CH3, wobei “R” für den “Rest” des Moleküls steht, in diesem Fall CoA, und CH3 eine Methylgruppe ist. Das R muss jedoch nicht für CoA stehen, sondern kann auch für eine andere CH3-Gruppe stehen, was ein kleines Molekül namens Methylthioacetat ergibt: CH3-S-CO-CH3.
Dieses Molekül ist ein reaktiver Thioester, in seinen chemischen Eigenschaften dem Acetyl-CoA selbst äquivalent, aber so einfach, dass es in alkalinen hydrothermalen Schloten aus H2 und CO2 gebildet werden konnte – tatsächlich haben es Claudia Huber und Günter Wächtershäuser allein aus CO (Kohlenmonoxid) und CH3SH (Methanthiol) hergestellt (Huber & Wächtershäuser 1997). Besser noch: Methylthioacetat sollte, wie Acetyl-CoA, direkt mit Phosphat zu Acetylphosphat reagieren können. Somit könnte dieser reaktive Thioester im Prinzip die Synthese neuer organischer Moleküle unmittelbar antreiben.
Eine Urversion des reduktiven Acetyl-Coenzym-A-Wegs könnte im Prinzip Energie und Bausteine für alles liefern, was für die Evolution primitiver Zellen im Inneren der Mikroporen alkaliner hydrothermaler Schlote benötigt wird.
Drei Stadien sind für die Evolution des reduktiven Acetyl-Coenzym-A-Weg denkbar (Martin & Russel 2003, 2007, Martin et al. 2014, Russel & Martin 2004, Abb. 11).
Im ersten Stadium trieben Protonengradienten über dünnen anorganischen Trennwänden mit katalytisch wirkenden FeS-Mineralen die Bildung kleiner organischer Verbindungen an. Diese organischen Verbindungen reicherten sich durch Thermophorese in den kühleren Poren an und agierten ihrerseits als wirkungsvollere Katalysatoren.
Das zweite Stadium bestand in der Bildung einfacher organischer Protozellen innerhalb der Schlotporen, als natürliches Ergebnis der physischen Interaktion zwischen organischen Verbindungen. Es entstanden durch Selbstorganisation der Materie einfache, zellähnliche Strukturen, noch ohne jede genetische Basis oder nennenswerte Komplexität. Diese einfachen Protozellen waren abhängig von einem Protonengradienten als Antrieb für die Synthese organischer Verbindungen, doch bestand dieser nun über ihren eigenen organischen Membranen (wie etwa Lipiddoppelschichten, die sich spontan aus Fettsäuren bildeten) und nicht mehr über den anorganischen Trennwänden im Schlot. Dafür werden keine Proteine benötigt. Der Protonengradient konnte die Bildung von Methylthioacetat und Acetylphosphat angetrieben haben, wie oben beschrieben, und damit auch einen Kohlenstoff- und Energiestoffwechsel. In diesem Stadium gibt es eine grundlegende Besonderheit: Neue organische Materie wird nun innerhalb der Protozelle selbst gebildet, angetrieben durch natürliche Protonengradienten über organischen Membranen.
Das dritte Stadium ist der Ursprung des genetischen Codes und echter Vererbung, die Protozellen nun befähigten, mehr oder weniger exakte Kopien von sich selbst herzustellen. Eine Thematik, die wir in späteren Kapiteln intensiv behandeln werden.
Abb. 11: Links: Ein Modell für die Entstehung von Leben an einem Redox-, pH- und Temperaturgradienten an einem submarinen hydrothermalen Schlot. Siehe Russell & Hall (1997) und Russell et al. (2003) für Einzelheiten. Die Begriffe RNA-, RNP- und DNA-Ära (anstelle von “Welt”) werden verwendet, um zu betonen, dass keine Nukleinsäure-Evolution ohne eine unterstützende Geochemie, später Biogeochemie und schließlich Biochemie möglich ist, um einen stetigen Fluss angemessener Konzentrationen polymerisierbarer Vorläufer (z. B. Nukleotide) zu gewährleisten und damit jede Art von Replikation zu unterstützen. Rechts: Ein Modell für die Entstehung von membranumschlossenen prokaryotischen Zellen aus Eisenmonosulfid-Kompartimenten, in denen der chemoautotrophe Ursprung des Lebens stattgefunden haben könnte. Die Zeichnung impliziert (zeigt aber nicht) sehr große Populationen von Replikationssystemen und nicht spezifizierte physische Entfernungen (jedoch innerhalb einer einzigen unterseeischen Versickerungsstelle) zwischen sich diversifizierenden Replikationssystemen auf dem Weg zu freilebenden eubakteriellen und archaebakteriellen Zellen. Verschiedene Arten des genetischen Austauschs, die wiederholt postuliert wurden (Woese 2002), bevor eine wirklich membrangebundene zelluläre Organisation von Prokaryonten entstand, könnten problemlos in dem Modell untergebracht werden.
Das hier skizzierte Hydrothermalschlot-Szenario hat einen schönen Fortbestand in der Biochemie der Methanogene, jener Archaeen, die mithilfe des reduktiven Acetyl-Coenzym-A-Wegs von H2 und CO2 leben (Abb. 12). Diese offenbar evolutionär alten Zellen erzeugen einen Protonengradienten über einer Membran und reproduzieren damit genau das, was hydrothermale Schlote gratis anbieten. Der Protonengradient dient als Antrieb des reduktiven Acetyl-Coenzym-A-Wegs, und zwar mithilfe eines in die Membran eingebetteten Eisen-Schwefel-Proteins – einer Energie umwandelnden Hydrogenase (energy-converting hydrogenase), kurz Ech. Dieses Protein schleust Protonen durch die Membran zu einem weiteren FeS-Protein, dem Ferredoxin, das seinerseits CO2 reduziert (Russel & Martin 2003, 2004, 2007, Martin et al. 2014, Lane 2010, 2017, Lane & Martin 2012, Welte et al. 2010, Nitschke & Russel 2013 Sojo et al. 2016).
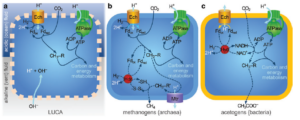
Abb. 12: Vorgeschlagene Evolution des Protonenpumpens in Archaeen und Bakterien. (a) Vorgeschlagener Kohlenstoff- und Energiestoffwechsel, angetrieben durch natürliche Protonengradienten in einer Urprotozelle mit undichter Membran. Ech, energieumwandelnde Hydrogenase; Fdox, Ferredoxin; Fdred, reduziertes Ferredoxin. Der Einfachheit halber wird in dieser Abbildung nur der -CH3-Zweig eines postulierten Acetyl-CoA-Wegs dargestellt. R ist einer von mehreren Cofaktoren, die sich zwischen Methanogenen und Acetogenen unterscheiden. Die Richtung des Protonenflusses durch Ech ist entscheidend und unterscheidet sich in (c). (b) Vereinfachter Kohlenstoff- und Energiestoffwechsel von Methanogenen (Archaeen). Ech reduziert Ferredoxin mit Hilfe eines Protonengradienten wie in (a), aber jetzt müssen Ionen gepumpt werden, um das Membranpotential zu regenerieren. Dies wird durch Elektronenverzweigung erreicht, wobei H2 zur gleichzeitigen Reduktion von Ferredoxin und einem Heterodisulfid (-S-S-) verwendet wird. Die Methanogenese regeneriert das Membranpotenzial über eine neue Ionenpumpe (Mtr), die sich möglicherweise aus einem Na+/H+-Antiporter entwickelt hat. (c) Vereinfachter Kohlenstoff- und Energiestoffwechsel von Acetogenen (Bakterien). Ech kehrt sich um und oxidiert Ferredoxin, um ein Membranpotenzial zu erzeugen. Nun muss das reduzierte Ferredoxin regeneriert werden, was durch eine besondere Form der Elektronenverzweigung erreicht wird, bei der H2 zur gleichzeitigen Reduktion von Ferredoxin und NAD+ verwendet wird. Acetogene können Ferredoxin jedoch nicht mehr zur CO2-Reduktion verwenden und mussten daher einen neuen Weg des Kohlenstoffstoffwechsels entwickeln, bei dem ATP und NADH anstelle von Ferredoxin verwendet werden. Neue Wege des Energiestoffwechsels Stoffwechselwege sind mit gestrichelten Linien dargestellt.
Methanogene nutzen den Protonengradienten auch direkt als Antrieb für die ATP-Synthese, nämlich über die ATP-Synthase. Somit werden sowohl der Kohlenstoff- als auch der Energiestoffwechsel durch Protonengradienten angetrieben, also durch genau das, was die Schlote gratis lieferten. Die frühesten Protozellen, die in alkalinen hydrothermalen Schloten lebten, betrieben ihren Kohlenstoff- und Energiestoffwechsel möglicherweise exakt auf diese Art.
Fassen wir zusammen: Basische Hydrothermalquellen produzieren kontinuierlich Acetyl-Thioester und liefern damit sowohl einen Ausgangspunkt für die Bildung komplexer organischer Moleküle als auch die Energie, die nötig ist, um diese Moleküle herzustellen und auch heutige Zellen nutzen. Die mineralischen Zellen, die die Schlote durchlöchern, stellen umgehend die Hilfsmittel zur Verfügung, die nötig sind, um die Reaktionsprodukte zu sammeln und die Reaktionen zu begünstigen. Nebenbei stellen sie die Katalysatoren bereit, die den Reaktionsablauf beschleunigen, und zwar ohne, dass komplexe Proteine notwendig sind. Und schließlich bewirkt das Einströmen von Wasserstoff und anderen Gasen in das Labyrinth von mineralischen Zellen, dass sämtliche Rohmaterialien kontinuierlich nachgeliefert und gründlich vermischt werden.
Die Rolle von ATP
Ein kleines Detail ist aber noch zu beachten: Das Problem bezieht sich auf den Energieschub, der zunächst benötigt wird, um Wasserstoff und CO2 für eine gemeinsame Bindung zu erwärmen. In den Quellen stellt dies selbst kein Problem dar, da unter den Hydrothermalbedingungen reaktionsfreudige freie Radikale gebildet werden, die den Ball ins Rollen bringen. Für freilebende Zellen ist dies jedoch ein Problem. Sie benötigen ATP, um in die Gänge zu kommen (Abb. 13). Bei der Reaktion zwischen Wasserstoff und CO2 wird genügend Energie frei, um ein ATP-Molekül zu bilden. Wenn wir aber ein ATP-Molekül abgeben müssen, um eines zu erzeugen, erzielen wir keinen Nettogewinn. Und wenn wir diesen nicht haben, kann der Citratzyklus nicht ablaufen und es können keine komplexen Moleküle gebildet werden.
Abb. 13: ATP
Als weiteres Problem: wir können entweder ein ganzes ATP gewinnen oder gar keins. So etwas wie ein Fünftel ATP gibt es nicht. Angenommen wir vergleichen diese Energiewährung mit unserer Währung. Nehmen wir an ein ATP kostet 10 Euro, 2 ATP 20 etc. Bzw., wenn wir Energie gewinnen, bekommen wir für ein ATP 10 Euro, für 2 ATP 20 etc. Wenn wir aber bei einer Reaktion im Prinzip 18 Euro gewinnen könnten, würde es nicht ausreichen 2 ATP herzustellen, wir bekämen immer noch 1 ATP, da uns 2 Euro fehlen – bzw. wir würden 8 Euro verlieren. Es gibt kein Kleingeld zum wechseln und wir wären immer gezwungen unsere 10 Euro-Note zu benutzen, ungeachtet dessen, dass wir nur 2 Euro benötigen, um alles in Gang zu setzen (Lane 2009, 2010, 2014, Thauer et al. 2008, Martin & Russel 2007).
Lebewesen können aber diese 10 Euro-Währung in kleinere Einheiten einteilen und zwar mit Hilfe einer ausgeklügelten Methode, die man Chemiosmose nennt, eine Eigenschaft die auch LUCA besaß.
Allgemein ausgedrückt ist Chemiosmose ein Fluss von Protonen durch eine Membran. Bei der Zellatmung passiert folgendes. Elektronen werden von der Nahrung abgespalten und über eine Trägerkette zum Sauerstoff transportiert. Die Energie, die dabei frei wird, wird dazu benutzt, um Protonen durch eine Membran zu Pumpen. Dies hat zur Folge, dass an der Membran ein Protonengradient aufgebaut wird. Die Membran hat die Funktion eines hydroelektrischen Damms. Ähnlich wie Wasser, das von einem Reservoir in den Bergen hinabfließt, um Turbinen anzutreiben, kurbelt der Protonenfluss durch die Proteinturbinen in der Zellmembran die Produktion von ATP an. Chemiker sind es normalerweise gewohnt, mit ganzen Zahlen zu arbeiten: es ist nicht möglich, dass ein Molekül mit der Hälfte eines anderen Moleküls reagiert. Die Eigenheit der Chemiosmose ist, dass bei ihr Fragmente von ganzen Zahlen auftauchen. Wie viele Elektronen müssen übertragen werden, um ein ATP herzustellen? Etwa 8 oder 9. Wie viele Protonen? Etwa 4,33. Solche Zahlen machen keinen Sinn, bis zu dem Zeitpunkt, an dem die Zwischenschaltung eines Gradienten entdeckt wurde. Ein Gradient wird im Grunde genommen von einer Millionen Abstufungen aufgebaut: er zerbricht nicht in ganze Zahlen. Und der große Vorteil eines Gradienten ist, dass eine einzelne Reaktion immer wieder ablaufen kann, nur, um ein einziges ATP hervorzubringen. Wird bei einer bestimmten Reaktion ein Hundertstel der Energie frei, die für die Herstellung von einem ATP nötig ist, wird diese Reaktion einfach hundertmal wiederholt. Der Gradient wird dabei Schritt für Schritt aufgebaut, bis das Protonenreservoir groß genug ist, um ein einziges ATP zu bilden.
Gehen wir zurück auf die Reaktion mit CO2 und Wasserstoff. Immer noch kostet diese Reaktion ein ATP, um den Ball ins Rollen zu bringen, sie sind aber nun dazu in der Lage, mehr als ein ATP herzustellen, da sie auf ein zweites ATP sparen können. Der Unterschied besteht darin, entweder die Möglichkeit zum Wachsen zu haben oder nicht.
Warum aber der Gebrauch von Protonen und nicht z. B. Natrium, Calcium oder Kaliumionen? Es gibt keinen Grund, weshalb Protonen anstelle anderer geladener Teilchen für einen Gradienten bevorzugt werden; es gibt nämlich auch Bakterien, die lieber einen Natriumgradienten aufbauen. Der Grund könnte in den Schloten liegen: Die Schlote blasen basische Fluide in einen Ozean, der durch gelöstes CO2 sauer ist. Säuren definieren sich über Protonen: eine Säure ist reich an Protonen, eine Base arm. Demzufolge baut sich durch die einströmenden basischen Fluide in das saure Meerwasser ein natürlicher Protonengradient auf. Es ist leichter für die Entstehung des Lebens einen vorhandenen Gradienten zu nutzen, als einen komplett neuen aufzubauen.
Das alles klingt recht plausibel, doch die Abhängigkeit von natürlichen Protonengradienten bringt ihre eigenen Probleme mit sich. Wirklich schwerwiegende Probleme. Und diese haben mit dem Aufbau und der Eigenschaft der Zellmembran zu tun. Das eigentliche Dilemma, sowie der Lösung lernen wir im nächsten Beitrag kennen.
Literatur
Amend, J. P., LaRowe, D. E., McCollom, T. M., Shock, E. L. (2013): The energetics of organic synthesis inside and outside the cell. Phil. Trans. R. Soc. B 368:20120255.
Amend, J. P., McCollom, T. M. (2009): Energetics of biomolecule synthesis on early Earth. In “Chemical Evolution II: from the Origins of Life to Modern Society”. Am. Chem. Soc. Chapter 4, 63–94.
Amend, J. P., Shock, E. L. (1998): Energetics of amino acids synthesis in hydrothermal ecosystems. Science 281, 1659–1662.
Berg, I. A., Kockelhorn, D., Ramos-Vera, W. H., Say, R. F., Zarzyncki, J., Hügler, M., et al. (2010): Autotrophic carbon fixation in archaea. Nat. Rev. Microbiol. 8, 447–460.
Buckel, W., Thauer, R. K. (2013): Energy conservation via electron bifurcating ferredoxin reduction and proton/Na(+) translocating ferredoxin oxidation. Biochim. Biophy. Acta. 1827, 94–113.
Canfield, D. E., Glazer, A. N., Falkowski, P. G. (2010): The evolution and future of Earth’s nitrogen cycle. Science 330, 192–196.
Dailey, H. A., Dailey, T. A., Gerdes, S., Jahn, D., Jahn, M., O’Brian, M. R., et al. (2017): Prokaryotic heme biosynthesis: multiple pathways to a common essential product. Microbiol. Mol. Biol. Rev. 81:e00048-16.
Daniels L, Fuchs G, Thauer RK, Zeikus JG. (1977): Carbon monoxide oxidation bymethanogenic bacteria. J. Bacteriol. 132:118–26
Decker, K., Jungerman, K., Thauer, R. K. (1970): Energy production in anaerobic organisms. Angew. Chem. Int. Ed. Engl. 9, 138–158.
Ducluzeau, A. L., van Lis, R., Duval, S., Schoepp-Cothenet, B., Russell, M. J., Nitschke, W. (2009): Was nitric oxide the first deep electron sink? Trend Biochem. Sci. 34, 9–15.
Drake HL, Gossner AS, Daniel SL. (2008): Old acetogens, new light. Ann. N. Y. Acad. Sci. 1125:100–28
Ebisuzaki, T., Maruyama, S. (2017): Nuclear geyser model of the origin of life: driving force to promote the synthesis of building blocks of life. Geosci. Front. 8, 275–298.
Eggins, B. R., Brown, E. M., McNeill, E. A., Grimshaw, J. (1988): Carbon dioxide fixation by electrochemical reduction in water to oxalate and glyoxylate. Tetrahedr. Lett. 29, 945–948.
Ferus, M., Nesvorný, D., Šponer, J., Kubelík, P., Michalˇcíková, R., Shestivská, V., et al. (2015): High-energy chemistry of formamide: a unified mechanism of nucleobase formation. Proc. Natl. Acad. Sci. U. S. A. 112, 657–662.
Fuchs G. (1986): CO2 fixation in acetogenic bacteria: variations on a theme. FEMS Microbiol. Rev. 39:181–213
Fuchs G. (1989): Alternative pathways of autotrophic carbon dioxide fixation in autotrophic bacteria. In Biology of Autotrophic Bacteria, ed. HG Schlegel, pp. 365–82. Madison, WI: Sci. Tech.
Fuchs, G. (2011): Alternative pathways of carbon dioxide fixation: insights into the early evolution of life? Annu. Rev. Microbiol. 65, 631–658.
Fuchs, G., Stupperich, E. (1985): “Evolution of autotrophic CO2 fixation. In Evolution of Prokaryotes,” in FEMS Symposium, Vol. 29, eds K. Schleifer and E. Stackebrandt (London: Academic Press), 235–251
Goldford, J. E., Hartman, H., Marsland, R. III, Segrè, D. (2019): Environmental boundary conditions for the origin of life converge to an organo-sulfur metabolism. Nat. Ecol. Evol. 3, 1715–1724.
Goldford, J. E., Hartman, H., Smith, T. F., Segrè, D. (2017): Remnants of an ancient metabolism without phosphate. Cell 168, 1126–1134.
Goldford, J. E., Segrè, D. (2018): Modern views of ancient metabolic networks. Curr. Opin. Syst. Biol. 8, 117–124.
Hamilton, T. L., Bryant, D. A., Macalady, J. L. (2016): The role of biology in planetary evolution: cyanobacterial primary production in low-oxygen Proterozoic oceans. Environ. Microbiol. 18, 325–340.
Herrmann, G., Jayamani, E., Mai, G., Buckel, W. (2008): Energy conservation via electron-transferring flavoprotein in anaerobic bacteria. J. Bacteriol. 190, 784–791.
Hordijk, W., Hein, J., Steel, M. (2010): Autocatalytic sets and the origin of life. Entropy 12, 1733–1742.
Hordijk, W., Steel, M. (2004): Detecting autocatalytic, self-sustaining sets in chemical reaction systems. J. Theor. Biol. 227, 451–461.
Huber, C., Wächtershäuser, G. (1997): Activated acetic acid by carbon fixation on (Fe,Ni)S under primordial conditions. Science 276, 245–248.
Hügler M, Sievert SM. (2011): Beyond the Calvin cycle: autotrophic carbon fixation in the ocean. Annu. Rev. Mar. Sci. 3:261–89
Jabło ́nska, J., Tawfik, D. S. (2021): The evolution of oxygen-utilizing enzymes suggests early biosphere oxygenation. Nat. Ecol. Evol. 5, 442–448.
Kalson, N.-H., Furman, D., Zeiri, Y. (2017): Cavitation-induced synthesis of biogenic molecules on primordial Earth. ACS Cent. Sci. 3, 1041–1049.
Kanehisa, M., Goto, S. (2000): KEGG: kyoto encyclopedia of genes and genomes. Nucleic Acids Res. 28, 27–30.
Kauffman, S. A. (1986): Autocatalytic sets of proteins. J. Theor. Biol. 119, 1–24.
Kitadai, N., Nakamura, R., Yamamoto, M., Okada, S., Takahagi, W., Nakano, Y., et al. (2021): Thioester synthesis through geoelectrochemical CO2 fixation on Ni sulfides. Commun. Chem. 4:37.
Lane, N. (2009): Life Ascending: The Ten Great Inventions of Evolution. WW Norton/Profile, London.
Lane, N. (2010): Why Are Cells Powered by Proton Gradients? Nature Education 3(9):18
Lane, N. (2014): Bioenergetic constraints on the evolution of complex life. Cold Spring Harbor Perspectives in Biology.
Lane, N. (2017): Der Funke des Lebens Energie und Evolution. Konrad Theis Verlag
Lane, N, Martin, W. (2012): The origin of membrane bioenergetics. Cell 151: 1406–16.
Lang, S. Q., Butterfield, D. A., Schulte, M., Kelley, D. S., Lilley, M. D. (2010): Elevated concentrations of formate, acetate and dissolved organic carbon found at the Lost City hydrothermal field. Geochim. Cosmochim. Acta 74, 941–952.
Ljungdahl LG. (1986): The autotrophic pathway of acetate synthesis in acetogenic bacteria. Annu. Rev. Microbiol. 40:415–50
Magnabosco, C., Lin, L.-H., Dong, H., Bomberg, M., Ghiorse, W., Stan-Lotter, H., et al. (2018): The biomass and biodiversity of the continental subsurface. Nat. Geosci. 11, 707–717.
Marín-Yaseli, M. R., González-Toril, E., Mompeán, C., Ruiz-Bermejo, M. (2016): The role of aqueous aerosols in the “glyoxylate scenario”: an experimental approach. Chemistry 22, 12785–12799.
Martin, W. F. (2020): Older than genes: the acetyl CoA pathway and origins. Front. Microbiol. 11:817.
Martin, W., Russell, M. J. (2003): On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells. Philosophical Transactions Royal Society B 358 59–83.
Martin, W., Russell, M. J. (2007): On the origin of biochemistry at an alkaline hydrothermal vent. Philos. Trans. R. Soc. Lond. B Biol. Sci. 362, 1887–1925.
Martin, W., Sousa, F. L., Lane, N. (2014): Energy at life’s origin. Science 344: 1092–93.
Mitchell, P. (1961): Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature 191, 144–148.
Muchowska, K. B. et al. (2017): Metals promote sequences of the reverse Krebs cycle. Nat. Ecol. Evol. 1, 1716–1721.
Muchowska, K. B., Varma, S. J., Moran, J. (2019): Synthesis and breakdown of universal metabolic precursors promoted by iron. Nature 569, 104–107.
Muchowska, K. B., Varma, S. J., Moran, J. (2020): Nonenzymatic metabolic reactions and Life’s origins. Chem. Rev. 120, 7708–7744.
Muller, A. W. (1995): Were the first organisms heat engines? A New model for biogenesis and the early evolution of biological energy conversion. Prog. Biophys. Mol. Biol. 63, 193–231.
Müller, V., Chowdhury, N. P., Basen, M. (2018): Electron bifurcation: a long-hidden energy-coupling mechanism. Annu. Rev. Microbiol. 72, 331–353.
Nitschke, W., Russell, M. J. (2013): Beating the acetyl coenzyme A-pathway to the origin of life. Philos Trans R Soc Lond B Biol Sci.;368(1622):20120258.
Ozawa, K., Nemoto, A., Imai, E. I., Honda, H., Hatori, K., Matsuno, K. (2004): Phosphorylation of nucleotide molecules in hydrothermal environments. Orig. Life Evol. Biosph. 34, 465–471.
Pasek, M. A. (2020): Thermodynamics of prebiotic phosphorylation. Chem. Rev. 120, 4690–4706.
Patel, B. H., Percivalle, C., Ritson, D. J., Duffy, C. D., Sutherland, J. D. (2015): Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism. Nat. Chem. 7, 301–307.
Proskurowski, G., Lilley, M. D., Seewald, J. S., Früh-Green, G. L., Olson, E. J., Lupton, J. E., et al. (2008): Abiogenic hydrocarbon production at Lost City hydrothermal field. Science 319, 604–607.
Preiner, M., Igarashi, K., Muchowska, K. B., Yu, M., Varma, S. J., Kleinermanns, K., et al. (2020): A hydrogen dependent geochemical analogue of primordial carbon and energy metabolism. Nature Ecol. Evol. 4, 534–542.
Ragsdale SW, Pierce E. (2008): Acetogenesis and theWood-Ljungdahl pathway of CO2 fixation. Biochim. Biophys. Acta 1784:1873–98
Rother, M., Metcalf, W. W. (2004): Anaerobic growth of Methanosarcina acetivorans C2A on carbon monoxide: an unusual way of life for a methanogenic archaeon. Proc. Natl. Acad. Sci. U.S.A. 101, 16929–16934.
Russell, J. B., Cook, G. M. (1995): Energetics of bacterial growth: balance of anabolic and catabolic reactions. Microbiol. Rev. 59, 48–62.
Russell, M. J., Hall, A. J. (1997): The emergence of life from iron monosulphide bubbles at a submarine hydrothermal redox and pH front. J. Geol. Soc. (London) 154, 377–402
Russell, M. J., Hall, A. J., Mellersh, A. R. (2003): On the dissipation of thermal and chemical energies on the early Earth: The onsets of hydrothermal convection, chemiosmosis, genetically regulated metabolism and oxygenic photosynthesis, in Natural and Laboratory-Simulated Thermal Geochemical Processes, edited by: Ikan, R., Dordrecht, Kluwer Academic Publishers, 325–388
Russell, M. J., Martin, W. (2004): The rocky roots of the acetyl-CoA pathway. Trends in Biochemical Sciences 29: 358–63.
Sakurai, M., Yanagawa, H. (1984): Prebiotic synthesis of amino acids from formaldehyde and hydroxylamine in a modified sea medium. Orig. Life 14, 171–176
Schönheit, P., Buckel, W., Martin, W. (2016): On the origin of heterotrophy. Trends Microbiol. 24, 12–25.
Schramm, G., Grotsch, H., Pollmann, W. (1962): Nicht-enzymatische Synthese von Polysacchariden, Nucleosiden und Nucleinsäuren und die Entstehung selbst vermehrungsfähiger Systeme. Angew. Chem. 74, 53–92.
Schrenk, M. O., Brazelton, W. J., Lang, S. Q. (2013): Serpentinization, carbon and deep Life. Rev. Mineral. Geochem. 75, 575–606.
Schuchmann, K., Müller, V. (2014): Autotrophy at the thermodynamic limit of life: a model for energy conservation in acetogenic bacteria. Nat. Rev. Microbiol. 12, 809–821.
Sherwood Lollar, B., Heuer, V. B., McDermott, J., Tille, S., Warr, O., Moran, J. J., et al. (2021): A window into the abiotic carbon cycle – Acetate and formate in fracture waters in 2.7 billion year-old host rocks of the Canadian Shield. Geochim. Cosmochim. Acta. 294, 295–314.
Sleep, N. H., Bird, D. K., Pope, E. C. (2011): Serpentinite and the Dawn of Life. Philos. Trans. R. Soc. B 366, 2857–2869.
Smith, A. R., Kieft, B., Mueller, R., Fisk, M. R., Mason, O. U., Popa, R., et al. (2019): Carbon fixation and energy metabolisms of a subseafloor olivine biofilm. ISME J. 13, 1737–1749.
Sojo, V., Herschy, B., Whicher, A., Camprubí, E., Lane, N. (2016): The Origin of Life in Alkaline Hydrothermal Vents. Astrobiology, 16(2), 181–197.
Sousa, F. L., Hordijk, W., Steel, M., Martin, W. F. (2015): Autocatalytic sets in E. coli metabolism. J. Syst. Chem. 6, 15–21.
Sousa, F. L., Preiner, M., Martin, W. F. (2018): Native metals, electron bifurcation, and CO2 reduction in early biochemical evolution. Curr. Opin. Microbiol. 43, 77–83.
Sousa, F. L., Thiergart, T., Landan, G., Nelson-Sathi, S., Pereira, I. A. C., Allen, J. F., et al. (2013): Early bioenergetic evolution. Phil. Trans. R Soc. Lond. B 368, 20130088.
Steffens, L., Pettinato, E., Steiner, T. M., Mall, A., König, S., Eisenreich, W., et al. (2021): High CO2 levels drive the TCA cycle backwards towards autotrophy. Nature 592, 784–788.
Taylor GT, Kelly DP, Pirt SJ. (1976): Intermediary metabolism in methanogenic bacteria (Methanobacterium). In Microbial Production and Utilization of Gases, ed. HG Schlegel, G Gottschalk, N Pfennig, pp. 173–80. Göttingen, Ger.: E. Goltze KG
Thauer, R. K., Jungermann, K., Decker, K. (1977): Energy conservation in chemotrophic anaerobic bacteria. Bacteriol. Rev. 41, 100–180.
Thauer, R. K., Kaster, A. K., Seedorf, H., Buckel, W., and Hedderich, R. (2008): Methanogenic Archaea: ecologically relevant differences in energy conservation. Nat. Rev. Microbiol. 6, 579–591.
Tian, T., Chu, X.-Y., Yang, Y., Zhang, X., Liu, Y.-M., Gao, J., et al. (2019): Phosphates as energy sources to expand metabolic networks. Life 9:43.
Varma, S. J., Muchowska, K. B., Chatelain, P., Moran, J. (2018): Native iron reduces CO2 to intermediates and end-products of the acetyl-CoA pathway. Nat. Ecol. Evol. 2, 1019–1024.
Wächtershäuser, G. (1988): Pyrite formation, the first energy source for life: a hypothesis. Syst. Appl. Microbiol. 10, 207–210.
Wächtershäuser, G. (1992): Groundworks for an evolutionary biochemistry – the iron sulfur world. Prog. Biophys. Mol. Biol. 58, 85–201.
Weiss, M. C., Sousa, F. L., Mrnjavac, N., Neukirchen, S., Roettger, M., Nelson-Sathi, S., et al. (2016): The physiology and habitat of the last universal common ancestor. Nat. Microbiol. 1:16116.
Welte, C., Krätzer, C., Deppenmeier, U. (2010): Involvement of Ech hydrogenase in energy conservation of Methanosarcina mazei. FEBS J;277(16):3396-403.
Williams, T. A., Szöll ̋osi, G. J., Spang, A., Foster, P. G., Heaps, S. E., Boussau, B., et al. (2017): Integrative modeling of gene and genome evolution roots the archaeal tree of life. Proc. Natl Acad. Sci. U.S.A 114, E4602–E4611.
Wimmer, J. L. E., Vieira, A. D. N., Xavier, J. C., Kleinermanns, K., Martin, W. F., and Preiner, M. (2021a): The autotrophic core: an ancient network of 404 reactions converts H2, CO2, and NH3 into amino acids, bases, and cofactors. Microorganisms 9:458.
Wimmer JLE, Xavier JC, Vieira ADN, Pereira DPH, Leidner J, Sousa FL, Kleinermanns K, Preiner M, Martin WF (2021): Energy at Origins: Favorable Thermodynamics of Biosynthetic Reactions in the Last Universal Common Ancestor (LUCA). Front Microbiol. 13;12:793664
Woese, C. R. (2002): On the evolution of cells. Proc. Natl Acad. Sci. USA 99, 8742–8747
Wood HG. (1991): Life with CO or CO2 and H2 as a source of carbon and energy. FASEB J. 5:156–63
Xavier, J. C., Gerhards, R. E., Wimmer, J. L. E., Brueckner, J., Tria, F. D. K., Martin, W. F. (2021): The metabolic network of the last bacterial common ancestor. Commun. Biol. 4:413.
Zubay, G. (2023): The glyoxylate cycle, a possible evolutionary precursor of the TCA cycle. Chemtracts 16, 783–788.