Der gegenwärtige wissenschaftliche Konsens besteht darin, dass Vögel eine Gruppe von theropoden Dinosauriern, genauer der Maniraptora sind, die während des Mesozoikums entstanden sind. Eine enge Beziehung zwischen Vögeln und Dinosauriern wurde erstmals im neunzehnten Jahrhundert nach der Entdeckung des Archaeopteryx in Deutschland vorgeschlagen, außerdem wurden Fossilien von mehr als dreißig Arten von Nicht-Vogel-Dinosaurier mit erhaltenen Federn gesammelt. Des Weiteren haben Vögel und ausgestorbene Nicht-Vogel-Dinosaurier viele einzigartige Skelettmerkmale gemeinsam.
In dieser Episode widmen wir uns hauptsächlich dem Bauplan einiger Vogelmerkmale leiten diese aus dem Dinosaurierbauplan ab. Dabei werden wir auch hier, wie in den letzten Episoden auf einige kreationistische Kritiken eingehen.
Text als pdf
Evolutionäre Entwicklungsbiologie und ihre Rolle bei der Evolution der Vögel
Ein wesentlicher Schritt in der Evolution der Vögel war die Umfunktionierung der Gliedmaßen zu funktionstüchtigen Flügeln. Damit ging beispielsweise die Verlängerung der Extremitäten, die Reduktion der Finger und das Verschmelzen der Handwurzel- und Mittelhandknochen zu einer Knochenspange (Carpometacarpus) einher. Evolutionsgegner stellen es gern so dar, als setze jede dieser Veränderungen eine komplizierte Abfolge von Mutationen oder sogar den Erwerb komplett neuer Gene voraus. Träfe das zu, wären derlei Anpassungen langwierig und Konvergenzen unwahrscheinlich. Das ist aber nicht der Fall, denn:
Der Übergang von den Gliedmaßen zum Flügel erfordert keinen komplett neuen Satz von Genen, sondern Änderungen in der Kontrolle einiger Gene, die das Wachstum fördern oder stoppen. Diese Gene produzieren sogenannte Wachstums- und Signalfaktoren, die den Zellen in einem wachsenden Embryo Anweisungen geben. Wenn sie zu unterschiedlichen Zeiten ein- und ausgeschaltet werden, kann das die Form eines Tieres drastisch verändern (Horner & Gorman 2009, S. 11).
In diesem Zusammenhang hat die Erforschung der Variation von Aktivitäten einer begrenzen Zahl von Kontrollgenen und Signalmolekülen, die im Zusammenspiel mit Strukturgenen und Umweltbedingungen die Entwicklung des Embryos steuern, zu ganz neuen Einsichten in die Entstehung neuer Merkmale und Baupläne geführt. Mit diesen Mechanismen befasst sich die evolutionäre Entwicklungsbiologie (kurz: Evo-Devo).
Viele erstaunliche Anpassungen beruhen i. w. auf Veränderungen der zeitlichen Koordination von Entwicklungsprozessen (Heterochronien, Abb. 1).
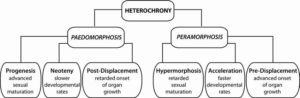
Abb. 1: Heterochronie und die daraus resultierenden verzögernden (Pädomorphose) und beschleunigenden (Peramorphose) morphologischen Auswirkungen. Progenese: Vorverlegung der Geschlechtsreife auf das Jugendstadium und frühere Beendigung der Entwicklung und des Größenwachstums. Dies hat zur Folge, dass der erwachsene Nachkomme kleiner ist, obwohl die (juvenile) Entwicklungsrate die gleiche ist wie beim Vorfahren. Neotenie: reduzierte Entwicklungsraten während der Jugendphase. Wenn auch die Geschlechtsreife verzögert wird, kann der Nachkomme größer sein als der Vorfahre (obwohl er die juvenilen Merkmale beibehält). Die Neotenie kann nur einige Strukturen (dissoziiert) oder den gesamten Körper betreffen. Postdisplacement: Verzögerung des Entwicklungsbeginns einiger Organe (ohne Beeinträchtigung der Entwicklungsraten und des Größenwachstums), die beim Nachkommen eine geringere Größe beibehalten (im Gegensatz zu anderen ausgewachsenen Strukturen und der Körpergröße). Hypermorphose: Verzögerung der Geschlechtsreife, durch die das juvenile Stadium verlängert wird (obwohl die Entwicklungsraten gleichbleiben können), so dass der Nachkomme juvenile Merkmale in einem größeren Erwachsenenstadium beibehält. Sie steht im Gegensatz zur Progenese. Akzeleration: Beschleunigung der morphologischen Entwicklung, durch die erwachsene Merkmale im juvenilen (geschlechtsreifen) Stadium erscheinen. Wenn auch die Geschlechtsreife beschleunigt (d. h. vorweggenommen) wird, erreicht der Nachkomme eine geringere Größe. Sie ist das Gegenteil von Neotenie und kann nur einige Organe oder den gesamten Körper betreffen. Vorverlagerung: Vorwegnahme des Beginns der Entwicklung einiger Organe (ohne Auswirkungen auf die Geschwindigkeit und den Zeitpunkt der Beendigung der Entwicklung), die im Vergleich zum Vorfahren eine größere Größe erreichen (trotz ähnlicher Körpergröße). Nach Ridente (2016).
Manche Mutationen beeinflussen die Aktivität von Entwicklungsgenen so, dass Jugendmerkmale bis ins Erwachsenenstadium erhalten bleiben. In einem solchen Fall spricht man von Pädomorphose. Dazu gehören zahlreiche Anpassungen der Vögel, etwa die Verringerung der Körpergröße, die relative Zunahme des Hirnschädelvolumens, der verkürzte Schnabel, die Reduktion der Zähne, die Bildung hakenförmiger Fortsätze an den Rippen, die dünnen, biegsamen, lose verbundenen Schädelknochen (Schädelkinese) und vieles andere (vgl. etwa Chatterjee 2015, S. 275, Abb. 2). Andere Mutationen, die regulatorische Gene betreffen, beschleunigen oder verlängern das Wachstum von Merkmalen. Dies kann dazu führen, dass Strukturen verschmelzen, sich ineinanderschieben oder im Vergleich zum angestammten Merkmal vergrößern.
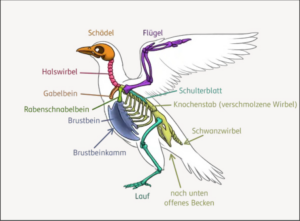
Abb. 2: Skelettbau der Vögel. Angefangen vom Schädelbau über die reduzierten Finger, die fusionierten Mittelhandknochen, den Brustbeinkamm, die verschmolzenen Mittelfuß- und Fußwurzelknochen bis hin zu den fusionierten Wirbeln erforderten die meisten Anpassungen der Vögel Änderungen in der Regulation von Genen. Nähere Erläuterungen im Text.
Plateau & Foth (2020) wiederum zeigten, dass der Schritt hin zu den hochgradig modularen, integrierten Schädeln der modernen Vögel auf einer abrupten Verschmelzung von Schädelknochen beruht (vgl. auch Felice & Goswami 2017). Phylogenetische Vergleiche deuten darauf hin, dass die Knochenfusion eine entwicklungsbedingte Übertreibung des ursprünglichen adulten Merkmals darstellt. So ähneln die Schädel jugendlicher Vögel in Anzahl und Verteilung der Module dem Erwachsenenschädel nicht-aviärer Theropoden (einschließlich Archaeopteryx) stärker als den elterlichen Schädeln.
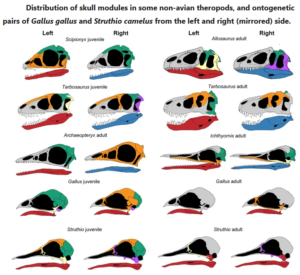
Abb. 3: Verteilung der Schädelmodule bei einigen nicht-avischen Theropoden und ontogenetische Paare von Gallus gallus und Struthio camelus von der linken und rechten (gespiegelten) Seite. Die Modularität nicht-avischer Theropoden ist zwischen verschiedenen Arten sehr ähnlich, aber auch während der gesamten Ontogenese. Juvenile Kronenvögel ähneln in Anzahl und Verteilung der Module dem Zustand der Vorfahren, während adulte Kronenvögel aufgrund der ontogenetischen Knochenfusion eine starke Reduzierung der Module aufweisen. Die Farben heben unterschiedliche Schädelmodule innerhalb der Arten hervor, bedeuten aber nicht unbedingt eine Homologie zwischen den Arten. Quelle: Plateau & Foth (2020).
Evolution des Vogelschnabels
Ein typisches Kennzeichen aller modernen Vögel ist ihr Hornschnabel (Abb. 4). Als Schnabel (Rostrum) bezeichnet man die mit verhärteten Hornscheiden (Rhamphothecae) verkleideten, zahnlosen Kieferpartien von Sauropsiden. Unter den heute lebenden Vertretern haben außer den Vögeln nur noch die Schildkröten einen Hornschnabel. Dieser findet sich auch bei einigen Dinosauriern, so auch bei den theropoden Oviraptorosauriern, aber die meisten Theropoden besaßen Kieferknochen mit Zähnen. Wie ist diese Umwandlung möglich? Die knöcherne Basis des Schnabels bildet größtenteils das gegenüber Nichtvogel-Theropoden stark vergrößerte Prämaxillare. Das Prämaxillare sitzt auf einem verkürzten Gesicht und einem bauchig vergrößerten Gehirnschädel und ist funktional in das kinetische System des Vogelschädels integriert. Die Hornscheiden bestehen aus übereinanderliegenden mehreckigen Schuppen, die überwiegend aus speziellen β-Keratinen sowie einem geringen Anteil alpha-Keratin aufgebaut sind. Mischung und Schichtdicke variieren und bestimmen die mechanischen Eigenschaften der Schnäbel (Kardong 2008, Westheide & Rieger 2010).
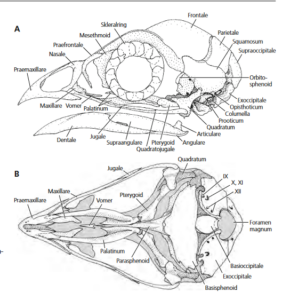
Abb. 4: Schädel. Haushuhn; Küken kurz nach dem Schlüpfen: Einzelne Skelettelemente daher noch deutlich erkennbar. A Lateralansicht. B Ventralansicht des Oberschädels. Römische Ziffern geben die Austrittsstellen von Hirnnerven an. Quelle: Westheide & Rieger (2010).
Übergangsformen wie Archaeopteryx und diverse kreidezeitliche Vögel wie Ichthyornis zeigen, dass der Schnabel nicht schlagartig entstand. Seine Bestandteile entstanden nicht simultan, sondern inkrementell und unabhängig voneinander. Zunächst fanden Schädelmodifikationen statt, die durch Pädomorphose verursacht wurden. Treten Merkmale der frühen Entwicklungsstadien (Juvenilstadien) eines Vorfahren im Erwachsenenstadium (Adultstadium) eines Nachfahren auf, wird das als Pädomorphose bezeichnet. In Bezug zur Vogelevolution sind dies die Verkürzung des Gesichts, die Verkleinerung der Maxilla (des Oberkieferknochens), die Vergrößerung des Gehirnschädels sowie eine Schrumpfung der Knochen, was zu einer bemerkenswerten Beweglichkeit (Kinese) der Schädelknochen bei Vögeln führte.
Dass es sich um Pädomorphose handelt, zeigen Schädelvergleiche zwischen jugendlichen Nichtvogel-Theropoden wie Coelophysis (Abb. 5, links unten) und basalen Vögeln wie Archaeopteryx (Abb. 5, Mitte oben). Schauen wir uns dazu Abb. 5 an:
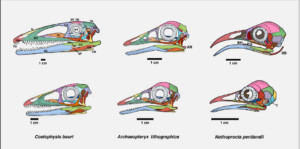
Abb. 5: Laterale Schädelansicht des Nichtvogel-Theropoden Coelophysis (linke Spalte), des ursprünglichen Vogels Archaeopteryx (mittlere Spalte) und dem rezenten Andensteißhuhn (rechte Spalte). Oben sind die Schädel der erwachsenen Tiere, unten die der juvenilen Tiere abgebildet. Die verschiedenen Schädelknochen sind farbkodiert. Man erkennt, dass der Evolution des Schnabels eine deutliche Reduktion der Maxilla (MX, dunkelgrün) vorausging. Dies schuf die Voraussetzung für die später einsetzende Vergrößerung des Prämaxillare (PM, rot), welches bei den modernen Vögeln den Oberschnabel bildet. Quelle: Bhullar et al. (2016).
Auf der linken Spalte sehen wir den ursprünglichen Theropoden Ceolophysis, in der Mitte den ursprünglichen Vogel Archaeopteryx und auf der rechten Spalte das heute noch lebende Andensteißhuhn; einer recht ursprünglichen flugunfähigen Vogelart aus Südamerika. Oben haben wir die adulten Tiere, unten die juvenilen. Die verschiedenen Schädelknochen sind farbkodiert. Man erkennt, dass der Evolution des Schnabels eine deutliche Reduktion der Maxilla (MX, dunkelgrün) vorausging. Dies schuf die Voraussetzung für die später einsetzende Vergrößerung des Prämaxillare (PM, rot), welches bei den modernen Vögeln den Oberschnabel bildet. Erwartungsgemäß wird der Übergang von dünnen, intrakraniell beweglichen Knochen zu dicken, überlappenden und fest verbunden Schädelknochen im Wachstum von Nichtvogel-Dinosauriern vollzogen und noch heute in der Ontogenese der Krokodile (Bhullar et al. 2016). Im nächsten Evolutionsschritt, mit dem Erscheinen der höheren Vögel, vergrößerte sich in verhältnismäßig kurzer Zeit das Prämaxillare und integrierte sich in das kinetische System von Schädelknochen. Studien legen nahe, dass eine funktionale Integration des vergrößerten Prämaxillare in den Schädel unter biomechanischen Gesichtspunkten erst nach der Verkürzung des Gesichts und einer deutlichen Reduktion der Maxilla durch Pädomorphose erfolgen konnte (Bhullar et al. 2016). Evolutionäre Modifikationen an Schädelmodulen wie der Prämaxillare sind nicht kompliziert. Arbeiten zur molekularen Kontrolle der Schnabelentwicklung bestätigen, dass ihre Parameter unabhängig vom Rest der Schnauze einer präzisen Kontrolle unterliegen (Schneider & Helms 2003). Letztere lässt sich durch viele Stellschrauben beeinflussen, wie etwa durch Veränderungen in der Konzentration des Transkriptionsfaktors BMP4, der u.a. das Knochenwachstum steuert, oder dem BMP-Antagonisten Noggin. Danach ermöglichen Mutationen, die den BMP-Signalweg im Oberkieferknochen beeinflussen, ein “Fine-Tuning” von Form und Größe der Schnäbel.
Über einen weiteren Evolutionsschritt, die Bildung der Hornscheiden am Schnabel, geben verschiedene Übergangsformen Aufschluss. Bei einigen kreidezeitlichen Vögeln waren zunächst nur Teile der Schnauze mit Hornscheiden ausgekleidet, ausgehend von der Schnabelspitze. Auch bei den heutigen Vögeln beginnt die Bildung zunächst in den distalen Schnabelanlagen. Ichthyornis beispielsweise besaß noch einen kleinen Übergangsschnabel mit einer zahnlosen, mit Horn bedeckten Zangenspitze, die möglicherweise als eine Art Greifwerkzeug zum Aufpicken von Nahrung diente, weiter kaudal (zum Schädel hin) noch Zähne und einen unverhornten Kiefer (Field et al. 2018, Abb. 6).
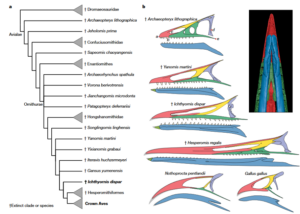
Abb. 6: Verwandtschaftsbeziehungen von I. dispar und der Ursprung des Vogelschnabels. a, Kladogramm, das die phylogenetische Position von I. dispar zeigt. b, Ursprung des Vogelschnabels. Strichzeichnungen des Rostrums der wichtigsten mesozoischen Vogelarten und Kronenvögel (phylogenetische Position siehe a). Die Punkte a-e auf dem Rostrum von A. lithographica markieren Orientierungspunkte, die für vergleichende Messungen verwendet wurden. Quelle: Field et al. (2018).
Woher stammen die Gene, die in die Bildung von Hornscheiden involviert sind? Analysen zeigen, dass bei den Vögeln mindestens 149 unterschiedliche β-Keratine an der Bildung hornartiger Strukturen wie Klauen, Schnäbel und Federn beteiligt sind; sie werden als corneous beta-proteins (CBPs) bezeichnet (Abb. 7).
Ihre Gene sind im epidermalen Differenzierungskomplex (EDC) organisiert und werden in einer bestimmten zeitlichen Abfolge exprimiert. Alle EDC-Gene sind an dem komplexen Differenzierungsprozess der Epidermis beteiligt. Sie kodieren sowohl interagierende Strukturproteine als auch regulatorische Proteine der Epidermis. Doch weder der EDC noch die CBPs entstanden in der Vogellinie de novo. Vielmehr war das Potenzial zur Ausbildung horniger Epidermalbildungen wie Klauen, Schuppen, faseriger Hautanhänge und Hornscheiden bereits in den genetischen Anlagen der frühen Dinosaurier (etwa Psittacosaurus) vorhanden. Allerdings kam es bei den Vögeln zu einer starken Expansion und Differenzierung des Genclusters.
Studien zur β-Keratin-Gen-Evolution legen nahe, dass mehrere Wellen der Genduplikation (Verdopplung von Genen) innerhalb eines einzigen Genomorts mit anschließender Diversifikation der duplizierten Gene bei Vögeln zur Entstehung von Krallen, Federn und Hornschuppen und parallel zu den Schuppen des Panzers bei Schildkröten führten (Li et al. 2013; Holthaus et al. 2017, 2019, Calvaresi et al. 2016, Ng et al. 2014). Anders gesagt, die Epidermalbildungen der Sauropsiden haben einen gemeinsamen evolutiven Ursprung, der mit der Entstehung der ersten CBPs vor mehr als 300 Mio. Jahren begann. In diesem Szenario ermöglichte eine wachsende Zahl neuer Varianten von CBP-Genen die fortschreitende Spezialisierung der Integumentstrukturen.
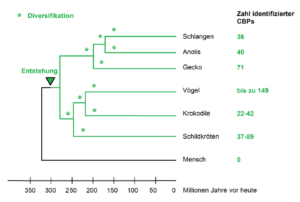
Abb. 7: Entstehung, Duplikation und anschließende Diversifikation der CBPs bei verschiedenen Sauropsiden. Nach Holthaus et al. (2019).
Nebenbei bemerkt gibt es auch Hinweise darauf, dass Schuppen und Federn auf Entwicklungsebene als homolog zu betrachten sind (Musser et al. 2015, Xie et al. 2020, Chang et al. 2020). So existieren bemerkenswerte Übereinstimmungen in der Wnt/β-Catenin-Signalgebung während der frühen Entwicklung von Federn und Reptilienschuppen, etwa hinsichtlich der Lokalisierung des Transkriptions-Kofaktors β-Catenin. Die Expression von β-Catenin ist ein zuverlässiger Marker für die Fähigkeit von Epithelien, Federanlagen und Schuppen zu bilden. Im Wesentlichen unterscheidet sich die Feder- von der Schuppen-Morphogenese dadurch, dass inkrementell weitere Differenzierungsschritte addiert wurden, wie die Follikel-Bildung, die Entstehung eines Epidermalkragens usw. (vgl. Prum 1999, Abb. 8).
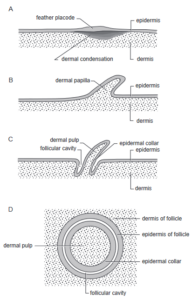
Abb. 8: Schematische Darstellung der Entwicklung eines Federfollikels. (A) Entwicklung der epidermalen Federplakode und der dermalen Kondensation. (B) Entwicklung einer Federpapille (oder einer verlängerten Federknospe) durch die Proliferation der dermalen Zellen. (C) Bildung des Federfollikels durch die Einstülpung eines Zylinders aus epidermalem Gewebe um die Basis der Federpapille (D) Querschnitt des Federfollikels durch die horizontale Ebene, die durch die gestrichelte Linie in C angezeigt wird. Der Follikel ist durch die Aneinanderreihung einer Reihe von Gewebeschichten (von der Peripherie zur Mitte) gekennzeichnet: die Dermis des Follikels, die Epidermis des Follikels (äußere Epidermisschicht), die Follikelhöhle oder das Lumen (der Raum zwischen den Epidermisschichten), der Follikelkragen (innere Epidermisschicht) und die dermale Pulpa (Gewebe in der Mitte des Follikels). Die Proliferation der Feder-Keratinozyten und der größte Teil des Wachstums der Feder findet im Follikelkragen statt.
Zähne
Alle modernen Vögel sind zahnlos (Abb. 9), aber warum?

Abb. 9: Skelett- und Lebendkonstruktionen des frühen Avialae Archaeopteryx lithographica, des Zahnvogel Hesperornis regalis und des rezenten Steißhuhns Nothoprocta pentlandii. Während des Übergangs zu den modernen Vögeln wird der Prämaxilla stark vergrößert, der Maxilla verkleinert, und das Gebiss ist eingeschränkt und verschwindet schließlich.
Frühere Studien waren zu dem Schluss gekommen, dass Vögel ihre Zähne verloren haben, um besser fliegen zu können, da so Gewicht eingespart wird (Zhou & Li 2010). Jedoch erklärt das nicht, warum eine Reihe flugunfähiger Nicht-Vogel-Dinosaurier, ebenfalls keine Zähne hatten. Andererseits wird diese Hypothese durch zahlreiche Funde von flugfähigen mesozoischen Vögeln mit Zähnen wie Pelagornithiden und Ichthyornis entkräftet.
Eine herkömmliche Hypothese für den Ursprung des zahnlosen Schnabels der Vögel führt dieses Merkmal auf ökologische Anpassungen zurück und eine Reihe neuerer Studien scheint dies zu bestätigen (Louchart & Viriot 2011, Zusi 1993, Larson et al. 2016, Cooney et al. 2017, Hieronymus & Witmer 2010, Zanno & Makovicky 2011). So zeigte eine Studie (Cooney et al. 2017), dass ökologische Anpassungen zur explosionsartigen Diversifizierung der Vogelschnäbel nach dem Massenaussterben am Ende der Kreidezeit vor 66 Millionen Jahren führten. Das K-Pg-Massenaussterben löschte jedoch auch einige zahnlose Vögel des Mesozoikums aus, was darauf hindeutet, dass ökologische Faktoren nicht die einzige Erklärung sein können (Larson et al. 2016).
Alternativ wurde die Hypothese aufgestellt, dass zahnlose Schnäbel den Schädel einiger Theropoden und Vögel verstärken (Lautenschlager et al. 2013), aber auch entwicklungsbedingte Hypothesen müssen in Betracht gezogen werden. Morphometrischen Studien an lebenden Greifvögeln haben gezeigt, dass die Schnabelform von Vögeln stark mit der Körpergröße gekoppelt ist und von nicht-ernährungsbedingten Faktoren wie spezifischen, während der Entwicklung aktiven Genen gesteuert wird (Bright et al. 2016, Felice & Goswami 2017).
In zahlreichen Studien aus der Entwicklungsbiologie wurden verschiedene genetische Mechanismen zur Erklärung der Zahnlosigkeit vorgeschlagen. Chen et al. (2000) erbrachten den Nachweis, dass Zahnlosigkeit auf eine Mutation zurückzuführen ist, die die genetischen Signalwege für die Zahnbildung in der tiefen Evolutionsgeschichte inaktiviert hat. Tatsächlich verfügen Vögel noch über einige intakte Signalwege für die Zahnbildung, was mit der Existenz von Zahnprimordien übereinstimmt. Die entwicklungsbiologischen Experimente von Chen et al. (2000) legen nahe, dass das Fehlen von Bmp4 zur Zahnlosigkeit beim Huhn beiträgt. In einer anderen Studie stellten Harris et al. (2006) die Hypothese auf, dass der Verlust der direkten Verbindung zwischen einem epithelialen Signalzentrum und dem Mesenchym für die Zahnlosigkeit der Vögel verantwortlich ist (Abb. 10). Das Mesenchym ist ein pluripotentes Grundgewebe der Embryonalzeit, von dem sich sämtliche Bindegewebe und Stützgewebe, wie Knochen, Sehnen und Blutzellen, ableiten.
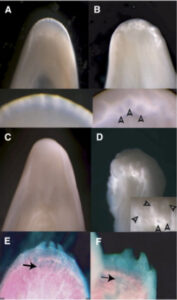
Abb. 10: Dieses Foto des mutierten Hühnerembryos zeigt, dass seine zahnähnlichen Strukturen (E und F) denen von Reptilien und einigen (inzwischen ausgestorbenen) Vögeln sehr ähnlich sind.
Die genetischen Mechanismen zur Regulation der Zahnlosigkeit hängen dabei eng mit der vorhin besprochenen Evolution des Vogelschnabels zusammen (Bhullar et al. 2016, 2015).
Eine entwicklungsgeschichtliche Erklärung für den Ursprung der Zahnlosigkeit wurde durch drei sehr aktuelle Studien anhand von Fossilien unterstützt. So wurde beim jurassischen Ceratorsaurier Limusaurus ontogenetische Studien anhand von 19 Exemplaren durchgeführt (Wang et al. 2017a). Als Ontogenese wird die Entwicklung eines Einzellebewesens, also von der Geburt bis zum Tod, bezeichnet. Die 19 Exemplare des jurassischen Theropoden können in sechs ontogenetische Stadien anhand von Körpergröße und histologischen Daten eingeteilt werden. Unter den 78 ontogenetischen Veränderungen, die man feststellen konnte, ist die unerwartetste der Wechsel von vollständig gezahnten Kiefern bei den schlüpfenden und juvenilen Individuen zu einem vollständig zahnlosen Schnabelkiefer bei den reiferen Individuen. Diese radikale morphologische Veränderung deutet auf eine Umstellung der Ernährung hin, wahrscheinlich vom Allesfresser für juvenile Limusaurus zum Pflanzenfresser für erwachsene Limusaurus, was auch durch zusätzliche Beweise aus Gastrolithen und stabilen Isotopen unterstützt wird (Abb. 11-12).
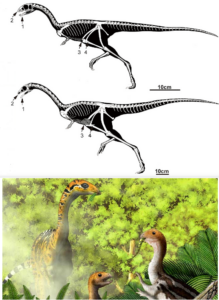
Abb. 11: Juvenile (obere) und subadulte (untere) Skelette von Limusaurus inextricabilis, die einige ontogenetisch variable Merkmale aufweisen: (1) gerades (juveniles) oder nach ventral gebogenes (subadultes) vorderes Ende des Dentale; (2) relativ tiefer (juveniler) oder länglicher (subadultes) Schädel; (3) fehlende (juvenile) oder vorhandene (subadultes) Gastrolithen; (4) kurzer (juveniler) oder länglicher (subadultes) hinterer Fortsatz des Schambeins. Man beachte auch die Zahnlosigkeit des subadulten Tieres gegenüber dem zahntragenden Jungtier. Unten eine Lebendrekonstruktion von Limusaurus
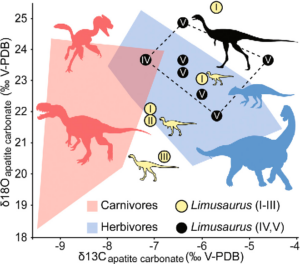
Abb. 12: Kohlenstoff-Isotopenzusammensetzung der Apatite von Limusaurus inextricabilis, Sauropoden, Ornithischianern und Theropoden, aufgetragen gegen die entsprechende Sauerstoff-Isotopenzusammensetzung von Apatitkarbonat. Polygone zeigen die Bereiche für fleischfressende (rot) und pflanzenfressende (blau) Dinosaurier aus der oberen Shishugou-Formation. Die Ziffern in den Limusaurus-Datenpunkten geben die ontogenetischen Stadien an. Die gestrichelte Linie grenzt die ontogenetischen Stadien von subadulten Limusaurus mit zahnlosen Schädeln und Gastrolithen ein.
Weitere Untersuchungen wurden an Dinosauriern aus der Gruppe der Oviraptoren und den frühkreidezeitlichen zahntragenden Vogel Sapeornis durchgeführt (Wang et al. 2017b, 2018). Bei beiden wurde eine Verkürzung der Zahnentwicklung während der postnatalen, also nach der Geburt stattfindenden, Ontogenese festgestellt. Auf der Grundlage dieser Belege wird vorgeschlagen, dass ein immer früherer postnataler und embryonaler Abbruch der Zahnbildung mit einer Ausdehnung des Keratins im Schnabel korrespondiert. Hier dürfte vor allem auf Peramorphose zurückzuführen sein, also Entwicklungsreihen, in denen Adultstadien (hier die Zahnlosigkeit) einen immer früheren Platz in der Ontogenese zugewiesen bekommen.
Die Abfolge verschiebt sich also im Laufe der Phylogenie zu einem früheren Zeitpunkt der Entwicklung, bis beim Schlüpfen kein Gebiss mehr vorhanden ist und die Odontogenese durch die Schnabelbildung in Ei gehemmt wird.
Und hier hat eine Forschergruppe herausgefunden, dass Vögel ihre Zähne aufgegeben haben, um das das Ausbrüten der Eier zu beschleunigen (Yang & Sander 2018).
Mittlerweile sind immer mehr Daten über die Inkubationszeit von Dinosauriern aus einer immer größeren Anzahl von Dinosaurier-Embryonen verfügbar, die in verschiedenen Entwicklungsstadien erhalten sind (Erickson et al. 2017).
Alle Dinosaurier schlüpften aus Eiern, und die Inkubationszeit ist eines der entscheidenden Merkmale in der Fortpflanzungsbiologie eierlegender Amnioten. Die Inkubationszeit ist von großer evolutionärer Bedeutung (Erickson et al. 2014, Ruxton et al. 2014, Werner & Griebeler 2013). Eine schnelle Bebrütung verringert das Risiko der Eimortalität durch Raubtiere, Krankheiten und Naturkatastrophen. In der Vergangenheit wurden die Inkubationszeiten von Dinosauriern anhand von Vogelmodellen auf 45 bis 82 Tage geschätzt, aber Erickson et al. (2014) liefern nun den direkten Gegenbeweis. Dieser Beweis sind die Ebner-Linien (Abb. 13). Als Ebner-Linien werden die durch die phasenweise Mineralisation des Dentins entstehende Linienmuster im mikroskopischen Schnittbild (“Baumringe”) des Zahns bezeichnet.
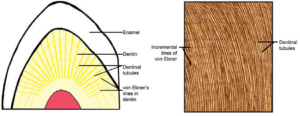
Abb. 13: Ebner-Linien
Man untersuchte die Ebner-Linien von zwei Dinosauriern, den Ceratopsier und Hadrosaurier. Die Anzahl der von Ebner-Linien in Protoceratops-Embryonen aus der späten Kreidezeit in der Mongolei und in Hypacrosaurus-Embryonen aus Kanada weist darauf hin, dass diese Dinosaurier die für moderne Reptilien typischen langen Inkubationszeiten von drei bis sechs Monaten hatten (Abb. 14). Was verlängert die Inkubationszeit der Eier bei diesen Ceratopsiern und Hadrosauriern, die vergleichbar mit jenen vieler Reptilien ist? Nach den Angaben der Forscher sind das die Zähne, da die Geschwindigkeit der Zahnbildung im Embryo der begrenzende Faktor ist. Die Analyse der Ebner-Linien zeigt, dass der Prozess des Zahnwachstums etwa 60% der Brutzeit eines Eis in Anspruch nehmen kann. Im Vergleich zur mehrmonatigen Inkubationszeit von Dinosaurier-Eiern schlüpfen moderne Vögel bereits nach wenigen Tagen oder Wochen. Das liegt daran, dass nicht gewartet werden muss, bis der Embryo Zähne entwickelt. Es ist möglich, dass die (evolutionäre) Selektion auf Zahnverlust (bei Vögeln) ein Nebeneffekt der Selektion auf schnelles Embryowachstum und damit auf eine kürzere Inkubationszeit war (Abb. 15).
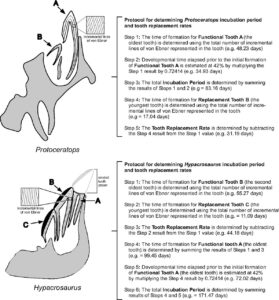
Abb. 14: Bestimmung der Inkubationszeit und der Zahnersatzrate bei embryonalen Dinosauriern. Das embryonale Gebiss von Protoceratops andrewsi und Hypacrosaurus stebingeri weist eine unterschiedliche Anzahl funktioneller Zähne in jeder Zahnfamilie auf und erfordert unterschiedliche Methoden zur Bestimmung der Inkubationszeit. P. andrewsi (oben) hat einen einzigen funktionsfähigen Zahn und einen einzigen Ersatzzahn. Die Bildungszeit für die am weitesten entwickelten funktionellen Zähne im Gebiss wurde mit 58 % der gesamten Inkubationszeit modelliert. Mit anderen Worten: Die Zähne, die das funktionelle Gebiss des Schlüpfers ergänzen sollen, wurden als 42 % der Entwicklungszeit angelegt. Bei H. stebingeri (Lower) gibt es zwei funktionsfähige Zähne und einen einzigen Ersatzzahn. Die Zeit, die für die Bildung des funktionalen Gebisses des Schlüpflings verstrichen ist, erfordert ebenfalls die Bestimmung der Anzahl der Tage, die für die Bildung des ältesten Zahns benötigt wurden. Die Krone dieses Zahns ist jedoch durch das Kauen in ovo abgenutzt. Daher ist eine Teilmenge der inkrementellen Linien im Zahn ausgelöscht worden, und seine Entstehungszeit kann nicht anhand der Gesamtzahl der Linien bestimmt werden. Er ist jedoch um einen einzigen Ersetzungszyklus älter als der nächstjüngere Funktionszahn. Durch die Alterung dieses Zahns und die Addition der Zahnerneuerungsrate ergibt sich die Prägezeit für den ältesten funktionsfähigen Zahn. Wenn man diesen Wert mit der Überlegung verbindet, dass dieser Zahn 42 % der Inkubationszeit durchlaufen hat, erhält man eine Schätzung der gesamten Inkubationszeit.
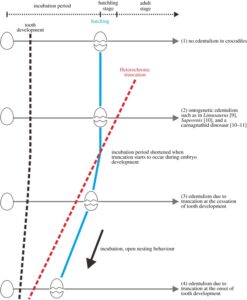
Abb. 15: Schematische Darstellung der hypothetischen vier Stadien der Entwicklung der Zahnlosigkeit. Stufe 1, weder Zahnlosigkeit noch heterochrone Abtrennung der Zahnbildung. Stadium 2: Ontogenetische Zahnlosigkeit, heterochrone Abtrennung des Zahnersatzes nach dem Durchbruch der funktionellen Zahngenerationen. Stadium 3, vollständige Zahnlosigkeit, heterochroner Abbruch bei Beendigung der embryonalen Zahnbildung. Stufe 4, vollständige Zahnlosigkeit, heterochrone Abtrennung erfolgt zu Beginn der embryonalen Zahnbildung, wie die Existenz von Zahnprimordien bei modernen Vögeln zeigt.
Es ist aber einzuräumen, dass diese Hypothese nicht mit der Zahnlosigkeit bei Schildkröten vereinbar ist, die trotz Zahnlosigkeit immer noch eine lange Inkubationszeit haben. Hier spielen aber auch phylogenetische Aspekte eine Rolle (Deeming et al. 2006). Schildkröten haben nicht das komplexe Brutverhalten theropoder Dinosaurier, welches übrigens auch komplexer ist als das der meisten anderen Dinosaurier (Varricchio & Jackson 2016). Des Weiteren gehen die Belege für Brutverhalten mit jenen für Endothermie („Warmblütigkeit“), schnellem Wachstum und der Existenz von Federn einher – Merkmale die bei Schildkröten fehlen (Koschowitz et al. 2014, Erickson 2014).
Finger
Der wohl wichtigste Einwand gegen die Tatsache, dass Vögel Dinosaurier seien, liegt nach Ansicht mancher Kritiker an den Fingern. Fortgeschrittene Theropoden, ebenso wie heutige Vögel, besitzen drei Finger, während ursprüngliche Theropoden noch fünf Finger besaßen (Abb. 16).
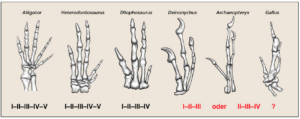
Abb. 16: Schematische Darstellung der Finger-Reduktion bei verschiedenen Archosauriern. Die Zahlen spiegeln die Zählweise der Finger beginnend mit dem Daumen zur Handaußenseite wider. Zeichnung von James Paul Baello, zusammengestellt nach Welten et al. (2005) und Čapek et al. (2014).
Es wurde argumentiert, dass die Finger der Vögel die Zeige, Mittel- und Ringfinger, also die Finger II, III und IV sind. Theropoden hingegen haben die Finger I, II und III, also Daumen, sowie Zeige- und Mittelfinger.
Diese Beobachtung basiert auf embryologischen Untersuchungen, bei der sich bei Vögeln zuerst der Ringfinger ausbildet und am Ende die Finger II-IV erhalten bleiben, während Daumen und kleiner Finger reduziert werden. Diese Sicht wird u. a. von Alan Feduccia vertreten (Burke & Feduccia 1997), der zu der „birds are not dinosaurs“-Bewegung gehört. Diese Bewegung zeichnet sich dadurch aus, jegliche Verbindung zwischen Vögeln und Dinosauriern zu leugnen. Stattdessen seien die Vögel von anderen Archosauriern aus der Trias entstanden. Jegliche Ähnlichkeit zwischen Vögeln und Dinosauriern sei durch konvergente Evolution zu erklären.
Es scheint eigenartig zu sein, zu behaupten, dass ein einzelnes Merkmal, hier die Finger, eine Liste von Dutzenden oder Hunderten anderer Merkmale übertrumpfen kann. Der starke Beweis für die Einbettung der Vögel in die Coelurosaurier muss entweder bedeuten, dass die vorgeschlagene Formel II-IV für die Hand der Vögel falsch ist, oder dass ein ungewöhnliches embryologisches Ereignis – ein so genannter Frameshift – in der Evolution der Theropoden stattgefunden hat. Dazu gleich mehr.
Wie unehrlich Feduccia arbeitet zeigt übrigens folgendes Beispiel. Da für Deinonychosaurier und Oviraptorosaurier Flügelfedern bekannt sind, haben Feduccia und Kollegen in jüngerer Zeit argumentiert, dass gefiederte Maniraptoren sekundär flugunfähige Mitglieder der Avialae sind, und damit eine jahrzehntelange Argumentation aufgegeben, in der sie behaupteten, dass Deinonychosaurier nicht ansatzweise was mit Vögeln zu tun haben (Feduccia 2002; Martin 2004; Feduccia et al. 2007). Was die Hypothese von Feduccia unhaltbar macht, ist ihre Folgerung, dass diese gefiederte Maniraptorengruppe nun auf einmal keine enge Verwandtschaft mit dem Rest der Dinosaurier aufweist. Es ist schwierig, dies ernst zu nehmen, wenn man bedenkt, dass nicht-aviale Maniraptoren offensichtliche Affinitäten zu nicht-avialen Coelurosauriern haben, die wiederum Affinitäten zu nicht-coelurosaurischen Theropoden haben, und so weiter und so weiter.
Die dreistrahlige Theropoden-Hand hat sich laut Lehrmeinung aus einer lateralen Reduktion der Finger gebildet: Der fünfte und der vierte Finger haben sich zurückgebildet, wodurch nur der erste, der zweite und der dritte Finger bestehen blieben. Diese Hypothese basiert auf anatomischen Merkmalen der Fingerglieder, die sich sowohl bei der ursprünglichen, fünfstrahligen Hand als auch bei der moderneren, dreistrahligen Hand beobachten lassen (Chatterjee 1998).
Wenn die Vogelhand tatsächlich eine andere Fingerkonfiguration aufweist als die der Nicht-Vogel-Theropoden, muss dies keineswegs gegen eine Verwandtschaft der beiden sprechen. So haben einige Autoren eine Frameshift, also eine Verschiebung des genetischen Bezugssystems, vorgeschlagen (Wagner & Gauthier 1999; Abb. 17). Das bedeutet, dass Zeige-, Mittel- und Ringfinger der Vögel in der Embryonalentwicklung den zur Verfügung stehenden Platz der reduzierten übrigen Finger ausnutzen und weiter nach innen wachsen. Dies führt dazu, dass die biomechanisch verlagerten Finger (II-III-IV) unter den Einfluss veränderter Signalfaktor-Konzentrationen geraten und das Genexpressionsmuster, sowie die Identität der inneren Finger (I-II-III) annehmen. Wenn ein solcher Frameshift stattgefunden hat, ging der echte Finger I verloren und der echte Finger II wurde zu Finger I.
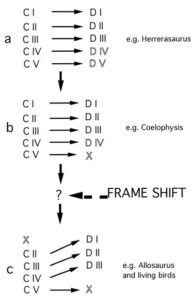
Abb. 17: Hypothese über die stammesgeschichtliche Entwicklung der Finger, die von einer fünfstelligen Theropodenhand (z. B. Herrerasaurus) zu der dreistelligen Hand von Allosaurus und den Maniraptoren einschließlich der lebenden Vögel führt. (A) Herrerasaurus hat fünf Finger (DI-DV), aber nur drei sind funktionsfähig (DI-DIII, fett gedruckt) und die übrigen sind rudimentär (DIV und DV, umrandet). Man geht davon aus, dass Herrerasaurus dem üblichen Muster der Amnioten folgte, bei dem sich die Verdickung CI zu Finger DI entwickelt usw. (B) Die nächste Evolutionsstufe ist der Verlust von Finger DV, wie am Beispiel von Coelophysis zu sehen ist. Coelophysis hat drei funktionelle Finger, DI-DIII, und einen rudimentären Finger, DIV. Man geht davon aus, dass dieser Schritt auf einen sekundären Verlust des Fingers DV zurückzuführen ist, bei dem sich die Verdickung CV bildet, sich aber nicht zu einem Finger ausdifferenziert. Verdickung CV bildet sich auch noch während der Handentwicklung lebender Vögel (1), wird aber nicht vollständig chondrifiziert und schließlich absorbiert. Gelegentlich findet sich ein Rest von DV in einigen wenigen Individuen von Coelophysis, was zeigt, dass CV von frühen Theropoden bis zu lebenden Vögeln erhalten bleibt. (C) Der Übergang von einer vier- zu einer dreistelligen Hand, repräsentiert durch Allosaurus, führt schließlich zum Verlust der Verdickung CI, wie in der Entwicklung der lebenden Vögel gezeigt. Während dieses Übergangs, so die Hypothese, kommt es zu einer Rahmenverschiebung, die CII in die Entwicklungsbahn der Finger DI, CIII in DII und CIV in DIII zwingt. Diese Hypothese bringt die Ergebnisse der vergleichenden Anatomie, die zeigen, dass die verbleibenden drei Finger der Vögel die Finger DI, DII und DIII sind, mit den embryologischen Daten in Einklang, die zeigen, dass sich diese Finger aus den Verdickungen CII, CIII und CIV entwickeln.
Da die Embryonalentwicklung aller Lebewesen von nur wenigen allgemeinen Signalfaktoren kontrolliert wird, ist solch ein Frameshift sehr plausibel. Zu solchen Signalfaktoren zählen unter anderem Proteine der Familien HOX, Wnt, Hedgehog, TGFβ und ihre Liganden, wie das Wachstumshormon BMP4. Sie beeinflussen kontextabhängig die Expression hunderter Gene. So spielt in die Entwicklung der Hand der Signalfaktor Sonic Hedgehog (Shh) eine Schlüsselrolle. Sein Gen wird nur auf einer Seite der Hand aktiviert; die Shh-Konzentration ist auf der Handaußenseite am höchsten und nimmt Richtung Handinnenseite ab. Die verschiedenen Fingeranlagen passen ihre Genexpression (und damit ihre Entwicklung) der Shh-Konzentration in ihrer Umgebung an. Sie gewinnen durch Shh sozusagen Information darüber, wo sie sich befinden und wie sie sich zu entwickeln haben (Čapek et al. 2014).
Feduccias Hypothese blieb auch nicht unwidersprochen (vgl. Chatterjee 1998, Tamura et al. 2011). Einige Studien stützen die 1-2-3-Konfiguration der Vogelfinger, sehen also eine Identität zwischen Theropodenhand und Vogelhand. Die Hox-Gene weisen darauf hin, dass die Kondensationsachse für den ersten embryonalen Handfinger bei Vögeln ein Hox-Signal erhält, das normalerweise mit dem Finger I assoziiert wird (Salinas-Saavedra et al. 2014, Vargas und Fallon 2005). Die Forschung hierzu ist tatsächlich nicht abgeschlossen. Erschwert wird dies durch die Tatsache, dass es bisher nicht möglich ist an fossilen Dinosaurierembryonen die Entwicklung der Finger zu studieren.
Tatsächlich kann auch hier der schon beim Zahnverlust vorgestellte Dinosaurier Limusaurus Abhilfe verschaffen. Limusaurus weist einen stark reduzierten ersten Finger auf, was eine bilaterale (zweiseitige) Reduktion der Finger anzeigt, bei der sich Daumen und der fünfte Finger zurückbildeten, wobei die Finger 2, 3 und 4 die längsten waren (Abb. 18). Diese Entdeckung könnte darauf hinweisen, dass die Hand der moderneren Theropoden sowie der Vögel durch bilaterale Reduktion entstand, und dass es sich bei den drei Fingern der Theropodenhand tatsächlich um den zweiten, dritten und vierten Finger handelte, und nicht um den ersten, zweiten und dritten Finger (Xu et al. 2009, Xu & Mackem 2013, Dal Sasso et al. 2018, Tamura et al. 2011). Diese Hypothese der bilateralen Reduktion wurde bereits von Thulborn & Hamley (1982) aufgestellt, fand in Wissenschaftskreisen jedoch wenig Beachtung.

Abb. 18: Theropoden-Handmorphologien, wie sie von mehreren nicht-avischen Theropoden dargestellt werden. a, b, Ceratosaurier Limusaurus (IVPP V 15923 und 15924); c, basaler Theropode Dilophosaurus (UCMP 37302); d, Tyrannosauroide Guanlong (IVPP V14531); e, Dromaeosaurier Deinonychus (YPM 5206). 1, dorsolateraler Fortsatz; 2, Mittelhandknochen IV liegt ventral von Mittelhandknochen III. Man beachte, dass die drei Mittelhandknochen von Guanlong und Deinonychus viele Ähnlichkeiten mit den Mittelhandknochen II-IV von Limusaurus und Dilophosaurus aufweisen. Interessanterweise wurden viele Merkmale des Mittelhandknochens, wie z. B. die Kontakte zwischen den drei Mittelhandknochen und die Morphologie des seitlichen Mittelhandknochens, früher als Synapomorphien der Tetanurae angesehen, können aber in Wirklichkeit besser als unverändert gegenüber dem Zustand bei nicht-tetanuranischen Theropoden interpretiert werden, wenn die drei Mittelhandknochen der Tetanurae als II-III-IV interpretiert werden.
Wenn man bedenkt, dass Nicht-Vogel-Theropodenhände durchaus bemerkenswert sind, schließlich haben wir ja auch Formen mit nur zwei oder gar einem Finger, dürfte eine entwicklungsbiologische Variation nicht ausgeschlossen sein. Dabei ist wichtig zu betonen, dass selbst Wissenschaftler, die die Indexierung der Vogelfinger als Zeige-, Mittel- und Ringfinger (II-III-IV) favorisieren (Čapek et al. 2014, De Bakker et al. 2021), keine Unvereinbarkeit mit der Theropoden-Abstammung feststellen – mit Ausnahme von Alan Feduccia und den Kreationisten.
Vogelbecken
Eine Besonderheit in der Klassifikation der Dinosaurier ist, dass Vögel zu den Echsenbecken-Dinosauriern (Saurischia) gehören, während die Vogelbecken-Dinosaurier, zu denen Gattungen wie Stegosaurus und Triceratops gehören, gar nicht mit den Vögeln verwandt sind. Die Ähnlichkeit zwischen dem Becken des Vogelbeckendinosaurier und der Vögel liegt in der Position des Schambeins (Abb. 19). Anders als bei den Echsenbeckendinosauriern zeigt das Schambein (Pubis) bei den Vogelbeckendinosauriern nicht nach unten und leicht nach vorn zum Kopf, sondern besteht aus einem schmalen, stabförmigen Knochen, der längs neben dem Sitzbein (Ischium) liegt und nach hinten zeigt. Bei Vögeln ist das Schambein komplett nach hinten verlagert.
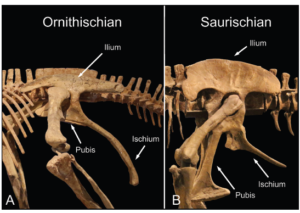
Abb. 19: Becken der Ornithischia und Saurischia
Dennoch: es gibt einige Echsenbecken-Dinosaurier, deren Position des Schambeins weiter nach hinten reicht: nämlich bei den Maniraptoren (Abb. 20). Es zeigt sich also eine zunehmende Verlagerung des Schambeins nach Hinten in die „vogelartige“ Position. Diese schrittweise Umwandlung ist durch einen hervorragenden Fossilnachweis gut dokumentiert.
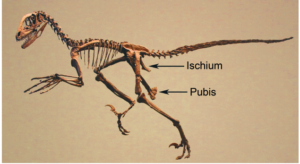
Abb. 20: Das Skelett von Deinonychus antirrhopus zeigt das für Maniraptora diagnostische nach hinten gerichtete Schambein.
In neuen Forschungsarbeiten haben Wissenschaftler der Universität Yale embryologische Bildgebungsverfahren eingesetzt, um das Beckengewebe von Vögeln in 3D zu untersuchen, was einen direkten Vergleich mit dem Fossilnachweis ermöglicht (Griffin et a. 2022, Abb. 21). In ihrer Studie untersuchten sie die Entwicklung des Beckens bei Alligatoren, Haushühnern, japanischen Wachteln, chilenischen Tinamou und Sittichen und verglichen ihre Entwicklungsstadien mit denen von Dinosauriern, einschließlich des Archaeopteryx. Sie markierten embryonale Becken mit Antikörpern, um nach Proteinen zu suchen, die in sich entwickelnden Knorpeln, Bindegewebe, Skelettmuskeln und Nerven exprimiert werden.
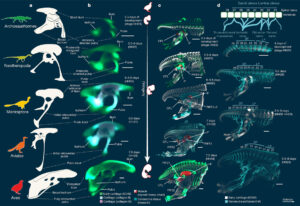
Abb. 21: Embryoserie der japanischen Wachtel (Coturnix coturnix japonica), die den Übergang von den angestammten zu den abgeleiteten Beckenstadien während der Ontogenese der Vögel vor dem Schlüpfen zeigt: (a) Beckenrekonstruktionen entlang des evolutionären Übergangs zu lebenden Vögeln; beachtet, dass die Becken als Beispiele für Merkmalszustände gezeigt werden und nicht eins zu eins mit den ontogenetischen Stadien übereinstimmen; (b) während der Ontogenese verlängert sich das Darmbein zuerst nach hinten und dann nach vorne, das Schambein wird retrovertiert, der Schwanz wird relativ reduziert und ein vorübergehender Schambeinschuh erscheint in mittleren ontogenetischen Stadien; (c) der CFL (M. caudofemoralis longus homologus) ist in den frühen ontogenetischen Stadien groß; der IF (M. iliofemoralis homologus) entspringt kleiner und weiter hinten am Darmbein, bevor er sich nach vorne zum abgeleiteten Zustand ausdehnt und sich nie in zwei Muskeln aufspaltet, wie es beim Erwachsenen der Fall ist; und PIFE1+2 (Mm. puboischiofemoralis externus 1 und 2 Homologe) differenzieren sich erst nach der Rückbildung des Schambeins vollständig aus; nicht hervorgehobene Muskeln sind grau hinterlegt; (d) die Anordnung der abgeleiteten Beckenwirbelnerven bei Vögeln (oben), mit zusätzlichen Spinalnerven, die zum Sakralplexus und zu den Nerven bei Coturnix-Embryonen beitragen (unten). Maßstabsbalken – 1 mm in (b und d), 2 mm in (c). Bildnachweis: Griffin et al., doi: 10.1038/s41586-022-04982-w.
Anschließend erstellten die Forscher mit Mikroskopen und CT-Scans 3D-Bilder des Beckens, der Muskeln und der Nerven. Sie stellten fest, dass das Becken der Vögel ein Beispiel für die “terminale Addition” (Gould 1977) ist, einen biologischen Mechanismus, bei dem die Merkmale der Vorfahren erst spät in der Entwicklung eines Tieres auftreten. Anders ausgedrückt: ein jeder Vogel fängt mit einem Dinosaurierbecken an. Dies ist insofern überraschend, da viele wichtige Merkmale beim Übergang von Dinosauriern zu Vögeln, wie z. B. der Vogelschnabel, schon früh in der Embryonalentwicklung eines Vogels auftreten. Innerhalb von nur zwei Tagen verändert sich der sich entwickelnde Embryo in einer Weise, die widerspiegelt, wie er sich im Laufe der Evolution verändert hat, indem er vom Aussehen eines frühen Dinosauriers zum Aussehen eines modernen Vogels übergeht.
Die Evolution der Furcula
Im Zusammenhang mit dem Vogelflug ist eine Struktur im Skelett der Vögel entscheidend: die Furcula, auch Gabelbein genannt (Abb. 22).
Das Gabelbein ist ein V- oder U-förmiger Mittellinienknochen, der durch die Verschmelzung der beiden Schlüsselbeine gebildet wird. Es wird in drei anatomische Bereiche unterteilt: die Symphyse, die Rami und die epikleidealen Fortsätze. Die Symphyse (sensu Baumel & Witmer 1993) befindet sich an der Mittellinie und stellt den Bereich der Verschmelzung der beiden primären Schlüsselbeine. Bei Vögeln dient er in erster Linie der Stärkung des Brustskeletts, um den Strapazen des Fluges standzuhalten.
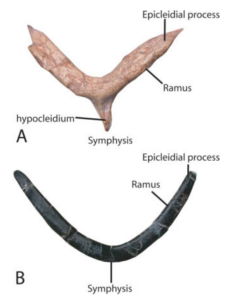
Abb. 22: Terminologie zur Beschreibung des Gabelbeins mit Beispielen von (A) Oviraptor philoceratops (AMNH FR 6517) und (B) Bambiraptor feinbergorum (AMNH FR 30554).
Seit die enge evolutionäre Verwandtschaft zwischen Vögeln und Dinosauriern zum ersten Mal behauptet wurde (Huxley 1868, 1870), war das Vorhandensein des Gabelbeins ein wichtiger Bestandteil der Debatte. Generell sind die Schlüsselbeine bei Dinosauriern reduziert oder nicht vorhanden bzw. nicht entdeckt worden, weswegen man auch früher annahm, dass Theropoden keine besaßen.
Der Brustgürtel der Ur-Archosaurier besteht aus paarigen, dorsal gelegenen Schulterblättern (Scapula), paarigen, ventral gelegenen Rabenbeinen (Coracoid), einem unpaarigen Interclavicula in der Mittellinie und paarigen Schlüsselbeinen (Clavicula). Schlüsselbeine sind in den Archosaurier-Schwestergruppen Lepidosauromorpha und Sphenodontia vorhanden. Innerhalb der Pseudosuchia fehlen die Schlüsselbeine bei den Crocodylomoprha (Benton & Clark 1988). Bei den Ornithodira sind Interclavicula, Schlüsselbeine und Brustbein (Sternum) bei den Pterosauriern verschmolzen (Wild 1993), während die Schlüsselbeine bei Scleromochlus (Benton 1999) oder Dinosauromorpha wie Silesaurus (Dzik 2003) und Marasuchus (Sereno & Arcucci 1994) nicht bekannt sind.
Das Fehlen eines Gabelbeins bei Dinosauriern wurde als wichtiger Beleg für die Ablehnung der vermuteten Verwandtschaft mit den Vögeln angesehen, welches vor allem in der Arbeit von Heilmann (1926) attestiert wurde.
Seit Heilmanns Monographie wurden Jedoch nicht nur Schlüsselbeine, sondern auch die zum Gabelbein verwachsenen Schlüsselbeine verschiedenen Theropodengruppen entdeckt, darunter (Abb. 23):
Coelophysiden (Downs 2000, Rinehart et al. 2007, Tykoski et al. 2002), Abelisauriden (Bonaparte et al. 1990), Spinosauroiden (Lipkin et al. 2007, Lipkin & Sereno 2002), Carcharodontosauriern (Coria & Currie 2006), Allosauroiden (Chure & Madsen 1996, Sereno et al. 2008), Compsognathiden (Hwang et al.2004), Tyrannosauriden (Brochu 2003, Larson & Rigby 2005, Lipkin et al. 2007, Makovicky & Currie 1998), Oviraptoriden (Ji et al. 1998, Zhou et al. 2000, Barsbold 1981, 1983, Clark et al. 2001, Lü 2002, Lü et al. 2005), Therizinosauriern (Xu et al. 1999a, Kirkland et al. 2005, Zhang et al. 2001), Dromaeosauriden (Norell et al. 1997, Xu et al. 1999b, 2000, Burnham et al. 2000, Makovicky et al. 2005, Hwang et al. 2002, Norell & Makovicky 1999), Troodontiden (Xu & Norell 2004, Russell & Dong 1993) sowie Archaeopteryx und anderen Avialae (Ostrom 1976, Mayr et al. 2007, Zhou & Zhang 2001, 2002a, b, 2003, 2005, Ji et al. 1999, 2002, Hou et al. 1995, Chiappe et al. 1999, Sanz & Bonaparte 1992, Sanz & Buscalioni 1992, Sanz et al. 1995, Chiappe & Calvo 1994, Clarke 2004, Clarke et al. 2006, Hou & Liu 1984, You et al. 2006).
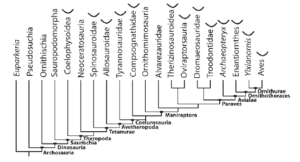
Abb. 23: Beziehungen zwischen den Hauptkladen der Theropoden. Beziehungen aus Smith et al. (2007), der neuesten TWiG-Matrix in Turner et al. (2007) und Clarke et al. (2006). Das kleine Furcula-Symbol zeigt an, welche Kladen mindestens ein Mitglied mit einer eindeutigen Furcula haben.
Aber: Angesichts des Fehlens von Schlüsselbeinen in den Dinosaurier-Vorläufergruppen wurde die Homologie des Schlüsselbeins der Theropoden mit jenen der Vögel angezweifelt (Bryant & Russell 1993). Dies liegt aber aufgrund falsch interpretierter Daten.
Da bei fast allen Theropodengruppen mittlerweile Gabelbeine entdeckt wurden, gilt die Homologie mit den Vögeln als sicher. Darüber hinaus hat die Entdeckung von Schlüsselbeinen, die nicht zum Gabelbein verwachsen sind, bei Sauropodomorpha (Yates & Vasconcelos 2005, Tschopp & Matteus 2013) und einigen Ornithischia (Chinnery & Weishampel 1998, Brown & Schlaikjer 1940, Sternberg 1951, Sereno 1990, Morschhauser et al. 2018, Averianov et al. 2006, Norman 2020, Spencer et al. 2020, Radermacher et al. 2021) Vergleiche innerhalb der Dinosaurier im Allgemeinen ermöglicht (Abb. 24 & 25).
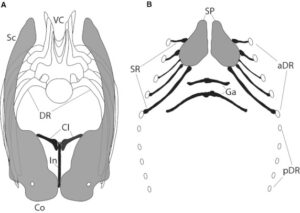
Abb. 24: Rekonstruktion des Brustgürtels und der Brustregion eines unbestimmten diplodociden Sauropoden auf der Grundlage fossiler Funde. Vordere (a) und ventrale (b) Ansicht. Abkürzungen: aDR, vordere dorsale Rippen; Cl, Clavicula (Morphotyp B); Co, Coracoid; DR, dorsale Rippe; Ga, Gastralia (Morphotyp D); In, Interclavicula (Morphotyp A); pDR, hintere dorsale Rippen; Sc, Scapula; SP, Sternumplatten; SR, Sternumrippen (Morphotypen C und E); VC, Wirbelsäule. Abgeändert von Schwarz et al. (2007; a) und Filla & Redman (1994; b). Quelle: Tschopp & Matteus (2013)
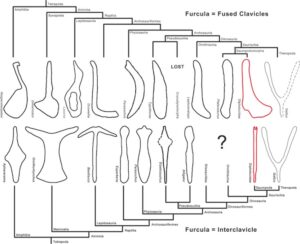
Abb. 25: Evolution der Furcula, Vergleich zwischen den beiden Hypothesen. Man beachte die Lücke innerhalb der Dinosauriformes bei der Furcula-Interclavicle-Hypothese. Eaton & Stewart (1960: Hesperoherpeton); Chatterjee (1978: Parasuchus); Klima (1987: Ornithorhynchus); Rieppel (1992: Lacerta); Steyer et al. (2000: Aphanerama); Benton & Walker (2002: Erpetosuchus); Martz (2002: Typothorax); Vickaryous & Hall (2010: Dimetrodon; 2010: Alligator, Basilicus, Gallus, Leptoceratops); Remes (2008: Euparkeria); Dilkes & Sues (2009: Doswellia).
Die entdeckten, gut erhaltenen und artikulierten Exemplare vieler Theropoden ermöglichen nicht nur den Nachweis eines Gabelbeins bei diesen, sondern zeigen zum einen Spezialisierungen bei bestimmten Gruppen auf, als auch einen Übergang hin zu dem Gabelbein moderner Vögel (Makovicky & Currie 1998). Dies ermöglicht nicht nur einige Synapomorphien der Details der Gabelbeinanatomie der Theropoden zu entdecken, sondern auch umfangreiche phylogenetische Analysen durchzuführen (Gauthier 1986, Rauhut 2003, Livezey & Zusi 2006, 2007, Clarke et al. 2006, Nesbitt et al. 2009).
Die evolutionäre Umwandlung des Gabelbeins aus separaten Schlüsselbeinen ist bei den Archosauriern und ihren nahen Verwandten, wie Euparkeia sehr schön zu sehen. Bei Euparkeria und den frühen Pseudosuchern sind sowohl die Interclavicula als auch die Schlüsselbeine erhalten geblieben. Die Interclavicula gehen bei den Dinosauriern oder bei den frühen Dinosauromorpha verloren. Von dort aus ist der Ursprung des Gabelbeins durch die Entdeckung an basalen Sauropodomorphen (Yates & Vasconcelos 2005) und bei frühen Theropoden (Tykoski et al. 2002, Rinehart et al. 2007) gut verstanden. Einige Ornithischia haben zwei kleine Schlüsselbeine, die einander nicht berühren (Brown & Schlaikjer 1940, Sternberg 1951, Chinnery & Weishampel 1998). Im Gegensatz dazu berühren sich bei den Saurischia die Schlüsselbeine in der Mittellinie, wie es sich bei den frühen Sauropodomorphen wie Massospondylus zeigt. Schon die ersten echten Theropoden, wie die Gattung Coelophysis oder verwandte Gattungen aus der Trias haben voll ausgebildete Gabelbeine und dürfte als Synapomorphie der Theropoda gelten (Nesbitt et al. 2009).
Innerhalb verschiedener Theropodenkladen gab es speziellere Anpassungen und Formen des Gabelbeines, die für einzelne Gruppen diagnostisch sind. So war das Gabelbein bei Ceolophysis, einem frühen Theropoden, U-förmig und hatte mehr Ähnlichkeiten mit den späteren Ceolurasauriern als mit basalen Tetanuriern wie den Spinosauriern und Allosauriern, die ein V-förmiges Gabelbein hatten. Basale Coelurosaurier, wie Tyrannosaurus und der Compsognathidae Huaxiagnathus haben ebenfalls ein U-förmiges Gabelbein mit einigen speziellen Synapomorphien. Die Mitglieder der basalen Maniraptoria-Kladen Therizinosauroidea und Oviraptorsauria haben apomorphe Gabelbeine, die für jede Klade diagnostizierbar sind und deren speziellen Formen und Anpassungen sich innerhalb dieser Kladen entwickelt haben. Die Paravier haben U-förmige Gabelbeine, wobei die bei den Dromeosauriern einfacher gebaut und dünner sind als bei den Troodontiden. Lediglich Velociraptor weicht vom Bauplan der Paravier ab, denn diese Gattung hat ein V-förmiges Gabelbein. Das Gabelbein der frühen Avialae ist nahezu identisch mit denen der eng verwandten Dromeosauridae und Troodontidae. Nur die frühen Ornithurinen besitzen ein Gabelbein, das für die heutigen Vogelgruppen typisch ist.
Die einzigen Theropodenkladen denen ein Gabelbein fehlt bzw. nicht entdeckt wurde, sind die Ornithomimiden und die Alvarezsauriden, obwohl zumindest von den Ornithomimiden vollständige und artikulierte Skelette vorliegen (Nicholls & Russell 1985, Osmolska et al. 1972, Kobayashi & Lü 2003). Man kann daher davon ausgehen, dass das Gabelbein bei diesen Gruppen sekundär verloren gegangen ist.
Es besteht kein Zweifel mehr daran, dass das Gabelbein der Vögel homolog zu jenen der Tetrapoden ist. Sowohl phylogenetische als auch entwicklungsgeschichtliche Daten stützen diese Schlussfolgerung nachdrücklich. Die Schlüsselbeine verschmelzen an der Basis der Theropoda zu einem einzigen Element. Der Ursprung und die Entwicklung der Merkmale des Theropoden-Gabelbeins lassen sich anhand der Fossilien leicht nachvollziehen.
Eine Besonderheit der Vögel ist natürlich ihre Fähigkeit zum Fliegen und damit auch einhergehende stoffwechselphysiologische Besonderheiten wie die Vogellunge und der Bau ihres Herzens. Dies wird Thema beim nächsten Beitrag sein.
Literatur
Averianov AO, Voronkevich AV, Leshchinskiy SV, Fayngertz AV. (2006): A Ceratopsian dinosaur Psittacosaurus sibiricus from the Early Cretaceous of West Siberia, Russia and its phylogenetic relationships . Journal of Systematic Palaeontology 4:359–395.
Barsbold R. (1981): Toothless dinosaurs of Mongolia. Joint Soviet-Mongolian Paleontological Expedition Transactions 15: 28–39.
Barsbold R. (1983): “Avian” features in the morphology of predatory dinosaurs. Transactions of the Joint Soviet Mongolian Paleontological Expedition 24: 96–103.
Baumel JJ, Witmer LM. (1993): Osteologia. In: Baumel JJ, editor. Handbook of Avian Anatomy: Nomina Anatomica Avium. Cambridge: Publications of the Nuttall Ornithological Club. pp 45–132.
Benton MJ. (1999): Scleromochlus taylori and the origin of dinosaurs and pterosaurs. Philos Trans R Soc Lond B 354: 1423–1446.
Benton MJ, Clark JM. (1988): Archosaur phylogeny and the relationships of the Crocodylia. In: MJ Benton, editor. The Phylogeny and Classification of the Tetrapods, Vol 1: Amphibians and Reptiles. Oxford: Clarendon Press. pp 295–338
Benton MJ, Walker AD. (2002): Erpetosuchus, a crocodile-like basal archosaur from the Late Triassic of Elgin, Scotland. Zool J Linn Soc. 136:25–47.
Bhullar B-AS, et al. (2015): A molecular mechanism for the origin of a key evolutionary innovation, the bird beak and palate, revealed by an integrative approach to major transitions in vertebrate history. Evolution 69, 1665–1677.
Bhullar, B.-A., et al. (2016): How to make a bird skull: major transitions in the evolution of the avian cranium, paedomorphosis, and the beak as a surrogate hand. Integrative and Comparative Biology, 56, 389–403.
Bonaparte JF, Novas FE, Coria RA. (1990): Carnotaurus sastrei Bonaparte, the horned, lightly built carnosaur from the Middle Cretaceous of Patagonia. Natural History Museum of Los Angeles County, Contributions in Science 416: 1–41.
Bright JA, Marugán-Lobón J, Cobb SN, Rayfield EJ. (2016): The shapes of bird beaks are highly controlled by nondietary factors. Proc. Natl Acad. Sci. USA 113, 5352–5357.
Brochu CA. (2003): Osteology of Tyrannosaurus rex: Insights from a nearly complete skeleton and high-resolution computed tomographic analysis of the skull. J Vertebr Paleontol 22 ( Suppl. 4): 1–138.
Brown DB, Schlaikjer DEM (1940): The structure and relationships of Protoceratops Transactions of the New York Academy of Sciences 2:99–100.
Bryant HN, Russell AP. (1993): The occurrence of clavicles within Dinosauria: Implications for the homology of the avian furcula and the utility of negative evidence. J Vertebr Paleontol 13:171–184.
Burke, A. C., Feduccia, A. (1997): Developmental Patterns and the Identification of Homologies in the Avian Hand Science 278, 666.
Burnham DA, Derstler KL, Currie PJ, Bakker RT, Zhou Z, Ostrom JH. (2000): Remarkable new birdlike dinosaur (Theropoda: Maniraptor) from the Upper Cretaceous of Montana. The University of Kansas Paleontological Contributions 13: 1–14.
Calvaresi, M., Eckhart, L., Alibardi, L. (2016): The molecular organization of the beta‐sheet region in corneous beta‐proteins (beta‐keratins) of sauropsids explains its stability and polymerization into filaments. Journal of Structural Biology, 194, 282–291.
Capek D, Metscher BD, Müller GB. (2014): Thumbs down: a molecular-morphogenetic approach to avian digit homology. J Exp Zool B Mol Dev Evol. 322(1):1-12.
Chang, WL., Lei, M., Wu, P., Chuong, CM. (2020). Evo-Devo of Scales, Feathers, and Hairs. In: Nuno de la Rosa, L., Müller, G. (eds) Evolutionary Developmental Biology. Springer, Cham.
Chatterjee, S. (1978): A primitive parasuchid (phytosaur) reptile from the Upper Triassic Maleri Formation of India. Palaeontology. 1978;21:83–127.
Chatterjee, S. (1998): Counting the Fingers of Birds and Dinosaurs. Science. 280 (5362): 355a–355.
Chatterjee, S. (2015): The rise of birds: 225 million years of evolution. 2nd Ed. Baltimore: John Hopkins University Press.
Chen Y et al. (2000): Conservation of early odontogenic signaling pathways in Aves. Proc. Natl Acad. Sci. USA 97, 10 044–10 049.
Chiappe LM, Calvo JM. (1994): Neuquenornis volans, a new Late Cretaceous bird (Enantiornithes: Avisauridae) from Patagonia, Argentina. J Vertebr Paleontol 14: 230–246.
Chiappe LM, Shu’an J, Qiang J, Norell MA. (1999): Anatomy and systematics of the Confuciusornithidae (Theropoda: Aves) from the Late Mesozoic of northeastern China. Bull Am Mus Nat Hist 242: 1–89.
Chinnery BJ, Weishampel DB (1998): Montanoceratops cerorhynchus (Dinosauria: Ceratopsia) and relationships among basal neoceratopsians Journal of Vertebrate Paleontology 18:569–585.
Chure DJ, Madsen JH. (1996): On the presence of furculae in some non-maniraptoran theropods. J Vertebr Paleontol 16: 573–577.
Clark JM, Norell MA, Barsbold R. (2001): Two new oviraptorids (Theropoda: Oviraptorosauria). Upper Cretaceous Djadokhta Formation, Ukhaa Tolgod, Mongolia. J Vertebr Paleontol 21: 209–213.
Clarke JA. (2004): Morphology, phylogenetic taxonomy, and systematics of Ichthyornis and Apatornis (Avialae: Ornthurae). Bull Am Mus Nat Hist 286: 1–179.
Clarke JA, Zhou Z, Zhang F. (2006): Insight into the evolution of avian flight from a new clade of Early Cretaceous ornithurines from China and the morphology of Yixianornis grabaui. J Anat 208: 287–308.
Cooney CR, Bright JA, Capp EJR, Chira AM, Hughes EC, Moody CJA, Nouri LO, Varley ZK, Thomas GH. (2017): Mega-evolutionary dynamics of the adaptive radiation of birds. Nature 542, 344–347.
Coria RA, Currie PJ. (2006): A new carcharodontosaurid (Dinosauria, Theropoda) from the Upper Cretaceous of Argentina. Geodiversitas 28: 71–118.
Dal Sasso C, Maganuco S, Cau A. (2018): The oldest ceratosaurian (Dinosauria: Theropoda), from the Lower Jurassic of Italy, sheds light on the evolution of the three-fingered hand of birds. PeerJ 6:e5976
De Bakker, M. A. G., et al. (2021): Selection on phalanx development in the evolution of the bird wing. Molecular Biology and Evolution 38, 4222-4237.
Deeming DC, Birchard GF, Crafer R, Eady PE. (2006): Egg mass and incubation period allometry in birds and reptiles: effects of phylogeny. J. Zool. 270, 209–218.
Dilkes D, Sues H-D. (2009): Redescription and phylogenetic relationships of Doswellia kaltenbachi (Diapsida: Archosauriformes) from the Upper Triassic of Virginia. J Vertebr Paleontol. 29:58–79.
Downs A. (2000): Coelophysis bauri and Syntarsus rhodesiensis compared, with comments on the preparation and preservation of fossils from the Ghost Ranch Coelophysis Quarry. New Mex Mus Nat Hist Sci Bull 17: 33–37.
Dzik J. (2003): A beaked herbivorous archosaur with dinosaur affinities from the early Late Triassic of Poland. J Vertebr Paleontol 23: 556–574.
Eaton TH, Stewart PL. (1960): A new order of fishlike Amphibia from the Pennsylvanian of Kansas. Univ Kans Mus Nat Hist. 1960;12:217–240.
Erickson GM. (2014): On dinosaur growth. Annu. Rev. Earth Planet. Sci. 42, 675–697.
Erickson GM, Zelenitsky DK, Kay DI, Norell MA. (2017): Dinosaur incubation periods directly determined from growth-line counts in embryonic teeth show reptilian-grade development. Proc. Natl Acad. Sci. USA 114, 540–545.
Feduccia, A. (2002): Birds are dinosaurs: simple answer to a complex problem. Auk 119: 1187–1201.
Feduccia, A., L. D. Martin, and S. Tarsitano. (2007): Archaeopteryx 2007: quo vadis? Auk 124: 373–380.
Felice RN, Goswami A. (2017): Developmental origins of mosaic evolution in the avian cranium. Proc. Natl Acad. Sci. USA 115, 555–560.
Field, D. J., et al. (2018): Complete Ichthyornis skull illuminates mosaic assembly of the avian head. Nature, 557, 96–100.
Filla BJ, Redman PD. (1994): Apatosaurus yahnahpin: a preliminary description of a new species of diplodocid dinosaur from the Late Jurassic Morrison Formation of Southern Wyoming, the first sauropod dinosaur found with a complete set of “belly ribs” 44:159–178. The Dinosaurs of Wyoming. Wyoming Geological Association 44th Annual Field Conference Guidebook.
Gauthier JA. (1986): Saurischian monophyly and the origin of birds. Mem Calif Acad Sci 8: 1–55.
Gould, S. J. (1977): Ontogeny and Phylogeny. Harvard University Press.
Griffin, C.T., Botelho, J.F., Hanson, M. et al. (2022): The developing bird pelvis passes through ancestral dinosaurian conditions. Nature 608, 346–352.
Harris MP, Hasso SM, Ferguson MWJ, Fallon JF. (2006): The development of archosaurian first-generation teeth in a chicken mutant. Curr. Biol. 16, 371–377.
Hieronymus TL, Witmer LM. (2010): Homology and evolution of avian compound rhamphothecae. The Auk 127, 590–604.
Holthaus, K. B., et al. (2017): Identification and comparative analysis of the epidermal differentiation complex in snakes. Scientific Reports, 7, 45338.
Holthaus, K. B., et al. (2019): Review: evolution and diversification of corneous beta‐proteins, the characteristic epidermal proteins of reptiles and birds. The Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 330, 438–453.
Horner, J., Gorman, J. (2009): How to build a dinosaur: extinction doesn’t have to be forever. New York: Dutton.
Hou LH, Liu Z-H. (1984): A new fossil bird from Lower Cretaceous of Gansu and early evolution of birds. Sci Sin 27: 1296–1302.
Hou L-H, Zhou Z-H, Martin LD, Feduccia A. (1995): A beaked bird from the Jurassic of China. Nature 377: 616–618.
Huxley TH. (1868): On the animals which are most nearly intermediate between birds and the reptiles. Ann Mag Nat Hist 2: 66–75.
Huxley TH. (1870): Further evidence of the affinity between the dinosaurian reptiles and birds. Q J Geol Soc 26: 12–31.
Hwang SH, Norell MA, Ji Q, Gao K. (2002): New specimens of Microraptor zhaoianus (Theropoda: Dromaeosauridae) from northeastern China. Am Mus Novit 3381: 1–44.
Hwang SH, Norell MA, Quiang J, Keqin G. (2004): A large compsognathid from the Early Cretaceous Yixian Formation of China. J Syst Paleontol 2: 13–30.
Ji Q, Chiappe LM, Ji S-A. (1999): A new late mesozoic confuciusornithid bird from China. J Vertebr Paleontol 19: 1–7.
Ji Q, Currie PJ, Norell MA, Ji S-A. (1998): Two feathered dinosaurs from northeastern China. Nature 393: 753–761.
Ji Q, Ji S, Zhang H, You H, Zhang J, Wang L, Yuan C, Ji X. (2002): A new avialan bird—Jixiangornis orientalis gen. et sp. nov.—From the Lower Cretaceous of Western Liaoning. NE China. J Nanjing University (Natural Sciences) 38: 723–736.
Kardong, K. V. (2008): Vertebrates Comparative Anatomy, Function, Evolution. 5th edition McGraw-Hill Education – Europe
Kirkland JI, Zanno LE, Sampson SD, Clark JM, DeBlieux DD. (2005): A primitive therizinosauroid dinosaur from the Early Cretaceous of Utah. Nature 435: 84–87.
Klima M. (1987): Early development of the shoulder girdle and sternum in marsupials (Mammalia: Metatheria) Adv Anat Embryol Cell Biol. 109:1–91.
Kobayashi Y, Lü J-C. (2003): A new ornithomimid dinosaur with gregarious habits from the Late Cretaceous of China. Acta Palaeontol Pol 48: 235–259.
Koschowitz M-C, Fischer C, Sander M. (2014): Beyond the rainbow. Science 346, 416–418.
Larson DW, Brown CM, Evans DC. (2016): Dental disparity and ecological stability in bird-like dinosaurs prior to the end-Cretaceous mass extinction. Curr. Biol. 26, 1325–1333.
Larson P, Rigby JHJ. (2005): The furcula of Tyrannosaurus rex. In: K Carpenter, editor. The Carnivorous Dinosaurs. Indianapolis: Indiana Press. pp 247–255.
Lautenschlager S, Witmer LM, Perle A, Rayfield EJ. (2013): Edentulism, beaks, and biomechanical innovations in the evolution of theropod dinosaurs. Proc. Natl Acad. Sci. USA 110, 20 657–20 662.
Li, Y. I., et al. (2013): Rapid evolution of beta‐keratin genes contribute to phenotypic differences that distinguish turtles and birds from other reptiles. Genome Biology and Evolution, 5, 923–933.
Lipkin C, Sereno PC, Horner JR. (2007): The furcula in Suchomimus tenerensis and Tyrannosaurus rex (Dinosauria: Theropoda: Tetanurae). J Paleontol 81: 1523–1527.
Lipkin C, Sereno PC. (2002): A spinosaurids furcula: A tetanuran invention. J Vertebr Paleontol 22 ( Suppl. 3): 79A.
Livezey BC, Zusi RL. (2006): Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. I. Methods and characters. Bull Carnegie Mus Nat Hist 37: 1–544.
Livezey BC, Zusi RL. (2007): Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. II. Analysis and discussion. Zool J Linn Soc 149: 1–94.
Louchart, A.; Viriot, L. (2011): From snout to beak: the loss of teeth in birds. Trends in Ecology & Evolution. 26 (12): 663–673.
Lü J-C. (2002): A new oviraptorosaurid (Theropoda: Oviraptorosauria) from the Late Cretaceous of southern China. J Vertebr Paleontol 22: 871–875.
Lü J-C, Huang D, Qui L. (2005): The pectoral girdle and the forelimb of Heyuannia (Dinosauria: Oviraptorosauria). In: K Carpenter, editor. The Carnivorous Dinosaurs. Indianapolis: University of Indiana Press. pp 257–273.
Makovicky PJ, Currie PJ. (1998): The presence of a furcula in tyrannosaurids theropods, and its phylogenetic and functional implications. J Vertebr Paleontol 18: 143–149.
Makovicky PJ, Apesteguia S, Agnolin FL. (2005): The earliest dromaeosaurid theropod from South America. Nature 437: 1007–1011.
Martin, L. D. (2004): A basal archosaurian origin for birds. Acta Zoologica Sinica 50: 978–990.
Martz JW. (2002): The Morphology and Ontogeny of Typothorax Coccinarum (Archosauria, Stagonolepididae) from the Upper Triassic of the American Southwest (Master thesis) Lubbock, TX, USA: Graduate Faculty, Texas Tech University.
Mayr G, Pohl B, Hartman S, Peters DS. (2007): The tenth skeletal specimen of Archaeopteryx. Zool J Linn Soc 149: 97–116.
Morschhauser EM, You H, Li D, Dodson P. (2018): Postcranial morphology of the basal neoceratopsian (Ornithischia: Ceratopsia) Auroraceratops rugosus from the Early Cretaceous (Aptian–Albian) of northwestern Gansu Province, China . Journal of Vertebrate Paleontology 38:75–116.
Musser, J. M., Wagner, G. P., & Prum, R. O. (2015): Nuclear β-catenin localization supports homology of feathers, avian scutate scales, and alligator scales in early development. Evolution & Development, 17, 185–194.
Nesbitt SJ, Turner AH, Spaulding M, Conrad JL, Norell MA. (2009): The theropod furcula. J Morphol. 270(7):856-79.
Ng, C. S., et al. (2014): Genomic organization, transcriptomic analysis, and functional characterization of avian α‐ and β‐keratins in diverse feather forms. Genome Biology and Evolution, 6, 2258–2273
Nicholls EL, Russell AP. (1985): Structure and function of the pectoral girdle and forelimb of Struthiomimus altus (Theropoda: Ornithomimidae). Palaeontology 28: 643–677.
Norell MA, Makovicky PJ. (1999): Important features of the dromaeosaurid skeleton. II. Information from newly collected specimens of Velociraptor mongoliensis. Am Mus Novit 3282: 1–45.
Norell MA, Makovicky PJ, Clark JM. (1997): A Velociraptor wishbone. Nature 389: 447.
Norman DB. (2020): Scelidosaurus harrisonii from the Early Jurassic of Dorset, England: postcranial skeleton. Zoological Journal of the Linnean Society 189:47–157.
Osmolska H, Roniewicz E, Barsbold R. (1972): A new dinosaur, Gallimimus bullatus n. gen., n. sp. (Ornithmimidae) from the Upper Creaceous of Mongolia. Palaeontol Pol 27: 103–143.
Ostrom JH. (1976): Archaeopteryx and the origin of birds. Biol J Linn Soc 8: 91–182.
Plateau, O., Foth, C. (2020): Birds have peramorphic skulls, too: anatomical network analyses reveal oppositional heterochronies in avian skull evolution. Commun Biol 3, 195.
Prum, R. O. (1999): Development and evolutionary origin of feathers. Journal of Experimental Zoology, 285, 291–306.
Radermacher, V. J., Fernandez, V., Schachner, E. R.., Butler, R. J., Bordy, E. M., Naylor, M., de Klerk, H. W. J., Chapelle, K. E. J., Choiniere, J. N. (2021): A new Heterodontosaurus specimen elucidates the unique ventilatory macroevolution of ornithischian dinosaurs eLife 10:e66036.
Rauhut OWM. (2003): The interrelationships and evolution of basal theropod dinosaurs. Spec Paper Palaeontol 69: 1–214.
Remes K. (2008): Evolution of the Pectoral Girdle and Forelimb in Sauropodomorpha (Dinosauria, Saurischia) (Dissertation) München, Germany: Fakultät für Geowissenschaften, LMU München.
Rieppel O. (1992): Studies on skeleton formation in reptiles. III. Patterns of ossification in the skeleton of Lacerta vivipara Jacquin (Reptilia, Squamata) Fieldiana Life Earth Sci. 68:1–25.
Ridente, D. (2016): Heterochrony and evolution in some Toarcian ammonites. Speculations and insights. Journal of Mediterranean Earth Sciences. 8. 25-37.
Rinehart LF, Lucas SG, Hunt AP. (2007): Furculae in the Late Triassic (Apachean) dinosaur Coelophysis bauri (Theropoda: Ceratosauria). Palaontologische Zeitschrift 81: 174–180.
Russell DA, Dong Z-M. (1993): A nearly complete skeleton of a new troodontid dinosaur from the early Cretaceous of the Ordos Basin, Inner Mongolia, People’s Republic of China. Can J Earth Sci 30: 2163–2173.
Ruxton GD, Birchard GF, Deeming DC. (2014): Incubation time as an important influence on egg production and distribution into clutches for sauropod dinosaurs. Paleobiology 40, 323–330.
Salinas-Saavedra et al. (2014): New developmental evidence supports a homeotic frameshift of digit identity in the evolution of the bird wing. Frontiers in Zoology 11: 33.
Sanz JL, Bonaparte JF. (1992): A new order of birds (Class Aves) from the Lower Cretaceous of Spain. Nat Hist Mus Los Angeles County, Sci Ser 36: 39–49.
Sanz JL, Buscalioni AD. (1992): A new bird from the Early Cretaceous of Las Hoyas, Spain. Palaeontology 35: 829–845.
Sanz JL, Chiappe LM, Buscalioni AD. (1995): The osteology of Concornis lacustris (Aves: Enantiornithes) from the Lower Cretaceous of Spain and a reexamination of its phylogenetic relationships. Am Mus Novit 3133: 1–23.
Schneider, R. A., Helms, J. A. (2003): The cellular and molecular origins of beak morphology. Science, 299, 565–568.
Schwarz D, Frey E, Meyer CA. (2007): Novel reconstruction of the orientation of the pectoral girdle in sauropods. Anat Rec (Hoboken) 290:32–47.
Sereno, PC (1990): New Data on Parrot-Beaked Dinosaurs (Psittacosaurus Dinosaur Systematics) Approaches and Perspectives.
Sereno PC., Arcucci AB. (1994): Dinosaurian precursors from the Middle Triassic of Argentina: Marasuchus lilloensis, gen. nov. J Vertebr Paleontol 14: 53–73.
Sereno PC, Martinez RN, Wilson JA, Varricchio DJ, Alcober OA, Larsson HCE. (2008): Evidence for avian intrathoracic air sacs in a new predatory dinosaur from Argentina. PLoS ONE 3: e3303.
Smith ND, Makovicky PJ, Hammer WR, Currie PJ. (2007): Osteology of Cryolophosaurus ellioti (Dinosauria: Theropoda) from the Early Jurassic of Antarctica and implications for early theropod evolution. Zool J Linn Soc 151:377–421.
Spencer MR, Forster CA, Poole KE, Clark JM, Xu X. (2020): New Late Jurassic Dinosaur (Ornithischia) From China Sheds Light on the Early Evolution of the Ornithopod Skeleton and Phylogeny of Ornithopoda. The FASEB Journal.
Sternberg, CM (1951): Complete skeleton of leptoceratops gracilis Brown from the upper edmonton member on red deer river, Alberta National Museum of Canada Bulletin 123:225–255.
Steyer J-S, Heyler D, Guillot L. (2000): Nouvelles données sur les stégocéphales du bassin de Souvigny. Revue Scientifique du Bourbonnais et du Centre de la France. 1998:80–88.
Tamura, K. et al. (2011): Embryological Evidence Identifies Wing Digits in Birds as Digits 1, 2, and 3. Science331:753-757
Thulborn, R. A., Hamley, T. L. (1982): The Reptilian Relationships of Archaeopteryx. Australian Journal of Zoology. 30(4):611–634.
Tschopp, E.; Mateus O. (2013): Clavicles, interclavicles, gastralia, and sternal ribs in sauropod dinosaurs: new reports from Diplodocidae and their morphological, functional and evolutionary implications. Journal of Anatomy. 222 (3): 321–340.
Turner AH, Pol D, Clarke JA, Norell MA. (2007): The basalmost dromeosaurid: A new species from Tugrugyin Shireh, Mongolia. J Vertebr Paleontol (Suppl. 3):161A.
Tykoski RS, Forster CA, Rowe T, Sampson SD, Munyikwa D. (2002): A furcula in the coelophysoid theropod Syntarsus. J Vertebr Paleontol 22: 728–733.
Vargas, A. O., Fallon, J. F. (2005): The digits of the wing of birds are 1, 2 and 3. A review. Journal of Experimental Zoology (Molecular and Developmental Evolution) 304B, 206-219.
Varricchio DJ, Jackson FD. (2016): Reproduction in Mesozoic birds and evolution of the modern avian reproductive mode. The Auk 133, 654–684.
Vickaryous MK, Hall BK. (2010): Comparative development of the crocodylian interclavicle and avian furcula, with comments on the homology of dermal elements in the pectoral apparatus. J Exp Zool A Ecol Genet Physiol. 314:196–207.
Wagner, G. P.; Gauthier, J. A. (1999): 1,2,3 = 2,3,4: A solution to the problem of the homology of the digits in the avian hand. Proc. Natl. Acad. Sci. U.S.A. 96 (9): 5111–6.
Wang S, Stiegler J, Amiot R, Wang X, Du G-H, Clark JM, Xu X. (2017a): Extreme ontogenetic changes in a ceratosaurian theropod. Curr. Biol. 27, 144–148.
Wang S, Stiegler J, Wu P, Chuong C-M, Hu D, Balanoff A, Zhou Y, Xu X. (2017b): Heterochronic truncation of odontogenesis in theropod dinosaurs provides insight into the macroevolution of avian beaks. Proc. Natl Acad. Sci. USA 114, 10 930–10 935.
Wang S, Zhang Q, Yang R. (2018): Reevaluation of the dentary structures of caenagnathid oviraptorosaurs (Dinosauria, Theropoda). Sci. Rep. 8, 391.
Welten, M. C. M., Verbeek, F. J., Meijer, A. H., et al. (2005): Gene expression and digit homology in the chicken embryo wing. Evolution & Development, 7, 18–28.
Werner J, Griebeler EM. (2013): New insights into non-avian dinosaur reproduction and their evolutionary and ecological implications: linking fossil evidence to allometries of extant close relatives. PLoS ONE 8, e72862.
Westheide, W., Rieger, R. (2010, Hrsg.): Spezielle Zoologie Teil 2: Wirbel- oder Schädeltiere. Spektrum akademischer Verlag, 2. Auflage
Wild R. (1993): A juvenile specimen of Eudimorphodon ranzii Zambelli (Reptilia, Pterosauria) from the Upper Triassic (Norian) of Bergamo. Rivista del Museo Civico di Scienze Naturali ‘E. Caffi’ Bergamo 16: 95–120.
Xie WY, Chen MJ, Jiang SG, Yan HC, Wang XQ, Gao CQ. The Wnt/β-catenin signaling pathway is involved in regulating feather growth of embryonic chicks. Poult Sci. 2020 May;99(5):2315-2323.
Xu, X., Mackem, S. (2013): Tracing the evolution of avian wing digits. Curr. Biol. 23: R538-R544
Xu X, Norell MA. (2004): A new troodontid dinosaur from China with avian-like sleeping posture. Nature 431: 838–841.
Xu X, Tang Z-L, Wang X-l. (1999a): A therizinosauroid dinosaur with integumentary structures from China. Nature 399: 350–354.
Xu X, Wang X-L, Wu X-C. (1999b): A dromeosaurid dinosaur with a filamentous integument from the Yixian Formation of China. Nature 401: 262–266.
Xu X, Zhou Z, Wang X. (2000): The smallest known non-avian theropod dinosaur. Nature 408: 705–708.
Xu, X., et al. (2009): A Jurassic ceratosaur from China helps clarify avian digital homologies. In: Nature 459(7249): 940–944.
Yang T.-R.,Sander P. M. (2018): The origin of the bird’s beak: new insights from dinosaur incubation periodsBiol. Lett.142018009020180090
Yates AM, Vasconcelos CC. (2005): Furcula-like clavicles in the prosauropod Massospondylus. J Vertebr Paleontol 25: 466–468.
You H-l, Lamanna MC, Harris JD, Chiappe LM, O’Connor J, Ji S, Lu J, Yuan C-x, Li D-q, Zhang W, Lacovara KJ, Dodson P, Ji Q. (2006): A nearly modern amphibious bird from the Early Cretaceous of Northwestern China. Science 312: 1640–1643.
Zanno LE, Makovicky PJ. (2011): Herbivorous ecomorphology and specialization patterns in theropod dinosaur evolution. Proc. Natl Acad. Sci. USA 108, 232–237. (doi:10.1073/pnas.1011924108)
Zhang X-H, Xu X, Zhao X-J, Sereno PC, Kuang X-W, Tan L. (2001): A long-necked therizinosauroid dinosaur from the Upper Cretaceous Iren Dabasu Formation of Nei Mongol, People.s Republic of China. Vertebrata Palasiatica 10: 282–290.
Zhou Z, Li FZZ. (2010): A new Lower Cretaceous bird from China and tooth reduction in early avian evolution. Proc. R. Soc. B 277, 219–227.
Zhou Z-H, Wang X-L, Zhang F-C, Xu X. (2000): Important features of Caudipteryx—Evidence from two nearly complete new specimens. Vertebrata Palasiatica 38: 243–254.
Zhou Z, Zhang F. (2001): Two new ornithurine birds from the Early Cretaceous of western Liaoning, China. Chin Sci Bull 46: 1258–1264.
Zhou Z, Zhang F. (2002a): A long-tailed, seed-eating bird from the Early Cretaceous of China. Nature 418: 405–409.
Zhou Z, Zhang F. (2002b): Largest bird from the Early Cretaceous and its implications for the earliest avian ecological diversification. Naturwissenschaften 89: 34–38.
Zhou Z, Zhang F. (2003): Anatomy of the primitive bird Sapeornis chaoyangensis from the Early Cretaceous of Liaoning. China. Can J Earth Sci 40: 731–747.
Zhou Z, Zhang F. (2005): Discovery of an ornithurine bird and its implication for Early Cretaceous avian radiation. Proc Natl Acad Sci USA 102: 18998–19002.
Zusi RL. (1993): Patterns of diversity in the avian skull. In The Skull (eds Hanken J, Hall BK), pp. 391–437. Chicago, IL: University of Chicago Press.



