Vögel sind eindeutig Dinosaurier, dies hatten wir anhand des Fossilberichtes im letzten Beitrag geklärt.
In diesem Beitrag wollen wir auf die Kritik von Evolutionsgegnern zur Evolution der Vögel eingehen. Nicht weil die Pseudoargumente der Kreationisten eine gewisse Plausibilität oder Daseinsberechtigung in der wissenschaftlichen Welt haben, sondern weil durch die Entlarvung von Pseudowissenschaften naturwissenschaftliche Tatsachen didaktisch auf eine interessante Weise aufgearbeitet werden können und auch Fehlvorstellungen zur Evolution in der allgemeinen Bevölkerung, die nicht unbedingt mit dem Kreationismus sympathisiert, aufgeräumt werden kann. Führender Vertreter des Kreationismus im deutschsprachigen Raum ist die evangelikale Studiengemeinschaft „Wort und Wissen“, dessen ehemaliger Geschäftsführer Reinhard Junker war. Wort und Wissen zeichnete sich – zumindest unter der Führung von Junker – im Vergleich zu US-amerikanischen Kreationisten durch eine gewisse Sorgfalt und oberflächlich betrachtet seriöse Herangehensweise aus. Doch ihre Argumente sind nicht originell oder wirklich neu, weshalb sie stellvertretend für andere Kreationisten stehen.
Der Text ist Teil der folgenden Arbeit: Evolution: Woher wissen wir, dass Vögel Dinosaurier sind? von Martin Neukamm und Andreas Beyer
Text als pdf
Verbreitete Konvergenzen und widersprüchliche Stammbäume
In ihrem Bemühen, die erdrückenden stammesgeschichtlichen Belege kleinzureden, richten Kreationisten ihren Blick auf vermeintliche „Anomalien“, die nicht zu ihrer Strohmann-Version der Evolutionstheorie passen. Sie verbeißen sich notorisch an der Konvergenzproblematik. Alleine 93-mal verweist Junker in seinem Artikel „Sind Vögel Dinosaurier?“, dass bestimmte vogeltypische Merkmale bei Dinosaurier konvergent entstanden seien. Dabei würden sich, je nach zugrunde gelegten Merkmalen, einander widersprechende Stammbäume bzw. Verwandtschaftsverhältnisse (Inkongruenzen) ergeben. Derlei Befunde, so JUNKER (2019), „passen besser zu einem Schöpfungsmodell“ als zu Evolution.
Nun ist der Behauptung, dass Merkmale, die bei mehreren Taxa unabhängig voneinander entstanden sind (Konvergenzen oder Homoplasien), relativ häufig auftreten zwar zuzustimmen. JUNKER lässt jedoch eine Reihe evolutions- und entwicklungsbiologischer Grundtatsachen außer Acht, die sein Resümee entkräften:
In der Gesamtschau ignoriert JUNKER „…die Tatsache, dass die meisten morphologischen und molekularbiologischen Analysen kongruente Ergebnisse hervorbringen“ (SMITH et al. 2015). Trotz verbreiteter Konvergenzen und der Unsicherheit hinsichtlich der Stellung einiger Taxa im Stammbaum ist die Anordnung der Haupttaxa stabil und unter den allermeisten Experten unstrittig. Vor allem sind und bleiben die Vögel aufgrund ihrer Merkmalsverteilung tief ins Taxon der Theropoden eingeschachtelt (RAUHUT & FOTH 2020, S. 37).
Es gibt beobachtbare populationsgenetische Mechanismen, die Inkongruenzen erklären. Ein solcher ist Artbildung mit oder durch Hybridisierung Zwischen sich auftrennenden Arten ist oft lange noch ein eingeschränkter Genfluss möglich. Je nachdem, welche Gene man sich anschaut, gelangt man dann zu verschiedenen Stammbäumen. Ein anderer Mechanismus ist das Incomplete lineage sorting (unvollständige Liniensortierung nach PFENNINGER (2016, S. 29, Abb. 1):
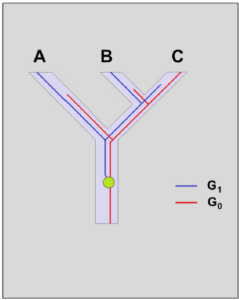
Abb. 1: Incomplete lineage sorting
Dargestellt sind zwei Artbildungsereignisse (Abb. 1): Eine Vorfahrenart spaltet zuerst in die Art A und später in die Schwesterarten B und C auf. Betrachtet werden die Stammlinien-Verläufe eines Gens G, das in zwei Versionen (Allelen) auftritt: G0 und G1. Der gemeinsame Vorfahre von A, B und C besaß zunächst nur das Allel G0. Irgendwann trat eine Mutation auf (symbolisiert durch den grünen Punkt) – die angestammte Population wurde polymorph: Einige Individuen besaßen G0, andere die Mutante G1. Stellen wir uns den Fall vor, dass das Allel G0 in der Linie von A verloren ging, wogegen die Vorfahren von B und C weiterhin polymorph blieben. Nachdem B und C divergierten, setzte sich in B nur G1 und in C nur G0 durch. Aufgrund des gemeinsamen Auftretens von G1 in den Arten A und B könnte man jetzt meinen, es handele sich um Schwesterarten, obwohl sie es nicht sind. Dieser Effekt stört die Stammbaumrekonstruktion übrigens noch stärker, wenn durch Duplikation paraloge Gene entstehen, von denen später jeweils das andere wieder verloren geht. Wir haben es mit einer Inkongruenz zu tun, die nicht die tatsächlichen Verwandtschaftsbeziehungen widerspiegelt.
Manche Merkmale entwickeln sich aus entwicklungsgenetischen Gründen bevorzugt konvergent (LUO et al. 2007; SHUBIN et al. 2009; MCGHEE 2011; HALL 2012; NARAMOTO et al. 2019; TOKITA et al. 2020). Konvergenz tritt umso häufiger auf, je mehr Arten sich genetisch ähneln. Dieses Phänomen ist auf Entwicklungszwänge und Tiefenhomologien zurückzuführen. Zum Beispiel können homologe regulatorische Gene in verschiedenen Linien unabhängig voneinander viele Male ein- und wieder ausgeschaltet werden. So werden aufgrund wiederholter Kanalisierung der Evolution entlang gleicher Entwicklungsbahnen Konvergenzen erzeugt (MCGHEE 2011, S. 7). Einige Fälle von Konvergenz beruhen also auf der ähnlichen „Reaktion“ ähnlicher Genome auf ähnliche Selektion (= Parallelismus). Andere sind auf den Verlust oder die Reversion von Merkmalen bei verwandten Arten zurückzuführen. Vor allem die Reduktion von Merkmalen (etwa die Rückentwicklung des Gabelbeins zu getrennten Schlüsselbeinen bei flugunfähigen Vögeln) ist leicht zu bewerkstelligen, z.B. durch Loss-of-Function-Mutationen. Reversionen, das heißt die wiederholte unabhängige Entstehung phylogenetisch älterer Merkmalszustände, sind auch nicht schwierig, sofern das Entwicklungspotenzial hierfür noch in der Ontogenese steckt (Atavismen sind ein Beispiel). Manchmal erfordert das nur die Reaktivierung eines alten Signalweges (MCGHEE 2011, S. 7) durch eine Mutation.
Aus all dem folgt zweierlei. Erstens: Für die Plausibilität der Abstammung der Vögel von Nichtvogel-Dinosauriern ist unerheblich, dass eine Reihe von Merkmalen konvergent (unabhängig) entstand. Einzelne Charaktere sind nie besonders aussagekräftig; die Vielzahl abgestuft ähnlicher Merkmale, welche die hierarchische Einschachtelung der Vögel in die Gruppe der Theropoden anzeigt, ist entscheidend. Um den Eindruck „stark vernetzte[r] oder gar chaotische[r] Merkmalsbeziehungen“ (S. 65) zu erwecken, ignoriert JUNKER einen entscheidenden statistischen Aspekt: Schon für wenige Organismen ist die Zahl möglicher Verwandtschaftsbäume enorm groß. Für 11 Taxa sind bereits 34 Millionen ungewurzelte Bäume möglich (PENNY et al. 1982). Die Wahrscheinlichkeit, durch zwei unabhängige Methoden oder unterschiedliche Merkmalssätze zufällig auch nur zu annähernd ähnlichen Bäumen zu gelangen, ist faktisch null. Tatsächlich aber sind „widersprüchliche“ Bäume einander meist sehr ähnlich und unterscheiden sich nur in Details. Um es anders zu formulieren:
„Im Allgemeinen können Stammbäume sehr inkongruent sein und dennoch mit einem extrem hohen Maß an statistischer Signifikanz übereinstimmen … Der verblüffende Grad an Übereinstimmung selbst zwischen den inkongruentesten Stammbäumen, die wir aus der Literatur kennen, wird selten gewürdigt, hauptsächlich, weil die meisten Menschen (darunter viele Biologen) die betreffende Mathematik nicht beherrschen“ (THEOBALD 2013).
Anders gesagt, wären die Merkmale verschiedener Arten chaotisch verteilt oder (durch Schöpfung) „frei kombiniert“, wie JUNKER behauptet, wäre es völlig unmöglich, auf unterschiedlichen Wegen Verwandtschaftsbäume zu ermitteln, die sich ähneln. Wir hätten es bei 11 Taxa mit bis zu 34 Millionen verschiedenen Bäumen zu tun, je nachdem, welche Merkmale und Methoden wir zugrunde legen. Tatsächlich gelangen wir jedoch zu ein paar Dutzend Alternativ-Bäumen, die im Großen und Ganzen übereinstimmen. Sie entsprechen einer Messgenauigkeit von 99,9999% PENNY & HENDY (1986, S. 414)! Wenn das kein starkes phylogenetisches Signal ist – was denn dann? Für alle die mehr über die Grundlagen der Kladistik wissen wollen: Dazu habe ich eine eigene Videoreihe!
Zweitens: Unter Berücksichtigung entwicklungsbiologischen Hintergrundwissens sind Homoplasien keine Anomalien, sondern eine klare Erwartung der Evolutionstheorie. Wie plausibel Konvergenz ist, muss der Biologe im Einzelfall abschätzen, was ohne entwicklungsbiologisches Wissen unsicher bleibt. Die Pauschalbehauptung, verbreitete Konvergenz sei ein Indiz gegen Evolution, ist jedoch völlig ungerechtfertigt. Im Gegenteil, die Fachwelt ist sich seit Jahrzehnten klar darüber, dass wir Parallelentwicklungen niemals unbeachtet lassen [können]; denn je mehr Arten sich genetisch ähnlich sind, umso wahrscheinlicher ist es, dass bei ihnen gleiche detaillierte Morphologien parallel entstehen. (TATTERSALL 1997, S. 216)
Diskontinuierliche und „chaotische“ Evolution im Zickzackkurs
Mit dem Konvergenzeinwand verknüpft ist die anachronistische Vorstellung, dass die Evolution sowohl linear als auch kontinuierlich zu verlaufen habe. Entsprechend betont JUNKER (2019) mit Blick auf die Flugfähigkeit der Vögel, dass aus evolutiver Sicht von einer „linearen, schrittweisen Entwicklung nicht die Rede sein kann“ (S. 9). Vielmehr sei die Entwicklung „chaotisch“ verlaufen; hinsichtlich einiger Merkmale müssten „problematische Reversionen“ (S. 48) postuliert oder evolutionstheoretisch eine Rückentwicklung [Reduktion] bzw. wie beim Schultergürtel eine Art evolutionärer Zickzackkurs angenommen werden, was allgemein als unplausibel gilt. (JUNKER 2019, S. 62)
Offenbar werden für die Evolution nur geradlinige, unidirektionale Veränderungen in einzelnen, nicht verzweigten Abstammungslinien (anagenetische Trends) verantwortlich gemacht. Durch Artaufspaltung (Kladogenese) entstehen jedoch voneinander getrennte Entwicklungslinien, in denen sich individuell verschiedene Evolutionsdynamiken entfalten. Dies erzeugt in der Gesamtschau das Bild eines nichtlinearen und chaotischen „Zickzackkurses“ zwischen den unterschiedlichen Linien (vgl. MACFADDEN 2005). Auch das Beharren auf „kontinuierlichen Veränderungen“ (S. 40) beweist, dass JUNKERs Kenntnisse über Artbildung nicht mehr zeitgemäß sind. Entwicklungsbiologische Zwänge lassen oft nur diskontinuierliche Veränderungen zu (MAYNARD SMITH 1983). Geringfügige Veränderungen der Konzentration bestimmter Signalmoleküle oder biomechanischer Kräfte können beim Überschreiten von Schwellenwerten abrupte Gestaltwandel während der Embryonalentwicklung hervorrufen (PETERSON & MÜLLER 2016). Kontinuierliche Veränderungen verbieten sich auch aufgrund der „räumlichen und zeitlichen Heterogenität der Umwelt mit ihren begrenzten Ressourcen, die zur Konkurrenzvermeidung ökologische Sonderung verlangt“ (MAHNER 1986, S. 68). In Populationen, die verschiedene adaptive Zonen bevölkern, entwickeln sich die Merkmale unterschiedlich schnell – oft sogar in unterschiedliche Richtungen (FUTUYMA 2015, S. 35).
Ein gut untersuchtes Beispiel betrifft die Evolution der Pferde und die Aufspaltung ihrer Ahnenpopulationen im Känozoikum (Abb. 2). Bereits in den 1950er Jahren wies der Evolutionsbiologe G. G. SIMPSON nach, dass der Pferde-Stammbaum keine einfachen, unilinearen Entwicklungen zeigt (SIMPSON 1951). Stattdessen besteht er aus zahlreichen Seitenästen, die Arten repräsentieren, welche wieder ausstarben. Als sich einige laubfressende Gattungen zu Grasfressern entwickelten, fanden mehrere komplexe Artaufspaltungsereignisse statt. In jeder adaptiven Zone etablierten sich diverse Abstammungslinien. Während einige Weidetiere bereits über gut entwickelte Hufe verfügten, behielten andere ihre Zehen. Zähne, Zehen und Körpergröße variierten je nach Klima, Vegetation und Selektionsdruck in verschiedenen Linien unterschiedlich rasch (MACFADDEN 2005; MIHLBACHLER et al. 2011). Diese „chaotische Evolution“ geht mit unserem Wissen über Artbildungsprozesse seit über 70 Jahren konform. Der daraus resultierende „Zickzackkurs“ lässt erst über viele Millionen Jahre hinweg, nach dem Aussterben zahlreicher Arten, einen evolutiven Trend erkennen.
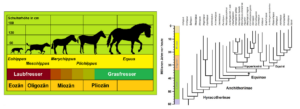
Abb. 2: Links: Vereinfachte (lineare) Darstellung, die den anagenetischen Trend in der Pferde-Evolution betont. Rechtes Schema: Wie die Evolution unter Berücksichtigung von Artaufspaltungen verlief. Im ausgehenden Oligozän und im Miozän waren die Verzweigungen derart zahlreich, dass hier nicht alle berücksichtigt werden können. Erst über sehr lange Zeiträume und zahlreiche Linien hinweg ergibt sich ein Trend zur Größenzunahme und zur Reduktion der Zehen. Silhouetten der Pferde: Scott HARTMAN (Eohippus), T. Michael KEESEY (Mesohippus), Andrew FARKE (Merychippus), Julián BAYONA (Pliohippus), Mercedes YRAYZOZ (Equus). Quelle: www.phylopic.org | Lizenzen: CC BY 4.0. Nach einer Vorlage von www.sofatutor.com/biologie/videos/stammbaum-der-pferde.
Junker bezieht sich bei seiner Argumentation auf eine Arbeit von Steven Brusatte (2017) um zu zeigen, dass die Entwicklung des Fliegens chaotisch verlief. Aber von der Notwendigkeit einer „linearen, schrittweisen Entwicklung“ ist in dem Artikel auch nirgendwo die Rede. Im Gegenteil, BRUSATTE widerlegt die Ansicht, dass die Theropoden aufs Fliegen zugeschnittene Federkleider und Flügelprofile zu entwickeln brauchten. Die unterschiedlichsten Prädispositionen, wie Hautlappen, versteifte Deckfedern, häutige Flügel, Beinflügel usw., fungierten als (semi-)stabile Tragflächen. Daraus gingen mannigfaltige Lösungen hervor. So waren Flügel und Federn von Anchiornis alles andere als ans Fliegen angepasst (PITTMAN et al. 2022a). Aber mit einer Hautmembran als Behelfslösung verhalfen sie ihm zumindest zu einem Gleit- oder schwachen Schlagflug. Die Gattung Yi wiederum, die einer Fledermaus glich, bewältigte nur knapp den Gleitflug – allein aufgrund einer Spannhaut zwischen den Fingern. Da entlang des Körpers eine solche fehlte, lag der Schwerpunkt weit hinter den Gleitmembranen des Tiers, sodass sein Flug wahrscheinlich sehr instabil war (DECECCHI et al. 2020). JUNKERs Annahme, dass solch ein chaotisches Stadium, in dem „Dinosaurier mit verschiedenen Flugarten experimentierten“ (BRUSATTE 2017, S. 792), gegen Evolution spreche, ist ein armseliger Strohmann, geboren aus der verqueren Sicht, dass Evolution linear zu verlaufen habe. Dass JUNKER zudem BRUSATTEs Experimental-Metapher als ein Argument für „Schöpfung“ anführt, obwohl ein Formen-Chaos mit vielen Sackgassen (wie etwa Yi) perfekt zu einem nicht-intendierten Naturprozess passt, stellt da nur das Sahnehäubchen dar.
Zusammenfassend lässt sich also sagen, dass die morphologische Evolution in den meisten Fällen zwar allmählich (gradualistisch), zugleich aber diskontinuierlich, episodisch und in ihrer Richtung schwankend verläuft. Vor allem verläuft die Evolution aufgrund zahlreicher Artspaltungsereignisse mehrgleisig – und somit nicht linear. Die Evolution lässt sich jeweils nur über mehr oder weniger gewundene Wege bis zu einem letzten gemeinsamen Vorfahren zurückverfolgen, aber kein Weg verläuft gerade, und alle führen über seitliche Schritte von einem Artbildungsereignis zum nächsten in die Vergangenheit, nicht über eine Abstammungsleiter der kontinuierlichen Veränderung. (GOULD 2002, S. 92)
Unpassende Mosaikformen statt Übergangsformen
Auch was die Natur evolutionärer Übergangsformen betrifft, enthalten kreationistische Argumente veraltete Vorstellungen. So zitiert JUNKER (2019) diverse Beispiele um zu zeigen, dass „das Merkmalsmosaik“ des betreffenden Fossils so gestaltet sei, „dass es insgesamt nicht als evolutionäre Übergangsform passt, sondern als eine eigene [sic!] evolutive Linie angenommen werden muss“ (S. 63). Zum Beispiel sei der vogelähnliche Theropode Rahonavis (Abb. 3), dessen Position im Stammbaum noch nicht endgültig geklärt ist, „in Bezug auf manche Merkmale ‘primitiver’ als Archaeopteryx, in Bezug auf andere dagegen deutlich vogelartiger, eigne sich also nicht als Übergangsform. (S. 55)
Nun ist die Erkenntnis, dass gerade Artaufspaltungen die Evolution solch unterschiedlicher Mosaike aus „primitiven“ und „fortschrittlichen“ Merkmale mitbedingen, keineswegs neu. So lesen wir bereits bei MAYR (1967, S. 465f):
„Beim Wechsel in eine neue adaptive Zone steht eine Struktur oder ein Strukturkomplex unter besonders strengem Selektionsdruck… Daraufhin evoluiert diese Struktur oder dieser Komplex besonders schnell, während andere zurückbleiben. Das Resultat ist nicht ein stetiger und harmonischer Wandel aller Teile des ‘Typus’, wie die idealistische Biologie sich das einbildet, sondern weit mehr eine Mosaik-Evolution. Jeder evolutive Typus ist ein Mosaik primitiver und fortschrittlicher Merkmale, von allgemeinen und spezialisierten Zügen.“
Der Umstand, dass bei Archaeopteryx einige Merkmale „primitiver“ blieben als bei Rahonavis, während andere fortschrittlicher waren, ist vor diesem Hintergrund nicht überraschend (Abb. 3): Die Besetzung verschiedener ökologischer Zonen geht mit unterschiedlichen Lebensweisen einher. Das hat zur Folge, dass auf die gleichen Merkmale unterschiedliche Selektionsdrücke wirken können. So war Rahonavis ein agiler Räuber der Lüfte mit Anpassungen an einen echten Schlagflug (PITTMAN et al. 2022b). Archaeopteryx war eher noch ein Gleiter mit geringerem Schlagflugpotenzial (LONGRICH et al. 2012; KSEPKA 2022), dessen Leben sich mehr am Boden abspielte (ELŻANOWSKI 2002; PITTMAN et al. 2022a). Das ursprünglichere Merkmal der Sichelklaue wiederum kam der Lebensweise der Dromaeosauriden entgegen (FRASER 2014) und blieb so bei Rahonavis erhalten.

Abb. 3: Lebendrekonstruktion von Rahonavis (links) und Archaeopteryx (rechts). Auf der einen Seite besitzt Rahonavis noch Merkmale der Dromaeosauriden (s. Abb. 4), die den (Ur-) Vögeln fehlen, wie etwa die Sichelkralle am zweiten Zeh. Andererseits entspricht er in einigen Merkmalen schon mehr der Anatomie heutiger Vögel als Archaeopteryx. Zum Beispiel war der Schultergürtel schon recht flexibel im Gegensatz zu dem verschmolzenen, starren Schultergürtel bei Archaeopteryx. Dieses an einen aktiven Flug angepasste Merkmal entstand eventuell bei den Vögeln konvergent. Beide Mosaikformen besaßen somit jeweils andere „Übergangsmerkmale“ „auf dem Weg“ zu den Vögeln. Dies zeigt, dass die Evolution nicht harmonisch entlang einer Schiene zu den Vögeln verlief. Artaufspaltungen bewirken, dass die Merkmale in jedem Organismus und in jeder Entwicklungslinie in unterschiedlichem Tempo evolvieren (Heterobathmie). Links: Künstlerische Darstellung von James Paul BAELLO. Rechte Grafik: Urheber: DBCLS | Quelle: www.doi.org/10.7875/togopic.2020.192 | Lizenz: CC BY 4.0.
Mosaik-Evolution ist auch das Resultat funktioneller und genetischer Bürden, die ihren Ursprung in der hierarchischen, modularen Organisation der Merkmale im Organismus haben (s. RIEDL 2003, S. 209; FELICE & GOSWAMI 2018). Im Allgemeinen gilt: Je phylogenetisch älter ein biologisches Merkmal ist, desto mehr jüngere Merkmale bauen heute auf dessen Funktion auf. In der Folge können die alten Merkmale kaum noch (oder nur noch in bestimmten Untermerkmalen) evolvieren, ohne das Zusammenspiel empfindlich zu stören: Die funktionelle und genetische „Bebürdung“ der betreffenden Merkmale ist hoch. Indem JUNKER (2019) behauptet, „Mosaik-Evolution“ sei ein „Fremdkörper in einem evolutionären Szenario“ (S. 65), zeigt er deutlich, dass ihm elementare evolutionsbiologische Grundlagen fehlen.
Diese klassische Erwartung an die Natur von Übergangsformen ist aufgrund des Mosaikmodus der Evolution nicht mehr haltbar (PROTHERO 2017, ebd.). Jeder Organismus und jede Art zeigen sowohl ursprüngliche als auch fortschrittliche Merkmale nebeneinander. Der Prozess der Artaufspaltung bei der Gründung unabhängiger Taxa gestaltet das Bild noch unübersichtlicher.
PADIAN & ANGIELCZYK (1999) empfehlen deshalb, den Fokus statt auf Übergangsformen auf einzelne Übergangsmerkmale zu richten. Das Konzept der Übergangsformen muss jedoch nicht verworfen werden, sofern der Begriff „Übergangsform“ etwas anders definiert wird als früher: Aus kladistischer Sicht können Übergangsformen zwischen ursprünglichen Dinosauriern und modernen Vögeln nichts anderes sein als Mosaikformen, die schon einige (aber noch nicht alle!) abgeleitete Merkmale (Synapomorphien) der Kronengruppenvögel aufweisen. Zudem besaßen sie noch einige ursprüngliche Merkmale, die den Vögeln der Kronengruppe fehlen (Abb. 4).
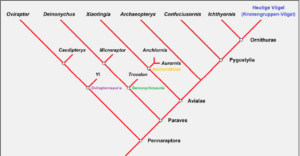
Abb. 4: Vereinfachtes Kladogramm der Pennaraptora, einer Theropoden-Untergruppe, zu der auch die heutigen Vögel (Kronengruppen-Vögel) zählen. Alle hier abgebildeten Arten (und viele weitere, die hier nicht angeführt sind) repräsentieren die sogenannte Ahnenlinie der Vögel. Das heißt, sie waren direkte oder indirekte Vorfahren der Vögel. Das bedeutet, dass sie bereits einige (aber nicht alle) abgeleiteten Merkmale der heutigen Vögel besaßen, zugleich aber noch Theropoden-Merkmale besaßen, die den heutigen Vögeln fehlen. Dies ist genau das, was man aus kladistischer Sicht von einer evolutiven Übergangsform erwartet. Ihre Position im Kladogramm gibt Aufschluss über die Reihenfolge der Entstehung der einzelnen Vogelmerkmale. Verändert nach PITTMAN & XU (2020).
Besonders müßig ist der Versuch, den Status von Übergangsformen unter Verweis darauf zu demontieren, dass diese lediglich einen Seitenast bekleiden (JUNKER 2019, S. 55).
In der Tat zeigen Fossilien oft stark spezialisierte, für die jeweilige Art charakteristische Merkmale (Autapomorphien), die sie als direkte Vorfahren heutiger Arten ausschließen oder zumindest unwahrscheinlich machen. Es wäre aber unsinnig zu fordern, dass die Übergangsformen wie die Perlen einer Kette in gerader Linie von den mesozoischen Vorfahren zu den modernen Arten (Kronengruppen) führen müssten. Ein solches für Kreationisten typisches Denken ist „oberflächlich und erinnert an das vor-evolutionäre Konzept der ‘Stufenleiter’ oder scala naturae“ (PADIAN & ANGIELCZYK 1999, S. 56). Evolution (bzw. Kladogenese) ist ein sich stetig verzweigender Prozess, der eine zunehmende Anzahl an Entwicklungslinien hervorbringt. Mehr als 99% Prozent aller Arten, die je gelebt haben, starben im Lauf der Zeit wieder aus (TAYLOR 2004, S. 1). Es kommt daher nur selten vor, dass wir Fossilien entdecken, die als direkte Vorfahren einer heute lebenden Art infrage kommen. Selbst dann, wenn wir einen direkten Vorfahren fänden, könnten wir aufgrund der Unvollständigkeit des Fossilienberichts nicht bestimmen, wie nahe er tatsächlich am Verzweigungspunkt liegt (PADIAN & ANGIELCZYK 1999). Kurzum: Das [evolutionäre] ‘Baumdenken’ verlagert den Fokus von der Suche nach linearen (direkten) Vorfahren auf die Suche nach Synapomorphien, welche indirekte Vorfahren (Nebenverwandte) miteinander verbinden. (MEAD 2009, S. 311)
Überhaupt ist die exakte Stellung von Mosaikformen wie Rahonavis, Archaeopteryx usw. im Stammbaum für die Richtigkeit der Evolutionstheorie unerheblich. Ihr Beweiswert für die Evolutionstheorie liegt darin, dass sie einander abgestuft ähnlich sind, sodass sie sich in eine Abfolge bringen lassen, in der ihre Morphologie mehr und mehr die Gestalt heutiger Vögel annimmt (Abb. 5).
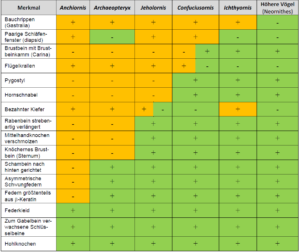
Abb. 5: Merkmalstabelle einiger Theropoden. (+) bedeutet: Merkmal vorhanden, (-): Merkmal fehlt, (±): Merkmal rudimentär vorhanden. Die orangefarbenen Felder zeigen den Besitz ursprünglicher Nichtvogel-Theropoden-Merkmale an, die grünen Felder die Präsenz fortschrittlicher Vogelmerkmale. Wir sehen, dass die Anzahl der Vogelmerkmale von Anchiornis über Archaeopteryx, Jeholornis und Confuciusornis bis zu den höheren Vögeln sukzessive zunimmt, so wie es die Evolutionstheorie erwarten lässt. Die Merkmalsverteilung legt zudem nahe, dass einige Vogelmerkmale in verschiedenen Linien konvergent (unabhängig voneinander) entstanden sind. So wurde bei Archaeopteryx unabhängig von den höheren Vögeln der diapside Schädel so abgewandelt, dass keines der Schläfenfenster noch klar erkennbar ist. Auch der Zahnverlust bei Confuciusornis und heutigen Vögeln scheint unabhängig erfolgt zu sein.
Die „stratigraphisch-phylogenetische Diskrepanz“
Kreationisten argumentieren oft, dass die Abfolge der Arten bzw. Taxa im Fossilbericht nicht mit den phylogenetischen Szenarien übereinstimme. Auch hierzu einige Beispiele:
- Die meisten Theropoden-Dinosaurier-Gattungen, die vogelartige Merkmale besitzen, sind geologisch jünger als die geologisch ältesten Vögel. (JUNKER 2019)
- Cruralispennia nimmt eine abgeleitete Stellung unter den Gegenvögeln ein und ist nicht als Übergangsform deutbar. Zudem gehört diese Gattung nach Archaeopteryx zu den ältesten Vögeln – eine ‘stratigraphisch-phylogenetische Diskrepanz’ (Wang et al. 2017). (JUNKER 2019, S. 52)
- Sowohl die Enantiornithes als auch die Ornithurae erscheinen in der Fossilabfolge relativ abrupt in großer Vielfalt, zeitlich gemeinsam mit Formen wie Confuciusornis, Jeholornis und Sapeornis, die als primitiver eingestuft werden. (JUNKER 2019, S. 65)
- Die Dromaeosauriden wiederum werden in einen weiteren Abstammungszusammenhang mit Vögeln gestellt (obwohl sie in deutlich jüngeren Schichten gefunden wurden als Formen mit echten, flächigen, flugtauglichen Federn). (JUNKER 2022)
Inhaltlich sind die Aussagen zwar korrekt, sie taugen aber nicht als Einwand gegen Evolution.
Tatsächlich ist die Erklärung für die „stratigraphisch-phylogenetische Diskrepanz“ denkbar einfach: Als in einigen Entwicklungslinien fortschrittlichere Vogelmerkmale evolvierten, starben die Dinosaurier mit primitiveren Merkmalen keineswegs aus. Warum sollten sie auch? Diese unterschiedlich entwickelten Theropoden koexistierten über sehr lange Zeit. Durch Artaufspaltungen existieren verschiedene Evolutionslinien gleichzeitig. Als sich die evolutionäre Linie aufspaltete und eine Linie sich zu den modernen Vögeln entwickelte, existierte die andere evolutionäre Linie ebenso weiter. (Schließlich existieren heute auch noch „Fische“, von denen einige vor 380 Mio. Jahren zu den Stamm-Tetrapoden, der Stammgruppe aller Landwirbeltiere, wurden.)
Schauen wir uns zur Verdeutlichung diesen vereinfachten Stammbaum der Vögel an (Abb. 6), mit den Fundhorizonten verschiedener Fossilien (blaue, orangefarbene und grüne Horizontallinien).
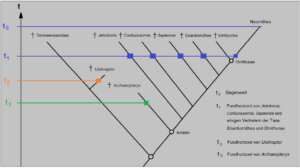
Abb. 6: Vereinfachter Stammbaum der Vögel (Avialae) mit den Fundhorizonten verschiedener Fossilien (blaue, orangefarbene und grüne Horizontallinien). Die ausgestorbenen Vogelarten Jeholornis, Confuciusornis und Sapeornis sind älter und urtümlicher als die ebenfalls ausgestorbenen „Gegenvögel“ (Taxon der Enantiornithes) und die ältesten Vertreter aus der Gruppe Ornithurae. Gleichwohl koexistierten sie alle über einen langen Zeitraum, sodass es nicht verwundert, dass entsprechende Fossilien aus dem gleichen Zeithorizont (t1) bekannt sind. Das Dinosaurier-Taxon der Dromaeosauridae wiederum ist ursprünglicher als das der Vögel. Einige Dromaeosauriden, wie beispielweise Utahraptor, sind aber erst später entstanden, sodass sie in jüngeren Schichten (t2) gefunden werden als zum Beispiel Archaeopteryx (t3).
Beachtet, dass heute nur die modernen Vögel, also die Neornithes bis heute überlebt haben, während die anderen ausgestorben sind. Aus dem Stammbaum wird auch deutlich, dass evolutionären Linien, die zu ausgestorbenen Vogelarten Jeholornis, Confuciusornis und Sapeornis führten, älter und urtümlicher sind als die ebenfalls ausgestorbenen „Gegenvögel“ (Taxon der Enantiornithes) und die ältesten Vertreter aus der Gruppe Ornithurae (die Ichthyornis und die modernen Vögel einschließen). D. h. all diese Gruppen haben sich im Stammbaum der Vögel vorher abgespalten. Gleichwohl hatten diese früheren Abspaltungen ihre eigenen Evolutionswege und es verwundert daher nicht, dass die genannten Gattungen über einen langen Zeitraum koexistierten und die Fossilien aus dem gleichen Zeithorizont bekannt sind (t1). Das Dinosaurier-Taxon der Dromaeosauridae wiederum ist ursprünglicher als das der Vögel (Avialae). Einige Dromaeosauriden, wie beispielweise Utahraptor, sind aber erst später entstanden, sodass sie in jüngeren Schichten (t2) gefunden werden als zum Beispiel Archaeopteryx (t3), weil auch da Taxon der Dromeosauride auch nach der Abspaltung von den Avialae seinen eigenen Evolutionsweg hatte. Warum auch nicht? Wer dies als problematisch für die Evolutionstheorie wertet, hat die Grundlagen der Evolution (bzw. das Prinzip der Kladogenese) nicht verstanden.
Es ist zu betonen, dass es auf die pyhlogenetischen Beziehungen der Gruppen ankommt, nicht auf ihre stratigraphischen Beziehungen (NORELL 1992).
Dazu kommt, dass weltweit nur wenige ergiebige Fossilienlagerstätten existieren, die einige spärliche Einblicke in die Lebenswelt jurassisch-kreidezeitlicher Theropoden gestatten; der Fossilbericht ist also nur fragmentarisch. Dazu zählen die 150 Mio. Jahre alten Solnhofer Plattenkalke der Fränkischen Alb, in denen alle (!) bekannten Archaeopteryx-Exemplare gefunden wurden. Da sich die Schichten des ehemaligen Lagunensystems innerhalb weniger Jahrmillionen bildeten, liefern sie nur Stichproben. Deshalb darf nicht erwartet werden, dass die Fossilien repräsentativ über die Dauer ihrer Existenz in den geologischen Schichten auffindbar sind. Die wahrnehmbaren Muster der Fossilienvielfalt sind stark verzerrt durch ungleiche Intensität der Probenahme über die Zeit, durch geologische Verzerrungen, die die zeitliche Verteilung von Fossilien und Formationen beeinflussen, durch unterschiedliches Erhaltungspotenzial von Organismen in verschiedenen Umgebungen, durch die heterogene Sammelpraxis, die Berichterstattung und sogar durch die Geopolitik. Daher ist der bekannte Fossilienbestand nicht nur eine unvollständige Stichprobe des gesamten Fossilienbestands, sondern diese Unvollständigkeit ist auch zeitlich und räumlich uneinheitlich. (FLANNERY-SUTHERLAND et al. 2022)
Angesichts des in der Kreide sehr breit gefächerten Artenreichtums vieler Theropodenfamilien muss es zweifellos auch ältere Stammlinien unter ihnen gegeben haben, die zumindest bis in den späten Jura, wahrscheinlich sogar darüber hinaus, zurückreichen. Während einzelne ergiebige Lagerstätten zumindest so etwas wie einen Teilüberblick über einen bestimmten Zeitabschnitt gewähren, sieht es auf der geologischen Zeitskala anderswo weniger günstig aus. Die Tierwelt des frühen und mittleren Jura, übrigens nicht nur der Dinosaurier, sondern aller Landtiere, ist bislang gegenüber den nachfolgenden Epochen nur äußerst spärlich überliefert. Ein solcher Negativbefund spricht aber nicht gegen einen Theropoden als Vogelvorfahren. Und ganz lückenhaft scheint der Befund auch nicht mehr zu sein. Die Anwesenheit von Dromaeosauriden bereits im mittleren Jura wurde durch die Entdeckung einzelner fossiler Zähne nahegelegt, obwohl aus dieser Zeit keine Dromaeosauriden-Körperfossilien gefunden wurden (WILLS et al. 2023).
Kladogramme spiegeln nicht die genaue zeitliche Abfolge der entdeckten Fossilien und ihrer evolutionären Veränderungen wider. Dafür ist der Fossilbericht nur stichprobenartig und dazu noch ungleich über die Jahrmillionen verteilt. Stattdessen liefert die Kladistik ein vergleichendes Modell der Stammesentwicklung, indem es fossile Lebewesen allein anhand ihrer in bestimmten Merkmalen verkörperten Entwicklungsstufe platziert. Um die Abstammungslinie von Dinosauriern zu den Vögeln zu erkunden, gilt es also, das jeweilige Maß an Übereinstimmung anhand von Merkmalen zu ermitteln, die fossile Lebewesen mit den Vögeln teilten oder in denen sie sich unterschieden. Die entdeckten Fossilien sind lediglich Repräsentanten dieser Merkmalsevolution, nicht zwingend die direkten Ahnen der Gruppen und können daher auch, bedingt, dass auch ihre Linien eine eigene Evolution hatten, stratigraphisch an der falschen Stelle liegen.
Gleichwohl entspricht „die Abfolge der Fossilien in der Zeit hinsichtlich ihrer morphologischen Änderung keiner Zufallsfolge“ (MAHNER 1986, S. 61). Mit abnehmendem Alter der Schichten finden sich dort erwartungsgemäß zusehends vogelähnlichere Theropoden.
Abruptes Auftreten von Merkmalen und das „Wartezeitproblem“
Kreationisten wie JUNKER (2019: 49; 50) erwähnen, dass manche Merkmale der Nicht-Vogel-Dinosaurier relativ abrupt auftreten. Diese Situation sei Herausforderung für evolutionäre Mechanismen, weil rasches Auftreten evolutionstheoretisch nicht zu erwarten sei.
Dieser Einwand ist schon deswegen bedeutungslos, da die bekannten Fossilien keinen repräsentativen Querschnitt ausgestorbener Formen darstellen: Jeder Fund eines fossilen Theropoden, wie die insgesamt nur 12 bekannten Archaeopteryx-Exemplare, stellt einen enormen Glücksfall dar. Die Hälfte aller Dinosauriergattungen ist nur durch ein einziges Exemplar vertreten; rund 80 % aller Dinosaurierskelette sind fragmentarisch überliefert (DODSON 1990). Schätzungen zufolge sind weniger als ein bis einige wenige Prozent der Arten fossil belegt (RAUP 1994). Forderungen nach fein gestaffelten Übergängen verbieten sich daher ebenso wie die Erwartung, Fossilienbelege ohne abruptes Auftauchen von Merkmalen vorzufinden.
Weiterhin, was soll unter abrupt zu verstehen sein? Wenn ein Paläontologe vom „abrupten“ Auftreten eines Merkmals spricht, meint er immer noch Zeiträume von mehreren Zehntausend bis Millionen von Jahren, Kreationisten denken dagegen meist an eine blitzartige Entstehung aus dem Nichts.
Grob irreführend ist auch die Behauptung, evolutionäre Mechanismen seien aufgrund des Wartezeitproblems „klar damit überfordert…, in geologisch kurzen Zeiträumen eine große Formenvielfalt relativ abrupt hervorzubringen“ (S. 67/93). Warum ist dem so?
Das „Wartezeitproblem“ beruht in seinem Kern auf zwei Prämissen: Zum einen müsse die Evolution ein „festes und vorgegebenes Ziel“ erreichen (HÖSSJER et al. 2021, S. 51). Zum anderen seien hierfür mehrere „koordinierte Mutationen“ erforderlich (ebd., S. 5). Angesichts der erforderlichen genetischen „Feinabstimmung“ und des Umstands, dass Rückmutationen potenziell vorteilhafte Einzel-Mutationen wieder eliminieren, könnten, so das Argument, (komplexere) Neuerungen nicht in realistischen Zeiträumen evolvieren.
Um ihr Argument vorzubringen, gehen die Kreationisten jedoch von falschen Voraussetzungen aus. Die Evolution muss keineswegs das Auftreten vorgegebener Zielstrukturen oder Funktionszustände „abwarten“. Ihr Wesen ist opportunistisch, das heißt, sie nutzt jede Veränderung, die unter den bestehenden Voraussetzungen irgendeinen Fitnessvorteil hervorbringt. Anders gesagt muss sie immer nur so lange „warten“, bis eine Struktur mit beliebiger Funktion entsteht.
Und auch, wenn eine bestimmte Funktion vorgegeben wäre, folgte daraus nicht, dass dafür nur im Voraus festgelegte DNA- oder Protein-Strukturen infrage kommen.
Ganz im Gegenteil, jeder Funktionszustand lässt sich auf unzählig vielen Wegen realisieren. Nehmen wir Antibiotika-Resistenzen als Beispiel: Antibiotika lassen sich unter anderem durch neue Enzyme, durch veränderte Rezeptoren oder durch „Heraufregulieren“ eines antagonistischen Signalwegs unwirksam machen. Jedem einzelnen dieser Wege stehen der Evolution wiederum mehrere Routen offen. Bezogen auf den enzymatischen Weg kann ein Medikament zum Beispiel durch eine Spaltung oder chemische Modifikation unwirksam gemacht werden. Für jede Route kann die Evolution wiederum zahlreiche verschiedene Optionen nutzen. Zu guter Letzt kann jedes Protein eine enorme Variabilität aufweisen, ohne seine Funktion einzubüßen. Die Annahme, es seien notwendigerweise mehrere aufeinander abgestimmte Mutationen erforderlich, um ein bestimmtes Ziel zu erreichen, erweist sich ebenfalls als falsch.
Die Entstehung von Enzymen mit völlig neuartigen Eigenschaften lässt sich oft schon durch einzelne Mutationen bewerkstelligen (DE KRAKER & GERSHENZON 2011). Analog zu diesem Befund zeigten YONA et al. (2018), dass ~ 60% aller möglichen Zufallssequenzen (!) nur eine Mutation davon entfernt sind, sich in aktive Promotor-Sequenzen zu verwandeln. Einer anderen Studie zufolge eignet sich ein hoher Prozentsatz zufällig erzeugter Peptide als funktionelle Zielsequenz, die man Proteinen anhängen kann, um sie in bestimmte Organellen zu importieren (TONKIN et al. 2008).
Dies liegt daran, dass tausende von (kryptischen) Genen, Signal- und Co-Faktoren eine enorme Anzahl von Kombinationsmöglichkeiten bieten, um Neuerungen entstehen zu lassen.
Was können wir zusammenfassen?
Evolutionsgegner stellen das Konvergenzproblem gravierender dar, als es ist. Trotz verbreiteter Konvergenzen und der Unsicherheit hinsichtlich der Stellung einiger Taxa ist die Anordnung der Haupttaxa im Stammbaum der Theropoden stabil und unter den Experten unstrittig. Die Vögel sind und bleiben tief ins Taxon der Theropoden eingeschachtelt (RAUHUT & FOTH 2020, S. 37).
Entgegen kreationistischer Darstellungen sind verbreitete Konvergenzen keine Anomalien, sondern unter Berücksichtigung entwicklungsbiologischen Hintergrundwissens eine klare Erwartung der Evolutionstheorie (MCGHEE 2011, S. 7).
Die Vorstellung, dass Evolution kontinuierlich und linear zu verlaufen habe, verträgt sich seit einem halben Jahrhundert nicht mehr mit dem Wissen über die Prozesse der Artdifferenzierung (MAHNER 1986, S. 68). Dass gerade diese Prozesse Diskontinuitäten, Inkongruenzen und einen Zickzackkurs (etwa Rückentwicklungen und Reversionen von Merkmalen in unterschiedlichen Entwicklungslinien) erzeugen, scheint nicht bekannt zu sein.
Kreationisten stellen antiquierte Erwartungen an die Natur evolutionärer Übergangsformen und behaupten, „widersprüchliche“ Merkmals-Mosaike erkannt zu haben. Dass Mosaik-Evolution gerade das Ergebnis von Artaufspaltungen (MAYR 1967, S. 465f) und genetischen Bürden (RIEDL 2003, S. 209) ist, wird verkannt. Kreationisten scheinen das Prinzip der Kladogenese (Stammesverzweigung) nicht verstanden zu haben, sonst würden sie nicht die „phylogenetisch-stratigraphische Diskrepanz“ problematisieren, das heißt das zeitlich spätere Auftreten von einigen Arten mit ursprünglicheren Merkmalen im Fossilienbefund.
Keine Alternativhypothese hat einer kladistischen Prüfung standgehalten, und tatsächlich gibt es seit mehr als 20 Jahren keine spezifischen Alternativhypothesen mehr. Es wurde keine andere Methode der phylogenetischen Analyse vorgeschlagen und argumentiert, um die Kladistik zu ersetzen, weshalb die Fachwelt als Ganzes von diesen Einwänden nicht überzeugt ist (PADIAN & HORNER 2002).
Bisher haben wir unseren Schwerpunkt der Vogelevolution anhand des Fossilberichts und der Kladistik untersucht (inklusive der haltlosen Kritiken des Kreationismus). Aber damit nicht genug. Vögel sind hochspezialisierte Dinosaurier, deren meisten Vertreter in der Lage sind zu fliegen und alle heute lebenden Vögel, die nicht fliegen können, haben ihre Flugfähigkeit sekundär verloren. Wie kam es aber zur Evolution des Fliegens? Welche anatomischen Voraussetzungen und Veränderungen müssen auftreten, damit ein befiederter Dinosaurier sich in die Lüfte erhebt? Das klären wir im nächsten Beitrag.
Literatur
BRUSATTE, S. L. (2017). A Mesozoic aviary. Science, 355, 792–794.
DECECCHI, T. A., ROY, A., PITTMAN, M., et al. (2020). Aerodynamics show membrane-winged theropods were a poor gliding dead-end. iScience, 23, 101574.
DE KRAKER, J.-W., & GERSHENZON, J. (2011). From amino acid to glucosinolate biosynthesis: protein sequence changes in the evolution of methylthioalkylmalate synthase in Arabidopsis. The Plant Cell, 23, 38–53.
DODSON, P. (1990). Counting dinosaurs: how many kinds were there? Proceedings of the National Academy of Sciences, 87, 7608–7612.
ELŻANOWSKI, A. (2002). Biology of basal birds and the origin of avian flight. In ZHOU, Z., & ZHANG, F. (Eds.) Proceedings of the 5thSymposium of the Society of Avian Paleontology and Evolution (S. 211–226). Beijing: Science Press.
FELICE, R. N., & GOSWAMI, A. (2018). Developmental origins of mosaic evolution in the avian cranium. PNAS, 115, 555–560.
FLANNERY-SUTHERLAND, J. T., SILVESTRO, D., & BENTON, M. J. (2022). Global diversity dynamics in the fossil record are regionally heterogeneous. Nature Communications, 13, 2751.
FRASER, G. (2014). “Bizarre structures” point to dromaeosaurs as parasites and a new theory for the origin of avian flight. The Journal of Paleontological Sciences, 6, 1–27.
FUTUYMA, D. J. (2015). Can modern evolutionary theory explain macroevolution? In SERRELLI, E., & GONTIER, N. (Eds.) Macroevolution. Explanation, interpretation, and evidence (S. 29–85). Heidelberg: Springer.
GOULD, S. J. (2002). Illusion Fortschritt. Die vielfältigen Wege der Evolution, 2. Auflage. Frankfurt: S. Fischer Verlag.
HALL, B. K. (2012). Parallelism, deep homology, and evo-devo. Evolution & Development, 14, 29–33.
HÖSSJER, O., BECHLY, G., & GAUGER, A. (2021). On the waiting time until coordinated mutations get fixed in regulatory sequences. Journal of Theoretical Biology, 524, 110657. https://doi.org/10.1016/j.jtbi.2021.110657.
JUNKER, R. (2019). Sind Vögel Dinosaurier? Eine kritische Analyse fossiler Befunde. https://www.tinyurl.com/msw952vh (Kurzversion), https://www.tinyurl.com/4eutmru7 (Langfassung).
JUNKER, R. (2022). Flugsaurier mit Federn? Begriffsverwirrung führt zu verwirrenden Aussagen. https://www.tinyurl.com/yn7p9b6p.
KSEPKA, D. T. (2022). Evolution of birds. In SCANES, C. G., & DRIDI, S. (Eds.) Sturkie’s avian physiology, 7th Edition (S. 83–107). Cambridge: Academic Press.
LONGRICH, N. R., VINTHER, J., MENG, Q., et al. (2012). Primitive wing feather arrangement in Archaeopteryx lithographica and Anchiornis huxleyi. Current Biology, 22, 2262–2267.
LUO, Z.-X., CHEN, P., LI, G., et al. (2007). A new eutriconodont mammal and evolutionary development in early mammals. Nature, 446, 288–293.
MACFADDEN, B. J. (2005). Fossil horses – evidence for evolution. Science, 307, 1728–1730.
MAHNER, M. (1986). Kreationismus. Inhalt und Struktur antievolutionistischer Argumentation. Berlin: Pädagogisches Zentrum Berlin.
MAYNARD SMITH, J. (1983). The genetics of stasis and punctuation. Annual Review of Genetics 17, 11–25.
MAYR, E. (1967). Artbegriff und Evolution. Singhofen: Verlag Paul Parey.
MCGHEE, G. R. (2011). Convergent evolution. Limited forms most beautiful. Cambridge: The MIT Press.
MEAD, L. S. (2009). Transforming our thinking about transitional form. Evolution: Education and Outreach, 2, 310–314.
MIHLBACHLER, M. C., RIVALS, F., SOLOUNIAS, N., et al. (2011). Dietary change and evolution of horses in North America. Science, 331, 1178–1181.
NARAMOTO, S., JONES, V. A. S., TROZZI, N., et al. (2019). A conserved regulatory mechanism mediates the convergent evolution of plant shoot lateral organs. PLoS Biology, 17, e3000560.
NORELL, M. A. (1992). Taxic origin and temporal diversity: the effect of phylogeny. In NOVACEK, M. J., & WHEELER, Q. D. (Eds.) Extinction and phylogeny (S. 89–118). New York: Columbia University Press.
PADIAN, K., & ANGIELCZYK, K. D. (1999). Are there transitional forms in the fossil record? The Paleontological Society Papers, 5, 47–82.
PADIAN, K., & HORNER, J. R. (2002). Typology versus transformation in the origin of birds. Trends in Ecology & Evolution, 17, 120–124.
PENNY, D., FOULDS, L. R., & HENDY, M. D. (1982). Testing the theory of evolution by comparing phylogenetic trees constructed from five different protein sequences. Nature, 297, 197–200.
PENNY, D., & HENDY, M. D. (1986). Estimating the reliability of phylogenetic trees. Molecular Biology and Evolution, 3, 403–417.
PETERSON, T., & MÜLLER, G. B. (2016). Phenotypic novelty in EvoDevo: the distinction between continuous and discontinuous variation and its importance in evolutionary theory. Evolutionary Biology, 43, 314–335.
PFENNINGER, M. (2016). Artbegriff im Wandel der Zeit. In LOZÁN, J. L., et al. (Eds.) Warnsignal Klima: Die Biodiversität (S. 26–31). Hamburg: Verlag Wissenschaftliche Auswertungen.
PITTMAN, M., & XU, X. (2020). Pennaraptoran theropod dinosaurs. Past progress and new frontiers. Bulletin of the American Museum of Natural History, 440, 1–355.
PITTMAN, M., BELL, P. R., MILLER, C. V., et al. (2022a). Exceptional preservation and foot structure reveal ecological transitions and lifestyles of early theropod flyers. Nature Communications, 13, 7684.
PITTMAN, M., Kaye, T. G., Wang, X., et al. (2022b). Preserved soft anatomy confirms shoulder-powered upstroke of early theropodflyers, reveals enhanced early pygostylian upstroke, and explains early sternum loss. PNAS, 119, e2205476119.
PROTHERO, D. R. (2017). Evolution. What the fossils say and why it matters. 2nd edition. New York Chichester, West Sussex: Columbia University Press.
RAUHUT, O. W. M., & FOTH, C. (2020). The origin of birds: current consensus, controversy, and the occurrence of feathers. In FOTH, C., & RAUHUT, O. (Eds.) The evolution of feathers. From their origin to the present (S. 27–45). Berlin: Springer Nature.
RAUP, D. M. (1994). The role of extinction in evolution. Proceedings of the National Academy of Science, 91, 6758–6763.
RIEDL, R. (2003). Riedls Kulturgeschichte der Evolutionstheorie. Berlin: Springer.
SHUBIN, N., TABIN, C., & CARROLL, S. (2009). Deep homology and the origins of evolutionary novelty. Nature, 457, 818–823.
SIMPSON, G. G. (1951). Horses. The story of the horse family in the modern world and through sixty million years of history. New York: Oxford University Press.
SMITH, N. A., CHIAPPE, L. M., CLARKE, J. A., et al. (2015). Rhetoric vs. reality: a commentary on “Bird origins anew” by A. Feduccia. The Auk: Ornithological Advances, 132, 467– 480.
TATTERSALL, I. (1997). Puzzle Menschwerdung. Auf der Spur der menschlichen Evolution. Heidelberg: Spektrum Akademischer Verlag.
TAYLOR, P. (2004). Extinction in the history of life. Cambridge: Cambridge University Press.
THEOBALD, D. (2013). 29+ Evidences for macroevolution. Part 1: The unique universal phylogenetic tree. https://www.tinyurl.com/4kzfp5jt.
TOKITA, M., MATSUSHITA, H., & ASAKURA, Y. (2020). Developmental mechanisms underlying webbed foot morphological diversity in waterbirds. Scientific reports, 10, 8028.
TONKIN, C. J., FOTH, B. J., RALPH, S. A., et al. (2008). Evolution of malaria parasite plastid targeting sequences. PNAS, 105, 4781–4785.
WANG, X., PITTMAN, M., ZHENG, X., et al. (2017). Basal paravian functional anatomy illuminated by high-detail body outline. Nature Communications, 8, 14576.
WILLS, S.; UNDERWOOD, C. J.; BARETT, P. M. (2023). Machine learning confirms new records of maniraptoran theropods in Middle Jurassic UK microvertebrate faunas. Papers in Palaeontology. 9 (2). e1487.
YONA, A. H., ALM, E. J., & GORE, J. (2018). Random sequences rapidly evolve into de novo promoters. Nature Communications, 9, 1530.



