Wir haben und in den vorherigen Teilen entweder mit absurden “philosophischen” Ansichten befasst (Butlers queer-Theorie oder Kutscheras Sympathien für Reaktionäre der AfD und der katholischen Kirche) oder sind sehr tief in die Genetik eingedrungen. An dieser Stelle befassen wir uns nun mit dem Liebesleben im Tierreich. Wer ein Interesse daran hat, wie vielfältig das Sexualleben der Tiere ist ohne viel wissenschaftliches “Blabla”, dem kann ich nur “Das Liebesleben der Tiere” von Katherina von der Gathen empfehlen.
Auf eine pädagogisch sinnvolle und kindgerechte Weise, ohne obszön zu sein, wird das Fortpflanzungsverhalten verschiedener Tiere angesprochen, von der Partnerwahl bis zur Jungenaufzucht ist alles dabei: witzig, schön illustriert und an Fakten orientiert. Wenn jetzt der ein oder andere Konservative mit “heiligen Familienwerten” und mit Stock im Anus (um eigene homosexuelle Gedanken zu unterdrücken) gleich schreit: “Hilfe Frühsexualisierung der armen Kinderchen”: Behaltet den Stock tief drin bei euch und steckt ggf. einen anderen zweiten in eure andere Öffnung (große Unterschiede gibt es da nicht), es geht um Aufklärung, nicht um Pornographie.
Hier sollen nur einige Extrem-Beispiele dargestellt werden.
Haben Männer doch drei Beine?
Die Funktion der Genitalien liegt in der Verbreitung bzw. Aufnahme der Keimzellen. Bei Amnioten (hierzu zählen: Säugetiere, Vögel, “Reptilien”) entwickeln sich die äußeren Genitalien aus der Kloake. Hierbei handelt es sich um ein embryonal angelegtes Organ, welches für die Ausscheidung notwendig ist. Bei Amphibien, “Reptilien”, Vögeln und eierlegenden Säugetieren ist es ein gemeinsamer Körperausgang für die Verdauungs-, Geschlechts- und Exkretionsorgane. Bei lebendgebärenden Säugetieren wird die Kloake zwar embryonal angelegt, aber durch getrennte Ausführöffnungen (Anus, Uro-Genitaltrakt) ersetzt. Einige Säugetiergruppen, wie die auf Madagaskar heimischen Tenreks haben aus zuvor getrennt vorhandenen Körperöffnungen erneut eine sekundäre Kloake entwickelt (B. Riedelsheimer, et al. 2007).
Aber bei allen Amnioten, inklusive der Säugetiere, induziert die embryonal angelegte Kloake die Bildung der Geschlechtsorgane (Tschopp et al. 2014; Herrera and Cohn 2014, Gredler et al. 2014., Vgl. Abb. 1). Die äußeren Genitalien beginnen als eine Schwellung von Zellen, sog. Geschlechtshöcker (Tuberculum genitale), auf beiden Seiten der Kloakenmembran. Entsprechende Experimente haben gezeigt, dass das Seitenplatten-Mesoderm die Quelle der Geschlechtshöcker ist (Schwanzzellen bei Mäusen, Zellen der Schwanz- und Extremitätenknospen bei Hühnern und Zellen der Extremitätenknospen bei Echsen, Vgl. Abb. 1). Das Mesoderm ist eine der embryonal angelegten Zellschichten (Keimblätter) aus denen sich bestimmte Organe entwickeln. Extremitätenknospen sind die embryonalen Anlagen der Gliedmaßen.
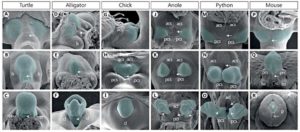
Abb. 1: Elektronenmiskorskopische Aufnahme der externen Geschlechtsorgane. A-C: Schildkröte, D-F: Alligator, G-I: Huhn, J-L: Anolis (Leguan-Gattung), M-O: Python, P-R: Maus; acl: anteriore kloakale Lippe, acs: anteriore kloakale Schwellung, cl: kloakale Lippe, g: Eichel, ls: laterale Schwellung, lss: labioskrotale Schwellung, p: Vorhaut, pcl: posteriore kloakale Lippe, pcs: posteriore kloakale Schwellung, prs: Vorhautschwellung. Quelle: Grendler et al. 2014
Der Grund, weshalb bei verschiedenen Amnioten-Gruppen verschiedene Mesodermzellen für die Ausbildung der Geschlechtsorgane rekrutiert werden, hat mit der Lage der Kloake zu tun, da sie bei den einzelnen Amniotengruppen an verschiedenen Orten angelegt wird. Bei Mäusen entwickelt sich die Kloake beispielsweise hinter den Hinter-Extremitäten, weswegen die Mesodermzellen der Schwanz-Anlage bei der Ausbildung der Genitalien beteiligt sind. Bei Hühnern erstreckt sich die Geschlechtshöcker zwischen Extremitätenknospen und Schwanz. Wird die Kloake bei einem Hühnerembryo an verschiedene Seiten transplantiert, entwickelt sich das benachbarte Seitenplattenmesoderm zum Geschlechtshöcker. Die Zellen der Kloake induzieren also benachbarte Mesodermzellen zur Ausbildung der Geschlechtshöcker (sog. Induktion, Tschopp et al. 2014). Sowohl bei Hühner- wie bei Mäuse-Embryonen verschmelzen die Genitalhöcker, die sich sowohl an der linken wie rechten Körperhälfte entwickeln, zu einer Öffnung (Herrera & Cohn 2014). Das erlaubt die Entwicklung eines Geschlechtsorganes (vgl. Abb. 1: G-I & P-R, Grendler et al. 2014). Bei Schlangen befinden sich die Genitalhöcker auf Höhe der hinteren Extremitätenknospen (Abb. 1: M-O). Bei Schlangen entwickeln sich jedoch keine Gliedmaßen (außer bei den Pythons und Boas, die rudimentäre Hinterbeine haben). Die Extremitätenknospen werden bei Schlangen jedoch für die Ausbildung der Genitalien genutzt. Da sich die Kloake in der Region der Extremitätenknospen befindet und die Kloake die Ausbildung der Genitalhöcker induziert, werden die Extremitätenknospen zu Genitalien umgeformt. Das ist der Grund, weshalb Schlangen auch zwei Kopulationsorgane haben. Die zwei Penisse der Schlange werden als Hemipenes bezeichnet, die beide funktionell sind, aber nicht zur selben Zeit (vgl. Abb. 2). D. h. die Kopulationsorgane der Schlange sind umgewandelte Gliedmaßen. Tatsächlich spielen auch Gene eine Rolle, die bei der Entwicklung der Gliedmaßen exprimiert werden. Die Kloake ist ein Signalzentrum für die Ausbildung von Genitalien durch das Ausschütten des Gens “Sonic Hedgehoc (Shh)” (Haraguchi et al. 2001). “Sonic Hedgehock” (Shh) ist auch bei der Ausbildung von Gliedmaßen wichtig (Tickle & Towers 2017).
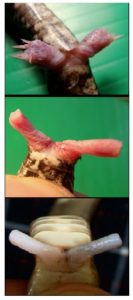
Abb. 2: Hemipenes von Ovophis monticola (Gebirgs-Grubenotter), Pareas margaritophorus (Weißflecken-Schneckennatter), and Naja siamensis (Siameisische Speikobra). https://www.sjonhauser.nl/hemipenes-amazing-copulatory-organs-of-snakes.html
Adams Rippe
Die Ähnlichkeit zwischen Gliedmaßen und Geschlechtsorganen wird auch durch weitere Befunde deutlich. Die meisten Säugetiere (jedoch nicht wir Menschen) haben Knochen in den Genitalien: Os clitoris (Klitorisknochen) bei Weibchen und Os penis (Penisknochen, Baculum) bei Männchen. Es handelt sich hierbei um zurückziehbare Knochen, welche den Kopulationsorganen Stabilität verleihen. Außerdem sorgen sie für die Stimulation des Sexualpartners und Schutz der Harnöffnung (Herdina et al. 2015, Abb. 3). Sie sind typisch für Nagetiere, Raubtiere, Fledermäuse und Primaten. Bei einigen marinen Säugetieren können sie ziemlich groß sein.

Abb. 3: Hund und Mensch. Während bei Hunden ein Baculum vorhanden ist, fehlt dieser bei Menschen. https://www.smithsonianmag.com/smithsonian-institution/grover-krantz-donated-his-body-to-science-on-one-condition-38726179/
Die Entwicklung des Baculums der Nagetiere ist durch einen Satz von HoxD-Transkriptionsfaktoren reguliert (Zákány et al. 1997), die durch Mitglieder der TGF-b1 und BMP Familien (ebenso Transkriptionsfaktoren) induziert werden (Origuchi et al. 1998). Die Hox-Gene (wichtige regulatorische Gene für die Entwicklung der Organismen), die für die Entwicklung der Finger und Zehen notwendig sind, finden sich auch im Baculum (Lonfat et al. 2014). Es ist nicht bekannt, weshalb bei Menschen das Baculum fehlt. Möglicherweise hat es mit der Entwicklung des aufrechten Gangs zu tun, wodurch das Baculum anfälliger für Verletzungen wäre.
Besonders interessant ist, wenn wir das fehlende Baculum des Mannes mit der Schöpfungsgeschichte der Bibel verbinden. Natürlich ist die biblische Schöpfungsgeschichte nicht wörtlich zu nehmen, doch liefern sie interessante Geschichte wie die Menschen damals die Welt betrachteten. Jeder, der die Schöpfungsgeschichte der Genesis kennt, weiß, dass Gott Eva aus Adams Rippe formte. Das “logische” Problem ist aber, dass Adam immer noch seinen vollen Satz an Rippen hat. So wurde in einer gemeinsamen Publikation des Entwicklungsbiologen S. F. Gilbert und des Bibel-Forscher Z. Zevit vorgeschlagen, dass mit der Rippe Adams, aus welcher Gott in der Schöpfungsgeschichte die Eva schafft, tatsächlich der Penisknochen gemeint ist. Bei der Rippe würde es sich damit um eine Fehlübersetzung eines hebräischen Euphemismus für Penisknochen handeln (Gilbert & Zevit 2001). Ich kann nicht die “Richtigkeit” dieser Interpretation bestätigen oder widerlegen (und sie wird auch nicht von allen geteilt). Es ist aber ein schönes Beispiel dafür, dass zwei verschiedenen Disziplinen miteinander kooperieren können.
Gut zu Vögeln…
Männliche Vögel unterscheiden sich enorm in ihren externen Genitalien. Beispielsweise unterscheiden sich männliche Hühner und Enten in ihrer Penisgröße. Hühner haben keinen wirklichen externen Phallus, was besonders rätselhaft erscheint, vergleicht man dies mit dem beachtlichen Penis von Gänsen und Enten (McCracken et al. 2001, Abb. 4). Jedoch sind Hühner die Norm, denn weniger als 5% aller männlichen Vogelarten haben einen Phallus, der zur Penetration fähig ist (neben Gänsen findet sich solch ein Phallus auch bei Laufvögeln). Der Wirkstoff, der eine Verkürzung des Hühner-Phallus einleitet ist der Transkriptionsfaktor BMP4, der (ähnlich wie bei der Entstehung von Fingern) einen Zelltod (Apotopsis) im Genitalhöcker einleitet. In der Zeit indem sich der Phallus entwickeln sollte findet sich BMP4 in den entsprechenden Zellen bei Hühnern, nicht jedoch bei Enten. Eine Zugabe des Proteins Noggin in die Genitalhöcker von Hühnern hemmt (inhibiert) die Funktion von BMP4 (Herrera et al. 2013).
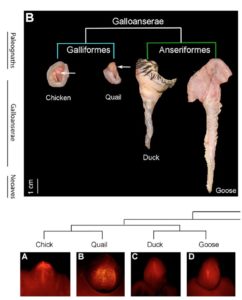
Abb. 4: Penis-Entwicklung bei Vögeln. Wie bei den meisten Vögeln haben Hühner und Wachteln einen sehr reduzierten Penis, das zur Penetration unfähig ist. Enten und Gänse haben hingegen einen größeren Penis.
Damit Spermien in das Weibchen eindringen können betreiben Vögel mit kleinem Phallus einen sogenannten “Kuss der Kloake”. Dabei sammelt das Männchen in seiner Kloakenöffnung das Sperma und transferiert dieses in die Kloakenöffnung des Weibchens, die sich in entsprechend positioniert und ihre Vagina öffnet (Abb. 5). Die Wortherkunft des eher vulgär benutzten Wortes “vögeln” stammt aus dem Mittelhochdeutschen und bezeichnete tatsächlich die Begattung bei Vögeln und wurde erst später auf die Menschen übertragen (Pschyrembel Wörterbuch Sexualität 2006, S. 577-578).
Abb. 5: Begattung bei Vögeln. Beim Kuss der Kloake dringen die Spermien in das Weibchen ein. Quelle: http://www.projekt.didaktik.mathematik.uni-wuerzburg.de/mathei/eibio/embryonalentwicklung.htm
Echte Mannsweiber
Normalerweise sorgt das Hormon Testosteron dafür, dass die Genitalhöcker des Embryos sich zu einem Penis formen (Rodriguez et al. 2012). Hormonelle (oder genetische) Störungen können jedoch zu einem Abweichenden Bild führen, man spricht von Intersexualität. Doch diese Intersexualität scheint bei der Flecken-Hyäne (Crocuta crocuta) “normal” zu sein, weil weibliche Hyänen eine Klitoris haben, die in Länge und Form einem Penis ähnelt. Weibliche Fleckenhyänen sind die einzige Säugetierart die ihre Klitoris nicht nur zur Kopulation, sondern auch zur Geburt einsetzen; ihnen fehlt auch eine Vaginalöffnung, Abb. 6). Die Tiere sind aber nicht per Definition “Intersexuell” sondern eindeutig weiblich, weil sie a) fruchtbar sind und b) weibliche Keimzellen produzieren. Bei dieser Art hängt das Wachstum von Penis und Klitoris nicht vom Testosteron ab, wenn auch Details der anatomischen Unterschiede testosteronabhängig sind. Die Mechanismen sind aber nicht ganz geklärt (Cunha et al. 2014).
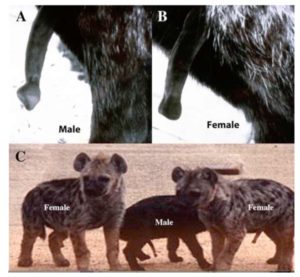
Abb. 6: erregierter Penis einer männlichen Hyäne (A) und Klitoris eines Weibchens (B). wenn auch beide lang sind und vom Körper abstehen, sind sie klar unterscheidbar durch die unterschiedliche Form der Spitze. C zeigt drei Jungtiere (3-4 Monate alt) mit voller Errektion. Quelle: Cunha et al. (2014.)
Bei Hyänen sind auch die Weibchen dominanter und aggressiver als die Männchen, haben auch einen höheren Testosteronspiegel. Eine Langzeitstudie an Flecken-Hyänen des Ngoro-Ngoro-Kraters in Tansania, bei der seit 1996 8 Hyänen-Clans (bis zu 130 Tiere pro Clan) beobachtet wurden und 4133 Interaktionen, bei denen 748 Hyänen beteiligt waren, konnten herausfinden, dass die höhere Aggression und der höhere Testosteronspiegel alleine nicht ausreichend sind, um die Dominanz der Weibchen zu sichern. Eine viel größere Rolle spielte die soziale Unterstützung durch andere Clan-Mitglieder. Wenn zwei Hyänen miteinander in Konflikte geraten, ist es – unabhängig vom Geschlecht oder der Körpergröße – die Unterstützung durch andere Hyänen, die den Sieger bestimmen. Die Körpermasse hat praktisch keinen Einfluss. Das Geschlecht spielt insofern eine Rolle, das das Sozialsystem auf eine Kooperation der Weibchen aufbaut. Das Geschlecht alleine reicht aber nicht aus, um als Sieger hervorzugehen. Weibchen dominieren durch ihre soziale Unterstützung, was durch ihre matrilineare Organisation wesentlich leichter ist: Weibchen verlassen selten den Clan, in dem sie geboren sind, nur die Männchen wandern ab. Dadurch haben Weibchen eine höhere Chance ranghöher zu sein als Männchen, da neu eingewanderte Männchen in einen Clan die Unterstützung der Weibchen brauchen (Vullioud et al. 2018). Eine Zusammenfassung der Arbeit findet sich auch hier:
Zweifelsohne Hyänen sind echt coole Tiere und bei weitem nicht die dummen und faulen Aasfresser oder Bösewichter, sondern bei der Jagd durchaus erfolgreicher als Löwen.
Wenn Männer “schwanger” werden …
Seepferdchen (Gattung Hippocampus) sind schon merkwürdige Fische. Nicht nur ihre Köperform weicht von denen anderer “typischer” Fische ab, sondern auch ihr Paarungsverhalten. Die Männchen tragen unter ihrem Schwanz einen oben mit einer Öffnung versehenen Brutbeutel. Zur Paarungszeit schwimmen sie den Kopf reckend um die Weibchen herum, wobei sie den Beutel mit Wasser vollpumpen und ihn so öffnen.
Während eines ausdauernden Liebesspiels schwimmen die Partner gemeinsam zur Wasseroberfläche, umfassen sich dort mit dem Schwanz und drehen sich einige Zeit im Kreis; dabei legt das Weibchen bis zu 200 Eier in den Beutel. Hier angekommen werden sie befruchtet (ein Paar kann in einem Jahr bis zu 15 Mal Nachwuchs haben). Die Männchen werden also nicht schwanger und sind auch klar männlich (Millus 2000, Robinson 2013, Masonjones & Lewis 1996, Abb. 7).
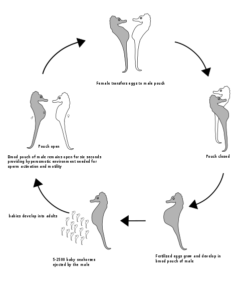
Abb. 7: Paarungsverhalten der Seepferdchen. Quelle: wikipedia
Transen-Fische
Bei einigen Arten ist dokumentiert, dass sie unter bestimmten Umständen ihr Geschlecht wechseln können. Dies ist u. a. beim Tabak-Sägebarsch (Serranus tabacarius) dokumentiert. Diese Art ist ein Beispiel für simultanen Hermaphroditismus, d. h. sie können von einem Moment zum nächsten als Männchen und dann als Weibchen fungieren. Wenn sich zwei Tiere treffen und in Paarungsstimmung sind, beginnt einer der Fische die Rolle des Weibchens zu übernehmen und initiiert damit das Balzverhalten. Sobald die Paarung abgeschlossen ist, tauschen sie ihre Rollen (und Geschlechter, Petersen 1995, 2006).
Neben des simultanen Hermaphroditismus existiert auch der sequentielle. Hier fungieren die Organismen als ein Geschlecht, aber bestimmte Bedingungen führen dazu, dass sich ein weibliches Tier in ein männliches Umwandeln kann oder anders rum, so beim Blaukopf-Junker (Thalassoma bifasciatum), eine Art der Familie der Lippfische. Diese karibischen Korallenfische haben einen Typ Weibchen, aber zwei alternative Männchen-Typen, die für zwei unterschiedliche soziale Bedingungen angepasst sind. Man stelle sich vor man lebt als jugendlicher Blaukopf-Junker ein einem kaum besiedelten Korallenriff. Unter solchen Umständen verteidigen einige wenige männliche schön gefärbte Blaukopf-Junker die wenigen Brutplätze und paaren sich mit den Weibchen. In solchen stark konkurrierenden Gebieten monoplisieren wenige Männchen die Gegend und es ist für den jugendlichen Blaukopf-Junker daher sinnvoll sich als Weibchen zu entwickeln. Man kann wachsen, wird größer und kann ggf. zu einem Männchen werden, wenn sich die Gelegenheit ergibt. Dies kann passieren, sobald eines der Männchen stirbt und man wechselt schnell das Geschlecht und wird vom Weibchen zum Männchen. Doch dieser Geschlechterwechsel kann einige Tage dauern und in dieser Zeit können auch andere Weibchen sich in ein Männchen verwandeln, von denen aber nur einer das Brutgebiet dominieren kann. Folgerichtig muss der Geschlechterwandel der anderen Weibchen unterdrückt werden und das funktioniert am besten, wenn einer der Weibchen sich wie ein dominantes Männchen verhält. Denn die Veränderung des Verhaltens geht viel schneller voran als die körperliche Veränderung. Dieses männliche Verhalten kann das Gehirn erzeugen, ohne dass dafür die Eierstöcke in Hoden umgewandelt werden müssen. Ist das Männerverhalten erreicht, kann der Fisch darauf warten bis sich die Hoden entwickeln. Die Weibchen entwickeln sich zu sekundären Männchen, weil die Hoden der Tiere früher Eierstöcke waren. Dies geschieht unter Bedingungen mit geringer Populationsdichte. Die primären Männchen, die ihre Hoden zuerst entwickelten, sind kleiner und nicht so bunt gefärbt wie die sekundären Männchen. Sie kommen in stark besiedelten Gebieten vor, wo also viele Blaukopf-Junker vorkommen (Munday et al. 2006, Semsar & Godwin 2003). Ein Wechsel der Geschlechter ist auch bei einigen Froscharten dokumentiert worden, z. B. Gewöhnlichen Riedfrosch (Hyperolius viridiflavus) aus Zentralafrika (Grafe & Linsenmair 1989).
Eine andere Fischart, der Blaue Sonnenbarsch (Lepomis macrochirus) haben zwei verschiedene Männchentypen. Die “Eltern-Männchen” erreichen ihre Geschlechtsreife mit sieben Jahren und sind recht groß. Sie bauen Nester und verteidigen diese gegen Eindringlinge. Kommt ein Weibchen zum Nest, laicht sie ihre Eier ab, die vom Männchen befruchtet werden. Das Überleben der befruchteten Eier hängt vom Schutz der Männchen ab. Neben diesen parentalen Männchen, gibt es sogenannte “Satelliten-Männchen”. Sie werden mit zwei Jahren geschlechtsreif und sind deutlich kleiner und schneller. Sie befruchten Eier indem sie in ein Nest eindringen und ihr Sperma abgeben. Um nicht vom “Eltern-Männchen” angegriffen und vertrieben zu werden haben sie die gleiche Färbung wie die Weibchen (Neff et al. 2003).
Männer sind Parasiten!
Bei einigen Fischarten ist der Unterschied der Geschlechter ziemlich groß. Ein gutes Beispiel sind einige Arten der Tiefseeanglerfische, bei dem die Weibchen um ein Vielfaches größer sein können als die Männchen! Bei der Art Ceratias holboelli sind die Weibchen 60 mal so lang und eine halbe Millionen mal schwerer als die Männchen (vgl. Abb. 8).
Wenn ein Männchen mit seinen großen Augen und Nasenlöchern ein Weibchen findet, verbeißt er sich in das Weibchen. Einmal angebissen verschwindet auch seine Individualität, da sich Körper und Blutgefäße miteinander verschmelzen. Sie versorgt das Männchen mit Nährstoffen und Sauerstoff, er liefert dafür die Spermien. Wir haben es hier mit einem sogenannten Sexualparasitismus zu tun (Pietsch 2005).

Abb. 8: Ceratias holboelli ganz groß das Weibchen und an der Bauchseite (Bildmitte) das Männchen. Quelle: wikipedia
Sind männliche Anglerfische richtig klein, sind sie beim Amazonenkärpfling (Poecilia „formosa“) geradezu verschwunden. Von dieser in Texas und Mexiko vorkommenden Fischart sind nämlich nur Weibchen bekannt. Diese Art entstand ursprünglich durch die Hybridisierung zweier nah verwandter Arten (Poecilia mexicana und Poecilia latipinna). Eigentlich produziert der Amazonenkärpfling diploide Eizellen, pflanzt sich also ungeschlechtlich fort. Interessanterweise benötigen sie aber die Spermien nah verwandter Arten, damit die Teilung der Eizelle initiiert werden kann. Das Gen-Material der Spermazelle wird aber nicht verwendet! (Lampert & Schartl 2008). Diese Form der ungeschlechtlichen Fortpflanzung, bei der die Eizelle durch Kontakt mit einer Spermazelle zur Teilung gebracht wird, ohne dass das gen-Material der Spermazelle aufgenommen wird bezeichnet man als Gynogenese.
Es geht aber auch komplett ohne Männchen
Einige Arten der amerikanischen Schienenechsen (Teiidae) haben nur Weibchen. Sie pflanzen sich asexuell fort (sogenannte Parthenogenese) und aus den Eier schlüpfen nur Weibchen (Maslin 1962).
Eine solche Parthenogenese ist auch bei Komodo-Waranen (Varanus komodoensis) beobachtet worden, zumindest in Zoos. Hier besteht aber die Besonderheit, dass nach der Ablage solcher Eier nur Männchen schlüpfen. Das hängt mit dem ZW-System der Geschlechtsdetermination zusammen, die bei Waranen erfolgt. Bei der Parthenogenese entstehen bei Waranen offensichtlich nur Tiere mit einem ZZ (Männchen)-Chromosomensatz oder mit einem WW-Chromosomensatz, die nicht lebensfähig sind (Watts et al. 2006).
Wenn Bakterien dein Geschlecht beeinflussen
Es geht aber noch absurder: Wolbachia ist eine parasitisch lebende Bakteriengattung, die hauptschlich Insekten, aber auch andere Arthropoden und Nematoden befällt. Man schätzt dass 25-70% aller Insektenarten von dieser Bakterienart befallen sind (Taylor 2018, Kozek & Rao 2007). Sie sind auch dafür bekannt, dass sie häufig in den Geschlechtsorganen ihrer Wirte leben und so deren Fortpflanzung beeinflussen können. Dabei bevorzugen sie Eizellen, nicht jedoch Spermazellen. Um die Verbreitung von Wolbachia zu fördern, hat diese Bakteriengattung eine Reihe von Strategien entwickelt (vgl. Abb. 9):
– das Töten infizierter Männchen während der Larvenentwicklung, wodurch die Rate der geborenen und infizierten Weibchen erhöht wird (Hurst et al. 1999).
– Feminisierung infizierter Männchen, was häufig bei Schmetterlingen vorkommt (Fuji et al. 2001).
– Förderung der Parthenogenese. So z. B. bei der Wespen-Gattung Trichogramma, welche durch die Präsenz von Wolbachia sich ohne Männchen fortpflanzt (Knight 2001, Murray 2009)
– Verhinderung einer Befruchtung nicht infizierter Weibchen durch cytoplasmatische Inkompatibilität (Breeuwer & Werren 1990)

Abb. 9: links: Wolbachia-Bakterien innerhalb einer Insektenzelle, rechts: Einfluss von Wolbachia auf die Fortpflanzung
Auch ohne Horn “horny”
Die Überfamilie Scarabaeoidea ist mit 14 Familien, 2000 Gattungen und etwa 35.000 Arten eine sehr vielfältige Familie der Käfer, zu denen einige besonders spektakuläre Arten gehören: Nashornkäfer, Herkuleskäfer, Maikäfer, Heiliger Pillendreher, Rosenkäfer, Hirschkäfer, Goliathkäfer etc. hier finden sich nicht nur die größten Käferarten (Herkuleskäfer, Goliathkäfer), sondern auch sehr viele Arten mit spektakulären Hörnern. Genauer gesagt sind die Männchen mit Hörnern und Schildern bewährt. Damit kämpfen sie um die Weibchen.
Bei einer Art, Onthophagus taurus, gibt es Männchen mit Hörnern und ohne Hörner (die Weibchen sind immer hornlos, Vgl. Abb. 10). Für die Entwicklung der Larven wird Dung benötigt. Die Weibchen graben Bruttunnel unter Dunghaufen und transportieren Teile des Dungs in den Stollen. Aus dem eingetragenen Dung werden Kugeln geformt und am Ende des Tunnels platziert. Dann wird in die Dungkugel eine kleine Eikammer gegraben in die ein einzelnes Ei gelegt wird. Die Eikammer wird verschlossen und das Ei dann sich selbst überlassen. Die gesamte Nahrung der Larve besteht aus der für sie geformten Dungkugel. Die Männchen nutzen ihre Hörner bei aggressiven Kämpfen um die Zugänge zu den Tunneln der Weibchen. Der Sieger ist Besitzer des Bruttunnels und darf sich mit dem Weibchen paaren. Gehörnte Männchen bleiben in der Regel bei einem Weibchen, bewachen es und helfen dabei den Bruttunnel fertigzustellen. Männchen die hingegen keine oder verkümmerte Hörner haben, nutzen eine andere Strategie. Sie halten sich versteckt am Eingang bereits besetzter Bruttunnel auf und schleichen sich in die Tunnel zu den Weibchen, wenn ihr Partner sich gerade außerhalb des Tunnels aufhält. Oder sie verstecken sich in dem manchmal stark verzweigten Bruttunnel-System und weichen so dem dominanten Männchen aus. Aufgrund der fehlenden Hörner bewegen sie sich deutlich geschickter als ihre gehörnten Konkurrenten. Die Paarung kann auch außerhalb des Bruttunnels stattfinden, wenn das Weibchen gerade Dung für die Brut sammelt. Auf diese Weise kommen auch kleinere Männchen zum Paarungserfolg (Moczek 1999, Moczek & Emlen 2000).

Abb. 10: männliche und weibliche Käfer bei Onthophagus taurus. Quelle: http://extendedevolutionarysynthesis.com/conditional-gene-expression-developmental-plasticity-diversification-horned-beetles/
Die Frage, die hier noch offen bleibt? Wie entstehen eigentlich bei Ontophagus taurus Männchen mit Hörnern und ohne Horn? Mehrere Studien haben belegt, dass hier der Faktor Ernährung eine wesentliche Rolle spielt, der dann Einfluss auf das Hormonsystem und die Genexpression nimmt. Es ist also ein epigenetischer Prozess (Moczek 2017, Kijimoto & Moczek 2016, Kijimoto, Moczek & Andrews 2011, Hunt & Simmons 2000).
Diese Beispiele – und es gäbe noch etliche mehr – aus dem Tierreich haben die vielfältigen Formen der Geschlechtsentwicklung gezeigt. Doch wie vielfältig die Formen auch sein mögen … es treten immer zwei Geschlechter auf, auch wenn es bei einigen Arten zwei Typen von Männchen gibt, es bleiben Männchen.
Wir werden uns nun im nächsten Teil mit dem Gehirn befassen …
Literatur
Cunha, G. R. and 17 others. 2014. Development of the external genitalia: perspectives from the spotted hyena (Crocuta crocuta). Differentiation 87(1–2): 4–22.
Fujii, Y.; Kageyama, D.; Hoshizaki, S.; Ishikawa, H.; Sasaki, T. (2001-04-22). “Transfection of Wolbachia in Lepidoptera: the feminizer of the adzuki bean borer Ostrinia scapulalis causes male killing in the Mediterranean flour moth Ephestia kuehniella”. Proceedings of the Royal Society of London B: Biological Sciences. 268 (1469): 855–859.
Gilbert, S. F. and Z. Zevit. 2001. Congenital human baculum deficiency: the generative bone of Genesis 2:21-23. Am J Med Genet. 101(3): 284–285.
Grafe, T. U.; K. E. Linsenmair (1989). “Protogynous sex change in the reed frog: Hyrperolius viridiflavus”. Copeia. 4 (4): 1024–1029.
Gredler, M. L. and 7 others. Evolution of External Genitalia: Insights from Reptilian Development. Sex Dev. 8(5): 311–26. doi: 10.1159/000365771.
Haaretz.com (2015): Why God Didn’t Use Adam’s Penis Bone to Make Eve
Haraguchi et al. 2001: Unique functions of Sonic hedgehog signaling during external genitalia development. Development 2001 128: 4241-4250;
Herdina, A. N., D. A. Kelly, H. Jahelková, P. H. Lina, I. HoráČek and B. D. Metscher. 2015. Testing hypotheses of bat baculum function with 3D models derived from microCT. J Anat. 226(3): 229–235.
Herrera, A. M., S. G. Shuster, C. L. Perriton and M. J. Cohn. 2013. Developmental Basis of Phallus Reduction during Bird Evolution. Current Biology. 23(12): 1065–1074.
Herrera, A. M. and M. J. Cohn. 2014. Embryonic origin and compartmental organization of the external genitalia. Sci Rep. 2014, Nov. 5; 4: 6896.
Hunt, J., & Simmons, LW (2000): Maternal and paternal effects on offspring phenotype in the dung beetle Onthophalgus taurus. Evolution 54, 936 – 941
Hurst G., Jiggins F. M., Graf von Der Schulenburg J. H., Bertrand D., et al. (1999). “Male killing Wolbachia in two species of insects“. Proceedings of the Royal Society B. 266 (1420): 735–740.
Teiya Kijimoto, Armin P. Moczek, Justen Andrews (2011): Diversification of doublesex function underlies morph-, sex-, and species-specific development of beetle horns PNAS December 11, 2012 109 (50) 20526-20531
Teiya Kijimoto and Armin P. Moczek (2016): Hedgehog signaling enables nutrition-responsive inhibition of an alternative morph in a polyphenic beetle PNAS May 24, 2016 113 (21) 5982-5987;
Knight J (5 July 2001). “Meet the Herod Bug“. Nature. 412 (6842): 12–14.
Kozek, Wieslaw J.; Rao, Ramakrishna U. (2007). “The Discovery of Wolbachia in Arthropods and Nematodes – A Historical Perspective“. Issues in Infectious Diseases. Issues in Infectious Diseases. 5 (Wolbachia: A Bug’s Life in another Bug): 1–14.
K.P. Lampert, M. Schartl: The origin and evolution of a unisexual hybrid: Poecilia formosa. Philos Trans R Soc Lond B Biol Sci. 2008 Sep 12;363(1505):2901-9.
Lonfat, N., T. Montavon, F. Darbellay, S. Gitto and D. Duboule. 2014. Convergent evolution of complex regulatory landscapes and pleiotropy at Hox loci. Science 346(6212): 1004–1006.
Maslin, P. T. (1962): All-Female Species of the Lizard Genus Cnemidophorus, Teiidae Science 19 Jan 1962: Vol. 135, Issue 3499, pp. 212-213
Masonjones, Heather D.; Lewis, Sara M. (1996). “Courtship Behavior in the Dwarf Seahorse, Hippocampus zosterae”. Copeia. 1996 (3): 634–640.
Milius, S. (2000). “Pregnant: And Still Macho” (PDF). Science News. 157 (11): 168.
Armin P. Moczek: Facultative paternal investment in the polyphenic beetle Onthophagus taurus: the role of male morphology and social context. In: Behavioral Ecology. 1999. Volume 10, Issue 6, pp. 641-647.
Armin P. Moczek (2017): Conditional gene expression, developmental plasticity, and the diversification of horned beetles
Armin P. Moczek, Douglas J. Emlen: Male horn dimorphism in the scarab beetle, Onthophagus taurus: do alternative reproductive tactics favour alternative phenotypes? In: Animal Behaviour. 2000. No. 59, 459-466.
Munday, PL, et al. (2006): A social basis for the developement of primary males in a sex-changing fish. Proceeding of the royal society of London B 273, 2845 – 2851
Murray, Todd. “Garden Friends & Foes: Trichogramma Wasps”. Weeder’s Digest. Washington State University Whatcom County Extension. Archived from the original on 2009-06-21. Retrieved 16 July 2009.
Neff, BD, Fu, P., Gross MR (2003): Sperm investment and alternative mating tactics in bluefull sunfish (Lepomis macrochirus). Behavioral Ecology 14, 634 – 641.
Origuchi, N., Y. Ishidou, T. Nagamine, T. Onishi, S. Matsunaga, H. Yoshida and T. Sakou. 1998. The spatial and temporal immunolocalization of TGF-beta 1 and bone morphogenetic protein-2/-4 in phallic bone formation in inbred Sprague Dawley male rats. In Vivo 12(5): 473–480.
Petersen CW. Reproductive behavior, egg trading, and correlates of male mating success in the simultaneous hermaphrodite, Serranus tabacarius, Env Biol Fish, 1995, vol. 43 (pg. 351-61)
Petersen CW. (2006): Sexual selection and reproductive success in hermaphroditic seabasses Integrative and Comparative Biology, Volume 46, Issue 4, 1 August 2006, Pages 439–448,
Pietsch, Theodore W. (25 August 2005). “Dimorphism, parasitism, and sex revisited: modes of reproduction among deep-sea ceratioid anglerfishes (Teleostei: Lophiiformes)“. Ichthyological Research. 52 (3): 207–236.
Riedelsheimer, Pia Unterberger, H. Künzle und U. Welsch: Histological study of the cloacal region and associated structures in the hedgehog tenrec Echinops telfairi. Mammalian Biology 72, 2007, S. 330–341
Robinson, James L (2013). Seahorses.
Rodriguez, E. Jr. and 8 others. 2012. Specific morphogenetic events in mouse external genitalia sex differentiation are responsive/dependent upon androgens and/or estrogens. Differentiation 84: 269–279.
Semsar, K. & Goldwin, J (2003): Social influences on the arginine vasotycin system are independent of gonads in sex-changing fish. Journal of Neuroscience 23, 4386 – 4393
Taylor, M.J. (2018). “Microbe Profile: Wolbachia: a sex selector, a viral protector and a target to treat filarial nematodes”. Microbiology 164: 1345-1347
Tickle, C. & Towers, M. (2017): Sonic Hedgehog Signaling in Limb Development Front Cell Dev Biol. 2017; 5: 14.
Tschopp, P. and 8 others. 2014. A relative shift in cloacal location repositions external genitalia in amniote evolution. Nature 516(7531): 391–394.
Vullioud, E. Davidian, B. Wachter, F. Rousset, A. Courtiol & O.P. Höner, “Social support drives female dominance in the spotted hyaena,” Nature Ecology & Evolution, 2018.
C. Watts et al. (2006): Parthenogenesis in Komodo dragons. Nature 444, S. 1021–1022,
Zákány, J., C. Fromental-Ramain, X. Warot and D. Duboule. 1997. Regulation of number and size of digits by posterior Hox genes: a dose-dependent mechanism with potential evolutionary implications. Proc Natl Acad Sci U S A. 94(25): 13695–700.


