Moderne Vögel – die Neornithes – sind die einzigen überlebenden Dinosaurier. Alle anderen Dinosaurier, auch verschiedene Mitglieder der Avialae wie die Enantiornithes und Gattungen wie Hesperornis und Ichthyornis überlebten das Massenaussterben am Ende der Kreidezeit nicht. Wir haben den evolutionären Prozess der Entstehung dieser Gruppe aus den Dinosauriern bis in die anatomischen Details vorgestellt. Was hat aber dazu geführt, dass die Neornithes so besonders sind, dass sie das große Massenaussterben überleben konnten?
Text als pdf
Neornithes
Doch beginnen wir erst einmal, was die Neornithes überhaupt definiert: worin unterscheiden sie sich von anderen Mitgliedern der Avialae wie Archaeopteryx, Confuciusornis oder den Enantiornithes?
Zu den evolutionären Neuheiten (Synapomorphien), die die Monophylie von Neornithes belegen, gehören das Fehlen von Zähnen, die Verschmelzung der Symphyse zwischen den beiden Hälften des Unterkiefers und das Vorhandensein von drei Gelenkfacetten am ventralen Ende des Quadratum. Das Quadratum ist ein Knochen im Unterkiefer, welches bei den Wirbeltieren das primäre Kiefergelenk bildet. Bei den Säugetieren, welches ein sekundäres Kiefergelenk haben, ist das Quadratum einer der Mittelohrknochen, nämlich der Amboss (incus). Die Neornithes haben auch einen komplexen Hypotarsus, ein knöcherner Wulst am Mittelfußknochen. Weiterhin fehlen ihnen die Bauchrippen (Gastralia) und sie haben eine pneumatischere Ohrregion als frühere Vögel. Manchmal wird angenommen, dass einige oder alle dieser Merkmale die Neornithes zu besseren Fliegern oder anpassungsfähigeren Fressern machten als die anderen Avialae (Naish 2012, Hope 2002). Es sollte jedoch immer bedacht werden, dass Vögel schon mehr als 70 Millionen Jahre vor dem Auftreten der Neornithes weit verbreitet und vielfältig waren.
Die meisten Studien zur molekularen Datierung deuten auf eine evolutionäre Radiation der Neornithes in der Kreidezeit hin, während fossile Beweise auf eine Radiation im Känozoikum hindeuten. Bedingt durch die Seltenheit der Fossilisation dürften molekulare Daten aber eine gewisse Aussagekraft haben. Die neuesten Arbeiten zeigen, dass sich die wichtigsten Hauptgruppen (Urkiefervögel, Hühner- und Gänsevögel sowie Neoaves) bereits vor 100 bis 75 Mio. Jahren auseinander entwickelten (z.B. Field et al. 2020, Abb. 1). Gestützt wird dies auch durch Fossilien, die eindeutig den Neornithes zugeordnet werden: Vegavis (Clarke et al. 2005, Agnolin et al. 2017), Austinornis (Clarke 2004) und Asteriornis (Field et al. 2020) sind drei kreidezeitliche Gattungen, die in die Verwandtschaft der Gänse- und Hühnervögel eingeordnet werden (Abb. 2).
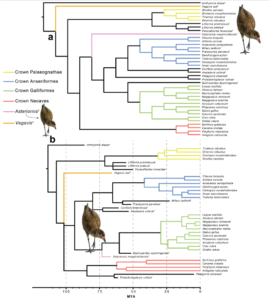
Abb. 1: a, Ergebnisse der Parsimony-Analyse. Asteriornis (rosa) wird als Schwestertaxon der Kronen-Galloanserae aufgelöst. b, Ergebnisse der Bayes’schen Analyse mit einem Alter der Neornithes von 86,5 Millionen Jahren (nach Field et al. 2020).
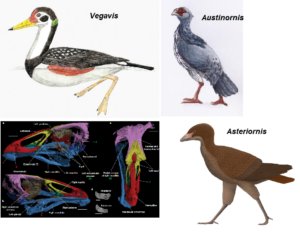
Abb. 2: Kreidezeitliche Neornithes
Warum haben so viele Neornithes Linien bis ins Känozoikum überlebt, während andere avialische Linien offenbar nicht überlebt haben? Möglicherweise waren die Neornithinen widerstandsfähiger gegen ökologische Störungen, mobiler oder schneller im Wachstum oder in der Fortpflanzung als die Nicht-Neornithinen. Die dürftige Überlieferung von Vögeln aus dem Paläozän bedeutet jedoch, dass das scheinbare Aussterben der Nicht-Neornithinen möglicherweise nicht so real ist, wie es scheint: Qinornis aus dem frühen Paläozän Chinas soll eine nicht-neornithine Linie repräsentieren (Mayr 2009, Xue 1995, Longrich et al. 2011, Abb. 3), was auf die Möglichkeit hindeutet, dass einige Gruppen weiterlebten und den Neornithinen im Hinblick auf das Überleben nicht unterlegen waren. Andererseits ist es aber auch denkbar, dass einige nicht-neornithine Gruppen vor dem Ende des Maastrichtiums verschwunden sind. In den letzten Jahren sind aber einige Studien erschienen, die etwas Klarheit über den Erfolg der Neornithes gegenüber ihren Dinosaurier-Verwandten bringen.

Abb. 3: Qinornis
Rolle der Ernährung
Eine dieser Studien (Larson et al. 2016, Abb. 4) legt nahe, dass die Ernährung der Schlüssel dazu sein könnte. Hierfür schauten sich die Forscher die Zähne der Maniraptora, inklusive der Dromeosaurier und Avialae, an, insgesamt wurden Daten von 3.000 Exemplaren gesammelt. Mit Hilfe statistischer Analysen verfolgten sie dann, wie sich die Variabilität der Zahnform in den letzten 18 Millionen Jahren der Kreidezeit veränderte, also in einer Zeit, in der die Dinosaurier nichts von dem Schrecken ahnten, der aus dem Weltall kommen sollte. Ihre Ergebnisse zeigen, dass es zu keiner Veränderung der Variation in der Zahnform gekommen ist. Das heißt wiederrum, dass die bezahnten Maniraptoren sich in ihren Ernährungsgewohnheiten nicht veränderten. Dies ist insofern interessant, weil die Neornithes gegenüber vielen ihrer Verwandten zahnlos waren. Viele andere Avialae-Gruppen, namentlich die Enantiornithes, aber auch solche wie Ichthyornis und Hesperornis, die alle sehr vogelähnlich aussehen, haben Schnäbel mit Zähnen. Die Ergebnisse der Forschung deuten darauf hin, dass die Zahnlosigkeit den Neornithes einen enormen Vorteil verschaffte.
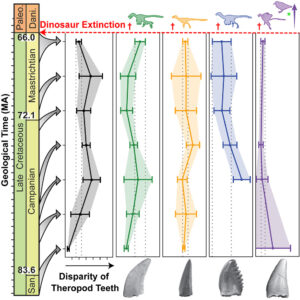
Abb. 4: Veränderung der Zähne verschiedener Maniraptora in der Kreidezeit. Graphical Abstract von Larson et al. (2016)
Paläontologen haben festgestellt, dass einige Dinosauriergruppen, darunter auch Vögel, Schnäbel entwickelten und ihre Zähne verloren, als sie zu Pflanzenfressern wurden. Während die ersten Vögel Zähne hatten, um Insekten und andere kleine Tiere zu fangen, spezialisierten sich einige Vogelstämme auf Früchte, Samen und andere pflanzliche Nahrung. Anstelle von Zähnen zum Fangen entwickelten die Vögel Schnäbel zum Rupfen und Pflücken.
Am Ende der Kreidezeit ernährten sich die zahnlosen Neornithes vielseitiger als ihre bezahnten Verwandten. Diese Vögel waren nicht auf Insekten oder andere tierische Nahrung spezialisiert und konnten daher auch harte Nahrung wie Samen und Nüsse fressen. Und in der Zeit nach dem Aussterben, als die Tierwelt stark zurückging, konnten die Neornithes mit dieser Fähigkeit die schweren Zeiten überstehen.
Von modernen ökologischen Störungen wie Waldbränden, die in kleinerem Maßstab mit den Ereignissen vor 66 Millionen Jahren vergleichbar sind, wissen wir, dass Samen selbst die schlimmsten Katastrophen überstehen können und dass samenfressende Vögel zu den ersten Arten gehören, die sich wieder ansiedeln, wenn die Dinge wieder in Ordnung kommen. Folgerichtig konnten die Vögel diese Nahrungsquelle nach dem Ende der Kreidezeit für sich nutzen.
Ein weiteres Forscherteam vom Institut für Wirbeltierpaläontologie und Paläoanthropologie der Chinesischen Akademie der Wissenschaften fand ebenfalls heraus, dass die Unterschiede in der Ernährung zwischen Vögeln und nicht-avianischen Dinosauriern dazu beitragen könnten, das Geheimnis zu lüften (Li et al. 2020, Abb. 5). Die Forscher untersuchten die Mikrostruktur der Zähne von Vögeln aus der frühen Kreidezeit und verglichen sie mit ihren nächsten Verwandten, den Dinosauriern Microraptor und Anchiornis.
In einer vorangegangenen Studie (Wang et al. 2015) fanden die Forscher durch die Anwendung der Röntgentransmissionsmikroskopie (TXM) an fossilen Zähnen heraus, dass es bei fleischfressenden Dinosauriern direkt unter dem Zahnschmelz eine besondere Dentinschicht (das sogenannte poröse Manteldentin) gab. Dieses besondere Dentin spielte eine Schlüsselrolle bei der Abschwächung des großen Schocks beim Abbeißen und verhinderte den Zahnbruch bei Dinosauriern (Wang et al. 2015, Torices et al. 2018,). In der aktuellen Studie verglichen die Forscher die mikroskopische Zahnstruktur von nicht-avischen Dinosauriern, darunter Troodon, Anchiornis und Microraptor, mit Vertretern der gezahnten Vögel aus der Kreidezeit, wie Sapeornis und Jeholornis.
Die Ergebnisse zeigten, dass zwar bei allen untersuchten mesozoischen Vogelzähnen der vereinfachte Zahnschmelz erhalten blieb, die poröse Mantel-Dentinschicht zwischen dem Zahnschmelz und dem eigentlichen Dentin jedoch verloren ging. Überraschenderweise verlor auch ein Zahn aus einem neuen Microraptor-Fossil diese Schicht. Das Team schlug vor, dass die Ernährungsstrategien der mesozoischen Zahnvögel in bemerkenswertem Gegensatz zu denen ihrer Konkurrenten, der Raubsaurier, standen. Die Zähne der fossilen Vögel wurden nicht mehr zum Beißen oder Reißen verwendet und benötigten nicht mehr die zusätzliche Dentinschicht, die einen besonderen mechanischen Schutz bietet (vgl. auch Zanno & Makovicky 2011, O’Connor 2019, O‘Connor & Chiappe 2011, Larson et al. 2016, Zhou & Li 2009, Field et al. 2018, Zheng et al. 2018, Zhou et al. 2004, Feng et al. 2016, Brink et al. 2016).
Die Ergebnisse lieferten indirekte Beweise dafür, dass Vögel und einige theropode Dinosaurier ihre Ernährungspräferenzen änderten. Sie vermieden den direkten ökologischen Wettbewerb um Nahrungsressourcen mit fleischfressenden Dinosauriern. Verglichen mit dem vorherrschenden Trend (d. h. Pflanzen-, Insekten- und Allesfresser zu werden), den diese frühen Vögel hatten, haben nur wenige andere Dinosaurier konvergent die gleichen Gewohnheiten entwickelt, die der neue Microraptor zeigte.
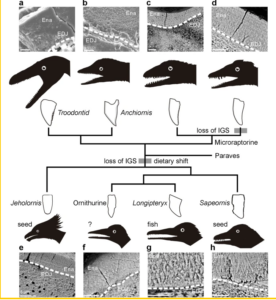
Abb. 5: Charakterisierung des Zahnschmelzes und Hinweise auf die Ernährung, die sich aus der Phylogenie der Paravianen ergeben. REM-Bilder, die die innere Struktur von geschnittenen Zähnen aus Paraves mit einer Betonung auf Avialanen (a Troodontid, b Anchiornis, c und d Microraptorines 1 und 2, e Jeholornis, f indet. Ornithurine, g Longipteryx und h Sapeornis. Abkürzungen: Ena, Zahnschmelz; EDJ (weiß gestrichelte Linie), Zahnschmelz-Dentin-Grenze. Alle Skalenbalken entsprechen 5 μm.
In unserem Beitrag über die Evolution des Vogelschnabels[1] haben wir zudem herausgefunden, dass der Verlust der Zähne bei Vögeln mit einem schnelleren Schlüpfen der Jungtiere aus den Eiern korreliert. Das Wachstum der Zähne ist etwas, was in der Embryonalentwicklung viel Zeit braucht und ein Verlust der Zähne verkürzt die Inkubationszeit im Ei. Eine schnelle Bebrütung verringert das Risiko der Eimortalität durch Raubtiere, Krankheiten und Naturkatastrophen (Erickson et al. 2017, Yang & Sander 2018).
Leben auf dem Boden statt in Bäumen
Einer weiteren Studie zur Folge (Field et al. 2018) waren die einzigen Vögel, die das Massenaussterben überlebten, Bodenbewohner, darunter alte Verwandte von Enten, Hühnern und Straußen. Nach der Katastrophe entwickelten sich diese Überlebenden schnell zu den meisten modernen Vogelarten, die wir heute kennen. Zur Untermauerung ihrer Hypothese trugen die Forscher eine Fülle von Beweisen aus unterschiedlichen Quellen zusammengetragen. Dazu gehören Daten aus umfangreichen neuen Stammbäumen für lebende Vögel (Abb. 6), Hinweise aus neu entdeckten fossilen Vögeln (Abb. 7) und eine Analyse von Sporen und Pollen aus der unmittelbar nach dem Einschlag abgelagerten Gesteinsschicht (Abb. 8). Zunächst wurde analysiert, wie sich die Ökologie der Vögel im Laufe der Evolutionsgeschichte verändert hatte. Nachdem das Team die evolutionären Beziehungen zwischen den mehr als 10.000 heute lebenden Vogelarten untersucht hatte, stellte es fest, dass die ersten Überlebenden bodenbewohnend waren, was darauf hindeutet, dass es in ihrer gemeinsamen Vergangenheit eine globale Entwaldung gegeben hat. Forscher hatten bereits seit langem vermutet, dass der Asteroideneinschlag globale Waldbrände verursachte, aber das Team hat nun das Argument der totalen Auslöschung der Wälder untermauert. Man sammelte Daten über die Anzahl fossiler Sporen und Pollen in Gesteinen aus vielen Regionen der Welt, einschließlich Neuseeland und den USA. In einer dünnen Gesteinsschicht, die sich in den ersten etwa tausend Jahren nach dem Einschlag gebildet hat, stammen 70 bis 90 Prozent der gefundenen Sporen von nur zwei Farnarten. Diese Farnsporen sind ein Beleg für eine ‘Katastrophenflora’, bei der Pionierarten schnell offenen Boden neu besiedeln, wie man es heute bei der Wiederbesiedlung von Lavaströmen auf Hawaii oder bei Erdrutschen nach Vulkanausbrüchen beobachten kann.
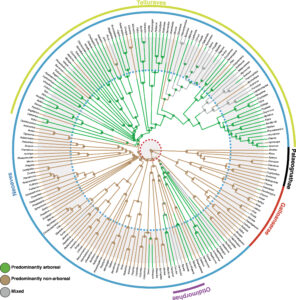
Abb. 6: Bayes’sche ökologische Rekonstruktionen der Vorfahren zeigen, dass die am weitesten auseinanderliegenden Kladen der Kronenvögel, einschließlich Neornithes (alle Kronenvögel), Neognathae (Galloanserae + Neoaves) und Neoaves, ursprünglich nicht arboreal waren (pp > 0,99 für jeden Knoten), wobei zahlreiche unabhängige Übergänge zur Arborealität im frühen Känozoikum stattfanden, vermutlich nachdem sich die globalen Wälder vom Chicxulub-Einschlag erholt hatten. Konzentrische Hintergrundringe grenzen geologische Perioden ab: Der innere graue Kreis in der Mitte zeigt die späte Kreidezeit an, wobei die K-Pg-Grenze (66,02 Ma) durch die rote gestrichelte Linie gekennzeichnet ist; der weiße Ring zeigt das Paläogen (66,02-23,03 Ma) an, das vom Neogen (23,03-2,58 Ma) durch die gestrichelte blaue Linie getrennt ist. Die Spitzen reichen bis in die Gegenwart. Nach dem Modell von Field et al. (2018).
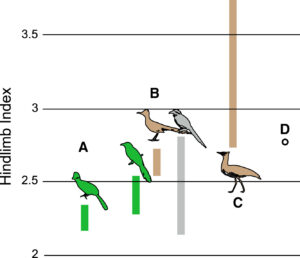
Abb. 7: Fossilien aus dem frühen Känozoikum einiger moderner Linien, die weitgehend baumbewohnend sind, deuten darauf hin, dass ihre frühen Vorfahren höchstwahrscheinlich bodenbewohnend waren. Die Indizes der Hintergliedmaßen ((Tarsometatarsuslänge + Tibiotarsuslänge) / Oberschenkellänge) sind für die wichtigsten Kladen innerhalb der Otidimorphae-Kronengruppe – Turakos (A; streng baumbewohnend), Kuckucke (B; mit baumbewohnenden, nicht baumbewohnenden und gemischten Mitgliedern) und Trappen (C; streng bodenbewohnend) – sowie für den früh-eozänen Stammturako Foro panarium (D) aufgetragen. F. panarium weist verlängerte Hinterbeine auf, die weit über den Bereich der heute lebenden Turakos und Baumkuckucke hinausgehen, was auf eine nicht-arboreale Lebensweise schließen lässt. Überwiegend baumbewohnende Taxa sind grün, überwiegend nicht baumbewohnende sind braun und “gemischte” sind grau.
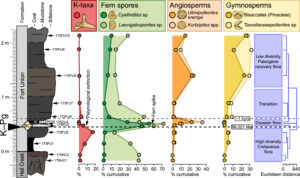
Abb. 8: Das Aussterben (Verschwinden der K-Taxa) und der Blütenumsatz werden durch Veränderungen der relativen Häufigkeit häufiger Pollentaxa an der K-Pg-Grenze belegt. BC, K-Pg-Grenze.
Eine Analyse der häufigsten fossilen Vögel der späten Kreidezeit – den Enantiornithes – zeigt außerdem, dass die meisten von ihnen auf Bäumen lebten. Keiner dieser Vögel hat das Massenaussterben überlebt, was die Autoren darauf zurückführen, dass ihr Lebensraum völlig verschwunden war (Schmitt 2023).
Darüber hinaus scheinen neu entdeckte fossile Vertreter lebender Vogelgruppen aus der Zeit kurz nach dem Einschlag aufgrund der Proportionen ihrer Beine Bodenbewohner gewesen zu sein. Hierzu gehört u. a. die Art Foro panarium (Field & Hsiang 2018; Abb. 7 & 9), welcher in die Verwandtschaft der Turakos gestellt wird und vor 48 Mio. Jahren in Wyoming, USA lebte. Er gilt als basalste Form der Turako-Familie, war aber im Gegensatz zu seinen baumbewohnenden Nachfahren, die es heute nur in Afrika gibt, ein Bodenbewohner. Diese Beobachtungen stimmen mit der Vorstellung überein, dass bodenbewohnende Linien am Ende der Kreidezeit überlebten und dann wiederholt auf die Bäume zurückkehrten, nachdem sich die Wälder wieder erholt hatten. Alle von den Forschern herangezogenen unterschiedlichen Datenquellen – Pollenfossilien, Vogelfossilien und Rückschlüsse aus der modernen Vogelökologie – stützen im Wesentlichen die gleiche Hypothese. Allerdings erklären die Daten noch nicht, warum eine Reihe von Enantiornithines und andere prähistorische Vögel, die nicht auf Bäumen lebten, ebenfalls ausstarben.

Abb. 9: Foro panarium
Mausern
Aber Wachstum und Entwicklung eines Vogels hören mit dem Schlüpfen nicht auf, auch ein Jungtier braucht gute Überlebenschancen. Hier spielen Federn tatsächlich eine Rolle. Federn sind komplexe Strukturen, die nicht repariert werden können. Um sie in guter Form zu halten, werfen Vögel ihre Federn ab und lassen sich Ersatzfedern wachsen, was als Mauser bezeichnet wird (Jenni & Winkler 2020, siehe auch Kiat et al. 2020), Küken mausern sich, um ihre juvenilen Federn durch die Federn erwachsener Vögel zu ersetzen; ausgewachsene Vögel mausern sich weiterhin etwa einmal im Jahr. Bei Vogelküken gibt es verschiedene Arten der Mauser, je nachdem, ob sie Nesthocker oder Nestflüchter sind (Abb. 10). Nesthocker schlüpfen nackt und hilflos; das Fehlen von Federn bedeutet, dass ihre Eltern die Körperwärme effizienter direkt auf die Haut der Jungvögel übertragen können. Nestflüchter hingegen werden mit Federn geboren und sind ziemlich unabhängig.

Abb. 10: Beispiele für Nesthocker und Nestflüchter
Alle Vogeljungen durchlaufen mehrere Mauserphasen, in denen sie ihre Federn verlieren und neue Federn nachwachsen lassen, bevor sie schließlich ihr erwachsenes Federkleid erhalten. Die Mauser ist sehr energieaufwändig, und wenn ein Vogel viele Federn auf einmal verliert, kann er sich nur schwer warmhalten. Aus diesem Grund neigen Nestflüchter dazu, sich langsam zu mausern, damit sie einen konstanten Federvorrat behalten, während Nesthocker, die sich auf ihre Eltern verlassen können, um Nahrung und Wärme zu erhalten, eine “gleichzeitige Mauser” durchlaufen, bei der sie alle Federn ungefähr zur gleichen Zeit verlieren.
Ein spannender Fund eines Enantiornithes-Kükens in Bernstein gibt Auskunft darüber, wie die Mauser bei dieser vielfältigen Vogelgruppe, die am Ende der Kreidezeit ausstarb, verlaufen ist (O‘Connor et al. 2023). Dieses Exemplar zeigt eine völlig bizarre Kombination von Merkmalen, die bei keinem modernen Vogelküken zu beobachten ist, denn es weist Kombinationen aus Nesthockern und Nestflüchtern auf. Alle Körperfedern befinden sich im Grunde im gleichen Entwicklungsstadium, was bedeutet, dass alle Federn gleichzeitig oder fast gleichzeitig zu wachsen begannen. Dies wäre ein typisches Muster bei Nesthockern. Aber die Enantiornithes sind allerdings Nestflüchter, wie verschiedene Studien schon demonstriert haben (Chiappe et al. 2007, Sanz et al. 1997, Kurochkin et al. 2013). Der Druck, ein frühreifes Vogelküken zu sein, das sich warmhalten musste, während es eine schnelle Mauser durchlief, könnte ein Faktor für den endgültigen Untergang der Enantiornithines gewesen sein.
Bei erwachsenen Vögeln findet die Mauser einmal im Jahr statt. Hier verläuft die Mauser bei den allermeisten Arten wie bei den Nestflüchter-Küken: Die Federn werden meist nach und nach ersetzt, häufig nach einem bestimmten System, um die Flugfähigkeit zu erhalten. Es gibt aber einige Vögel, bei denen die Schwungfedern innerhalb einer sehr kurzen Zeitspanne (oft nur einige Tage) alle gleichzeitig abgeworfen und wieder ersetzt werden. Vögel, die durch solch ein gleichzeitiges Mausern ihr Federkleid ersetzten sind während der Mauser flugunfähig. Diese Form der Mauser ist zum Beispiel bei vielen Entenvögeln verbreitet, die nicht unbedingt fliegen müssen, um Nahrung zu finden und Raubtieren auszuweichen.
In einer Studie wurde das Muster der Mauser bei modernen Vögeln untersucht (Kiat et al. 2023), um besser zu verstehen, wie sich dieser Prozess ursprünglich entwickelt hat (Abb. 11). Bemerkenswerter Weise finden sich bei fossilen Vögeln und Nicht-Vogeldinosauriern, deren Federkleid überliefert ist, keinerlei Anzeichen für eine Mauser. Man geht davon aus, dass diese Gruppen dann eine gleichzeitige Mauser hatten, bei der innerhalb kurzer zeit das gesamte Federkleid gewechselt wurde (vgl. auch Kiat et al. 2020). Da diese Art der Mauser sehr schnell vonstattengeht, ist die Wahrscheinlichkeit, dass solch ein Individuum, das sich gerade in der Mauser befindet, zum Fossil wird, sehr gering. Um ihre Hypothese zu überprüfen, untersuchten die Forscher die Sammlung moderner Vögel des Field Museum, insgesamt über 600 Vogelhäute. Sie stellten dabei fest, dass Arten, die während der Mauser jeweils nur ein paar Federn verlieren wesentlich häufiger anzutreffen sind, als jene, die bei der Mauser alle Federn gleichzeitig verlieren. Obwohl es sich um moderne Vögel und nicht um Fossilien handelt, sind sie ein nützlicher Anhaltspunkt. In diesem Fall deutet das Fehlen der Mauser bei fossilen Vögeln darauf hin, dass sich die fossilen Vögel einfach nicht so oft mauserten wie die meisten modernen Vögel. Möglicherweise haben sie sich gleichzeitig gemausert, oder sie haben sich nicht jährlich gemausert, wie es die meisten heutigen Vögel tun.

Abb. 11: a Eine aktive Primärmauser schließt eine vorübergehende Mauserlücke in der Flügelschlagfläche ein (Weißkehlchen, Irania gutturalis). b Primäre sequentielle Mauser bei Microraptor (IVPP V13352). Der Pfeil zeigt die Lage der Mauserlücke in den Primärfedern an, Maßstabsbalken entsprechen 10 cm. c-e Der Anteil der aktiv mausernden Exemplare bei drei Arten, die eine sequenzielle Primärmauser durchführen: c Hoatzin (Opisthocomus hoazin; 76,9 %, n = 52 Exemplare), d Trauertaube (Zenaida macroura; 27. 6%, n = 127) und e Glattschnabeltaube (Crotophaga ani; 38,8%, n = 103), und f-h drei Arten, die sich gleichzeitig primär mausern: f Stockente (Anas platyrhynchos; 0,0%, n = 81), g Zwergtaucher (Podilymbus podiceps; 1,4%, n = 72), und h Purpurhuhn (Porphyrio martinica; 0,6%, n = 175). Diese Daten zeigen den Zusammenhang zwischen der Dauer der Mauser und der Wahrscheinlichkeit, ein Individuum in der aktiven Mauser zu finden. Bei Arten mit längerer Mauserdauer (z. B. sequenzielle Mauser) ist der Anteil der Exemplare mit aktiver Mauser höher als bei Arten mit kürzerer Mauserdauer (z. B. gleichzeitige Mauser).
Vogelhirn
Nach den in der Fachzeitschrift Science Advances veröffentlichten Erkenntnissen sind die Vogelarten, die überlebt haben, jene, die ein größeres Vorderhirn gehabt haben müssen (Torres et al. 2021). Es hat sich herausgestellt, dass man bei einer Apokalypse lieber den Verstand als die Muskeln einsetzt.
Über die Gehirne der frühen Vögel ist nicht viel bekannt, da ihre Hirnschalen (das Innere des Schädels) nur selten versteinert sind. Aus diesem Grund sind Wissenschaftler über einen Schädelteil von Ichthyornis, einem Urvogel, der vor etwa 85 Millionen Jahren in Kansas lebte, sehr erfreut (Abb. 12). Forscher der University of Texas in Austin haben einen Röntgen-CT-Scan des Fossils angefertigt, mit dem das Gesichtsskelett und die Hirnschale des kreidezeitlichen Vogels digital in 3D rekonstruiert werden konnten, ohne dass die Fossilien in irgendeiner Weise invasiv verändert werden mussten.
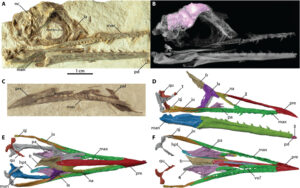
Abb. 12: Fotos und digitale Renderings der neuen Ichthyornis (AMNH FARB 32773) Schädelanatomie mit Anzeichen eines segmentierten Gaumens. (A) Foto des Schädelblocks mit dem Neurokranium und einem Teil des Ober- und Unterkiefers. (B) Rendering des Schädelblocks, das die Position des Schädelinneren (rosa) in Bezug auf den Schädel und die in der Nähe erhaltenen Gesichtselemente (durchscheinend weiß) zeigt. (C) Foto des Blocks mit dem Prämaxilla, dem linken Oberkiefer und dem linken Gaumen. Digitale Rekonstruktionen des Gesichtsskeletts in (D) seitlicher, (E) dorsaler (Unterkiefer entfernt) und (F) ventraler (Unterkiefer entfernt) Ansicht. Erhaltene Elemente sind farbig dargestellt; symmetrische Elemente, die von der gegenüberliegenden Seite gespiegelt wurden, sind grau dargestellt. Die Zahlen entsprechen den neuen Erkenntnissen aus diesem Exemplar: 1, vollständiger Orbitalfortsatz der Quadrate; 2, vollständiger Nasomaxillar-Kontakt; 3, segmentiertes Hemipterygoid. den, dentary; fr, frontals; hpt, hemipterygoid; ju, jugal; la, lacrimal; max, maxilla; mes, mesethmoid; na, nasal; nc, neurocranium; pa, palatine; pd, predentary; pman, posterior mandible; pre, premaxilla; qj, quadratojugal; qu, quadrate; vo? vorläufiger Vomer. Bildnachweis: Christopher R. Torres, Universität von Texas in Austin.
Die Analyse ergab, dass das Gehirn von Ichthyornis dem anderer Dinosaurier erstaunlich ähnlich war, während moderne Vögel (Neornithes) über ein viel größeres Vorderhirn als ihre ausgestorbenen Verwandten verfügten. Aber Ichthyornis, der phylogenetisch relativ eng mit den Neornithes verwandt ist, hat eine zusätzliche Struktur, die man sonst nur von modernen Vögeln kennt: einen sogenannten Wulst (Abb. 13). Diese Gehirnstruktur ist eine dorsale Erweiterung des Großhirns, die es nur bei Vögeln gibt und die einer Unterregion des Großhirns entspricht, von der man annimmt, dass sie homolog zu Teilen des Neokortex von Säugetieren ist (Reiner et al. 2005, Jarvis et al. 2005, Stacho et al. 2020, Gold et al. 2016). Der Wulst ist ein visuelles Verarbeitungszentrum, dem eine Rolle beim Flug zugeschrieben wird, das aber auch allgemein an der somatosensorischen Integration beteiligt ist (Reiner et al. 2005, Gold et al. 2005). Es ist also wichtig für die neuroanatomische Kontrolle des Vogelfluges, hat sich aber erst nach diesem zur Optimierung des Fluges entwickelt, da solch eine Region z. B. beim Archaeopteryx fehlt (Beyrand et al. 2019, Balanoff et al. 2013). Wie bereits erwähnt, handelt es sich beim Wulst jedoch um eine Gehirnstruktur mit vielfältigen Funktionen, die sich nicht auf die im Flug eingesetzten Funktionen beschränken (Reiner et al. 2005).
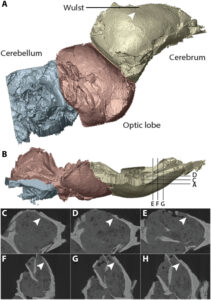
Abb. 13: Beweise für eine Wulst bei Ichthyornis. (A und B) Rekonstruktion des Ichthyornis-Schädelinneren in (A) rechtsseitiger und (B) dorsaler Ansicht. (C bis H) CT-Schichtdaten, die die endokraniale Oberfläche im Bereich der Vallecula (Pfeilspitzen) in (C bis E) koronaler und (F bis H) sagittaler Ebene zeigen. Gelb, Telenzephalon; rot, Sehnervenkopf; blau, Kleinhirn.
Die Entdeckung eines Wulst im Gehirn bei Ichthyornis zeigt, dass die Gehirne anderer Avialae komplexer waren als bisher angenommen. Und da Ichthyornis sehr eng mit modernen Vögeln verwandt ist, aber immer noch nicht das riesige Vorderhirn hatte, das wir von lebenden Vögeln kennen, schlossen die Forscher daraus, dass “sich diese großen Gehirne beim Vorfahren der lebenden Vögel entwickelt haben.
Der Ursprung der Aves (heutige Vögel) ist durch größere, umgestaltete Gehirne gekennzeichnet, was auf eine Selektion für relativ große Telencephala und Augen hindeutet, aber nicht auf eine einzigartig kleine Körpergröße (Abb. 14). Unterschiede im sensorischen System, die möglicherweise mit diesen Verschiebungen zusammenhängen, könnten dazu beitragen, das Überleben der Vögel im Vergleich zu anderen Dinosauriern zu erklären.
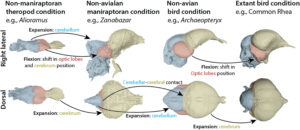
Abb. 14: Evolution des Vogelhirns
Die Kombination aus größeren Gehirnen, geringerer Größe, ihrer Fähigkeit, ein breiteres Spektrum an Nahrungsmitteln zu verzehren, und ihrer Fähigkeit zu fliegen, könnte den Vögeln letztlich geholfen haben, das letzte Massenaussterben zu überleben. Heute gibt es mindestens 11.000 Vogelarten. Doch wie ging es mit der Evolution der Vögel nach dem Aussterben der Dinosaurier weiter?
Literatur
Agnolín, F. L., Egli, F. B., Chatterjee, S., Marsà, J. A. G (2017): Vegaviidae, a new clade of southern diving birds that survived the K/T boundary. The Science of Nature. 104 (87): 87
Balanoff, A. M., Bever, G. S., Rowe, T. B., Norell, M. A. (2013): Evolutionary origins of the avian brain. Nature501, 93–96.
Beyrand, V., Voeten, D. F. A. E., Bureš, S., Fernandez, V., Janáček, J., Jirák, D., Rauhut, O., Tafforeau, P. (2019): Multiphase progenetic development shaped the brain of flying archosaurs. Sci. Rep.9, 10807.
Brink KS, Chen Y-C, Wu Y-N, Liu W-M, Shieh D-B, Huang TD, et al. (2016): Dietary adaptions in the ultrastructure of dinosaur dentine. J R Soc Interface. 13(125):20160626.
Chiappe, Luis M.; Shu’an, Ji; Qiang, Ji (2007): Juvenile Birds from the Early Cretaceous of China: Implications for Enantiornithine Ontogeny. American Museum Novitates (3594): 1–46.
Clarke, J. A. (2004): Morphology, phylogenetic taxonomy, and systematics of Ichthyornis and Apatornis (Avialae: Ornithurae). Bulletin of the American Museum of Natural History. 286: 1–179.
Clarke, J. A., Tambussi, C. P., Noriega, J. I., Erickson, G. M., Ketcham, R. A. (2005): Definitive fossil evidence for the extant avian radiation in the Cretaceous. Nature. 433 (7023): 305–308.
Erickson GM, Zelenitsky DK, Kay DI, Norell MA. (2017): Dinosaur incubation periods directly determined from growth-line counts in embryonic teeth show reptilian-grade development. Proc. Natl Acad. Sci. USA 114, 540–545.
Feng R, Maley JM, Schatte G, Hoffmeyer RE, Brink KS, Ellis T, et al. (2016): Chemical and structural information from the enamel of a Troodon tooth leading to an understanding of diet and environment. Appl Spectrosc. 70(11):1883–90.
Field, D. J., Benito, J., Chen, A., Jagt, J. W. M., Ksepka, D. T. (2020): Late Cretaceous neornithine from Europe illuminates the origins of crown birds. Nature. 579 (7799): 397–401.
Field DJ, Bercovici A, Berv JS, Dunn R, Fastovsky DE, Lyson TR, et al. (2018): Early evolution of modern birds structured by global Forest collapse at the end-cretaceous mass extinction. Curr Biol. 28(11):1825–1831.e1822.
Field, D.J., Hsiang, A.Y. (2018): A North American stem turaco, and the complex biogeographic history of modern birds. BMC Evol Biol 18, 102
Gold, M. E. L., Schulz, D., Budassi, M., Gignac, P. M., Vaska, P., Norell, M. A. (2016): Flying starlings, PET and the evolution of volant dinosaurs. Curr. Biol.26, R265–R267.
Hope, S. (2002): The Mesozoic radiation of Neornithes. In: L. Chiappe, L. Witmer (Hrsg.): Mesozoic Birds: Above the Heads of Dinosaurs, S. 339–388.
Jarvis, E. D., Güntürkün, O., Bruce, L. et al. (2005): Avian brains and a new understanding of vertebrate brain evolution. Nat. Rev. Neurosci.6, 151–159.
Jenni, L., Winkler, R. (2020): The Biology of Moult in Birds. (Bloomsbury Publishing).
Kiat, Y. et al. (2020): Sequential molt in a feathered dinosaur and implications for early paravian ecology and locomotion. Curr. Biol. 30, 3633–3638.
Kiat, Y. et al (2023): Rarity of molt evidence in early pennaraptoran dinosaurs suggests annual molt evolved later among Neornithes, Communications Biology.
Kurochkin, E. N.; Chatterjee, S.; Mikhailov, K. E. (2013): An embryonic enantiornithine bird and associated eggs from the cretaceous of Mongolia. Paleontological Journal. 47 (11): 1252–1269.
Larson, D. W., Brown, C. M., Evans, D. C. (2016): Dental disparity and ecological stability in bird-like dinosaurs prior to the end-Cretaceous mass extinction Curr. Biol., 26 (2016), pp. 1325-1333
Li, Z., Wang, CC., Wang, M. et al. (2020): Ultramicrostructural reductions in teeth: implications for dietary transition from non-avian dinosaurs to birds. BMC Evol Biol 20, 46.
Longrich, N.R., Tokaryk, T. and Field, D.J. (2011): Mass extinction of birds at the Cretaceous–Paleogene (K–Pg) boundary. Proceedings of the National Academy of Sciences, 108(37): 15253-15257.
Mayr, G. (2009): Paleogene Fossil Birds. Berlin: Springer.
Naish, D. (2012): Birds. In Brett-Surman, M. K., Holtz, T. R., Farlow, J. O. (eds): The Complete Dinosaur, second edition, S. 419-484
O’Connor JK. (2019): The trophic habits of early birds. Palaeogeogr Palaeoclimatol Palaeoecol. 513:178–95.
O’Connor JK, Chiappe LM. (2011): A revision of enantiornithine (Aves: Ornithothoraces) skull morphology. J Syst Palaeontol. 9(1):135–57.
O’Connor, JK et al. (2023): Immature feathers preserved in Burmite provide evidence of rapid molting in enantiornithines, Cretaceous Research.
Reiner, A., Yamamoto, K., Karten, H. J. (2005): Organization and evolution of the avian forebrain. Anat. Rec. A Discov. Mol. Cell Evol. Biol.287, 1080–1102.
Sanz, J. L.; Chiappe, L. M.; Pérez-Moreno, B. P.; Moratalla, J. J.; Hernández-Carrasquilla, F.; Buscalioni, A. D.; Ortega, F.; Poyato-Ariza, F. J.; Rasskin-Gutman, D.; Martı́nez-Delclòs, X. (1997): A Nestling Bird from the Lower Cretaceous of Spain: Implications for Avian Skull and Neck Evolution. Science. 276 (5318): 1543–6.
Schmitt, A. (2023): Großartige Giganten. Den letzten Geheimnissen der Dinosaurier auf der Spur. Dtv Verlagsgesellschaft
Stacho, M., Herold, C., Rook, N., Wagner, H., Axer, M., Amunts, K., Güntürkün, O. (2020): A cortex-like canonical circuit in the avian forebrain. Science369, eabc5534.
Torices A, Wilkinson R, Arbour VM, Ruiz-Omeñaca JI, Currie PJ. (2018): Puncture-and-pull biomechanics in the teeth of predatory Coelurosaurian dinosaurs. Curr Biol. 28(9):1467–1474.e1462.
Torres, C. R. et al. (2021): Bird neurocranial and body mass evolution across the end-Cretaceous mass extinction: The avian brain shape left other dinosaurs behind.Sci. Adv.7,eabg7099
Wang C-C, Song Y-F, Song S-R, Ji Q, Chiang C-C, Meng Q, et al. (2015): Evolution and function of dinosaur teeth at Ultramicrostructural level revealed using synchrotron transmission X-ray microscopy. Sci Rep. 5:15202.
Xue, X. (1995): Qinornis paleocenica – a Paleocene bird discovered in China. Courier Forschungsinstitut Senckenberg, 181: 89-93.
Yang T.-R.,Sander P. M. (2018): The origin of the bird’s beak: new insights from dinosaur incubation periodsBiol. Lett.142018009020180090
Zanno LE, Makovicky PJ. (2011): Herbivorous ecomorphology and specialization patterns in theropod dinosaur evolution. Proc Natl Acad Sci. 108(1):232–7.
Zheng X, O’Connor JK, Wang X, Wang Y, Zhou Z. (2018): Reinterpretation of a previously described Jehol bird clarifies early trophic evolution in the Ornithuromorpha. Proc R Soc B Biol Sci. 285:1871.
Zhou Z, Clarke J, Zhang F, Wings O. (2004): Gastroliths in Yanornis: an indication of the earliest radical diet-switching and gizzard plasticity in the lineage leading to living birds? Naturwissenschaften 91(12):571–4.
Zhou Z, Li FZZ. (2009): A new lower cretaceous bird from China and tooth reduction in early avian evolution. In: Proceedings of the Royal Society B: biological sciences.
[1] https://internet-evoluzzer.de/evolution-des-vogel-skeletts/



