In den letzten Episoden untersuchten wir die Merkmale der Dinosaurier und stellten einige evolutionäre Übergänge innerhalb der Dinosaurier vor. Doch der wohl wichtigste und gleichzeitig am besten dokumentierte evolutionäre Übergang ist der zwischen den Theropoden, also den fleischfressenden Dinosauriern und den modernen Vögeln.
Innerhalb des Stammbaums der Dinosaurier gehören Vögel zu den Avialae (Weishampel et al. 2004, Currie 2023, Fastovsky & Weishampel 2021, Holtz 2007, Paul 2016, Prothero 2017, 2022, Schweitzer et al. 2021, Neukamm & Beyer 2023, Cau 2018, Gauthier & Gall 2001, Norell & Xu 2005, Witmer 2009, Padian & Chiappe 1998, Chiappe 2009 Abb. 1). Zu den Avialae zählen Paläontologen traditionell alle Arten, die vom letzten gemeinsamen Vorfahren von Archaeopteryx und den modernen Vögeln abstammen – in der Hauptsache also kleine, flugfähige Gefiedertiere mit voll entwickelten Flügeln (Senter 2007, Agnolin & Novas 2013). Jacques Gauthier, der die Avialae 1986 benannte, definierte sie 2001 neu als alle Dinosaurier, die gefiederte Flügel besaßen, die zum Schlagflug benutzt wurden, und die Vögel, die von ihnen abstammen (Gauthier 1986, Gauthier & de Queiroz 2001).
Text als pdf
Die Schwestergruppe der Avialae sind die Troodontidae, beide Kladen bilden zusammen die Averaptora. Averaptora und die Dromeosauriden, dazu zählen Gattungen wie Deinonychus, Velociraptor oder Microraptor, bilden die Paraves. Und die Paraves zusammen mit den Oviraptorosaurier die Pennaraptora. Pennaraptora plus Therizionsauridae und Alvarezsauroidea bilden schließlich die Maniraptora („Handräuber“). Die Maniraptora und die Ornithomimosaurier bilden die Klade der Maniraptoriformes und diese zusammen mit den Compsognathidae und den Tyrannosauroidae, zu denen auch der T. rex gehört, die Tyrannoraptora. Die Tryannoraptora sind dann zusammen mit einigen basalen Gattungen wie Zuolong die Coelurosaurier (Hohlschwanzechsen). Die Coelurosaurier sind dann wiederrum eine Untergruppe der Theropoden (Abb. 1).
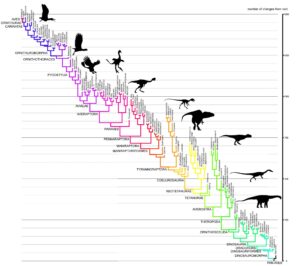
Abb. 1: Verwandtschaftsbaum der PAN-AVES (Avemetatarsalia). Dieses Taxon umfasst neben den modernen Vögeln (AVES, links oben), den Vögeln im weiteren Sinn (ursprünglichen Avialae), Nichtvogel-Dinosauriern und Flugsauriern sämtliche Archosaurier, die näher mit den Vögeln verwandt sind als mit den Krokodilen. Die höheren Vögel zeichnen sich gegenüber der Stammart an der Basis des Baums (rechts unten) durch etwa 1500 morphologische Veränderungen (abgeleitete Merkmale, Apomorphien) aus. Diese traten sukzessive in der Ahnenlinie der Vögel auf. Erwartungsgemäß sind die Gruppen hierarchisch ineinander verschachtelt. So beinhaltet das Dinosaurier-Taxon die Gruppe der Theropoden, dieses Taxon die Gruppe der Tetanurae, und die Tetanurae die Gruppe der Coelurosaurier. Die Maniraptoren wiederum bilden eine Untergruppe der Coelurosaurier, die Pennaraptoren eine Untergruppe der Maniraptoren usw. Das hierarchische System und die sich darin widerspiegelnde abgestufte Ähnlichkeit der Arten ist der stärkste Beleg für die Evolution und die Abstammung der Vögel von frühen Dinosauriern. Illustration: James Paul Baello, verändert nach Cau (2018). Für eine höhere Auflösung siehe: https://www.ag-evolutionsbiologie.net/bilder/kladogramm-pan-aves.jpg
Diese Erkenntnis wird heute nur noch von sehr wenigen Raubsaurier-Spezialisten und Paläornithologen bestritten, und die wenigen, die sie abstreiten, scheinen eher ideologische als wissenschaftliche Gründe zu haben (vgl. Prum 2003, Smith et al. 2015, Rauhut & Foth 2020).
Archaeopteryx
In der Fachwelt genießt der Zusammenhang, dass Vögel Dinosaurier sind, den Status einer gefestigten Theorie. Wie kam es dazu? Tatsächlich begann es mit einer alten Feder.
Im Jahr 1861, nur 2 Jahre nach der Veröffentlichung von Darwins Buch, wurde in den Kalksteinbrüchen von Solnhofen in Bayern ein bemerkenswertes Exemplar gefunden. Diese Steinbrüche waren jahrelang abgebaut worden, weil sie schöne flache Platten aus extrem feinem Kalkstein lieferten, die mit Säure geätzt werden konnten, um die lithografischen Platten zu bilden, die Drucker für die Herstellung von Buchillustrationen verwendeten. Gelegentlich wurden in diesen Kalksteinen auch hervorragend erhaltene Fossilien gefunden, darunter der winzige Dinosaurier Compsognathus und einige der ersten gut erhaltenen Flugsaurier (Abb. 2).
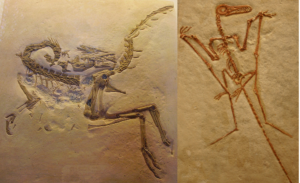
Abb. 2: links: Compsognathus, rechts: Flugsaurier aus Solnhofen
Doch 1860 wurde ein Abdruck einer fossilen Feder gefunden, und sechs Monate später stießen Arbeiter auf das Teilskelett eines seltsamen Wesens, das zwar Federn, aber Knochen wie ein Dinosaurier hatte (Abb. 3). Dieses Exemplar erregte natürlich großes Aufsehen, und das British Museum in London überbot alle anderen, um es zu erwerben. Sobald es in London ankam (es ist immer noch als „Londoner“ Exemplar bekannt, weil es sich dort befindet), war es die Aufgabe von Richard Owen, dem Kurator des Britischen Museums und dem Mann, der den „Dinosauria“ den Namen gab, es zu beschreiben. Es hatte bereits den Namen Archaeopteryx („alter Flügel“) erhalten, und obwohl Owen es im Grunde als Vogel beschrieb, konnte er nicht umhin, alle Dinosauriermerkmale des Skeletts zu erkennen. Da er jedoch einer der letzten seriösen Biologen war, der sich der Evolution widersetzte, machte er keine Anstalten, dieses Fossil mit seinen Verwandten in Verbindung zu bringen
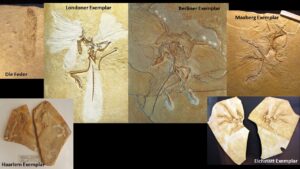

Abb. 3: Alle Archaeopteryx-Exemplare
Die Dinosauriermerkmale entgingen jedoch nicht Owens Rivalen Thomas Henry Huxley, der zu diesem Zeitpunkt „Darwins Bulldogge“ geworden war, Reden hielt und Werke veröffentlichte, die Darwins Theorie unterstützten. Als einer der ersten, der anatomische Studien an modernen Vögeln durchführte und eine Reihe von Dinosauriern wie Compsognathus studierte, konnte Huxley nicht umhin zu bemerken, dass Archaeopteryx ein klassisches „fehlendes Bindeglied“ zwischen Vögeln und Dinosauriern war (Huxley 1868, 1870). In einem berühmten Vortrag vor der Royal Society im Jahr 1863 schlug er vor, dass Vögel von Dinosauriern abstammen, und zählte 35 Merkmale auf, die nur Dinosaurier und Vögel gemeinsam haben (17 dieser Merkmale werden von modernen Paläontologen immer noch verwendet Padian & Chiappe 1998). 1877 wurde ein noch besseres Fossil gefunden, das klassische „Berliner Exemplar“, das das am besten erhaltene der 12 bekannten Exemplare ist. Zu diesem Zeitpunkt hatten die Deutschen die Bedeutung des Archaeopteryx bereits erkannt. Deutsche Industrielle kauften ihn und sorgten dafür, dass er in Berlin blieb, wo er heute im Museum für Naturkunde ausgestellt ist. Er hat sogar die Bombardierung während des Zweiten Weltkriegs überstanden. Ich habe sowohl das Londoner als auch das Berliner Original aus der Nähe gesehen, und es ist wie eine Pilgerfahrt zum Heiligen Gral, solche erstaunlichen und historischen Fossilien im Original zu sehen. In der Tat gleicht das Skelett des Archaeopteryx so frappierend dem des Raubsauriers Compsognathus, dass zwei scheinbar federlose Exemplare des Urvogels jahrzehntelang mit dem Nichtvogel-Theropoden verwechselt wurden (das Eichstätter und Solnhofener Exemplar; Shipman 1999, S. 43 f.).
Huxleys Hypothese geriet aufgrund eines einflussreichen Buchs des niederländischen Paläontologen Gerhard Heilmann vorübergehend ins Abseits. Heilmann argumentierte, dass den Theropoden Schlüsselbeine zu fehlen schienen, die bei den Vögeln zum Gabelbein verwachsen sind, sodass sie unmöglich Vorfahren der Vögel sein konnten (Heilmann 1926). Dabei ignorierte er alle abgeleiteten Ähnlichkeiten zwischen Dinosauriern und Vögeln, die Huxley nachgewiesen hatte, vor allem weil die meisten Paläontologen Dinosaurier als groß und spezialisiert ansahen und sich nicht vorstellen konnten, dass Vögel von diesen riesigen Landtieren abstammen. Heilmanns Denken wurde auch von Szenarien diktiert, wie Vögel den Flug entwickelten, indem sie von Ast zu Ast glitten (die „tree down“-Hypothese), und große terrestrische Dinosaurier passen nicht in dieses Szenario. Heute weiß man auch, dass die meisten Theropoden sogar bereits Gabelbeine besaßen, und das schon seit der Trias (Rauhut et al. 2020). Da diese Knochen recht fragil sind, bleiben sie selten erhalten.
Betrachten wir Archaeopteryx als Übergangsfossil näher (Yalden 1984, Chiappe & Witmer 2002, Ostrom 1974,1976, 1985, Christensen & Bonde 2004, Longrich 2006, Prothero 2017, Abb. 4):
Wie die meisten theropoden Dinosaurier (aber keine lebenden Vögel) hatte er einen langen knöchernen Schwanz, einen stark durchlöcherten Schädel mit Zähnen, theropode (nicht vogelähnliche) Wirbel, ein riemenartiges Schulterblatt, ein Becken, das in der Mitte zwischen dem typischer Echsenbecken-Dinosaurier und späterer Vögel lag, Bauchrippen und einzigartige Spezialisierungen an den Gliedmaßen.
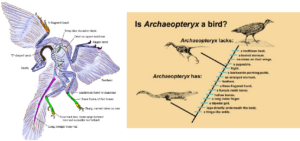
Abb. 4: Mosaikform Archaeopteryx
Am auffälligsten sind dabei die Handgelenke (Abb. 5). Vögel und einige theropode Dinosaurier, wie die Dromaeosaurier, haben alle ein halbmondförmiges Handgelenk, das aus der Verschmelzung mehrerer Handgelenksknochen besteht. Es dient als Hauptscharnier für die Bewegung des Handgelenks und ermöglicht es den Dromaeosauriern, ihre Handgelenke auszustrecken und Beutetiere mit einem schnellen Vor- und Zurückziehen zu greifen. Zufälligerweise ist genau die gleiche Bewegung Teil des Abwärtsflugschlags der Vögel. Archaeopteryx hatte dieselben drei Finger (Daumen, Zeige- und Mittelfinger) wie die meisten anderen theropoden Dinosaurier, und der mittlere Finger (der Zeigefinger) ist bei weitem der längste. Außerdem sind die Krallen des Archaeopteryx denen der Theropoden-Dinosaurier sehr ähnlich.
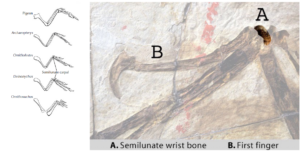
Abb. 5: Anatomie der Vorderextremitäten von Vögeln und Dinosauriern, mit Darstellung des halbmondförmigen Handwurzelknochens.
Auch die Hintergliedmaßen des Archaeopteryx weisen viele Merkmale der Dinosaurier auf (Abb. 6). Am auffälligsten ist der Knöchel. Schon im letzten Beitrag lernten wir das Mesotarsalgelenk als Apomorphie der Dinosaurier und Flugsaurier kennen, welches sich natürlich auch bei Archaeopteryx findet. Darüber hinaus hat ein Teil der ersten Reihe von Fußwurzelknochen einen Knochensporn, der an der Vorderseite des Schienbeins hochläuft, ein weiteres einzigartiges Merkmal der Echsenbecken-Dinosaurier und Vögel. Schließlich sind auch die Details und die Struktur der Zehenknochen und der großen Zehe einzigartig für Theropoden und Vögel, obwohl der Archaeopteryx keine opponierbare große Zehe besaß, die es ihm ermöglicht hätte, Äste gut zu greifen.
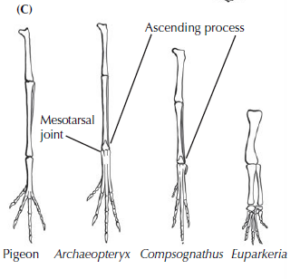
Abb. 6: Anatomie des Hinterbeins von Vögeln und Dinosauriern, mit Darstellung des Mesotarsalgelenks und des Knochensporns (Ascending process) des Astragalus.
In der Tat weist er nur einige wenige vogelähnliche Merkmale auf, die bei anderen Theropoden nicht zu finden sind: Die große Zehe ist vollständig umgedreht, die Zähne sind ungezackt, und der Schwanz ist relativ kurz, aber die Arme sind im Vergleich zu den meisten anderen Theropoden lang. Alle anderen Merkmale des Archaeopteryx, einschließlich der Federn und der verschmolzenen Schlüsselbeine, wurden inzwischen auch bei anderen Theropoden-Dinosauriern gefunden (Abb. 4 & 7)
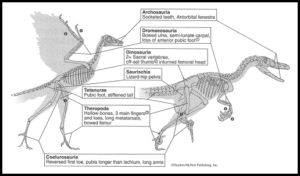
Abb. 7: Vergleich zwischen Archaeopteryx und seinem nahen Verwandten Velociraptor, der einige der wichtigsten anatomischen Ähnlichkeiten zeigt, die darauf hindeuten, dass sich Vögel aus anderen Dinosauriern entwickelt haben. Neben diesen Ähnlichkeiten im Skelett haben einige der Nicht-Vogel-Dinosaurier nachweislich Federn gehabt.
In Anbetracht all dieser überwältigenden Beweise ist es bizarr zu lesen, wie die Kreationisten den Archaeopteryx falsch darstellen. Ihrer Meinung nach müssen die erschaffenen „Arten“ eindeutig sein, und Übergangsformen kann es nicht geben, daher werden sie alles tun, was nötig ist, um Archaeopteryx als Übergangsform zu diskreditieren. Weil Archaeopteryx Federn hatte, muss er ihrer Meinung nach ein schlichter Vogel sein. Die erwähnten typischen Dinosaurier-Merkmale, die moderne Vögel nicht haben, werden ignoriert. Beispiel für diese dilettantische Herangehensweise ist der US-amerikanische Junge-Erde-Kreationist Duane Gish, zu Lebzeiten eine Koryphäe auf dem Gebiet kreationistischer Absurditäten (Gish 1995). So argumentiert er, dass die Zähne von Archaeopteryx nicht jenen von Theropoden ähneln, sondern einigen ausgestorbenen „Zahnvögeln“. Zwar stimmt auch das nicht, sie haben sowohl primitive Ähnlichkeiten mit den Zähnen der Theropoden als auch ihre eigenen, abgeleiteten Merkmale, aber dieses ganze Argument geht am Thema vorbei: Keine lebenden Vögel haben Zähne, aber wenn fossile Vögel wie der Archaeopteryx welche hatten, dann verbindet das Vögel und Dinosaurier. Er erwähnt auch den langen Schwanz des Archaeopteryx und entgegnet, dass einige Reptilien und einige Vögel lange Schwänze und einige kurze Schwänze haben. Der Punkt ist, dass kein lebender Vogel einen langen knöchernen Schwanz hat. Gish versucht, die drei knöchernen Krallenfinger des Archaeopteryx zu diskreditieren, indem er auf den Hoatzin, verweist, die ebenfalls diese drei Finger haben, während sie noch Küken sind (obwohl er nicht erwähnt, dass ihre Konfiguration völlig anders ist; Abb. 8). Aber ein isolierter Atavismus ändert nichts an der Tatsache, dass die Hand des Archaeopteryx im Grunde ein Dinosaurier ist. Kein anderer lebender Vogel außer den Hoatzin-Küken hat diese Art von Hand, die hochspezialisiert ist und in keiner Weise der Hand des Archaeopteryx ähnelt. Kurz gesagt, jedes Mal, wenn Kreationisten ein Merkmal erwähnen, das den Archaeopteryx zu einem Dinosaurier macht, verdrehen sie die Beweise, zeigen ihre Unkenntnis der anatomischen Details oder versäumen es, Gegenargumente oder Details zu erwähnen, die ihren Fall diskreditieren würden.

Abb. 8: Der in Südamerika heimische Hoatzin (Opisthocomus hoazin) hat als Jungvogel Krallen an den Flügeln.
Die Renaissance der Dinosaurier-Vogel-Evolution
Aber Archaeopteryx ist bei weitem nicht das einzige Beispiel für die Verbindung zwischen Dinosauriern und Vögeln!
Eine Renaissance erlebte Huxleys Hypothese durch Veröffentlichungen des Paläontologen John Oostrom, der zeigte, dass die Vögel mehr Merkmale mit Theropoden teilen als mit jeder anderen Archosaurier-Gruppe (Ostrom 1976). Beeinflusst wurde er durch die Tatsache, dass er in den 1960er Jahren den hochspezialisierten Dinosaurier Deinonychus aus der Familie der Dromeosauridae entdeckt und beschrieben hatte, der erstaunliche anatomische Ähnlichkeiten mit den frühesten Vögeln aufweist (Ostrom 1969, Abb. 9).
Ostroms Folgerung, dass Vögel von kleinen Theropoden abstammen, setzte sich immer mehr durch, als die phylogenetische Systematik zum Standard der vergleichenden Biologie avancierte. Gauthier (1986) beschrieb 84 gemeinsam abgeleitete Merkmale der Saurischia-Dinosaurier, die auch die Theropoden einschließen, und hat Ostroms Folgerung voll bestätigt. Er zeigte mithilfe der Kladistik, dass die Vögel den Maniraptoren, diese den Coelurosauriern und selbige wiederum den Theropoden angehören.
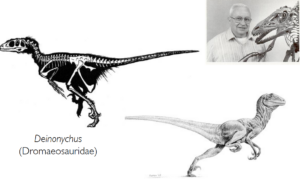
Abb. 9: In den 1960er Jahren vertrat der Paläontologe John Ostrom die Idee, dass Vögel von theropoden Dinosauriern abstammen. Der von ihm beschriebene Dinosaurier Deinonychus weist eine Reihe an Merkmalen auf, die auch bei Vögeln vorkommen.
Die Datenlage, die diese Analyse stützt, nahm bis heute erheblich zu, ebenso das Wissen um den sukzessiven Erwerb von Vogelmerkmalen (Brusatte et al. 2015, Smith et al. 2015, Cau 2018, Rauhut & Foth 2020). Ein Beispiel:
In den 1990er Jahren machten Expeditionen des American Museum of Natural History in der Wüste Gobi in der Mongolei einige bemerkenswerte Entdeckungen, darunter Nester mit Eiern des Dinosauriers Oviraptor. Diese Eier waren in der Mongolei so häufig, dass die ursprünglichen Expeditionen des Amerikanischen Museums in den 1920er Jahren sie dem häufigsten Dinosaurier dieser Schichten, dem Horndinosaurier Protoceratops, zugeschrieben hatten (Osborn 1924, Coombs 1989, Thulborn 1992). Als in der Nähe einiger Nester die Knochen eines kleinen Theropoden gefunden wurden, gab man ihnen den Namen Oviraptor („Eierdieb“). Aber die jüngsten Expeditionen zeigen, dass dieser Name verleumderisch ist: Oviraptor hat die Eier nicht gestohlen – es war ihre Mutter! In einigen Fällen wurde das weibliche Oviraptor-Skelett in brütender Haltung direkt über den Eiern begraben, als beide in einem Sandsturm begraben und versteinert wurden. Die Details dieser Bruthaltung und die Art und Weise, wie sie konserviert wurde, zeigen, dass sich viele Theropoden-Dinosaurier eher wie Vögel als Reptilien verhielten (Norell et al. 1994, 1995, Dong & Currie 1996, Hopp & Orsen 2004, Clark et al. 1999, Sato et al. 2005, Varricchio et al. 2008, Yang et al. 2018, 2019; Abb. 10).

Abb. 10: Fossilfunde des Oviraptosauriers Citipati, belegen, dass Dinosaurier ihre Eier ausbrüteten.
Die erschütterndsten Entdeckungen stammen aus den berühmten Liaoning-Fossillagerstätten aus der Unterkreide in China, die heute zu den wichtigsten Fossillagerstätten der Welt gehören. In diesen feinen Seeschiefern sind außergewöhnliche Fossilien erhalten, darunter Körperumrisse, Federn und vollständige Skelette, denen kein einziger Knochen fehlt. In den letzten 20 Jahren wurde alle paar Monate ein wichtiger neuer Fund aus diesen Lagerstätten bekannt gegeben, und fast alle früheren Vorstellungen über Vögel und Dinosaurier wurden durch diese Entdeckungen schnell überholt (eine Zusammenfassung findet sich in Norell 2005). Die erstaunlichsten Fossilien von allen waren eine Reihe von eindeutig nicht fliegenden, Nicht-Vogel-Dinosauriern mit gut entwickelten Federn. Dazu gehören unglaublich vollständige Exemplare wie Sinosauropteryx, Protarchaeopteryx, Sinornithosaurus, Caudipteryx, Beipiaosaurus und Microraptor. (Ji & Ji 1996, 1997, Xu et al. 1999b, Ji et al. 1998, Xu et al. 1999a, 2000; Abb. 11-16). Die meisten dieser Dinosaurier, die keine Vögel sind, haben eindeutig keine Flugfedern oder andere Anzeichen dafür, dass ihre Federn zum Fliegen verwendet wurden. Stattdessen zeigen sie, dass Federn bei Theropoden (und vielleicht auch bei anderen Dinosauriern und Archosauriern, insbesondere Pterosauriern) offenbar weit verbreitet waren. Die Federn haben sich also nicht für den Flug entwickelt, sondern waren bereits bei den Theropoden vorhanden, vermutlich zur Isolierung, und wurden später zu fliegenden Strukturen.
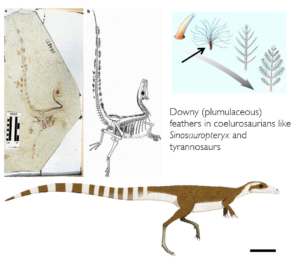
Abb. 11: Sinosauropteryx

Abb. 12: Protarchaeopteryx

Abb. 13: Sinornithosaurus

Abb. 14: Caudipteryx
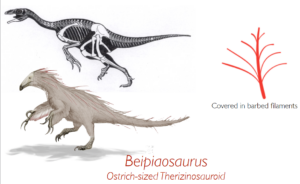
Abb. 15: Beipiaosaurus

Abb. 16: Microraptor
Wie bereits betont, wurde aufgrund der Theropoden-Zugehörigkeit der Vögel auch die Existenz von (Proto-) Federn bei Nichtvogel-Dinosauriern vorhergesagt.
So sagte der Ornithologe Richard Prum (1999) anhand embryologischer Differenzierungsprozesse bei den Vögeln eine Reihe evolutionärer Zwischenformen der Federn vorher (nach Sues 2001, Prum 1999, Prum & Brush 2003, Perrichot et al. 2008, Abb. 17):
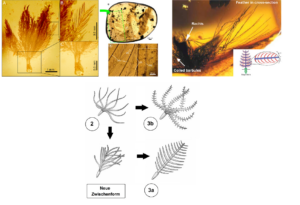
In Schritt 1 entsteht durch lokales Einstülpen der Epidermis der Federfollikel. Die Feder entsteht am Grund des Follikels durch stetige Teilung von Keratin bildenden Zellen. Die Bildungszone formt einen Ringwulst (Epidermalkragen), aus dem sich die älteren Zellen aus der Haut schieben. Diese Federn sind einfache Hohlzylinder. Schritt 2: Das innere Bildungsgewebe differenziert zu radiärsymmetrischen Astanlagen, es entsteht ein Büschel aus unverzweigten Filamenten. Schritt 3a: Durch Bildung und Verschmelzung weiterer Astanlagen an der Basis entsteht der Federschaft und eine bilateralsymmetrische, offene Federfahne. Schritt 3b: An den Ästen bilden sich einfache Strahlen, dies entspricht morphologisch einer Nestlingsdaune. Dann bildet sich eine Konturfeder mit Schaft, Ästen, Strahlen und offener Fahne. In Schritt 4 differenzieren sich die Strahlen in Haken- und Bogenstrahlen, es bildet sich eine geschlossene Fahne. Im 5. Schritt entstand die asymmetrische Feder.
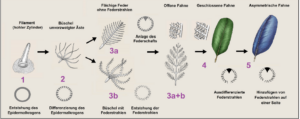
Abb. 17: Entwicklung der Feder nach Prum (1999) und Prum & Brush (2003).
Wenn die Theropoden-Hypothese stimmt, dann sollten bestimmte Federstadien, die in der Ontogenese der Vögel durchlaufen werden, bei erwachsenen Dinosauriern als vollentwickelte Federsubtypen existiert haben. Der Rest ist, wie man so schön sagt, Geschichte: Nach und nach wurden alle (!) der aus Prums ontogenetischem Modell prognostizierten Federsubtypen an Theropoden-Skeletten oder in Bernstein entdeckt.
Typ-1-Federn sind treten Sinosauropteryx auf. Federn des Typs 2 und Typs 3 werden bei dem großen Therizinosaurier Beipiaosaurus gefunden, was darauf hindeutet, dass sie bei fast allen Theropoden vorhanden waren. Federn des Typs 4 kommen bei Caudipteryx vor, was darauf schließen lässt, dass sie auch bei höheren Theropoden (einschließlich Tyrannosaurus rex) vorkamen. Die klassische asymmetrische Flugfeder mit dem Schaft in der Nähe der Vorderkante des Flügels taucht erstmals beim Archaeopteryx auf, und aus diesem Grund glauben viele Wissenschaftler, dass der Archaeopteryx einer der ersten war, der das lange Erbe der Federn für den echten Flug modifizierte (Prum & Brush 2003, Prothero 2017, Roy et al. 2020, Carrol et al. 2019, McKellar et al. 2011, Benton et al. 2019, Neukamm & Beyer 2023).
Eine weitere, nicht explizit vorhergesagte Zwischenform vermittelt sogar zwischen den Stadien 2 und 3a. Hier sind mehrere Äste lose am Schaft verbunden, der aus noch unvollständig verwachsenen sekundären Ästen besteht. Die abgeflachte, bilateral-symmetrische Form moderner Federn deutet sich bereits an (Neukamm & Beyer 2023).
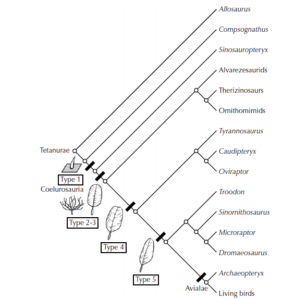
Abb. 18: Die Entwicklung der Federtypen von einfachen Federschäften über Daunenfedern bis hin zu komplexen Flugfedern mit asymmetrischen Fahnen und Schaft. Anhand ihres Auftretens bei verschiedenen gefiederten, nicht fliegenden Dinosauriern aus Liaoning können wir nachweisen, dass die meisten Raubsaurier (einschließlich T. rex) wahrscheinlich irgendeine Art von Federn hatten.
Abb. 19: Fossile Federn in Bernstein. Die Morphologie des Exemplars links stimmt mit Stadium 3b des weithin akzeptierten Modells von Prum überein (aus: Roy et al. 2020). Das mittige Foto zeigt eine Feder im Stadium 3a (aus: Caroll et al. 2019). Rechts: Feder im Stadium 3a+b (aus: McKellar et al. 2011; www.tinyurl.com/8h5edctm). Unten: Eine weitere in Bernstein konservierte Zwischenform der Feder. Hier sind mehrere Äste lose am Schaft verbunden, der aus noch unvollständig verwachsenen sekundären Ästen besteht. Die abgeflachte, bilateralsymmetrische Form moderner Federn deutet sich bereits an. Das Stadium intermittiert zwischen Schritt 2 und Schritt 3a in Prums Modell.
Ein weiterer besonderer Vertreter ist Rahonavis aus der Kreidezeit von Madagaskar (Forster et al. 1998a, b, zur taxonomischen Einordnung als Avialae siehe: Agnolin & Novas 2013, Cau 2018, Padian 2004, Chiappe & Dyke 2006, andere Autoren sehen Rahonavis außerhalb der Avialae als Dromeosauridae, siehe Makovicky et al. 2005, Norell et al. 2005, Turner et al. 2007, Hartmann et al. 2019, Abb. 20). Er ist etwa so groß wie eine Krähe, hatte die primitiven, sichelförmigen Krallen an den Hinterfüßen, den langen, knöchernen Schwanz, Zähne und viele andere Theropodenmerkmale, aber auch vogelähnliche Merkmale wie die Verschmelzung der unteren Rückenwirbel mit dem Becken (das Synsacrum), Löcher in den Wirbeln für alle Blutgefäße und Luftsäcke, die bei lebenden Vögeln zu finden sind, Finger mit Federkielknöpfen, was darauf hindeutet, dass er gefiedert war und ein Wadenbein, das nicht bis zum Knöchel reicht. Bei Vögeln ist das Wadenbein auf einen winzigen Knochensplitter reduziert, während Archaeopteryx ein voll entwickeltes Wadenbein wie die Dinosaurier hat.
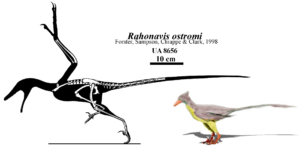
Abb. 20: Rahonavis
Avialae
Den nächsten Schritt (Abb. 21) markieren Confuciusornis und seine Verwandten, die ein einzigartiges Merkmal aufweisen, das bei allen höheren Vögeln zu finden ist: das Pygostyl, welches durch die Verschmelzung aller alten Dinosaurier-Schwanzwirbel entstand (Hou et al. 1995, Chiappe et al. 1999, Zhou & Hou 1998, Zhou 2004; Abb. 22). Bei Confuciusornis sind sieben Rückenwirbel (Sakralwirbel) zum Synsacrum verschmolzen, also jenem Abschnitt der Wirbelsäule, der als starres Gebilde das Dach des Beckens ausbildet. Die Knochen, die die Schulter verstärken, sind zudem verlängert, was den Flug verbessert. Sie sind auch die ersten Vögel mit einem zahnlosen Schnabel.
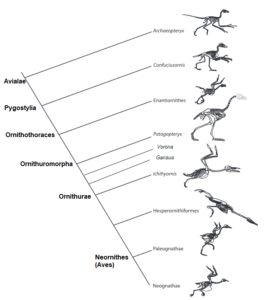
Abb. 21: Kladogramm mesozoischer Avialae
Abb. 22: Fossil und Rekonstruktion von Confuciusornis; unten rechts findet sich die Darstellung des Synsacrum und des Pygostyls moderner Vögel
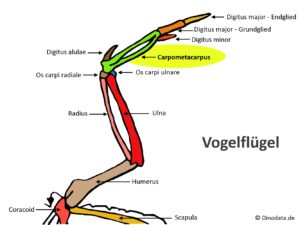
Nach dieser Übergangsform gibt es eine weitere Verzweigung, die zu den ausgestorbenen Enantiornithes oder Gegenvögel führt, eine Gruppe zahntragender Vögel, die zum Ende der Kreidezeit ausstarben (Walker 1981, Chiappe 2002, Chiappe & Walker 2002, Padian 2004, Zhou 2004, Zheng 2012, Wang et al. 2015, 2022, Abb. 23). In der Oberkreide waren sie die artenreichste Gruppe der Avialae und damit auch häufiger als die „modernen Vögel“, den Neornithes. Dazu gehören Iberomesornis aus Las Hoyas in Spanien (Sanz & Bonaparte 1992), Sinornis aus China (Sereno & Rao 1992), Gobipteryx aus der Mongolei (Elżanowski 1974), Enantiornis aus Argentinien (Walker 1981) und einige andere, insgesamt sind über 100 Gattungen beschrieben worden. Alle diese Vögel sind insofern spezialisierter als Archaeopteryx, Rahonavis oder Confuciusornis, als sie die Anzahl der Rumpfwirbel reduziert haben, ein flexibles Gabelbein haben, das Schultergelenk für das Fliegen optimiert haben, die Handknochen zu einem Knochen namens Carpometacarpus und die Fingerknochen zu einem einzigen Element verschmolzen haben.
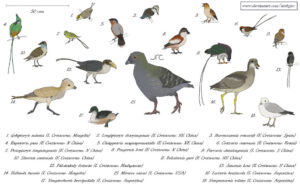
Abb. 23: Die Vielfalt der Enantiornithes
Von den modernen Vögeln unterscheiden sich die Gegenvögel in der Gelenkverbindung zwischen Schulterblatt und Rabenbein: Im Gegensatz zur Anordnung bei modernen Vögeln liegt am Schulterblatt eine Gelenkpfanne und am Rabenbein ein Gelenkzapfen vor (Abb. 24). Im Carpometacarpus (Abb. 25) der Enantiornithes reichte der dritte Mittelhandknochen nach außen über die Länge des zweiten Mittelhandknochens hinaus.
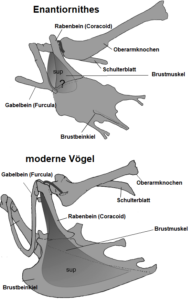
Abb. 24: Unterschiede des Schultergürtels bei Gegenvögeln und modernen Vögeln.
Abb. 25: Der Carpometacarpus moderner Vögel.
Aufgrund ihrer Zehenproportionen und der langen gebogenen Klauen werden viele Gegenvögel als Baumbewohner angesehen. Manche Formen wie Eoenantiornis (Hou et al. 1999, Zhou et al. 2005), Protopteryx (Zhang & Zhou 2000) und Eoalulavis (Sanz et al. 1996) besaßen einen Daumenfittich (Alula; Abb. 46) und dürften gegenüber urtümlichen Vögeln wie Archaeopteryx, Jeholornis und Confuciusornis bessere Flieger gewesen sein.
Ein besonderer Fund wurde im Juni 2017 bekannt (Abb. 26): Ein Fuß und Teile des Flügels eines 99 Millionen Jahre alten Jungtiers waren in einem knapp acht Zentimeter großen Stück Bernstein in Burma entdeckt worden (Xing et al. 2017, vgl. auch Xing et al. 2016, 2018, 2019a, b, 2020). Dazu kommt ein 127 Millionen Jahre altes Küken aus Spanien, das 2018 beschrieben wurde (Knoll et al. 2018).

Abb. 26: In Bernstein gefundenes Küken.
Besonders auffallend ist, dass bei vielen Enantiornithes-Gattungen Jungtiere gefunden wurden. Genauere Untersuchungen ergaben, dass die Küken der Enantiornithes meistens frühreif und Nestflüchter waren und ihre Eier eine geringere Variabilität in der Größe aufwiesen, als bei den modernen Vögeln. Wobei der Fund aus Spanien belegt, dass dieses ein Nesthocker war (Abb. 27). Diese Kombination aus Baumbewohner und Nestflüchter ist einzigartig, denn bei allen modernen baumbewohnenden Vögeln sind die Küken Nesthocker. Der relativ frühe Zeitpunkt der Fortpflanzungsreife und ihre niedrigere Wachstumsrate sind ebenfalls untypisch für moderne Vögel. Durch ihr verzögertes Wachstum waren die Gegenvögel damit auch länger der Gefahr von Fressfeinden ausgesetzt, was ihre Sterblichkeit erhöhte (Schmitt 2023).

Abb. 27: Das in Spanien entdeckte Küken eines Enantiornithen (Fundname: MPCM-LH-26189) wird als Nestflüchter interpretiert – eine Seltenheit in dieser Vogelgruppe. Es besteht aus einem nahezu vollständigen Skelett und gehört zu den kleinsten bekannten mesozoischen Vogelfossilien, die Entwicklungsstadien nach dem Schlüpfen repräsentieren. Vergleiche zwischen diesem neuen Exemplar und anderen bekannten frühen juvenilen Enantiornithinen belegen ein cladeweites asynchrones Muster der Osteogenese im Brustbein und in der Wirbelsäule und deuten stark darauf hin, dass die Schlüpflinge dieser phylogenetisch basalen Vögel in Größe und Tempo der Skelettreifung stark variierten (Knoll et al. 2018).
In ihren Nahrungsspektren waren die Gegenvögel vielfältig: es gab welche mit robusten Kiefern zum Verzehr hartschaliger Wirbelloser. Andere hatten kurze, stumpfe Zähne und dienten wahrscheinlich der Ernährung von Gliederfüßern mit weichen Körpern (O’Connor & Chiappe 2011) Andere Gattungen hatten stark gekrümmte Krallen und lassen vermuten, dass sie kleine bis mittelgroße Wirbeltiere erbeuteten, aber ihre robusten Zähne deuten eher auf eine Ernährung mit hartschaligen Tieren hin (Wang et al. 2014).
Eine Studie über das Verdauungssystem zeigt, dass die bekannten Enantiornithen keinen Kropf und keinen Muskelmagen hatten, keine Gastrolithen benutzten und keine Pellets auswarfen. Dies steht im Widerspruch zu der großen Vielfalt der Ernährungsweisen, die sich aus ihren unterschiedlichen Zähnen und Schädelformen ergibt (O’Connor et al. 2019), obwohl einige moderne Vögel den Muskelmagen verloren haben und sich ausschließlich auf starke Magensäuren verlassen (Houston & Copsey 1994). Es wurde ein Exemplar entdeckt, bei dem man Gastrolithen im Magen des Fossils vermutete, was die Diskussion über die Verwendung von Gastrolithen durch Enantiornithes neu eröffnete. Röntgen- und rastermikroskopische Untersuchungen des Gesteins ergaben, dass es sich tatsächlich um Chalcedonkristalle und nicht um Gastrolithen handelte (Abb. 28)[1].
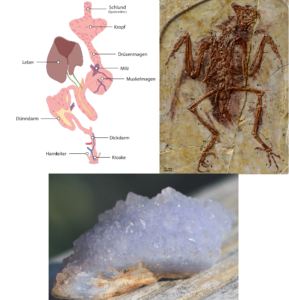
Abb. 28: Oben links: Zeichnung des Verdauungssystems moderner Vögel. Bei den Enantiornithes scheint ein Muskelmagen und Kropf zu fehlen. Sie nutzen auch keine Magensteine (Gastrolithen). Oben rechts: Die bei einem Exemplar der Enantiornithes im Magen entdeckten Magensteine waren jedoch Chalcedonkristalle (unten).
Die Longipterygidae (Zhang et al. 2001, Abb. 29) sind aufgrund ihrer eher ungewöhnlichen rostralen Anatomie mit langen Kiefern und wenigen, an den Kieferenden angeordneten Zähnen die am intensivsten untersuchte Familie in Bezug auf die Ernährung. Sie wurden auf verschiedene Weise als Fischfresser (O’Connor et al. 2011), als Ufervögel (Hou et al. 2004) und als Baumrindenfresser interpretiert (Morschhauser et al. 2009). Eine Studie aus dem Jahr 2022 kommt jedoch zu dem Schluss, dass sie höchstwahrscheinlich generalistische Insektenfresser sind (Miller et al. 2022, Clark et al. 2023).

Abb. 29: Longipterygidae
Trotz ihrer Vielfalt an Ernährungstypen haben die Enantiornithes nicht die Bandbreite der modernen Vögel erreicht, so gibt es hier keine Formen, die an das Leben im Wasser angepasst sind (Schmitt 2023).
Weiter oben im Kladogramm (Abb. 21), innerhalb der Gruppe der Euornithes, stoßen wir auf mehrere Vögel aus der Kreidezeit wie Vorona aus Madagaskar (Abb. 30; Forster et al. 1996; einige Autoren klassifizieren ihn als Enantiornithes; siehe Pei et al. 2020), Patagopteryx aus Argentinien (Abb. 31; Alvarenga & Bonaparte 1992), Gansus (Abb. 32; Hou & Liu 1984) aus China und die bekannten Wasservögel Hesperornis (Abb. 33; Marsh 1872a) und Ichthyornis (Abb. 34; Marsh 1872b) aus den Kreidefelsen von Kansas. Diese Vögel sind durch mindestens 15 klar definierte Merkmale miteinander verbunden, darunter der Verlust der Bauchrippen oder Gastralia, die Neuausrichtung des Schambeins in die moderne vogelähnliche Position parallel zum Sitzbein, die Verringerung der Anzahl der Rumpfwirbel und viele andere Merkmale an Hand und Schulter, die die Flugleistung verbesserten. Ichthyornis ähnelt den modernen Vögeln sogar noch mehr, da er einen Kiel am Brustbein für die Flugmuskeln und einen knopfartigen Kopf am Oberarmknochen hatte, der den Flügel flexibler machte. Die Gruppe, zu der alle modernen Mitglieder der Klasse Aves gehören, ist durch den vollständigen Verlust der Zähne und eine Reihe anderer anatomischer Spezialisierungen gekennzeichnet, wie z. B. die Verschmelzung der Beinknochen zu einem Tarsometatarsus.
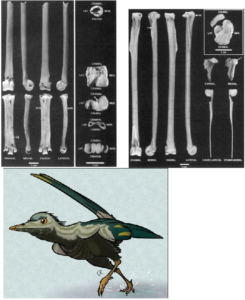
Abb. 30: Fossilfunde und Lebendrekonstruktion von Vorona

Abb. 31: Patagopteryx

Abb. 32: Gansus

Abb. 33: Hesperornis

Abb. 34: Ichthyornis
Wann sich die modernen Vögel diversifizierten ist noch nicht ganz geklärt. Die meisten Studien sind sich einig, dass der jüngste gemeinsame Vorfahre der modernen Vögel aus der Kreidezeit stammt, aber die Schätzungen reichen von der frühen Kreidezeit (Yonazawa et al. 2017, Lee et al. 2014) bis zur jüngsten Kreidezeit (Prum et al. 2015, Kuhl et al. 2020). Ebenso besteht keine Einigkeit darüber, ob der größte Teil der frühen Diversifizierung der modernen Vögel in der Kreidezeit stattfand und mit dem Auseinanderbrechen des Superkontinents Gondwana zusammenhing oder später und möglicherweise als Folge des kreidezeitlich-paläogenen Aussterbeereignisses (Ericson et al. 2006). Die meisten Studien zur molekularen Datierung deuten auf eine evolutionäre Radiation in der Kreidezeit hin, während fossile Beweise auf eine Radiation im Känozoikum hindeuten. Bedingt durch die Seltenheit der Fossilisation dürften molekulare Daten aber eine gewisse Aussagekraft haben.
Die Entdeckung von Vegavis aus dem Maastrichtium, der letzten Stufe der späten Kreidezeit, bewies, dass die Diversifizierung der modernen Vögel bereits vor dem Känozoikum begann (Abb. 35; Clarke et al. 2005, Agnolin et al. 2017). Vegavis wird in die Verwandtschaft der Familie der Gänse und Enten eingeordnet, einer Familie der modernen Vögel, die sich relativ früh abspaltete. Die Verwandtschaft eines früheren Fossils, Austinornis lentus, der auf vor etwa 85 Millionen Jahren datiert wurde (Abb. 36; Clarke 2004), ist noch zu umstritten, um einen fossilen Beweis für die Diversifizierung der modernen Vögel zu liefern. Einige ordnen ihn in die Verwandtschaft der Hühnervögel, ebenfalls einer frühen Gruppe moderner Vögel. Im Jahr 2020 wurde Asteriornis aus dem Maastrichtium beschrieben, es scheint ebenso ein naher Verwandter der Hühner- und Entenvögel zu sein (Abb. 37; Field et al. 2020).

Abb. 35: Vegavis

Abb. 36: Austinornis lentus
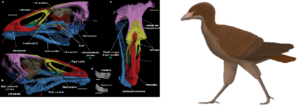
Abb. 37: Asteriornis
Eine Schätzung aus dem Jahr 2015, bei der eine neue Methode zur Kalibrierung molekularer Uhren zum Einsatz kam, bestätigte, dass moderne Vögel zwar schon früh in der späten Kreidezeit, wahrscheinlich in Westgondwana, entstanden sind, dass aber um das kreidezeitlich-paläogene Aussterbeereignis herum ein Diversifizierungsimpuls in allen Hauptgruppen stattfand (Claramunt & Cracraft 2015).
Die neuesten Arbeiten zeigen, dass sich die wichtigsten Gruppen (Urkiefervögel, Hühner- und Gänsevögel sowie Neoaves) bereits vor 100 bis 75 Mio. Jahren auseinander entwickelten (z.B. Field et al. 2020; Abb. 38).
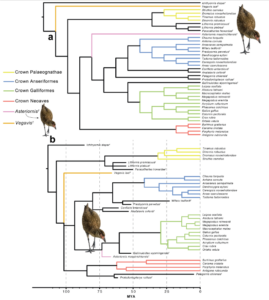
Abb. 38: a, Ergebnisse der Parsimony-Analyse. Asteriornis (rosa) wird als Schwestertaxon der Kronen-Galloanserae aufgelöst. b, Ergebnisse der Bayes’schen Analyse mit einem Alter der Neornithes von 86,5 Millionen Jahren (nach Field et al. 2020).
Mei long, Anchiornis, Mononykus, Fujianvenator: Vogel oder Dinosaurier?
Mei long, übersetzt der schlafende Drache, ist ein Nicht-Vogel-Dinosaurier aus Familie der Troodontidae, also jeder Dinosaurierfamilie, die die engsten Verwandten der Avialae sind. Er lebte vor etwa 125 Mio. Jahren und wurde in China entdeckt. Bei dem Typusfossil handelt es sich um ein etwa 53 Zentimeter langes, vollständiges und außergewöhnlich gut erhaltenes Jungtier mit dreidimensionalen Details, bei dem die Schnauze unter einem der Vorderbeine liegt und die Beine ordentlich unter dem Körper gefaltet sind, ähnlich der Schlafposition moderner Vögel. Diese Haltung stellt eine weitere Verhaltensverbindung zwischen Vögeln und Dinosauriern dar (Abb. 39; Lü et al. 2010, Xu & Norell 2004).

Abb. 39: Die Schlafposition von Mei long ähnelt dem moderner Vögel.
Erwähnenswert ist auch die Familie der Anchironitidae, dessen bekannteste Gattung Anchiornis ist. Anchiornis heißt übersetzt in etwa „Fast-Vogel“. Fossilien von Anchiornis wurden nur in Gesteinen aus dem späten Jura vor etwa 160 Millionen Jahren in China gefunden. Er ist von Hunderten von Exemplaren bekannt, und angesichts der ausgezeichneten Erhaltung einiger dieser Fossilien wurde er zur ersten mesozoischen Dinosaurierart, für die fast das gesamte Lebensbild bestimmt werden konnte, und zu einer wichtigen Quelle für Informationen über die frühe Evolution der Vögel. So sind von einigen Exemplaren sogar Überreste der Farbpigmente bekannt. Er hatte eine graue Grundfarbe, auf dem Kopf einen irokesenschnittartigen, rotbraunen Federkamm und weiße, mit schwarzen Bändern versehene Konturfedern an Vorder- und Hinterbeinen. Der Fund von Anchiornis ist vor allem von Bedeutung, da damit ein vogelähnlicher Dinosaurier vorliegt, der älter als Archaeopteryx ist (Abb. 40; Xu et al. 2009, Hu et al. 2009, Foth & Rauhut 2017, Li et al. 2010, Lindgren et al. 2015).

Abb. 40: Anchiornis
Seine taxonomische Stellung wird in der Wissenschaft debattiert. Die Anchiornithiden wurden an unterschiedlichen Stellen im Stammbaum der Maniraptoren eingeordnet, wobei einige Wissenschaftler sie als eigene Familie, als basale Unterfamilie der Troodontidae (Xu et al. 2011, Lee & Worthy 2011, Brusatte et al. 2014, Shen et al. 2017) als Mitglieder der Archaeopterygidae (Hartmann et al. 2019) oder als eine Gruppe von Dinosauriern, die eine evolutionäre Stufe innerhalb der Avialae (Wang et al. 2016) oder der Paraves darstellen (Lefevre et al. 2017), einstufen.
Seine nicht ganz eindeutige Einordnung ist dem Merkmalsmosaik von Anchiornis und verwandter Gattungen seiner Familie zu verdanken. Sein Schädel weist Merkmale der Dromeosaurier, der Troodontiden und der Avialae auf. Das Postcranialskelett, also das Skelett hinter dem Schädel ähnelt dem der Troodontiden. Die Vorderbeine waren allerdings länger, ähnlich lang wie bei den Dromaeosauriden und basalen Vögeln. Der Vorderarm hatte zehn lange Schwungfedern, die Hand hatte elf, der Unterschenkel 12 bis 13, der Fuß zehn bis elf. Hand- und Armschwingen waren etwa gleich lang. Im Unterschied zu den Verhältnissen bei Archaeopteryx und bei Microraptor lag bei Anchiornis der breitere Teil des Flügels proximal (zum Körperzentrum hin, Abb. 41). Neben den Schwungfedern an den Gliedmaßen hatte Anchiornis noch zwei weitere Federtypen. Daunenähnliche Büschelfedern, deren Filamente alle an der Basis zusammenliefen und Konturfedern deren Filamente entlang einem langen und festen Federkiel angeordnet waren (Xu et al. 2009, Hu et al. 2009, Longrich et al. 2012).
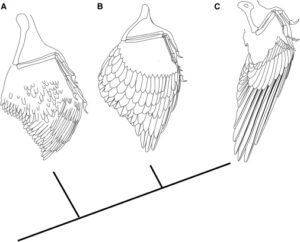
Abb. 41: Hypothetische Evolution des Vogelflügels.
(A) Die ursprüngliche Flügelmorphologie (am Beispiel von Anchiornis), bei der der Flügel aus schlanken, symmetrischen und wenig differenzierten Flugfedern besteht.
(B) Flügel der frühen Avialae (z. B. Archaeopteryx), bei denen die Schwungfedern langgestreckt, breit und asymmetrisch sind.
(C) Flügel der Pygostylia (hier Confuciusornis), bei denen die primären Remigien weiter verlängert und die Deckfedern verkürzt sind. Phylogenie nach Turner et al. (2012)
Ein weiteres besonders Fossil ist Mononykus und lebte vor etwa 70 Mio. Jahren. Man fand das Fossil 1987 in der Nemegt Formation in der Mongolei und 1993 als Art beschrieben wurde. Der Name bezieht sich auf die sehr kurzen, stämmigen Arme des Tieres, bei denen die Handknochen jeweils in nur einem einzigen Fingerglied münden, das eine dicke, scharfe Kralle trug. Eine Zeit lang konnten sich Forscher sogar nicht entscheiden, ob es sich bei Mononykus noch um einen fleischfressenden Nicht-Vogel-Dinosaurier oder einen sehr frühen flugunfähigen Laufvogel handele. Tatsächlich wurde er zuerst als Laufvogel beschrieben, da er u.a. das für zuvor allein fliegenden Vögel beschriebene gekielte Brustbein hat. Ein solcher Knochenkamm auf dem Brustbein dient bei Vögeln als Ansatzfläche für die mächtige Flugmuskulatur. Bei flugunfähigen Vögeln wie Straußen und Emus ist der Brustbeinkiel stark zurückgebildet – ähnlich wie bei Mononykus. Weitere vogelähnliche Merkmale waren das Gaumensegel, das Foramen magnum, die Hals- und Schwanzwirbel und viele andere. Mononykus wurde zusammen mit ähnlichen Gattungen in die Familie der Alvarezsauridae als Teil der Avialae eingegliedert (Abb. 42; Perle et al. 1993a, b, 1994).
Mittlerweile gilt Mononykus, bzw. die Alvarezsauridae, nicht mehr als sekundär flugunfähige Laufvogel bzw. Avialae, sondern werden zu den Nicht-Vogel-Dinosauriern innerhalb der Maniraptoren gezählt. Diese irrtümlichen Zuordnungen von Alvarezsauridae zu Vögeln wurden vor allem durch Merkmale verursacht, die auffallend oder sogar einzigartig vogelartig sind. Jedoch haben die früheren Formen der monophyletischen Gruppe der Alvarezsauridae, diese Vogelmerkmale nicht. Die nächsten verwandten dieser Dinosaurierfamilie sind die Ornithomimosauria, zu denen berühmte Gattungen wie der Gallimimus aus Jurassic Park gehören. Die verbleibenden Ähnlichkeiten zwischen Vögeln und Alvarezsauriern, wie z. B. das gekielte Brustbein, sind ein weiterer Fall von Homoplasie, bei dem die vogelähnlichen Merkmale durch konvergente Evolution entstanden sind (Sereno 1991, Agnolin et al. 2012, Xu et al. 2011, Zhou 1995).

Abb. 42: Mononykus
Übrigens sind auch bei vielen Ornithomimosauriern Federn nachgewiesen worden (Abb. 43). Eindeutige Belege für Federn sind von Ornithomimus edmontonicus bekannt, von dem es mehrere Exemplare gibt, die Federspuren aufweisen (van der Reest et al. 2016). Bei Deinocheirus und Pelecanimimus wurde ebenfalls über Federn spekuliert, bei Deinocheirus aufgrund des Vorhandenseins eines Pygostyls (Lee et al 2014) und bei Pelecanimimus aufgrund möglicher Abdrücke (Briggs et al. 1997).

Abb. 43: Einige Vertreter der Ornithomimidae mit Federkleid
Eine andere Familie, deren genaue Position im Stammbaum der Maniraptora nicht ganz sicher ist, sind die Scansoriopterygidae aus China (Abb. 44 Czerkas & Yuan 2002). Einige Autoren ordnen sie innerhalb der Avialae ein (Senter 2007, Zhang et al. 2008), andere außerhalb als basale Paraves oder basale Pennaraptora (Agnolin & Novas 2011, 2013, Brusatte et al. 2014, Lefevre et al. 2014, Sorkin 2021, Pittman et al. 2020). Sie werden in einem gesonderten Beitrag nochmal erwähnt werden.

Abb. 44: Scansoriopteryx
Die Schwierigkeit der Forscher, kreidezeitliche Vögel und Nicht-Vogel-Dinosaurier überhaupt voneinander abzugrenzen, macht einmal mehr deutlich, wie eng die offensichtliche Verwandtschaft dieser Gruppen ist.
2023 wurde eine neue befiederte Dinosauriergattung entdeckt: Fujianvenator prodigiosus, einem fasanengroßen Dinosaurier mit langen Beinen und krallenbewehrten Flügeln aus der späten Jurazeit (Abb. 45; Xu et al. 2023). Die neue Art, die vermutlich vor rund 150 Millionen Jahren gelebt hat, weist eine bizarre Kombination verschiedener Merkmale auf, die sie mit anderen Vertretern der Avialae, Troodontidae und Dromaeosauridae teilt. Besonders markant ist die Tatsache, dass das Schienbein doppelt so lang wie der Oberschenkelknochen ist. Fujianvenator zeichnet sich somit durch eine einzigartige Kombination der Skelettmerkmale verschiedenster Archosaurier aus, weswegen die Erstbeschreiber folgern, dass Mosaikmerkmale bei frühen theropoden Dinosauriern eine gewichtige Rolle bei der Evolution der Vögel gespielt haben muss. Der überraschend lange Unterschenkel und andere Erscheinungsmerkmale in Kombination mit geologischen Beobachtungen deuteten darauf hin, dass Fujianvenator in einer sumpfähnlichen Umgebung lebte und ein Hochgeschwindigkeitsläufer oder ein langbeiniger Watvogel war. Dieser Befund steht im Gegensatz zu anderen frühen Vogelarten, von denen man annimmt, dass sie sich eher auf Bäumen und in der Luft fortbewegten.

Abb. 45: Fujianvenator
Zusammenfassung
Fassen wir zusammen:
Abb. 1 zeigt den Verwandtschaftsbaum der Avemetatarsalia. Dieses Taxon umfasst neben den modernen Vögeln (AVES, links oben), den Vögeln im weiteren Sinn (ursprünglichen Avialae), Nichtvogel-Dinosauriern und Flugsauriern sämtliche Archosaurier, die näher mit den Vögeln verwandt sind als mit den Krokodilen. Die höheren Vögel zeichnen sich gegenüber der Stammart an der Basis des Baums (rechts unten) durch etwa 1500 morphologische Veränderungen (abgeleitete Merkmale, Apomorphien, Cau 2018) aus. Diese traten sukzessive in der Ahnenlinie der Vögel auf. Erwartungsgemäß sind die Gruppen hierarchisch ineinander verschachtelt. Das hierarchische System und die sich darin widerspiegelnde abgestufte Ähnlichkeit der Arten ist der stärkste Beleg für die Evolution und die Abstammung der Vögel von frühen Dinosauriern.
Eine andere Studie stellte fest, dass eine klare Abgrenzung zwischen Vögeln und ihren unmittelbaren „Nichtvogel“-Vorfahren gar nicht erkennbar ist (Brusatte et al. 2014). Hierfür wurden von rund 150 Theropoden aus jener Zeitspanne Datensätze für mehr als 850 Skelettmerkmale zusammengetragen. Mit einem Statistikverfahren, das viele Merkmale einrechnet, wurde jede Art in einem so genannten Morphospace (einem „Gestaltraum“) abgebildet (Abb. 46). Im Prinzip handelt es sich dabei um eine mehrdimensionale Karte, auf der die Arten entlang mehrerer Achsen nach dem Anteil von Merkmalen gruppiert sind, die sie miteinander teilen. Zwei sehr ähnliche Arten liegen dann nah zusammen, während in vielem verschiedene Arten weit auseinanderrücken. Wären die Vögel aus Dinosauriern auf Grund einer Anzahl rasch aufeinander folgender einschneidender Mutationen hervorgegangen, hätte sich demnach binnen kurzer Zeit eine völlig andere Tierform herausgebildet, dann müssten die beiden Gruppen von Theropoden auf der Karte deutlich verschiedene Bereiche, also eigene Morphospaces einnehmen. Das ist aber nicht der Fall. Vielmehr finden sich die damaligen Vögel bunt verstreut mitten in der Wolke der Dinosaurier. Das heißt, ihre Entwicklung geschah so langsam, dass der Übergang verschwamm.
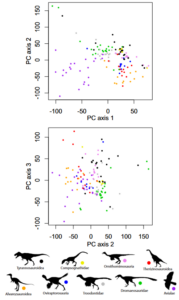
Abb. 46: Diskreter Morphospace der Coelurosaurier. Darstellung der anatomischen Gesamtvariabilität der Arten. Gezeigt werden bivariate Darstellungen der Hauptkoordinatenachsen 2 gegen 1 und 3 gegen 2 (die Achsen 1-3 machen 4,25% der Gesamtvarianz aus). Vögel unterscheiden sich weitgehend von anderen Coelurosauriern auf der Hauptkoordinatenachse 1, aber nicht auf Achse 2 oder 3 (oder allen folgenden Achsen). Permutationstests zeigen, dass es keine klare, signifikante Trennung zwischen Vögeln und ihren engsten Verwandten unter den Theropoden gibt.
Um diesem Morphenkontinuum einen Sinn zu geben, werden jene theropoden Dinosaurier, die zu den Vögeln führen als Avialae definiert. Die Dromaeosauriden, dazu zählen Gattungen wie Deinonychus, Velociraptor oder Microraptor, gehören aber nicht dazu, denn ihre Evolutionslinie hat sich kurz vorher abgezweigt.
Mehr als 40 % der Schlüsselmerkmale moderner Vögel entwickelten sich während des 60 Millionen Jahre dauernden Übergangs von den ersten vogelartigen Archosauriern zu den ersten Maniraptoren, d. h. den ersten Dinosauriern, die den lebenden Vögeln näherstanden als dem Tyrannosaurus rex. Nach dem Auftreten der Maniraptoromorpha kam es in den nächsten 40 Millionen Jahren zu einer kontinuierlichen Verkleinerung der Körpergröße und zur Anhäufung neotenischer (juveniler) Merkmale. Die Hyperkarnivorie wurde immer seltener, während sich die Gehirnhälften vergrößerten und die Vordergliedmaßen länger wurden (Cau 2018). Das Integument entwickelte sich zu komplexen, gefiederten Federn (Prum & Brush 2003, Prothero 2017, Roy et al. 2020, Carrol et al. 2019, McKellar et al. 2011, Benton et al. 2019, Neukamm & Beyer 2023).
Während der Kreidezeit entwickelten sich die Avialae zu einer großen Vielfalt an Formen. Viele Gruppen behielten primitive Merkmale, wie z. B. Klauenflügel und Zähne, obwohl letztere bei einer Reihe von Avialae-Gruppen, einschließlich der modernen Vögel (Aves), unabhängig voneinander verloren gingen (Chiappe 2007). Zunehmend steifere Schwänze sind in der Evolution der Maniraptoren zu beobachten, und dieser Prozess gipfelte im Auftreten des Pygostylus, einer Verknöcherung verschmolzener Schwanzwirbel, wie wir sie schon bei Confuciusornis sehen können (Hou et al. 1995, Chiappe et al. 1999, Zhou & Hou 1998, Zhou 2004, Cau 2018). In der späten Kreidezeit, vor etwa 100 Millionen Jahren, entwickelten die Vorfahren aller modernen Vögel ein offeneres Becken, das es ihnen ermöglichte, im Verhältnis zur Körpergröße größere Eier zu legen (Pickrell 2018).
Schließlich kam es mit der Evolution der Ornithothoraces zu denen u. a. die Gegenvögel, Ichthyornis, Hesperornis und die modernen Vögel gehören, zu einer Verfeinerung der Aerodynamik und der Flugfähigkeit sowie dem Verlust oder Verschmelzung mehrerer Skelettmerkmale. Von besonderer Bedeutung sind die Entwicklung eines vergrößerten, gekielten Brustbeins und der Alula (Abb. 47) sowie der Verlust der Greifhände (Cau 2018).
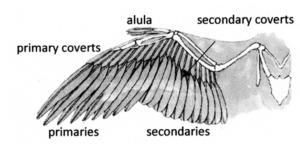
Abb. 47: Alula
Es führt also kein Weg mehr an der Einsicht vorbei, dass Vögel Dinosaurier-Vorfahren haben – zumindest, wenn man wissenschaftliche Rationalitätsstandards gelten lässt (vgl. Prum 2003, Havstad & Smith 2019). Seit 20 Jahren ist dies wissenschaftlicher Konsens. In der nächsten Episode werden wir uns jedoch mit einigen Einwänden der Gegner der Dinosaurier-Vögel-Verwandtschaft befassen. Eine Auseinandersetzung damit ist insofern sinnvoll, als dass sie populäre Mythen über die Evolution verbreiten. Außerdem lernen wir so auch mehr über die Evolutionsgeschichte der Dinosaurier kennen.
Literatur
Agnolín, F. L., Egli, F. B., Chatterjee, S., Marsà, J. A. G (2017): Vegaviidae, a new clade of southern diving birds that survived the K/T boundary. The Science of Nature. 104 (87): 87
Agnolín, F. L., Novas, F. E. (2011). Unenlagiid theropods: are they members of the Dromaeosauridae (Theropoda, Maniraptora)? Anais da Academia Brasileira de Ciências. 83 (1): 117–162.
Agnolín, F. L., Novas, F. E. (2013): Avian ancestors. A review of the phylogenetic relationships of the theropods Unenlagiidae, Microraptoria, Anchiornis and Scansoriopterygidae. SpringerBriefs in Earth System Sciences: 1–96.
Agnolin, F. L., Powell, J.E., Novas, F. E., Kundrát, M. (2012): New alvarezsaurid (Dinosauria, Theropoda) from uppermost Cretaceous of north-western Patagonia with associated eggs. Cretaceous Research. 35: 33–56.
Alvarenga, H. M. F., Bonaparte, J. F. (1992): A new flightless landbird from the Cretaceous of Patagonia. Los Angeles County Museum of Natural History, Science Series 36:51-64
Benton, M. J., Dhouailly, D., Jiang, B., McNamara, M. (2019): The Early Origin of Feathers. Trends in Ecology & Evolution. 34 (9): 856–869.
Briggs, D. E. G., Wilby, P. R., Pérez Pérez-Moreno, B., Sanz, J. L., Fregenal-Martinez, M. (1997): The mineralization of dinosaur soft tissue in the Lower Cretaceous of Las Hoyas, Spain. Journal of the Geological Society of London, 154: 587-588.
Brusatte, S. L., Lloyd, G. T., Wang, S. C., Norell, M. A. (2014): Gradual assembly of avian body plan culminated in rapid rates of evolution across the dinosaur-bird transition. Current Biology. 24 (20): 2386–2392.
Brusatte, S. L., O’Connor, J. K., Jarvis, E. D. (2015): The origin and diversification of birds. Current Biology, 25, R888–R898.
Caroll, N. R., Chiappe, L. M., Bottjer, D. J. (2019): Mid-Cretaceous amber inclusions reveal morphogenesis of extinct rachis-dominated. Scientific reports, 9, 18108.
Cau, A. (2018): The assembly of the avian body plan: A 160-million-year long process. Bollettino della Società Paleontologica Italiana, 57, 1–25.
Claramunt, S., Cracraft, J. (2015): A new time tree reveals Earth history’s imprint on the evolution of modern birds. Sci Adv. 1 (11): e1501005.
Clark, A. D, Hu, H., Benson, R. B., O’Connor, J. K. (2023): Reconstructing the dietary habits and trophic positions of the Longipterygidae (Aves: Enantiornithes) using neontological and comparative morphological methods. PeerJ 11:e15139
Clark, J. M., Norell, M. A., Chiappe, L. M. (1999): An oviraptorid skeleton from the Late Cretaceous of Ukhaa Tolgod, Mongolia, preserved in an avianlike brooding position over an oviraptorid nest. American Museum Novitates (3265): 1−36.
Clarke, J. A. (2004): Morphology, phylogenetic taxonomy, and systematics of Ichthyornis and Apatornis (Avialae: Ornithurae). Bulletin of the American Museum of Natural History. 286: 1–179.
Clarke, J. A., Tambussi, C. P., Noriega, J. I., Erickson, G. M., Ketcham, R. A. (2005): Definitive fossil evidence for the extant avian radiation in the Cretaceous. Nature. 433 (7023): 305–308.
Coombs, W. P. (1989): Modern analogs for dinosaur nesting and parental behavior. In Farlow, J. O. (ed.). Paleobiology of the dinosaurs. Geological Society of America Special Papers. Vol. Geological Society of America Special Paper 238. Colorado: Boulder. pp. 21−54.
Chiappe, L.M. (2002): Basal bird phylogeny: problems and solutions. In: L.M. Chiappe and L.M. Witmer (Hrsg.): Mesozoic Birds: Above the Heads of Dinosaurs. 448–472. University of California Press, Berkeley.
Chiappe, L. M. (2007): Glorified Dinosaurs: The Origin and Early Evolution of Birds. Sydney: University of New South Wales Press.
Chiappe, L. M. (2009): Downsized Dinosaurs: The Evolutionary Transition to Modern Birds. Evo Edu Outreach 2, 248–256.
Chiappe, L. M., Dyke, G. J. (2006): The early evolutionary history of birds. Journal of the Paleontological Society of Korea. Bd. 22, Nr. 1, S. 133–151.
Chiappe, L. M., Shu-An, J., Qiang, J., Norell, M. A. (1999): Anatomy and systematics of the Confuciusornithidae (Theropoda:Aves) from the Late Mesozoic of northeastern China. Bulletin of the American museum of Natural History no.242 89pp.
Chiappe, L.M., Walker, C.A. (2002): Skeletal morphology and systematics of the Cretaceous Euenantiornithes (Ornithothoraces: Enantiornithes). In: L.M. Chiappe and L.M.Witmer (Hrsg.): Mesozoic Birds: Above the Heads of Dinosaurs. 240–267. University of California Press, Berkeley.
Chiappe, L. M. Witmer, L. M. eds. (2002): Mesozoic birds: above the heads of dinosaurs. Berkeley and Los Angeles, California: University of California Press.
Christensen, P., Bonde, N. (2004): Body plumage in Archaeopteryx: a review, and new evidence from the Berlin specimen. Comptes Rendus Palevol. 3 (2): 99–118.
Currie, P. J. (2023): Celebrating dinosaurs: their behaviour, evolution, growth, and physiology. Canadian Journal of Earth Sciences. 60(3): 263-293.
Czerkas, S.A., Yuan, C. (2002): An arboreal maniraptoran from northeast China. Pp. 63-95 in Czerkas, S.J. (Ed.), Feathered Dinosaurs and the Origin of Flight. The Dinosaur Museum Journal 1. The Dinosaur Museum, Blanding, U.S.A
Dong, Z., Currie, P. J. (1996): On the discovery of an oviraptorid skeleton on a nest of eggs at Bayan Mandahu, Inner Mongolia, People’s Republic of China. Canadian Journal of Earth Sciences. 33 (4): 631−636.
Elżanowski, A. (1974): Preliminary note on the Palaeognthous bird from the Upper Cretaceous of Mongolia Palaeontologia Polonica 30.
Ericson, P. G.P., et al. (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters. 2 (4): 543–547.
Fastovsky, D. E., Weishampel, D. B. (2021): Dinosaurs: A Concise Natural History (4th ed.). Cambridge university Press, Cambridge.
Field, D. J., Benito, J., Chen, A., Jagt, J. W. M., Ksepka, D. T. (2020): Late Cretaceous neornithine from Europe illuminates the origins of crown birds. Nature. 579 (7799): 397–401.
Forster, C. A., Chiappe, L.M., Krause, D. W., Sampson, S. D. (1996): The first Cretaceous bird from Madagascar. Nature. 382 (6591): 532–534.
Forster, C. A., Sampson, S. D., Chiappe, L. M., Krause, D. W. (1998a): The theropod ancestry of birds: new evidence from the Late Cretaceous of Madagascar. Science 279:1915–1919.
Forster, C. A., Sampson, S. D., Chiappe, L. M., Krause, D. W. (1998b): Genus correction. Science. 280 (5361): 179.
Foth, C., Rauhut, O. W. M. (2017): Re-evaluation of the Haarlem Archaeopteryx and the radiation of maniraptoran theropod dinosaurs. BMC Evolutionary Biology. 17 (1): 236.
Gauthier, J. A. (1986): Saurischian monophyly and the origin of birds. Memoirs of the California Academy of Sciences. 8: 1–55.
Gauthier, J., de Queiroz, K. (2001): Feathered dinosaurs, flying dinosaurs, crown dinosaurs, and the name Aves. Pp. 7-41 in New perspectives on the origin and early evolution of birds: proceedings of the International Symposium in Honor of John H. Ostrom (J. A. Gauthier and L. F. Gall, eds.). Peabody Museum of Natural History, Yale University, New Haven, Connecticut, U.S.A.
Gauthier, J., Gall, L. F. (2001): New perspectives on the origin and early evolution of birds. New Haven: Peabody Museum of Natural History, Yale University.
Gish, D. (1995): Evolution, the Fossils Still Say NO! San Diego, Calif.: Creation-Life.
Hartman, S., Mortimer, M., Wahl, W. R., Lomax, D. R., Lippincott, J., Lovelace, D. M. (2019): A new paravian dinosaur from the Late Jurassic of North America supports a late acquisition of avian flight. PeerJ. 7: e7247.
Havstad, J. C., Smith, N. A. (2019): Fossils with feathers and philosophy of science. Systematic Biology 68, 840–851.
Heilmann, G. (1926): The origin of birds. London: H. F. & G. Witherby.
Holtz, T. R. (2007): Dinosaurs: The Most Complete, Up-to-Date Encyclopedia for Dinosaur Lovers of All Ages
Hopp, T. P., Orsen, M. J. (2004): Dinosaur Brooding Behavior and the Origin of Flight Feathers (PDF). In Currie, P. J., Koppelhus, E. B., Shugar, M. A., Wright, J. L. (eds.). Feathered dragons: studies on the transition from dinosaurs to birds. Bloomington: Indiana University Press. pp. 234−250.
Hou, L., Chiappe, L. M., Zhang, F., Chuong, C.-M, (2004): New Early Cretaceous fossil from China documents a novel trophic specialization for Mesozoic birds. Naturwissenschaften. 91 (1): 22–25.
Hou, L., Liu, Z. (1984): A new fossil bird from Lower Cretaceous of Gansu and early evolution of birds. Sci. Sin. Ser. B. 27:1296−1302.
Hou L., Martin L., Zhou Z. and Feduccia A., (1999): Archaeopteryx to opposite birds – missing link from the Mesozoic of China. Vertebrata PalAsiatica. 37(2), 88–95.
Hou, L., Zhou, Z., Gu, Y., Zhang, H. (1995): Confuciusornis sanctus, a new Late Jurassic sauriurine bird from China. In: Chinese Science Bulletin. 40, Nr. 18, S. 1545–1551.
Houston, David C., Copsey, J. A. (1994): Bone digestion and intestinal morphology of the Bearded Vulture. The Journal of Raptor Research. 28 (2): 73–78.
Hu, D., Hou, L., Zhang, L., Xu, X. (2009): A pre-Archaeopteryx troodontid theropod from China with long feathers on the metatarsus. In: Nature. Bd. 461, Nr. 7264, S. 640–643
Huxley, T. H. (1868): On the animals which are most nearly intermediate between birds and the reptiles. Ann Mag Nat Hist 2: 66–75.
Huxley, T. H. (1870): Further evidence of the affinity between the dinosaurian reptiles and birds. Q J Geol Soc 26: 12–31.
Ji, Q., Currie, P.J., Norell, M.A., Ji, S. (1998): Two feathered dinosaurs from northeastern China. Nature. 393 (6687): 753–761.
Ji, Q., Ji, S. (1996): On the discovery of the earliest bird fossil in China (Sinosauropteryx gen. nov.) and the origin of birds. Chinese Geology. 10 (233): 30–33.
Ji, Q., Ji, S. (1997): Protarchaeopterygid bird (Protarchaeopteryx gen. nov.) – fossil remains of archaeopterygids from China. Chinese Geology, 238: 38–41.
Knoll, F. et al. (2018): A diminutive perinate European Enantiornithes reveals an asynchronous ossification pattern in early birds. Nature Communicationd 9.: 937
Kuhl, H., Frankl-Vilches, C., Bakker, A., Mayr, G., Nikolaus, G., Boerno, S. T., Klages, S., Timmermann, B., Gahr, M. (2020): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38 (1): 108–127.
Lee, M. S. Y., Cau, A., Naish, D., Dyke, G.J. (2014): Morphological Clocks in Paleontology, and a Mid-Cretaceous Origin of Crown Aves. Systematic Biology. Oxford Journals. 63 (1): 442–449.
Lee, M. S. Y., Worthy, T. H. (2011): Likelihood reinstates Archaeopteryx as a primitive bird. Biology Letters. 8 (2): 299–303.
Lee, Y.-N., Barsbold, R., Currie, P. J., Kobayashi, Y., Lee, H.-J., Godefroit, P., Escuillié, F., Chinzorig, T. (2014): Resolving the long-standing enigmas of a giant ornithomimosaur Deinocheirus mirificus. Nature. 515 (7526): 257–260.
Lefèvre, U., Cau, A., Cincotta, A., Hu, D., Chinsamy, A., Escuillié, F., Godefroit, P. (2017): A new Jurassic theropod from China documents a transitional step in the macrostructure of feathers. The Science of Nature. 104 (9–10): 74.
Lefèvre, U., Hu, D., Escuillié, F. O., Dyke, G., Godefroit, P. (2014): A new long-tailed basal bird from the Lower Cretaceous of north-eastern China. Biological Journal of the Linnean Society. 113 (3): 790–804.
Li, Q., Gao, K.-Q., Vinther, J., Shawkey, M. D., Clarke, J. A., d’Alba, L., Meng, Q., Briggs, D. E. G., Prum, R. O. (2010): Plumage color patterns of an extinct dinosaur (PDF). Science. 327 (5971): 1369–1372.
Lindgren, J., Sjövall, P., Carney, R. M., et al. (2015): Molecular composition and ultrastructure of Jurassic paravian feathers. Scientific Reports. 5: 13520
Longrich, N. (2006): Structure and function of hindlimb feathers in Archaeopteryx lithographica. Paleobiology. 32 (3): 417–431.
Longrich, N.R., Vinther, J., Meng, Q., Li, Q., Russell, A.P. (2012): Primitive wing feather arrangement in Archaeopteryx lithographica and Anchiornis huxleyi. Current Biology. 22 (23): 2262–2267.
Lü, J., Xu, L., Liu, Y., Zhang, X., Jia, S., Ji, Q. (2010): A new troodontid (Theropoda: Troodontidae) from the Late Cretaceous of central China, and the radiation of Asian troodontids. Acta Palaeontologica Polonica. 55 (3): 381–388.
Makovicky, P. J., Apesteguía, S., Agnolín, F. L. (2005): The earliest dromaeosaurid theropod from South America. Nature. 437 (7061): 1007–1011.
Marsh, Othniel C. (1872a): Preliminary description of Hesperornis regalis, with notices of four other new species of Cretaceous birds. The American Journal of Science and Arts 13-18: 360-365.
Marsh, O. C. (1872b): Notice of a new and remarkable fossil bird. American Journal of Science, series 3, 4(22):344.
McKellar, R. C., Chatterton, B. D. E., Wolfe, A. P., et al. (2011): A diverse assemblage of late cretaceous dinosaur and bird feathers from Canadian amber. Science, 333, 1619–1622.
Miller, C. V., Pittman, M., Wang, X., Zheng, X., Bright, J. A. (2022): Diet of Mesozoic toothed birds (Longipterygidae) inferred from quantitative analysis of extant avian diet proxies. BMC Biology. 20 (1): 101.
Morschhauser, E. M., Varricchio, D.J., Gao, C., Liu, J., Wang, Z., Cheng, X. & Meng, Q. (2009): Anatomy of the Early Cretaceous bird Rapaxavis pani, a new species from Liaoning Province, China. Journal of Vertebrate Paleontology. 29 (2): 545–554.
Neukamm, M., Bayer, A. (2023): Woher wissen wir, dass Vögel lebende Dinosaurier sind? Eine kritische Analyse kreationistischer Argumentation. https://www.ag-evolutionsbiologie.net/pdf/2023/evolution-warum-voegel-dinosaurier-sind.pdf
Norell, M. (2005): Unearthing Dragons: The Great Feathered Dinosaur Discoveries. New York: Pi.
Norell, M. A., Clark, J. M., Chiappe, L. M., Dashzeveg, D. (1995): A nesting dinosaur. Nature. 378 (6559): 774−776.
Norell, M. A., Clark, J. M., Dashzeveg, D., Barsbold, R., Chiappe, L. M., Davidson, A. R., McKenna, M. C., Altangerel, P., Novacek, M. J. (1994): A theropod dinosaur embryo and the affinities of the Flaming Cliffs Dinosaur eggs. Science. 266 (5186): 779−782.
Norell, M.A., Clark, J. M., Turner, A.H., Makovicky, P. J., Barsbold, R., Rowe, T. (2006): A new dromaeosaurid theropod from Ukhaa Tolgod (Omnogov, Mongolia). American Museum Novitates (3545): 1–51.
Norell, M.A., Xu, X (2005): Feathered dinosaurs. Annual Review of Earth and Planetary Sciences 33: 277–299.
O’Connor, J. K., Chiappe, L. M. (2011): A revision of enantiornithine (Aves: Ornithothoraces) skull morphology. Journal of Systematic Palaeontology. 9 (1): 135–157.
O’Connor, J. K., Zhou, Z., Smith, A. (2019): The evolution of the modern avian digestive system: insights from paravian fossils from the Yanliao and Jehol biotas. Palaeontology. 63 (1): 13–27.
O’Connor, J. K., Zhou, Z., Zhang, F. (2011): A reappraisal of Boluochia zhengi (Aves: Enantiornithes) and a discussion of intraclade diversity in the Jehol avifauna, China. Journal of Systematic Palaeontology. 9 (1): 51–63.
Osborn, H. F. (1924): Three new Theropoda, Protoceratops zone, central Mongolia. American Museum Novitates (144): 1−12.
Ostrom, John H. (1969): Osteology of Deinonychus antirrhopus, an unusual theropod from the Lower Cretaceous of Montana. Bulletin of the Peabody Museum of Natural History. 30.
Ostrom, J. H. (1974): Archaeopteryx and the origin of flight. Quarterly Review of Biology 49:27–47.
Ostrom, J. H. (1976): Archaeopteryx and the origin of birds. Biological Journal of the Linnean Society 8:91–182.
Ostrom, J. H. (1985): Introduction to Archaeopteryx. In Hecht, M. K. O., Ostrom, J. H., Viohl, G., Wellnhofer, P. (eds.). The Beginnings of Birds: Proceedings of the International Archaeopteryx Conference. Eichstätt: Freunde des Jura-Museums Eichstätt. pp. 9–20
Padian, K. (2004): Basal Avialae. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a., S. 196–209.
Padian, K., Chiappe, L. M. (1998): The origin and early evolution of birds. Biological Reviews 73: 1–42.
Paul, G. S. (2016): The Princeton Fieldguide to Dinosaurs. 2nd Edition. Princeton University Press
Pei, R., Pittman, M., Goloboff, P. A., Dececchi, T. A., Habib, M. B., Kaye, T. G., Larsson, H. C.E., Norell, M. A., Brusatte, S. L., Xu, X. (2020): Potential for Powered Flight Neared by Most Close Avialan Relatives, but Few Crossed Its Thresholds. Current Biology. 30 (20): 4033–4046.e8.
Perle, A., Chiappe, L. M., Rinchen, B., Clark, J. M., Norell, M. A. (1994): Skeletal morphology of Mononykus olecranus (Theropoda, Avialae) from the late Cretaceous of Mongolia. American Museum Novitates (3105): 1−29.
Perle, A., Norell, M. A., Chiappe, L. M., Clark, J. M. (1993a): Flightless bird from the Cretaceous of Mongolia. Nature. 362: 623−626. Bibcode:1993Natur.362..623A. doi:10.1038/362623a0
Perle, A., Norell, M. A., Chiappe, L. M., Clark, J. M. (1993b): Correction: Flightless bird from the Cretaceous of Mongolia. Nature. 363 (188)
Perrichot, V., Marion, L., Neraudeau, D., et al. (2008): The early evolution of feathers: fossil evidence from Cretaceous amber of France. Proceedings of the Royal Society B: Biological Sciences, 275, 1197–1202.
Pittman, M., Xu, X. (2020): Pennaraptoran Theropod Dinosaurs Past Progress and New Frontiers. Bulletin of the American Museum of Natural History. 440 (1): 1–355.
Pickrell, J. (2018): Early birds may have been too hefty to sit on their eggs. Nature. doi:10.1038/d41586-018-03447-3.
Prothero, D. (2017): Evolution – What the Fossils say and why it matters. Second edition. New York: Columbia University Press
Prothero, D. (2022): Vertebrate Evolution. From Origins to Dinosaurs and beyond. CRC Press
Prum, R. O. (1999): Development and evolutionary origin of feathers. Journal of Experimental Zoology, 285, 291–306.
Prum, R. O. (2003): Are current critiques of the theropod origin of birds science? Rebuttal to Feduccia (2002). The Auk: Ornithological Advances, 120, 550–561.
Prum, R. O., Brush, A. H. (2003): Which came first, the feather or the bird? Scientific American, 288, 84–93.
Prum, R. O., et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Rauhut, O. W. M., Foth, C. (2020): The origin of birds: current consensus, controversy, and the occurrence of feathers. In Foth, C., & Rauhut, O. (Eds.) The evolution of feathers. From their origin to the present (S. 27–45). Berlin: Springer Nature.
Rauhut, O. W. M., Foth, C., Tischlinger, H. (2020): Archaeopteryx und andere Urvögel aus dem Solnhofener Archipel. Archaeopteryx, 36, 4–15.
Roy, A., Miller, C. V., Pittmann, M., et al. (2020): Three-dimensionally preserved ‘Stage IIIb’ fossil down feather supports developmental modularity in feather evolution. BioRxiv, preprint, 1–5.
Sanz, J.L., Bonaparte, J.F., Lacasa, A. (1988): Unusual Early Cretaceous birds from Spain. Nature. 331 (6155): 433–435.
Sanz, J., Chiappe, L., Pérez-Moreno, B. et al. (1996): An Early Cretaceous bird from Spain and its implications for the evolution of avian flight. Nature 382, 442–445.
Sato, T., Cheng, Y.-N., Wu, X.-C., Zelenitsky, D. K., Hsiao, Y.-F. (2005): A Pair of Shelled Eggs Inside A Female Dinosaur. Science. 308 (5720): 375.
Schmitt, A. (2023): Großartige Giganten. Den letzten Geheimnissen der Dinosaurier auf der Spur. Dtv Verlagsgesellschaft.
Schweitzer, M. H., Schroeter, E. R., Czajka, C. D. (2021): Dinosaurs How We KNow What We Know. CRC Press
Senter, P. (2007): A new look at the phylogeny of Coelurosauria (Dinosauria: Theropoda). Journal of Systematic Palaeontology. 5 (4): 429–463.
Sereno, Paul (2001): Alvarezsaurids: Birds or ornithomimosaurs?. In Gauthier, Jacques, Ostrom, John H. (eds.). New Perspectives on the Origin and Early Evolution of Birds. Peabody Museum of Natural History Yale University.
Sereno, P. C., Rao, C. (1992): Early evolution of avian flight and perching: New evidence from the lower Cretaceous of China. Science, 255(5046), 845.
Shen, C., Zhao, B., Gao, C., Lü, J., Kundrát, M. (2017): A New Troodontid Dinosaur (Liaoningvenator curriei gen. et sp. nov.) from the Early Cretaceous Yixian Formation in Western Liaoning Province. Acta Geoscientica Sinica. 38 (3): 359–371.
Shipman, P. (1999): Taking wing: Archaeopteryx and the evolution of bird flight. New York: Simon & Schuster.
Smith, N. A., Chiappe, L. M., Clarke, J. A., et al. (2015): Rhetoric vs. reality: a commentary on Bird origins anew” by A. Feduccia. The Auk: Ornithological Advances, 132, 467–480.
Sorkin, B. (2021): Scansorial and aerial ability in Scansoriopterygidae and basal Oviraptorosauria. Historical Biology. 33 (12): 3202–3214.
Sues, H.-D. (2001): Palaeontology: ruffling feathers. Nature, 410, 1036–1037.
Thulborn, R. A. (1992): Nest of the dinosaur Protoceratops. Lethaia. 25 (2): 145−149.
Turner, A. H., Pol, D., Clarke, J. A., Erickson, G. M., Norell, M. (2007): A basal dromaeosaurid and size evolution preceding avian flight. Science. 317 (5843): 1378–1381
Turner, A. H., Makovicky, P. J., Norell, M. A. (2012): A review of dromeosaurid systematics and paravian phylogeny Bull. Am. Mus. Nat. Hist., 371:1-206
van der Reest, A.J., Wolfe, A.P., Currie, P.J. (2016): A densely feathered ornithomimid (Dinosauria: Theropoda) from the Upper Cretaceous Dinosaur Park Formation, Alberta, Canada. Cretaceous Research. 58: 108–117.
Varricchio, D. J., Moore, J. R., Erickson, G. M., Norell, M. A., Jackson, F. D., Borkowski, J. J. (2008): Avian paternal care had dinosaur origin. Science. 322 (5909): 1826−1828.
Walker, C. (1981): New subclass of birds from the Cretaceous of South America. In: Nature. 252: 51- 53.
Wang, M., Hu, H., Li, Z. (2015): A new small enantiornithine bird from the Jehol Biota, with implications for early evolution of avian skull morphology. Journal of Systematic Palaeontology. 14 (6): 481–497.
Wang, M., Zhou, Z.-H., O’Connor, J. K., Zelenkov, N. V. (2014): A new diverse enantiornithine family (Bohaiornithidae fam. nov.) from the Lower Cretaceous of China with information from two new species. Vertebrata PalAsiatica. 52 (1): 31–76.
Wang, M., Wang, X., Wang, Y., Zhou, Z. (2016): A new basal bird from China with implications for morphological diversity in early birds. Scientific Reports. 6: 19700.
Wang, X., Cau, A., Luo, X., Kundrát, M., Wu, W., Ju, S., Guo, Z., Liu, Y., Ji, Q. (2022): A new bohaiornithid-like bird from the Lower Cretaceous of China fills a gap in enantiornithine disparity. Journal of Paleontology. 96 (4): 961–976.
Wellnhofer, P. (2004): The Plumage of Archaeopteryx. In Currie PJ, Koppelhus EB, Shugar MA, Wright JL (eds.). Feathered Dragons. Indiana University Press. pp. 282–300.
Weishampel, D. B., Dodson, P., Osmólska, Halszka (2004): The Dinosauria, Second Edition. University of California Press.
Witmer, L. M. (2009): Palaeontology: Feathered dinosaurs in a tangle. Nature 461: 601–602.
Xing, L. et al. (2016): Mummified precocial bird wings in mid-Cretaceous Burmese amber. Nature Communications. 7 (1): 12089.
Xing, L et al. (2017): A mid-Cretaceous enantiornithine (Aves) hatchling preserved in Burmese amber with unusual plumage. Gondwana Research. 49: 264–277.
Xing, L et al. (2018): A flattened enantiornithine in mid-Cretaceous Burmese amber: morphology and preservation. Science Bulletin. 63 (4): 235–243.
Xing, L. et al. (2019a): A fully feathered enantiornithine foot and wing fragment preserved in mid-Cretaceous Burmese amber. Scientific Reports. 9 (1): 927.
Xing, L. et al. (2019b): A New Enantiornithine Bird with Unusual Pedal Proportions Found in Amber. Current Biology. 29 (14): 2396–2401.e2.
Xing, L. et al. (2020). An unusually large bird wing in mid-Cretaceous Burmese amber. Cretaceous Research. 110: 104412.
Xu, L., Wang, M., Chen, R., et al. (2023): A new avialan theropod from an emerging Jurassic terrestrial fauna. Nature. 621 (7978): 336–343.
Xu, X., Norell, M. A. (2004): A new troodontid dinosaur from China with avian-like sleeping posture (PDF). Nature. 431 (7010): 838–841.
Xu, X., Sullivan, C., Pittman, M., Choiniere, J. N., Hone, D., Upchurch, P., Tan, Q., Xiao, D., Tan, L., Han, F. (2011): A monodactyl nonavian dinosaur and the complex evolution of the alvarezsauroid hand. Proceedings of the National Academy of Sciences of the United States of America. 108 (6): 2338–2342.
Xu, X., Tang, Z.-L., Wang, X. L. (1999a): A therizinosauroid dinosaur with integumentary structures from China. Nature. 339 (6734): 350–354.
Xu, X., Wang, X.-L., Wu, X.-C. (1999b): A dromaeosaurid dinosaur with a filamentous integument from the Yixian Formation of China. Nature. 401 (6750): 262–266.
Xu, X., You, H., Du, K., Han, F. (2011): An Archaeopteryx-like theropod from China and the origin of Avialae (PDF). Nature. 475 (7357): 465–470.
Xu, X, Zhao, Q., Norell, M., Sullivan, C., Hone, D., Erickson, G., Wang, X., Han, F., Guo, Y. (2009): A new feathered maniraptoran dinosaur fossil that fills a morphological gap in avian origin. Chinese Science Bulletin. 54 (3): 430–435.
Xu, X., Zhou, Z., Wang, X. (2000): The smallest known non-avian theropod dinosaur. Nature 408: 705-708.
Yalden D. W. (1984): What size was Archaeopteryx? Zoological Journal of the Linnean Society. 82 (1–2): 177–188
Yang, T.-R., Chen, Y.-H., Wiemann, J., Spiering, B., Sander, P. M. (2018): Fossil eggshell cuticle elucidates dinosaur nesting ecology. PeerJ. 6: e5144.
Yang, T.-R., Wiemann, J., Xu, L., Cheng, Y.-N., Wu, X.-C., Sander, P. M. (2019): Reconstruction of oviraptorid clutches illuminates their unique nesting biology. Acta Palaeontologica Polonica. 466: 581−596.
Yonezawa, T., et al. (2017): Phylogenomics and Morphology of Extinct Paleognaths Reveal the Origin and Evolution of the Ratites. Current Biology. 27 (1): 68–77.
Zhang, F., Zhou, Z. (2000): A Primitive Enantiornithine Bird and the Origin of Feathers. Science. 290 (5498): 1955–1959.
Zhang, F., Zhou, Z., Hou, L., Gu, G. (2001). Early diversification of birds: Evidence from a new opposite bird. Chinese Science Bulletin. 46 (11): 945–949.
Zhang, F., Zhou, Z., Xu, X., Wang, X., Sullivan, C. (2008): A bizarre Jurassic maniraptoran from China with elongate ribbon-like feathers. Nature. 455 (7216): 1105–1108.
Zheng, X., Wang, X., O’Connor, J., Zhou, Z. (2012): Insight into the early evolution of the avian sternum from juvenile enantiornithines. Nature Communications. 3 (1): 1116.
Zhou, Z. (1995): Is Mononykus a Bird? In: The Auk. Bd. 112, Nr. 4, S. 958–963,
Zhou, Z. (2004): The origin and early evolution of birds: discoveries, disputes and perspectives from fossil evidence. Naturwissenschaften. 91, Nr. 10, S. 455–471
Zhou Z., Chiappe L. Zhang F., (2005): Anatomy of the Early Cretaceous bird Eoenantiornis buhleri (Aves: Enantiornithes) from China. Canadian Journal of Earth Sciences, 42 (7): 1331–1338.
Zhou, Z, Hou, L. (1998): Confuciusornis and the early evolution of birds. Vertebrata PalAsiatica. 36 (2): 136–146.
[1] https://georarities.com/2021/03/12/short-crystal-quartz-and-the-fossilized-bird/