Text als pdf
In unserer Reihe über die Vielfalt und Evolution der Vögel begegnen wir heute einer recht bekannten Gruppe von Vögeln, welche für uns – nach den Hühner- und Gänsevögeln – zu den gesellschaftlich wichtigsten zählen: die Columbimorphae. In diese Klade fallen drei Familien: Die Stelzenrallen, Flughühner und die für uns relevanten Tauben (Jarvis et al. 2014, Prum et al. 2015, Stiller et al. 2024, Kuhl et al. 2021). Weiterhin begegnen wir einigen Vertretern einer anderen großen Klade, den Strisores. Die bekanntesten Vertreter dieser Gruppe sind die Segler und Kolibris, doch die werden wir in der nächsten Episode behandeln. Zu den Strisores gehören einige bemerkenswerte Vertreter nachtaktiver Vögel. Wenn wir an nachtaktive Vögel denken, kommen uns meistens die Eulen in den Sinn. Doch die Eulen gehören einer völlig anderen Klade an. innerhalb der Strisores finden sich eine Reihe nachtaktiver Vogelfamilien mit ihren ganz speziellen Anpassungen (Jarvis et al. 2014, Prum et al. 2015, Stiller et al. 2024, Kuhl et al. 2021).
Beginnen wir aber erstmal mit den Columbimorphae und dort mit den zwei eher unbekannten Familien: den Stelzenrallen und Flughühnern.
Text als pdf
Columbimorphae I: Stelzenrallen (Mesitornithidae)
Die Columbimorphae umfassten ursprünglich eigentlich nur die Tauben und Flughühner, beide zusammen werden dann als Columbiformes bezeichnet, die eine Reihe morphologischer Merkmale miteinander teilen. Molekulare Untersuchungen integrieren auch die Stelzenrallen (Mesitornithidae) in diese Klade. Je nach Datensatz sind sie die Schwestergruppe der Tauben (Hackett et al. 2008) oder Flughühner (Jarvis et al. 2014; Prum et al. 2015). Ursprünglich wurden die Stelzenrallen auf Grund anatomischer Merkmale als besonders urtümliche Verwandte der Rallenvögel angesehen, mit denen sie einige Gemeinsamkeiten haben, jedoch auch gewisse Unterschiede aufweisen. So fehlt den Stelzenrallen im Vergleich zu den Rallen das ungeteilte Nasenloch, zudem haben die Stelzenrallen 14 Steuerfedern, wohingegen die Rallen lediglich zwölf besitzen. Eine Einordnung wird weiterhin durch den Umstand erschwert, dass bisher keine fossilen Exemplare gefunden wurden. Mit den Tauben und Flughühnern teilen sie einige Merkmale, so im Bau der Brustwirbel und im Flügelskelett. Gleichzeitig fehlen ihnen aber die meisten abgeleiteten Merkmale, die die Columbiformes gemeinsam haben, wie ein großer Kropf und gut entwickelte Basipterygoid-Fortsätze. Stelzenrallen kommen mit drei Arten ausschließlich auf Madagaskar vor, die dort verschiedene Lebensräume bewohnen und ihre Verbreitungsgebiete innerhalb Madagaskars sich nicht überschneiden (Del Hoyo 2020, Del Hoyo et al. 1996, Winkler et al. 2020a, Abb. 1). Es sind bodenbewohnende, aber flugfähige Vögel mit runden Flügeln und sehr kräftigen Beinen und Füßen. Die Körperlänge beträgt etwa 30 cm, wovon etwa die Hälfte auf den Schwanz entfällt. Der Kopf erscheint im Vergleich zum Körper recht klein, der an der Basis kräftige Schnabel ist bei den beiden Arten der Gattung Mesitornis wenige Zentimeter lang und nur schwach nach unten gebogen, bei der Halbwüsten-Stelzenralle erreicht der Schnabel etwa Kopflänge und weist eine deutliche, sichelförmige Biegung auf. Die Stelzenrallen gelten als eine der am stärksten bedrohten Vogelfamilien, alle Arten werden von der IUCN als Vulnerable (gefährdet) geführt. Der Gesamtbestand der drei Arten wird auf 154.000 Individuen geschätzt (Callaghan et al. 2021). Zerstörung der Lebensräume, Jagd und invasive Arten gelten dabei als Hauptursache für ihre Bedrohung. Erschwerend kommt hinzu, dass alle Arten in relativ geringen Populationsdichten vorkommen und Verluste somit nur schlecht ausgleichen können. Der schlechten Flugfähigkeit und der geringen Reproduktionsrate wegen können sich die Stelzenrallen nur sehr langsam ausbreiten.
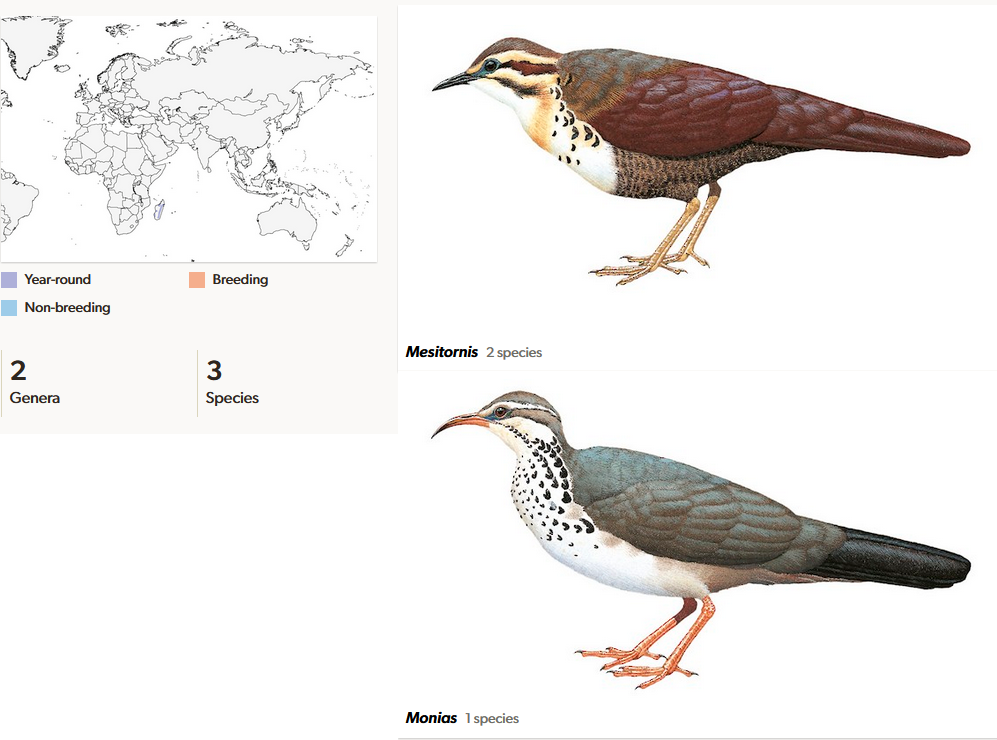
Abb. 1: Stelzenrallen
Columbimorphae II: Flughühner
Flughühner (Pteroclidae) sind Bodenvögel, die in 16 Arten die Wüstensteppen und Halbwüsten Eurasiens und Afrikas bewohnen. Flughühner sind rebhuhn- bis taubengroß mit einem Gewicht von 150 bis 400 g, besitzen kurze Schnäbel, kurze Beine, einen rundlichen Körper und einen kleinen Kopf (Del Hoo 2020, Del Hoyo et al. 1997, Winkler et al. 2020b, Abb. 2). Einige Arten (z. B. Spießflughuhn; Pterocles alchata) haben an Flügeln und Schwanz verlängerte Federn. In Anpassung an ihre Umgebung ist ihr Gefieder vorherrschend sand- und ockerfarben mit schwarzen Bändern und Tupfen. Die Beine sind befiedert, bei den Steppenhühnern (Syrrhaptes) auch die Zehen. Flughühner bevorzugen Gebiete mit hohen Temperaturen und wenig Schatten. Sie ernähren sich hauptsächlich von Samen und leben nomadisch, manche wechseln auch saisonal zwischen Brut- und Wintergebieten, z. B. Gelbkehl-Flughuhn (Pterocles gutturalis) und Senegal-Flughuhn (Pterocles senegallus). Flughühner müssen trinken und haben hierfür eine Besonderheit in ihren Federn entwickelt. In der Dämmerung suchen sie in großen Schwärmen Wasserstellen auf, die bis zu 50 km entfernt liegen können. Die Männchen von Brutpaaren kauern sich dabei bis zum Bauch in die Wasserstellen und schwenken ihren Körper hin und her. Dabei saugt sich ihr Bauchgefieder mit Wasser voll. Damit fliegt das Männchen zurück zum Nest und lässt die Jungen das Wasser aus dem Gefieder saugen. Die Federn am Bauch besitzen einen speziellen Aufbau, der eine besonders hohe Speicherfähigkeit aufweist und die Verdunstung während des Transports reduziert. Dadurch bleiben trotz der großen Entfernung zum Nest durchschnittlich 40–45 % des aufgenommenen Wassers im Gefieder gespeichert (Cade & Maclean 1967).
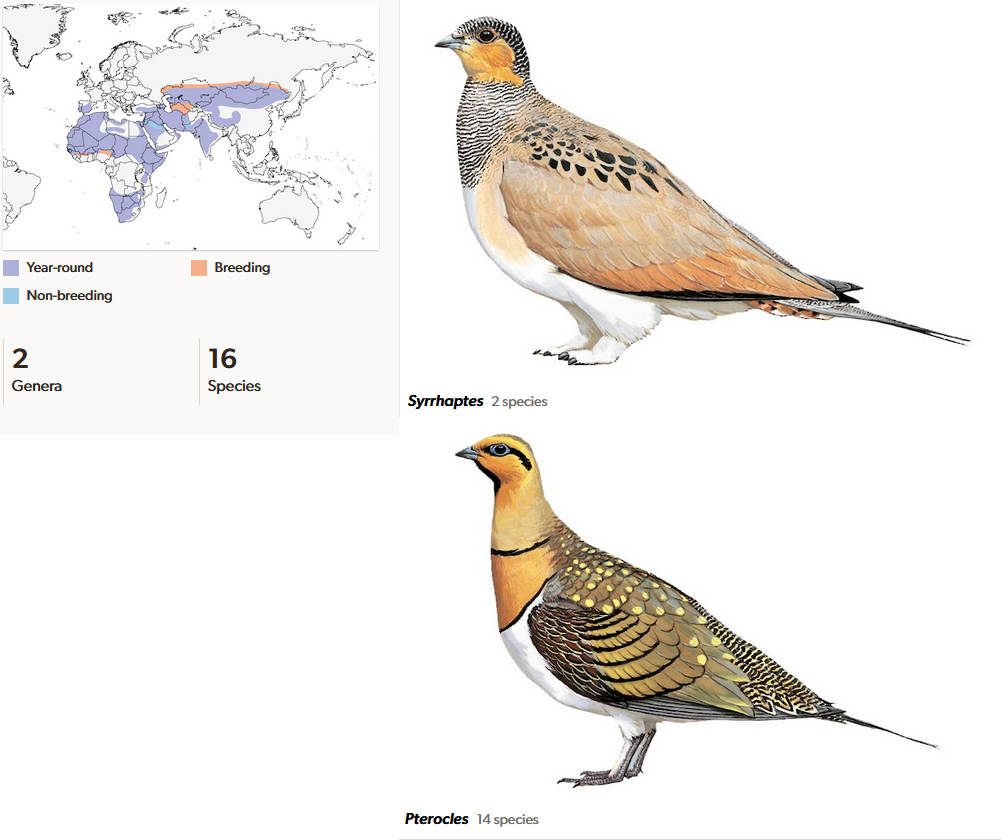
Abb. 2: Flughühner
Der früheste gut datierte Stammgruppenvertreter der Flughühner ist Leptoganga aus dem späten Oligozän und dem frühen Miozän Frankreichs (Mayr 2016, Mourer-Chauvire 1993). Das Vorkommen von Flughühnern in Europa reicht jedoch möglicherweise noch weiter zurück, da für drei Archaeoganga-Arten aus dem späten Eozän oder Oligozän Frankreichs genaue stratigraphische Daten fehlen. Wie ihre heutigen Verwandten kamen die Archaeoganga-Arten in trockenen Lebensräumen vor, obwohl sie größer waren als die heutigen Flughühner.
Columbimorphae III: Tauben (Columbidae)
Die mit Abstand bekannteste Gruppe der Columbimorphae sind die Tauben (Columbidae). Kulturell haben Tauben für Menschen eine signifikante Bedeutung. Sie gelten als Symbol des Friedens (Friedenstaube), der Treue (Turteltaube), der Freiheit und auch als Symbol des Heiligen Geistes im Christentum. Brieftauben haben lange Zeit eine wichtige Rolle im Krieg gespielt. Aufgrund ihrer Peilfähigkeit, Geschwindigkeit und Flughöhe wurden sie oft als militärische Boten eingesetzt. Die Felsentaube wird seit Jahrhunderten gezüchtet und war für Charles Darwins Entdeckung der Evolution von zentraler Bedeutung. Darwin stellte die These auf, dass die vielen Hundert Haustaubenrassen trotz der großen morphologischen Unterschiede alle auf die wilde Felsentaube zurückgehen; die menschliche Auslese bei den Taubenrassen entspreche im Wesentlichen der natürlichen Auslese (Baptista 2009, Abb. 3). Eine verwilderte Form der Haustauben, die Stadttauben, sind in größeren Städten mittlerweile allgegenwärtig und teilweise Plagegeister.

Abb. 3: Darwin und die Taubenrassen
Innerhalb der Columbimorphae sind sie die mit Abstand artenreichste Gruppe. 344 Arten sind beschrieben worden (Del Hoyo 2020, Del Hoyo et al. 1997, Winkler et al. 2020c, Abb. 4-8). Die größte Formenvielfalt findet sich von Südasien bis Australien, als Region mit der größten Vielfalt bezogen auf Körpergröße und besetzte ökologische Nische gilt Neuguinea (Beehler et al. 2016).
In Südostasien, auf den indonesischen Inseln mit dem Schwerpunkt Neuguinea, aber auch vielen Südseeinseln kommen die artenreichen Großen Fruchttauben (Ducula), Flaumfußtauben (Ptilinopus), Kuckuckstauben (Macropygia), Langschwanztauben (Reinwardtoena), Dolchstichtauben (Gallicolumba), Weißgesichttauben (Turacoena) und indopazifischen Erdtauben (Pampusana) vor. Auch die Kragentaube (Caloenas nicobarica) findet hier ein zu Hause. Die Zahntaube (Didunculus strigirostris) kommt nur auf den Samoa-Inseln vor, die Spaltschwingentaube (Drepanoptila holosericea) in Neukaledonien. Erwähnenswert sind auch die Krontauben (Goura), die mit vier Arten auf Neuguinea und den vorgelagerten Inseln heimisch sind. Sie sind mit 2,4 kg und zwischen 66 und 79cm Körperlänge die größten rezenten Taubenarten und leben überwiegend auf dem Boden (Abb. 4 und 5).

Abb. 4: Taubengattungen mit Verbreitungsschwerpunkt in Südostasien, Indonesien, Philippinen, Neuguinea und Ozeanien.

Abb. 5: endemische Taubengattungen Australiens
Auf Madagaskar, Mauritius, den Komoren und Seychellen kommt die Gattung der Blauen Fruchttauben (Alectroenas) vor, während die Braunen Fruchttauben (Phapitreron) mit 8 Arten nur auf den Philippinen leben (Abb. 6 und 4). Die Gattung der Grüntauben (Treron) haben ihren Verbreitungsschwerpunkt ebenfalls im südostasiatisch-pazifischen Raum, es gibt aber auch einige Arten in Afrika (Abb. 7). Typisch afrikanische Gattungen sind die Afrikanischen Buschtauben (Turtur), die Zimttaube (Aplopelia larvata), das Kaptäubchen (Oena capensis) und mehrere Arten von Turtel- und Feldtauben (Streptopelia und Columba) (Abb. 6 & 7).

Abb. 6: endemische Gattungen Afrikas (Aplopelida, Turtur, Oena) und der Inseln des indischen Ozeans (Alectroenas, Nesoenas, Raphus, Pezophaps).

Abb. 7: Gattungen, die in Afrika und Asien vorkommen. Columba und Streptopelia haben viele Arten in Afrika und dem gemäßigten Asien, inklusive Europas; die Grüntauben (Treron) haben einen Verbreitungsschwerpunkt in den Tropen Asiens mit einigen afrikanischen Arten. Spilopelia hat je eine Art in Afrika und Asien.
Auf dem amerikanischen Doppelkontinent sind u. a. die amerikanischen Erdtauben (Geotrygon), die Schallschwingentauben (Leptotila), die Amerikanischen Feldtauben (Patagioenas), sowie Trauer- und Wachteltauben (Zenaida und Zentrygon) endemisch (Abb. 8).

Abb. 8: Taubengattungen Nord- und Südamerikas.
In der Paläarktis kommen 29 Arten vor, davon fünf in Mitteleuropa (Ringeltaube, Columba palumbus, Hohltaube, Columba oenas, Türkentaube, Streptopelia decaocto, Turteltaube, Streptopelia turtur und Stadttaube, Columba livia f. domestica, Abb. 9). Die Schneetaube (Columba leuconota) brütet in Höhenlagen von 4-6.000 Metern im Himalaya und unternimmt teilweise Vertikalwanderungen von mehr als 2000 Höhenmetern, um nach Nahrung zu suchen.

Abb. 9: Mitteleuropäische Taubenarten
Die meisten Arten ernähren sich fast ausschließlich pflanzlich. Tauben sind anders als viele andere samenfressende Vögel nicht in der Lage, Samen oder Körner mit dem Schnabel zu enthülsen. Sie nehmen daher Samen, Früchte, Beeren und auch kleine Wirbellose ganz auf und verschlucken sie. Tauben sind kräftig gebaut und meist auffallend kleinköpfig. Der Schnabel hat nur in der distalen Hälfte eine Hornscheide. Die basale Hälfte wird von einer weichen, basisnah geschwollenen Haut bedeckt, unter der sich die schlitzförmigen Nasenlöcher befinden. Der Tarsometatarsus ist mehr oder weniger ausgedehnt befiedert. Der unbefiederte Teil des Tarsometatarsus ist vorn meist durch eine Reihe tafelförmiger Schuppen bedeckt und im Übrigen fein beschildert oder mehr oder weniger nackt. Der Fuß ist als Sitzfuß ausgebildet und anisodactyl, drei Zehen weisen nach vorn, eine nach hinten. Das Deckgefieder ist recht dicht und die Federfahnen haben basal und seitlich dunige Bereiche. Die Geschlechter unterscheiden sich in der Regel nur geringfügig (Del Hoyo et al. 1997).
Alle Tauben haben rudimentäre Blinddärme und einen großen, zweiteiligen Kropf. In diesem wird nicht nur Nahrung gespeichert, sondern auch die sogenannte Kropfmilch zur Fütterung der Nestlinge gebildet. Diese Kropfmilch entsteht durch die kontinuierliche Neubildung und Ablösung von Epithelzellen im Kropf. Die äußerst nahrhafte Flüssigkeit wird von beiden Geschlechtern erzeugt (Del Hoyo et al. 1997, Silver 1984, Gillespie et al. 2012, Davis 1939, Abb. 10).

Abb. 10: Kropfmilch
Eine Reihe an Taubenarten sind in den letzten Jahrhunderten ausgestorben. So ist die Socorrotaube (Zenaida graysoni) in ihrer Heimat ausgerottet, kommt aber in Zoos mit einem Bestand von etwa 300 Tieren, noch vor. Sie werden nachgezüchtet mit dem Ziel diese auf Socorro wieder anzusiedeln, wenn dort die Voraussetzungen geschaffen sind, die eine solche Wiederansiedlung erfolgversprechend machen (Schmechel 2006, Horblit et al. 2006, Ortiz-Alcaraz et al. 2017, Abb. 11). Ähnlich ist man bei der auf Mauritius beheimateten Rosataube (Nesoenas mayeri) vorgegangen, bei der die Wiederansiedelung seit Jahren erfolgreich verläuft (Edmunds et al. 2008, Tatayah 2021, Bunburry et al. 2008, Abb. 12). Für die Mauritius-Fruchttaube (Alectroenas nitidissimus) kommt jedoch jede Hilfe zu spät, sie ist nämlich ausgestorben (Shapiro et al. 2002, Tuijn 1969, Cheke & Hume 2008), wie die wohl bekannteste durch Menschenhand ausgestorbene Vogelart: der Dodo (Raphus cucullatus).
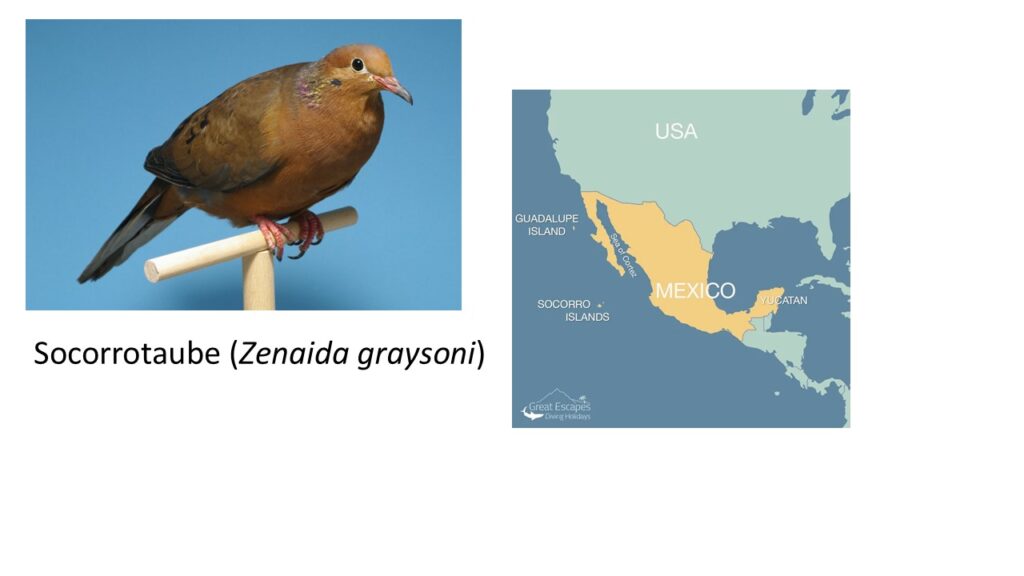
Abb. 11: Socorrotaube

Abb. 12: Rosentaube und Mauritius-Fruchttaube
Der Dodo (Abb. 13) oder auch die Dronte war ein flugunfähiger Vogel, der ausschließlich auf der Insel Mauritius vorkam und trotz seiner merkwürdigen Erscheinung tatsächlich zu den Tauben zählt. Der Dodo ernährte sich von vergorenen Früchten und nistete auf dem Boden. Die Forschung geht davon aus, dass die Spezies um 1690 ausstarb. Sein nächster Verwandter war der ebenfalls ausgestorbene Rodrigues-Solitär (Pezophaps solitaria) auf der politisch zu Mauritius gehörenden Insel Rodrigues. Aus Berichten weiß man, dass der Dodo ein blaugraues Gefieder, einen etwa 23 Zentimeter langen, schwärzlichen, gebogenen Schnabel mit einem rötlichen Punkt sowie kleine Flügel hatte, die ihn nicht zum Fliegen befähigten. Weiterhin bildete ein Büschel gekräuselter Federn den Schwanz und der Vogel legte gelbe Eier. Dodos waren etwa einen Meter groß und wogen 11 bis 17 Kilogramm. Auch wegen seiner schwachen Brustmuskulatur konnte der Dodo nicht fliegen. Das war auch nicht nötig, da er auf Mauritius keine Fressfeinde hatte. Hauptgrund für das Aussterben der Art dürften eingeschleppte Ratten sowie eingeführte und verwilderte Haustiere gewesen sein und dort vor allem Schweine und Affen, welche die Gelege der bodenbrütenden Vögel zerstörten, indem sie ihre Eier fraßen. Da der Dodo ursprünglich keine Feinde besaß, verfügte er über kein Flucht- oder Verteidigungsverhalten. Die Zutraulichkeit des Dodos und die Flugunfähigkeit machten ihn auch für Menschen zu einer leichten Beute. Er war zwar nicht wohlschmeckend, aber als Frischfleisch für lange Seefahrten geeignet. Auch die Eier wurden von Seeleuten in Massen gegessen (Shapiro et al. 2002, Cheke & Hume 2008, Young et al. 2021, Rijsdijk et al. 2009, Parish 2013, Hume 2012).

Abb. 13: Dodo und Rodrigues-Solitär
Keineswegs muss man aber ein seltener Vogel auf einer Insel sein, um als Art auszusterben. Eine weitere bekannte Taubenart, die ausgestorben ist, ist die Wandertaube (Ectopistes migratorius), die Ende des 19. Jahrhunderts in Freiheit ausgerottet wurde und seit dem frühen 20. Jahrhundert, mit dem Tod des letzten in Gefangenschaft gehaltenen Tiers, als ausgestorben gilt (Abb. 14). Noch Anfang des 19. Jahrhunderts zählte die Wandertaube mit einem geschätzten Gesamtbestand von drei bis fünf Milliarden Exemplaren zu den häufigsten Vogelarten der Welt. Sie brütete in riesigen, teils mehrere hundert Quadratkilometer umfassenden Kolonien[1] im östlichen Nordamerika und durchzog in heute unvorstellbar großen Schwärmen das Land. Umso dramatischer ist die Tatsache ihrer Ausrottung. Neben dem Bison wurde sie zum Symbol für den Raubbau an der Natur, der besonders im 19. Jahrhundert in Nordamerika stattfand. Obwohl das Ausmaß ihrer Verfolgung durch den Menschen unzweifelhaft einer der Hauptgründe ihres Aussterbens ist, da sie für die Ernährung exzessiv gejagt wurden, ist die Frage nicht abschließend geklärt, warum ab einem bestimmten Zeitpunkt die Bestände einbrachen und die überlebenden Tiere nicht mehr in der Lage waren, sich in ausreichendem Maße zu vermehren. Hierzu gibt es mehrere Hypothesen. Eine besagt, dass die Art als Koloniebrüter potentiellen Prädatoren einzig die Strategie entgegenbrachte, diese durch einen ständigen Überschuss zu sättigen. Einzelpaare oder kleine Gruppen verfügten nur über unzureichende Anpassungen, den zur Erhaltung der Art nötigen Bruterfolg zu erzielen. Sie brüteten weiterhin relativ offen in schlecht versteckten Nestern. Zudem bestand das Gelege nur aus einem Ei. Andere angenommene Ursachen wie Klimaveränderungen, Wettereinflüsse oder Erkrankungen sind nicht ausreichend belegbar (Blockstein 2002, Fuller 2014, Schorger 1955, Johnson et al. 2010).
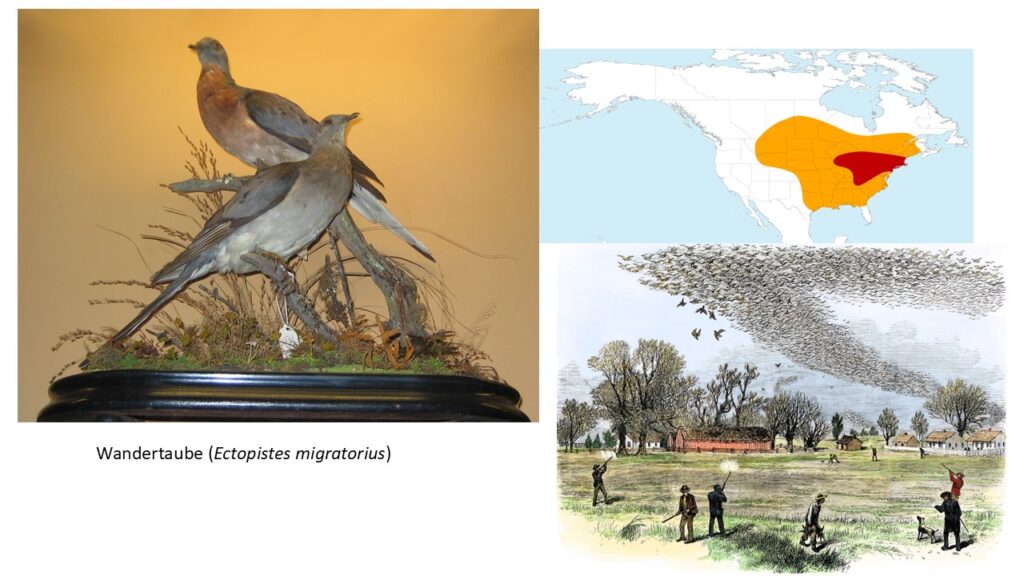
Abb. 14: Wandertaube
Strisores
Die nächste Vogelgruppe, die Strisores, zeichnen sich durch eine Reihe besonderer Anpassungen aus: wir haben hier zum einen Familien, die überwiegend nachtaktiv sind, zum anderen sind einige ausgezeichnete Flieger. Außerdem finden sich hier die kleinsten Vögel der Welt. Die Strisores umfassen 6 Ordnungen und 8 Familien (Ericson et al. 2006, Hackett et al. 2008, Jarvis et al. 2014, Prum et al. 2015, Kuhl et al. 2021, Wu et al. 2024, Stiller et al. 2024, Chen & Field 2020, Mayr 2009a, Chen et al. 2019; Abb. 15): Nachtschwalben (Caprimulgiformes; Caprimulgidae), Fettschwalme (Steatornithiformes; Steatornithidae), Tagschläfer (Nyctibiiformes; Nyctibiidae), Eulenschwalme (Podargiformes; Podargidae) und Höhlenschwalme (Aegotheliformes; Aegothelidae), die alle nachtaktiv sind und die tagaktiven Segler (Apodiformes; Apodidae), Baumsegler (Apodiformes; Hemiprocnidae) und Kolibris (Apodiformes; Trochilidae). Die Verwandtschaft dieser acht Familien gründet sich auf molekularbiologische Untersuchungen und wird nicht durch morphologische Merkmale gestützt, da bestimmte morphologische Merkmale nicht von allen Familien geteilt werden. Beispielsweise haben sieben Strisores-Familien 17 oder 18 freie Wirbel vor dem Kreuzbein (Sakrum); die Fettschwalme jedoch 19. Der Schnabel ist bei den meisten Taxa der Strisores kürzer als der Rest des Kopfes (Abb. 16). Ausnahmen sind die Eulenschwalme, die Kolibris und die ausgestorbene Gattung Fluvioviridavis. Die DNA-Vergleiche bestätigen aber die Zusammensetzung der Strisores als monophyletische Gruppe.
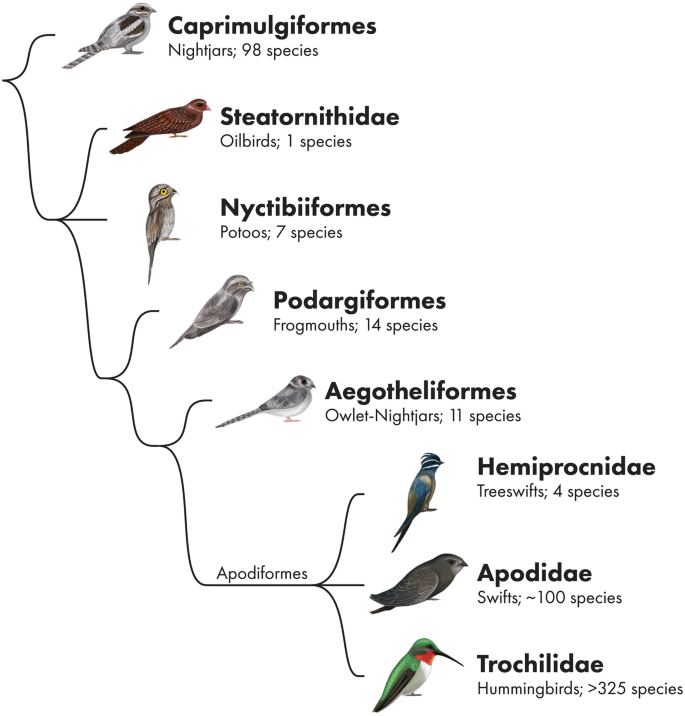
Abb. 15: Phylogenie der Strisores
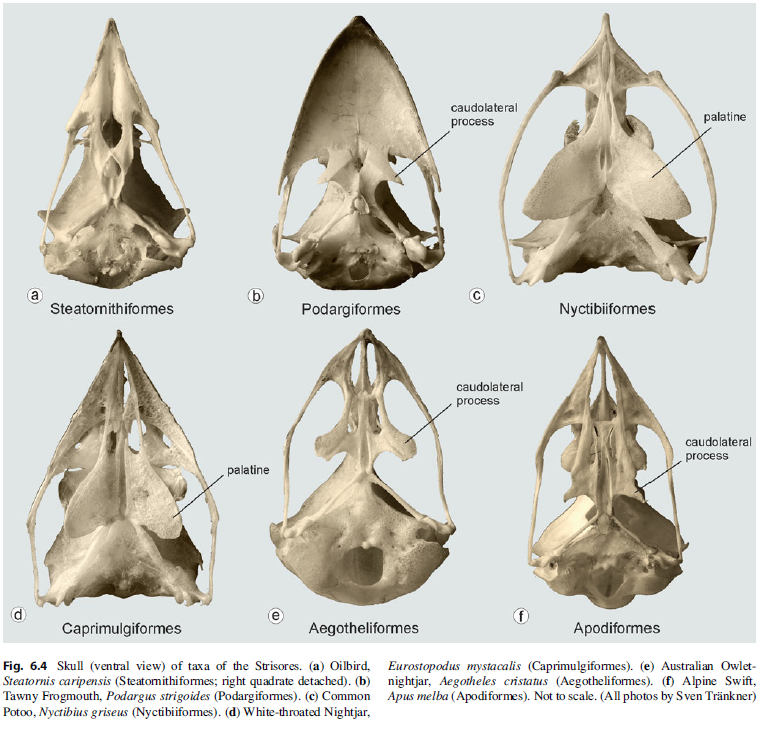
Abb. 16: Schädelformen der Strisores
Die Bezeichnung Strisores wurde übrigens schon 1847 durch den deutschen Ornithologen Jean Louis Cabanis eingeführt. Cabanis gab den Strisores den Rang einer Ordnung und zählte auch den Hoatzin (Opisthocomus hoazin), die Mausvögel (Coliidae) und die Turakos (Musophagidae) dazu (Cabanis 1847). Diese drei Taxa gehören heute nicht zu den Strisores. Zuerst wollen wir uns nur mit den fünf nachtaktiven Familien der Strisores befassen. Die Segler und Kolibris bekommen eine eigene Episode.
Die fünf nachtaktiven Familien der Strisores wurden bis vor kurzem einer gemeinsamen Ordnung zugerechnet, den Schwalmartigen (Caprimulgiformes), die sich jedoch als polyphyletisch herausstellte, da einige Familien der Schwalmartigen näher mit den Seglervögeln verwandt sind als mit den übrigen Schwalmartigen (Ericson et al. 2006, Hackett et al. 2008, Jarvis et al. 2014, Prum et al. 2015, Kuhl et al. 2021, Wu et al. 2024, Stiller et al. 2024, Chen & Field 2020, Mayr 2009, Chen et al. 2019). Um wieder zu monophyletischen Taxa zu kommen und da sich die Familien schon im Paläozän vor 65 bis 60 Millionen Jahren voneinander getrennt haben (Mayr 2014), wurden sie in fünf eigenständige Ordnungen gestellt.
Nachtschwalben (Caprimulgiformes; Caprimulgidae)
Die basalste Gruppe der Strisores sind die Nachtschwalben (Caprimulgidae). Die knapp 100 Arten sind fast weltweit verbreitet mit einem Schwerpunkt in den Tropen (Abb. 17). In Europa kommen zwei Arten vor: der Ziegenmelker (Caprimulgus europaeus) und der Rothals-Ziegenmelker (Caprimulgus ruficollis) (Abb. 18). Der Name Ziegenmelker hat einen Ursprung in dem Mythos, dass der Vogel nachts Ziegen die Milch aussauge, wodurch diese erblinden oder sterben würden. In Wirklichkeit wird der Ziegenmelker aber wohl eher von den Insekten angelockt, die das Weidevieh begleiten.
Nachtschwalben haben ein weiches, überwiegend bräunliches, gut tarnendes Gefieder. Der Rumpf ist zylindrisch, Kopf und Augen sind relativ groß; der Schnabel ist kurz aber breit. Beine und Krallen sind kurz (Winkler et al. 2015, 2020d, Del Hoyo 2020, Del Hoyo et al. 1999). Die Einteilung innerhalb der Nachtschwalben ist Gegenstand der Forschung (Han et al. 2010, Sigurðsson & Cracraft 2014). Ursprünglich wurden mehr als die Hälfte der Arten in die Gattung Caprimulgus gestellt, molekulare Untersuchungen zeigen jedoch, dass diese Gattung polyphyletisch ist: d. h. viele Arten sind nicht näher miteinander verwandt und werden daher anderen Gattungen zugeordnet. Zur Gattung Caprimulgus zählen daher nur Arten aus der alten Welt (Europa, Asien, Afrika und Australien), insgesamt sind es 38 Arten, etwa die Hälfte kommt in Afrika und die andere in Asien und Europa vor. Die Caprimulgus-Arten aus Nord- und Südamerika werden in eine eigene Gattung gestellt – Anstrosomus – weil sie mit anderen neuweltlichen Gattungen näher verwandt sind als mit jenen der alten Welt. Einige Arten der Gattung Caprimulgus wurden zu anderen Gattungen gestellt. Viele weitere kleinere Gattungen sind auf dem amerikanischen Doppelkontintent zu finden. Besondere Erwähnung sollen die Nachtfalken (Chordeiles) haben, die weniger nachtaktiv sind als die anderen Nachtschwalben und auch bei der Jagd gesehen werden können, wenn es noch hell ist (Abb. 19). Eine Unterfamilie der Nachtschwalben, die Eurostopodidae, welche in Asien und Australien vorkommen, haben als charakteristisches Merkmal ein Kopfgefieder, das an Ohren erinnert (Abb. 19).

Abb. 17: phylogenetische Beziehungen der Nachtschwalben

Abb. 18: die zwei in Europa vorkommenden Nachtschwalben

Abb. 19: Nachtfalken und Eurostopodidae
Fettschwalme (Steatornithiformes; Steatornithidae)
Der Fettschwalm (Steatornis caripensis) ist der einzige Vertreter seiner Familie (Steatornithidae) und kommt im nördlichen Südamerika vor. Dieser Vogel zeichnet sich durch einige Besonderheiten aus, die eine Einteilung in eine eigene Familie erlauben. Etwa 40 – 49 cm lang und bis zu 375 g schwer, ist sein Gefieder rötlichbraun mit weißen Flecken. Zwischen Männchen und Weibchen gibt es keine Unterschiede im Gefieder. Sie unterscheiden sich von den anderen Schwalmen durch ihren harten, gekrümmten und kräftigen Schnabel, der einen kleinen Subterminalzahn besitzt. Der Schnabel ist flexibel mit dem Schädel verbunden. Des Weiteren hat er relativ lange Flügel und einen langen Schwanz. Die Füße sind klein und eignen sich besonders zum Festkrallen an vertikalen Flächen. Fettschwalme verfügen über einen sehr guten Geruchssinn (Del Hoyo 2020, Del Hoyo et al. 1999, Winkler et al. 2020e, Winkler et al. 2015, Abb. 20).
Die Augen sind an die nächtliche Nahrungssuche angepasst. Sie sind eher klein, besitzen jedoch eine große Pupille, wodurch sie die höchste Lichtempfindlichkeit von allen Vogelarten erreichen. Mit 1.000.000 Stäbchen pro mm2 auf der Netzhaut liegt deren Dichte höher als bei allen anderen Wirbeltieren. Die Stäbchen sind schichtweise angeordnet, was sonst nur bei Tiefseefischen vorkommt (Martin et al. 2004, Rojas et al. 2004).
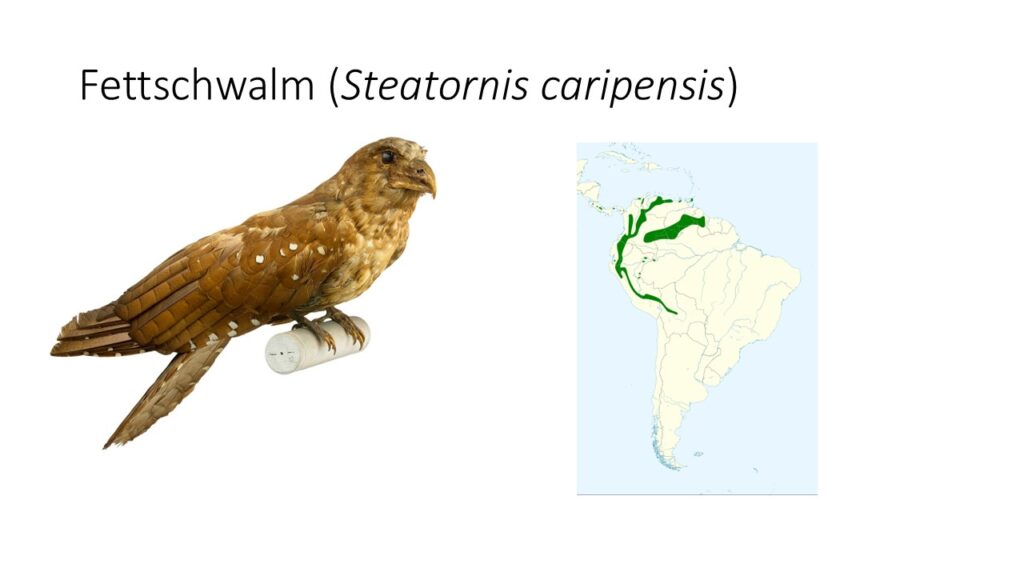
Abb. 20: Fettschwalme
Der Fettschwalm ist der einzige nachtaktive, flugfähige Vogel der Welt, der sich von Früchten ernährt, etwa von Lorbeergewächsen, Palmen oder Balsambaumgewächsen. Es wird nur das Fruchtfleisch verdaut, die Samen werden wieder ausgeschieden, wodurch er zu einem wichtigen Verbreiter von Pflanzen ist. Tagsüber hält sich der Fettschwalm in Kolonien in bis zu einem Kilometer langen, vollkommen dunklen Erdhöhlen im Boden auf, in denen er trotz seiner Nachtaugen nichts mehr sieht. In diesen dunklen Höhlen, die als Ruhe- und Nistplatz dienen, orientiert er sich mittels Echoortung, welche jener der Fledermäuse ähnelt. Der Name Fettschwalm, im englischen Oilbird, rührt auf einer Notiz von Alexander von Humboldt bei seiner Expedition in Venezuela her. Er berichtet, dass die Einwohner die Jungvögel kurz vor dem Flüggewerden sammeln und aus ihnen durch stundenlanges Kochen Öl gewinnen.
Aus der eozänen Green-River-Formation in Nordamerika wurde das fossile Taxon Prefica nivea entdeckt, welches ebenfalls den Fettschwalmen zugeordnet wird (Olson 1987, Abb. 21). Sein Fund belegt, dass diese Familie wesentlich weiterverbreitet war als heute. Der Schnabel von Prefica ähnelt dem des Fettschwalms, weswegen man davon ausgeht, dass er eine ähnliche Ernährungsweise hatte. In der gleichen Schicht finden sich Fossilien der gleichen Familien und teilweise sogar Gattungen von Pflanzen, deren Früchte der Fettschwalm im heutigen Südamerika frisst. Aus der Green-River-Formation als auch der Grube Messel sind weitere Vogelfossilien bekannt, Fluvioviridavis (Abb. 22) und Eurofluvioviridavis (Abb. 23) die Ähnlichkeiten mit Prefica zeigen, deren taxonomische Einordnung jedoch nicht ganz sicher sind (Mayr & Daniels 2001). Sollten sie aber tatsächlich frühe Formen der Fettschwalme darstellen, wäre der heutige Fettschwalm eine Reliktart aus einer einstmals über mehrere Kontinente verbreiteten Ordnung. Einige ordnen aber Fluvioviridavis der Gruppe der Eulenschwalme zu (Nesbitt et al. 2011) oder als basalen Vertreter der Strisores (Mayr 2009, 2016). Nach neuesten Untersuchungen ist die Gattung Eurofluvioviridavis kein Vertreter der Strisores, sondern wird in die Klade der Psittacopasseres, zu der die Papageien und Singvögel gehören, eingeordnet (Nesbitt et al. 2011; Mayr 2015a, 2016).
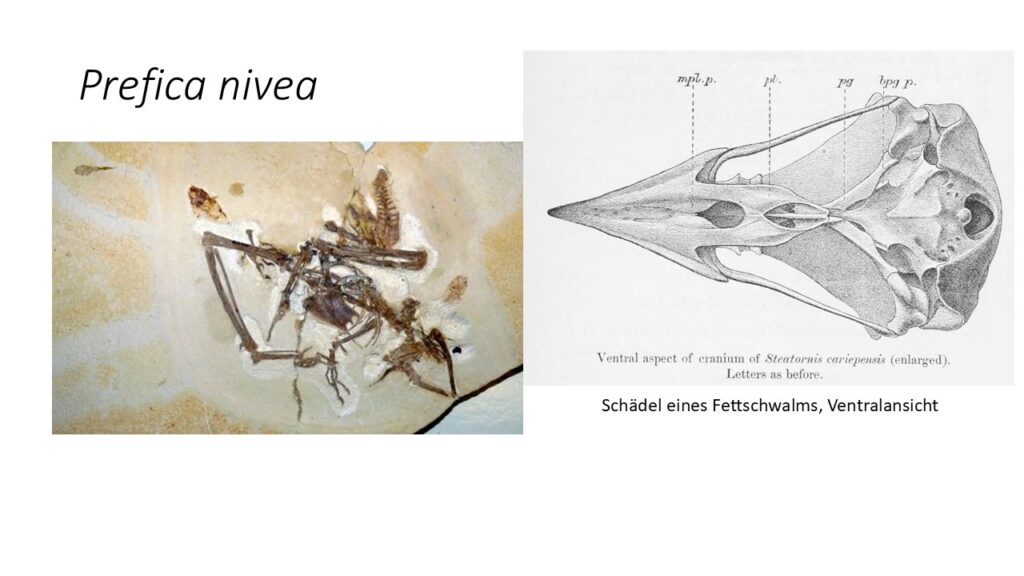
Abb. 21: Prefica
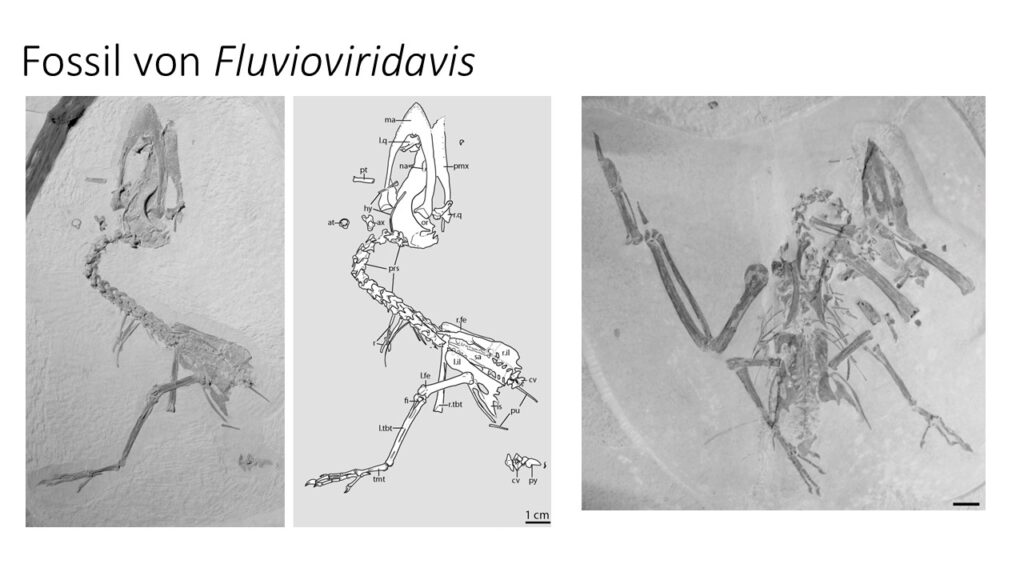
Abb. 22: Fluvioviridavis

Abb. 23: Eurofluvioviridavis
Tagschläfer (Nyctibiiformes; Nyctibiidae)
Die Familie der Tagschläfer (Nyctibiidae) sind die Schwestergruppe der Fettschwalme und kommen mit 7 Arten in zwei Gattungen in Mittel- und Südamerika, sowie in den Karibikinseln Hispaniola und Jamaika vor (Winkler et al. 2020f, Del Hoyo 2020, Del Hoyo et al. 1999, Winkler et al. 2015, Braun & Huddleston 2009, Costa et al. 2021 Abb. 24). Ihr Körper ist langgestreckt und zylindrisch; Kopf und Augen sind groß, der Hals kurz. Der Schnabel ist zart und an der Spitze nach unten gebogen. Geöffnet ist der Schnabelspalt aber sehr weit und breit. Ein besonderes Merkmal der Familie ist das sogenannte magic eye, bei dem es sich um zwei oder drei kleine Falten am Rand des oberen Augenlids handelt, die dafür sorgen, dass schmale Schlitze entstehen, durch die die Vögel auch mit geschlossenen Augen Bewegungen wahrnehmen können. Alle Arten bewohnen vorwiegend dichte tropische Regenwälder, der Mexikotagschläfer (Nyctibius jamaicensis) kommt aber auch in Trockenwäldern vor. Den Tag verbringen die Tagschläfer starr in einer Position mit aufgerichtetem Kopf, so dass sie einem toten, abgebrochenen Ast ähneln. Tagschläfer ernähren sich von größeren, fliegenden Insekten, die sie von einer exponierten Sitzwarte aus im Flug erbeuten.
Neben den rezenten Arten ist mit Paraprefica auch eine ausgestorbene Gattung der Tagschläfer aus dem Eozän bekannt. Gut erhaltene Fossilien dieser Gattung wurden in der Grube Messel in Hessen gefunden und belegen ebenfalls eine prähistorisch größere Verbreitung dieser Vogelfamilie (Mayr 1999, 2016 Abb. 25).
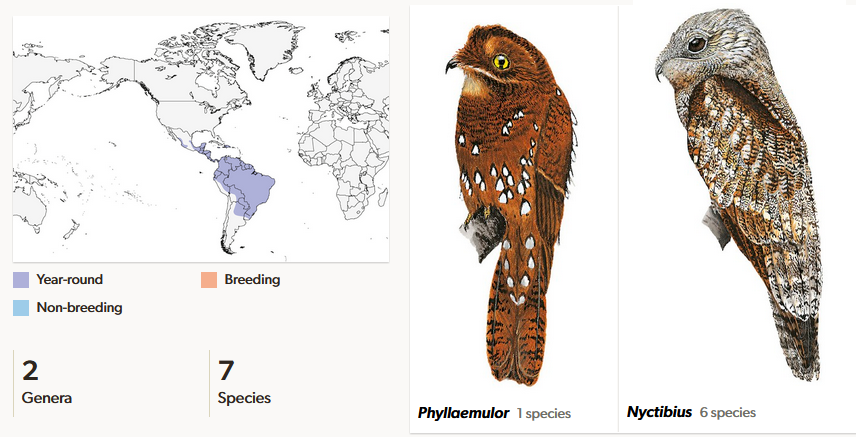
Abb. 24: Tagschläfer

Abb. 25: Paraprefica
Eulenschwalme (Podargiformes; Podargidae)
Eulenschwalme (Podargidae) kommen mit 16 Arten und drei Gattungen in Südindien, Südostasien, Neuguinea und Australien, sowie den Salomon-Inseln vor (Winkler et al. 2015, 2020g, Del Hoyo 2020, Del Hoyo et al. 1999, Abb. 26). Einigen Untersuchungen zur Folge könnte die asiatische Gattung Batrachostomus eine eigene Familie darstellen (Sibley et al. 1988, Mayr 2002). Trotz ihres ähnlichen Aussehens mit den Fettschwalmen und Tagschläfern sind sie enger mit den Seglern verwandt (Chen et al. 2019, Chen & Field 2020). Eulenschwalme haben einen stämmigen Körper, einen großen Kopf und einen dicken, kurzen Hals. Ihr Gefieder ist grau, braun, schwarz, weiß und gelb gemustert und bietet eine gute Tarnung. Die Flügel sind kurz und abgerundet und die Vögel sind deshalb keine wendigen Flieger. Der Schwanz ist lang, die mittleren Schwanzfedern sind etwas länger als die äußeren. Der Schnabel ist dreieckig und breit. Geöffnet ist der Schnabelspalt sehr weit. Dies gibt den Vögeln ihren englischen Namen „Frogmouth“. An der Spitze ist der Schnabel hakenförmig nach unten gebogen. An seiner Basis befinden sich zahlreiche borstenartige Federn.

Abb. 26: Eulenschwalme
Die meisten Arten leben in Wäldern, andere auch in Savannen. Als nachtaktive Insektenfresser ruhen sie tagsüber in Bäumen. Bei Gefahr oder Beunruhigung erstarren sie in einer charakteristischen Haltung: Von ihrem Sitzplatz aus strecken sie ihren Kopf und ihren Vorderkörper schräg nach oben, sodass sie nicht von einem abgebrochenen Ast zu unterscheiden sind. Größere Arten fressen auch kleine Wirbeltiere wie Nager, kleine Reptilien oder Frösche. 2007 wurde eine neue Art aus den Salomonen beschrieben, der Salomonenschwalm (Rigidipenna inexpectata). Zwar wurde er schon 1901 beschrieben, doch erst 2007 als eigenständige Art anerkannt. Vorher galt er als Unterart des Mamorschwalms (Podargus ocellatus) aus Neuguinea und Nordaustralien. Die Gattung Masillapodargus aus dem Eozän der Grube Messel wird von den meisten Autoren den Eulenschwalmen zugeordnet (Mayr 2015b, 2016 Abb. 27).

Abb. 27: Masillapodargus
Höhlenschwalme (Aegotheliformes; Aegothelidae)
Höhlenschwalme (Aegothelidae) sind mit den Seglervögel enger verwandt als mit allen anderen Schwalmen. Sie bestehen aus neun Arten in einer Gattung. Eine Studie aus dem Jahr 2003 (Dumbacher et al. 2003), bei der molekulare Merkmale analysiert wurden, legt nahe, dass 11 lebende Höhlenschwalme anerkannt werden sollten, sowie eine weitere, die Anfang des zweiten Jahrtausends nach Christus ausgestorben ist. Höhlenschwalme sind beschränkt auf Neuguinea, eine Art lebt in Australien und Tasmanien, eine weitere auf den Molukken und eine auf Neukaledonien. Sie leben in dichten Wäldern, die australische Art auch in offenem Buschland. Die nacht- und dämmerungsaktiven Vögel ruhen während des Tages in Baumhöhlen oder auf Ästen. Sie sind Einzelgänger. In der Nacht und in der Dämmerung suchen sie am Boden nach Insekten, Spinnen und weiteren Wirbellosen oder sie fangen ihre Beutetiere in der Luft. Höhlenschwalme brüten in Baumhöhlen, manchmal auch in Höhlen an Steilufern und verbringen dort auch den Tag. Sie haben einen runden Kopf und ähneln in ihrer Sitzhaltung den Eulen, jedoch mit 19-32cm Länge deutlich kleiner. Ihre Augen stehen seitlich. Ihre Zeichnung besteht aus feinen dunklen Wellen auf einer hellen Grundfarbe oder aus großen weißen Tupfen (Winkler et al. 2015, 2020h, Del Hoyo 2020, Del Hoyo et al. 1999, Abb. 28).
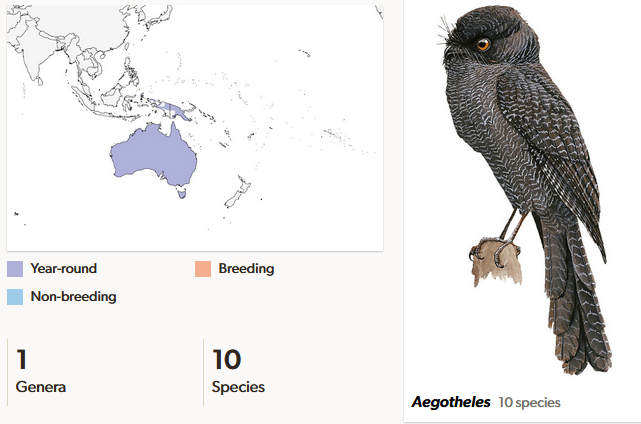
Abb. 28: Höhlenschwalme
Der fossile Nachweis der Höhlenschwalme ist gering. Die ältesten Exemplare stammen aus dem frühen Miozän Neuseelands und bestehen aus einigen fragmentarischen Knochen (Worthy et al. 2007). Der einzige andere fossile Höhlenschwalm, Quipollornis aus dem frühen Miozän Australiens, basiert auf einem Teilskelett und hat verhältnismäßig kürzere Hintergliedmaßen als die heute lebenden Höhlenschwalme (Rich & McEvey 1977, Abb. 29).

Abb. 29: Quipollornis
Die zweite Hauptklade der Strisores, die Apodiformes, zu der Segler, Baumsegler und Kolibris gehören, sind uns viel vertrauter und in vielerlei Hinsicht eine äußerst spannende Vogelordnung, die wir in der nächsten Episode kennenlernen werden.
Literatur
Baptista, L. (2009): Darwin’s pigeons and the evolution of the columbiforms: recapitulation of ancient genes. Acta Zoológica Mexicana. Nueva Serie. 25 (3): 719–741.
Beehler, BM, Pratt, TK (2016): Birds of New Guinea; Distribution, Taxonomy, and Systematics. Princeton University Press, Princeton
Blockstein, D. E. (2002): Passenger Pigeon (Ectopistes migratorius) in The Birds of North America Online (A. Poole, Ed.), Cornell Lab of Ornithology, Ithaca
Braun, M. J.; Huddleston, C. J. (2009): A molecular phylogenetic survey of caprimulgiform nightbirds illustrates the utility of non-coding sequences. Molecular Phylogenetics and Evolution. 53 (3): 948–960.
Bunbury, N.; Stidworthy, M. F.; Greenwood, A. G.; Jones, C. G.; Sawmy, S.; Cole, R.; Edmunds, K.; Bell, D. J. (2008): Causes of mortality in free-living Mauritian pink pigeons Columba mayeri, 2002–2006. Endangered Species Research.
Cabanis, J. (1847): Ornithologische Notizen. II. Archiv für Naturgeschichte. Berlin. 13 (1): 308–352.
Cade, TJ, Maclean, GL (1967): Transport of Water by Adult Sandgrouse to Their Young. The Condor 69(4), S. 323–343.
Callaghan, C.T., Nakagawa, S., Cornwell, W.K. (2021): Global abundance estimates for 9,700 bird species. Proceedings of the National Academy of Sciences. 118 (21), e2023170118
Cheke, A. S.; Hume, J. P. (2008): Lost Land of the Dodo: an Ecological History of Mauritius, Réunion & Rodrigues. New Haven and London: T. & A. D. Poyser.
Chen, A., Field, D. J. (2020): Phylogenetic definitions for Caprimulgimorphae (Aves) and majorconstituent clades under the International Code of PhylogeneticNomenclature. Vertebrate Zoology 70(4):571-585
Chen, A., White, N. D., Benson, R. B. J., Braun, M. J., Field, D. J. (2019): Total-Evidence Framework Reveals Complex Morphological Evolution in Nightbirds (Strisores). Diversity. 11(9); 143.
Cleere; et al. (2007): A new genus of frogmouth (Podargidae) from the Solomon Islands – results from a taxonomic review of Podargus ocellatus inexpectatus Hartert 1901. Ibis. 149 (2): 271–286.
Costa, T. V. V.; Silveira, L. F.; Posso, S. R.; Donatelli, R.J. (2021): Phylogenetic analysis of the nocturnal avian family Nyctibiidae (Caprimulgiformes) inferred from osteological characters. Zoologischer Anzeiger.
Gerald Mayr (2005). The Palaeogene Old World potoo Paraprefica Mayr, 1999 (Aves, Nyctibiidae): its osteology and affinities to the New World Preficinae Olson, 1987. Journal of Systematic Palaeontology, 3, 359 – 370. doi: 10.1017/S1477201905001653
Davis, W.L. (1939): The Composition of the Crop Milk of Pigeons. Biochem. J. 33 (6): 898–901.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliot, A.; Sargatal, J., eds. (1997): Handbook of the Birds of the World Volume 4: Sandgrouse to Cuckoos. Lynx Editions.
Del Hoyo, J.; Elliot, A.; Sargatal, J., eds. (1999): Handbook of the Birds of the World. Volume 5: Barn-owls to Hummingbirds. Lynx Edicions.
Dumbacher, J. P. ; Pratt, T. K., Fleischer, R. C. (2003): Phylogeny of the owlet-nightjars (Aves: Aegothelidae) based on mitochondrial DNA sequence. Mol. Phylogenet. Evol. 29(3): 540–549.
Edmunds, K.; Bunbury, N.; Sawmy, S.; Jones, C.G.; Bell, D.J. (2008): Restoring avian island endemics: use of supplementary food by the endangered Pink Pigeon (Columba mayeri). Emu. 108 (1): 74–80.
Ericson, P. G. P., et al. (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters 22: 543–547.
Fuller, E. (2014): The Passenger Pigeon. Princeton and Oxford: Princeton University Press.
Gillespie, M. J.; Stanley, D.; Chen, H.; Donald, J. A.; Nicholas, K. R.; Moore, R. J.; Crowley, T. M. (2012): Functional Similarities between Pigeon ‘Milk’ and Mammalian Milk: Induction of Immune Gene Expression and Modification of the Microbiota. PLOS ONE. 7 (10): e48363.
Hackett, S. J. et al. (2008): A phylogenomic study of birds reveals their evolutionary history. Science 320: 1763–1768.
Han, K.-L-., Robbins, M. B., Braun, M. J. (2010): A multi-gene estimate of phylogeny in the nightjars and nighthawks (Caprimulgidae). Molecular Phylogenetics and Evolution 55 (2), S. 443–453.
Horblit, H.; Stadler, L.; Martínez-Gómez, J.E (2006): The Socorro Dove as a flagship species for the restoration of the Revillagigedo Archipelago, México. Wings Without Borders: IV North American Ornithological Conference. Veracruz, Mexico: American Ornithologists: 149.
Hume, J. P. (2012): The Dodo: From extinction to the fossil record. Geology Today. 28 (4): 147–151.
Jarvis, E. D.; et al. (2014): Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 346 (6215): 1320–1331
Johnson, K. P.; Clayton, D. H.; Dumbacher, J. P.; Fleischer, R. C. (2010): The flight of the Passenger Pigeon: phylogenetics and biogeographic history of an extinct species. Molecular Phylogenetics and Evolution. 57 (1): 455–8.
Kuhl, H. et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38: 108–127.
Martin, G., Rojas, L. M., Ramírez, Y., McNeil, R. (2004): The eyes of oilbirds (Steatornis caripensis): pushing at the limits of sensitivity. Naturwissenschaften 91(1), S. 26–29.
Mayr, G. (1999): The Palaeogene Old World Potoo Paraprefica Mayr, 1999 (Aves, Nyctibiidae): its osteology and affinities to the New World Preficinae. Journal of Systematic Palaeontology 3(4), S. 359–370.
Mayr, G (2002): Osteological evidence for paraphyly of the avian order Caprimulgiformes (nightjars and allies). Journal für Ornithologie. 143 (1): 82–97.
Mayr, G. (2009): Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G. (2009a): Phylogenetic relationships of the paraphyletic of caprimulgiform birds (nightjars and allies). Journal Zoological Systematics Evolutionary Research. doi: 10.1111/j.1439-0469.2009.00552.x
Mayr, G. (2014): The origins of crown group birds: molecules and fossils. Palaeontology 57: 231–242.
Mayr, G. (2015a): A reassessment of Eocene parrotlike fossils indicates a previously undetected radiation of zygodactyl stem group representatives of passerines (Passeriformes). Zoologica Scripta 44, 587–602.
Mayr, G. (2015b): Eocene fossils and the early evolution of frogmouths (Podargiformes): Further specimens of Masillapodargus and a comparison with Fluvioviridavis. Palaeobiodiversity and Palaeoenvironments 95, 587–596.
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G., Daniels, M. (2001): A new short-legged landbird from the early Eocene of Wyoming and contemporaneous European sites. In: Acta Palaeontologica Polonica 43 (3), S. 393–402.
Mourer-Chauviré C., (1993): Les gangas (Aves, Columbiformes, Pteroclidae) du Paléocène et du Miocène inférieur de France. Palaeovertebrata 22 (2-3): 73-98.
Nesbitt, S. J.; Ksepka, D. T.; Clarke, J. A. (2011): Podargiform Affinities of the Enigmatic Fluvioviridavis platyrhamphus and the Early Diversification of Strisores (“Caprimulgiformes” + Apodiformes). PLoS ONE. 6 (11): e26350.
Olson, S. L. (1987): An early Eocene oilbird from the Green River formation of Wyoming (Caprimulfiformes: Steatornithidae). Documents des Laboratoires de Géologie de Lyon 99, S. 57–69.
Ortiz-Alcaraz, A.; et al. (2017): Ecological restoration of Socorro Island, Revillagigedo urchipelago, Mexico: the eradication of feral sheep and cats. Occasional Paper of the IUCN Species Survival Commission. 2019 (62): 267–273.
Parish, J. C. (2013): The Dodo and the Solitaire: A Natural History. Bloomington (US): Indiana University Press.
Prum, R. O. et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Rich, P.V., McEvey, A. (1977): A new owlet-nightjar from the early to mid-Miocene of eastern New South Wales. Memoirs of the National Museum of Victoria 38, 247–253.
Rijsdijk, K. F. et al. (2009): Mid-Holocene vertebrate bone Concentration-Lagerstätte on oceanic island Mauritius provides a window into the ecosystem of the dodo (Raphus cucullatus). Quaternary Science Reviews 28 (1–2), S. 14–24.
Rojas, L. M., Ramírez, Y., McNeil, R., Mitchell, M., Marín, G. (2004): Retinal Morphology and Electrophysiology of Two Caprimulgiformes Birds: The Cave-Living and Nocturnal Oilbird (Steatornis caripensis), and the Crepuscularly and Nocturnally Foraging Common Pauraque (Nyctidromus albicollis). Brain, Behavior and Evolution 64(1), S. 19–33.
Schmechel, R. (2006): Socorro Dove – Zenaida graysoni. WAZA : World Association of Zoos and Aquariums.
Schorger, A. W. (1955): The Passenger Pigeon: Its Natural History and Extinction. Madison, WI: University of Wisconsin Press.
Shapiro, B.; Sibthorpe, D.; Rambaut, A.; Austin, J.; Wragg, G. M.; Bininda-Emonds, O. R. P.; Lee, P. L. M.; Cooper, A. (2002): Flight of the Dodo. Science. 295 (5560): 1683.
Sibley, C. G.; Alquist, J. E.; Monroe Jr., B. L. (1988): A Classification of the Living Birds of the World Based on Dna-Dna Hybridization Studies. The Auk. 105 (3): 409–423.
Sigurðsson, S., Cracraft, J. (2014): Deciphering the diversity and history of New World nightjars (Aves: Caprimulgidae) using molecular phylogenetics, Zool. J. Linn. Soc. 170, 506-545.
Silver, R. (1984): Prolactin and Parenting in the Pigeon Family. The Journal of Experimental Zoology. 232 (3): 617–625.
Stiller, J. et al. (2024): Complexity of avian evolution revealed by family-level genomes. Nature 629, 851–860. https://doi.org/10.1038/s41586-024-07323-1
Tatayah, V. (2021): Nesoenas mayeri (Green Status assessment). IUCN Red List of Threatened Species. 2021: e.T22690392A2269039220213.
Tuijn, P. (1969): Notes on the extinct pigeon from Mauritius, Alectroenas nitidissima (Scopoli, 1786). Beaufortia. 16 (218): 163–170.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a): Mesites (Mesitornithidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.mesito1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b): Sandgrouse (Pteroclidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.pteroc1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c): Pigeons and Doves (Columbidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.columb2.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d): Nightjars and Allies (Caprimulgidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.caprim2.02
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020e): Oilbird (Steatornithidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.steato1.02
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020f): Potoos (Nyctibiidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.nyctib1.02
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020g): Frogmouths (Podargidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.podarg1.02
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020h): Owlet-nightjars (Aegothelidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.aegoth1.02
Worthy, T.H., Tennyson, A.J.D., Jones, C., McNamara, J.A., Douglas, B.J. (2007): Miocene waterfowl and other birds from central Otago, New Zealand. Journal of Systematic Palaeontology 5, 1–39.
Young, M. T. et al. (2024): The systematics and nomenclature of the Dodo and the Solitaire (Aves: Columbidae), and an overview of columbid family-group nomina. Zoological Journal of the Linnean Society 201 (4), zlae086, doi: 10.1093/zoolinnean/zlae086



