Es herrscht wohl um kaum ein Hormon ein größerer Mythos oder gar ein Kult als um Testosteron. Es ist das Männlichkeitshormon schlecht hin und erfülle aller erdenklichen Aufgaben, die den Mann zum Mann machen. Diese Sichtweisen werden beispielsweise in Joe Herberts Buch „Testosterone: Sex, Power, and the Will to Win“ (HERBERT 2015) anschaulich dargestellt. HERBERT (2015) erklärt, dass die „typisch männlichen“ Eigenschaften (Sex, Macht, Gewinnstreben) sich im Testosteron widerspiegeln und ohne dieses nette Hormon gäbe es gar keine menschliche Geschichte. Also zusammengefasst: Die Geschichte sei gar keine Geschichte von Klassenkämpfern, sondern von Hormontitern. Nicht anders sieht es bei KUTSCHERA (2018) aus. Für Kutschera sind “[d]ie Jungen (…) mehrheitlich aktiv-aggressiv-autoritätsverachtend-selbstbestimmt (…) die Mädchen hingegen sind brav und angepasst“ (KUTSCHERA 2018: S. 23). Eine entscheidende Rolle spiele hierbei das „Männlichkeitshormon“ Testosteron. Männer, die meinen sich um den Nachwuchs zu kümmern und daher Elternzeit nehmen, anstatt es den Frauen zu überlassen, sind für Kutschera unnatürlich und es widerspreche dem Testosterongehalt der Männer. Testosteron mache Männer unfähig für die Kindererziehung, da sie mit „Babys überhaupt nichts anfangen können, bzw. gestresst-aggressiv auf deren Hilferufe reagieren.“ Infantizid (Kindstötung) sei in der Evolution des Menschen ein natürlicher Auslesefaktor gewesen. Die ideologische „Gleichschaltung“, die die armen kinderhassenden Testosteronwesen namens Männer dazu zwinge sich um Kinder zu kümmern, werden dann noch von den „Genderisten“ schamlos als „Rabenväter“ bezeichnet. Dabei sollen Männer schlicht und einfach das Brot erwerben, was sie ja schon über Jahrmillionen gemacht haben und dieses „altruistisch“ mit Frau und Kind teilen (KUTSCHERA 2018, S. 27). Es bleibt offen, ob Kutschera hier allgemein wissenschaftliche Fakten erzählt oder seinen Erziehungsstil hier versucht „wissenschaftlich“ zu verteidigen.
Wir haben schon in unserer dreiteiligen über das Gehirn (Teil 1, Teil 2, Teil 3) dargelegt, dass man solchen Behauptungen mit äußerster Vorsicht begegnen muss. Wir zitieren hier nochmal den Neurobiologen BECK (2014):
„Der Mythos vom weiblichen und männlichen Gehirn ist das Paradebeispiel für die Entwicklung eines Neuromythos. Hier kommt alles zusammen, was man für eine zukünftige Hirnlegende braucht: wissenschaftliche Untersuchungen, die Unterschiede in den Gehirnen von Männern und Frauen zeigen, ein Thema, bei dem jeder mitreden will, viel Halbwissen und Klischees – und (nicht zu vergessen) die prima Möglichkeit, diesen Mischmasch aus Wissenschaft, Vorurteilen und persönlicher Meinung auch gut verkaufen zu können.“ (BECK 2014 S. 83-84)
Außerdem warnt er davor in eine “Steinzeit-Falle” zu geraten:
“Passen Sie besonders auf, wenn Geschlechterrollen evolutionär begründet und anschließend mit vermeintlichen Neuro-Argumenten vermischt werden. (…) Sie können nämlich alles mit evolutionären Scheinargumenten ‘begründen’, dabei ist es nur äußerst schwer nachzuprüfen, wie denn die Gesellschaftsstruktur vor 50.000 Jahren wirklich ausgesehen hat.” (BECK 2014: S. 89)
Das ist bei der Frage um das Hormon Testosteron nicht anders. Es scheint ein regelrechter Kult um das Männlichkeits-Hormon zu bestehen, sodass Richard Francis die Bezeichnung des „Testosteron Rex“ einführte, um sich über die übertrieben dargestellte Rolle dieses Hormons lustig zu machen (FRANCIS 2004). Es lohnt sich also, hier die gängigen Thesen zu überprüfen.
Einführung in das Hormonsystem
Was ist eigentlich Testosteron? Und was sind Hormone eigentlich überhaupt?
Folgendes schildert das „Lehrbuch der Tierphysiologie“ (PENZLIN 2009):
„Ein Vielzelliger Organismus kann nur existieren, wenn zwischen den Zellen und Geweben ein intensiver Informationsaustausch existiert, durch den die verschiedenen Funktionen wie Stoffwechsel, Wachstum und Differenzierung aufeinander abgestimmt werden. Neben der interzellulären Kommunikation bei direktem Kontakt (…) spielt die Kommunikation mit Hilfe von Signalstoffen (Mediatoren) über eine mehr oder weniger lange Distanz (…) eine hervorragende Rolle.“ (PENZLIN 2009: S. 479).
Hormone sind solche Signalstoffe, die von bestimmten Organen oder Zellen gebildet werden und in ein Zirkulationsmedium (z. B. Blut) abgegeben und im Körper verteilt werden. Die Organe, welche über die Hormone erreicht werden sollen, bezeichnet man als Targetorgane. Diese besitzen Rezeptormoleküle an die die Hormone nach einem Schlüssel-Schloss-Prinzip andocken können. Wenn dies geschieht wird über Signalkaskaden die DNA im Zellkern aktiviert (manche Hormone passieren die Zellmembran und docken direkt an die DNA an) und die entsprechenden Proteine gebildet. Hormone steuern vielfältige Prozesse: Stoffwechsel, Wasserhaushalt, Entwicklung, Fortpflanzung und das Verhalten. Chemisch kann man sie in mehrere Klassen einteilen. Zum einen gibt es sogenannte Peptidhormone, hierbei handelt es sich um Proteine, die als Hormone fungieren; z. B. gehört das Hormon Insulin zu den Peptidhormonen. Zum anderen gibt es Derivate von Aminosäuren, die also aus einzelnen Aminosäuren wie Phenylalanin oder Thyroxin gebildet werden. Schilddrüsenhormone und Adrenalin gehören zu dieser Hormonklasse. Die Sexualhormone – Testosteron, Östrogen etc. – gehören zu den Steroidhormonen. Steroide sind eine Stoffklasse der Lipide („Fette“). Neben den Sexualhormonen gehören übrigens auch das Cholesterin und Vitamin D zu Steroidderivaten.
Das Hormonsystem sowie die Hormonregulation der Wirbeltiere sind hierarchisch aufgebaut (Abb. 1). Die „Zentrale“ des Hormonsystems ist der Hypothalamus. Dieser ist Bestandteil des Zwischenhirns und ist mit der Hypophyse verbunden. Erhält die Hypophyse vom Hypothalamus entsprechende Signale, werden von der Hypophyse Hormone ausgeschüttet, die die entsprechenden Hormondrüsen (z. B. Hoden, Ovarien, Nebennierenrinde, Bauchspeicheldrüse, Schilddrüse) erreichen, die wiederrum ihre spezifischen Hormone (z. B. Testosteron, Östrogen, Corticoide, Insulin, Thyroxin) ins Blut abgeben. Das Hormonsystem verfügt über einen Rückkopplungsmechanismus, dass wenn z. B. genügend Testosteron produziert wurde, chemische Botenstoffe zurück zum Hypothalamus befördert werden, welche die Stimulation der Hypophyse hemmen. Der Hypothalamus steht natürlich unter Kontrolle des Gehirns und seine Aktivität steht im Zusammenhang mit genetischen Faktoren wie Umweltfaktoren.
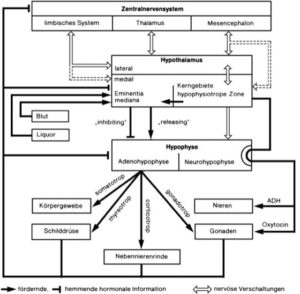
Abb. 1: Rückkopplungsmechanismus des Hormonsystems
Testosteron ist ein Sexualhormon, das zu den Androgenen zählt. Androgene sind jene Steroid-Hormone, die bei der Differenzierung der männlichen Geschlechtsorgane und der sekundären männlichen Geschlechtsmerkmale (Bartwuchs, Muskelwachstum etc.) beteiligt sind. Neben Testosteron gehören auch Dehydroepiandrosteron (DHEA), Androstendion und Dihydrotestosteron (DHT) zu den Androgenen. Bei Männern werden die Androgene in den Leydig-Zellen der Hoden und in der Nebennierenrinde gebildet. Androgene sind aber keineswegs rein männlich; auch Frauen produzieren in den Eierstöcken und der Nebennierenrinde Androgene, wenn auch in deutlich geringeren Mengen.
Estrogene, wie Östrogen und Gestagene, wie Progesteron, sind die weiblichen Sexualhormone. Sie werden in den Eierstöcken gebildet, aber auch in der Nebennierenrinde. In letzterer werden die weiblichen Sexualhormone auch bei Männern produziert, jedoch in geringerer Konzentration. Gestagene wie Progesteron sind auch Ausgangssubstanzen von Cortcoiden, Hormonen der Nebennierenrinde, die für die Regulation verschiedener Stoffwechselreaktionen notwendig sind. Außerdem kann durch das Enzym Aromatase aus Androgenen Estrogene gebildet werden. Ein entscheidender Aspekt ist also: sowohl Männer als auch Frauen produzieren Testosteron, jedoch in unterschiedlichen Konzentrationen. Bei Frauen entsteht ein Teil des Testosterons durch Umwandlung von Androstendion und Dehydroepiandrosteron in peripheren Geweben. Zusätzlich wird es in den Ovarien produziert. In erster Linie ist Testosteron bei Frauen für die Estradiolsynthese von Bedeutung. Durch eine Aromatase wird Testosteron in Estradiol umgesetzt. Estradiol ist einer der wichtigsten Vertreter der weiblichen Sexualhormone (Estragene). (REED, BOU NEMER, CARR 2016, AKTORIES et al. 2005, PENZLIN 2009). Abb. 2 liefert einen Überblick über die komplexen Synthesewege der Sexualhormone. FEDERMANN (2006) und JOHNSON (2013) können zeigen, dass ab der Pubertät die Hoden eines Mannes täglich 7000 µg Testosteron produzieren, davon wird 1% in Estrogene umgewandelt (70µg). Weibliche Ovarien produzieren hingegen nur 300 µg Testosteron pro Tag, wovon die Hälfte in Estrogene umgewandelt wird. Die Konzentration schwankt natürlich individuell, mit dem Alter und abhängig von Tageszeiten oder sonstigen Faktoren. Aber selbst bei weiblichen Spitzensportlerinnen ist der Testosterongehalt im Blut geringer als bei Männern (KARKAZIS & JORDAN-YOUNG 2015).
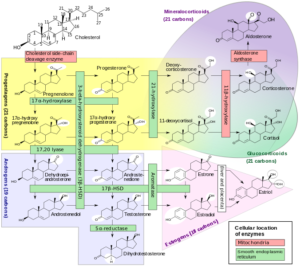
Abb. 2: Synthese der Sexualhormone aus Steroiden wie Cholesterol. Gelb: Gestagene, blau: Androgene, Rosa: Estrogene. Mineralo- und Glucocorticoide sind keine Sexualhormone, sondern Hormone der Nebennierenrinde, die aus dem Progesteron gebildet werden.
Funktion der Sexualhormone
Welche Aufgaben erfüllt nun das Testosteron? Wie in Teil 3 (Aktenzeichen XY … gelöst) schon dargestellt, wird das Testosteron in den u. a. Leydig-Zellen im Hoden produziert und „vermännlichen“ den Fötus. Doch darin erschöpft sich keineswegs die Funktion von Testosteron (oder anderen Sexualhormonen). Testosteron selbst übt einige wichtige Funktionen im weiblichen Körper aus: So finden sich Androgenrezeptoren in einer Vielzahl von Organen, u. a. Brust, Gehirn, Knochen, Muskeln, Fettgewebe, Leber und Haut (ELRAIYAH et al. 2014). Testosteron stimuliert geschlechtsunspezifisch den Aufbau der Muskulatur (JONES 2009) und fördert die Bildung roter Blutkörperchen (Erythrozyten) sowie den Knochenaufbau (NIESCHLAG, BEHRE & NIESCHLAG 2010).
Testosteron verändert den Körper auf vielfältige Weise, was bei verschiedenen Tierarten zu unterschiedlichen Ergebnissen führt. Dabei wirkt das Testosteron auch auf das Gehirn. Bei Männern dringt Testosteron ins Gehirn ein und verändert dort die Aktivität von Zellen – aber nur, wenn es im Hirngewebe zu Östrogen umgewandelt wird, kann es biologisch wirksam sein. Was den Mann also tatsächlich zum Mann macht ist das weibliche Geschlechtshormon (BECK 2014: S. 93). Testosteron bindet an einen Androgenrezeptor und „wandert“ in den Zellkern der Zelle und aktiviert, zusammen mit weiteren Co-Faktoren, entsprechende Gene, die die gewünschten Proteine bilden. Mithilfe des Enzyms Aromatase kann Testosteron in Östrogene umgewandelt werden (vgl. Abb. 3A). Wenn die Östrogenrezeptoren bei Mäusen ausgeschaltet wurden, ist das männliche Sexualverhalten vollständig verloren gegangen (OGAWA et al. 2000; KUDWA et al. 2005). So übt Testosteron bei Nagern seine Wirkung auf das Nervensystem aus, indem es im Gehirn in Estradiol umgewandelt wird.
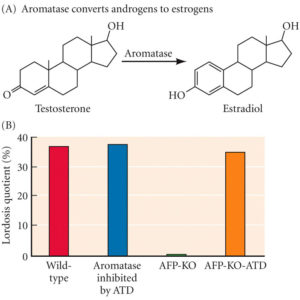
Abb. 3: Organisation der Gehirnentwicklung durch Hormone. (A) Das Enzym Aromatase wandelt Androgene (wie Testosteron) in Östrogene (wie Östradiol) um. (B) Das Verhalten der weiblichen Lordose (bei dem die weibliche Maus ihre Wirbelsäule biegt, damit sich das männliche Tier leicht mit ihr paaren kann) bleibt bei Mäusen, denen der Aromatasehemmer ATD verabreicht wird, erhalten. Das Verhalten wird aufgehoben, wenn die Gene für α-Fetoprotein ausgeschaltet werden (AFP-KO). Wenn jedoch Aromatase in weiblichen Mäusen ohne α-Fetoprotein (AFP-KO-ATD) blockiert wird, wird das Lordoseverhalten wiederhergestellt. (Nach Bakker und Baum 2008.)
Es ist bekannt, dass verschiedene Bereiche des Gehirns von Säugetieren an geschlechtsspezifischen Verhaltensweisen beteiligt sind, und es wird angenommen, dass diese Gehirnregionen durch Sexualhormone reguliert werden. Die zyklische Ausschüttung von Luteinisierungshormon (beteiligt am Eisprung) durch die Hypophyse bei erwachsenen weiblichen Ratten hängt von einem Testosteronmangel in der ersten Lebenswoche des Tieres ab. Die Sekretion dieses Hormons weiblicher Ratten kann nichtzyklisch werden, indem sie 4 Tage nach der Geburt Testosteron erhalten. Umgekehrt kann die Sekretion dieses Hormons bei männlichen Ratten durch Entfernung der Hoden zyklisch werden (BARRACLOUGH & GORSKI 1962).
Das fetale Milieu ist jedoch reich an Östrogenen aus Gonaden und Plazenta. Was hindert diese Östrogene daran, das Nervensystem eines weiblichen Fötus zu maskulinisieren? Sowohl bei männlichen als auch bei weiblichen Ratten wird fötales Östrogen durch α-Fetoprotein gebunden, das Östrogen bindet und inaktiviert, nicht jedoch Testosteron. Die Beziehungen zwischen Östradiol, Aromatase und α-Fetoprotein wurden analysiert, indem sexuelles Verhalten bei Mäusen beobachtet wurde, die Mutationen mit Funktionsverlust für Aromatase und α-Fetoprotein aufweisen. Das Gehirn und das Verhalten von Mäusen, denen α-Fetoprotein fehlt, wurden defeminisiert, was zeigt, dass α-Fetoprotein die Aufnahme von zirkulierenden Östrogenen durch das weibliche Gehirn verhindert.
In der Tat sind weibliche Mäuse, deren α-Fetoprotein-Gene ausgeschaltet wurden, steril, weil die den Eisprung steuernden Hirngene (wie jene für das Gonadotropin freisetzende Hormon) herunterreguliert sind. Dieser Mangel an Ovulation kann jedoch rückgängig gemacht werden (und das normale weibliche Muster der Genexpression kann festgestellt werden), wenn solchen Mäusen auch Arzneimittel verabreicht werden, die die Aromatase blockieren. In ähnlicher Weise ist das Ausmaß der Lordose (eine von weiblichen Nagetieren eingenommene Pendelhaltung, die es männlichen Tieren ermöglicht, sich mit ihnen zu paaren) bei weiblichen Mäusen, denen funktionelle α-Fetoprotein-Gene fehlen, nahezu vollständig aufgehoben. Auch dieses Verhalten kann wiederhergestellt werden, indem die Mäuse vor der Geburt mit Aromataseinhibitoren behandelt werden (Abb. 3B; BAKKER et al. 2006; DE MEES et al. 2006; BAKKER & BAUM 2008).
Während der pränatale Mangel an Östrogen und Testosteron für die Bildung weiblicher Gehirne entscheidend sein kann, kann die Feminisierung des Gehirns von Nagetieren nach der Geburt Östrogene erfordern. Dies wird durch die Verhaltensphänotypen von Mäusen nahegelegt, deren Aromatasegene ausgeschaltet wurden. Ihr weibliches spezifisches Verhalten (z. B. Lordose; die Fähigkeit, männliche Pheromone zu unterscheiden) ist ebenfalls beeinträchtigt (BAKKER & BAUM 2008).
Spannend wird es hier, dass Östrogene nicht unbedingt Testosteron als ursprungsquelle haben müssen, ja noch nicht mal die Gonaden. Man fand heraus, dass das Gehirn seine eigenen Östrogene bilden kann (ADKINS-REGAN 2005). Früher ging man davon aus, dass die Sexhormone (Testosteron, Östrogen) auch die Entwicklung des Gehirns beeinflussen, diese also vermännlichen oder verweiblichen. Das ist durchaus richtig, aber man konnte beispielsweise in Mäusen über 50 Gene nachweisen, die bei Männchen und Weibchen unterschiedlich aktiviert werden und zwar bevor sich die Keimdrüsen entwickeln. Selbst das SRY-Gen konnte im Gehirn nachgewiesen werden (GILBERT 2006: S. 541).
Die Differenzierung der Geschlechter beginnt auch bei Fischen im Gehirn, bevor sich die Keimdrüsen entwickeln. Beide, Gehirn und Keimdrüsen, produzieren beide Varianten des für die Geschlechtsdetermination wichtigen Enzyms Aromatase, aber ihre Aktivierung erfolgt zuerst im Gehirn und ist dort teilweise größer (VIZZIANO-CANTONNET et al. 2011). Auch bei Hühner-Embryonen beginnt die sexuelle Differenzierung zuerst im Gehirn und diese sexuelle Differenzierung des Gehirns hat Einfluss auf die weitere Entwicklung (SCHOLZ et al. 2006, AGATE et al. 2003, LEE et al. 2009).
Ein großer Unterschied zwischen männlichen und weiblichen Finken besteht darin, dass große Bereiche des männlichen Gehirns der Erzeugung von Gesängen gewidmet sind. Männliche Finken singen; die Weibchen nicht. Während Testosteron für die Bildung der Gesangszentren in Finken wichtig ist (und, wenn es experimentell hinzugefügt wird, weibliche Vögel zum Singen bringen kann), verhindert das Blockieren dieser Hormone bei Männchen nicht die normale Entwicklung der Gesangszentren oder das Singen. Genetisch männliche Vögel bilden diese Hirnregionen auch ohne männliche Hormone (MATHEWS & ARNOLD 1990).
Ein natürliches Experiment zeigte sich in Form eines Vogels, der halb männlich und halb weiblich war und in der Mitte geteilt war (Abb. 4). Solche Tiere, bei denen einige Körperteile männlich und andere weiblich sind, werden Gynandromorphe genannt (griechische Gynos, „weiblich“; Andros, „männlich“; Morphos, „Form“). Wir haben uns mit diesem Phänomen in Teil drei beschäftigt. AGATE et al. (2002) zeigten, dass der gynandromorphe Fink ZZ (männliche) Geschlechtschromosomen auf der rechten Seite und ZW (weibliche) Geschlechtschromosomen auf der linken Seite hatte. Seine Hoden produzierten Testosteron, und der Vogel sang wie ein Männchen und kopulierte mit Weibchen. Obwohl viele Hirnstrukturen auf beiden Seiten ähnlich waren, unterschieden sich einige Hirnregionen zwischen der männlichen und der weiblichen Hälfte. Die Gesang-Schaltkreise auf der rechten Seite hatten einen männlicheren Phänotyp als ähnliche Strukturen auf der linken Seite, was zeigt, dass sowohl intrinsische als auch hormonelle Einflüsse wichtig waren.

Abb. 4: Gynandromorpher Fink mit ZZ-Zellen (männlich) auf der rechten Seite und ZW-Zellen (weiblich) auf der linken Seite. Da das Gefieder durch Gene auf den Geschlechtschromosomen kontrolliert wird, hat der erwachsene Fink ein männliches Gefieder rechts und ein weibliches Gefieder links. Mikroskopische Aufnahmen zeigen den Unterschied in den Hirnregionen zwischen der rechten und der linken Seite, was durch Färbung der Neuronen des HVC-Kerns (ein Neuronencluster, der an der Produktion von Vogelliedern beteiligt ist) angezeigt wird. (Aus AGATE et al. 2002.)
Solche Effekte können jedoch bei Vögeln (und anderen Tieren) auch kompensiert werden (De VRIES 2004). Bei einer afrikanischen Webervogelart ist die Hirnregion, die für den Gesang verantwortlich ist, bei den Männchen wesentlich größer als bei den Weibchen. Aber bei dieser Art singen sowohl Männchen als auch Weibchen. Wie kommt es, dass hier die Weibchen den gleichen Gesang zwitschern können, obwohl die entsprechende Gehirnregion bei den Männchen wesentlich größer ist? Die Antwort: bei den Weibchen werden die Gene, die für den Gesang notwendig sind (wichtige Gehirnproteine) wesentlich häufiger abgelesen (exprimiert) als bei den Männchen (GAHR et al. 1998).
Genetische, hormonelle und Umwelteinflüsse spielen alle bei der Erzeugung sexuellen Verhaltens eine Rolle (McCARTHY & ARNOLD 2011; NGUN et al. 2011).
Wie sehr auch das Hormonsystem im Tierreich, gerade in Bezug zum Testosteron variabel ist, sollen einige Beispiele demonstrieren.
Eine Buntbarschart aus Afrika, Haplochromis burtoni hat territoriale und nicht-territoriale Männchen. Territoriale Männchen, die ein Brutgebiet kontrollieren sind farblich anders gemustert und verbringen viel Zeit damit ihr Territorium zu verteidigen und Weibchen zu begatten. Sie haben größere Hoden und einen höheren Testosteronspiegel als nicht-territoriale Männchen. Aber selbst hier spielt Testosteron nicht si über-dominante Rolle wie man vermuten könnte. Denn selbst kastrierte territoriale Männchen, die durch den Akt der Kastration ihren Testosteronspiegel senken, sind immer noch im Verhalten dominant und vertreiben die nicht-territorialen Männchen, auch wenn sie nicht mehr so aggressiv sind (FRANCIS et al. 1992). Wenn man ein territoriales Männchen in der Rangfolge abstufen möchte, ist keine Kastration notwendig, sondern das Vorhandensein eines größeren territorialen Männchens. Innerhalb weniger Tage ändert dann das kleinere territoriale Männchen seine Färbung, Größe und Hodengröße ändern. Führt man dagegen ein nicht-territoriales Männchen in ein gebiet ohne territoriale Männchen, vergrößert er seine Hoden und wird zum territorialen Männchen (FRANCIS et al. 1993). Es sind also im Wesentlichen die sozialen Einflüsse, die den Hormonspiegel und damit die soziale Dominanz bei Buntbarschen steuern (vgl. OLIVEIRA et al. 1996). Ein anderes Beispiel stammt von Zwerg-Meerkatzen (Gattung Miopithecus), einer Gattung kleiner Affenarten aus dem Kongo-Gebiet. In einer Versuchsgruppe mit kastrierten und nicht-kastrierten Männchen wurden die kastrierten Exemplare mit Testosteron behandelt und untersucht welchen Einfluss Testosteron auf den sozialen Status der Affen hatte. Obwohl diese sich dadurch aggressiver verhielten, konnten sie ihren sozialen Status nicht erhöhen und übten die Aggression lediglich an rangniederen Männchen aus. Die Testosteronbehandlung hatte keinen Einfluss auf Änderungen im Rangordnungssystem (DIXON & HERBERT 1979).
Während bei Ratten und anderen Säugetieren Testosteron notwendig ist, damit die Tiere kopulieren können (z. B. damit die Männchen eine Erektion kriegen), besteht dieser Zusammenhang bei Primaten nicht. Ein erhöhter Testosteronspiegel sorgt zwar für eine erhöhte Bereitschaft zur Kopulation, bedingt diese aber nicht. Dies konnte WALLEN (2001) in einem Versuch mit Rhesus-Affen nachweisen, indem sie das Sexualverhalten der Männchen untersuchte, als diese eine Testosteron-unterdrückende Behandlung erhalten haben. Diese Behandlung hatte bei Männchen, die in Gruppen lebten, in dem andere Männchen vorkamen, einen größeren Effekt auf ihr Sexualverhalten, als in Gruppen, wo es nur ein Männchen gab. Dies lag offensichtlich am Konkurrenzverhalten der Männchen um Sexualpartner. Aber selbst in den Gruppen, wo es viele Männchen gab, hatte die Unterdrückung des Testosterons nicht immer zu einer Unterdrückung des Sexualverhaltens geführt. Während bei rang-niederen Männchen das Sexualverhalten nachließ, zeigte die Testosteron-Unterdrückung bei ranghohen Männchen keine Wirkung.
Sexualhormone und Mensch
Bei all diesen Aspekten sollte jedoch bedacht werden, dass aus Experimenten an Ratten oder Vögeln keine allgemeinen Schlussfolgerungen für menschliches Sexualverhalten gezogen werden sollten. Hormone verursachen nämlich kein Verhalten, sondern machen bestimmte Verhaltensweisen nur wahrscheinlicher. ADKINS-REGAN erklärt:
„Hormone sind eine der vielen Faktoren, die die Entscheidungen des Nervensystems beeinflussen. Sie mögen die Schwellenwerte der anderen Faktoren beeinflussen, die in die Entscheidungen miteinfließen (…) sie sind aber normalerweise nicht der einzige auslösende Wirkstoff.“
WADE (2013: S. 284) kommentiert:
„Hormone sind daher nicht ein Teil eines biologischen Programms, die uns darin beeinflussen die das Verlangen unserer Vorfahren ausleben. Sie sind ein dynamischer Teil unserer Biologie, dafür geschaffen auf die physikalische, soziale und kulturelle Umwelt zu reagieren.“
HINES (2004, S. 82) hebt hervor, dass ein Penis ein Penis ist und sowohl bei männlichen Ratten wie auch bei Männern dieselbe Funktion hat. Ein Nagerhirn lässt sich jedoch schon alleine wegen der Relation der Gehirngröße zur Körpermasse, sowie der Hirnrinde nicht mit dem menschlichen Gehirn vergleichen. Auch haben die Hirnregionen unterschiedliche und beim Menschen auch komplexere Aufgaben und Strukturen (JORDAN-YOUNG 2010, S. 48)
WALLEN (2005) geht davon sogar aus, dass die Daten von Hormonstudien, die man aus Ratten gewonnen hat, wenig darüber Auskunft geben, was tatsächlich beim Menschen vor sich geht. So gibt es Unterschiede wann, wo und wie die Hormone bei Menschen und Ratten wirken. Das gilt übrigens nicht nur für Ratten, sondern natürlich auch für andere Versuchstiere. Anders als bei Tieren sind Hormone bei Menschen weniger relevant für die Determination des Verhaltens aufgrund unserer komplexen Gehirne, wodurch man bei Übertragungen der Ergebnisse von Tierversuchen auf menschliches Verhalten sehr vorsichtig sein sollte (HALPERN 2012, S. 183).
Menschliche Feten beispielsweise bilden kein stark östrogenbindendes Protein und haben einen viel höheren Gehalt an freiem Östrogen als Nagetierembryonen; das α-Fetoprotein, welches die Östrogene bei nagetieren stark bindet (vgl. Abb. 3B), kommt bei Menschen nicht vor (NAGEL & VOM SAAL 2004).
Was wir also in unserem Kapitel über das Gehirn festgestellt haben, gilt natürlich auch für die Hormone und das Steuern des Verhaltens.
Natürlich spielen Hormone auch beim Menschen eine wichtige Rolle. Sexualhormone steuern die Pubertät und sind für die Produktion von Keimzellen von Bedeutung. Folgerichtig spielen Sexualhormone bei Menschen während der Pubertät eine größere Rolle, sind aber – genauso wie Gene oder das Gehirn – nicht als allmächtige „Diktatoren“ am Werk.
Die Unterschiede in der Konzentration der Sexualhormone haben auch zur Folge, dass die Fertilität, also die Fruchtbarkeit der Geschlechter unterschiedlich ausfällt. Männer sind theoretisch gesehen bis ins hohe Alter reproduktionsfähig, da täglich Spermien gebildet werden. Bei Frauen hingegen ist die Fertilität geringer, sie kommen früher in die Wechseljahre und haben einen Menstruationszyklus, sodass ihre Fruchtbarkeit auch innerhalb eines Monats wechselt. Der Hypothalamus und die Hypophyse spielen bei der Regulation der Keimzellenproduktion und des weiblichen Zyklus eine entscheidende Rolle (FEDERMANN 2006, JOHNSON 2013, KUTSCHERA 2018, S. 210-212). Abb. 5 zeigt den Einfluss der Hormone auf den weiblichen Zyklus.
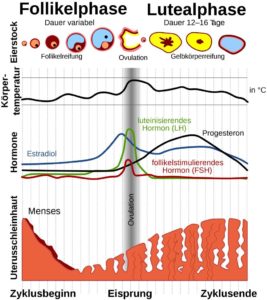
Abb. 5: weiblicher Zyklus und der Einfluss der Hormone
In den Eierstöcken sammeln sich die Eizellen (weibliche Keimzellen, haploid), in den äußeren Bereich und sind von den Körperzellen des Eierstocks umgeben, sie sich zu den Granulosa-Zellen entwickeln. Weitere Zellen des Eierstocks differenzieren sich zu den Theca-Zellen, die zusammen mit den Granulosa-Zellen das Follikel bilden, die jede Eizelle umhüllen und die weiblichen Sexualhormone bilden.
Der Ovarialzyklus besteht aus der Follikelphase (Reifung des Follikels und der Eizelle bis zum Eisprung = Ovulation), der Ovulationsphase (Eisprung) und der Gelbkörperphase (nach dem Eisprung, bei dem der Follikel zum Gelbkörper = Corpus luteum umgewandelt wird). Der Zyklus dauert 28 Tage, sofern keine Befruchtung erfolgt.
Die Follikelphase beginnt damit, dass durch die Degeneration des Gelbkörpers der Spiegel des Follikel-Stimulierenden Hormons (FSH), eines Hormons der Hypophyse, ansteigt. Dies sorgt für das Wachstum des größten Follikels und induziert in den Granulosa-Zellen die Synthese eines Enzyms, das unter dem Einfluss des Luteinisierenden Hormons (LH), ebenfalls ein Hypophysenhormon, in den Theca-Zellen Estradiol synthetisiert. Dieser erhöhte Estradiol-Spiegel lässt den Follikel weiter reifen und die Fruchtbarkeit zunehmen. Im Blut hemmt der erhöhte Estradiol-Spiegel die FSH-Freisetzung, wodurch die Heranreifung eines weiteren Follikels verhindert wird. Wir haben es hier mit einem typischen Rückkopplungsmechanismus zu tun. FSH stimuliert die Reifung des Follikels, dessen Hormone (Estrogene) im reifen Follikel dann wieder die FSH-Freisetzung blockieren. Gleichzeitig wird die LH-Ausschüttung vor dem Eisprung gefördert, da so mehr Estrogene gebildet werden. Es kommt zum Eisprung (Ovulation) und die Eizelle tritt in den Eileiter. Die Estradiol-Konzentration fällt etwas ab, während unter Einfluss des LH sich der Follikel zum Gelbkörper (Corpus luteum) umwandelt und beginnt neben Estrogenen auch Progesteron zu bilden und freizusetzen. Dies ist die Gelbkörperphase des Zyklus. Diese Phase endet, wenn keine Befruchtung stattfindet und der Gelbkörper damit degeneriert und somit der Estradiol- und Progesteron-Spiegel abfallen. Das Progesteron bewirkt jedoch vor Ende des Zyklus eine erneute Sekretion des FSH, welches dann einen neuen Zyklus einleitet. Im Uterus befindet sich die Gebärmutterschleimhaut (Endometrium) vor der Ovulationsphase in einer Wachstumsphase, die unter dem Einfluss von Progesteron in die Sekretionsphase übergeht und damit für die Einnistung der Eizelle geeignet ist. Kommt es zur Befruchtung und Einnistung der Eizelle, beginnt die Plazenta (Gewebe an der Gebärmutterwand, das zum embryonalen Organismus gehört, von diesem gebildet wird und von Blutgefäßen der Mutter und des Embryos durchwoben ist) die Sekretion des Hormons Choriongonadotropin, welches die gleiche Wirkung wie LH hat. Dadurch wird die Progesteronbildung im Gelbkörper aufrechterhalten, der deswegen nicht degeneriert (nach PENZLIN 2009, S. 520-521).
Hier kann man sagen, dass in Bezug zur Hormonwirkung, wir den größten Unterschied zwischen Männern und Frauen haben: Männer haben diesen Menstruationszyklus nicht.
Wir haben bereits festgestellt, dass Männer und Frauen alle die gleichen Hormone haben, nur dass es zwischen den Geschlechtern unterschiedliche Konzentrationen dieser Hormone geben kann. Im Zusammenhang mit der Ernährung wissen wir, dass ein Hormon namens Oxytocin bei Frauen nach der Geburt wichtig ist, um das Stillen zu erleichtern und Bindungen zwischen Müttern und Säuglingen herzustellen. Wir wissen auch, dass dieselbe Chemikalie an der Bindung zwischen menschlichen Partnern (und bei vielen Säugetieren) beteiligt ist. Dieses Hormon wurde bei Frauen gut untersucht, bei Männern weniger. Oxytocin wirkt bei Männern und Frauen im Gehirn auf die gleiche Weise. Bei Frauen steht es jedoch auch mit der Milchbildung (Laktation) in Verbindung, so dass dies ein Unterschied zwischen Männern und Frauen in Bezug auf die Oxytocin-Funktion ist. Die Gesamtwirkung von Oxytocin scheint darin zu liegen, soziale Bindung zu vermitteln und zu belohnen, indem es dabei hilft, physiologischen Stress abzubauen, Muskelentspannung zu bewirken und einige neurochemische Belohnungen zu erhalten. Dieser Vorgang funktioniert bei männlichen und weiblichen Menschen auf die gleiche Weise. Je sicherer und positiver sich Menschen in ihren Beziehungen fühlen, desto größer ist der messbare Anstieg des Oxytocins während sozialer Interaktionen. Während dieser Effekt bei beiden Geschlechtern auftritt, deuten einige Studien auf einen größeren Nutzen für die Gesundheit (weniger Stress und andere kardioprotektive Vorteile) durch erhöhte Oxytocinspiegel bei Frauen und / oder eine etwas höhere Empfindlichkeit gegenüber Oxytocin bei Frauen hin (FUENTES 2012: S. 172, vgl. auch SANCHEZ et al. 2009).
Wir wissen, dass Männer im Durchschnitt einen höheren Testosteronspiegel im Blut haben als Frauen, aber es gibt nur sehr wenige Studien, in denen eine Gruppe vergleichbarer Männer und Frauen getestet wird, die zur gleichen Zeit dasselbe tun. Es wird vermutet, dass die Beziehung zwischen Eltern und Testosteron negativ ist: Die Interaktion mit Säuglingen kann den Testosteronspiegel senken. Dies scheint das entgegengesetzte Muster für ein anderes für die Pflege wichtiges Hormon zu sein, Prolaktin. Wenn Mütter stillen und intensiv mit jungen Säuglingen interagieren, ist der Hormonspiegel für Prolaktin hoch und der Testosteronspiegel niedrig. Im Allgemeinen ist der Prolaktinspiegel bei Männern morgens am höchsten (immer noch viel niedriger als bei Frauen) und nimmt tagsüber ab. Wir wissen, dass der Testosteronspiegel bei Männern durch Aktivitätsmuster, Dominanzinteraktionen und aggressive Ereignisse oder Wettbewerbe beeinflusst werden kann. Jüngste Forschungen untersuchten den Prolaktin- und Testosteronspiegel von Männern, die mit Säuglingen in Wechselwirkung traten. Obwohl es einige Unterschiede in den Ergebnissen gibt, ging der Trend dahin, dass Testosteron sinkt und Prolaktin stabil bleibt oder bei den Vätern zunimmt, wenn sie mit Säuglingen interagieren, im Vergleich zu Kontrollmännern, die nicht mit Säuglingen interagieren. Außerdem war Testosteron bei frisch verheirateten Männern, verheirateten Vätern und Männern in langfristigen Beziehungen im Allgemeinen niedriger als bei alleinstehenden Männern (GRAY & CAMPBELL 2009). Anders als von KUTSCHERA (2018) behauptet, eignen sich Männern eben doch zur Kindererziehung – Pech gehabt Herr Kutschera!
Fötales Testosteron und kognitive Fähigkeiten
Die Frage, ob es in Bezug zu schwankenden Hormonspiegeln auch unterschiedliche kognitive Fähigkeiten bestehen bleibt umstritten, die meisten Studien belegen jedoch keinen oder sehr geringen Einfluss des Menstruationszyklus auf kognitive Fähigkeiten (HALPERN 2012, S. 201-207). Auch eine früh einsetzende Pubertät scheint keinen Einfluss auf kognitive Fähigkeiten auszuüben (HALPERN 2012, S. 195-196).
Wir wissen aber, dass Sexualhormone auch vorgeburtlich eine Rolle spielen. So ist bekannt, dass Testosteron dafür sorgt, dass männliche Föten sich im Uterus häufiger bewegen (ELLIS & HE 2014).
Eine Theorie von GESCHWIND & GALABURDA (1985) sowie GESCHWIND & BEHAN (1982) hatte postuliert, dass pränatale Hormone einen starken Einfluss auf die Entwicklung des Gehirns und damit auf die kognitiven Fähigkeiten haben. Bei Menschen entwickelt sich die rechte Gehirnhälfte schneller als die linke, wodurch die linke Gehirnhälfte anfälliger sei für negative Effekte und ungünstiger Bedingungen im Mutterleib. Der höhere Testosterongehalt im Mutterleib während der Schwangerschaft sorge dafür, dass bei männlichen Individuen sich die linke Gehirnhälfte langsamer entwickele, wodurch die rechte Gehirnhälfte dominiere. Dadurch seien Männer potentiell talentierter, was die Fähigkeiten betrifft, die typisch für die rechte Gehirnhälfte sind. Dies zeige sich auch daran, dass bei Männern Linkshänder häufiger vorkommen als bei Frauen (die Linke Hand wird von der rechten Gehirnhälfte kontrolliert). Es ist sicherlich nicht auszuschließen, dass Testosteron eine wichtige Rolle bei der Gehirnentwicklung spielt, wobei nicht immer offensichtlich ist, ob pränatale (vorgeburtliche) oder postnatale (nachgeburtliche) Hormone bei der Gehirnentwicklung eine Rolle spielen, wie Studien an 6-12 Monate alten Babys nahelegen (ELIOT 2009). Doch die Theorien von Geschwind unterliegen einigen Problemen. In unserem Kapitel über die Unterschiede zwischen Männer- und Frauenhirnen haben wir dargelegt, dass die Lateralisation (also die unterschiedliche Ausprägung der beiden Gehirnhälften) keineswegs so eindeutig zu sein scheint. GILLMORE et al. (2007) konnten, nachdem bei 72 Neugeborenen Gehirne gescannt wurden, keine Unterschiede zwischen linker und rechter Hirnhälfte erkennen. Eine Meta-Analyse von SOMMER et al. (2004) mit 377 untersuchten Männern und 442 Frauen fand auch keinen Unterschied in der Lateralisation der Gehirnhälften bei der Sprache (d. h. beide Gehirnhälften waren beim Sprechen beteiligt). Aber schon 1986, als die Theorien von Geschwind “modern” waren, hatte BLEIER (1986) bemerkt, dass diese Theorie unschlüssig ist, indem sie bei einer groß angelegten postmortalen Studie fötaler Hirne keine Unterschiede zwischen linker und rechter Gehirnhälfte entdeckte.
Eine weitere Meta-Analyse untersuchte den Einfluss des pränatalen Testosterons bei Menschen und anderen Säugetierarten, sowie bei Vögeln auf die Lateralisation des Gehirns. Dabei entdeckten sie, dass pränatales Testosteron einen Einfluss bei nichtmenschlichen Säugetieren (hauptsächlich motorische Eigenschaften) und Vögeln (visuell-kognitive Aufgaben), jedoch nicht bei Menschen (PFANNKUCHE, BOUMA & GROOTHUIS 2008) hat.
Verschiedene Studien haben aber versucht eine Korrelation zwischen erhöhtem Testosterongehalt und kognitiven Fähigkeiten, bzw. typisch männlich und typisch weiblichem Verhalten zu verbinden.
Es sind zwei größere Studien bekannt, die anhand des Blutbildes der Mütter eine positive Korrelation von pränatalen Hormonen mit „typisch männlichen“ Verhalten bei Mädchen entdeckt haben wollen. Doch beide Studien kommen zu widersprüchlichen Ergebnissen. Eine Studie (UDRY, MORRIS & KOVENOCK 1995) entdeckten, dass höhere Werte des „Sexualhormon-bindenden Globulins“ (SHBG), jedoch nicht höhere Werte von Testosteron mit „typisch männlichen“ Eigenschaften bei Mädchen korrelieren. Beim SHBG handelt es sich um einen von der Leber gebildeter Bluteiweißstoff, der die männlichen und weiblichen Sexualhormone im Blut bindet, speichert und transportiert. Die zweite Studie (HINES et al. 2002) fand eine kleine, aber statistisch signifikante, Korrelation zwischen männlichem Spielverhalten und Testosteron, jedoch keine Korrelation mit dem SHBG. Unabhängig von der Tatsache, was nun typisch männliche und typisch weibliche Eigenschaften sind und beide Studien zu entgegengesetzten Ergebnissen kamen, gibt es weitere Gründe dafür, die Ergebnisse vorsichtig zu behandeln. Zum einen ist Testosteron im Mutterblut kein guter Indikator für fötale Testosteronwerte, zum anderen sind die Methoden in der Studie von UDRY, MORRIS & KOVENOCK (1995) nicht ausreichend beschrieben und stehen im Widerspruch zu einer späteren Arbeit des Erstautoren (UDRY 2000, zur Kritik: COHEN-BENDAHAN et al. 2005). Bei der Studie von HINES et al. (2002) konnte nur gezeigt werden, dass etwa 2% der Variation in den Geschlechterrollen sich auf das Testosteron zurückführen lassen.
Viel häufiger werden Fruchtwasseruntersuchungen unternommen und dort z. B. der Testosterongehalt gemessen. Einige Studien haben sich dabei zur Aufgabe genommen einen Zusammenhang zwischen Geschlechterrollen und dem Testosteron im Fruchtwasser zu untersuchen (KNICKMEYER et al. 2005a, 2005b, 2006, GRIMSHAW et al. 1995, LUTCHMAYA et al. 2002). Diese Studien entstammen alle derselben Arbeitsgruppe unter der Leitung von BARON-COHEN, dessen Theorien über die kognitive Gehirnentwicklung bei Männern und Frauen wir schon im letzten Teil begegnet sind. Einige dieser Studien fanden keine Korrelation zwischen geschlechtsspezifischen Interessen und der Hormonkonzentration im Fruchtwasser (z. B. GRIMSHAW et al. 1995, KNICKMEYER et al. 2005a). Die anderen Arbeiten weisen einige Schwierigkeiten in der Interpretation auf. BARON-COHENS (2003) Theorie sieht eine fundamentale Differenz zwischen einer weiblichen und männlichen Persönlichkeit in der Tatsache, dass Frauen eher Interesse an „empathischen“, Männer eher ein Interesse an „systematischen“ Dingen haben, die sich bei der Fragestellung der Kleinkinder, die zwecks ihrer Interessen untersucht wurden, auf ein Interesse an Menschen vs. Interesse an Dingen reduzieren lassen. Die Widersprüche der Ergebnisse und Methoden lassen sich auch daran sehen, wie mit „statistischen Ausreißern“ (z. B. Mädchen mit hohem Testosterongehalt) behandelt werden oder die statistischen Zusammenhänge zwischen Testosteron und geschlechtsspezifischen Interessen allgemein. Da die Befragung bei Kleinkindern stattfand ist eine Interpretation der Ergebnisse auch schwieriger als bei Erwachsenen (JORDAN-YOUNG 2010: S. 218-219). Diese Arbeiten stehen auch im Widerspruch zu der sonst methodisch gut dargelegten Studie von HINES et al. (2002), die weiter oben erwähnt wurde. HINES et al. (2002) entdeckten, dass mütterliches Testosteron mit typisch männlichen Interessen bei Mädchen korreliert, wenn auch nur sehr gering. Die Studien der Fruchtwasseruntersuchungen hingegen zeigten eine positive Korrelation zwischen Testosteron und „typisch männlichen“ Interessen nur bei Jungen, jedoch niemals mit Mädchen. Nun ließe sich sowohl einwenden, dass HINES et al. (2002) Studie problematisch sei, da aus dem Blutserum der Mutter keine Verbindung zu den Interessen von Kleinkindern in Abhängigkeit von ihrem Testosterongehalt besteht. Auf der anderen Seite sind die Studien von Baron-Cohens Team methodisch schwach.
Adrenogenitales Syndrom (AGS)
Das Adrenogenitale Syndrom (AGS), in Englisch Congenital adrenal hyperplasia (CAH), ist eine Stoffwechselkrankheit, die durch eine Störung der Hormonsynthese in der Nebennierenrinde gekennzeichnet sind. Dabei ist die Bildung von Cortisol und Aldosteron gestört. Durch Überstimulation der Nebennierenrinde werden vermehrt Nebenwege des Stoffwechsels aktiviert und Vorstufen (z. B. Pregnenolon, Progesteron) gebildet. Der Mangel an Cortisol führt zur kompensatorischen Stimulierung der gesamten Nebenniere durch den Hypothalamus und die Hypophyse. Da die Bildung der Sexualhormone – welche dabei nicht gestört ist – ebenfalls in der Nebennierenrinde erfolgt, kommt es bei Mädchen zur Vermännlichung beziehungsweise vorzeitigen Geschlechtsentwicklung beim Jungen.
Mädchen mit AGS stehen dabei im Interesse der Erforschung geschlechtsspezifischer Eigenschaften. Jungen mit AGS zeigen keine Unterschiede gegenüber Jungen mit normalem Testosteron-Haushalt in Bezug auf Präferenzen für Spielsachen, Spielgefährten oder Aggression (BERENBAUM & HINES 1992, BERENBAUM & SNYDER 1995, HINES, BROOK & CONWAY 2004, BERENBAUM & RESNICK 1997), scheinen aber stressanfälliger zu sein (BERENBAUM et al. 2004).
Studien an Mädchen mit AGS hingegen scheinen zu belegen, dass Testosteron und andere Androgene einen großen Einfluss auf ihr Verhalten und geschlechtsspezifische Interessen haben. Sie seien in ihren Interessen „vermännlicht“ (BERENBAUM 1998, BERENBAUM & RESNICK 1997).
Acht unabhängige Studien untersuchten die Spielzeug- und Spielpräferenzen bei Kindern mit AGS, und sieben der acht Studien ergaben, dass Mädchen mit AGS mit größerer Wahrscheinlichkeit Spielzeug und Spiele bevorzugen, die als „typisch männlich“ gelten, als nicht betroffene Mädchen (EHRARDT & BAKER 1974, RESNICK et al. 1986, DITTMANN et al. 1990, BERENBAUM & HINES 1992, BERENBAUM, DUCK & BRYK 2000, SERVIN et al. 2003, PASTERSKI et al. 2005, MEYER-BAHLBURG et al. 2006). Beispielsweise zeigen Mädchen mit AGS weniger Interesse mit Puppen zu spielen und haben häufiger männliche Spielgefährten.
Während es keine Frage darin zu geben scheint, dass Mädchen mit AGS „männlicher“ in ihrer Auswahl an Spielzeugen, Spielen und Spielkameraden sind als andere Mädchen, zeigen keine anderen Interessen- oder Verhaltensbereiche so starke Ergebnisse. Beispielsweise haben Mädchen mit AGS keine stärkeren Interessen an Raufereien und „Kampfspielen“ als nicht betroffene Mädchen (DITTMANN et al. 1990, HINES & KAUFMANN 1994). Zwar zeigen einige Studien (z. B. DITTMANN et al. 1990), dass Frauen mit AGS eher an einer Karriere interessiert sind, als an einer Heirat oder Mutterschaft und tatsächlich auch seltener heiraten und Mutter werden (z. B. HURTIG & ROSENTHAL 1987, STIKKELBROECK et al. 2003). Doch dies kann auch damit zusammenhängen, dass AGS oft mit Problemen der Fruchtbarkeit einhergeht (vgl. JORDAN-YOUNG 2010: S. 227). Konnten einige Studien zeigen, dass Frauen mit AGS eher an Männerberufen interessiert sind (z. B. BERENBAUM 1999, SERVIN et al. 2003), zeigen andere Studien das genaue Gegenteil (z. B. KUHNLE & BULLINGER 1997). Auch sind Mädchen und Frauen mit AGS nicht aggressiver als nicht betroffene Mädchen (z. B. DITTMANN et al. 1990, EHRARDT & BAKER 1974). Wenn auch BERENBAUM & RESNICK (1997) bei Mädchen mit AGS eine höhere Aggressionsbereitschaft postulierten, wird diese in einer größeren Studie von denselben Autoren relativiert (BERENBAUM et al. 2004, BERENBAUM 2008).
Frauen mit AGS haben einen höheren Androgen-Spiegel als alle anderen Frauen. Wenn Androgene wie Testosteron maßgeblich die Entwicklung des menschlichen Gehirns und der Psyche beeinflussen sollen, dann müssten Frauen mit AGS in vielen psychologischen und soziologischen Merkmalen Männern näherstehen als Frauen. Doch bisherige Untersuchungen haben ergeben, dass dies nur auf Spielpräferenzen zutrifft. Dies erinnert ein wenig an die Probleme in Bezug zu den Spielpräferenzen bei Affen, welche in Teil 10 vorgestellt wurden. Angeblich präferieren männliche Meerkatzen und Rhesusaffen „männliche“ Spielzeuge und weibliche Meerkatzen und Rhesusaffen „weibliche“. Doch das Problem der Untersuchung bestand schon alleine darin, dass die Einteilung in männliche und weibliche Spielzeuge sehr subjektiv war. Dort wurde auch die Studie von SERVIN et al. (2003) zitiert und das beliebteste Spielzeug bei Mädchen, sowohl mit als auch ohne AGS waren die als „Jungen-Spielzeuge“ deklarierten Lincoln Logs.
Es gibt aber noch weitere Probleme: Will man untersuchen, wie Sexualhormone Gehirn und Psyche beeinflussen, so kann man dies bei Menschen aus berechtigten ethischen Gründen nur indirekt machen. So wie sich anhand anatomischer Gehirnstrukturen nicht automatisch psychologische Persönlichkeitsmerkmale ableiten lassen, lassen unterschiedliche Hormonkonzentrationen auch keine genauen Rückschlüsse auf psychologische Merkmale zu. Dieser Zusammenhang wurde an mehreren Stellen ausführlicher kommentiert.
Der Wissenschaft den Finger zeigen
Es gibt jedoch eine weitere Methode, die versucht den Einfluss von Testosteron auf psychologische Merkmale zu erkunden, die so einfach ist, dass sie praktisch jeder zu Hause durchführen kann. Was man dazu braucht ist nur ein Lineal und eine Hand (am besten mit Zeige- und Ringfinger). Es ist das sogenannte 2D:4D-Verhältnis, also das relative Größenverhältnis des Zeigefingers (2D) zum Ringfinger (4D, vgl. Abb. 6). Dabei haben Männer durchschnittlich einen längeren Ringfinger, Frauen durchschnittlich einen längeren Zeigefinger. Geht man von einer Normalverteilung aus (95% aller Probanden) so ist das Verhältnis 2D:4D bei Männern etwa bei 0,951 (mit einer typischen Spannbreite von 0.889–1.005) und bei Frauen 0,968 (bei einer Spannbreite von 0.913–1.017), basierend auf einer Studie von DALTON & GHOSAL (2018). Andere Studien kommen zu ähnlichen Verhältnissen, z. B. BAILEY & HURD (2005) mit einem Verhältnis von Männern: 0,947 (+/- 0,029) und bei Frauen mit 0,965 (+/- 0,026). Dieses Experiment kann jeder machen und die Zahl der Studien ist schier unendlich. Der englische wikipedia-Eintrag zitiert 142 Studien zur Fingerlängen-Messung. Sie ist aber auch sehr einfach. Ich habe es selbst ausprobiert: Mein Zeigefinger hat die Länge von 8,4 cm, mein Ringfinger ist 8,8 cm. Mein Verhältnis 2D:4D ist somit 0,966. Das heißt ich bin ein Mann (und das ohne mir in den Schritt zu schauen – hoho), auch wenn ich über dem Durchschnittswert für Männer liege.

Abb. 6: Fingerlängen-Verhältnis
Was sagt uns das jetzt? Postuliert wird, dass höhere Testosteronmengen einen Einfluss auf das Fingerwachstum und psychologische Eigenschaften haben und als Indikator für hormonbasierte Geschlechtsunterschiede dienen können (z. B. WILSON 1983, 2010, MANNING et al. 1998). Und bei dieser sehr einfachen Vermessungsmethode, die zweifelsfrei leichter ist als die Schädelmessungen, können allerlei „Zusammenhänge“ entdeckt werden: Aggression, sexuelle Orientierung, kognitive Fähigkeiten, geschlechtsspezifische Interessen usw.
Jedoch: es ist schlechte Wissenschaft – es ist noch nicht mal Wissenschaft an sich. Man entdeckt erstens, wenn überhaupt, nur Korrelationen, jedoch keine Ursachen. Zweitens: wenn schon die Hormonkonzentrationen wenig über geschlechtsspezifische Merkmale und Interessen etwas aussagen, wieso sollten Fingermessungen glaubwürdiger sein? Alleine die Einfachheit der experimentellen Herangehensweise, die selbst die faulsten Studenten durchführen können, lässt an der Wissenschaftlichkeit solcher Ergebnisse zweifeln. Drittens sind die Ergebnisse oft widersprüchlich: Z. B. haben mehrere Studien das Fingerlängenverhältnis in Bezug zur Aggression untersucht, dabei fanden einige Studien eine Korrelation bei Männern, nicht jedoch bei Frauen. Andere Studien wiederrum entdeckten eine Korrelation bei beiden Geschlechtern oder bei Frauen (BAILEY & HURD 2005, BENDERLIOGLU & NELSON 2004, COYNE et al. 2007, MCINTYRE et al. 2007, HAMPSON, ELLIS & TENK 2008). VORACEK & STIEGER (2009) konnten hingegen bei beiden Geschlechtern keine Korrelation entdecken. Bei 8 Studien, die das 2D:4D Verhältnis von homosexuellen und heterosexuellen Männern verglichen, zeigten drei Studien ein größeres 2D:4D Längenverhältnis bei homosexuellen Männern (LIPPA 2003, COLLAER, REIMERS & MANNING 2007), also ein Verhältnis, das typisch sei für Frauen. Zwei weitere Studien (ROBINSON & MANNING 2000, RAHMANN & WILSON 2003) demonstrierten jedoch das Gegenteil: schwule Männer haben ein niedrigeres Längenverhältnis als heterosexuelle; schwulen Männer sind demnach männlicher. Drei weitere Studien fanden keinen Zusammenhang zwischen Fingerlängenverhältnis und sexueller Orientierung (WILLIAMS et al. 2000, VORACEK, MANNING & PONOCNY 2005, KRAEMER et al. 2006), wenn auch bei WILLIAMS et al. (2000) bemerkt wird, dass, je mehr ältere Brüder man habe, desto höher wird die Wahrscheinlichkeit, dass der nächstgeborene Sohn homosexuell wird (die meisten schwulen Männer, die ich kenne, sind übrigens Erstgeborene – Internet-Evoluzzer). Diese Widersprüchlichkeiten finden sich auch in anderen Bereichen (vgl. JORDAN-YOUNG 2010: S. 216f.).
Es besteht jedoch ein viertes, vielleicht gravierenderes Problem: Auch wenn Männer einen kleineren 2D:4D Wert haben als Frauen, sind die Überschneidungen extrem groß. Abb. 7 zeigt, basierend auf der Studie von BAILEY & HURD (2005) mit 136 Männern und 137 Frauen, die Verteilung der 2D:4D-Fingerlängen-Verhältnisse bei Männern (blau), Frauen (grün) und der Gesamtbevölkerung (rot): Man beachte die starke Überschneidung zwischen Männern und Frauen.
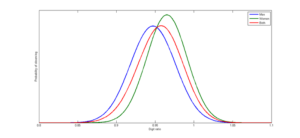
Abb. 7: Verteilung 2D:4D nach BAILEY & HURD (2005)
Noch deutlicher wird dies bei MANNING et al. (2008, Abb. 8) mit je 400 Männern und Frauen: Bei Männern beträgt das Verhältnis 0,98, bei Frauen 1,0. Der Unterschied liegt als bei 0,2, jedoch ist auch hier die Variation enorm, sodass auf dem ersten Blick Unterschiede kaum bemerkbar sind.
Was wir hier mitnehmen können ist eigentlich nur Folgendes: Das 2D:4D-Fingerlängenverhältnis sagt nur eines aus: Männer haben durchschnittlich einen längeren Ringfinger, bei Frauen hingegen ist der Zeigefinger durchschnittlich länger. Alles andere ist Spekulation.
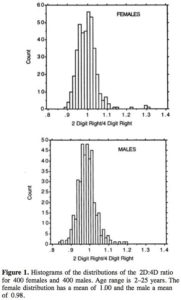
Abb. 8: Fingerlängenverhältnis bei Männern und Frauen nach MANNING et al. (2008)
Literatur
ADKINS-REGAN (2005): Hormones and animal social behavior. Princeton: Princeton University Press
AGATE et al. (2002): Neural, not gonadal, origin of brain sex differences in a gynandromorphic finch. PNAS 100 (8) 4873-4878
AKTORIES et al. (2005): Allgemeine und spezielle Pharmakologie und Toxikologie. Elsevier GmbH, Urban & Fischer Verlag, 9. Auflage.
BAILEY & HURD (2005): “Finger length ratio (2D:4D) correlates with physical aggression in men but not in women”. Biological Psychology. 68 (3): 215–22.
BAKKER et al. (2006): Alpha-fetoprotein protects the developing female mouse brain from masculinization and defeminization by estrogens. Nat Neurosci., 9(2):220-6
BAKKER & BAUM (2008): Role for estradiol in female-typical brain and behavioral sexual differentiation. Front Neuroendocrinol. 2008 Jan;29(1):1-16.
BARON-COHEN (2003): The Essential Difference: Men, women and the extreme male brain. London: Allen Lane
BARRACLOUGH & GORSKI (1962): Studies on Hypothalamic Regulation of FSH Secretion in the Androgen-Sterilized Female Rat. Proc Soc Exp Biol Med.;110:298-300.
BECK (2014): Hirnrissig. Die 20,5 größten Neuromythen – und wie unser Gehirn wirklich tickt. München: Hanser
BENDERLIOGLU & NELSON (2004): Digit Length Ratios Predict Reactive Aggression in Women, but Not in Men. Hormones and Behavior 46 (5): 558–564.
BERENBAUM (1998): How Hormones Affect Behavioral and Neural Development. Introduction to Special Issue, “Gonadal Hormones and Sex Differences in Behavior.” Developmental Neuropsychology 14 (2–3): 175–196.
BERENBAUM (1999): Effects of Early Androgens on Sex-Typed Activities and Interests in Adolescents with Congenital Adrenal Hyperplasia. Hormones and Behavior 35:102–110.
BERENBAUM (2008): Information for Families with CAH. www.personal.psu.edu/faculty/s/a/sab31/cah_info.html.
BERENBAUM, DUCK & BRYK (2000): Behavioral Effects of Prenatal versus Postnatal Androgen Excess in Children with 12-Hydroxylase-Deficient Congenital Adrenal Hyperplasia. Journal of Clinical Endocrinology and Metabolism 85 (2): 727–733.
BERENBAUM & HINES (1992): Early Androgens Are Related to Childhood Sex-Typed Toy Preferences. Psychological Science 3 (3): 203–206.
BERENBAUM & RESNICK (1997): Early Androgen Effects on Aggression in Children and Adults with Congenital Adrenal Hyperplasia. Psychoneuroendocrinology 22 (7): 505–515.
BERENBAUM & SNYDER (1995): Early Hormonal Influences on Childhood Sex-Typed Activity and Playmate Preferences: Implications for the Development of Sexual Orientation. Developmental Psychology 31 (1): 31–42.
BERENBAUM et al. (2004): Psychological Adjustment in Children and Adults with Congenital Adrenal Hyperplasia. Journal of Pediatrics 144 (6): 741–746.
BLEIER (1986): Sex differences research: Science or belief? In BLEIER (1986, Hrsg.): Feminist approaches to science (S. 147-164). New York: Pergamon Press
COHEN-BENDAHAN et al. (2005): Maternal Serum Steroid Levels Are Unrelated to Fetal Sex: A Study in Twin Pregnancies. Twin Research and Human Genetics 8 (2): 173–177.
COLLAER, REIMERS & MANNING (2007): Visuospatial Performance on an Internet Line Judgment Task and Potential Hormonal Markers: Sex, Sexual Orientation, and 2D:4D. Archives of Sexual Behavior 36 (2): 177–192.
COYNE et al. (2007): Directional Asymmetry (Right-Left Differences) in Digit Ratio (2D:4D) Predict Indirect Aggression in Women. Personality and Individual Differences 43 (4): 865–872.
DALTON & GHOSAL (2018): “Self-confidence, Overconfidence and Prenatal Testosterone Exposure: Evidence from the Lab”. Frontiers in Behavioral Neuroscience. 12: 5.
DE MEES et al. (2006): Alpha-Fetoprotein: From a Diagnostic Biomarker to a Key Role in Female Fertility. Biomark Insights. 2006; 1: 82–85.
De VRIES (2004): Sex differences in adult and developing brains: Compensation, compensation, compensation. Endocrinology, 145 (3), 1063-1068
DITTMANN et al. (1990): Congenital Adrenal Hyperplasia I: Gender-Related Behavior and Attitudes in Female Patients and Sisters. Psychoneuroendocrinology 15 (5–6): 401–420.
EHRARDT & BAKER (1974): Fetal Androgen, Human Central Nervous System Differentiation, and Behavior Sex Differences. In Sex Differences in Behavior, ed. R. C. Friedman, R. M. Richart, and R. L. Vande Weile. New York: John Wiley.
ELIOT (2009): Pink brain blue brain. How small differences grow into troublesome gaps and what we can do about it . Boston, New York : Houghton Miffl in Harcourt
ELLIS & HE (2014): Sex differences in fetal activity and childhood hyperactivity. Res. J. Dev. Biol., 1-6
ELRAIYAH et al. (2014): The benefits and harms of systemic testosterone therapy in postmenopausal women with normal adrenal function: a systematic review and meta-analysis. J Clin Endocrinol Metab, 99 (10), pp. 3543-3550.
FEDERMANN (2006): The biology of human sex differences. N. Engl. J. Med. 354, 1507-1514
FRANCIS 2004: Why men won’t ask for directions. The seductions of sociobiology. Princeton: Princeton University Press
FRANCIS et al. (1992): Castration lowers aggression but not dominance in male Haplochromis burtoni (Cichlidae). Ethology, 90 (3), 247-255
FRANCIS et al. (1993): social regulation oft he brain-pituitary axis. Proceedings of the National Academy of Sciences, 90 (16), 7794-7798
FUENTES (2012): Race, Monogamy and other Lies they told you. Buting Myth about Human Nature. University of California Press
GAHR et al. (1998): Sex difference in the size oft he neural song control regions in a dueting songbird with similar song repertoire size of males and female. Journal of Neuroscience, 18 (3), 1124-1131
GESCHWIND & BEHAN (1982): Left-handedness: Association with immune disease, migraine and developmental lerning disorder. Proceedings of the National Academ of Sciences USA, 79, 5097-5100
GESCHWIND & GALABURDA (1985): Cerebral lateralization. Biological mechanisms, associations, and pathology: I. A hypothesis and a program for research JAMA Neurology 42(5):428-59
GILBERT, S. (2006): Developmental Biology. 8th Edition. Sinauer Associations
GILLMORE et al. (2007): Regional Gray Matter Growth, Sexual Dimorphism, and Cerebral Asymmetry in the Neonatal Brain. Journal of Neuroscience 7 February 2007, 27 (6) 1255-1260
GRAY & CAMPBELL (2009): Human male testosterone, pair bonding and fatherhood, in P. T. Ellison and P. B. Gray, eds., The Endocrinology of Social Relationships, pp. 270–93.
GRIMSHAW et al. (1995): Mental Rotation at 7 Years: Relations with Prenatal Testosterone Levels and Spatial Play Experiences. Brain and Cognition 29 (1): 85–100.
HALPERN (2012): Sex Differences in Cognitive Abilities. 4th edition. New York: Psychology Press
HAMPSON, ELLIS & TENK (2008): On the Relation between 2D:4D and Sex-Dimorphic Personality Traits. Archives of Sexual Behavior 37:133–144.
HERBERT (2015): Testosterone: Sex, Power and the Will to Win OUP Oxford
HINES (2004): Brain gender. Oxford and New York: Oxford University Press Population Study. Child Development 73 (6): 1678–1687.
HINES, BROOK & CONWAY (2004): Androgen and Psychosexual Development: Core Gender Identity, Sexual Orientation, and Recalled Childhood Gender Role Behavior in Women and Men with Congenital Adrenal Hyperplasia (CAH). Journal of Sex Research 41 (1): 75–81.
HINES & KAUFMANN (1994): Androgen and the Development of Human Sex-Typical Behavior: Rough-and-Tumble Play and Sex of Preferred Playmates in Children with Congenital Adrenal-Hyperplasia (CAH). Child Development 65 (4): 1042–53.
HINES et al. (2002): Testosterone during Pregnancy and Gender Role Behavior of Preschool Children: A Longitudinal, Population Study. Child Development 73 (6): 1678–1687.
HINES et al. (2002a): Prenatal Stress and Gender Role Behavior in Girls and Boys: A Longitudinal, Population Study. Hormones and Behavior 42 (2): 126–134.
JOHNSON (2013): Essential Reproduction. 7th Ed. Wiley-Blackwell, Oxford
JONES (2009): Advances in the Management of Testosterone Deficiency. S. Karger AG.
JORDAN-YOUNG (2010): Brain Storm The Flaws in the Science of Sex Differences. Cambridge: Harvard University Press
KRAEMER et al. (2006): Finger Length Ratio (2D:4D) and Dimensions of Sexual Orientation. Neuropsychobiology 53 (4): 210–214.
KARKAZIS & JORDAN-YOUNG (2015): Science and society: debating a testosterone „sex gap“. Science 348, 858-860
KNICKMEYER et al. (2005a): Foetal Testosterone, Social Relationships, and Restricted Interests in Children. Journal of Child Psychology and Psychiatry 46 (2): 198–210.
KNICKMEYER et al. (2005b): Gender-Typed Play and Amniotic Testosterone. Developmental Psychology 41 (3): 517–528.
KNICKMEYER et al. (2006): Androgens and Autistic Traits: A Study of Individuals with Congenital Adrenal Hyperplasia. Hormones and Behavior 50 (1): 148–153.
KUDWA et al. (2005): A previously uncharacterized role for estrogen receptor β: Defeminization of male brain and behavior. PNAS 102 (12) 4608-4612
KUHNLE & BULLINGER (1997): Outcome of Congenital Adrenal Hyperplasia. Pediatric Surgery International 12 (7): 511–515.
KUTSCHERA (2018): Das Gender-Paradoxon – Mann und Frau als evolvierte Menschentypen. LIT-Verlag
LEE et al. (2009): Sexual dimorphic gene expression in the chick brain, before gonadal differntiation. Poult. Sci. 88, 1003-1015
LIPPA (2003): Are 2D:4D Finger-Length Ratios Related to Sexual Orientation? Yes for Men, No for Women. Journal of Personality and Social Psychology 85 (1): 179–188.
LUTCHMAYA et al. (2002): Foetal Testosterone and Eye Contact in 12-Month-Old Human Infants. Infant Behavior and Development 25 (3): 327–335.
MANNING et al. (1998): The ratio of 2nd to 4th digit length: a predictor of sperm numbers and concentrations of testosterone, luteinizing hormone and oestrogen”. Human Reproduction. 13 (11): 3000–4.
MATHEWS & ARNOLD (1990): Antiestrogens fail to prevent masculine ontogeny of the zebra finch song system. General and Comparative Endocrinology 80(1):48-58
McCARTHY & ARNOLD (2011): Reframing sexual differentiation of the brain. Nat Neurosci. 14 (6):677-83.
MCINTYRE et al. 2007): Finger Length Ratio (2D:4D) and Sex Differences in Aggression during a Simulated War Game. Personality and Individual Differences 42(4): 755–764.
MEYER-BAHLBURG et al. (2006): Gender Development in Women with Congenital Adrenal Hyperplasia as a Function of Disorder Severity. Archives of Sexual Behavior 35 (6): 667–684.
NAGEL & VOM SAAL (2004): Endocrine control of sexual differentiation: effects of the maternal–fetal environment and endocrine disrupting chemicals. Advances in Molecular and Cell Biology Volume 34, 2004, Pages 15-37
NIESCHLAG, BEHRE & NIESCHLAG (2010): Andrology. Springer Verlag, 3. Auflage.
NGUN et al. (2011): The genetics of sex differences in brain and behavior. Front Neuroendocrinol.; 32(2):227-46.
OGAWA et al. (2000): Abolition of male sexual behaviors in mice lacking estrogen receptors alpha and beta (alpha beta ERKO). Proc Natl Acad Sci U S A. ; 97(26):14737-41.
OLIVEIRA et al. (1996): Social modulation of sex steroid concentraitions in the urine of male cichlid fish Oreochromis mossambicus. Hormones and Behevior, 30 (1), 2-12
PASTERSKI et al. (2005): Prenatal Hormones and Postnatal Socialization by Parents as Determinants of Male-Typical Toy Play in Girls with Congenital Adrenal Hyperplasia. Child Development 76 (1): 264–278.
PENZLIN (2009): Lehrbuch der Tierphysiologie. Spektrum akademischer Verlag. 7 Auflage (Neudruck)
PFANNKUCHE, BOUMA & GROOTHUIS (2008): Does testosterone affect lateralization of brain and behaviour? A meta-analysis in humans and other animal species Philos Trans R Soc Lond B Biol Sci. 2009 Apr 12; 364(1519): 929–942.
RAHMANN & WILSON (2003): Sexual Orientation and the 2nd to 4th Finger Length Ratio: Evidence for Organising Effects of Sex Hormones or Developmental Instability? Psychoneuroendocrinology 28 (3): 288–303.
REED, BOU NEMER, CARR (2016): Has testosterone passed the test in premenopausal women with low libido? A systematic review. Int J Womens Health, (8), pp. 599-607.
RESNICK et al. (1986): Early Hormonal Influences on Cognitive Functioning in Congenital Adrenal-Hyperplasia. Developmental Psychology 22 (2): 191–198.
ROBINSON & MANNING (2000): The Ratio of 2nd to 4th Digit Length and Male Homosexuality. Evolution and Human Behavior 21 (5): 333–345.
SANCHEZ et al. (2009): Oxytocin, vasopressin, and human social behavior, in P. T. Ellison and P. B. Gray, eds., The Endocrinology of Social Relationships, pp. 319–39.
SCHOLZ et al. (2006): Sex-dependent gene expression in earkly brain developement of chicken embryos. BMC Neurosci. 7,12
SERVIN et al. (2003): Prenatal Androgens and Gender-Typed Behavior: A Study of Girls with Mild and Severe Forms of Congenital Adrenal Hyperplasia. Developmental Psychology 39 (3): 440–450.
SOMMER et al. (2004): Do women really have more bilateral language representation than men? A meta-analysis of functional imaging studies Brain, Volume 127, Issue 8, 1 August 2004, Pages 1845–1852
STIKKELBROECK et al. (2003): Fertility in Women with Congenital Adrenal Hyperplasia Due to 21-Hydroxylase Deficiency. Obstetrical and Gynecological Survey 58 (4): 275–284.
UDRY (2000): Biological Limits of Gender Construction. American Sociological Review 65 (3): 443–457.
UDRY, MORRIS & KOVENOCK (1995): Androgen Effects on Women’s Gendered Behavior. Journal of Biosocial Science 27 (3): 359–368.
VIZZIANO-CANTONNET et al. (2011): Sexual dimorphism in the brain aromatase expression and activity, and in the central expression of other steridogenic enzymes during the period of sex differentiation in monosex rainbow trout populations. Gen. Comp. Ebndocrinol. 170, 346-355
VORACEK, MANNING & PONOCNY (2005): Digit Ratio (2D:4D) in Homosexual and Heterosexual Men from Austria. Archives of Sexual Behavior 34 (3): 335–340.
VORACEK & STIEGER (2009): Replicated Nil Associations of Digit Ratio (2D:4D) and Absolute Finger Lengths with Implicit and Explicit Measures of Aggression. Psicothema 21 (3): 382–389.
WADE (2013): The new science of sex difference. Sociology Compass, / (4), 278-293
WALLEN (2001): Sex and context: Hormones and primate sexual motivation. Hormones and Behavoir, 40 (2), 339-357
WALLEN (2005): Hormonal Influences on sexually differentiated behavoiur in nonhuman primates. Frontiers in Neuroendocrinology, 26, 7-26
WILLIAMS et al. (2000): Finger-Length Ratios and Sexual Orientation. Nature 404 (6777): 455–456.
WILSON (1983): “Finger-length as an index of assertiveness in women”. Personality and Individual Differences. 4: 111–112
WILSON (2010): “Fingers to feminism: The rise of 2D:4D”. Quarterly Review. 4: 25–32.


