Anmerkungen zu Teil eins und zwei
Einige Leser haben mich darum gebeten, weil sie in Bio nicht so fit sind, dass ich ihnen in Kürze nochmal die wesentlichen Aspekte darstelle.
Genetik und Molekularbiologie sind inhaltsstarke Fächer (wenn man bedenkt, dass alleine die Abschnitte Mitose und Meiose in ALBERTs “Molekularbiologie der Zelle etwa 80 Seiten ausmachen und das Buch selbst über 1600 Seiten hat, kriegt vielleicht eine Vorstellung über die Komplexität dieses Themas), weswegen eine kurze Zusammenfassung sich als schwierig erweist. Ich werde aber, sobald die Gender-Geschichte im Wesentlichen abgeschlossen ist, versuchen die Grundlagen der Molekularbiologie (dieser Begriff erscheint mir übrigens sinnvoller als “Genetik”) kurz darzustellen, ähnlich wie z. B. der Artikel zur phylogenetischen Systematik (ebenfalls ein Thema, welches viele Bio-Studenten zum Wahnsinn treibt. Für die Ungeduldigen empfehle ich z. B. die Seite “Bio einfach erklärt“.
Die dreiteilige Videoreihe “Grundlagen der Genetik” auf youtube ist ebenfalls für jene zu empfehlen, die es sich lieber ansehen.
Die Kernaussage, die wir uns bisher wirklich merken müssen, warum es zwei Geschlechter gibt (womit Teil zwei zusammengefasst wäre), sind folgende:
- Wir Menschen (und die meisten Lebewesen) haben einen doppelten Satz an Chromosomen (= diplopid). Und das gilt im Wesentlichen für die meisten Lebewesen, vor allem Tiere.
- Wir Menschen produzieren, wie alle sich sexuell vermehrenden Lebewesen, Keimzellen (=Gameten). Diese haben nur einen halben Chromosomensatz (=haploid). Der Prozess, bei dem aus einer diploiden Zelle vier haploide Zellen entstehen bezeichnet man als Meiose (oder Reduktionsteilung).
- Wir produzieren zwei verschiedene Typen von Keimzellen, Spermazellen (klein, beweglich) und Eizellen (groß, unbeweglich). Dies gilt für ALLE Tiere. Auch andere Gruppen von Lebewesen produzieren entweder unterschiedliche Keimzellen (und zwar immer zwei), oder sie produzieren gleichwertige Keimzellen, bei denen sich dann aber auch immer zwei verschmelzen (für Menschen und Tiere allgemein aber uninteressant).
- Lebewesen durchlaufen in ihrem Leben einen Wechsel der haploiden und diploiden Phase (=Kernphasenwechsel). Je nach Typ überwiegt die ein oder andere Phase. Bei Menschen und allen Tieren dominiert die diploide Phase (= Diplonten).
- Jede Produktion der Keimzellen geht mit einer “Keimzellenproduktionsstätte” zusammen. Spermien werden bei Tieren in Hoden produziert, Eizellen in Eierstöcken. Das geht auch einher mit der Verbreitung der Keimzellen (innere oder äußere Befruchtung, Eilegeapparate, Penis etc.).
- Wenn es Lebewesen gibt, die über drei oder mehr Chromosomensätze verfügen (=Polyploid), sind sie ein Sonderfall aufgrund von Störungen während der Meiose. Dabei entstehen aber auch immer zwei Keimzellentypen.
Dadurch lassen sich eben zwei biologische Geschlechter begründen = Verschmelzung von ZWEI haploiden Zellen, die BEIDE unterschiedlichen Typs sind und JEWEILS von einem bestimmten Typ einer “Keimzellenproduktionsstätte” (Hoden, Eierstöcke) gebildet werden. Wer also die Existenz eines dritten (oder weiterer) Geschlechts postuliert, muss nachweisen, dass es bei einer Art einen dritten Typ an Keimzellen gibt, der von einem dritten Organ-Typ (der also kein Hoden oder Eierstock ist) gebildet wird. Dabei muss angemerkt werden, dass jedes neu postulierte Geschlecht funktional sein muss (denn Sex und damit das Geschlecht erfüllt eine Funktion, nämlich die “Durchmischung” der Erbanlagen). Dies hat auch Bedeutung für die Bemerkung, dass es “Intersexuelle” gibt.
Zu Teil eins (die Analyse der Queer-Theorie) sei nur gesagt: Sie ist unwissenschaftlich und der Rede nicht wert …
Teil drei befasst sich mit der Geschlechtsdetermination- und Entwicklung.
Geschlechtsdetermination – nur über Chromosomen?
Die meisten Darstellungen, die sich mit der Vererbung des Menschen befassen, verweisen bei der Vererbung der Geschlechter auf die Geschlechtschromosomen. Wir halten fest: Wir haben 23 Paare Chromosomen in unseren Zellen (=46 Chromosomen). 22 Paare davon sind sogenannte autosomale Chromosomen, oder auch Autosomen genannt. Der Begriff Autosomen umfasst schlicht und einfach alle Chromosomen, die keine Geschlechtschromosomen sind. Sie sind bei allen Menschen, gleich welchen Geschlechts, ähnlich, zu einander homolog. Menschen haben ein paar von Geschlechtschromosomen, auch Gonosomen genannt. Diese sind jeweils mit einem für das Geschlecht typischen Chromosomenpaar ausgestattet. Frauen haben zwei X-Chromosomen (XX), Männer haben ein X und ein Y-Chromosom (XY). Wir wissen nun auch von Keimzellen, dass diese haploid sind, also von einem Chromosomenpaar nur ein Chromosom haben. Bezogen auf die Geschlechtschromosomen heißt das: Weibchen bilden Keimzellen mit jeweils einem X-Chromosom und Männchen produzieren Keimzellen, die entweder ein X- oder ein Y-Chromosom haben. Verschmitzt eine Keimzelle des Weibchens mit einem X-Chromosom mit der eines Männchens, das auch ein X-Chromosom trägt, so hat die Zygote (=befruchtete Eizelle) zwei X-Chromosomen (XX) und entwickelt sich weiblich. Fusioniert eine Keimzelle des Weibchens (X-Chromosom) mit einer Keimzelle des Männchens, die ein Y-Chromosom hat, so entsteht daraus ein Männchen (XY-Chromosom). Bildlich ist dieser Erbgang im Abb. 1 verdeutlicht. Weil die Männchen zwei unterschiedliche Geschlechtschromosomen haben, sind sie heterogametisch. Weibchen mit XX bezeichnet man als homogametisch.
Auf dem Y-Chromosom liegt das sogenannte SRY-Gen (Abkürzung für “Sex determining region of Y-Gen”). Dieses Gen codiert einen sogenannten Transkriptionsfaktor namens TDF (Testis determining factor; Testis steht für Hoden). Ein Transkriptionsfaktor definiert sich dadurch, dass er andere Gene (teilweise eine ganze Reihe davon) aktiviert und so die Ausbildung wichtiger Proteine ermöglicht. Dieses Gen ist erforderlich für die Ausprägung des männlichen Geschlechts. Wir werden uns später mit den molekularen Mechanismen, als auch der Embryonalentwicklung der Geschlechtsentwicklung befassen. Gesagt sei hier schon mal, dass das SRY-Gen eine wichtige Rolle spielt, bei weitem aber nicht der einzige Faktor ist.
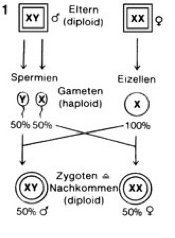
Abb. 1: Geschlechtsdetermination nach dem XX/XY-System bei Säugetieren. Quelle: Spektrum Biologie
Nun gibt es aber auch weitere Formen der Geschlechtsdetermination über Chromosomen. Bei Vögeln ist es beispielsweise umgekehrt. Dort haben die Männchen zwei identische Geschlechtschromosomen (ZZ), und wie Weibchen verfügen über zwei verschiedene Geschlechtschromosomen (ZW) (vgl. Abb. 2); hier sind also die Männchen homogametisch und die Weibchen heterogametisch. Zur Abgrenzung des XX/XY-Systems spricht man hierbei von einem ZW/ZZ-System. Diese Form der Geschlechtsbestimmung findet sich auch z. B. bei Schmetterlingen und vielen Schlangen. Bei dem ZW-System der Vögel kommt ein entscheidendes geschlechtsdeterminierendes Gen, das DMRT1, vor, welches die Geschlechtsentwicklung beeinflusst. Dieses kommt auf dem Z-Chromosom vor, jedoch nicht auf dem W-Chromosom. Weibchen haben also eine, Männchen zwei Kopien dieses Gens. Da DMRT1 bei Männchen doppelt so häufig vorkommt als bei Weibchen, führt diese “Überdosis” zur Ausbildung männlicher Geschlechtsorgane.
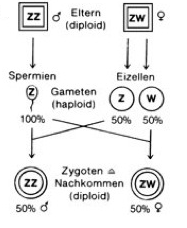
Abb. 2: Geschlechtsdetermination nach dem ZW/ZZ-System. Hier haben die Weibchen zwei unterschiedliche Geschlechtschromosomen. Vorkommen: Vögel, Schlangen, Schmetterlinge
Eine weitere Form der genetischen Geschlechtsdetermination ist das XX/X0-System (Abb. 3). Das ist eine Form, bei der ein Geschlecht (meist die Männchen) nur ein Geschlechtschromosom (X0) trägt, während das andere Geschlecht (meistens das Weibchen) zwei verfügt (XX). Diese Form der Geschlechtsdetermination findet sich bei vielen Insekten.
Eine weitere Sonderform ist die Haplodiploidie. Das Geschlecht wird über die vorhandenen Chromosomen bestimmt, es gibt jedoch keine Geschlechtschromosomen, sondern diploide und haploide Individuen. Solch eine Form der Geschlechtsbestimmung findet sich u. a. bei den staatenbildenden Bienen, Wespen und Ameisen. Dort schlüpfen aus unbefruchteten Eiern Männchen, die haben daher nur einen haploiden Chromosomensatz. Königinnen und Arbeiter sind weiblich und haben einen doppelten Chromosomensatz.

Abb. 3: Geschlechtsdetermination nach dem X0/XX-System, welches bei einigen Insektengruppen vorkommt. Quelle: Spektrum Biologie
Erwähnenswert ist auch die Geschlechtsdetermination bei der Taufliege Drosophila melanogaster, dem Modellorganismus der Chromosomenforschung. Diese Art hat vier unterschiedliche Chromosomenpaare. Ähnlich den Säugetieren haben sie zwei Geschlechtschromosomen: Weibchen sind XX, Männchen XY. Aber hier trägt nicht das Y-Chromosom, sondern das X-Chromosom die geschlechtsbestimmenden Gene. Im Y-Chromosom sind jedoch Gene vorhanden, die für die Differenzierung der Spermien notwendig sind. Dabei wird die Geschlechtsentwicklung bei Drosophila in jeder Zelle separat festgelegt und zwar über das Verhältnis der X-Chromosomen zu den Autosomen (= Nicht-Geschlechtschromosomen). Fliegen mit nur einem X-Chromosom sind männlich, Fliegen mit zwei X-Chromosomen weiblich. Mutanten ohne Y-Chromosom (X0) sind zwar Männlich, aber steril (ihnen fehlen die auf den Y-Chromosom gelegenen Gene zur Spermienproduktion). Mutanten mit zwei X-Chromosomen und einem Y-Chromosom (XXY) sind dagegen weiblich, da die Zahl der X-Chromosomen überwiegt. Da das Geschlecht in jeder Drosophila-Zelle separat festgelegt wird, können ursprünglich weibliche Embryonen mit zwei X-Chromosomen durch Verlust eines X-Chromosoms männliche Zellen ausbilden (das gilt übrigens auch für Vögel). Bei Insekten entscheidet, anders als bei Säugetieren, dabei nicht das hormonelle Milieu (Konzentration von Testosteron, Östrogen etc.) die Geschlechtsentwicklung, sondern nur die Zahl der X-Chromosomen. Man bezeichnet solche Mischwesen mit männlichen und weiblichen Zellen dann als “Gynander”. Solche Mischwesen können durch experimentelle Steuerung bzw. Manipulation der Embryonalentwicklung so entstehen, dass die eine Hälfte männlich, die andere weiblich ist. Solche Gynander gibt es nicht nur bei Fliegen, sondern auch bei Schmetterlingen oder gar Vögeln (vgl. Abb. 4). Aber solche Gynander sind kein drittes Geschlecht, sondern eben eine Mischung aus männlich und weiblich (also zwei Geschlechtern), die qualitativ nichts neues produzieren (keinen dritten Keimzellentyp).

Abb. 4: Gynander beim Vogelfalter (links männlich, rechts weiblich), Drosophila (links männlich, rechts weiblich) und Roter Kardinal (links weiblich, rechts männlich).
Die Geschlechtsdetermination erschöpft sich keineswegs auf die Chromosomen. Einige Arten (und davon nicht wenige!) entwickeln ihr Geschlecht durch äußere Umweltfaktoren, z. B. über die Temperatur. Sie kommt z. B. bei einigen Echsen, Fischen und Amphibien vor, bei den Schildkröten und Krokodilen ist sie die überwiegende, gar ausschließliche Form der Geschlechtsdetermination.
Man kennt beispielsweise von keiner Meeresschildkröte und keiner Krokodilart Geschlechtschromosomen. Ihr Geschlecht ist abhängig von der Temperatur. Während einer bestimmten Phase der Embryonalentwicklung dieser Arten entscheidet die Außentemperatur des Brutgeleges, ob sich Männchen oder Weibchen entwickeln. Bei Krokodilen entstehen bei Temperaturen bis 30 °C Weibchen, ab 34°C nur noch Männchen. Bei Temperaturen dazwischen entstehen sowohl Männchen als auch Weibchen. Bei Schildkröten ist es genau umgekehrt: Bei niedrigen Temperaturen entstehen nur Männchen, bei hohen Weibchen. Verantwortlich für die Geschlechtsentwicklung ist das Enzym Aromatase, dessen Gen über die entsprechenden Temperaturen aktiviert wird. Es wandelt dabei das Testosteron in Östrogen um. Dieses Enzym kommt auch bei allen anderen Wirbeltieren vor, so auch bei Säugetieren, unterliegt aber keiner Regulation durch die Außentemperatur. Es gibt noch andere Formen der umweltbedingten Geschlechtsdetermination, bzw. ist von einigen Arten auch bekannt, dass sie ihr Geschlecht wechseln können (dokumentiert bei einigen Fischarten). Wir werden uns damit in einem separaten Artikel näher auseinandersetzen.
MANOLAKOU et al. (2006) liefern einen guten Gesamtüberblick über die Geschlechtsdetermination verschiedener Tiergruppen.
Zur Evolution der Geschlechtschromosomen
Die Frage die sich hier natürlich stellt ist, warum es einige Arten gibt, die ihr Geschlecht durch Chromosomen bestimmen lassen, andere durch Umwelteinflüsse. Vor allem stellt sich die Frage, welche dieser Formen, zumindest bei Wirbeltieren, evolutionär ursprünglicher ist.
Es gibt hierzu mehrere plausible Theorien und Hypothesen. Tatsächlich gibt es bei nah verwandten Gruppen und Arten beide Varianten. Die Waldbach-Schildkröte (Glyptemys insculpta, Familie Neuwelt-Sumpfschildkröten Emydidae) hat beispielsweise eine Bestimmung des Geschlechts durch Chromosomen (XY), während andere Arten der Neuwelt-Sumpfschildkröten, z. B. die Tropfenschildkröte, Clemmys guttata, ihr Geschlecht über die Temperatur bestimmen lässt (vgl. Jansen & Paukstis 1991a, Literman et al. 2017, Montiel et al. 2017). Auch bei einigen Echsengruppen (Squamata) gibt es sowohl eine genetische, wie auch temperaturabhängige Geschlechtsdetermination, so bei Agamen und Geckos (vgl. Viets et al. 1994). Gingen Janzen & Paukstis (1991a & 1991b) noch davon aus, dass es zwischen den verschiedenen Reptilien-Taxa einen Wechsel zwischen genetischer und temperaturabhängiger Geschlechtsdetermination bei Echsen und Schildkröten geben könnte, zeigen neuere Untersuchungen, die die phylogenetischen Beziehungen der Taxa näher untersuchten, dass die Entwicklung von temperaturabhängiger hin zur genetischen Geschlechtsdetermination erfolgte (z. B. POKORNÁ KRATOCHVÍL 2009). D. h. die temperaturabhängige Geschlechtsbestimmung ist evolutionär ursprünglicher und wenn Arten eine genetische Geschlechtsdetermination entwickelt haben, sei eine Rückkehr zur temperaturabhängigen nicht möglich, so die Autoren der Studie. Dies erkläre auch, weshalb die genetische Geschlechtsdetermination bei einigen Gruppen (z. B. Säugetieren und Vögeln) konserviert ist (also immer vorkommt).
Sollte dies tatsächlich so sein, brachte die genetische Geschlechtsdetermination einzelnen Gruppen einen Selektionsvorteil. Eine Geschlechtsdetermination über die Temperatur hat zum Nachteil, dass bei Temperaturschwankungen je nachdem nur Männchen oder nur Weibchen entstehen. Das kann bei Arten, die sich sexuell Fortpflanzen müssen, zum Aussterben führen. Tatsächlich gibt es aufgrund der steigenden Temperaturen das Problem, dass aus einigen Gelegen der Meeresschildkröten fast nur Weibchen schlüpfen.
Andererseits sind gerade Schildkröten und Krokodile Taxa, die wesentlich älter sind als Säugetiere und Vögel und diverse erdgeschichtliche Massenaussterben überlebt haben. Geschlechtsdetermination durch die Temperatur kann also nicht per se als “rückschrittlich” oder “nachteilig” definiert werden.
Außerdem ergab eine Studie von QUINN et al. (2007), dass wenn männliche Embryonen der Streifenköpfigen Bartagame (Pogona vitticeps) mit dem homogametischen Chromosomensatz ZZ unter hohen Temperaturen inkubiert werden, sie sich zu phänotypischen Weibchen entwickeln. Die Temperatur war also in der Lage das genetische Geschlecht zu verändern. Daraus lässt sich ableiten, dass temperaturabhängige und genetische Geschlechtsdetermination durchaus korrelieren können, zumindest bei einigen Echsenarten. Bei dem ZW/ZZ-System befinden sich die geschlechtsdeterminierenden Gene nicht auf dem W-Chromosom der Weibchen, sondern auf den Z-Chromosomen. Eine doppelte Präsenz dieser Gene bei den Agamen-Männchen lässt daraus schließen, dass diese die Entwicklung des männlichen Geschlechtes fördern, aber bei einigen Arten durch den Einfluss der Temperatur sich diese “verweiblichen”. POKORNÁ & KRATOCHVÍL (2009) bemerken hierzu, dass zwar eine Koexistenz von temperaturabhängiger und genetischer Geschlechtsdetermination bei einigen Arten existiert, dennoch behielten diese “geschlechtsumgewandelten” Individuen ihre Geschlechtschromosomen und wenn diese “verweiblichten” Männchen sich mit anderen Männchen paarten, kam es zu einem verzerrten Geschlechterverhältnis. Auch sei die “Fitness” (im Sinne des Fortpflanzungserfolgs) solcher “verweiblichten” Männchen geringer. HOLLELY et al. (2016) bemerken aber richtigerweise, dass die Geschlechtsdetermination bei Reptilien und anderen Wirbeltierklassen, im Gegensatz zu den Säugetieren, labiler und veränderlicher sei. QUINN et al (2001) bemerken sogar, dass es unterschiedliche Entwicklungswege neuer Sexdetermination bei Wirbeltieren gibt. Alle möglichen Wege der Geschlechtsdetermination (XY, ZW, Temperaturabhängigkeit) können durch veränderte Schwellenwerte der Genexpression (also wie viel, wann und wo Genprodukte gebildet werden) geschlechtsdeterminierender Gene entstehen. Unter bestimmten, sich leicht veränderten, Umweltbedingungen können labile Geschlechtsdeterminations-Systeme einen selektiven Vorteil haben (vgl. auch SCHWANZ et al. 2013). Das erklärt vielleicht auch, weshalb einige phylogenetisch sehr alte Gruppen, wie Krokodile, eine temperaturabhängige Geschlechtsdetermination beibehalten haben. Ihre Fitness hat darunter nicht gelitten (zumindest in Bezug zur Geschlechtsdetermination).
Diese Plastizität der Sexdetermination bei Reptilien wurde von HOLLELY et al. (2015) experimentell bestätigt (ebenfalls bei Pogona vitticeps, die verweiblichen Männchen verhielten sich aber dennoch wie Männchen, vgl. LI et al. 2016, außerdem hatten sie im Gegensatz zu POKORNÁ & KRATOCHVÍL 2009 Behauptung eine erhöhte individuelle Fitness). Bei Amphibien (Gattung Xenopus) wurde dies von SARRE et al. (2011) ebenso nachgewiesen. HAYES et al. (2010) konnten durch die Zugabe der Chemikalie Atrazin eine komplette Feminisierung Männlicher Krallenfrösche (Xenopus laevis) hervorrufen. Atrazin verringert die Hodengröße und Sperminenproduktion auch bei Fischen, Reptilien und Säugetieren (HAYES et al 2011). Während also die Geschlechtsdetermination bei Säugetieren und Vögeln im wesentlichen auf die Chromosomen beschränkt, also fixiert, ist, ist sie bei Fischen, Amphibien und Reptilien plastischer (vgl. SARRE et al. 2011).
Bei Säugetieren und Vögel hat die genetische Geschlechtsdetermination durchaus einen Vorteil. Zum einen, anders als bei Krokodilen und Schildkröten, ist die Zahl der Nachkommen relativ beschränkt, wodurch eine gleichmäßige Verteilung der geborenen Geschlechter von Vorteil ist (diese ist bei einer genetischen Geschlechtsdetermination immer 1:1, siehe Abb. 1-3). Schildkröten und Krokodile hingegen legen viele Eier, sodass auch mehr Nachkommen entstehen (von denen aber prozentual nur 1% die Geschlechtsreife erreicht). Doch es gibt einen wesentlich wichtigeren Grund: Die meisten Säugetierarten (Placentatiere) entwickeln sich im Mutterleib. D. h. nicht nur in einer Umgebung mit relativ konstanter Temperatur, sondern auch in einem weiblichen Organismus, d. h. in einem weiblichen hormonellen Milieu. Hätte dieses Milieu einen Einfluss auf die Geschlechtsdetermination, gäbe es nur Säugetierweibchen (vgl. GILBERT & EPEL 2015: S. 18-19). Vögel hingegen brüten ihre Eier, halten die Temperatur also mehr oder weniger konstant. Auch hier erweist sich also die genetische Geschlechtsdetermination als vorteilhaft.
Die gängigste Theorie der Entstehung der Geschlechtschromosomen der Säugetiere besagt, dass die Geschlechtschromosomen durch Mutationen eines Autosomen (=Nicht-Geschlechtschromosom) hervorgegangen sind. Ursprünglich war die Geschlechtsdetermination durch die Temperatur oder andere äußere Umwelteinflüsse geregelt. Ein evolutionäres Modell, entwickelt von Page, und Lahn (1999) schlägt vor, dass der gemeinsame Vorfahr von Reptilien und Säugetieren ein paar homologer autosomaler Chromosomen hatte, statt der Geschlechtschromosomen. Im Verlauf der Evolution kam es während der Meiose zu Fehlern der Chromosomenanordnung, bei der ein Teil des einen Chromosoms durch eine “Inversion” falsch angeordnet wurde. Inversionen finden statt, indem ein Chromosom an zwei Stellen bricht und wieder zusammengefügt wird. Der Abschnitt zwischen den beiden Bruchstellen wird jedoch in umgekehrter Anordnung eingebaut. Dadurch wird die Reihenfolge der Gene auf diesem Chromosomenabschnitt umgekehrt (vgl. Abb. 5), so entstand das Y-Chromosom. Solche Inversionen kommen durchaus regelmäßig vor, unter 10.000 Geburten tritt solch eine Inversion 1,3 mal auf. Durch diese Inversion entstanden durch weitere Mutationen neue Gene, aus denen dann das SRY-Gen hervorging. Im weiteren Verlauf verlor das Y-Chromosom mehrere Gene, sodass die Homologie zwischen diesen beiden Chromosomen verloren ging. Dennoch verfügt das Y-Chromosom auch heute noch Gene, die mit jenen des X-Chromosoms homolog sind (vgl. PAGE et al. 1984). Aber gerade der Bereich mit dem SRY-Gen des Y-Chromosoms ist nicht mit dem X-Chromosom vergleichbar, ist also dem Y-Chromosom eigen (vgl. WATSON et al.1991).
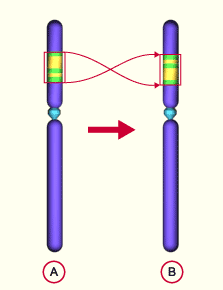
Abb. 5: Inversion. A normales Chromosom, B Chromosom mit Inversion. Quelle: http://www.embryology.ch/allemand/kchromaber/abweichende02.html
Für die Weibchen besteht nun folgendes Problem: Sie verfügen über ein X-Chromosom mehr als die Männchen, haben also von bestimmten Genen eine höhere Genaktivität. Um eine erhöhte Genaktivität zu verhindert, wird bei Weibchen ein X-Chromosom deaktiviert. Dieses inaktive X-Chromosom wird auch Barr-Körperchen genannt. Als Folge der X-Inaktivierung bestehen für die meisten Genprodukte von X-chromosomalen Genen keine geschlechtsspezifischen Unterschiede, wie sie ansonsten zu erwarten wären. Welches X-Chromosom inaktiviert wird, entscheidet die Zelle. Es handelt sich um einen epigenetischen Prozess (vgl. BARR 1949, LYON 1960, 1992, CARREL et al. 1999, PAYER & LEE 2008, DISTECHE 2013).
Spannend ist die Geschlechtsdetermination bei einer Säugetiergruppe, nämlich der Kloakentiere. Sie legen nämlich, wie Reptilien und Vögel, noch Eier und säugen ihre Jungtiere mit Milch. Heute gibt es nur noch sehr wenige Kloakentiere, das bekannteste ist das Schnabeltier (Ornithorhynchus anatinus). Eine Studie entdeckt, dass diese nicht 2 Geschlechtschromosomen haben, sondern gleich 10! Männchen haben 5 XY-Paare, Weibchen 5 XX-Paare (ATKINSON 2004). Interessanterweise haben Untersuchungen der Geschlechtschromosomen des Schnabeltiers ergeben, dass sie sowohl Gemeinsamkeiten mit den X-Chromosomen der Säugetiere und den Z-Chromosomen der Vögel und Schlangen haben. Andererseits findet sich auf dem Y-Chromosom der Schnabeltiere kein vergleichbares SRY-Gen wie bei anderen Säugetieren. Das 5. X-Chromosom hingegen habe das DMTR1-Gen der Z-Chromosomen der Vögel (GRÜTZNER et al. 2004a, b, VEYRUNES et al. 2008). Da die Geschlechtschromosomen der Schnabeltiere sowohl Gemeinsamkeiten mit den X-Chromosomen der anderen Säugetiere, als auch der Z-Chromosomen der Vögel haben gehen VEYRUNES et al. 2008 davon aus, dass der gemeinsame Vorfahre beider Gruppen schon Geschlechtschromosomen hatte und diese sich im Verlauf der Evolution spezialisierten. Die Geschlechtschromosomen der Schnabeltiere sind kein Bindeglied zwischen Vogel- und Säugetierchromosom, sondern stammt von einem Chromosom ab, welches homologe Regionen sowohl des ZW-Systems der Vögel als auch des XY-System der Säuger hatte, ab. Ihr Ergebnis bedeutet, dass die ursprünglichen Säugetiere nicht das XY-System der heutigen Säugetiere hatte, sondern dieses aus einem vogelartigen ZW-System abstammt. Ihr Evolutionsmodell ist in Abb. 6 dargestellt:
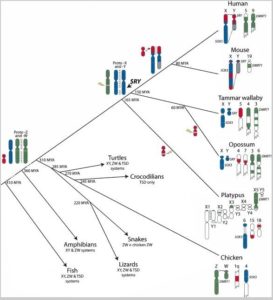
Abb. 6: Evolution der Geschlechtschromosomen nach VEYRUNES et al. 2008
Hier ergibt sich jedoch ein widersprüchliches Bild bezogen auf die Behauptung, dass die temperaturabhängige Geschlechtsbestimmung evolutionär ursprünglicher ist. Aus dem Stammbaum in Abb. 6 ergibt sich, dass der gemeinsame Vorfahre der Vögel und Säugetiere auch die Schildkröten und Krokodile beinhaltet (zur Stammbaumanalyse allgemein, siehe meinen Artikel zur phylogenetischen Systematik). Säugetiere, Vögel und “Reptilien” fasst man alle als “Amniota” zusammen. Wenn der gemeinsame Vorfahre aller Amniota schon über Geschlechtschromosomen verfügte, müssen Krokodile und Schildkröten ihre Geschlechtschromosomen sekundär verloren haben. Das widerspricht aber den Ergebnissen von POKORNÁ & KRATOCHVÍL (2009), die postulieren, dass, sobald Geschlechtschromosomen vorhanden sind, eine Rückkehr zur temperaturabhängigen Geschlechtsdetermination unmöglich macht. Die meisten Autoren gehen aber immer noch von einer unabhängigen Entwicklung der Geschlechtschromosomen von Vögeln und Säugern aus (z. B. NAMEKWA & LEE 2009, VALLENDER & LAHN 2006).
Sollte sich aber VEYRUNES et al. 2008 Modell als richtig erweisen, ist davon auszugehen, dass die genetische Geschlechtsdetermination der frühen Amnioten nicht so fixiert war, sodass frühere Abzweigungen der “Reptilien” entweder zwischen beiden System wechseln oder gar zur kompletten temperaturabhängigen Geschlechtsdetermination “zurückkehren” konnten.
Zweifelsohne besteht hier also noch Klärungs- und Forschungsbedarf, um diese spannende Frage zu lösen. Die hier dargestellten Quellen liefern lediglich einen kleinen Überblick über vorhandene Arbeiten zur Geschlechtsdetermination und erheben keineswegs einen Anspruch auf Vollständigkeit. Sollten andere, hier nicht erwähnte, Arbeiten bestehende Hypothesen weiter verstärken oder widerlegen, würde es mich freuen, hierauf aufmerksam gemacht zu werden.
Doch auch hier ist allen Arbeiten gemeinsam: die Realität der biologischen Geschlechter!
Des Müllers Wolf – Entwicklung der Keimdrüsen
Die genetische (oder umweltbedingte) Geschlechtsdetermination wird als die primäre bezeichnet. Sie bestimmt das Schicksal welche Keimdrüsen (Hoden, Eierstöcke) sich entwickeln. Säugetierembryonen haben alle, unabhängig ihrer Geschlechtschromosomen, sexuell neutrale Keimdrüsen. Das SRY-Gen am Y-Chromosom sorgt u. a. dafür, dass sich die Keimdrüsen zu Hoden entwickeln.
Die sekundäre Geschlechtsdetermination bezeichnet die Entwicklung der männlichen und weiblichen Geschlechtsorgane. Diese werden im Wesentlichen von den Hormonen, die die Keimdrüsen produzieren, beeinflusst. Abb. 7 zeigt oben die embryonal angelegten Anlagen eines Säugetiers, bevor sich Männchen und Weibchen differenzieren.
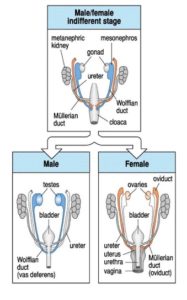
Abb. 7: embryonale Anlagen des Uro-Genitaltraktes eines Säugeiterembryos vor und nach der sekundären Geschlechtsdetermination Quelle: WOLPERT et al. 2007
Wir sehen neben den Keimdrüsen (gonads) und den Nierenanlagen (metanephric kidney) die Müllerschen Gänge (Müllerian duct, orange) und die Wolfschen Gänge (Wolfian duct, blau).
Produzieren die Keimdrüsen Östrogen (sind also weiblich, XX) entwickeln sich die Müllschern Gänge zum Uterus, Eileiter und den oberen Teil der Vagina (Abb. 7, unten rechts). Entwickeln sich die Keimdrüsen unter Einfluss des Y-Chromosoms zu Hoden werden zwei wichtige Hormone produziert. Das erste Hormon ist das Anti-Müller-Hormon (AMH), welches die Müllerschen Gänge degenerieren lässt. Das zweite Hormon, Testosteron, vermännlicht den Fötus, stimuliert die Ausbildung der männlichen Geschlechtsorgane und unterdrückt die Bildung des Brustgewebes. Das erklärt übrigens auch, weshalb Männer Brustwarzen haben: diese bilden sich aus, bevor das Antimüller-Hormon und Testosteron zum Einsatz kommen. Menschliche Embryonen beginnen diese sekundäre Geschlechtsdifferenzierung ab der 7. Schwangerschaftswoche. Bis dahin sind die Keimdrüsen sexuell neutral und der Phänotyp des Embryos weiblich (WOLPERT et al 2007, GILBERT 2006).
Im Hodengewebe entwickeln sich zwei wichtige Zelltypen: Sertoli-Zellen und Leydig-Zellen.
Sertoli-Zellen dienen als Stützzellen der Hodenkanälchen und bilden die so genannte Blut-Hoden-Schranke, die die sich entwickelnden Spermien vor dem körpereigenen Immunsystem und vor Giften schützt. Sie bilden auch zwei Proteine: das androgenbindende Globulin (ABG), welches ermöglicht, dass Testosteron in die Spermien eingelagert werden kann und das Inhibin, welches über das Hypophysen-Hormon FSH, die Spermienproduktion kontrollieren. Die Vorläuferzellen der Sertoli-Zellen produzieren auch das Anti-Müller-Hormon.
Ein weiteres Gewebe im Hoden, die Leydig-Zellen, produzieren das Testosteron. Abbildung 8 zeigt einen solchen Hodenkanal mit Sertoli- und Leydig-Zellen.
Aus einem Teil des Wolfschen Gangs entwickeln sich auch die Nebenhoden, in dem die Samenzellen gespeichert werden und heranreifen. Außerdem produzieren sie Gylkoproteine (Verbindungen aus Proteinen und Kohlenhydraten, im allgemeinen: das Ejakulat). Ein anderer Bereich des Wolfschen Gangs entwickelt sich zum Samenleiter, der mit dem Harnleiter zum Harnsamenleiter verschmilzt du die Spermien hinausbefördert.
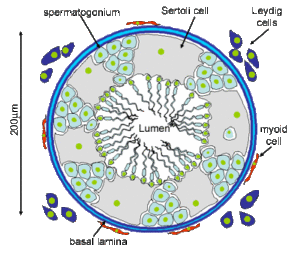
Abb. 8: Hodenkanälchen mit Sertoli-Zellen und Urkeimzellen (spermatogonium), die in das Lumen abgegeben werden und zum Samenleiter übergehen. Außerhalb des Hodenkanälchens befinden sich die Leydig-Zellen.
In den Eierstöcken sammeln sich die Eizellen (weibliche Keimzellen, haploid), in den äußeren Bereich und sind von den Körperzellen (also keine Keimzellen!) des Eierstocks umgeben, sie sich zu den Granulosa-Zellen entwickeln. Weitere Zellen des Eierstocks differenzieren sich zu den Theca-Zellen, die zusammen mit den Granulosa-Zellen Follikel bilden, die jede Eizelle umhüllen und die weiblichen Sexualhormone bilden (Abb. 9). Da nicht ausreichend Testosteron in weiblichen Keimzellen gebildet wird, degeneriert der Wolfsche Gang.
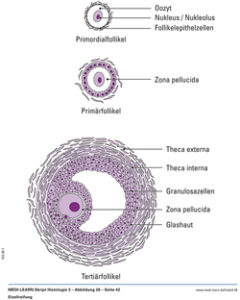
Abb. 8: Darstellung eines Follikels mit Eizelle
Insgesamt steht die Keimzellenproduktion, sowie die Produktion der Sexualhormone unter zentraler Steuerung des Gehirn-Hypothalamus-Hypophysen-Stammes. Der Hypothalamus (Teil des Zwischenhirns) steuert mit der Hypophyse (Hormondrüse, direkt unter dem Hypothalamus) das Hormonsystem des Körpers. Der Hypothalamus sendet an die Hypophyse das Hormon GnRH. Unter dem Einfluss von GnRH schüttelt die Hypophyse das luteinisierende Hormon (LH), sowie das follikelstimulierende Hormon (FSH) aus. Diese kontrollieren zum einen die Reifung der Keimzellen, sowie die Bildung der Sexualhormone.
Beteiligte Gene der Geschlechtsdetermination
An der Geschlechtsentwicklung sind sehr viele Gene beteiligt. Das schon erwähnte SRY-Gen bei Säugetieren ist nur eines von vielen (wenn auch ein ganz wichtiger!). SRY hat die Aufgabe, dass sich die Hoden entwickeln. Bei Versuchen mit transgenen Mäus-Embryonen hatte man weiblichen Embryonen (XX) kurz nach der Befruchtung das SRY-Gen injiziert. Infolgedessen entwickelten diese injizierten genetischen XX-Mäuse Hoden und weitere männliche Geschlechtsorgane (GILBERT 2006: S. 534). Es gibt jedoch weitere Gene, die an der Ausbildung der Geschlechter beteiligt sind. So gibt es ein weiteres Gen, das SOX9, welches nicht auf den Geschlechtschromosomen liegt. So zeigte sich ebenfalls bei Untersuchungen an genetisch weiblichen Mäusen (XX), dass wenn sie eine Extra-Kopie des SOX9 haben, auch diese Hoden entwickeln, selbst wenn das SRY-Gen fehlt. Stört oder blockiert man das SOX9-Gen bei XY-Männchen (bei Vorhandensein des SRY-Gens), entwickeln sie keine Hoden. Das Vorhandensein von SOX9 und SRY ist notwendig, damit sich Hoden entwickeln. Das sollte nicht verwundern, da sich das SRY-Gen nur bei Säugetieren findet, SOX9 kommt bei allen Wirbeltiertaxa vor (GILBERT 2006: S. 535).
Es gibt auch bei Menschen XX-Männer, nämlich dann, wenn das SRY-Gen nicht auf dem Y-Chromosom, sondern auf dem X-Chromosom liegt. Solche Formen des Gen-Austausches finden bei der Meiose statt, bei dem homologe Chromosomen einzelne Bruchstücke austauschen können, wodurch die genetische Variabilität erhöht wird (crossing over, Abb. 9). Dies kann auch bei Geschlechtschromosomen vorkommen (wenn auch hier ein crossing over extrem selten vorkommt), wenn das Y-Chromosom seinen SRY-Abschnitt auf das X-Chromosom überträgt. Verschmilzt eine Keimzelle mit dem “normalen” X-Chromosom mit einer anderen Keimzelle, die das X-Chromosom mit dem SRY-Gen enthält, entstehen Männchen. Fehlt dem Y-Chromosom das SRY-Gen, so entstehen XY-Weibchen (GILBERT 2006: S. 534).
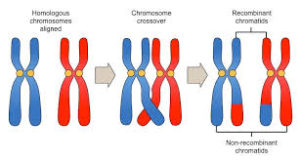
Abb. 9: Crossing over. So können verschiedene Abschnitte der homologen Chromosomen während der Meiose ausgetauscht werden.
Weitere Gene, die bei der Geschlechtsdetermination zum Einsatz kommen sind z. B. der “Fibrioblast Growth Factor 9”. Dieses Gen ist u. a. wichtig für die Entwicklung der Sertoli-Zellen in den Hoden. Das SF1-Gen (Steroidogenic Factor 1) wird entweder direkt oder indirekt durch das SRY-Gen aktiviert, welches ebenfalls für die Entwicklung der Sertoli- und Leydig-Zellen im Hoden benötigt wird. Zusammen mit dem SOX9-Gen kontrolliert es die Produktion des Anti-Müller-Hormons und in den Leydig-Zellen aktiviert es die Gene für die Enzyme zur Testosteron-Produktion. Das Gen DAX1 hingegen ist ein Hoden-Inhibierendes Gen des X-Chromosoms, ist also an der Bildung der Eierstöcke beteiligt. WNT4 ist ebenfalls ein Gen, welches bei der Eierstock-Produktion beteiligt ist, liegt aber nicht auf dem X-Chromosom. Möglicherweise kann SRY die Funktion von WNT4 blockieren, sodass Hoden ausgebildet werden können. Die Gene SF1 (Splicing factor 1, nicht zu verwechseln mit Steroidogenic factor 1!), WT1 (Wilms-Tumor-Gene) und LHX9 (LIM Homeobox Gene 9) sind grundsätzlich für die Ausbildung der Gonadenanlagen Verantwortlich, die aus der embryonalen Genitalleiste entstehen (GILBERT 2006: S. 535 – 538, 531). Auch das Gen DMRT1, welches u. a. bei der Geschlechtsdetermination bei Vögeln eine Rolle spielt, kommt bei Säugetieren vor und ist aber der Geschlechtsentwicklung beteiligt (vgl. z. B. PASK, BEHRINGER & RENFREE 2001 & MATSON et al. 2010)
Eine schematische Funktion der Gene und oben beschriebenen Hormone bei der Geschlechtsentwicklung ist in Abb. 10 dargestellt (nach GILBERT 2006: S. 531).
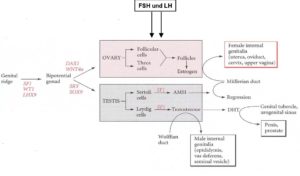
Abb. 10: Gene und Hormone bei der Entwicklung der Geschlechtsorgane. Nach GILBERT 2006: S. 531
Es sei noch anzumerken, dass diese erwähnten Gene nur einen Bruchteil derjenigen ausmachen, die Anteile an der Geschlechtsdetermination haben. Hier ist natürlich auch wichtig anzumerken, dass die richtigen Gene zur richtigen Zeit am richtigen Ort und in der richtigen Menge abgelesen werden, da es sonst zu Funktionsstörungen kommen kann.
Diktatur der Chromosomen?
Der Geschlechterforscher und Biologe Heinz-Jürgen Voß ist einer der wenigen Vertreter der biologischen Wissenschaften, der das Postulat aufstellt, dass es mehr als zwei Geschlechter gäbe und dass dies biologisch bewiesen sei. In einem Artikel des Tagesspiegel gibt er folgende Aussagen:
“Galt bis vor wenigen Jahren noch die DNS als heimliche „Diktatorin“ der Zelle, so wird sie nun entthront. Heute heißt es, dass die DNS nicht schon Information beinhalte und die Zelle über Abläufe informieren würde, vielmehr gibt es in der Zelle ein ganzes Netzwerk von Faktoren, die miteinander in Wechselwirkung stehen, sich zusammenlagern und letztlich entscheiden, welches tatsächlich wirksame Produkt hergestellt wird und wie ein Abschnitt der DNS abgelesen, das Produkt verändert und schließlich gefaltet werden muss, damit ein wirksames Produkt entsteht. Kurz gesagt: „Gene“ und DNS sagen eben nicht die Entwicklung eines Organismus beziehungsweise hier eines „Genitaltraktes“ voraus. Vielmehr stellen sie lediglich einen Faktor im komplexen Zusammenspiel von Faktoren der Zelle dar. So zeigte sich für einige Gene, die als bedeutsam für die Geschlechtsentwicklung angenommen werden, dass aus ein und demselben Gen mehr als zwei Dutzend unterschiedliche Produkte gebildet werden, die in der Zelle unterschiedliche Aufgaben erfüllen.” Quelle
Diesen Aussagen würde ich ohne Vorbehalt zustimmen. Schon in meinem Artikel zur Konstruktionsmorphologie habe ich nachgewiesen, dass Organismen mehr sind als die Summe ihrer genetischen Information. Ich möchte hier einige wichtige Zitate wiederholen:
Organismen können so auch nicht auf „Gen-Vehikel“ reduziert werden (vgl. DAWKINS 1976). Da lebende Organismen in den Dimensionen des Raumes und der Zeit existieren, lassen sie sich nicht aus der eindimensionalen Struktur der DNA ablesen (Rose 2000, VOGEL 1991). Dies zeigt alleine schon das oben erwähnte Beispiel der Muskelkontraktion durch Muskelantagonisten. Aus der Aktin- und Mysionstruktur (bzw. der dafür kodierenden Gene) lässt sich die Muskelarbeit nicht sinnvoll beschreiben, erst im Verband ist sie erklärbar. Wir haben es mit den Organismen um einen höheren und komplexeren Verband der Materie (vgl. ROSE 200: 109 – 111) zu tun, bei der neue Interaktionen und Beziehungen entstehen, die man nicht reduktionistisch durch Zerlegung in ihre Eigenbestandteile erklären kann. Folgerichtig kritisiert die Konstruktionsmorphologie den Reduktionismus der Molekularbiologen.
(…)
Gene enthalten zwar wichtige Materialinformationen, aber noch lange keine vollständige Bauinformation. Im genetischen Apparat und dessen Kodierung liegen nicht sämtliche notwendigen „Informationen“ für den Organismus vor (Gutmann 1997). So gibt es eine Vielzahl kleinerer und größerer Moleküle, wie Ionen, Polysaccharide und Proteine, ohne die die DNA nicht funktionsfähig wäre. Die Metapher der DNA als Buch des Lebens entspricht nicht der Realität. DNA ohne zelluläre Umgebung ist nutzlos.
(…)
Die Vorstellung, dass Gene direkt für komplexere Strukturen kodieren, ist eine Fehlkonzeption (LANGE 2012). Dieser Vorstellung schließt sich auch WEST-EBERHARD (2003) an, die in ihrem Werk nachweist, dass genotypische Veränderungen den phänotypischen folgen. Die Embryonalentwicklung wird als Motor der Evolution gesehen und die Embryonalentwicklung ist das Ergebnis vieler epigenetischer Regulationsprozesse. Änderungen dieser Prozesse werden durch Umwelteinflüsse angestoßen.
(…)
In dieser Hinsicht muss auch das von WEISMANN (1892a,b) aufgestellte Konzept der Keimbahn neu interpretiert werden. WEISMANN konnte nachweisen, dass sich in der Embryonalentwicklung vieler Tiergruppen die Urkeimzellen früh absondern und anders als die somatischen Zellen nicht an der Entwicklung des Organismus beteiligt waren. Entsprechend bestehen vielzellige Organismen aus den Keimzellen, die für die Fortpflanzung nötig sind und den somatischen Zellen, die die Körperfunktionen erfüllen. Die Zellenabfolge aus der die Keimzellen hervorgehen bezeichnet man dabei als Keimbahn. Die von der Keimbahn abzweigenden somatischen Zellen bilden den Körper (das Soma). Da durch die Keimbahn eine ununterbrochene Folge von Keimzellen entstehen, gelten diese als potentiell unsterblich. Die Körperzellen unterliegen dagegen einem natürlichen Tod (GRIESEMER 2002). Eine wichtige Folge dieser Beobachtung ist, dass die Keimzellen von den Somazellen nicht beeinflusst werden, womit die Vererbung erworbener Eigenschaften als widerlegt galt. WEISMANNS Vererbungstheorie bildet die theoretische Grundlage des „Zentralen Dogmas der Molekularbiologie“ (CRICK 1970). Grundaussage ist, dass keine Information von Protein zu Protein oder zu Nukleinsäure möglich ist. WATSON (1965) gibt eine vereinfachte Version des Zentralen Dogmas wider (DNA -> RNA -> Protein), während CRICK auch die Möglichkeit RNA -> DNA (z. B. beim Enzym Reverse Transkriptase) und DNA -> Protein zuließ. So richtig die Beobachtung von WEISMANN ist, so ist sie zum einen nicht universell, da Pflanzen, Pilze und einige Tiergruppen sowie die Einzeller keine Keimbahn entwickeln. Zum anderen, wenn man von einem kohärenten und operational geschlossenen energiewandelnden Organismus ausgeht, ist eine Unabhängigkeit der Keimzellen vom Rest des Organismus nicht möglich. Auch die Keimzellen sind in das kohärente System integriert, nicht zuletzt weil auch Keimzellen mit Energie gepowert werden müssen. Morphologisch lässt sich dies daran zeigen, dass jede Eizelle von Nährzellen (Keimbahn-Ursprung) und Follikelzellen (somatischer Ursprung) umgeben ist (WOLPERT 2007). Diese Zellen versorgen die Eizelle mit RNAs, Proteinen, Nährstoffen, Neurotransmittern und Hormonen. Diese Stoffe sind für die spätere Embryonalentwicklung unerlässlich. Die Konzentration dieser Stoffe, sowie deren Transport über die Nähr- und Follikelzellen wird über das neuro-hormonelle Netzwerk des Organismus gesteuert (CABEJ 2012, 2013). Nährstoffe wie Dotterproteine werden bei Vögeln und Amphibien in den Leberzellen gebildet und gelangen über das Blut zu den Eierstöcken. Dort werden die Proteine von der Eizelle durch Phagozytose aufgenommen (WOLPERT 2007). Von CRICK wird diese Einbahnstraße des Informationsflusses reduktionistisch verstanden, da die DNA zum Mastermolekül erhoben wird (ROSE 2000). Die Information die aber in den Nukleinsäuren gespeichert ist nur ein Teil der für die Proteine notwendigen Informationen. Die einzige Information, welche sich in der DNA befindet ist die Anordnung der Aminosäuren in einem Protein sowie entsprechende Regulationssequenzen. Aus der Anordnung der Aminosäuren alleine ergibt sich jedoch kein Bauplan eines Organismus (GUTMANN & BONIK 1981). Dies erkennt man alleine daran, dass ein Protein nur dann seine Wirkung entfalten kann, wenn es gefaltet ist, also eine dreidimensionale Struktur aufweist. Die Faltung der Proteine ist aber zu einem wesentlichen Bestandteil abhängig vom zellulären Umfeld (LEWONTIN 2002).
(…)
Auch die Genregulation, also wann ein bestimmtes Gen aktiviert oder abgeschaltet wird, ist in der DNA nicht codiert. JABLONKA & LAMB (2004) konnten auch zeigen, dass für die Vererbung „erworbener Eigenschaften“ eine Rückübersetzung von Protein zu DNA nicht notwendig ist, da die „erworbenen Eigenschaften“ keine Veränderungen der Aminosäurensequenz erfordern. Bei der Reaktion der Organismen auf veränderte Umweltbedingungen ändert sich nicht die Aminosäurensequenz, sondern die Menge bestimmter Proteine durch Genregulation. Genregulation ist ein komplexes Wechselspiel zwischen Genen, Organismus und Umwelt (vgl. CABEJ 2012, 2013, JABLONKA & LAMB 2004, GILBERT & EPEL 2009, LANGE 2012, LEWONTIN 2002). Desweiteren konnte gezeigt werden, dass bestimmte Proteine, sogenannte Prionen, in der Lage sind andere Proteine mit ähnlicher oder gleicher Aminosäurenzusammensetzung in ein Ebenbild ihrer eigenen Struktur umzubilden (JABLONKA & LAMB 2004, HALFMANN & LINDQUIST 2010). Dadurch wird der Informationsfluss von den Nukleinsäuren (DNA, RNA) zu den Proteinen weder falsch noch unnötig. Doch für die Konstruktion des Organismus ist dieser nicht entscheidend, da weder in den Nukleinsäuren noch in den Proteinen die Information für die Konstruktion der Organismen codiert ist.
Auch wenn diese Zitate manchem biologisch nicht versierten Leser nicht unbedingt verständlich sein könnten, ist die entscheidende Kernaussage, die man sich merken muss folgende: Gene, DNA und Chromosomen sind nur ein Teil des Gefüges sich entwickelnder Lebewesen. Sie spielen eine wichtige Rolle in der Entwicklung der Organismen, agieren aber niemals unabhängig von der Umwelt, sondern sind integraler Bestand von ihr und lassen sich ggf. von der Umwelt beeinflussen (WEST-EBERHARD 2003 konnte z. B. feststellen, dass umweltinduzierte Faktoren, z. B. Umweltgifte, Temperatur etc., dieselben phänotypischen Änderungen hervorrufen können wie Mutationen, ohne dass sich die DNA ändern muss). Teilweise ist eine Vererbung erworbener Eigenschaften möglich, da besonders die Eizelle in ihrem Zellplasma wichtige Stoffe für die zukünftige Entwicklung des Embryos einlagert. Die Einlagerung dieser Stoffe unterliegt den Stoffwechselmechanismus der Mutter. Gene sind nicht als kleine Diktatoren im Zentralkomitee des Chromosomenhauses zu verstehen, die unabhängig “Befehle” geben, wie sich ein Organismus zu entwickeln hat. Sie sind gleichberechtigter und ebenso abhängiger Bestandteil im Stoffwechselprozess der Zelle. In Teil 2 der Mars versus Venus-Reihe konzentrierte ich mich bei der Keimzellenbildung der stark auf die Chromosomen. Aber natürlich werden hierbei nicht nur die Chromosomen geteilt, sondern der gesamte Zellapparat (Zellplasma, Zellskelett, Organellen etc.).
Auch in Bezug zur Geschlechtsdetermination konnten wir sehen, dass zumindest bei einigen Arten ein Wechsel zwischen genetischer und temperaturabhängiger Geschlechtsentwicklung möglich ist.
Doch nichts von alledem deutet darauf hin, dass die Wechselwirkungen zwischen Genen und Umwelt die Existenz von mehr als zwei Geschlechtern beweisen. Natürlich wäre es falsch bzw. stark verkürzt, würde man die “Männlichkeit” alleine auf das Vorhandensein eines Y-Chromosomen reduzieren. Doch Geschlechter definieren sich, wie in Teil zwei angedeutet, durch ihre Funktion der Fortpflanzung (Produktion von Keimzellen) und nicht dadurch ob die nun durch die Temperatur oder das SRY-Gen determiniert werden!
An anderer Stelle schreibt Voß im selben Artikel:
“So wurden etwa in der Genetik in Modellversuchen an Mäusen mittlerweile ungefähr 1000 Gene als möglicherweise an der Geschlechtsentwicklung beteiligt beschrieben, von denen gerade einmal 80 etwas untersucht sind, durchaus mit widersprüchlichen Befunden. Die allermeisten dieser Gene finden sich im Regelfall nicht auf dem X- oder dem Y-Chromosom.”
Wir haben uns schon weiter oben mit der Rolle einiger Gene bei der Geschlechtsdetermination befasst. Wir haben feststellen können, dass nicht ein, sondern viele Gene daran beteiligt sind, die u. U. auch andere Funktionen im Organismus haben. Hier erzählt Voß nun wirklich nichts neues und die Existenz mehrerer Geschlechter beweist er auch nicht. Oder meint er etwa, dass nur weil bei Individuum A (mit XY) etwas mehr Testosteron produziert wird, als bei Individuum Nr. 2 (ebenfalls XY), dass wir hier von zwei Geschlechtern sprechen können?
Es ist wohl sinnvoll sich im nächsten Teil nun mit dem Thema der Intersexualität auseinanderzusetzen.
Literatur
ALBERTS, B. et. Al (2017): Molekularbiologie der Zelle. Wiley-VCH; Auflage: 6.
ATKINSON, N. (2004): Platypus has 10 sex chromosomes https://www.the-scientist.com/news-analysis/platypus-has-10-sex-chromosomes-49427
BARR ML, BERTRAM, EG: A Morphological Distinction between Neurones of the Male and Female, and the Behaviour of the Nucleolar Satellite during Accelerated Nucleoprotein Synthesis. In: Nature. 163, Nr. 4148, 1949, S. 676–7.
CARREL. L, et al. (1999): A first generation X-inactivation profile of the human X chromosome. Procl Natl Acad Sci USA. 1999, 96: 14440-14444.
DISTECHE, C. (2013): Dosage Compensation of the Sex Chromosomes. Annu Rev Genet. 2012; 46: 537–560. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3767307/
GILBERT, S. F., EPEL, D. (2009): Ecological Developmental Biology. Integrating Epigenetics, Medicine and Evolution. Sinauer Associates Inc. Publishers, Sunderland, Massachusetts USA
GILBERT, S. (2006): Developmental Biology. 8th Edition. Sinauer Associations
GRÜTZNER, F., GRAVES J.A.M., GRAVES J.A.M. (2004): A platypus’ eye view of the mammalian genome. Curr. Opin. Genet. Dev. 2004;14:642–649.
GRÜTZNER, F. et al. (2004):. In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes. Nature. 2004;432:913–917.
HAYES T. et al. (2010): Atrazine induces complete feminization and chemical castration in male African clawed frogs (Xenopus laevis) Proc Natl Acad Sci U S A. 2010 Mar 9; 107(10): 4612–4617. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2842049/
HAYES T. et al. (2011): Demasculinization and feminization of male gonads by atrazine: Consistent effects across vertebrate classes J Steroid Biochem Mol Biol. 2011 Oct; 127(0): 64–73. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4303243/
HOLLELY CE, et al. (2015): Sex reversal triggers the rapid transition from genetic to temperature-dependent sex. Nature 523: 79–82 (2015). https://www.ncbi.nlm.nih.gov/pubmed/26135451
HOLLELY CE, et al. (2016): Sex Reversal in Reptiles: Reproductive Oddity or Powerful Driver of Evolutionary Change? Sex Dev 2016;10:279–287 https://www.karger.com/Article/FullText/450972
JANZEN, F.J. & PAUKSTIS (1991a): A preliminary test of the adaptive significance of environmental sex determination in reptiles. Evolution, 45: 435-440
JANZEN, F.J. & PAUKSTIS (1991b): Environmental sex determination in reptiles: Ecology, evolution and experimental design. Q. Rev. Biol., 66: 149-179
LAHN B, PAGE D (1999): Four evolutionary strata on the human X chromosome. Science. 1999, 286: 964-967.
LI, H. et al. (2016): The behavioural consequences of sex reversal in dragons Proc Biol Sci. 2016 Jun 15; 283(1832): 20160217. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4920310/
LITERMAN, R. et al.(2017): Development of sexing primers in Glyptemys insculpta and Apalone spinifera turtles uncovers an XX/XY sex-determining system in the critically-endangered bog turtle Glyptemys muhlenbergii Conservation Genet Resour December 2017, Volume 9, Issue 4, pp 651–658 https://link.springer.com/article/10.1007/s12686-017-0711-7
LYON MF (1961): Gene Action in the X-chromosome of the Mouse (Mus musculus L.) (abstract) In: Nature. 190, Nr. 4773, 1961, S. 372–3. https://www.nature.com/articles/190372a0
LYON M (1992): Some milestones in the history of X-chromosome in activation. Annu Rev Genet. 1992, 26: 17-28.
MANOLAKOU, P., et al. (2006): Molecular patterns of sex determination in the animal kingdom: a comparative study of the biology of reproduction Reproductive Biology and Endocrinology20064:59 https://rbej.biomedcentral.com/articles/10.1186/1477-7827-4-59
MATSON et al. (2010): The mammalian Doublesex homolog DMRT1 is a transcriptional gatekeeper that controls the mitosis versus meiosis decision in male germ cells Dev Cell. 2010 Oct 19; 19(4): 612–624. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2996490/
MONTIEL EE et al. (2017): Discovery of the youngest sex chromosomes reveals first case of convergent co-option of ancestral autosomes in turtles. Chromosoma. 2017 Feb;126(1):105-113. https://www.ncbi.nlm.nih.gov/pubmed/26842819
NAMEKAWA, SH & LEE JT (2009): XY and ZW: Is Meiotic Sex Chromosome Inactivation the Rule in Evolution? PLoS Genet. 2009 May; 5(5): e1000493. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2679206/
PAGE D, et al. (1984): Occurrence of a transposition from the X chromosome long arm to the Y chromosome short arm during human evolution. Nature. 1984, 311: 119-123.
PASK, BEHRINGER & RENFREE (2001): Expression of DMRT1 in the mammalian ovary and testis–from marsupials to mice. Cytogenet Genome Res. 2003;101(3-4):229-36. https://www.ncbi.nlm.nih.gov/pubmed/14684988
PAYER B, LEE JT (2008): X Chromosome Dosage Compensation: How Mammals Keep the Balance. In: Annual review of genetics. August 2008. Vol. 42:733-772 https://www.annualreviews.org/doi/10.1146/annurev.genet.42.110807.091711
POKORNÁ, M. & KRATOCHVÍL, L. (2009): Phylogeny of sex-determining mechanisms in squamate reptiles: are sex chromosomes an evolutionary trap? Zoological Journal of the Linnean Society, 2009, 156, 168–183. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1096-3642.2008.00481.x
QUINN AE, et al. (2007): GTemperature sex reversal implies sex gene dosage in a reptile. Science 316 :41 https://www.ncbi.nlm.nih.gov/pubmed/17446395
QUINN AE, et al. (2011): Evolutionary transitions between mechanisms of sex determination in vertebrates. Biol Lett 7: 443–448. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3097877/
SARRE SD, EZAZ T, GEORGES A (2011): Transitions between sex-determining systems in reptiles and amphibians. Annu Rev Genom Hum Genet 12: 391–406. https://www.ncbi.nlm.nih.gov/pubmed/21801024
SCHWANZ LE,et al (2013): Novel evolutionary pathways of sex-determining mechanisms. J Evol Biol 26: 2544–2557 https://www.ncbi.nlm.nih.gov/pubmed/24118347
Spektrum.de: Geschlechtsbestimmung https://www.spektrum.de/lexikon/biologie-kompakt/geschlechtsbestimmung/4773
VALLENDER, E. & LAHN, B. T. (2006): Multiple independent origins of sex chromosomes in amniotes Proc Natl Acad Sci U S A. 2006 Nov 28; 103(48): 18031–18032.
VEYRUNES F et al. (2008): Bird-like sex chromosomes of platypus imply recent origin of mammal sex chromosomes. Genome Research 18: 965–973. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2413164/
WATSON JM, et al (1991): Sex chromosome evolution: Platypous gene mapping suggests that part of the human X chromosome was originally autosomal. PNAS. 1991, 88: 11256-11260.
WEST-EBERHARD, M. J. (2003): Developmental Plasticy and Evolution. Oxford University Press
WETS, B. A., EWERT,M., TALENT, L. G., NELSON, C. E. (1994): Sex-Determining mechanisms in Squamate Reptiles. Journal of Experimental Zoology 270:45-56 (1994) http://www.lacerta.de/AS/Bibliografie/BIB_1987.pdf
WOLPERT, L., JESSELL, T., LAWRENCE, P., MEYEROWITZ, E., ROBERTSON, E., SMITH, J. (2007): Principles of Development. Das Original mit Übersetzungshilfen. Third Edition. Spektrum-Verlag Berlin Heidelberg


