Text als pdf
Telluraves
In den Kronen der Wälder, auf weiten Savannen und sogar in den Städten begegnen uns Vertreter einer erstaunlich vielfältigen Vogelgruppe: der Telluraves. Diese Klade vereint die „irdischen Vögel“ – eine große Teilgruppe der Neoaves, die vor etwa 60 Millionen Jahren begann, unseren Planeten zu erobern. Trotz ihrer ökologischen und morphologischen Vielfalt eint sie ein gemeinsamer evolutionärer Ursprung. Bedenkt: für die Palaeognathe, den eigentlichen Laufvögeln, haben wir eine Episode gebraucht, die Galloansere, also die Gänse- und Entenvögel wurden auch in einer Episode vorgestellt. Die Neoaves vereinen 10 Hauptkladen und in den vorherigen 8 Episoden behandelten wir 9 von diesen. Aber die 10. Neoavesgruppe können wir unmöglich in einer Episode abarbeiten, denn dafür ist sie zu vielfältig.
Zu den Telluraves gehören mehrere Großgruppen, darunter die Sperlingsvögel, die mit über 6.000 Arten die mit Abstand artenreichste Vogelordnung darstellen, die Spechttvögel, die Rackenvögel, Nashornvögel, Eulenvögel, aber auch die Papageien, Falken und Greifvögel. Diese enorme Bandbreite reicht von winzigen Spatzen bis zu majestätischen Adlern und Bussarden.
Innerhalb der Telluraves lassen sich zwei große Hauptkladen unterscheiden: die Afroaves und die Australaves. Während die Afroaves unter anderem die Greifvögel, Eulen, Rackenvögel, Nashornvögel und Spechte umfassen und ihren Ursprung in Afrika hatten, gehören zu den Australaves die faszinierenden Falken, Papageien und vor allem die artenreiche Ordnung der Sperlingsvögel. Die Namensgebung deutet darauf hin, dass die Australaves ursprünglich ihre Wurzeln in Australien und vielleicht auch Südamerika hatten. Sowohl Afroaves als auch Australaves spiegeln die tiefen geographischen und evolutionären Trennungen wider, die durch den Zerfall des Südkontinents Gondwanas entstanden sind. Hier setzt die Geschichte der Afroaves besonders an – eine Untergruppe, deren Name auf ihren vermuteten Ursprung in Afrika verweist.
Innerhalb dieser Afroaves stechen die Accipitrimorphae hervor – eine Gruppe, die zu den bekanntesten und am meisten bewunderten Vögeln zählt: die Greifvögel. Diese beeindruckenden Jäger, zu denen Adler, Bussarde, Milane und Geier gehören, haben sich durch perfekte Anpassungen an das Leben als Spitzenprädatoren einen festen Platz in vielen Ökosystemen gesichert. Ihre scharfen Krallen, ausgezeichneten Augen und kraftvollen Flügel machen sie zu Symbolen für Kraft und Freiheit – und zu einem faszinierenden Kapitel in der Evolution der Vögel (Ericson et al. 2006, Hackett et al. 2008, Houde et al. 2008, Jarvis et al. 2014, Kimball et al. 2013, Kuhl et al. 2021, Mirarab et al. 2024, Prum et al. 2015, Reddy et al. 2017, Sangster et al. 2022, Stiller et al. 2024, Suh et al. 2016, Winkler et al. 2015, Wu et al. 2024, Abb. 1).
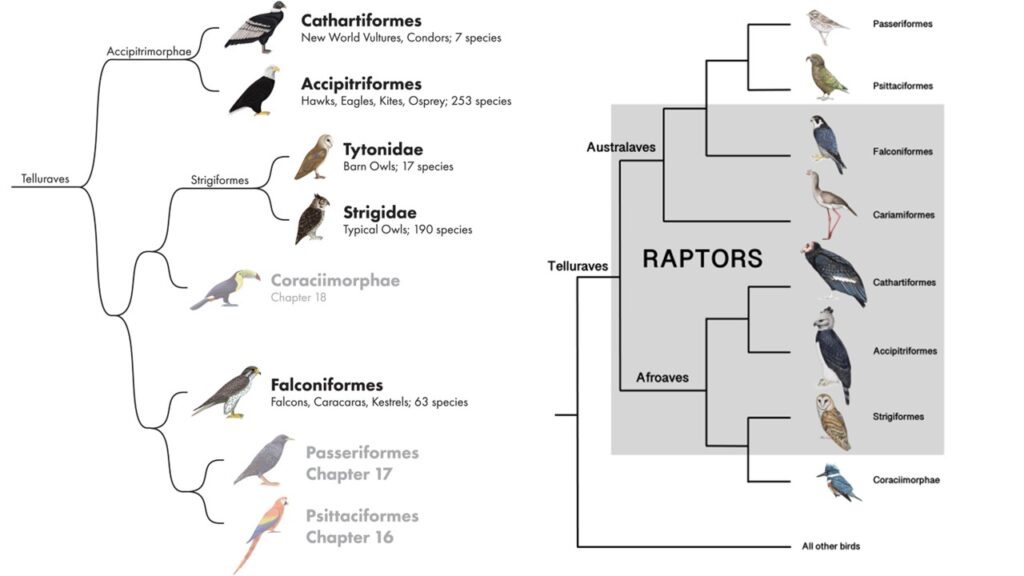
Abb. 1: Kladogramm der Telluraves
In diesem Video tauchen wir ein in die spannende Evolutionsgeschichte dieser Vogelgruppen, von den Ursprüngen der Telluraves bis hin zu den gefiederten Jägern der Lüfte.
Innerhalb der Accipitrimorphae finden sich vier Familien: die Neuweltgeier (Cathartidae), Sekretäre (Sagittariidae), Fischadler (Pandionidae) und Habichtartige (Accipitridae). Manchmal werden die Neuweltgeier in eine eigene Ordnung gestellt, den Cathartiformes, während die anderen drei Familien zu den eigentlichen Greifvögeln, der Ordnung den Accipitriformes, gestellt werden. Die Falken sehen trotz ihrer Ähnlichkeit mit den Greifvögeln nicht in diese Gruppe. Früher wurden alle diese 5 Familien als Greifvögel in die Ordnung Falconiformes zusammengefasst. Aber neueste molekulare Phylogenien zeigen, dass die Falken eine eigene Ordnung bilden, die sich auch nicht bei den Afroaves, sondern Australaves findet. Falken und Greifvögel entwickelten ihre Merkmale also konvergent und tatsächlich sind die Falken mit Papageien enger verwandt als mit Adlern. Auch die Neuweltgeiern wurden zwischenzeitlich in die Nähe der Storchenverwandtschaft gestellt (vgl. Sibley & Ahlquist 1990); das gilt aber schon längst als überholt.
Neuweltgeier (Cathartiformes)
Die Neuweltgeier (Cathartidae) kommen auf dem amerikanischen Doppelkontinent vor und sind mit den Altweltgeiern, die alle zu den Habichtartigen gehören, nur entfernt verwandt (Del Hoyo 2020, Del Hoyo et al. 1994, Winkler et al. 2015, Winkler et al 2020a, Abb. 2). Die Neuweltgeier unterscheiden sich von den Altweltgeiern durch das Fehlen einer Nasenscheidewand und den gut entwickelten Geruchssinn, während die Altweltgeier sich vor allem auf ihre Augen verlassen. Ihrem guten Geruchsinn ist es auch zu verdanken, dass Neuweltgeier auch in den tropischen Regenwaldgebieten vorkommen, die Altweltgeier für gewöhnlich meiden. Es gibt 7 Arten in 5 Gattungen. Der größte von ihnen ist der Andenkondor (Vultur gryphus), einer der größten flugfähigen Vögel der Erde und neben dem Wanderalbatros jener mit der größten Flügelspannweite. Der Kalifornische Kondor (Gymnogyps californianus) kommt vor allem in Kalifornien und Arizona vor, was historisch aber bis in den Südwesten Kanadas verbreitet. Infolge aktiver Bejagung und passiver Vergiftung durch Pestizide wie DDT nahm sein Bestand insbesondere in der ersten Hälfte des 20. Jahrhunderts dramatisch ab. Von 1987 bis 1992 galt er in freier Wildbahn als ausgestorben, es gab aber noch 27 Individuen in Zoos. Durch intensive Zuchtbemühungen wurde die Art vorm aussterben bewahrt und es existieren heute insgesamt über 500 Tiere, davon über 300 in einigen Nationalparks Kaliforniens und Arizonas, die restlichen in Zoos (US Fish and Wildlife Service). Truthahngeier (Cathartes aura) und Rabengeier (Coragyps atratus) kommen vom Süden der USA bis Feuerland praktisch in allen Lebensräumen vor. In Mittel- und Südamerika kommen zudem Königsgeier (Sarcoramphus papa), sowie der Große (Cathartes melambrotus) und Kleine Gelbkopfgeier (Cathartes burrovianus) vor.

Abb. 2: Neuweltgeier
Wie bei den Altweltgeiern gibt es an größeren Kadavern eine feste Hierarchie zwischen den verschiedenen Arten. Nur die beiden Kondorarten sind in der Lage, bei größeren toten Säugetieren die Haut aufzureißen. In den Regenwäldern dominiert der Königsgeier, der noch mittelgroße Kadaver von Affen oder Faultieren öffnen kann. Rabengeier fressen vor allem Muskelfleisch und Eingeweide. Die übrigen drei Arten fressen wesentlich langsamer und nagen vor allem Fleischreste von den Knochen.
Fossil sind die Neuweltgeier auch nicht auf Amerika beschränkt. Es gab fossile Neuweltgeier in Europa, Afrika und Asien und wiederrum Altweltgeier in Amerika. Es gibt allerdings keine fossilen Überreste von Neuweltgeiern in Europa, Asien oder Afrika, die jünger als 20 Mio. Jahre sind. Zu den europäischen fossilen Neuweltgeiern gehören Gattungen wie Diatropornis und Parasarcoramphus aus dem Eozän und Oligozän. Altweltgeier überlebten in Amerika bis zum späten Pleistozän vor 10.000 Jahren. Aus dem Pliozän vor fünf Millionen Jahren kennt man einen gemeinsamen Vorfahren von Andenkondor und Königsgeier. Seit dem frühen Pleistozän vor zwei Millionen Jahren können der Rabengeier, der Truthahngeier und der Kalifornische Kondor zusammen mit anderen, inzwischen ausgestorbenen Neuweltgeiern fossil nachgewiesen werden. Einige ausgestorbene Neuweltgeiergattungen aus dem Eozän und Miozän sind z. B. Phasmagyps, Brasilogyps und Perugyps (Olson 1985, Alvarenga 1985, Emslie 1988; Stucchi and Emslie 2005; Stucchi et al. 2015, Mayr 2016).
Vom oberen Oligozän bis zum Pleistozän gab es die Teratornithidae, die viele Übereinstimmungen mit den Neuweltgeiern teilen. Zu ihnen gehören mit Teratornis und Argentavis die größten fliegenden Vögel. Teratornis aus Nordamerika hatte eine Flügelspannweite von über 3,5 Meter, Argentavis erreichte eine Flügelspannweite von über 7 Metern mit einem Gewicht von 72 kg. Zwei weitere Gattungen, Aiolornis und Cathartornis sind nur von wenigen Knochen bekannt. 2002 wurde mit Taubatornis aus dem oberen Oligozän Brasiliens der bislang älteste Teratornithidae entdeckt (Olson & Alvarega 2002, Mayr 2009, 2016, Campbell & Tonni 1980, 1983, Campbell et al. 1999, Chatterjee et al. 2007).
Sekretäre (Sagittariidae)
Die Familie der Sekretäre (Sagittariidae) besteht aus nur einer Art (Sagittarius serpentarius), die die Savannen Afrikas südlich der Sahara bewohnt und sich überwiegend von Insekten, kleinen Säugetieren und auch Schlangen ernährt (Del Hoyo 2020, Del Hoyo et al. 1994, Winkler et al. 2015, Winkler et al 2020b, Abb. 3). Ihre Beute töten sie mit Fußtritten ihrer langen Beine. Die Nahrung wird ausschließlich am Boden gesucht, wobei der Vogel am Tag zwischen 20 und 30 km zurücklegen kann. Wegen seines einzigartigen Körperbaus, der zum Teil eher an Seriemas, Trappen oder Kraniche erinnert und ihn so von allen anderen Greifvögeln unterscheidet, wird der Sekretär in eine eigene Familie gestellt. Er erreicht eine Standhöhe von etwa 1,20 m und wiegt über 4 Kilo. Ihr Kopf ist klein mit großen bewimperten Augen und hakenförmigem Schnabel. Das Nackengefieder ist zu einer charakteristischen, langen und schütteren Haube verlängert, die aufgestellt oder an den Nacken angelegt werden kann. Möglicherweise geht der Name „Sekretär“ auf dieses Merkmal zurück, da die Federn der Haube wie hinter das Ohr gesteckte Federkiele wirken. Sekretäre kommen heute nur in Afrika vor, waren aber prähistorisch weiterverbreitet, wie die Gattung Pelargopappus aus dem Oligozän Frankreichs belegt (Mourer-Chauviré & Cheneval 1983). In Afrika findet sich fossil die Gattung Amanuensis aus dem Miozän Namibias (Mourer-Chauviré 2003).
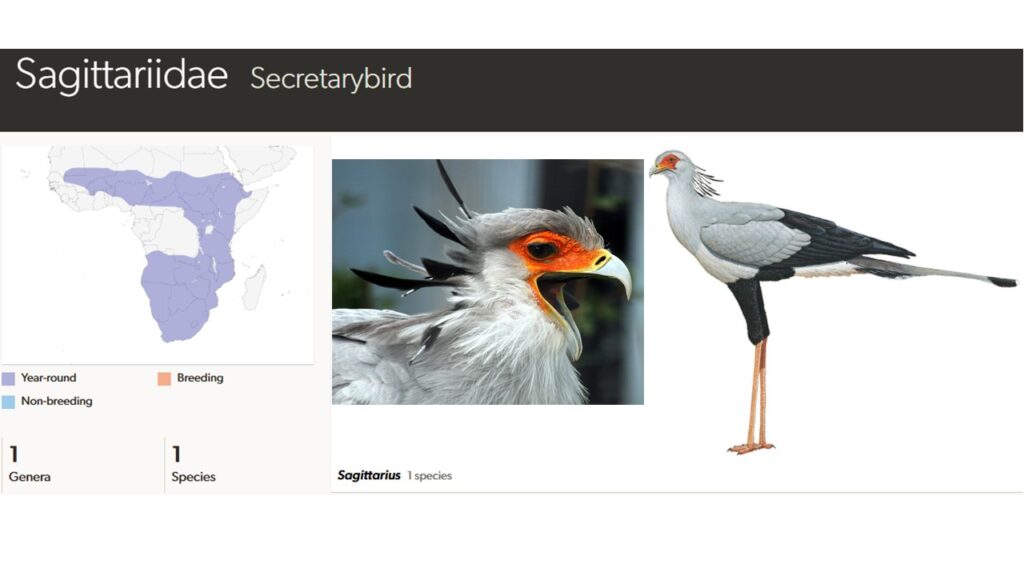
Abb. 3: Sekretäre
Fischadler (Pandionidae)
Die Familie der Fischadler (Pandionidae) bestehen ebenfalls aus nur einer Art (Pandion haliaetus) und ist nicht direkt mit den anderen als „Adler“ bezeichneten Greifvögeln verwandt (Del Hoyo 2020, Del Hoyo et al. 1994, Winkler et al. 2015, Winkler et al 2020c, Abb. 4). Fischadler haben eine Flügelspannweite von 1,20 bis 1,70 m. Der weiße Kopf zeigt einen dunkelbraunen Augenstreif, der sich von der Schnabelbasis bis zum Nacken zieht. Die Nahrung besteht fast ausschließlich aus See- und Süßwasserfischen. In Anpassung an seine hochspezialisierte Ernährung zeigt der Fischadler zahlreiche besondere Merkmale. So sind die Nasenlöcher schräg und schlitzförmig. Der kräftige Tarsometatarsus ist bis auf den obersten Teil unbefiedert. Die kurzen, aber sehr kräftigen Zehen haben auf der Unterseite viele kleine, dornartig zugespitzte Schuppen, die äußere (dritte) Zehe kann nach hinten gedreht werden. Die Krallen sind ein diagnostisches Merkmal der Fischadler und unterscheiden sich von anderen Greifvögeln: Sie sind im Querschnitt oval und nicht, wie bei fast allen anderen Greifvögeln, auf der Unterseite konkav.
Fischadler sind mit Ausnahme der Antarktis weltweit verbreitet. Je nach geographischer Lage ist der Fischadler Standvogel bis Langstreckenzieher. Die nordamerikanischen Fischadler überwintern in Südamerika, die eurasischen Vögel überwintern überwiegend jedoch in Afrika und in Süd- und Südostasien. Die Brutvögel Floridas, der Karibik, des Mittelmeerraumes, der Arabischen Halbinsel, Südostasiens und Australiens sind überwiegend Standvögel. Fischadler werden in bis zu vier Unterarten aufgeteilt, entsprechend ihrer Brutgebiete in Eurasien, Nordamerika, Karibik und im Indo-australischen Raum. Einige ordnen die Unterart im Indo-australischen Raum als eigenständige Art ein.
Zwei fossile Arten der Fischadler sind aus dem Miozän von Kalifornien und Florida bekannt: Pandion homalopteron und Pandion lovensis. Es gibt noch ältere, aber fragmentarische Überreste in Ägypten. Ein weiterer Fund von Fischadlerkrallen stammt aus dem Oligozän des Mainzer Beckens (Mayr 2006, 2016, Olson 1985).
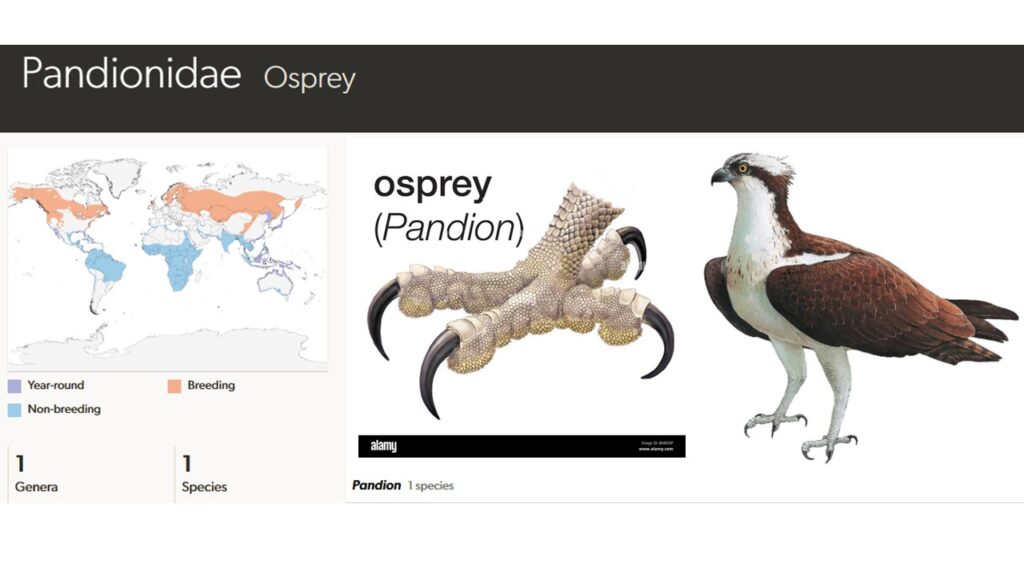
Abb. 4: Fischadler
Habichtartige (Accipitridae)
Zu den Habichtartigen zählen Adler, Bussarde, Habichte, Sperber, Milane, Weihen und die Altweltgeier (Del Hoyo 2020, Del Hoyo et al. 1994, Winkler et al. 2015, Winkler et al 2020d, Ferguson-Lees & David 2001). Insgesamt über 250 Arten in etwa 70 Gattungen – die genauen Zahlen variieren in der Literatur – mit weltweiter Verbreitung mit Ausnahme der Antarktis. Der größte Artenreichtum findet sich in tropischen Regionen.
Zu den kleinsten Vertretern gehören der südamerikanische Perlaar (Gampsonyx swainsonii) und afrikanische Zwergsperber (Tachyspiza minulla) mit einer Flügelspannweite zwischen 45 und 55 cm und einem Gewicht von 74 bis 105 g. Der eurasische Mönchsgeier (Aegypius monachus) ist mit einer Flügelspannweite von bis zu knapp 3m und einem Gewicht von 12 kg einer der größten Vertreter der Familie. Der im 14. Jh. ausgestorbene Haastadler (Hieraaetus moorei) aus Neuseeland war mit bis zu 16 kg sogar noch größer (Worthy & Holdaway 2003, Brathwaite 1992, Tennyson & Martinson 2006, Bunce et al. 2005). Bei den meisten Habichtartigen sind die Weibchen größer und schwerer als die Männchen, bei einigen Habichten kann dieser Unterschied zwischen 25-50% liegen, bei den Altweltgeiern ist dieser Größenunterschied zwischen den Geschlechtern kaum vorhanden. Bei einigen Arten gibt es auch Unterschiede in der Gefiederfarbe, so bei den Weihen (Paton et al. 1994, Ferguson-Lees & David 2001).
Der kräftige und hakenförmig gebogene Schnabel ist ein Erkennungszeichen dieser Vögel, genauso wie ihre Fänge mit scharfen Krallen. Die Fänge der verschiedenen Arten variieren je nach Beutespektrum – lang und dünn bei den vogeljagenden Sperbern, während Arten, die große Säugetiere jagen, viel dickere und stärkere Fänge haben.
Habichartige haben ein außergewöhnlich gutes Sehvermögen. Große Augen mit zwei Sehgruben in der Netzhaut sorgen für binokulares Sehen und für die Bewegungs- und Entfernungsbeurteilung. Darüber hinaus haben sie die größten Pecten aller Vögel (Abb. 5). Das sind Vorsprünge an der Austrittsstelle des Sehnervs im Vogelauge, welche stark durchblutet sind und die Sehschärfte erhöhen. Die Augen sind röhrenförmig und können sich in ihren Augenhöhlen kaum bewegen. Neben dem ausgezeichneten Sehvermögen haben viele Arten auch ein ausgezeichnetes Gehör, aber anders als bei Eulen ist der Sehsinn im Allgemeinen der Hauptsinn, der bei der Jagd eingesetzt wird. Ihr Geruchsystem ist ebenfalls gut entwickelt (Mitkus et al. 2018, Martin 1986, Reymond 1985, Potier 2020).
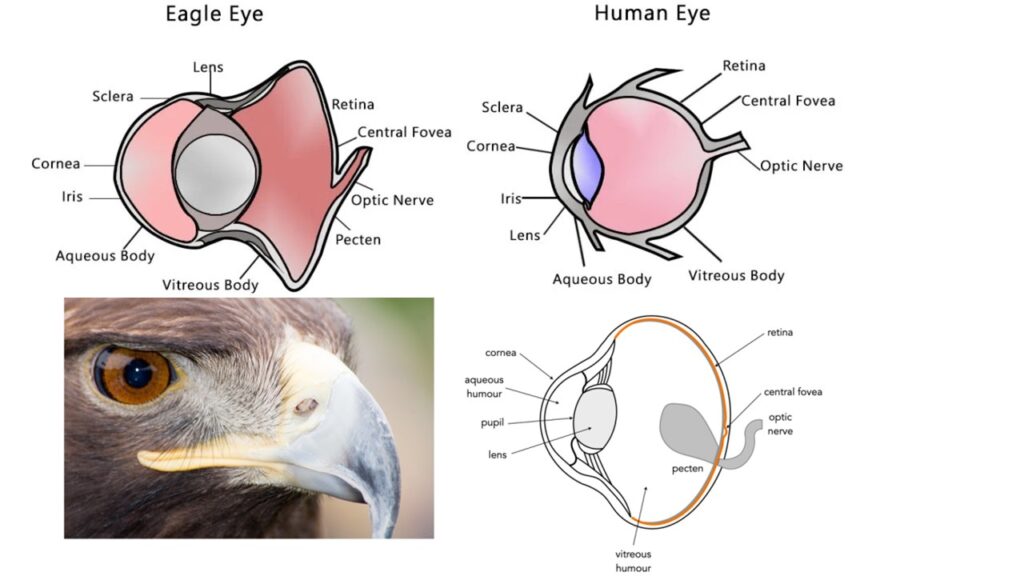
Abb. 5: Augen der Habichtartigen
Das Nahrungsspektrum der verschiedenen Arten reicht von Insekten und Schnecken bis hin zu mittelgroßen Säugetieren. Einige Arten sind auch auf bestimmte Beute spezialisiert, wie Schlangenadler (Circaetus), Wespenbussard (Pernis apivorus), Schneckenbussard (Rostrhamus sociabilis) und Fledermausaar (Macheiramphus alcinus). Geier fressen fast ausschließlich Aas, einige Arten auch Exkremente. Der Palmgeier (Gypohierax angolensis) ist sogar auf Früchte spezialisiert.
Beim Nestbau und Aufzucht der Jungen sind beide Geschlechter beteiligt. Je nach Art werden 1 bis 6 Eier gelegt – bei mehreren Eiern werden diese nicht zeitgleich gelegt, sodass die älteren Jungtiere stärker sind und die jüngeren Geschwister töten. Wie schon bei anderen Vogelfamilien erwähnt ist der Vorteil dieser Strategie, dass im Falle des Todes des ältesten, stärksten Nestlings eines der kleineren Geschwister dessen Platz einnehmen kann.
Sobald die Jungtiere unabhängig von ihren Eltern sind, wandern sie oft für einige Jahre umher, bevor sie die Geschlechtsreife erlangen. Die meisten Arten haben in ihrem unreifen Stadium ein ausgeprägtes Federkleid, das ihnen als visueller Hinweis für Artgenossen dient und es ihnen ermöglicht, Revierkämpfe zu vermeiden. Kurz nach Erreichen der Geschlechtsreife bilden sich Paare, bei denen das Männchen in der Regel durch Zurschaustellung – oft im Flug, manchmal aber auch lautstark – versucht, ein Weibchen für sich zu gewinnen. Viele Habichtartige brüten mehrere Jahre oder ein Leben lang mit demselben Partner, obwohl dies nicht bei allen Arten der Fall ist, und wenn ein Partner stirbt, versucht der verwitwete Vogel in der nächsten Brutsaison einen neuen Partner zu finden.
Die Habichtartigen werden in mehr als 10 Unterfamilien unterteilt. Grundsätzlich ist hier anzumerken: die Bezeichnung „Adler“, „Habicht“, „Bussard“, „Weihe“, „Geier“ oder „Milane“ stellen nicht unbedingt natürliche taxonomische Gruppen dar. Vieles, was wir als „Adler“ bezeichnen sind i. d. R. große Beutegreifer, die aber verschiedenen Unterfamilien angehören können (Mindell et al. 2018, Starikov & Wink 2020, Sangster et al. 2021, Gill et al. 2022, Catanach et al. 2024, Lerner & Mindell 2005, Griffith et al. 2007, Kruckenhauser et al. 2004, Abb. 6).
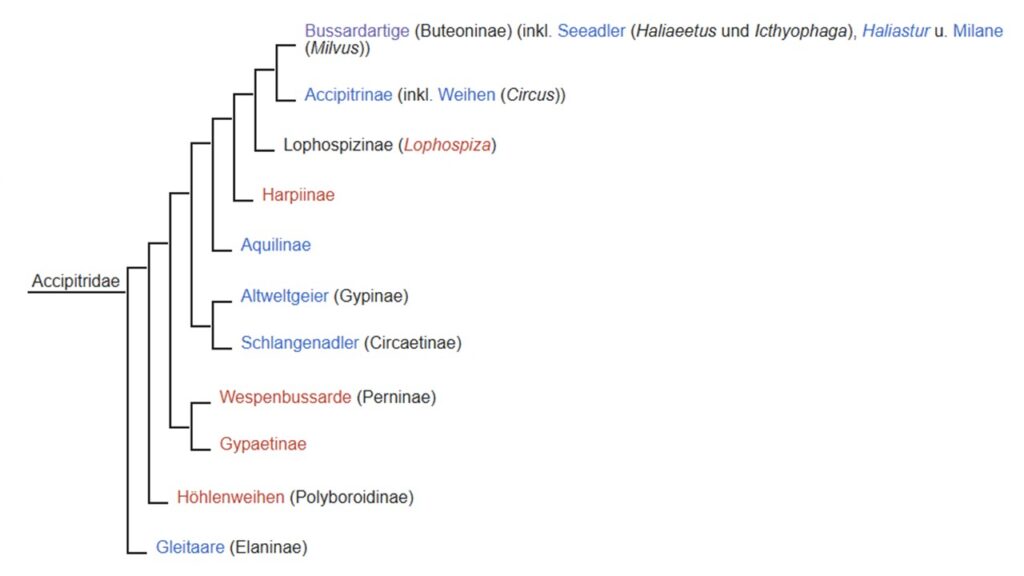
Abb. 6: Phylogenie der Habichtartigen
Elaninae – Gleitaare
Gleitaare sind die ursprünglichste Unterfamilie und haben 6 Arten in 3 Gattungen in Süd-, Mittel- und dem südlichen Nordamerika, Afrika, Südeuropa, dem Nahen Osten, tropischen Asien und Australien (Elanus, Chelictinia, Gampsonyx, Abb. 7). Sie sind überwiegend weiß oder grau gefärbt. Die Augen sind rot, orange oder kastanienfarben. Das Gewicht beträgt etwa 90 bis 400 g, die Flügelspannweite 45 bis 100 cm. Damit gehören sie zu den kleinen Vertretern der Familie. Der Schädel der Gleitaare gilt als primitiv und ist dem Schädel anderer Habichtartiger in einem bestimmten Stadium der Embryonalentwicklung ähnlich. Das Brustbein ähnelt dem der Fischadler und die ersten Rippen der Halswirbelsäule sind mit den Wirbeln verwachsen.

Abb. 7: Gleitaare
Gypaetinae – Bartgeier, Schmutzgeier, Palmgeier und Höhlenweihen
Die Unterfamilie der Gypaetinae umfasst einige Geierarten, nämlich jene, die einen befiederten Kopf haben. Hierzu zählen der Bartgeier (Gypaetus barbatus), Schmutzgeier (Neophron percnopterus) und Palmgeier (Gypohierax angolensis). Traditionell wurden sie zu den Altweltgeiern gezählt, werden nach neuesten Studien jedoch von diesen ausgegliedert. Hinzu kommt noch die Gattung der Höhlenweihen (Polyboroides) mit zwei Arten in Madagaskar und Afrika (Abb. 8).
Bartgeier (Gypaetus barbatus) haben eine Flügelspannweite von bis zu 2,8 m und werden bis zu 7 kg schwer. Auffällige borstenartige schwarze Federn hängen dem Bartgeier über den Schnabel und gaben ihm seinen Namen. Sie kommen in den Bergregionen Afrikas, Asiens und Europas vor. Bei Bartgeiern gab es – besonders in den Alpen – den Irrglauben, dass sie Schafe jagen würden, weswegen sie stark bejagt und in den Alpen noch vor dem ersten Weltkrieg ausgestorben sind. Intensive Zuchtprogamme in zoologischen Gärten hatten dafür gesorgt, dass ab den 1970er Bartgeier in den Alpen wieder ausgewildert werden konnten. Bis 2019 wurden 227 Bartgeier ausgewildert. Eine Besonderheit dieser Tiere ist ihre Nahrung: Erwachsene Tiere ernähren sich überwiegend von Knochen toter Tiere (während Jungtiere noch auf Muskelfleisch angewiesen sind). Sind die Knochenstücke zu groß, lassen sie diese aus großer Höhe auf Felsen fallen und fressen die. Wegen des geringen Wassergehaltes der Knochen trinken Bartgeier häufig. Sie sind daher auf Frischwasserquellen in ihrem Lebensraum angewiesen und nehmen auch Schnee auf, um ihren Durst zu stillen.
Schmutzgeier (Neophron percnopterus), welche in Afrika, Südeuropa und Zentral- bis Südasien vorkommen, verdanken ihren Namen daher, dass sie auf Müllkippen nach essbarem suchen und sogar Exkremente fressen. Aber auch sie haben eine außergewöhnliche Fähigkeit. Sie sind in der Lage mit Steinen Straußeneier zu knacken um an den nahrhaften Inhalt zu kommen. Der afrikanische Palmgeier (Gypohierax angolensis) ist für Greifvögel sogar noch spezialisierter. Diese, hauptsächlich in Regenwäldern lebende Art ernährt sich vorwiegend von Palmfrüchten. Das Nahrungsspektrum des Palmgeiers ist jedoch sehr breit und umfasst neben Früchten auch Fische und andere kleine Wirbeltiere sowie Wirbellose und Aas jeder Größe.
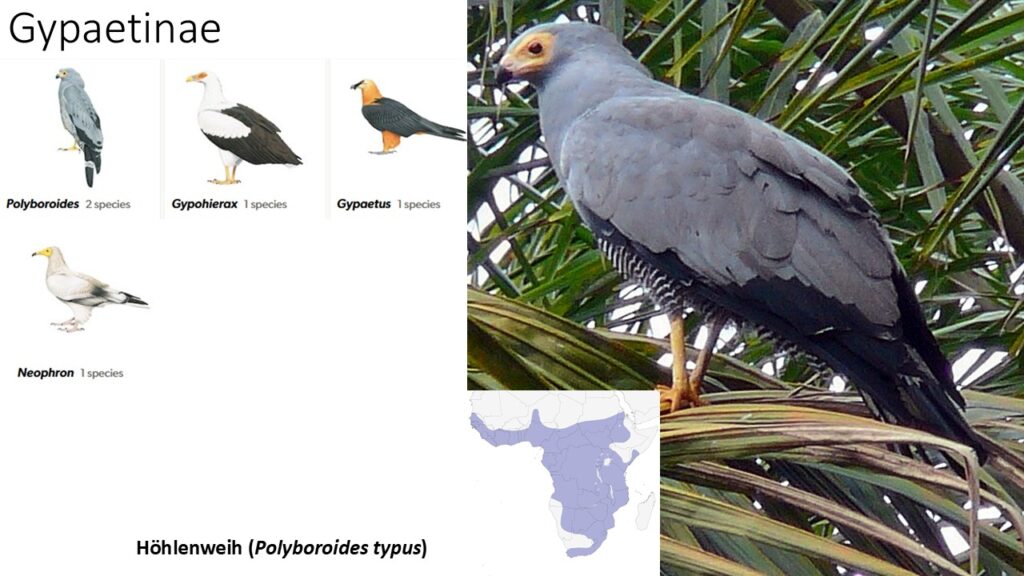
Abb. 8: Gypaetinae
Perninae – Wespenbussarde und Verwandte
Zur Unterfamilie der Perninae gehören die Wespenbussarde (Pernis). Es gibt vier Arten, die hauptsächlich in Asien vorkommen. Der eigentliche Wespenbussard (Pernis apivorus) brütet in Europa und überwintert in Afrika. Der deutsche Name bezieht sich auf die besondere Nahrung, die vor allem aus der Brut sozialer Faltenwespen der Gattung Vespula besteht. Der Wespenbussard zeigt in Anpassung an diese spezielle Nahrung zahlreiche morphologische Besonderheiten, so sind die Nasenlöcher schlitzförmig, insbesondere das Kopfgefieder ist sehr steif und die Füße sind für eine grabende Tätigkeit optimiert. In diese Unterfamilie gehören weiterhin 8 weitere Gattungen mit 15 Arten (Aviceda, Leptodon, Lophoictinia, Hamirostra, Elanoides, Henicopernis, Chondrohierax, Eutriorchis), die teilweise als Weihen bezeichnet werden, z. B. der Langschwanzweih (Henicopernis longicauda) aus Neuguinea und der Kuckucksweih (Aviceda cuculoides) aus Afrika (Abb. 9).

Abb. 9: Perninae
Circaetinae – Schlangenadler
Unterfamilie der Schlangenadler (Circaetinae) umfasst mittelgroße bis sehr große Arten mit meist sehr breiten Flügeln und einem großen Kopf. Fünf Gattungen mit 16 Arten sind in Asien und Afrika beheimatet (Circaetus, Dryotriorchis, Terathopius, Spilornis, Pithecophaga, Abb. 10). Die meisten Arten sind auf Schlangen und Eidechsen als Nahrung spezialisiert, aber nicht nur.
Die Gattung der Schlangenadler (Circaetus) mit 6 Arten kommen in Afrika vor, wobei der gewöhnliche Schlangenadler (Circaetus gallicus) auch in Europa brütet. In Afrika kommt zudem die Gattung der Kongo-Schlangenadler (Dryotriorchis spectabilis; neuerdings aber zur Gattung Circaetus gestellt) und der Gaukler (Terathopius ecaudatus) mit jeweils einer Art vor. Die Gattung der Schlangenweihen (Spilornis) lebt dagegen mit 6 Arten in Südostasien. Zu dieser Unterfamilie zählt aber auch der Philippinenadler (Pithecophaga jefferyi), der die Tropenwälder der Philippinen bewohnt und auch Affenadler genannt wird (Abb. 11). Es sind große Greifvögel mit einer aufrichtbaren Federhaube und einer Flügelspannweite von bis zu 2m und ein Gewicht von bis zu 8 Kg, wobei nur Weibchen so groß werden, Männchen sind kleiner. Der Philippinenadler wurde lange Zeit zusammen mit den beiden neotropischen Arten Harpyie (Harpia harpyja) und Würgadler (Morphnus guianensis) sowie dem Papuaadler (Harpyopsis novaeguineae) Neuguineas in eine Unterfamilie Harpiinae gestellt. Nach molekulargenetischen Untersuchungen ist der Philippinenadler jedoch nicht näher mit diesen drei Arten verwandt, sondern gehört zu den Schlangenadlern. Sie erbeuten ein breites Nahrungsspektrum, welches von Nagetieren über schlangen hin zu Affen und Nashornvögeln reicht. Philippinenadler sind in ihrem Bestand bedroht – vor allem durch die Zerstörung ihres Lebensraums. Der Gesamtbestand wird bei großen Unsicherheiten auf noch etwa 90 bis 250 Paare geschätzt, maximal könnte er 340 Paare umfassen (Lerner & Mindell 2005, Ferguson-Lees & Christie 2001).
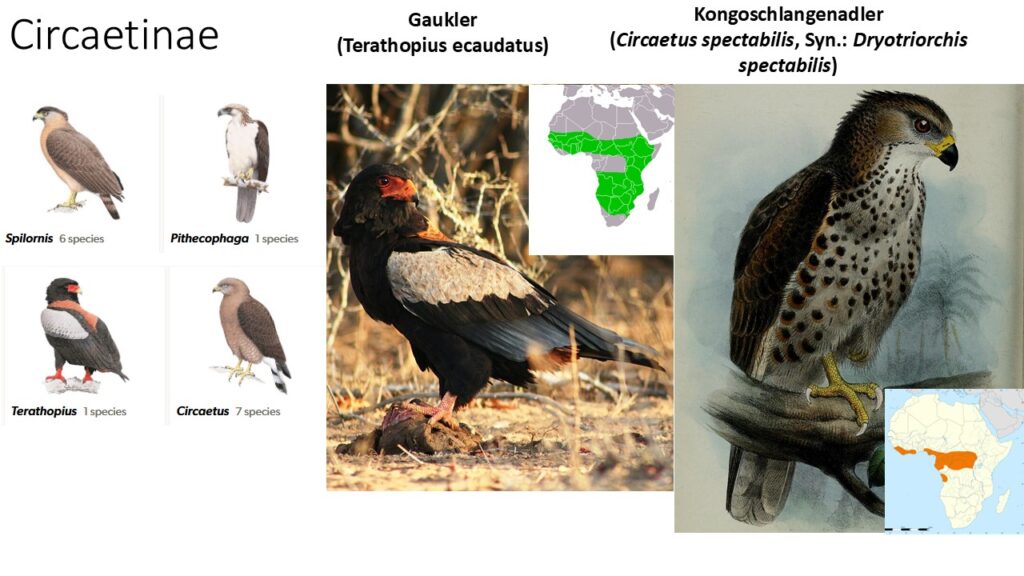
Abb. 10: Circaetinae

Abb. 11: Philippinenadler
Aegypiinae – die Altweltgeier
Die Aegypiinae umfassen alle Altweltgeier, außer Bart- Schmutz- und Palmgeier (Abb. 12). Sie erreichen Körpergrößen von bis zu über einem Meter und Flügelspannweiten von bis zu 2,90 m. Typisch für viele Arten ist eine Halskrause, aus der ein langer nackter oder kurzbefiederter Hals ragt. Man nimmt an, dass dies die Verschmutzung der Federn verhindert und die Wärmeregulierung unterstützt (Ward et al. 2008). Sie kommen in Afrika, Asien und Europa vor. Als Lebensraum kommen offene Landschaften wie Steppen und Halbwüsten, aber auch Gebirge in Frage. Insgesamt gibt es 13 Arten in sechs Gattungen. 5 Gattungen bestehen aus nur einer Art, der in Europa und Asien vorkommende Mönchsgeier (Aegypius monachus), der asiatische Kahlkopfgeier (Sarcogyps calvus), sowie die afrikanischen Kappen-, Wollkopf- und Ohrengeier (Necrosyrtes monachus, Trigonoceps occipitalis, Torgos tracheliotos). Die Gattung Gyps hat 8 Arten, die in Afrika, Asien und Europa leben. Hierzu gehört auch der Gänsegeier (Gyps fulvus), der auch in den Alpen vorkommt. Anders als bei Neuweltgeiern verlassen sich Altweltgeier bei der Beutesuche hauptsächlich auf ihre guten Augen. Sie alle sind Aasfresser und ernähren sich vom Muskelfleisch und den Innereien der Kadaver. Trotz ihres negativen Rufes haben Geier als Aasfresser eine wichtige ökologische Funktion, weil sie die Ökosysteme von verwesenden Kadavern befreien, die auch Seuchen verbreiten können. Viele Geierarten, vor allem in Indien, aber auch in Afrika sind mittlerweile bedroht und in einigen Regionen sind die Bestände um über 90% eingebrochen. Die größten Bedrohungen sind der Lebensraumverlust und damit auch der Verlust des Nahrungsangebots durch wilde Huftiere. Die besonders hohen Bestandsrückgänge in Südasien sind auch mit dem Wirkstoff Diclofenac verbunden. Diclofenac ist ein entzündungshemmendes Medikament, mit dem verletzte Hausrinder häufiger behandelt wurden. Starb ein solches Rind und fraßen Geier von dem Kadaver, erlitten die Geier ein tödliches Nierenversagen. Diclofenac wird in ganz Südasien routinemäßig eingesetzt; problematisch erwies sich seine Verwendung vor allem dort, wo es Anhängern des Hinduismus verboten ist, Rindfleisch zu verzehren. In diesen Regionen wird ein totes Rind gewöhnlich am Sterbeort liegengelassen, wo es dann von den Geiern gefressen wird. Die Verwendung von Diclofenac in der Tiermedizin wurde sowohl in Nepal als auch in Indien sehr rasch verboten, nachdem man seine schädliche Wirkung auf die Geier erkannt hatte. Dazu trug wesentlich bei, dass mit dem Rückgang der Geier die Rattenpopulation und die Zahl kadaververzehrender verwilderter Hunde und damit auch die Zahl von Tollwutfällen bei Menschen stark anstieg. Trotz des Verbotes wird dennoch Diclofenac in Südasien vielerorts immer noch eingesetzt.

Abb. 12: Aegypiinae
Harpiinae- die Waldadler
Zu den Harpiinae zählen vier Arten: der auf Neuguinea beheimatete Papuaadler (Harpyopsis novaeguineae), der in Afrika und Südostasien vorkommende Fledermausaar (Macheiramphus alcinus), der sich auf die Jagd von Fledermäusen spezialisiert hat, sowie die in Mittel- und Südamerika lebenden Würgadler (Morphnus guianensis) und die Harpyie (Harpia harpyja). Die weibliche Harpyie gehört mit einer Flügelspannweite von bis zu 2m und einem Gewicht von bis zu 9 Kg zu den größten Greifvögeln der Welt und ist wohl der physisch stärkste Greifvogel. Die Männchen der Art sind mit etwa 4,8 kg deutlich kleiner. Der Körperbau der Harpyie ermöglicht das Erjagen von Tieren, wie Affen und Faultieren, in den dicht bewachsenen Baumkronen des Regenwaldes (Abb. 13).

Abb. 13: Harpiinae
Aquilinae – Gestiefelte Adler
Die Aquilinae sind eine mit 38 Arten in 10 Gattungen (Stephanoaetus, Spizaetus, Polemaetus, Nisaetus, Lophotriorchis, Lophaetus, Ictinaetus, Hieraaetus, Clang, Aquila) recht artenreiche Gruppe mit einer weltweiten Verbreitung (Abb. 14). Der Schwerpunkt des Artenreichtums liegt jedoch in den Tropen Asiens, Afrikas und Australiens. Gemeinsames Merkmal aller Vertreter der Aquilinae sind die bis zu den Zehen befiederten Beine, im Englischen wird das Taxon daher als „Booted Eagles“ (wörtlich übersetzt: „Gestiefelte Adler“) bezeichnet. In Südamerika kommen nur vier Arten vor, die zur Gattung Spizaetus gehören. Die asiatischen Haubenadler (Nisaetus) kommen mit 11 Arten in den Tropen Asiens vor. Weiterhin auf das tropische Asien beschränkt sind die Gattung der Maleienadler (Ictinaetus malayensis) und Rotbauchadler (Lophotriorchis kienerii) mit jeweils einer Art. Die drei Gattungen Kronenadler (Stephanoaetus coronatus), Kampfadler (Polemaetus bellicosus) und Schopfadler (Lophaetus occipitalis) gibt es nur in Afrika. Der Kronenadler ist dabei der größte afrikanische Adler und der Harpyie in Südamerika ähnlich zu einem großen Teil Affen jagt. In Eurasien kommt die Gattung Clanga mit drei Arten vor, von denen der Schreiadler (Clanga pomarina) auch in Deutschland brütet. Die Gattung Hieraaetus hat 5 Arten in Europa, Afrika, Asien und Australien, deren bekanntester Vertreter der Zwergadler (Hieraaetus pennatus) ist, der auch in Südeuropa brütet. Die Gattung Aquila sind die „echten Adler“, mit 11 Arten, die in Europa, Afrika, Asien, Australien und Nordamerika vorkommen. Hierzu gehören u. a. Stein- und Steppenadler (A. chrysaetos, A. nipalensis), aber auch der australische Keilschwanzadler (A. audax) und die afrikanischen Raubadler (A. rapax).

Abb. 14: Aquilinae
Harpaginae – Zahnhabichte und Verwandte
In die Unterfamile Harpaginae gehören drei Gattungen mit 5 Arten (Abb. 15). Zwei Gattungen mit je zwei Arten, Microspizias und Harpagus, letzter bekannt auch als Zahnhabichte, kommen in Mittel- und Südamerika vor. Zahnhabichte haben ihren Trivialnamen durch die am Schnabelrand vorhandenen zahnartigen Vorsprünge, die zum Zerteilen der Beute benutzt werden. Die dritte Gattung besteht aus nur einer afrikanischen Art, dem Kuckuckshabicht oder Sperberbussard (Kaupifalco monogrammicus) genannt.
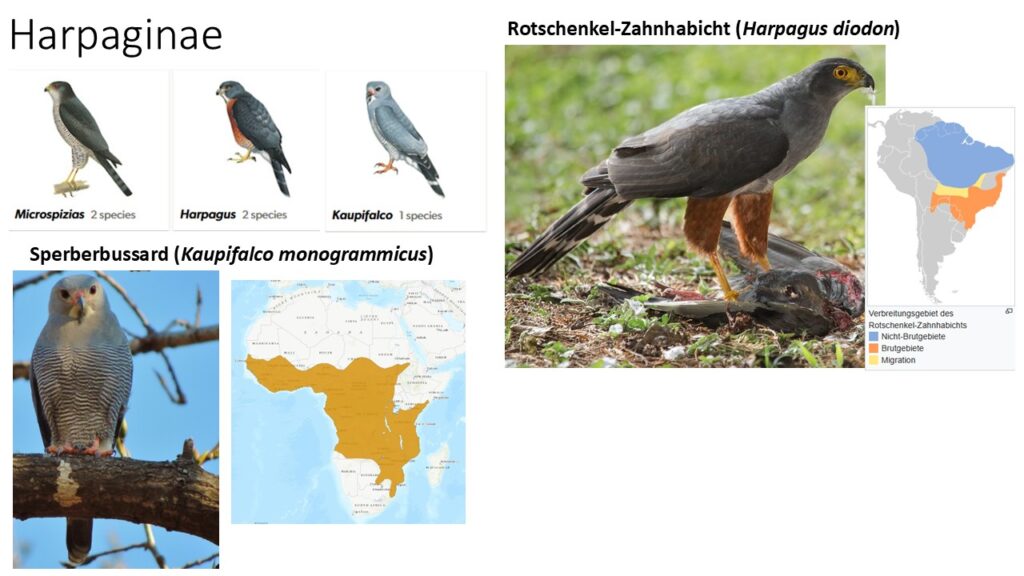
Abb. 15: Harpaginae
Melieraxinae – Singhabichte
Die Unterfamilie der Singhabichte (Melieraxinae) haben drei Gattungen (Melierax, Micronius, Urotriorchis, die zwei letzteren vielleicht Teil der Accipitrinae) mit 5 Arten, die nur in Afrika vorkommen. Wie der Name schon vermuten lässt, sind Singhabichte sehr stimmgewaltige Vögel (Abb. 16).

Abb. 16: Melieraxinae
Accipitrinae – Habichte und ihre Verwandten
Die Accipitrinae haben drei Gattungen, wobei die Gattung Accipiter, die Habichte und Sperber, etwa 50 Arten umfassen (nach neueren Angaben wir die Gattung Accipiter in folgende Gattungen aufgeteilt: neben Accipiter sind dies Astur, Aerospiza, Tachyspiza und Lophospiza) und die zwei weiteren Gattungen Erythrotriorchis und Megatriorchis nur zwei bzw. eine Art haben. Die letzten beiden Gattungen sind auf Australien und Neuguinea beschränkt, während die Habichte eine weltweite Verbreitung haben. Alle Arten sind an bewaldete Lebensräume gebunden. Viele Arten bewohnen die Inseln Indonesiens und Ozeaniens, wo zahlreiche Arten auf den einzelnen Inseln oder Inselgruppen endemisch sind. Viele Arten sind spezialisierte Vogeljäger, bei anderen Arten umfasst das Nahrungsspektrum auch andere kleine Wirbeltiere und Insekten. Es sind meist schlanke Vögel, mit kurzen gerundeten Flügeln und grazilen langen Beinen und Zehen. Bei fast allen Arten ist die Oberseite einfarbig grau oder schwärzlich und die Unterseite dazu kontrastierend hell und häufig fein quergebändert (Fachjargon: gesperbert). Größere Arten wie der in Europa und Nordasien lebende Habicht (Astur gentilis) können über 2 kg schwer werden. Zwei weitere europäische Arten sind der Sperber (Accipiter nisus) und der Kurzfangsperber (Tachyspiza brevipes). Die typischen Proportionen sind auch im Flug gut erkennbar, fast alle Arten haben darüber hinaus auch eine typische Flugweise mit einigen schnellen Flügelschlägen und einer anschließenden kurzen Gleitphase (Abb. 17).

Abb. 17: Accipitrinae
Circinae – Weihen
Weihen werden als weitere Gattung der Unterfamilie Accipitrinae angesehen, von manchen aber als eigene Unterfamilie behandelt (Oatley et al. 2015, Ferguson-Lees & Christie 2001, Nieboer 1973, Simmons 2000, Simmons & Legra 2009).
Weihen sind mittelgroße Greifvögel, die sich durch eine schlanke Silhouette und lange, breite Flügel auszeichnen. Sie bestehen aus einer Gattung mit 16 heute lebenden Arten, sowie zwei kürzlich ausgestorbenen Arten auf Hawaii und Neuseeland. Sie kommen fast weltweit vor, wobei 13 Arten in der Alten Welt leben. In der Neuen Welt kommt lediglich die Hudsonweihe (Circus hudsonius) in Nordamerika vor, während Südamerika von Grau- und Weißbrauenweihe (C. cinereus und C. buffoni) bewohnt wird. Auf dem afrikanischen Festland brüten zwei Arten, auf Madagaksar und Reunion jeweils eine, in Australien zwei, in Neuguinea eine Art. Der Schwerpunkt der Artenvielfalt liegt in den gemäßigten Zonen Asiens und in Europa. Bekannte Arten sind Rohrweihe (C. aeruginosus), Kornweihe (C. cyaneus) und Wiesenweihe (C. pygargus), die auch in Deutschland brüten. Weihen bewohnen offene, weitflächige Lebensräume, in denen sie kleine Nagetiere und Vögel im Gaukelflug erbeuten. Weihen sich durch ihren grazilen Balzflug aus, bei dem das Männchen um das Weibchen wirbt. Bei einigen Weihen paaren sich die Männchen mit mehreren Weibchen gleichzeitig. Fast alle Arten brüten in Bodennestern, wobei das Männchen das brütende Weibchen und die Jungen mit Nahrung versorgt. Die molekulargenetischen Untersuchungen legen nahe, dass sich die Weihen vor 6 – 8 Millionen Jahren aus einem habichtähnlichen Vorfahren entwickelten, als dieser in die C4-Grassteppen vorstieß, die sich damals über die Welt ausbreiteten.
Die Weihen unterteilen sich in zwei Gruppen: den trockenlandbewohnenden Arten und dem Rohrweihen-Komplex, inklusive der Wiesenweihe. Die Arten im Rohrweihenkomplex wurden früher als eine Art zusammengefasst. Sie lassen sich jedoch genetisch unterscheiden, wenn auch vergleichsweise gering, was ihre relativ junge Artbildung erklärt. So trennen die Mangrove-, Madagaskar- und Réunionweihe (C. spilonotus, C. macrosceles, C. maillardi) nur zwischen 100.000 und 300.000 Jahre. Ähnlich nah verwandt sind Sumpf- und Papuaweihe (C. approximans, C. spilothorax).
Buteoninae I – Bussarde und Milane
Die letzte Unterfamilie stellen die Bussardartigen (Buteoninae) dar. Sie haben fast 80 Arten in 19 Gattungen. Die größte Gattung ist Buteo, die Bussarde, mit 29 Arten, wobei der Artstatus einiger Unterarten nicht sicher ist. Sie kommen weltweit mit Ausnahme von Australien und der Antarktis vor. Ein Schwerpunkt der Artenvielfalt liegt im tropischen Amerika und Afrika, wo jeweils über 10 Arten vorkommen. In Mitteleuropa brüten Mäusebussard (Buteo buteo) und Adlerbussard (Buteo rufinus). Bussarde sind breitflügelige, kurzschwänzige Schwebeflieger. Im Aussehen ähneln sie den echten Adlern, sind aber z. B. kleiner, der Schnabel kürzer und kräftiger gebogen und die Beine sind unbefiedert. Bussarde jagen hauptsächlich Kleinsäuger (Abb. 18).
Viele weitere Gattungen sind im Wesentlichen auf Mittel- und Südamerika beschränkt. Hierzu gehören z. B. die Weißbussarde (Leucopternis), Schneebussarde (Pseudastur) und die Gattung Geranoaetus mit je 3 Arten, Parabuteo mit zwei Arten, Wegebussarde (Rupornis), Bleibussarde (Cryptoleucopteryx), Schneckenbussarde (Rostrhamus), Fischbussarde (Busarellus), Stelzenbussarde (Geranospiza), Hakenbussarde (Helicolestes) und Prinzenbussarde (Morphnarchus) mit je einer Art und die Schwarzbussarde (Buteogallus) mit 9 Arten. Einer der wenigen Arten dieser Gattungen, die auch in den USA vorkommen ist der Wüstenbussard (Parabuteo unicinctus). Die Gattung Ictinia kommt mit zwei Arten in Nord- und Südamerika vor. Die Gattung Butastur kommt hingegen mit 3 Arten in Asien und einer in Afrika vor. Diese 15 Gattungen machen die Buteonini, also die eigentlichen Bussarde aus. Innerhalb der Unterfamilie gibt es aber noch die Gattungsgruppe der Milvini mit 4 Gattungen und 15 Arten. Hierzu zählen die Milane (Milvus) mit drei Arten – Rotmilan (M. milvus), Schwarzmilan und afrikanischer Schwarzmilan (Milvus aegyptius), der früher als Unterart des Schwarzmilans (M. migrans) galt. Die zweite Gattung Haliastur besteht aus zwei Arten: dem asiatischen Brahmanenmilan (Haliastur indus) und dem australischen Keilschwanzmilan (Haliastur sphenurus).

Abb. 18: Buteoninae
Buteoninae II – Seeadler
Eine weitere Gattungsgruppe der Bussardartigen sind die Seeadler mit 10 Arten in zwei Gattungen, wobei manche Autoren sie in eine Gattung zusammenfassen (Abb. 19). Für gewöhnlich werden die in den gemäßigten Regionen vorkommenden Seeadler, genauer Weißkopfseeadler (Haliaeetus leucocephalus), Eurasische Seeadler (Haliaeetus albicilla), Bindenseeadler (Haliaeetus leucoryphus) und Riesenseeadler (Haliaeetus pelagicus) in die Gattung Haliaeetus gestellt. Die bekannteste Art ist der Weißkopfseeadler, der einst über das ganze Festland Nordamerikas verbreitet war. Heute kommt er im Wesentlichen an der Ost- und Westküste der USA, sowie in Alaska und Teilen Kanadas vor. Menschliche Bejagung und Lebensraumzerstörung stellen eine Hauptursache für den Bestandsrückgang dar. Für Bestandsrückgänge sorgte in den 1960er Jahren auch das Insektizid DDT. Zum Schutz des Weißkopfseeadlers wurden sehr früh Maßnahmen ergriffen. In Kanada und den Vereinigten Staaten wurde er bereits durch den 1918 Migratory Bird Treaty geschützt, der später auf das gesamte nordamerikanische Gebiet ausgedehnt wurde. 1940 stimmte der US-Kongress dem Bald and Golden Eagle Protection Act zu, der ein kommerzielles Fangen und Töten von Weißkopfseeadlern und Steinadlern unter Strafe stellte. Als entscheidender Schritt, der zur Bestandserholung führte, gilt das DDT-Verbot in den Vereinigten Staaten, das 1972 erlassen wurde. Vor ähnlichen Problemen stand bzw. steht auch der Riesenseeadler, der an der Pazifikküste Asiens vorkommt. Der Riesenseeadler gehört zu den größten Greifvögeln mit einer Flügelspannweite von 2,90 m und einem Gewicht von bis zu 9 kg. Neben DDT ist die Zerstörung des Lebensraums Hauptursache für die Gefährdung dieser Vogelart. Die sechs tropischen Arten gehören in die Gattung Icthyophaga. Hierzu gehören u. a. der afrikanische Schreiseeadler (Icthyophaga vocifer) und der asiatisch-australische Weißbauch-Seeadler (Icthyophaga leucogaster). Die Nahrung besteht entsprechend dem Lebensraum vor allem aus Fischen und Wasservögeln.

Abb. 19: Seeadler
Die fossilen Habichtartigen
Einer der frühesten vertreter der Habichtartigen ist die Gattung Horusornis, die in eine eigene Familie (Horusornithidae) gestellt wird. Horusornis war ein vergleichsweise langbeiniger Vogel mit einer spezialisierten Fußmorphologie, die auf ein besonders flexibles Intertarsalgelenk schließen lässt (Mourer-Chauviré 1991). Nicht zuletzt aufgrund seiner ungewöhnlichen Morphologie sind die Verwandtschaftsverhältnisse von Horusornis schwer zu bestimmen. Ein sehr flexibles Intertarsalgelenk ist ansonsten nur von Pengana aus dem Oligozän oder Miozän Australiens (Boles 1993) sowie vom südamerikanischen Stelzenbussard (Geranospiza caerulescens) und den afrikanischen Höhlenweihen (Polyboroides) bekannt. Letztere sind weder mit Horusornis noch untereinander enger verwandt und benutzen ihre Füße, um Beute aus Baumhöhlen zu holen.
Weitere fossile Gattungen sind Aquilavus und Palaeohierax aus dem Eozän und Oligozän Europas, sowie weitere, fragmentarische Funde aus dem Oligozän Ägyptens und Zentralasiens, die eine Verwandtschaft mit Palmgeiern und Seeadlern schließen lassen (Mayr 2009, 2016, Harrison & Walker 1979, Zhang et al. 2012, Rasmussen et al. 1987, Kurochin 1976).
Fossile Gypaetinae, also Verwandte von Bartgeier und co. finden sich auch auf dem amerikanischen Doppelkontinent, wie Neophrontops, von dem 5 Arten bekannt sind und einige den Schmutzgeiern ähneln (Lerner & Mindell 2005, Rich 1980). Weiterhin sind drei Arten der Gattung Palaeoborus aus dem Miozän der Great Plains in den USA, sowie die Gattung Anchigyps aus dem Miozän Nebraskas bekannt, die den Gypaetinae ähnlich sind, letztere ähnelt dabei dem Palmgeier (Zhang et al. 2012).
Ein Schnabelfragment aus dem mittleren Miozän von Kenia wurde mit dem heute lebenden Mönchsgeier (Walker & Dyke 2006) verglichen, von dem er sich aber in einigen Merkmalen unterscheidet (Manegold et al. 2014). Mehrere mutmaßliche Altweltgeier wurden auch aus dem Miozän von China gemeldet, wie Qiluornis uns Gansugyps (Zhang et al. 2010).
Einige fragmentarische Habichtartige aus dem Oligozän Nordamerikas wurden dem heutigen Taxon Buteo, den Bussarden, zugeordnet (Mayr 2009, 2016). Die ältesten Überreste großer Greifvögel, die dem heutigen Taxon Aquila, den Adlern, ähneln, stammen aus dem Miozän von Frankreich und Australien (Gaff & Boles 2010). Apatosagittarius, ein ungewöhnlicher, langbeiniger Habichtartiger aus dem Miozän von Nebraska, scheint sich in seinem Nahrungsverhalten den Sekretären zu ähneln (Feduccia & Voorhies 1989). Weiterhin gibt es fragmentarische Überreste von Habitchartigen aus dem Oligozän und Miozän von Australien (Boles 1993, Mather et al. 2021), Neuseeland (Worthy et al. 2007) Namibia und Kenia (Mourer-Chauviré 2008; Walker und Dyke 2006).
Habichtartige weisen eine große Vielfalt an Nahrungsspezialisierungen auf und umfassen große Aasfresser, spezialisierte Insektenfresser und einige wenige, vorwiegend pflanzenfressende Formen. Die meisten Arten ernähren sich von Wirbeltieren, und die Evolution der Habichtartigen wurde daher wahrscheinlich von der Entwicklung ihrer Beutetiere, insbesondere von Nagetieren und andere kleine und mittelgroße tagaktive Säugetiere, beeinflusst. Die Ausbreitung offener Landschaften im mittleren Känozoikum hat die Diversifizierung vieler Habichtartigen begünstigt, wie wir bei den Weihen gesehen haben. Ebenso ermöglichte das Auftauchen großer Säugetiere die Evolution großer Aasfresser wie der Geier, die für diese Vögel ausreichend Nahrungsressourcen boten.
All diese Greifvögel sind nicht die einzigen beutegreifenden Arten in der Vogelwelt. Eine Gruppe der Afroaves ist ebenfalls darauf spezialisiert Wirbeltiere zu jagen, doch das tun sie eher nachts: die Eulen.
Literatur
Alvarenga, H. M. F. (1985): Notas sobre os Cathartidae (Aves) e Descrição de um Novo Gênero Cenozóico Brasileiro. Anais da Academia brasileira de Ciências 57 (3): 349-357.
Boles WE (1993): Pengana robertbolesi, a peculiar bird of prey from the Tertiary of Riversleigh, northwestern Queensland, Australia. Alcheringa 17:19–25
Brathwaite, D. H. (1992). Notes on the weight, flying ability, habitat, and prey of Haast’s Eagle (Harpagornis moorei). Notornis. 39 (4): 239–247.
Bunce, M et al. (2005): Ancient DNA Provides New Insights into the Evolutionary History of New Zealand’s Giant Eagle. PLoS Biology. Band 3, Nummer 1, e9.
Campbell, K.E., Tonni, E.P. (1980): A new genus of teratorn from the Huayquerian of Argentina (Aves: Teratornithidae). Natural History Museum of Los Angeles County, Contributions in Science 330, 59–68.
Campbell, KE & Tonni, EP (1983): Size and locomotion in teratorns. The Auk 100(2): 390-403.
Campbell, KE Scott, E, Springer, KB (1999): A new genus for the Incredible Teratorn (Aves: Teratornithidae). Smithsonian Contributions to Paleobiology 89: 169–175.
Catanach, TA, Halley MR, Pirro, P (2024): Enigmas no longer: using ultraconserved elements to place several unusual hawk taxa and address the non-monophyly of the genus Accipiter (Accipitriformes: Accipitridae). Biological Journal of the Linnean Society,
Chatterjee, S.R., Templin J., Campbell, K.E. (2007) The aerodynamics of Argentavis, the world’s largest flying bird from the Miocene of Argentina. Proceedings of the National Academy of Sciences USA 104, 12398–12403.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliot, A.; Sargatal, J., eds. (1994): Handbook of the Birds of the World, volume 2, New World Vultures to Guineafowl, Lynx Edicions, Barcelona.
Emslie, SD. (1988). An early condor-like vulture from North America. The Auk 105(3):529-535
Ericson, P. G. P., et al. (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters 22: 543–547.
Feduccia, A, Voorhier, MR (1989): Miocene hawk converges on secretarybird. Ibis 131.3: 349-354
Ferguson-Lees, J; Christie, D A. (2001). Raptors of the World. Illustrated by Kim Franklin, David Mead, and Philip Burton. Houghton Mifflin.
Gaff, P., Boles, W.E. (2010). A new eagle (Aves: Accipitridae) from the mid Miocene Bullock Creek Fauna of Northern Australia. Records of the Australian Museum 62, 71–76.
Gill, F; Donsker, D; Rasmussen, P, eds. (2022). Hoatzin, New World vultures, Secretarybird, raptors. IOC World Bird List Version 12.2. International Ornithologists’ Union.
Griffiths, C. et al. (2007): Phylogeny, diversity, and classification of the Accipitridae based on DNA sequences of the RAG‐1 exon. Journal of Avian Biology 38(5):587 – 602
Hackett, S. J. et al. (2008): A phylogenomic study of birds reveals their evolutionary history. Science 320: 1763–1768.
Harrison, CJO; Walker, CA (1979). Birds of the British Middle Eocene. Tertiary Research Special Papers. 50: 19–26.
Houde, P. et al. (2019): Phylogenetic Signal of Indels and the Neoavian Radiation. Diversity. 11 (7): 108.
Jarvis, E. D.; et al. (2014): Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 346 (6215): 1320–1331
Kimball, RT et al. (2013): Identifying localized biases in large datasets: A case study using the Avian Tree of Life. Mol Phylogenet Evol. 69 (3): 1021–32.
Kuhl, H. et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38: 108–127.
Kurochkin, E.N. (1976). A survey of the Paleogene birds of Asia. Smithsonian Contributions to Paleobiology 27, 75–86.
Kruckenhauser, L. et al. (2004): Genetic vs. morphological differentiation of Old World buzzards. (genus Buteo, Accipitridae). Zoologica Scripta, 33, S. 197–211
Lerner, HRL, Mindell, DP (2005): Phylogeny of eagles, Old World vultures, and other Accipitridae based on nuclear and mitochondrial DNA. Molecular Phylogenetics and Evolution Bd. 37, S. 327–346
Manegold, A., Pavia, M., Haarhoff, P. (2014). A new species of Aegypius vulture (Aegypiinae, Accipitridae) from the early Pliocene of South Africa. Journal of Vertebrate Paleontology 34, 1394–1407.
Mather, E. K., Lee, M. S. Y., Camens, A. B., Worthy, T. H. (2021). An exceptional partial skeleton of a new basal raptor (Aves: Accipitridae) from the late Oligocene Namba formation, South Australia. Historical Biology, 34(7), 1175–1207.
Martin, GR (1986). Vision: Shortcomings of an eagle’s eye. Nature. 319 (6052): 357.
Mayr, G (2006). An osprey (Aves: Accipitridae: Pandioninae) from the early Oligocene of Germany. Palaeobiodiversity and Palaeoenvironments. 86 (1): 93–96.
Mayr, G. (2009). Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mindell, M. D.; Fuchs, J.; Johnson, J. A. (2018). Phylogeny, Taxonomy, and Geographic Diversity of Diurnal Raptors: Falconiformes, Accipitriformes, and Cathartiformes. In Sarasola, J.; Grande, J.; Negro, J. (eds.). Birds of Prey. Springer, Chame. pp. 3–32.
Mirarab S. et al. (2024): A region of suppressed recombination misleads neoavian phylogenomics. Proc Natl Acad Sci U S A.;121(15):e2319506121.
Mitkus, M; Potier, S; Martin, GR.; Duriez, O; Kelber, A (2018): Raptor Vision, Oxford Research Encyclopedia of Neuroscience.
Mourer-Chauviré C (1991): Les Horusornithidae nov. fam., Accipitriformes (Aves) à articulation intertarsienne hyperflexible de l’Éocene du Quercy. Geobios, mém spéc 13:183–192
Mourer-Chauviré, C (2003). Birds (Aves) from the Middle Miocene of Arrisdrift (Namibia). Preliminary study with description of two new genera: Amanuensis (Accipitriformes, Sagittariidae) and Namibiavis (Gruiformes, Idiornithidae). In Martin Pickford; Brigitte Senut (eds.). Geology and palaeobiology of the Central and Southern Namib. Vol. 2: Paleontology of the Orange River Valley. Geological Survey of Namibia, Memoir 19. pp. 103–113.
Mourer-Chauviré, C. (2008). Birds (Aves) from the Early Miocene of the Northern Sperrgebiet, Namibia. Memoir of the Geological Survey of Namibia 20, 147–167.
Mourer-Chauviré, C; Cheneval, J (1983): Les Sagittariidae fossiles (Aves, Accipitriformes) de l’Oligocène des phosphorites du Quercy et du Miocène inférieur de Saint-Gérand-le-Puy. Geobios. 16 (4): 443–459.
Nieboer, E (1973): Geographical and Ecological Differentiation in the Genus Circus. Vrije Universiteit te Amsterdam
Robert E. Simmons: Harriers of the World: Their Behaviour and Ecology. Oxford University Press, 2000. ISBN 0-19-854964-4.
Oatley, G, Simmons, RE, Fuchs, J (2015): A molecular phylogeny of the harriers (Circus, Accipitridae) indicate the role of long distance dispersal and migration in diversification. Molecular Phylogenetics and Evolution 85, 150–160.
Olson, S.L. (1985). The Fossil Record of Birds. Vol. Avian Biology.
Olson, SL, H. M. F. Alvarenga, HMF (2002): A new genus of small teratorn from the Middle Tertiary of the Taubaté Basin, Brazil (Aves: Teratornithidae). Proceedings of the Biological Society of Washington 115(4):701-705
Paton, P. W. C.; Messina, F. J.; Griffin, C. R. (1994). A Phylogenetic Approach to Reversed Size Dimorphism in Diurnal Raptors. Oikos. 71 (3): 492–498.
Potier, S (2020). Olfaction in raptors. Zoological Journal of the Linnean Society. 189 (3): 713–721
Prum, R. O. et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Rasmussen, D.T., Olson, S.L., Simons, E.L. (1987): Fossil birds from the Oligocene Jebel Qatrani Formation, Fayum Province, Egypt. Smithsonian Contributions to Paleobiology 62, 1–20.
Reddy, S. et al. (2017): Why Do Phylogenomic Data Sets Yield Conflicting Trees? Data Type Influences the Avian Tree of Life more than Taxon Sampling. Systematic Biology. 66 (5): 857–879.
Reymond, L. (1985). Spatial visual acuity of the eagle Aquila audax: a behavioural, optical and anatomical investigation. Vision Research. 25 (10): 1477–1491.
Rich, P.V. (1980): New World vultures with Old World affinities? A review of fossil and recent Gypaetinae of both the Old and the New World. In: M.K. Hecht & F.S. Szalay (eds.), Contributions to Vertebrate Evolution, vol. 5. Basel: Karger, pp. 1–115.
Sangster, G; Braun, EL; Johansson, US; Kimball, RT.; Mayr, G; Suh, A (2022): Phylogenetic definitions for 25 higher-level clade names of birds. Avian Research. 13: 100027
Sangster, G; Kirwan, GM.; Fuchs, J; Dickinson, EC.; Elliott, A; Gregory, SMS (2021). A new genus for the tiny hawk Accipiter superciliosus and semicollared hawk A. collaris (Aves: Accipitridae), with comments on the generic name for the crested goshawk A. trivirgatus and Sulawesi goshawk A. griseiceps. Vertebrate Zoology. 71: 419–424. doi:10.3897/vz.71.e67501. ISSN 2625-8498.
Sibley, C, Ahlquist, J. (1990): Phylogeny and classification of birds. Yale University Press, New Haven, Connecticut
Simmons RE (2000): Harriers of the World: Their Behaviour and Ecology. Oxford University Press.
Simmons, RE, Legra LAT (2009): Is the Papuan Harrier a globally threatened species? Ecology, climate change threats and first population estimates from Papua New Guinea. Bird Conservation International.19, Nr. 1, S. 1–13.
Starikov, I. J.; Wink, M. (2020). Old and Cosmopolite: Molecular Phylogeny of Tropical–Subtropical Kites (Aves: Elaninae) with Taxonomic Implications. Diversity. 12 (9).
Stiller, J. et al. (2024): Complexity of avian evolution revealed by family-level genomes. Nature 629, 851–860. https://doi.org/10.1038/s41586-024-07323-1
Stucchi, M.; Emslie, S.D. (2005). A new condor (Ciconiiformes, Vulturidae) from the Late Miocene/Early Pliocene Pisco Formation, Peru. The Condor. 107: 107–113.
Stucchi, M., Emslie, S.D., Varas-Malca, R.M., Urbina-Schmitt, M. (2015): A new late Miocene condor (Aves, Cathartidae) from Peru and the origin of South American condors. Journal of Vertebrate Paleontology 35, e972507.
Suh, A. (2016): The phylogenomic forest of bird trees contains a hard polytomy at the root of Neoaves. Zoologica Scripta. 45: 50–62.
Tennyson, A, Martinson P. (2006): Extinct Birds of New Zealand. Te Papa Press, Wellington, New Zealand.
U.S. Fish and Wildlife Service: California Condor (Gymnogyps californianus). 5-Year Review: Summary and Evaluation. USFWS, Pacific Region, Portland (OR). National Park Service: World CA Condor Update – 2021
Walker, C.A., Dyke, G.J. (2006). New records of fossil birds of prey from the Miocene of Kenya. Historical Biology 18, 95–98.
Ward, J.; McCafferty, D.; Houston, D.; Ruxton, G. (2008). Why do vultures have bald heads? The role of postural adjustment and bare skin areas in thermoregulation. Journal of Thermal Biology. 33 (3): 168–173.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a). New World Vultures (Cathartidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.cathar2.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b). Secretarybird (Sagittariidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.sagitt1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c). Osprey (Pandionidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.pandio1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d). Hawks, Eagles, and Kites (Accipitridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.accipi1.01
Worthy, T., Holdaway, R. (2003): The Lost World of the Moa: Prehistoric Life of New Zealand. Indiana University Press
Worthy, T.H., Tennyson, A.J.D., Jones, C., McNamara, J.A., Douglas, B.J. (2007). Miocene waterfowl and other birds from central Otago, New Zealand. Journal of Systematic Palaeontology 5, 1–39.
Wu, S. et al. (2024): Genomes, fossils, and the concurrent rise of modern birds and flowering plants in the Late Cretaceous. Proceedings of the National Academy of Sciences. 121 (8).
Zhang, Z., Feduccia, A., James, H.F. (2012). A Late Miocene accipitrid (Aves: Accipitriformes) from Nebraska and its implications for the divergence of Old World vultures. PLoS ONE 7, e48842.
Zhang, Z., Zheng, X., Zheng, G., Hou, L. (2010). A new Old World vulture (Falconiformes: Accipitridae) from the Miocene of Gansu Province, northwest China. Journal of Ornithology 151, 401–408.



