Text als pdf
In der letzten Episode lernten wir einige besondere Meeresvögel kennen, die zur Klade der Aequornithes gehören: die Seetaucher, Albatrosse, Sturmschwalben, Wellenläufer, Sturmvögel und die Pinguine. Mit Ausnahme der Seetaucher, gehören diese Vogelfamilien zu den Procellariimorphae. Deren Schwestergruppe stellen die Pelecanimorphae dar, die wiederrum in drei Ordnungen aufgeteilt werden: Ciconiiformes, Suliformes und Pelecaniformes (Hackett et al. 2008, Jarvis et al. 2014, Kuhl et al. 2021, Kuramoto et al. 2015, Prum et al. 2015, Sangster & Mayr 2021, Sangster et al. 2022, Suh et al. 2005, Wu et al. 2024, Yuri et al. 2013, Kimball et al. 2013, Abb. 1). Auch hier finden sich, vornehmlich unter den Suliformes, einige charakteristische Meeresvögel, doch die Mehrheit der Pelecanimorphae sind Bewohner von Süßwasser-Lebensräumen. Diese Episode widmet sich den zwei Ordnungen Ciconiiformes und Suliformes.
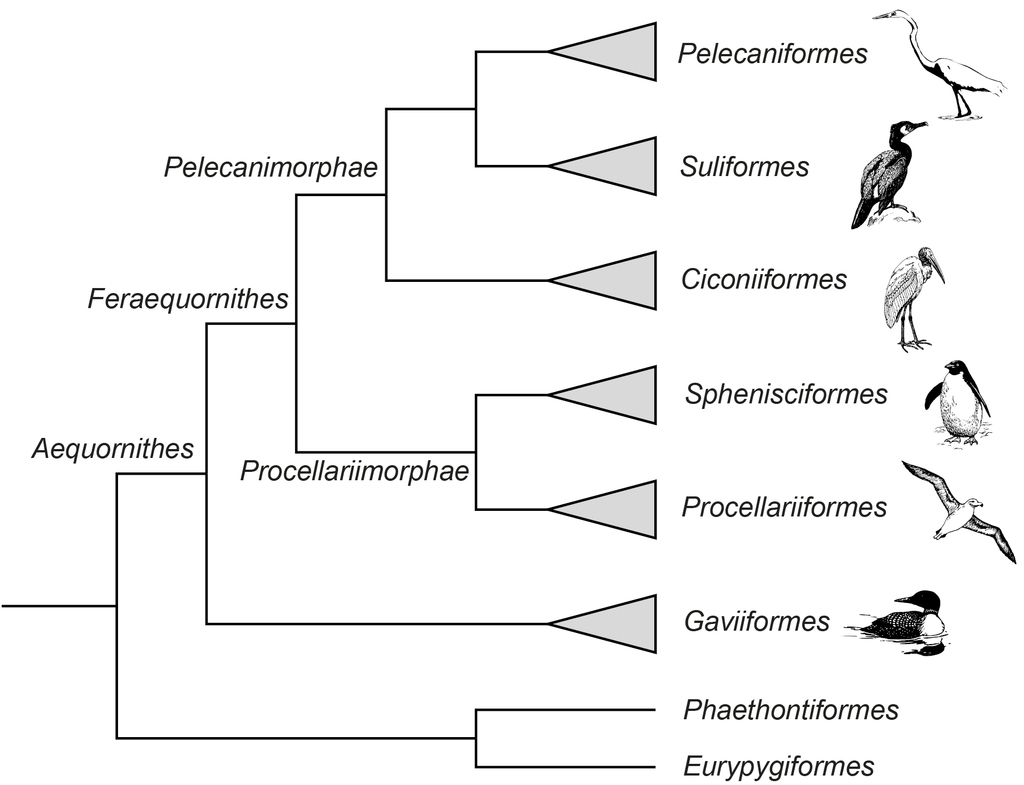
Abb. 1: Kladogramm der Aequornithes
Störche (Ciconiiformes, Ciconiidae)
Die Ordnung der Ciconiiformes umfasst nur eine Familie, die Störche (Ciconiidae, Abb. 2), eine uns sehr vertraute Familie, allen voran durch den Weißstorch (Ciconia ciconia). Früher zählte man auch die Ibisse und Reiher, sowie Schuhschnabel und Hammerkopf in diese Ordnung. Tatsächlich sind diese aber mit den Pelikanen näher verwandt und werden in die Ordnung Pelicaniformes gestellt. Insgesamt gibt es in der Familie der Störche nur 20 Arten in 6 Gattungen (Anastomus, Leptoptilos, Mycteria, Ephippiorhynchus, Jabiru, Ciconia). Störche kommen fast weltweit vor, haben ihren größten Artenreichtum jedoch in den Tropen Afrikas und Asiens. In Europa und den gemäßigten Zonen Asiens kommen Weiß- und Schwarzstorch (Ciconia ciconia, Ciconia nigra) vor. Beide überwintern auch im tropischen Afrika und Indien, wobei der Schwarzstorch im südlichen Afrika auch brütet. In Ostsibirien, China und Japan kommt zusätzlich der Schwarzschnabelstorch vor (Ciconia boyciana). Neben Weiß- und Schwarzstorch kann man in Afrika noch sechs weitere Storcharten bestaunen, die es nur dort gibt: Glanzklaffschnabel (Anastomus lamelligerus), Marabu (Leptoptilos crumenifer), Nimmersatt (Mycteria ibis), Sattelstorch (Ephippiorhynchus senegalensis), Afrikanischer Wollhalsstorch (Ciconia microscelis) und Adminstorch (Ciconia abdimii). Acht Arten brüten in den Tropen Asiens, wobei es hier passende Gegenstücke zu den afrikanischen Arten gibt: Silberklaffschnabel (Anastomus oscitans), zwei Marabu-Arten, nämlich Sunda-Marabu (Leptoptilos javanicus) und Großer Adjutant (Leptoptilos dubius), die zu den Nimmersatten zählenden Buntstorch (Mycteria leucocephala) und Milchstorch (Mycteria cinerea), der mit dem Sattelstorch verwandte Riesenstorch (Ephippiorhynchus asiaticus) und der Asiatische Wollhalsstorch (Ciconia episcopus). Der Riesenstorch kommt zusätzlich in Australien vor. Der auf Borneo und Sumatra lebende Höckerstorch (Ciconia stormi) ist mit 250-500 Individuen die seltenste Storchart der Welt. In Südamerika brütet der zu den Nimmersatten zählende Waldstorch (Mycteria americana), der auch in Teilen Nordamerikas vorkommt. Weiterhin leben in Südamerika der Maguaristorch (Ciconia maguari) und der Jabiru (Jabiru mycteria) (Winkler et al. 2015, 2020a, del Hoyo et al. 1992, del Hoyo 2020, Kuramotot et al. 2015).
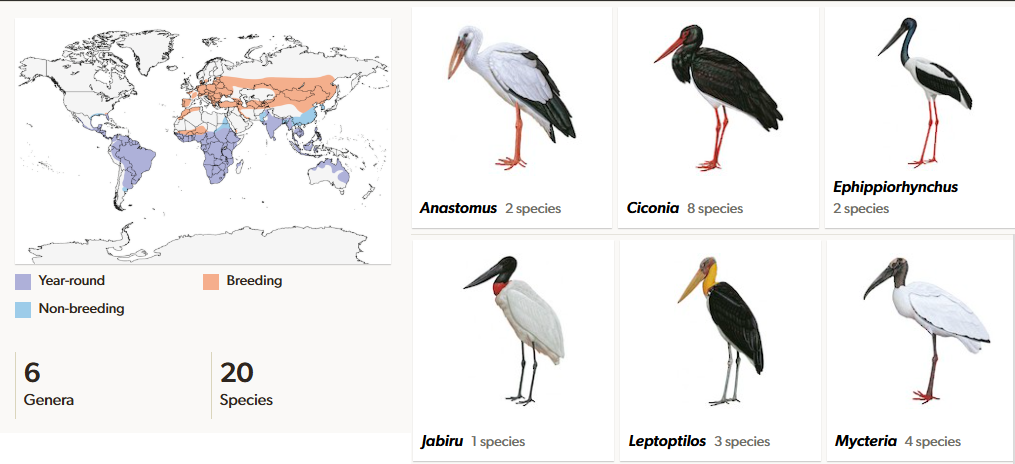
Abb. 2: Störche
Kennzeichnend für Störche sind die langen Beine und der lange Hals, während der Schwanz sehr kurz ist. Äußerlich ähneln sie somit den Reihern, wirken aber meistens massiger und schwerer. Sie haben lange Schnäbel, die aber bei verschiedenen Gattungen unterschiedliche Formen haben können. Während bei der Gattung Ciconia, den eigentlichen Störchen, der Schnabel lang, schmal und gerade ist, ist er bei den Marabus (Leptoptilos) besonders groß und voluminös. Bei den großen Storcharten ist der Schnabel mächtig und leicht aufwärts gebogen, bei den Nimmersatten (Mycteria) leicht abwärts gebogen, an dessen Spitze Sinneszellen sitzen, die beim Aufspüren von Nahrung im trüben Wasser hilfreich sind. Die Klaffschnäbel (Anastomus) haben beidseits eine Lücke zwischen Ober- und Unterschnabel; dieser Schnabel dient dem Öffnen von Schneckengehäusen. Beim Storchenfuß zeigt die erste Zehe nach hinten und die übrigen drei nach vorn (anisodactyl). Schwimmhäute finden sich nur verkümmert an der Zehenbasis. Die langen Beine ermöglichen ein langsames Schreiten. Die Flügel sind groß und breit. Sie sind gut für den Segelflug geeignet, der nur zwischendurch von langsamen Flügelschlägen unterbrochen wird. Marabus (Leptoptilos) fliegen wie Reiher mit eingezogenem Hals, während für alle anderen Störche ein Flugbild mit gestrecktem Hals typisch ist, das auch Laien als sicheres Unterscheidungsmerkmal zu den Reihern dienen kann. Fliegen Störche in Gruppen, bilden sie keine Formationen. Ein geringfügiger Größendimorphismus zugunsten der Männchen besteht bei allen Arten, auffallend ist dieser nur bei Sattel- und Riesenstorch (Ephippiorhynchus senegalensis und E. asiaticus). Störche geben zwar Laute von sich, bekannter ist aber ihr Schnabelklappern, das beim Weißstorch am verbreitetsten ist. Störche sind überwiegend tagaktiv und die meisten Arten haben ein breites Nahrungsspektrum, welches aus Fischen, Amphibien, Echsen, Schlangen, Nagetieren und Insekten besteht. Die Beute eines Jabiru (Jabiru mycteria) reicht bis zur Größe eines jungen Kaimans (Winkler et al. 2015, 2020a, del Hoyo et al. 1992, del Hoyo 2020)
Der Adminstorch (Ciconia abdimii) hat eine abweichende Ernährungsweise. Er ist ein Vogel der offenen Savanne ohne Bindung an das Wasser. Seine Nahrung besteht fast ausschließlich aus Insekten, vor allem Heuschrecken und Schmetterlingsraupen. Die Nimmersatte (Mycteria) sind darauf spezialisiert, in sehr flachem Wasser zu jagen, das oft schlammig und trüb ist. Da ihre Augen in diesem Wasser nichts zu erkennen vermögen, bewegen sie sich mit eingetauchtem Schnabel durch das Wasser. Mit ihren Füßen wühlen sie den Schlamm auf, um Beute aufzuscheuchen. Kommt ein Beutetier mit dem Schnabel in Berührung, packt der Storch sofort zu. Dabei hat sich der Milchstorch (Mycteria cinerea) darauf spezialisiert, Schlammspringer in den Mangrovenwäldern zu jagen. Klaffschnäbel (Anastomus) haben sich ganz auf Wasserschnecken spezialisiert, vor allem Apfelschnecken. Das Lösen des Schneckengehäuses geschieht unter Wasser. Mit dem Oberschnabel wird die Schnecke gegen den Grund gedrückt, während der scharfe Unterschnabel in das Operculum eindringt und den Muskel auftrennt, der die Schnecke im Gehäuse hält. Großer Adjutant (Leptoptilos dubius) und besonders der Marabu (Leptoptilos crumenifer) sind auf Aas spezialisiert. Ihr Schnabel ist aber zum Öffnen eines Kadavers ungeeignet, so dass diese Aufgabe von anderen Tieren übernommen werden muss. Dann wird das Fleisch aus dem Aas gezogen, bis zu 1 kg schwere Stücke werden in einem Stück verschlungen. Am Kadaver konkurrieren Marabus mit Geiern, Hyänen und Schakalen. Ihr mächtiger Schnabel dient dabei vor allem als Waffe, um sich gegen die Konkurrenten durchzusetzen. Marabus sind aber nicht ausschließlich Aasfresser – sie erbeuten ebenso wie andere Störche auch Fische, Amphibien und Nagetiere (Winkler et al. 2015, 2020a, del Hoyo et al. 1992, del Hoyo 2020, Coulter & Lawrence 1993, Kahl 1964, 1971, 1971a, 1973, 1972, 1987, 2009, Kahl & Peackock 1963, Dean 1964, Thabete et al. 2021, Hancock 1992, Bell-Cross 1974).
Einige Storcharten brüten in Kolonien, aber Arten wie der Schwarzstorch und Sattelstorch sind Einzelgänger. Für gewöhnlich nisten Störche auf Bäumen. Nur der Maguaristorch brütet überwiegend am Boden. Die Zeit von der Befruchtung bis zur Eiablage dauert ca. 2 Tage. Im Abstand von 2–3 Tagen werden meistens drei bis fünf, selten ein bis sieben Eier gelegt. Die Eier werden 25 bis 38 Tage von beiden Partnern bebrütet. Die Jungen sind untereinander friedlich, so dass oft die gesamte Brut durchgebracht werden kann. Beide Partner sind für die Beschaffung von Nahrung zuständig. Nach fünfzig bis hundert Tagen sind die Jungstörche flügge (Winkler et al. 2015, 2020a, del Hoyo et al. 1992, del Hoyo 2020, Koju et al. 2019, Katuwal et al. 2022, Adjakpa 2000).
Fossil sind Störche seit dem Oligozän überliefert. Älteste bekannte Art ist Palaeoephippiorhynchus dietrichi, der fossil in Ägypten gefunden wurde; beim noch älteren Eociconia sangequanensis (Eozän, China) bestehen Zweifel, ob es sich wirklich um einen Storch handelt. Aus dem Miozän sind bereits die rezenten Gattungen der „echten“ Störche (Ciconia), der Marabus (Leptoptilos) sowie der Sattel- und Riesenstörche (Ephippiorhynchus) bekannt. Die Fossilien zeigen, dass einige Gattungen, vor allem die Marabus, auch weiterverbreitet waren als heute (Miller et al. 1997; Louchart et al. 2005, 2008; Zhang et al. 2012; Noriega & Cladera 2008; Boles 2005; Dyke & Walker 2008; Mayr 2009, 2014, 2016, Abb. 3). Eine fossile Storchengattung, die mit den Marabus verwandt ist, ist Grallavis aus dem frühen Miozän von Frankreich und Libyen (De Pietri & Mayr 2014).

Abb. 3: einige fossile Storchtaxa
Suliformes
Die Ordnung der Suliformes umfasst vier rezente Familien: die Tölpel (Sulidae), die Fregattvögel (Fregatidae), die Kormorane (Phalacrocoracidae) und die Schlangenhalsvögel (Anhingidae). Als ausgestorbene Vogelfamilie sind hier noch die Plotopteridae zu nennen.
Gemeinsam ist allen Familien der Suliformes der Bau der Füße, bei denen alle vier Zehen durch eine Schwimmhaut verbunden sind. Ein weiteres allen Familien gemeinsames Merkmale ist das Fehlen eines Brutflecks und im Kehlbereich unbefiederte Haut, die einen mehr oder weniger großen Kehlsack bildet. Nasenlöcher sind geschlossen oder extrem verkümmert. Der Tarsometatarsus ist stark verkürzt und nur noch halb so lang wie der Carpometacarpus (Nelson 2005, Mayr 2008, Jarvis et al. 2014, Prum et al. 2015, Hackett et al. 2008).
Diese vier Familien wurden früher zusammen mit den Tropikvögeln und Pelikanen in die Ordnung der Pelicaniformes, auch Ruderfüßer genannt, gestellt. Erst molekularbiologische Untersuchungen haben gezeigt, dass die Pelikane, die Namensgeber der Ordnung eher mit den afrikanischen Schuhschnabel und Hammerkopf verwandt sind als mit den übrigen Suliformes und die Tropikvögel weder mit den Pelikanen noch mit den anderen Ruderfüßern verwandt sind, sondern zu den Eurypygimorphae gehören.
Fregattvögel (Fregatidae)
Fregattvögel (Fregatidae) sind die basalste Gruppe der Suliformes und kommen mit 5 Arten in einer Gattung an den Küsten und über das offene Meer in den tropischen und subtropischen Regionen der Erde vor. Sie haben lange, schmale Flügel, die Flügelspannweite liegt zwischen 175 und 244 cm, die Körperlänge zwischen 71 und 114 cm. Die Knochen sind sehr leicht gebaut und machen nur 5 % des Körpergewichts aus – ein Rekord im Vogelreich. Mit einem Gewicht von 600 bis 1600 g sind sie im Verhältnis zur Körpergröße zudem leichter als jeder andere Vogel. Zum Gewicht trägt mit 15 bis 20 % die kräftige Brustmuskulatur erheblich bei. Die Knochen des Schultergürtels sind miteinander verwachsen, was ebenfalls ein unter Vögeln einmaliges Merkmal ist. Der Oberarmknochen ist relativ kurz, Elle und Speiche dagegen stark verlängert. Durch all diese Merkmale sind Fregattvögel zu wendigen Flugmanövern imstande. Sie können wochenlang in der Luft bleiben, ohne einmal zu landen, schlafen auch währenddessen und können pro Tag Entfernungen bis über 400 km zurücklegen. Die Beine sind stark verkürzt und machen es dem Vogel nahezu unmöglich, zu gehen oder zu schwimmen. Anders als bei anderen Suliformes sind die Schwimmhäute zwischen den Zehen reduziert und mit ihren starken Krallen finden sie Halt beim Sitzen auf einem Ast. Der Schnabel ist schlank und kräftig. Er erreicht eine Länge von bis zu 15 cm und endet in einem spitzen Haken, der sowohl beim Festhalten schlüpfriger Beute hilfreich ist (Del Hoyo 2020, Winkler et al. 2015, 2020b, Nelson 2005, Abb. 4).
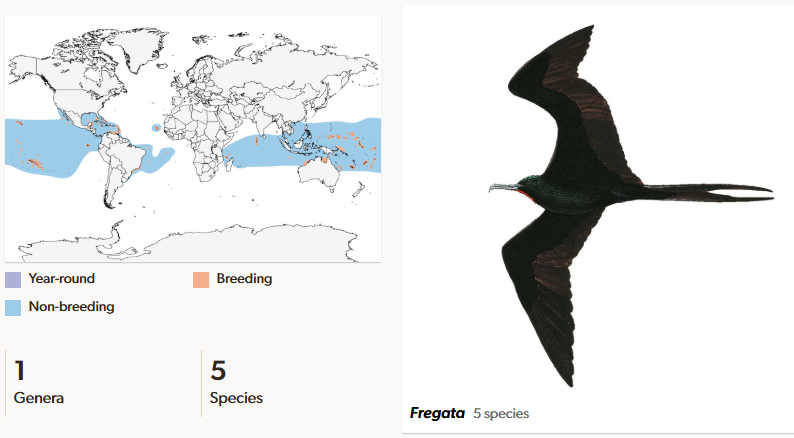
Abb. 4: Fregattvögel
Fregattvögel zeigen einen sehr auffälligen Geschlechtsdimorphismus (Abb. 5). Zunächst sind Weibchen im Schnitt 25 % größer als Männchen. Der viel deutlichere Unterschied besteht aber in der Färbung. Nur die Männchen haben einen stark vergrößerten Kehlsack, der zur Brutzeit leuchtend rot gefärbt ist und durch ballonartiges Aufblasen nochmals erheblich anwachsen kann. Das Gefieder ist bei adulten Männchen fast ausschließlich schwarz gefärbt, nur der männliche Weißbauch-Fregattvogel hat einen weißen Unterbauch. Weibchen haben eine weiße Brust, beim Weißbauch-Fregattvogel umfasst die weiße Färbung somit die gesamte Unterseite. Auch die Füße der Geschlechter sind unterschiedlich gefärbt: braun oder schwarz bei Männchen, weiß oder rot bei Weibchen. Abweichend vom oben beschriebenen Schema gibt es beim Adlerfregattvogel eine helle und eine dunkle Morphe der Weibchen. Fregattvögel haben ein auffälliges balzverhalten. Männliche Fregattvögel finden sich an den Küsten in kleinen Gruppen zusammen und werben gemeinsam. Dabei legen sie den Kopf in den Nacken und blähen ihren scharlachroten Kehlsack auf. Zugleich breiten sie die Flügel aus und präsentieren deren silbrigweiße Unterseiten. Ist ein Weibchen in der Nähe, beginnt das Männchen mit zitternden Kopfbewegungen und stößt trommelnde und schnarrende Geräusche aus (Del Hoyo 2020, Winkler et al. 2015, 2020b, Nelson 2005, Diamond 1972, Juola 2010, Trefry & Diamond 2017).
Sie brüten in Kolonien, und außerhalb der Brutzeit sieht man sie in Gruppen fliegen oder ruhen. Das Nest wird bevorzugt in hohen Bäumen errichtet, bei deren Fehlen auch in Sträuchern, und an vegetationslosen Küsten selbst auf dem Boden. Meistens wird nur ein Ei gelegt, das von beiden Elterntieren abwechselnd bebrütet wird. Das Junge schlüpft nach 40 bis 55 Tagen. Es ist zunächst nackt, entwickelt aber bereits in den ersten Tagen ein Daunenkleid. Nach wenigen Tagen lernt es, seinen Schnabel in den Schnabel oder den Kehlsack des Elternvogels zu stecken, was diesen dazu veranlasst, Futter hervorzuwürgen. Während des ersten Monats wird das Junge stets von einem Elternteil bewacht, danach immer öfter allein gelassen. Das Wachstum geht extrem langsam vonstatten. So dauert es viereinhalb bis sieben Monate, bis das Junge flugfähig ist. Auch hiernach sorgen die Elternvögel für das Junge, und zwar für mindestens neun Monate oder länger (Del Hoyo 2020, Winkler et al. 2015, 2020b, Nelson 2005, Nelson 1976).

Abb. 5: Sexualdimorphismus bei Fregattvögeln
Fregattvögel ernähren sich von Fischen, besonders Fliegende Fische werden bevorzugt. Ansonsten suchen Fregattvögel nach Fischen oder Kopffüßern, die so oberflächennah schwimmen, dass es nicht nötig ist, mehr als den Schnabel oder den Kopf einzutauchen. Bekannt sind die Fregattvögel auch, anderen Vögeln die Beute zu stehlen. Auch Eier und Jungvögel anderer Seevögel werden meistens aus der Luft erbeutet (Vickery & Brooke 1994, Osorno et al. 1992).
Fregattvögel sind eine sehr alte Vogelgruppe. Die Art Limnofregata azygosternon stammt aus dem Eozän Wyomings (Abb. 6) Eine weitere, größere und langschnäbligere Art derselben Epoche wurde erst kürzlich nachgewiesen und als Limnofregata hasegawai benannt. Die Limnofregata-Fregattvögel des Eozäns waren von heutigen Fregattvögeln offenbar recht verschieden. Sie hatten längere Zehen, die einen Ruderfuß bildeten, der mutmaßlich für eine schwimmende und tauchende Lebensweise geeigneter war als für die heutigen Fregattvögel (Olson 1977, Olson & Matsuika 2005, Stidham 2014, Ashmole 1963, Mayr & Kitchener 2024).

Abb. 6: Limnofregata
Tölpel (Sulidae)
Die Tölpel (Sulidae) sind nach ihrem unbeholfen wirkenden Gang auf dem Festland benannt, sind aber ausgezeichnete Flieger. 10 Arten in drei Gattungen (Morus, Sula, Papasula) sind beschrieben worden, und sind von der Arktis über die Tropen bis in die Subantarktis als Brutvögel vertreten (Abb. 7). Die kleinste Art, der Brauntölpel (Sula leucogaster), hat eine Körperlänge von 64 Zentimetern und ein Gewicht von 724 Gramm, der Basstölpel (Morus bassanus) hat als größte Art eine Körperlänge von 100 Zentimetern und wiegt bis zu 3,6 Kilogramm. Sie haben einen torpedoförmigen Körper, einen kurzen Hals, einen keilförmigen Schwanz und schmale abgewinkelte Flügel. Schwarze, braune und weiße Gefiederfarben herrschen vor, typisch für die Arten der Gattung Morus ist zudem die gelbe Kopf- und Halspartie. Im Gesichts- und Kehlbereich gibt es unbefiederte Stellen, die bunt gefärbt sein können und vor allem während der Balzzeit kräftig leuchtende Farben annehmen. Männchen und Weibchen unterscheiden sich zwar nicht im Gefieder, jedoch bei manchen Arten in der Schnabel- oder Augenfarbe; zudem sind die Weibchen größer (Abb. 8). Der lange und konisch geformte Schnabel verfügt über eine scharfe Kante, um Fische festhalten zu können. Der Graufußtölpel (Papasula abbotti) hat zudem einen Haken am Ende des Schnabels. Mit den nach vorn gerichteten Augen haben Tölpel eine gute Raumwahrnehmung. Tölpel haben sekundäre Nasenlöcher, die beim Tauchen durch bewegliche Klappen verschlossen werden können. Die langen und schmalen Flügel setzen relativ weit hinten am Körper an und ermöglichen ein geschicktes Gleiten in starkem Wind. Zum Abheben benötigen vor allem die größeren Arten Anlauf. Die Landung auf dem Land wirkt schwerfällig und kann mit Stürzen enden, da die schmalen Flügel keine wendigen Manöver erlauben. Die Beine setzen weit hinten am Körper an und ermöglichen nur einen watschelnden Gang, sind aber beim Schwimmen und Tauchen hilfreich (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020c, Nelson 2005).

Abb. 7: Tölpel

Abb. 8: Sexualdimorphismus bei Tölpeln
Die in Kolonien brütenden Tölpel sind nicht nur in der Lage, ihre Partner und ihre Jungen an deren Stimme zu erkennen, sondern auch die in unmittelbarer Nachbarschaft brütenden Vögel zu identifizieren. Bei manchen Arten bestehen ausgeprägte Unterschiede zwischen den Rufen der beiden Geschlechter, so beim Blaufuß-, Braun- und Masken-Tölpel (Sula nebouxii, Sula leucogaster, Sula dactylatra). Bei ihnen pfeifen die Männchen, während die Weibchen eher Grunzlaute von sich geben. Beim Kaptölpel (Morus capensis) und beim Australischen Tölpel (Morus serrator) ist die Stimme der Männchen höher als die der Weibchen. Beim Basstölpel (Morus bassanus) dagegen besteht kein geschlechtsabhängiger Unterschied bei den Rufen. Die meisten Tölpel-Arten brüten in Kolonien. Als Brutplätze kommen flache Strände ozeanischer Inseln, steile Klippen oder Bäume in Betracht. Blaufuß- und Maskentölpel gehören zu den Bodenbrütern; der Basstölpel (Morus bassanus) ist ein typischer Klippennister; Rotfuß- und Graufußtölpel (Sula sula, Papasula abbotti) sind hingegen Baumbrüter. Die einzige europäische Art ist der Basstölpel (Morus bassanus), der seit den 1990er Jahren auch auf der Insel Helgoland brütet. Die dortige Kolonie hat sich stetig vergrößert und umfasst mittlerweile mehr als 200 Brutpaare. Bei den meisten Arten besteht das Gelege nur aus einem Ei. Ausnahmen sind Blaufuß-, Masken- und Weißbauchtölpel (Sula nebouxii, Sula dactylatra, Sula leucogaster) mit je zwei und der Guanotölpel (Sula variegata) mit im Schnitt sogar drei Eiern je Gelege. Auch bei Arten, die mehrere Eier legen, wird in der Regel nur ein Küken aufgezogen, während das zweite Ei, entsprechend der Reserveei-Hypothese lediglich als Versicherung dient, falls das zuerst gelegte Ei entweder nicht befruchtet war oder es durch das Absterben des Embryos nicht zum Schlupf kam. Schlüpft das zweite Küken, wird es von dem älteren und stärkeren Küken getötet. Lediglich beim Guanotölpel (Sula variegata) werden mehr als ein Jungtier flügge, weil das Nest ständig von einem Elterntier bewacht wird (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020c, Nelson 2005, Anderson 1990, Anderson & Ricklefs 1995).
Kap- Bass- und Australischer Tölpel (Morus capensis, Morus bassanus, Morus seerator) sind lebenslang monogam, während die anderen Arten mit jährlich wechselnden Partner Saisonehen eingehen können. Tölpel zeigen in Kolonien eine Reihe ritualisierter Verhaltensweisen, die der Paarbindung, der Aggressionsvermeidung oder anderen Zwecken dienen. Oft gibt es ein festes Begrüßungsritual, sobald ein Partner zum Nest zurückkehrt, sowie weitere ritualisierte Gesten, zum Beispiel, wenn ein Partner das Nest verlässt.
Die frühesten Nachweise von Tölpeln könnten aus dem frühen Eozän stammen. So findet sich ein fossiler Schädel der Gattung Masillastega aus der Grube Messel und aus marinen Ablagerungen Rumäniens die Gattung Eostega. Die Zugehörigkeit dieser Fossilien zu den Tölpeln ist jedoch nur schwach begründet (Mayr 2009). Eindeutige Nachweise sind erst ab dem Miozän bekannt und stammen alle von marinen Fossilfundstellen. Von besonderem Interesse ist das Vorkommen von sehr kleinen Arten im Miozän Europas und Nordamerikas, die dem Taxon Microsula zugeordnet werden (Olson 1985; Göhlich 2003). Vor allem aus Amerika sind viele miozäne und pliozäne Tölpel beschrieben worden, und es gab eine große Vielfalt dieser Vögel in der frühen pliozänen Pisco-Formation in Peru, wo fünf Arten unterschieden wurden (Warheit 2002; Stucchi 2003; Stucchi & Urbina 2004). Hierzu gehört auch eine kleine Art, die etwa 10-15 % kleiner war als die kleinste heute lebende Art, der Rotfußtölpel (Stucchi 2003). Ein besonders bemerkenswertes Taxon aus der Pisco-Formation ist Ramphastosula, das nur von Schädelresten bekannt ist und sich in der Schnabelform erheblich von den heutigen Tölpeln unterscheidet, wobei der obere Schnabel tiefer und stärker gebogen ist. Aufgrund dieses Unterschieds in der Schnabelmorphologie war Ramphastosula möglicherweise nicht in gleichem Maße wie die heutigen Tölpel an das Sturztauchen angepasst (Stucchi & Urbina 2004). Die Gattung Morus, zu der heute nur Kap-, Bass- und Australischer Tölpel gehören und die eher gemäßigte Küstenregionen bewohnen, waren in der Vergangenheit vielfältiger und es wurden nicht weniger als drei Arten aus dem späten Miozän bzw. Pliozän der nordamerikanischen Ostküste beschrieben (Olson & Rasmussen 2001). Im Miozän und Pliozän war die Familie grundsätzlich weit artenreicher vertreten als heute und besiedelte auch den Nordpazifik, in dem Tölpel heute fehlen. Tölpel entwickelten sich offenbar auf der Nordhalbkugel. Auf der Südhalbkugel finden sich fossile Tölpel erst seit dem Pliozän, also relativ spät. Aus dem nördlichen Pazifik verschwanden sie erst im Pleistozän; die Gründe hierfür sind unbekannt (Abb. 9).

Abb. 9: Fossile Tölpel
Kormorane (Phalacrocoracidae)
Kormorane kommen in 40 oder 41 Arten in 7 Gattungen auf allen Kontinenten vor, bevorzugen jedoch die wärmeren Breitengrade (Abb. 10). Unter den Kormoranen gibt es viele Endemiten, die ausschließlich auf kleinen Inseln vorkommen, darunter die Galapagosscharbe (Nannopterum harrisi), der Sokotrakormoran (Phalacrocorax nigrogularis) und die Chathamscharbe (Leucocarbo onslowi); auf vielen subantarktischen Inseln gibt es weitere Beispiele. Andere Arten haben hingegen extrem große Verbreitungsgebiete; so ist der Gemeine Kormoran (Phalacrocorax carbo) beinahe ein Kosmopolit. Man findet sie sowohl an Meeresküsten als auch an Binnengewässern. Manche Arten leben ausschließlich im Binnenland, andere ausschließlich an Küsten und weitere haben beide Lebensräume gleichermaßen besiedelt. Arten der gemäßigten Breiten sind Zugvögel.

Abb. 10: Kormorane
Ihre Körperlänge variiert zwischen 0,45 und 1,0 m, das Gewicht zwischen 360 und 2800 g (bei der Galapagosscharbe Nannopterum harrisi bis 4000 Gramm). Es gibt zwei Färbungstypen: Eine Reihe von Arten ist einfarbig schwarz oder dunkelbraun. Bei der zweiten Färbungsvariante ist nur die Oberseite dunkel, die Unterseite weiß. Zweifarbige Arten sind auf der Südhalbkugel verbreiteter, weitgehend einfarbige auf der Nordhalbkugel. Manchmal kommen beide Färbungsvarianten innerhalb einer Art vor, beispielsweise bei der Kräuselscharbe (Microcarbo melanoleucos) und der Stewartscharbe (Leucocarbo stewarti). Einen auffälligen Geschlechtsdimorphismus gibt es nicht; allerdings sind Männchen im Schnitt größer und schwerer als Weibchen. Kormorane haben einen langen Hals und einen ziemlich langen, keilförmigen Schwanz. Wie alle Vögel der Ordnung Suliformes haben sie einen dehnbaren Kehlsack, in dem Fische vor dem Schlucken verwahrt werden können. Der Schnabel ist lang, relativ hoch und an der Spitze scharf hakenförmig gebogen. Die Nasenöffnungen sind verwachsen. Die Beine setzen weit hinten am Körper an und ermöglichen an Land nur einen unbeholfen wirkenden, watschelnden oder hüpfenden Gang. Die Füße sind vierzehig und mit Schwimmhäuten versehen, wie es für die Suliformes typisch ist. Im Wasser bewegen sich Kormorane sehr gewandt, wobei die kräftigen Füße als Antrieb genutzt werden. Beim Tauchen werden beide Beine gleichzeitig und parallel als Paddel eingesetzt. Die Flügel sind dabei meist dicht am Körper angelegt. Der Schwanz dient als Ruder. Das dichte, wenig pneumatisierte Skelett verringert den Auftrieb. So können Kormorane schnell und mit geringem Energieaufwand größere Tiefen erreichen. Die Flügel sind relativ kurz, leicht gerundet und werden im Flug im Handgelenk meist stark gewinkelt. Die Flügelschläge sind kräftig und fördernd. Zum Auffliegen müssen Kormorane eine lange Strecke über die Wasseroberfläche laufen, ehe sie abheben können. Die Landung erfolgt aufrecht, mit gefächertem Schwanz und vorgestreckten Füßen. Eine Art, die Galapagosscharbe (Nannopterum harrisi), ist flugunfähig; ihre Flügel sind stark reduziert. Die Vertreter dieser Familie sind in erster Linie Fischfresser, andere Arten fressen zudem wirbellose Wassertiere wie Tintenfische, Schecken und Krebse. Kormorane legen zwei bis vier Eier, wobei das zuletzt geschlüpfte Jungtier nicht überlebt, weil es nicht kräftig genug ist, sich gegen seine Geschwister zu behaupten (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020d, Kennedy et al. 2000).
Neben kormoranähnlichen Schnabelfragmenten aus dem späten Eozän Englands und dem frühen Oligozän Ägyptens gibt es in Privatsammlungen vollständige Skelette von kleinen Kormoranen aus dem frühen Oligozän Frankreichs, die noch auf eine Beschreibung warten (Mayr 2009). Im späten Oligozän waren die Kormorane bereits diversifiziert und weit verbreitet, und es gab drei verschiedene Taxa: Nambashag in Neuseeland sowie Borvocarbo und Oligocorax in Europa. Eines der phylogenetisch am frühesten divergierenden Kormoranttaxa ist vermutlich Borvocarbo (Mourer-Chauviré et al. 2004; Mayr 2010, Worthy 2011). Er war etwas kleiner als die kleinsten heute lebenden Kormorane, seine Skelettmorphologie ist nur unzureichend bekannt. Bekannter ist die Gattung Oligocorax, von dem mehrere vollstände Skelette gefunden wurden (Mayr 2015b). Oligocorax ist etwas größer als der Zwergkormoran (Microcarbo pygmaeus), und seine Zugehörigkeit zu den Kormoranen lässt sich anhand mehrerer abgeleiteter Merkmale feststellen, darunter ein kräftiger Oberschenkelknochen, eine sehr große Patella und eine lange vierte Zehe (Smith 2010; Mayr 2015b). Oligocorax weist jedoch eine Reihe von plesiomorphen Merkmalen auf, die seine Position außerhalb der Kronengruppe unterstützen (Mayr 2015a).
Ein weiterer vermutlich basaler Kormoran ist Nectornis, der im Miozän Frankreichs der Türkei und Kenias entdeckt wurde (Cheneval 1984; Mayr 2014, Göhlich & Mourer-Cauvire 2010 ). Nectornis unterscheidet sich von der Kronengruppe der Kormorane durch einige Skelettmerkmale, die auf andere Fortbewegungsmerkmale hinweisen, darunter ein anders geformtes proximales Ende des Oberarmknochens und einen schlankeren Oberschenkelknochen (Mayr 2015b). Die Fossilienaufzeichnungen deuten darauf hin, dass sich Kormorane in der Alten Welt entwickelt haben, von wo alle paläogenen Fossilien stammen, und die frühesten Vertreter waren kleine Vögel. Ab dem mittleren Miozän wurden von verschiedenen Orten rund um den Globus nur noch Kormorane der modernen Gattungen gemeldet. In Südamerika traten die Kormorane erstmals im späten Miozän oder frühen Pliozän von Chile auf (Walsh & Hume 2001).
Schlangenhalsvögel (Anhingidae)
Die nächsten Verwandten der Kormorane sind die Schlangenhalsvögel (Anhingidae). Sie sind den Kormoranen in vielerlei Hinsicht ähnlich, auffällig ist aber ihr langer s-förmig gebogener Hals. Schlangenhalsvögel haben je nach Art eine Körperlänge von 81 bis 97 cm und sind 1060 bis 1350 Gramm schwer. Die Flügelspannweite beträgt im Durchschnitt etwa 120 cm. Die kräftige Halsmuskulatur erlaubt es dem Vogel, den spitzen Schnabel blitzschnell vorzustoßen und so seine (Fisch-)Beute zu erdolchen (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020e, Abb. 11). Aufgrund der Ähnlichkeit zu den Kormoranen ordnen einige Forscher sie als Unterfamilie ein (z. B. Cracraft 1985, Kennedy et al. 1998). Heute kommen vier Arten in einer Gattung vor, mit je einer Art in den Tropen und Subtropen Afrikas, Asiens, Australiens, sowie Nord- und Südamerikas. Sie waren aber früher deutlich artenreicher und es gab in den jeweiligen geographischen Regionen mehr als eine Art.
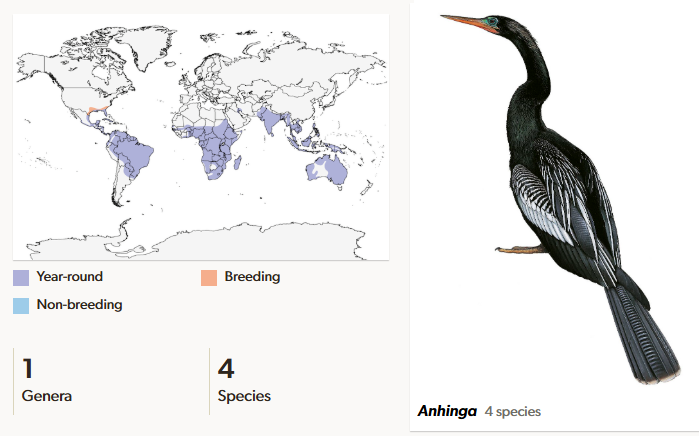
Abb. 11: Schlangenhalsvögel
Fossil sind Schlangenhalsvögel mit Anhinga walterbolesi ab dem späten Oligozän bis frühen Miozän von Australien belegt. Anhinga pannonica aus dem mittleren bis späten Miozän ist die einzige bekannte Art, deren Verbreitungsgebiet auch weite Teile Europas umfasste. Ebenfalls aus dem späten Miozän stammt der älteste bekannte Vertreter aus der Neuen Welt, Anhinga subvolans, der zunächst für einen Vertreter der Kormorane gehalten wurde. Bemerkenswert ist ferner der südamerikanische Macranhinga paranensis, der mit einem Durchschnittsgewicht von 5,4 kg die heutigen Arten bei weitem übertraf. Andere fossile Schlangenhalsvögel sind die Gattungen Giganhinga aus Uruguay und Megahinga aus Chile, die möglicherweise flugunfähig waren (Becker 1986, Alvarenga 1995; Campbell 1996; Cozzuol 2006, Noriega & Alvarenga 2002; Alvarenga & Guilherme 2003; Guilherme et al. 2020, Areta et al. 2007; Cenizo & Agnolín 2010; Rinderknecht & Noriega 2002; Noriega 2001; Mlíkovský 2002; Dyke & Walker 2008; Louchart et al. 2008, Worthy 2012, Mayr 2009, 2016, Mayr et al. 2020).
Der ursprünglich als ältester Schlangenhalsvogel beschriebene Protoplotus beauforti aus dem Eozän ist nach heutiger Auffassung kein Schlangenhalsvogel; seine tatsächliche Zuordnung bleibt rätselhaft (Mayr 2009, Tets et al. 1989, Rich et al. 1986). Als einzige rezente Art ist der Amerikanische Schlangenhalsvogel (Anhinga anhinga) fossil aus dem Pleistozän nachgewiesen.
Plotopteridae
Eine ausgestorbene Familie der Suliformes sind die Plotopteridae, flugunfähige Vögel Seevögel, die vom mittleren Eozän bis zum frühen Miozän an den Küsten des nördlichen Pazifiks lebten (Abb. 12). Sie nahmen im nördlichen Pazifik die ökologische Nische der nur in den südlichen Weltmeeren lebenden Pinguine ein und hatten sich konvergent zu ihnen entwickelt. Sie ähneln zwar den Pinguinen, ihre Merkmale weisen sie aber eindeutig als Suliformes zu. Zu den Plotopteridae gehörten die größten bekannten Tauchvögel; die größte Art maß vom Schnabel bis zur Schwanzspitze mehr als zwei Meter.

Abb. 12: Plothopteridae
Eines der frühesten Taxa, Phocavis aus dem Eozän von Oregon, ist nur durch einen einzigen Tarsometatarsus bekannt (Goedert 1988), aber andere Plotopteridae sind durch umfangreichere Fossilien vertreten. Diese Vögel waren im späten Eozän und Oligozän im nordöstlichen Pazifik, entlang der westlichen nordamerikanischen Küste, besonders zahlreich vertreten. Besonders reichhaltig ist der Fossilnachweis in den marinen Ablagerungen im Bundesstaat Washington, USA, aus denen mindestens zwei Arten der Gattung Tonsala gemeldet wurden (Olson 1980; Goedert & Cornish 2000; Dyke et al. 2011, Mayr et al. 2015, Mayr & Goedert 2016, 2017, 2021). Zu den jüngsten nordamerikanischen Plotopteridae gehören das vergleichsweise kleine Plotopterum und das sehr ähnliche Stemec aus dem späten Oligozän von Kalifornien bzw. British Columbia (Howard 1969, Kayser et al. 2015). In Japan sind die Gattungen Copepteryx und Hokkaidornis aus dem Oligozän beschrieben (Olson & Hasegawa 1979, 1985, 1996; Sakurai et al. 2008; Hasegawa et al. 1977, Kayser et al. 2015). Die meisten dieser japanischen Plotopteridae waren sehr große Vögel, aber ein Oberschenkelknochen des kleineren Plotopterum wurde in Gesteinen des mittleren Miozäns gefunden (Olson & Hasegawa 1985; Kayser et al. 2015). Die Flügel der Plotopteridae sind den Flossen der Pinguine bemerkenswert ähnlich. Das Schulterblatt ist wie bei Pinguinen mit Ausnahme des basal abweichenden Waimanu stark erweitert, und wie bei den Pinguinen ist der Tarsometatarsus sehr kurz. Der Schädel der Plotopteridae unterscheidet sich in seinen Proportionen sowie in abgeleiteten Merkmalen wie einem breiten Nasensteg und einem ausgeprägten nasofrontalen Scharnier von dem der Pinguine und ähnelt dem Schädel der Tölpel (Mayr et al. 2015; Kawabe et al. 2014). Plotopteridae unterscheiden sich von den Pinguinen (einschließlich sehr früher Stammgruppenvertreter wie Waimanu) auch dadurch, dass der Schädel keine über den Augenhöhlen liegenden Öffnungen für Salzdrüsen aufweist, weiterhin bestehen Unterschiede im Gabelbein und Rabenbein. Die Form ihres Gehirns ähnelt dagegen der von Pinguinen und unterscheidet sich von den Suliformes (Kawabe et al. 2014). Die meisten Autoren führten die Ähnlichkeiten zwischen Plotopteridae und Pinguinen auf Konvergenz zurück und betrachteten die Plotopteridae als eng mit den Kormoranen und Schlangenhalsvögeln verwandt (Olson 1980; Olson & Hasegawa 1996; Smith 2010), aber es wurde auch eine Schwestergruppenbeziehung mit den Pinguinen vorgeschlagen (Mayr 2005; siehe auch Mayr et al. 2015). In einigen Punkten unterscheiden sich die Plotopteridae deutlich von den heutigen Suliformes. Die Nasenlöcher sind beispielsweise lang und schlitzförmig, während sie bei allen Sulifomes stark reduziert sind, und die Gaumenlöcher weisen nicht die abgeleitete Morphologie der Suliformes auf. Diese plesiomorphen Merkmale der Plotopteridae sprechen für ihre Stellung außerhalb einer Gruppe, die Tölpel, Kormorane und Schlangenhalsvögel umfasst. Einige der abgeleiteten Merkmale, die sie mit Kormoranen und Schlangenhalsvögeln teilen, wie z. B. eine stark vergrößerte Patella, sind daher wahrscheinlich das Ergebnis einer konvergenten Evolution (Mayr et al. 2015).
Eine endgültige Klassifizierung der Plotopteridae hängt nicht nur von einem besseren Verständnis der Morphologie von Phocavis aus dem späten Eozän ab, einem der frühesten Vertreter der Gruppe. Entscheidend für die Beurteilung der Verwandtschaft dieser Vögel wäre auch die Entdeckung von Exemplaren, bei denen die Hinterzehe erhalten ist, die vermutlich sehr lang ist, wenn die Plotopteridae tatsächlich am engsten mit den Suliformes verwandt sind. Der evolutionäre Ursprung der Plotopteridae ist nach wie vor wenig bekannt, ebenso wie die Faktoren, die zu ihrem Aussterben führten, das im Wesentlichen mit dem der Riesenpinguine zusammenfiel. Es wurde angenommen, dass das Aussterben der Plotopteridae auf die Evolution der Robben zurückzuführen ist, die Plotopteridae zur Beute gemacht haben könnten und wahrscheinlich auch um Brutplätze auf vorgelagerten Inseln konkurrierten (Goedert & Cornish 2000).
Diese Hypothese stimmt zumindest für die nordamerikanische Küste mit der Tatsache überein, dass der Anstieg des Meeresspiegels im Känozoikum zunächst zum Verschwinden der vorgelagerten Inseln an den Küsten Washingtons und Oregons führte, während solche Inseln in Kalifornien, von wo einige der letzten nordamerikanischen Plotopteridae stammen, länger bestehen blieben (Goedert & Cornish 2002). Ob in Japan ein ähnliches Muster zu beobachten ist, wurde jedoch noch nicht untersucht, und für ein umfassendes Verständnis der Gründe, die zum Aussterben dieser ungewöhnlichen Vögel führten, sind weitere Daten erforderlich.
In der nächsten Episode schauen wir uns die letzte Gruppe der Aequornithes an: die Pelecaniformes.
Literatur
Adjakpa, JB (2000): The breeding biology of Abdim’s Stork in the far north of Benin. Ostrich. 71 (1–2): 61–63.
Alvarenga, H.M.F. (1995): A large and probably flightless anhinga from the Miocene of Chile. Courier Forschungsinstitut Senckenberg 181, 149–161.
Alvarenga, H. M.F.; Guilherme, E. (2003): The anhingas (Aves: Anhingidae) from the upper tertiary (Miocene-Pliocene) of southwestern Amazonia. J. Vertebr. Paleontol. 23 (3): 614–621.
Anderson, DJ (1990): Evolution of obligate siblicide in boobies. 1: A test of the insurance egg hypothesis. American Naturalist 135:334-350. doi:10.1086/285049.
Anderson, DJ (1995): The role of parents in sibilicidal brood reduction of two booby species. The Auk 112(4): 860–869. doi:10.2307/4089018.
Anderson, DJ, Ricklefs, RE (1995): Evidence of kin-selected tolerance by nestlings in a siblicidal bird. Behavioral Ecology and Sociobiology volume 37, S. 163–168
Areta, J. I.; Noriega, J. I.; Agnolin, F. (2007): A giant darter (Pelecaniformes: Anhingidae) from the Upper Miocene of Argentina and weight calculation of fossil Anhingidae. Neues Jahrbuch für Geologie und Paläontologie – Abhandlungen. 243 (3): 343–350.
Ashmole, NP (1963): Sub-fossil bird remains on Ascension Island. Ibis. 103 (3): 382–89.
Becker, JJ (1986): Reidentification of Phalacrocorax subvolans Brodkorb as the earliest record of Anhingidae. The Auk, 103, (4), S. 804–808.
Bell-Cross, G. (1974): Observations on fish-eating birds in central Africa. Honeyguide, 77: 23–31.
Boles, WE (2005): A review of the Australian fossil storks of the Genus Ciconia (Aves: Ciconiidae), with the Description of a New Species. In: Records of the Australian Museum Band 57, S. 165–178.
Campbell, K.E. Jr. (1996): A new species of giant anhinga (Aves: Pelecaniformes: Anhingidae) from the upper Miocene (Huayquerian) of Amazonian Peru. Natural History Museum of Los Angeles County Contributions in Science. 460: 1–9.
Cenizo, M.M., Agnolín, F.L. (2010): The southernmost records of Anhingidae and a new basal species of Anatidae (Aves) from the lower–middle Miocene of Patagonia, Argentina. Alcheringa 34, 493–514.
Cheneval, J. (1984): Les oiseaux aquatiques (Gaviiformes à Ansériformes) du gisement aquitanien de Saint-Gérand-le-Puy (Allier, France): Révision systématique. Palaeovertebrata 14, 33–115.
Coulter, MC.; Lawrence BA (1993): Foraging Ecology of Wood Storks (Mycteria americana) in East-Central Georgia I. Characteristics of Foraging Sites. Colonial Waterbirds. 16 (1): 59–70.
Cozzuol, M.A (2006): The Acre vertebrate fauna: Age, diversity, and geography, Journal of South American Earth Sciences, 21 (3): 185–203
Cracraft, J. (1985): Monophyly and phylogenetic relationships of the Pelecaniformes: A numerical cladistic analysis. The Auk. 102, S. 834–853.
Dean, GJW (1964): Stork and egret as predators of the red locust in the Rukwa Valley outbreak area. Ostrich. 35 (2): 95–100.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliot, A.; Sargatal, J., eds. (1992): Handbook of the Birds of the World, volume 1, Ostrich to Dodos, Lynx Edicions, Barcelona.
De Pietri, VL, Mayr, G (2014): The phylogenetic relationships of the Early Miocene stork Grallavis edwardsi, with comments on the interrelationships of living Ciconiidae (Aves). Zoologica Scripta 43, 576–585.
Diamond, AW (1972): Sexual dimorphism in breeding cycles and unequal sex ratio in Magnificent Frigatebirds. Ibis 114; S. 395–398
Dyke, GJ, Walker, CA (2008): New records of fossil “waterbirds” from the Miocene of Kenya. American Museum Novitates 3610, 1–12.
Dyke, G. J.; Wang, X.; Habib, M. B. (2011): Fossil Plotopterid Seabirds from the Eo-Oligocene of the Olympic Peninsula (Washington State, USA): Descriptions and Functional Morphology. PLOS ONE. 6 (10): e25672.
Goedert, JL (1988): A new genus of penguin-like pelecaniform bird from the Oligocene of Washington (Pelecaniformes : Plotopteridae). Proceedings of the California Academy of Sciences. 45 (6): 97–102.
Goedert, JL.; Cornish, J (2000): Preliminary Report on the Diversity and Stratigraphic Distribution of the Plotopteridae (Pelecaniformes) in Paleogene Rocks of Washington State, USA. In Zhou, Z.; Zhang, F. (eds.). Proceedings of the 5th symposium of the Society of Avian Paleontology and Evolution, Beijing, 1-4 June 2000. Beijing: Science Press. pp. 63–76.
Göhlich, U.B. (2003): The avifauna of the Grund Beds (Middle Miocene, Early Badenian, northern Austria). Annalen des Naturhistorischen Museums in Wien 104, 237–249.
Göhlich, UB, Mourer-Cauvire, C (2010): A new cormorant-like bird (Aves: Phalacrocoracoidea) from the Early Miocene of Rauscherod (Southern Germany). Records of the Australian Museum 62:61-70
Guilherme, E.; Souza, L. G. D.; Loboda, T. S.; Ranzi, A.; Adamy, A.; Dos Santos Ferreira, J.; Souza-Filho, J. P. (2020): New material of Anhingidae (Aves: Suliformes) from the upper Miocene of the Amazon, Brazil. Historical Biology. 33 (11): 1–10.
Hackett, S. J. et al. (2008): A phylogenomic study of birds reveals their evolutionary history. Science 320: 1763–1768.
Hancock, K (1992): Storks, Ibises and Spoonbills of the World. Princeton University Press
Hasegawa, Y.; Okumura, Y.; Okazaki, Y. (1977): A Miocene Bird Fossil from Mizunami, Central Japan. Bull. Mizunami Fossil Mus. 4: 119–138.
Howard, H. (1969): A new avian fossil from Kern County, California. The Condor. 71 (1): 68–69.
Jarvis, E. D.; et al. (2014): Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 346 (6215): 1320–1331
Juola, F.A. (2010): Mate Choice in a Sexually Dimorphic Marine Bird, the Great Frigatebird (Fregata minor).
Kahl, MP (1964): Food Ecology of the Wood stork (Mycteria americana) in Florida.
Kahl, MP (1971): Food and feeding behavior of Openbill Storks. Journal of Ornithology. 112 (1): 21–35.
Kahl, MP (1971a): Observations on the Jabiru and Maguari storks in Argentina, 1969. The Condor. 73 (2): 220–229.
Kahl, MP (1972): A revision of the family Ciconiidae (Aves). Journal of Zoology. 167 (4): 451–461.
Kahl, MP (1973): Comparative ethology of the Ciconiidae. Part 6. The blacknecked, saddlebill, and jabiru storks (genera Xenorhynchus, Ephippiorhynchus, and Jabiru). The Condor. 75 (1): 17–27
Kahl, MP (1987): An Overview of the Storks of the World. Colonial Waterbirds. 10 (2): 131–134.
Kahl, MP (2009): A Contribution to the Ecology and Reproductive Biology of the Marabou Stork (Leptoptilos Crumeniferus) in East Africa. Journal of Zoology, 148: 289–311.
Kahl, MP; Peacock, LJ (1963): The Bill-snap Reflex : a Feeding Mechanism in the American Wood Stork. Nature. 199 (4892): 505–506.
Katuwal, Hem B. et al. (2022): Factors affecting the breeding ecology of the globally threatened Lesser Adjutant (Leptoptilos javanicus) in agricultural landscapes of Nepal. Avian Conservation and Ecology. 17 (2): 15.
Kawabe, S., Ando, T., Endo, H. (2014): Enigmatic affinity in the brain morphology between plotopterids and penguins, with a comprehensive comparison among water birds. Zoological Journal of the Linnean Society 170, 467–493.
Kayser, G.; Watanabe, J.; Johns, M. (2015). A new member of the family Plotopteridae (Aves) from the late Oligocene of British Columbia, Canada. Palaeontologia Electronica. 18.3.52A: 1–18.
Kennedy, M; Gray, RD.; Spencer, HG (2000): The Phylogenetic Relationships of the Shags and Cormorants: Can Sequence Data Resolve a Disagreement between Behavior and Morphology?. Molecular Phylogenetics and Evolution. 17 (3): 345–359.
Kennedy, M, Spencer, HG, Gray RD (1998): Hop, step and gape: do the social displays of the Pelecaniformes reflect phylogeny? Animal Behaviour 51, S. 273–291.
Kimball, RT et al. (2013): Identifying localized biases in large datasets: A case study using the Avian Tree of Life. Mol Phylogenet Evol. 69 (3): 1021–32.
Koju, R; Maharjan, B; Gosai, KR; Kittur, S; Sundar, KSG (2019): Ciconiiformes nesting on trees in cereal-dominated farmlands: importance of scattered trees for heronries in lowland Nepal. Waterbirds. 42 (4): 355–365.
Kuhl, H. et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38: 108–127.
Kuramoto T, Nishihara H, Watanabe M, Okada N (2015): Determining the position of storks on the phylogenetic tree of waterbirds by retroposon insertion analysis, Genome Biol. Evol. 7, 3180-89.
Louchart, A., Haile-Selassie, Y., Vignaud, P., Likius, A., Brunet, N. (2008): Fossil birds from the Late Miocene of Chad and Ethiopia and zoogeographical implications. Oryctos 7, 147–167.
Louchart, A., Vignaud, P., Likius, A., Brunet, M., White, T.D. (2005): A large extinct marabou stork in African Pliocene hominid sites, and a review of the fossil species of Leptoptilos. Acta Palaeontologica Polonica 50, 549–563.
Mayr, G. (2005): Tertiary plotopterids (Aves, Plotopteridae) and a novel hypothesis on the phylogenetic relationships of penguins (Spheniscidae). Journal of Zoological Systematics and Evolutionary Research 43, 61–71.
Mayr, G. (2008): Avian higher-level phylogeny: well-supported clades and what we can learn from a phylogenetic analysis of 2954 morphological characters. J. Zool. Syst. Evol. Res. 46 (1): 63–72
Mayr, G. (2009): Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G. (2010): Mousebirds (Coliiformes), parrots (Psittaciformes), and other small birds from the late Oligocene/early Miocene of the Mainz Basin, Germany. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 258, 129–144.
Mayr, G. (2014): On the middle Miocene avifauna of Maboko Island, Kenya. Geobios 47, 133–146.
Mayr, G. (2015a): New remains of the Eocene Prophaethon and the early evolution of tropicbirds (Phaethontiformes). The Ibis 157, 54–67.
Mayr, G. (2015b): A new skeleton of the late Oligocene “Enspel cormorant” – from Oligocorax to Borvocarbo, and back again. Palaeobiodiversity and Palaeoenvironments 95, 87–101.
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G.; Goedert, J. L. (2016): New late Eocene and Oligocene remains of the flightless, penguin-like plotopterids (Aves, Plotopteridae) from western Washington State, U.S.A.. Journal of Vertebrate Paleontology. 36 (4): e1163573.
Mayr, G.; Goedert, J. L. (2017): First record of a tarsometatarsus of Tonsala hildegardae (Plotopteridae) and other avian remains from the late Eocene/early Oligocene of Washington State (USA). Geobios. 51: 51–59.
Mayr, G.; Goedert, J. L. (2021): New late Eocene and Oligocene plotopterid fossils from Washington State (USA), with a revision of “Tonsala” buchanani (Aves, Plotopteridae). Journal of Paleontology. 96 (1): 224–236.
Mayr, G.; Goedert, J. L.; Vogel, O. (2015): New late Eocene and Oligocene plotopterid fossils from Washington State (USA), with a revision of “Tonsala” buchanani (Aves, Plotopteridae). Journal of Vertebrate Paleontology. 35 (4): 1–14.
Mayr, G.; Kitchener, A. (2024): A large frigatebird-like tarsometatarsus from the London Clay of Walton-on-the-Naze (Essex, UK) may shed light on the affinities of a poorly known early Eocene seabird taxon. Acta Palaeontologica Polonica.
Mayr, G, Lechner, T, Böhme, M (2020): The large-sized darter Anhinga pannonica (Aves, Anhingidae) from the late Miocene hominid Hammerschmiede locality in Southern Germany. PLoS ONE, 15(5), e0232179
Miller, E.R., Rasmussen, D.T., Simons, E.L. (1997): Fossil storks (Ciconiidae) from the Late Eocene and Early Miocene of Egypt. Ostrich 68, 23–26.
Mlíkovský, J (2002): Cenozoic Birds of the World, Part 1: Europe. Ninox Press, Prague.
Mourer-Chauviré, C., Berthet, D., Hugueney, M. (2004): The late Oligocene birds of the Créchy quarry (Allier, France), with a description of two new genera (Aves: Pelecaniformes: Phalacrocoracidae, and Anseriformes: Anseranatidae). Senckenbergiana lethaea 84, 303–315.
Nelson, BI (1976): The breeding biology of frigatebirds – a comparative review. Living Bird 14; S. 113–155
Nelson, BI (2005): Pelicans, Cormorants and their relatives. Oxford University Press
Noriega, JI (2001): Body mass estimation and locomotion of the Miocene pelecaniform bird Macranhinga. Acta Palaeontologica Polonica, 46(2), S. 247–260.
Noriega, J.I., Alvarenga, H.M.F. (2002): Phylogeny of the Tertiary giant darters (Pelecaniformes: Anhingidae) from South America. In: Z.-H. Zhou & F.-Z. Zhang (eds.), Proceedings of the 5th Symposium of the Society of Avian Paleontology and Evolution, 1–4 June 2000. Beijing: Science Press, pp. 41–49.
Noriega, J.I., Cladera, G. (2008): First record of an extinct marabou stork in the Neogene of South America. Acta Palaeontologica Polonica 53, 593–600.
Olson, SL (1977): A Lower Eocene frigatebird from the Green River Formation of Wyoming (Pelecaniformes, Fregatidae). In: Smithsonian Contributions to Paleobiology 35, S. 1–33.
Olson, S. L. (1980): A new genus of penguin-like pelecaniform bird from the Oligocene of Washington (Pelecaniformes : Plotopteridae). Contributions in Science. 330: 51–57.
Olson, SL (1985): Section X.G.5.a. Sulidae. In: The Fossil Record of Birds. Avian Biology 8: 203-204.
Olson, S.L.; Hasegawa, Y. (1979): Fossil Counterparts of Giant Penguins from the North Pacific. Science. 206 (4419): 688–689.
Olson, S. L.; Hasegawa, Y. (1985): A Femur of Plotopterum from the Early Middle Miocene of Japan (Pelecaniformes : Plotopteridae). Bulletin of the National Science Museum. 11 (3): 137–140.
Olson, S. L. Hasegawa, Y (1996): A new genus and two new species of gigantic Plotopteridae from Japan (Aves: Pelecaniformes). J. Vertebr. Paleontol. 16 (4): 742–751.
Olson, SL, Hiroshige M (2005): New specimens of the early Eocene frigatebird Limnofregata (Pelecaniformes: Fregatidae), with the description of a new species. Zootaxa 1046, S. 1–15.
Olson, S.L., Rasmussen, P.C. (2001): Miocene and Pliocene birds from the Lee Creek Mine, North Carolina. Smithsonian Contributions to Paleobiology 90, 233–365.
Osorno, JL, Torres, R, Garcia CM (1992): Kleptoparasitic behaviour of the Magnificent Frigatebird: sex bias and success. Condor 94; S. 692–698
Prum, R. O. et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Rich, PV.; Hou, LH.; Ono, K; Baird, RF. (1986): A review of the fossil birds of China, Japan and Southeast Asia. Geobios. 19 (6): 755–772.
Rinderknecht, A.; Noriega, J.I. (2002): Un nuevo género de Anhingidae (Aves: Pelecaniformes) del Plioceno–Pleistoceno del Uruguay (Formación San José). Ameghiniana. 39 (2): 183–191.
Sakurai, K; Kimura, M, Katoh, TA (2008): New penguin-like bird (Pelecaniformes; Plotopteridae) from the Late Oligocene Tokoro Formation, northeastern Hokkaido. Oryctos. 7: 83–94.
Sangster, G; Braun, EL; Johansson, US; Kimball, RT.; Mayr, G; Suh, A (2022): Phylogenetic definitions for 25 higher-level clade names of birds. Avian Research. 13: 100027
Sangster G, Mayr G (2021): Feraequornithes: a name for the clade formed by Procellariiformes, Sphenisciformes, Ciconiiformes, Suliformes, and Pelecaniformes (Aves), Vertebr. Zool. 71, 49-53.
Smith, N.D. (2010): Phylogenetic analysis of Pelecaniformes (Aves) based on osteological data: Implications for waterbird phylogeny and fossil calibration studies. PLoS ONE 5, e13354.
Stidham, TA (2014): A new species of Limnofregata (Pelecaniformes: Fregatidae) from the Early Eocene Wasatch Formation of Wyoming: implications for palaeoecology and palaeobiology. Palaeontology. 58 (2): 1–11.
Stucchi, M. (2003): Los piqueros (Aves: Sulidae) de la Formación Pisco, Peruì. Boletín de la Sociedad Geológica del Perú 95, 75–91.
Stucchi, M., Urbina, M. (2004): Ramphastosula (Aves, Sulidae): A new genus from the early Pliocene of the Pisco Formation, Peru. Journal of Vertebrate Paleontology 24, 974–978.
Suh, A. (2016): The phylogenomic forest of bird trees contains a hard polytomy at the root of Neoaves. Zoologica Scripta. 45: 50–62.
Tets, GFV.; Rich, P; Marino-Hadiwardoyo, HR (1989): A reappraisal of Protoplotus beauforti from the early tertiary of Sumatra and the basis of a new pelecaniform family. Publ. Geol. Res. Dev. Cent., Paleontol. Ser (5): 57–75.
Thabethe, V; McPherson, S; Downs, C. T. (2021): Diet of nestling African woolly-necked storks in suburban areas of KwaZulu-Natal, South Africa. African Journal of Ecology. 59 (3): 769–772.
Trefry, S.A., Diamond, Tony. (2017): Exploring hypotheses for sexual size dimorphism in frigatebirds. Evolutionary Ecology Research 18, 225-252.
Vickery, JA, Brooke, ML (1994): The kleptoparasitic interactions between great frigatebirds and masked boobies on Henderson Island, South Pacific. Condor 96; S. 331–340
Walsh, S.A., Hume, J.P. (2001): A new Neogene marine avian assemblage from north-central Chile. Journal of Vertebrate Paleontology 21, 484–491.
Warheit, K.I. (2002): The seabird fossil record and the role of paleontology in understanding seabird community structure. In: E.A. Schreiber & J. Burger (eds.), Biology of Marine Birds. Boca Raton, FL: CRC Marine Biology Series, pp. 17–55.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a): Storks (Ciconiidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b): Frigatebirds (Fregatidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.fregat1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c): Boobies and Gannets (Sulidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.sulida1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d): Cormorants and Shags (Phalacrocoracidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.phalac1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020e): Anhingas (Anhingidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.anhing3.01
Worthy, TH (2011): Descriptions and phylogenetic relationships of a new genus and two new species of Oligo-Miocene cormorants (Aves: Phalacrocoracidae) from Australia. Zoological Journal of the Linnean Society. 163 (1): 277–314.
Worthy, TH (2012): A new species of Oligo-Miocene darter (Aves: Anhingidae) from Australia. The Auk. 129 (1): 96–104.
Wu, S. et al. (2024): Genomes, fossils, and the concurrent rise of modern birds and flowering plants in the Late Cretaceous. Proceedings of the National Academy of Sciences. 121 (8).
Zhang, Z., Huang, Y., James, H.F., Hou, L. (2012): A marabou (Ciconiidae: Leptoptilos) from the Middle Pleistocene of northeastern China. The Auk 129, 699–706.



