Aequornithes
Text als pdf
Was haben Pinguine, Pelikane, Albatrosse, Störche und Reiher gemeinsam, außer dass die Vögel sind? Sie alle und einige weitere Familien gehören der Großklade der Aequornithes an; spezialisierte aquatische und semiaquatische Vögel, die sich vorwiegend von Fischen und anderen Tieren ernähren.
Diese Vögel weisen sehr unterschiedliche Spezialisierungen auf, und ihre Vielfalt umfasst das morphologische Spektrum von langbeinigen Watvögeln und hochfliegenden Vögeln mit schwachen Beinen bis hin zu flugunfähigen Tauchern mit Flügelantrieb. Die Monophylie der Gruppe wird derzeit durch mehrere molekularphylogenetische Studien gestützt (Hackett et al. 2008, Jarvis et al. 2014, Kuhl et al. 2021, Kuramoto et al. 2015, Prum et al. 2015, Sangster & Mayr 2021, Sangster et al. 2022, Suh et al. 2005, Wu et al. 2024, Yuri et al. 2013, Kimball et al. 2013, Abb. 1). Die in einer vorherigen Episode vorgestellten Eurypygimorphae, zu denen der Kagu (Rhynochetidae), die Sonnenralle (Eurypygidae) und die Tropikvögel (Phaethontidae) gehören, bilden den meisten Studien zur Folge die Schwestergruppe der Aequornithes. Beide zusammen werden als Phaethoquornithes bezeichnet.
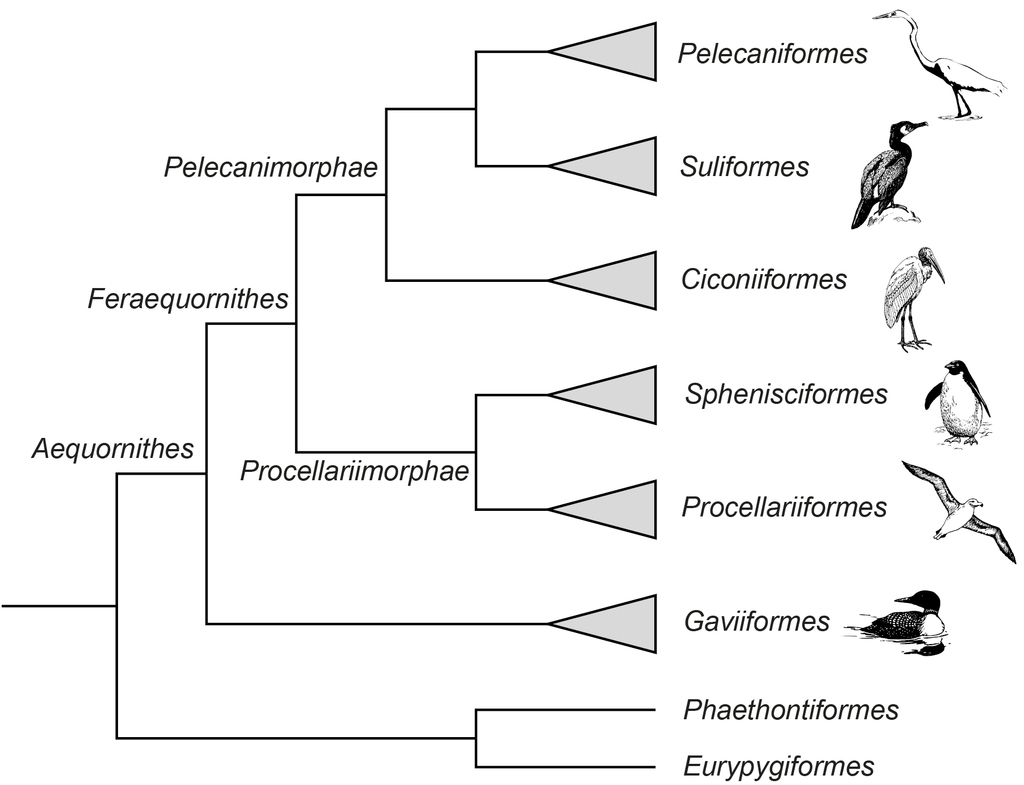
Abb. 1: Kladogramm der Aequornithes
Viele Aequornithes haben einige für sie typischen morphologischen Merkmale. Bei den meisten Arten hat zumindest die Basis der drei Vorderzehen Schwimmhäute. Weiterhin besteht die Hornscheide (Rhamphotheca) des Schnabels aus mehreren hornigen Platten und die Nasenlöcher sind stark reduziert und bei Jungvögeln mit Ausnahme der Seetaucher lang und schlitzförmig.
An der Basis der Aequornithes stehen die Seetaucher (Gaviiformes), die den anderen Aequornithes, den Feraequornithes, als Schwestergruppe gegenübergestellt sind. Die Feraequornithes teilen sich in zwei weitere Kladen auf: die Procellariimorphae und die Pelicanimorphae. Zu den Procellariimorphae zählen zwei Ordnungen: die Pinguine (Sphenisciformes) mit einer Familie (Spheniscidae) und die Röhrennasen (Procellariiformes) bestehend aus den Familien der Albatrosse (Diomedeidae), Sturmschwalben (Oceanitidae), Sturmvögel (Procellariidae) und Wellenläufer (Hydrobatidae). Die Pelicanimorphae teilen sich in drei Ordnungen. An deren Basis stehen die Ciconiiformes, bestehend aus der Familie der Störche (Ciconiidae). Ihnen gegenübergestellt sind die Suliformes und Pelicaniformes, beide als Pelecanes vereint. Die Suliformes bestehen aus den Familien Fregattvögel (Fregatidae), Tölpel (Sulidae), Schlangenhalsvögel (Anhingidae) und Kormorane (Phalacrocoracidae). Die Pelicaniformes bestehen aus den Familien Ibisse (Threskiornithinae), Reiher (Ardeidae), Hammerkopf (Scopidae), Pelikane (Pelecanidae) und Schuhschnabel (Balaenicipitidae). Insgesamt haben die Aequornithes 16 Vogelfamilien mit etwa 370 Arten. D. h. wir haben zwar eine recht hohe taxonomische Diversität, deren Artenzahl jedoch überschaubar ist. Die Stammart der Aequornithes war wahrscheinlich ein fleischfressender Vogel, der zumindest in einer semi-aquatischen Umgebung lebte. Die frühesten fossilen Vertreter der Aequornithes stammen aus Schichten um die Kreide/Paläogen-Grenze, was auf einen mesozoischen Ursprung der Gruppe hinweist. Diese Fossilien zeigen Verwandtschaft mit den früh divergierenden Taxa, besonders den Seetauchern und Röhrennasen, auf, während es für die Pelicanimorphae keine definitiven Belege vor dem späten Eozän gibt.
Seetaucher (Gaviiformes)
Die Seetaucher (Gaviiformes, Gaviidae) sind tag- und nachtaktive, Wasservögel, die in fünf Arten die Taiga und Tundra Nordamerikas, Europas und Asiens bewohnen. Sie überwintern aber auch in den gemäßigten Zonen (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020a, Abb. 2).
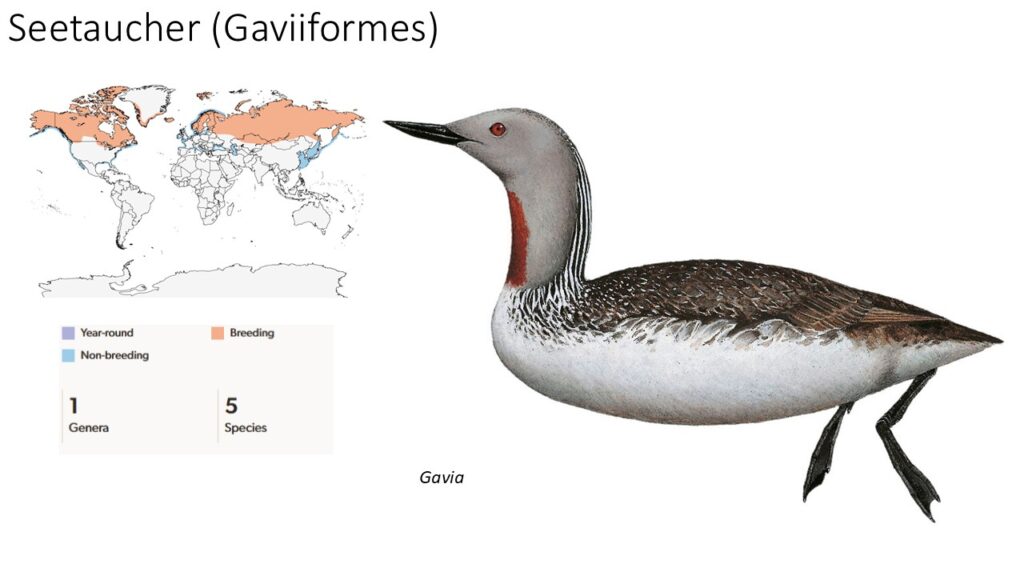
Abb. 2: Seetaucher
Seetaucher sind große Schwimm- und Tauchvögel mit einer Körperlänge von 53 bis 91 Zentimetern, einem stromlinienförmigen Körper und einer Flügelspannweite zwischen 106 und 152 Zentimetern. Ihr Gewicht liegt zwischen 1 und 6,4 Kilogramm. Zwischen ihren Zehen befinden sich voll ausgebildete Schwimmhäute und die Beine setzen weit hinten am Körper an und tragen kräftige Füße, was den Antrieb im und unter Wasser perfektioniert.
Das Gefieder der meisten Arten ist in der Brutzeit auf der Oberseite schachbrettartig schwarz-weiß, die Unterseite bei den meisten Arten weiß. Kopf und Hals sind bei allen Arten sehr farbenprächtig. Außerhalb der Brutzeit ist das Gefieder schlichter gefärbt. Ein Geschlechtsdimorphismus ist kaum ausgeprägt, die Männchen sind etwas größer. Das Gefieder ist sehr dicht und isoliert gut gegen die Kälte der arktischen Gewässer. Sie bilden monogame Brutpaare und haben auch keine komplizierten Balzrituale. Sie ernähren sich überwiegend von kleinen bis mittelgroßen Fischen, die sie mit ihrer sehr dehnbaren Speiseröhre verschlucken können.
Traditionell wurden die Seetaucher in die Nähe der Lappentaucher (Podicipedidae) gestellt, mit denen sie in äußerer Erscheinung und Lebensweise einige Gemeinsamkeiten haben. Die genomischen Analysen belegen jedoch, dass die Ähnlichkeit zwischen beiden Vogelfamilien auf konvergente Evolution beruht und die Lappentaucher zusammen mit den Flamingos innerhalb der Mirandornithes gestellt werden. Die Seetaucher sind eine sehr alte Vogelgruppe, deren ersten fossilen Vertreter möglicherweise schon aus der späten Kreidezeit stammen. Neogaeornis aus Chile ist durch einen Tarsometatarsus bekannt und Polarornis, der möglicherweise aber ebenfalls Neogeaornis zugerechnet werden kann, aus der Antarktis ist durch einige Schädelfragmente überliefert. Lonchodytes ist aus Wyoming bekannt (Agnolin et al. 2017, Bordkorb 1963, Olson 1985, Mayr 2009, 2016, Mlikovsky 2002, van Tuinen & Hedges 2004, Chatterjee 2002, Clarke et al. 2005, Rozadilla et al. 2016, Tambnussi et al. 2019, Hope 2002, Abb. 3). Die genaue taxonomische Einordnung dieser kreidezeitlichen Fossilien ist aber nicht ganz geklärt; einige Autoren ordnen Neogaeornis eher in die Verwandtschaft von Hesperornis oder anderer mesozoischer Avialae. Aus dem Eozän und Oligozän Europas und Nordamerikas sind die Gattungen Colymbiculus, Gaviella, Nasidytes und Colymboides überliefert, die sehr frühe Vertreter der Seetaucher repräsentieren könnten (Mayr 2004, 2009, 2016, Mayr & Zvonok 2011, Mayr & Smith 2013, Mayr et al. 2013, Mayr & Kitchener 2022, Wetmore 1940, Olson 1985, Olson & Rasmussen 2001, Storer 1956, Abb. 4). Colymboides ist aber wahrscheinlich ein paraphyletisches Sammelbecken von Formen, die durch die Abwesenheit von für die rezente Gattung Gavia typischen Merkmalen definiert ist. Die Gattung Gavia ist seit dem frühen Miozän bekannt, von denen 10 Arten beschrieben sind (G. brodkorbi, G. concinna, G. egeriana, G. fortis, G. howardae, G. moldavica, G. palaeodytes, G. paradoxa, G. schultzi) dabei sind die ältesten Arten kleiner als die modernen Seetaucher (Mayr 2016, Mlikovski 1998, 2002, Olson 1985, Howard 1978, Wetmore 1940, 1943, Svec 1982, Olson & Rasmussen 2001, Brodkorb 1953, Kessler 1984).
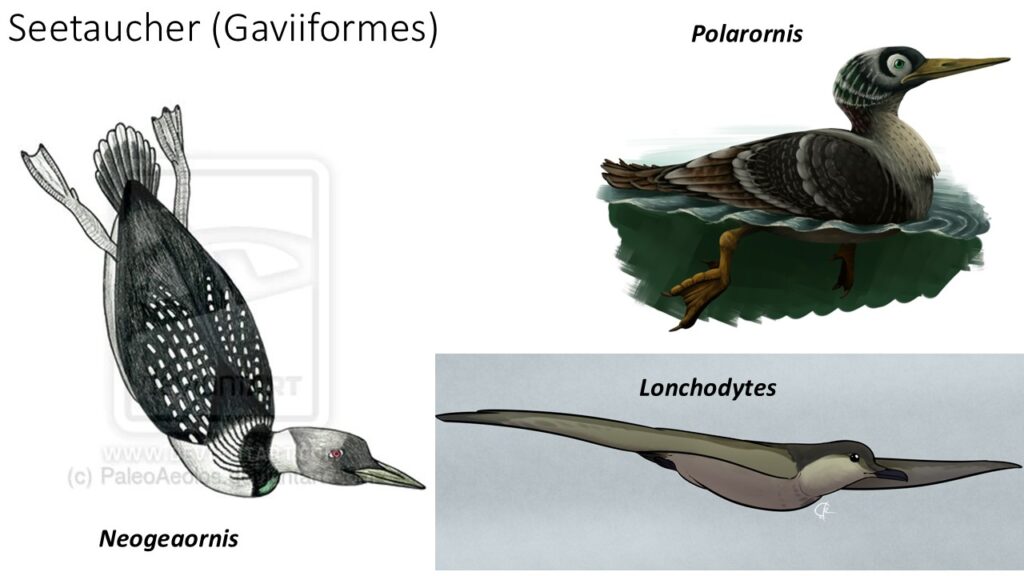
Abb. 3: Neogaeornis, Polarornis und Lonchodytes
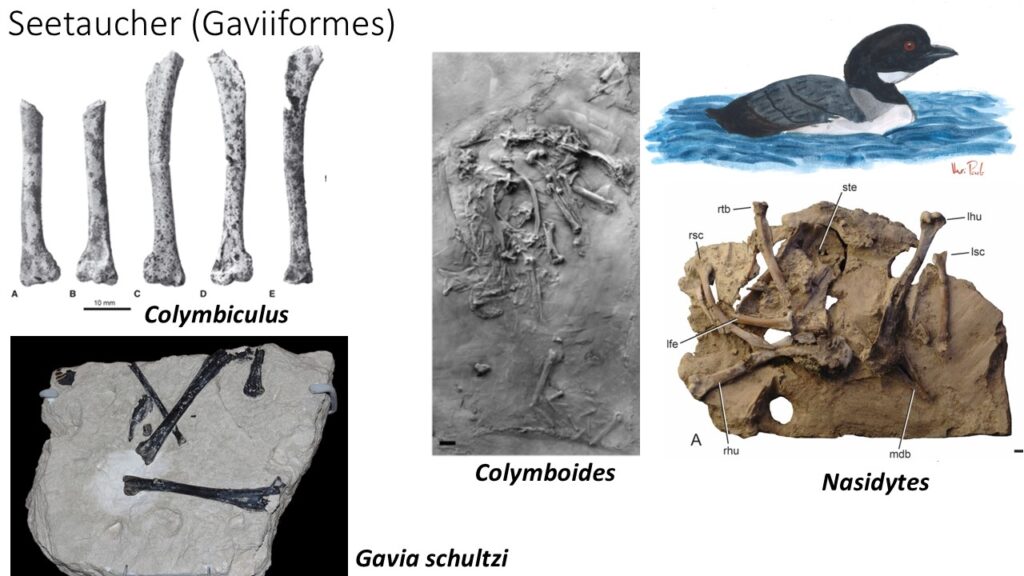
Abb. 4: Colymbiculus, Colymboides, Nasidytes und Gavia schultzi
Röhrennasen (Procellariiformes)
Die Procellariiformes, auch als Röhrennasen bekannt, zu denen Albatrosse, Sturmvögel, Sturmschwalben und Wellenläufer gehören, sind Meeresvögel, die meistens nur zum Brüten das Land aufsuchen. Benannt sind die Röhrennasen nach ihrem eigentümlichen Schnabel, der aus mehreren schmalen, längs verlaufenden Hornstücken zusammengesetzt ist. Auf dem Schnabel sitzen zwei Röhren auf, die dazu dienen, das Salz aus dem beim Trinken aufgenommenen Meerwasser auszuscheiden (Abb. 5). Weiterhin sind viele Röhrennasen in der Lage Dimethylsulfid aufspüren, das aus dem Plankton im Meer freigesetzt wird. Diese Fähigkeit zu riechen hilft bei der Ortung von unregelmäßig verteilten Beutetieren im Meer und kann auch dabei helfen, ihre Nester innerhalb von Nistkolonien zu finden (Buskirk & Nevitt 2008, Bonadonna et al. 2003, Piro 2022, Piro & Acosta Hospitaleche 2019).

Abb. 5: Röhrennasen
Albatrosse (Diomedeidae)
Albatrosse (Diomedeidae) sind eine Gruppe von großen Seevögeln mit sehr langen und schmalen Flügeln, deren größte Arten Spannweiten von über 3,5 Metern erreichen können. Auch die kleinsten Vertreter der Familie haben noch Spannweiten von zwei Metern. Mit einem Gewicht von bis zu 12 Kilogramm gehören Albatrosse zu den schwersten flugfähigen Vögeln. Der gelbe oder rosa Schnabel ist groß, kräftig und spitz und haben die für diese Ordnung typischen Röhren am Schnabel. Die Beine sind kurz und kräftig und befähigen zu einem watschelnden, aber sicheren Gang. Die Zehen sind mit Schwimmhäuten verbunden. Albatrosse sind gute Schwimmer, die sich auch bei hohen Wellen auf dem Wasser halten können. Die Hauptnahrung der Albatrosse sind Tintenfische, daneben sind kleine Fische ein wichtiger Nahrungsbestandteil. Albatrosse sind gute Flieger, bedingt durch ihre langen und schmalen Flügel. Sie nutzen dazu die Technik des Dynamischen Segelflugs, eine Flugtechnik, bei der ein Vogel aus der Windscherung, also einem nicht konstanten Windfeld, Energie gewinnen kann. Hierbei versucht der Vogel die Flugbahn so zu wählen, dass der Energiegewinn (infolge der Windscherung) den Energieverlust (infolge des Strömungswiderstands) im zeitlichen Mittel übertrifft. Unter Ausnutzung des Dynamischen Segelflugs können Albatrosse wenige Meter über dem Meer fliegend sehr weite Strecken zurücklegen. Der Dynamische Segelflug wird auch von Segelflugmodell-Piloten praktiziert. Fällt die Windgeschwindigkeit unter 12 km/h, können Albatrosse nicht mehr abheben und müssen an Land oder auf dem Wasser verbleiben. Hingegen können sie selbst in Stürmen noch manövrieren. Die meisten Albatrosse lassen sich daher auf dem Wasser nieder und fressen schwimmend. Albatrosse haben einen außerordentlich langen Fortpflanzungszyklus. Vom Nestbau bis zur Selbstständigkeit der Jungen vergeht bei den größeren Arten ein volles Jahr, so dass sie nur alle zwei Jahre brüten können. Im Gegensatz zu den meisten anderen Röhrennasen pflegen Albatrosse ein komplexes Balzritual. Hierzu zählen das synchrone Hochrecken der Köpfe, das Ausbreiten der Flügel, Reiben der Flanken mit den Schnäbeln und zahlreiche Rufe. Albatrosse sind monogam und treffen zu jeder Brut den vorherigen Partner wieder. Albatrosse nisten in Kolonien, die einige hundert bis einige tausend Nester umfassen können. Albatrosse sind sehr langlebige Vögel. Das dokumentierte Rekordalter liegt bei 70 Jahren (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020b, Wilson 1975, Weimerskirch et al. 2000, Sachs 2005, Abb. 6).

Abb. 6: Albatrosse
Die Anzahl der Albatrosarten variiert je nach Literatur. Traditionell wurden die Albatrosse in zwei Gattungen mit 14 Arten unterteilt. Dies waren Diomedea und Phoebetria. Als deutlich wurde, dass Diomedea in der ursprünglichen Zusammenstellung paraphyletisch wäre, teilte man noch die Gattungen Phoebastria und Thalassarche ab, so dass es nun vier Gattungen gibt, die alle mit ziemlicher Sicherheit monophyletisch sind. Die Artenzahl wurde zuletzt drastisch erhöht, deren höchste Zahl bei 24 Arten liegt. Die meisten Arten kommen auf der Südhalbkugel vor, 3 Arten im Nordpazifik und mit dem Galapagos-Albatros haben wir auch eine Art, die am Äquator anzutreffen ist (Nunn et al. 1996, Robertson & Nunn 1998, Nunn & Stanley 1998, Chambers et al. 2009, Burg & Croxall 2001, 2004, Bried et al. 2007, Rains et al. 2011, Winkler et al. 2020b, Abb. 7).
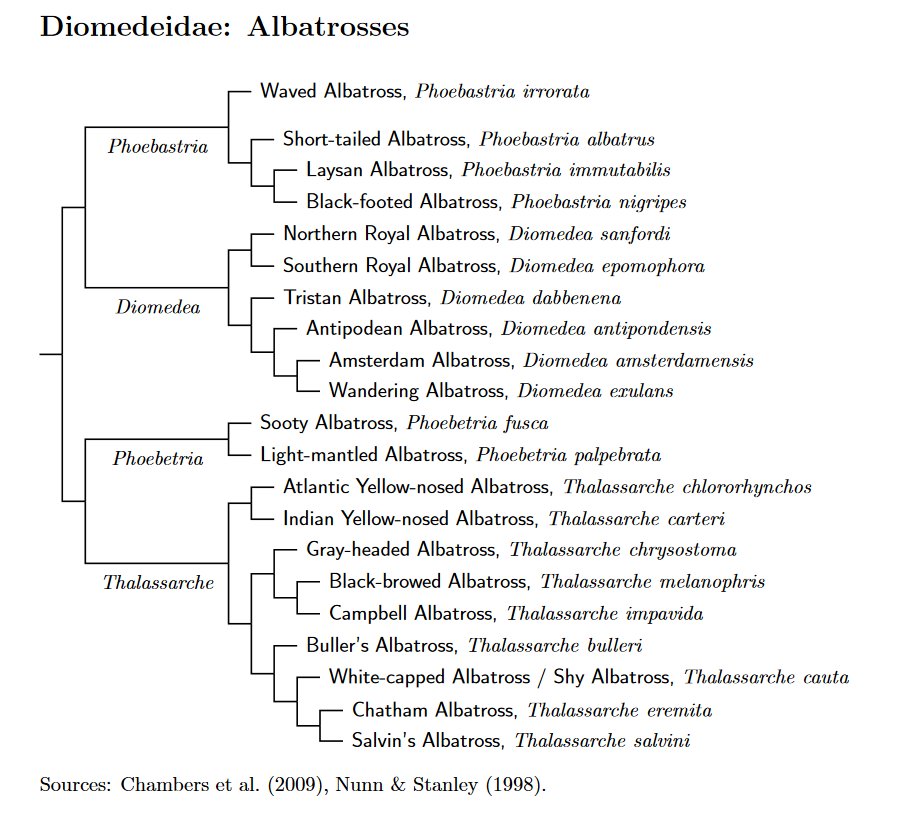
Abb. 7: Phylogenie der Albatrossarten
Bereits im frühen Oligozän ist der Albatros Tydea septentrionalis nachgewiesen, der im Bereich der Nordsee lebte, wo heute keine Albatrosse mehr vorkommen. Daneben gab es in der gleichen Region albatrosähnliche Vögel. Diese Seevögel, die den längst ausgestorbenen Gattungen Rupelornis und Diomedeoides zugerechnet werden, werden nach den neueren Klassifizierungen in einer eigenen Familie Diomedeoididae geführt und waren offenbar noch keine echten Albatrosse (Mayr 2009, 2009a, 2016, Mayr & Smith 2012, Mayr et al. 2002, Mayr & Goedert 2017, Mayr & Tennyson 2020, Olson & Rasmussen 2001, De Pietri et al. 2010, Abb. 8).
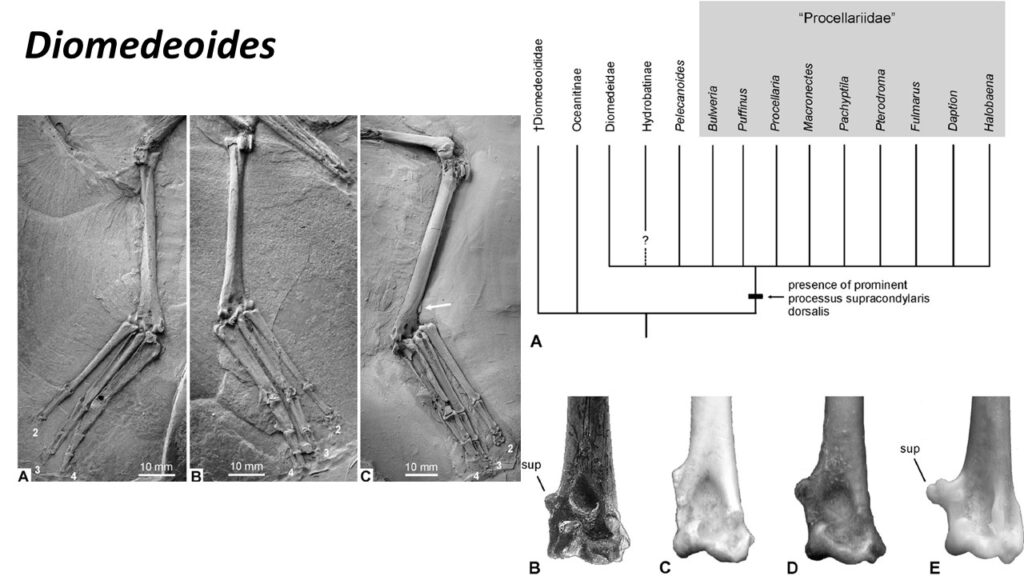
Abb. 8: Diomedeoididae
Vertreter der echten Albatrosse sind verstärkt seit dem Miozän belegt. Hierzu gehören die ausgestorbene Albatrosgattung Plotornis sowie Vertreter der rezenten Gattungen Diomedea und Thalassarche. Die Trennung der nördlichen Albatrosse von den südlichen Arten war bereits im Miozän vollzogen, ebenso legt die molekulare Uhr den Schluss nahe, dass alle vier rezenten Gattungen am Ausgang des Miozäns existent waren. Diomedea und Phoebastria trennten sich vor rund 23, Thalassarche und Phoebetria vor etwa 28 Millionen Jahren (Mayr 2016, Mayr & Smith 2012, Ksepka et al. 2023, Mayr & Pavia 2014, Dyke et al. 2007).
Heute fehlen Albatrosse im Nordatlantik. Dort waren sie im Pliozän aber noch in wenigstens fünf Arten verbreitet, von denen vier der Gattung Phoebastria angehörten, eine der Gattung Diomedea. Auf den Bermudainseln lebten noch vor 400.000 Jahren Alabtrosse, seitdem sind sie im Nordatlantik komplett ausgestorben (Olson & Hearty 2003). Der Grund für das Aussterben im Nordatlantik ist nicht bekannt, könnte aber mit klimatischen Schwankungen während des Pleistozäns zusammenhängen.
Sturmschwalben (Oceanitidae) und Wellenläufer (Hydrobatidae)
Zwei Familien, die Sturmschwalben und die Wellenläufer wurden ursprünglich als zwei Unterfamilien der Sturmschwalbenartigen angesehen. Molekulare Untersuchungen zeigten jedoch, dass die Sturmschwalben kein einheitliches Taxon bilden und die zwei Unterfamilien den Status einer eigenen Familie bekamen (Nunn & Stanley 1998, Hackett et al. 2008, Prum et al. 2015, Winkler et al. 2015, Penhallurick & Wink 2004, Sausner et al. 2016, Norambuena et al. 2024). Beide Familien ernähren sich von Zooplankton, kleinen Fischen, Krebstieren und Kopffüßern, die sie mit ihren kurzen Schnäbeln im Flug dicht unter der Wasseroberfläche erbeuten.
Die Sturmschwalben (Oceanitidae) sind eine auf allen Weltmeeren weit verbreitete Familie mit zehn Arten in fünf Gattungen (Del Hoyo, Del Hoyo et al. 1992, Winkler et al. 2015, 2020c, Abb. 9). Sie sind in der Regel dunkelbraun oder grau gefärbt, und haben weiße Flecken im Gesicht, auf Brust und den Unterseiten der Flügel. Die Flügel sind lang und schmal. Der Kopf ist klein mit einem steilen Profil. Der Hals ist kurz und dick. Der Schnabel ist relativ kurz und schlank. Er trägt an der Spitze einen Haken. Die röhrenförmigen Nasen münden in einer einzigen Öffnung. Sturmschwalben kommen auf dem Pazifik von den Küsten der Antarktis bis knapp nördlich des Äquators, auf fast dem gesamten Indischen Ozean und auf dem Atlantik von der Antarktisküste bis zur Bretagne und Labrador. Auch wenn die meisten Arten weit verbreitet sind, brüten sie doch nur auf wenigen Inseln. Zum Beispiel brütet die Buntfuß-Sturmschwalbe (Oceanites oceanicus) nur auf einigen subantarktischen Inseln sowie auf dem Festland der Antarktis, überfliegt aber außerhalb der Brutzeit alle Ozeane und kann nordwärts bis vor die Küsten Kanadas und Frankreichs vordringen. Es gibt jedoch auch Arten, die in äquatorialen Regionen brüten, in einem Fall sogar auf der Nordhalbkugel, wie die Fregattensturmschwalbe (Pelagodroma marina) auf den Kapverdischen Inseln und den Kanaren.
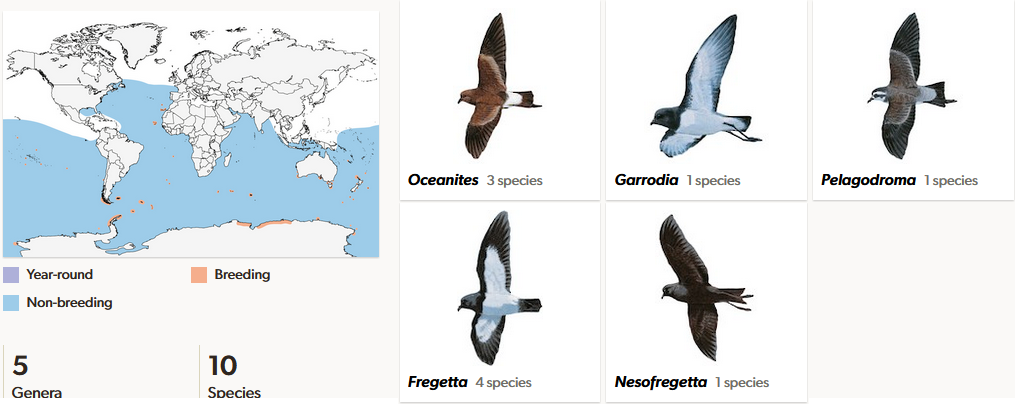
Abb. 9: Sturmschwalben
Wellenläufer (Hydrobatidae) sind relativ kleine Meeresvögel und in der Regel dunkelbraun oder schwärzlich gefärbt (Del Hoyo, Del Hoyo et al. 1992, Winkler et al. 2015, 2020d, Abb. 10). Sie ähneln den Sturmschwalben, aber ihre Flügel sind länger und die Beine kürzer. 18 Arten in einer Gattung sind beschrieben worden, sie kommen im pazifischen Ozean, dem indischen Ozean nördlich des Äquators und im Atlantik zwischen dem Kap der Guten Hoffnung und dem Nordkap sowie im westlichen Mittelmeer vor. Während manche Arten außerhalb der Brutzeit riesige Aktionsräume haben, beschränken sich ihre Brutgebiete meist auf wenige Felseninseln. Viele Arten der Wellenläufer gelten als bedroht. Besonders invasive Arten stellen ein Problem dar, da sie die Brutgebiete plündern oder die Vegetation zerstören. Der Guadalupe-Wellenläufer (Hydrobates macrodactylus) ist wahrscheinlich ausgestorben, von dem es seit 1912 keine zuverlässigen Nachweise mehr gibt. Der Rückgang der, auf der mexikanischen Insel Guadeloupe vorkommenden, Art begann mit der Invasion von Ziegen und Katzen auf der Insel im späten 19. Jahrhundert. Über 50.000 Ziegen zerstörten die Vegetation und zertrampelten die Eier. Die Katzen stellten den Küken nach (IUCN 2018, Sydeman et al. 1998).
Der Fossilbericht beider Familien ist spärlich und die frühesten Vertreter aus dem Miozän werden der modernen Gattung der Wellenläufer zugeordnet (Olson 1985a; Warheit 2002).
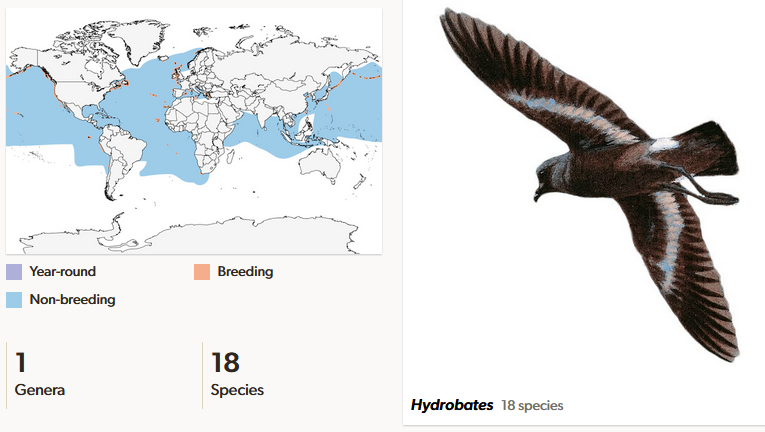
Abb. 10: Wellenläufer
Sturmvögel (Procellariidae)
Die Sturmvögel (Procellariidae) sind mit 99 Arten in 16 Gattungen die artenreichste Gruppe der Röhrennasen und kommen über allen Ozeanen, vor allem aber auf der Südhalbkugel vor (Del Hoyo, Del Hoyo et al. 1992, Winkler et al. 2015, 2020e, Grosser et al. 2021, Ferrer-Obiol et al. 2021, 2023, Welch et al. 2014, Gangloff et al. 2012, Abb. 11). Die südlichste Art ist der Schneesturmvogel (Pagodroma nivea), der in der Antarktis brütet. Die am nördlichsten verbreitete Art ist der Eissturmvogel (Fulmarus glacialis). Wie andere Röhrennasen sind Sturmvögel durch zwei röhrenartige Nasenöffnungen auf der Oberseite des Schnabels gekennzeichnet, durch die Meersalz ausgeschieden werden kann. Der Schnabel ist lang und hakenförmig, hat eine nagelartige Spitze und sehr scharfe Kanten. Diese Beschaffenheit hilft dabei, schlüpfrige Beute wie Fische besser festhalten zu können. Als kleinste Art ist der Kleine Sturmtaucher (Puffinus assimilis) 25 cm lang, hat eine Flügelspannweite von 60 cm und ein Gewicht von 170 g. Die meisten Arten sind nur unwesentlich größer. Ausnahmen sind allein die Riesensturmvögel (Macronectes giganteus), sie können 1 m lang werden, eine Spannweite von 2 m und ein Gewicht von 5 kg erreichen. Das Gefieder ist weiß, grau, braun oder schwarz gefärbt. Alle Sturmvögel sind sehr gute Flieger, die Beine sind dagegen schwach und sitzen weit hinten am Körper an. Zum Laufen sind sie ungeeignet, so dass sich ein Sturmvogel an Land mit der Brust abstützen und die Flügel zur Hilfe nehmen muss. Außerhalb der Brutzeit verbringen sie ihr ganzes Leben auf hoher See. Die meisten Arten fressen kleine Fische und wirbellose Meerestiere, die sie an oder knapp unter der Meeresoberfläche erbeuten. Sturmvögel brüten gewöhnlich in großen Kolonien in der Nähe von Küsten, häufig auf steilen Klippen oder Geröllhalden. Sie legen ein einziges Ei, das im Verhältnis zum Vogel ungewöhnlich groß ist. Eine besondere Erwähnung sollen hier die Tauchsturmvögel (Pelecanoides) finden. Diese in den südlichen Ozeanen verbreiteten Vögel haben eine tauchende Lebensweise perfektioniert und dabei in konvergenter Evolution Ähnlichkeiten zu den Alkenvögeln entwickelt.
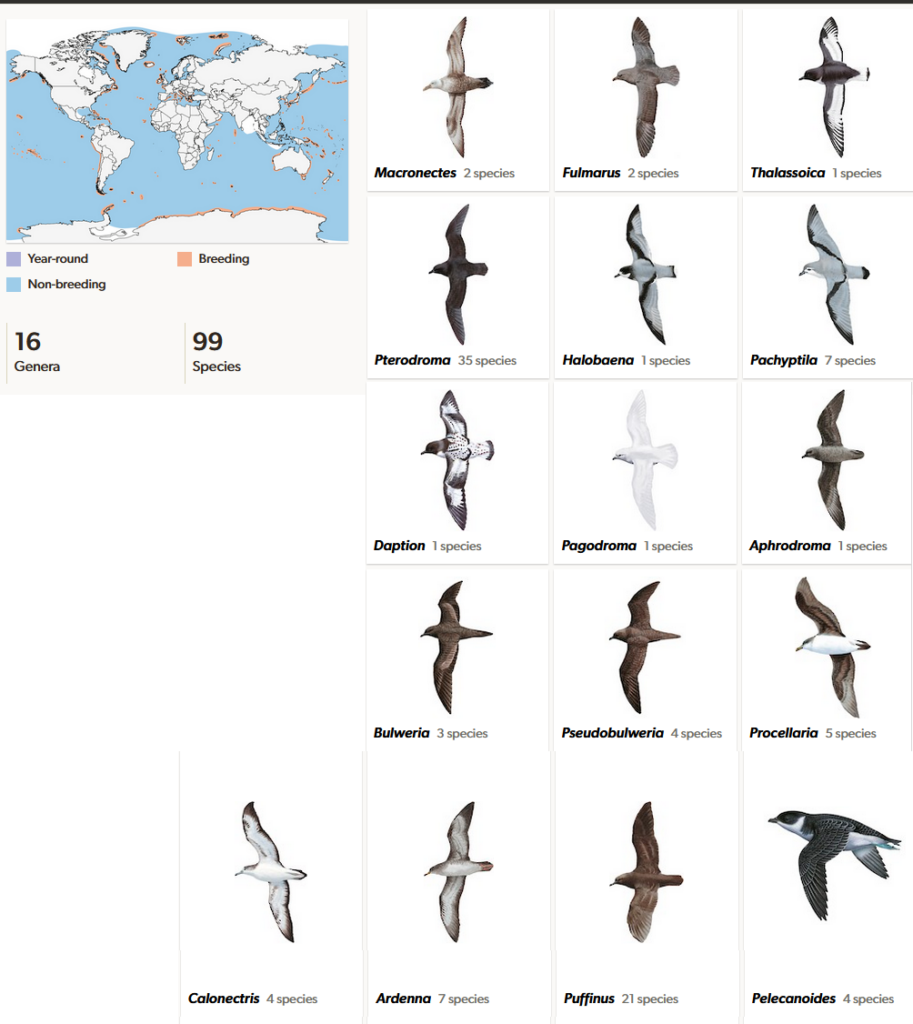
Abb. 11: Sturmvögel
Fragmentarische Überreste von Sturmvogel-ähnlichen Fossilien sind aus dem Eozän und Oligozän Nord- und Südamerikas bekannt (Mayr 2009), aber nur ein Teilskelett von Makahala aus dem späten Eozän des Staates Washington (USA) erlaubt aussagekräftige Vergleiche mit den heute lebenden Taxa (Mayr 2015). Trotz vieler Ähnlichkeiten mit modernen Sturmvögeln gibt es Unterschiede in den Details des Oberarmknochens, weswegen Makahala bestenfalls ein Vertreter der Stammgruppe der Sturmvögel ist. Die frühesten gesicherten Sturmvogel-Fossilien sind unbeschriebene Exemplare aus dem späten Oligozän von South Carolina (Olson 1985a; Ksepka 2014). Die genauen Zugehörigkeiten vieler Fossilien aus dem Neogen bedürfen einer Revision, aber es scheint, dass sich die Kronengruppe der Sturmvögel nicht sehr lange vor dem Miozän diversifiziert hat.
Die meisten der frühesten Fossilien weisen den breiten und abgeflachten Oberarmknochenschaft auf, der für die Gattung Puffinus (den Sturmtauchern) charakteristisch ist. Ausgestorbene Puffinus-Arten wurden aus dem Miozän Nordamerikas, Japans und Europas beschrieben (Olson 1985a; Warheit 1992, 2002), und eine ausgestorbene Art der Gattung Calonectris wurde in miozänen Schichten des östlichen Nordamerikas gefunden (Olson 2009). Fragmentarische Fossilien, welche möglicherweise zur Gattung Fulmarus oder einer nah verwandten ausgestorbenen Linie gehören, wurden aus dem Miozän von Kalifornien gemeldet (Olson 1985a). Die Gattung Pterodromoides, welche der modernen Gattung der Hakensturmtaucher (Pterodroma) nahesteht, stammt aus dem späten Miozän von Menorca im Mittelmeer (Seguí et al. 2001). Weiterhin ist ein Schädel der Gattung der Walvögel (Gattung Pachyptila) aus dem Miozän von Chile bekannt (Sallaberry et al. 2007).
Pinguine (Spheniscidae)
Allgemeiner Körperbau
Die Pinguine (Spheniscidae) sind die einzige Familie der Ordnung der Sphenisciformes und gelten als die Schwestergruppe der Röhrennasen. Derzeit werden 18 Arten in 6 Gattungen anerkannt, die alle ausschließlich auf der Südhalbkugel vorkommen (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f, Baker et al. 2006, Ksepka & Thomas 2012, Grosser et al. 2015, 2016, Pan et al. 2019, Cole et al. 2022, Williams 1995, Abb. 12 und 13). Einige Autoren sehen aber in der australischen Population der Zwergpinguine eine weitere, eigenständige Art (Eudyptula novaehollandiae Grosser et al. 2015, 2016). Entgegen der Vorurteile kommen nicht alle Pinguine auf der Antarktis vor, viele Arten gibt es auch an den Küsten Südamerikas und Australiens, der Brillenpinguin (Spheniscus demersus) brütet an der südafrikanischen Küste und mit dem Galapagos-Pinguin (Spheniscus mendiculus) gibt es auch eine Art am Äquator. Das Vorkommen von Pinguinarten in den wärmeren Klimazonen ist durch die kalten Meeresströmungen, wie dem Humboldtstrom und dem Benguelastrom möglich. Diese Kaltwasserströme sind eine reiche Nahrungsgrundlage für die Pinguine, die sich hauptsächlich von Fischen, Krebstieren und Tintenfischen ernähren.

Abb. 12: Pinguine

Abb. 13: Darstellung aller Pinguinarten
Ihre Körper sind an das Leben im offenen Meer angepasst. Sie sind stromlinienförmig mit zu Flossen umgestalteten Flügeln und einer kräftigen Brustmuskulatur mit stark ausgebildetem Kiel am Brustbein. Die Flügel dienen zum Schwimmen im Wasser und können rund drei Schläge pro Sekunde absolvieren. Da anders als beim Fliegen in Luft beim Schwimmen unter Wasser wegen des höheren Wasserwiderstands der Flügelaufschwung genauso viel Energie kostet wie der Flügelabschwung, haben die Schulterblätter eine im Vergleich zu anderen Vögeln vergrößerte Oberfläche, an der die für den Aufschwung verantwortliche Muskulatur ansetzen kann. Ober- und Unterarmknochen sind am Ellbogen geradlinig und steif miteinander verbunden, was den Flossen eine große Festigkeit verleiht. Die bei Vögeln sonst hohlen Knochen sind bei Pinguinen dicht und schwer, da eine Gewichtsreduktion zum Schwimmen nicht notwendig ist. Die Oberschenkel sind sehr kurz, das Kniegelenk starr und die Beine stark nach hinten versetzt, wodurch an Land der ungewöhnliche aufrechte Gang hervorgerufen wird. Die mit Schwimmhäuten versehenen großen Füße sind relativ kurz – an Land ruhen die Tiere häufig auf ihren Fersen, wobei ihre vergleichsweise starren Schwanzfedern eine zusätzliche Stütze bilden. Der Schwanz ist meist stark reduziert, seine bei anderen tauchenden Seevögeln wesentlich ausgeprägtere Funktion als Ruder wird in erster Linie von den Beinen übernommen (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f, Williams 1995, Abb. 14).
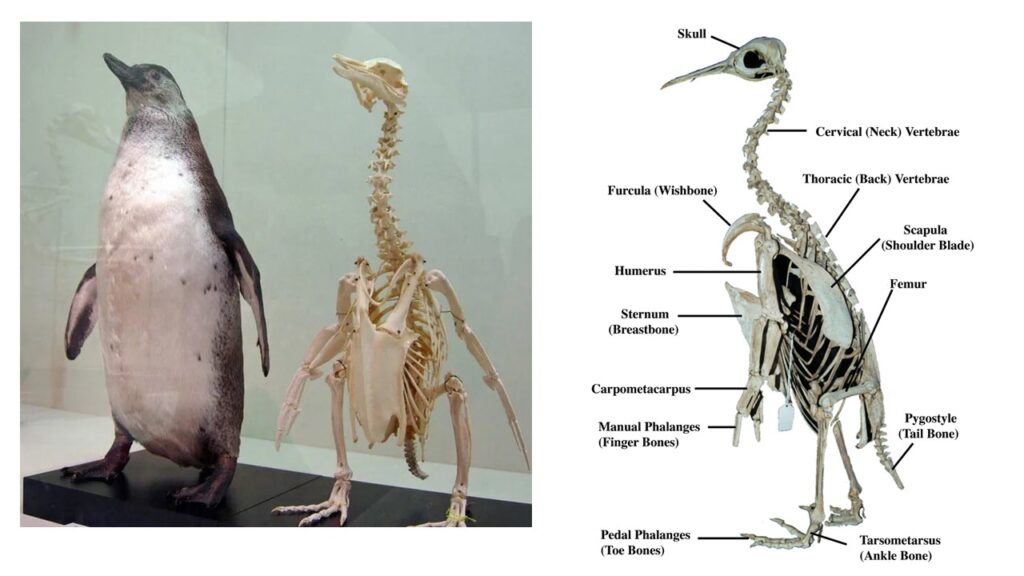
Abb. 14: Pinguinskelett
Der Schnabel ist bei den meisten Arten nicht sehr lang, dafür aber kräftig; eine Ausnahme bilden Königs- und Kaiserpinguin, deren Schnabel wahrscheinlich in Anpassung an ihre Beutetiere – schnell schwimmende Fische – lang, schlank und leicht nach unten gekrümmt ist. Zur Wärmeisolation dient eine ausgeprägte, oft zwei bis drei Zentimeter dicke Fettschicht, über der sich drei wasserdichte Schichten kurzer, dicht gepackter und gleichmäßig über den ganzen Körper verteilter Federn befinden. Die in den Federschichten eingeschlossene Luft schützt im Wasser ebenfalls sehr effektiv vor Wärmeverlusten. Flossen und Beine sind gut durchblutet und regulieren ebenfalls den Wärmehaushalt. Arten in wärmeren Gebieten haben im Vergleich zur Körpergröße verbreiterte Flossen, so dass die Fläche, über die Wärme abgegeben werden kann, erweitert ist. Bei einigen Arten ist zudem die Gesichtshaut nicht von Federn bedeckt, so dass aufgestaute Wärme im aktiv aufgesuchten Schatten schneller abgegeben werden kann (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f, Hadden et al. 2022, Thomas & Fordyce 2007, 2012, Williams 1995).
Die kleinste Pinguinart ist der Zwergpinguin (Eudyptula minor) mit einer Größe von 30 bis 45 Zentimetern und einem Gewicht von 1 bis 1,5 Kilogramm. Dagegen gehört der Kaiserpinguin (Aptenodytes forsteri) mit einer Größe von bis zu 1,20 Metern und einem Gewicht von bis zu 40 Kilogramm zu den größten Neukiefervögeln überhaupt (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f). Das Gefieder der Pinguine ist rückseitig ein ins Schwarze spielendes Blaugrau, bauchseitig dagegen weiß. Ein besonders auffälliger orangegelber Kopfschmuck zeichnet die meisten Schopfpinguine (Eudyptes) aus. Bei Jungtieren ist das Gefieder meistens einheitlich grau bis braun.
Die Augen der Pinguine sind für eine scharfe Sicht unter Wasser angepasst. Besonders bei den tief tauchenden Kaiserpinguinen sind die Pupillen des Auges zudem extrem dehnungs- und kontraktionsfähig, so dass sich die Augen sehr schnell auf unterschiedliche Lichtverhältnisse einstellen können. Pinguine sind in der Lage Licht im blauen Spektrum besser zu sehen als im roten. Da rotes Licht schon in den obersten Wasserschichten ausgefiltert wird, lässt dies eine evolutionäre Anpassung vermuten. Kaiserpinguine haben auch Rekordwerte der Tauchtiefe innerhalb ihrer Familie, die bis zu 20 Minuten unter Wasser bleiben und Rekordtiefen von über 580 Meter erreichen. Kleiner Arten tauchen jedoch nur in Tiefen von bis zu 20 Metern. Während des Tauchens wird der Herzschlag der Tiere auf ein Fünftel des normalen Ruhewertes herabgesetzt, was den Sauerstoffverbrauch verringert. Die Druck- und Temperaturregulation bei tiefen Tauchgängen ist dagegen noch eine Herausforderung für die Forschung (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f, Sivak et al. 1987, Williams 1995).
Brutverhalten
Während weiter nördlich lebende Arten ganzjährig brüten können, beginnen fast alle subantarktischen und antarktischen Pinguine grundsätzlich im Frühling oder Sommer mit der Eiablage. Der Kaiserpinguin (Aptenodytes forsteri) macht hier wieder eine Ausnahme, die schon im Herbst brüten. Die Jungen werden dann während des antarktischen Winters bei Temperaturen von bis zu −40 Grad Celsius aufgezogen (Abb. 15). Eiablage, Brut und die weitere Aufzucht der Jungen finden bei vielen Arten synchron in großen Brutkolonien statt, die im Extremfall bis zu fünf Millionen Tiere umfassen können. Während Kaiser- und Königspinguine ihr jeweils einziges Ei auf ihren Füßen ausbrüten (Abb. 16), legen bei allen anderen Arten die Pinguinweibchen im Abstand von drei bis fünf Tagen zwei Eier in ein einfaches Nest, das aus den in der Umgebung vorhandenen Materialien wie Gräsern oder kleinen Kieselsteinen angelegt wird. Während bei jungen Brutpaaren nicht alle Eier erfolgreich ausgebrütet werden, steigt der Bruterfolg mit zunehmendem Alter an. Meist ist das erste Ei etwas größer als das zweite, so dass das erste Küken etwas eher schlüpft als sein Geschwisterküken. Die Brutdauer beträgt je nach Art zwischen einem und zwei Monaten. Das erstgeborene Jungtier wird von seinen Eltern bevorzugt und erhält zum Beispiel mehr Nahrung als das zweitgeschlüpfte, welches meist schnell stirbt. Diese sogenannte Brutreduktion ist eine evolutionäre Anpassung an ein begrenztes Nahrungsangebot: Durch den schnellen Tod des zweiten Kükens wird sichergestellt, dass die Überlebenschancen des ersten nicht durch Verteilung der knappen Ressourcen auf zwei Nachkommen herabgesetzt werden. Umgekehrt haben sich die Eltern durch das zweite Ei „rückversichert“, falls das erste Küken frühzeitig umkommen sollte (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f, Williams 1995).

Abb. 15: Kolonie von Kaiserpinguinen mit Küken

Abb. 16: Königspinguin mit Ei
Pinguine bilden in der Regel monogame Brutpaare, bei der Männchen durch trompetenhaftes Rufen die Weibchen anlocken. Handelt es sich nicht um den ersten Brutversuch, ist dies oft die Partnerin vom letzten Jahr. Die „Scheidungsrate“ ist bei Pinguinen je nach Art unterschiedlich hoch: Die Prozentzahl der Gelbaugenpinguine (Megadyptes antipodes), die nach einem Jahr einen anderen Partner wählten, liegt mit 14 sehr niedrig; ihre Partnertreue wird auch dadurch unterstrichen, dass zwölf Prozent der Partnerschaften länger als sieben Jahre andauern. Dagegen liegt die jährliche Trennungsrate bei Adeliepinguinen (Pygoscelis adeliae) bei mehr als 50 Prozent, entsprechend sind keine Partnerschaften bekannt, die länger als sechs Jahre überdauert hätten. Es ist bekannt, dass der Bruterfolg des Vorjahres bei der Frage der Partnerwahl eine gewichtige Rolle spielt. Die Aufzucht der Jungen lässt sich in zwei Phasen unterteilen: In den ersten zwei bis drei – bei Großpinguinen sogar sechs – Wochen werden das bzw. die Küken permanent von einem Elternteil beaufsichtigt, während der Partner auf Nahrungssuche geht. Sobald die Jungtiere herangewachsen sind, beginnt die „Kindergarten“-Zeit, in der die Jungen sich in Gruppen zusammenschließen, während beide Alttiere versuchen, Nahrung herbeizuschaffen. Je nach Art können solche Kindergarten-Gruppen nur einige wenige Tiere umfassen wie zum Beispiel bei Zügel- oder Brillen-Pinguinen oder sich aus Tausenden Individuen zusammensetzen wie bei Adelie-, Esels- Königs- oder Kaiserpinguinen (Del Hoyo 2020, Del Hoyo et al. 1992, Winkler et al. 2015, 2020f, Williams 1995, Lee et al. 2018, Ancel et al. 2013, Bried et al. 1999).
Drei Pinguinarten, Kronenpinguin (Eudyptes sclateri), Gelbaugenpinguin (Megadyptes antipodes) und Galápagos-Pinguin (Spheniscus mendiculus), werden als vom Aussterben bedroht eingestuft, sieben weitere gelten als gefährdet. Die meisten antarktischen Arten gelten wegen der Abgelegenheit ihres Lebensraums als stabil. Zu den Gründen der Bedrohung zählen Verlust des Lebensraums, ausgewilderte Säugetiere, die die Gelege fressen, klimatische Veränderungen oder auch Konflikte mit der kommerziellen Fischerei, die sich teilweise auf dieselben Arten spezialisiert hat, die von manchen Pinguinen gefressen werden, was zu einem Rückgang der Fischbestände führt. Sie verfangen sich auch oft in Fischernetzen.
Evolution der Pinguine
Fossile Pinguine
Pinguine verfügen über ein umfangreiches Fossilarchiv, was zum Teil darauf zurückzuführen ist, dass ihre Gliedmaßenknochen ungewöhnlich robust sind, aber wahrscheinlich auch darauf, dass diese Vögel große Ansammlungen in Meeresumgebungen bilden, die ein hohes Fossilisationspotenzial aufweisen. Bei vielen dieser neuen Funde handelt es sich um partielle oder vollständige Skelette, die neue Einblicke in die Evolutionsgeschichte der Pinguine ermöglichen (Jadwiszczak 2009, Ksepka & Ando 2011). Bemerkenswerterweise gab es auf allen Kontinenten der südlichen Hemisphäre Zeiten, in denen mehr fossile Pinguinarten nebeneinander existierten, als heute in jedem dieser Gebiete zu finden sind (Ksepka & Ando 2011).
Die ältesten Überreste der Stammgruppe der Pinguine stammen aus der Kreidezeit von Chatham Island, deren Klassifizierung jedoch noch unsicher ist (siehe Mayr 2009, 2016). Das älteste eindeutig zur Stammgruppe der Pinguine zählende Fossil ist die Gattung Waimanu aus dem späten Paläozän (58-61 mya) von Neuseeland (Ksepka & Ando 2011, Abb. 17). Waimanu umfasst zwei Arten von leicht unterschiedlichem Alter und Größe, die bereits flugunfähige, flügelschlagende Taucher mit einer aufrechten Haltung und einer Standhöhe von etwa 80-100 Zentimetern waren (Slack et al. 2006). Das Skelett von Waimanu weist viele der abgeleiteten Merkmale der heutigen Pinguine auf, von denen es sich jedoch noch in zahlreichen plesiomorphen Merkmalen unterscheidet. Tatsächlich weist Waimanu die primitivste Morphologie aller Stammgruppen-Pinguine auf (Gavryushkina et al. 2017), so ist sein Schulterblatt nicht so stark verbreitert wie bei den modernen Pinguinen, die distalen Teile von Elle und Speiche sind weniger abgeflacht, und der Tarsometatarsus ist länglicher (Abb. 19).

Abb. 17: Waimanu

Abb. 18: Crossvallia
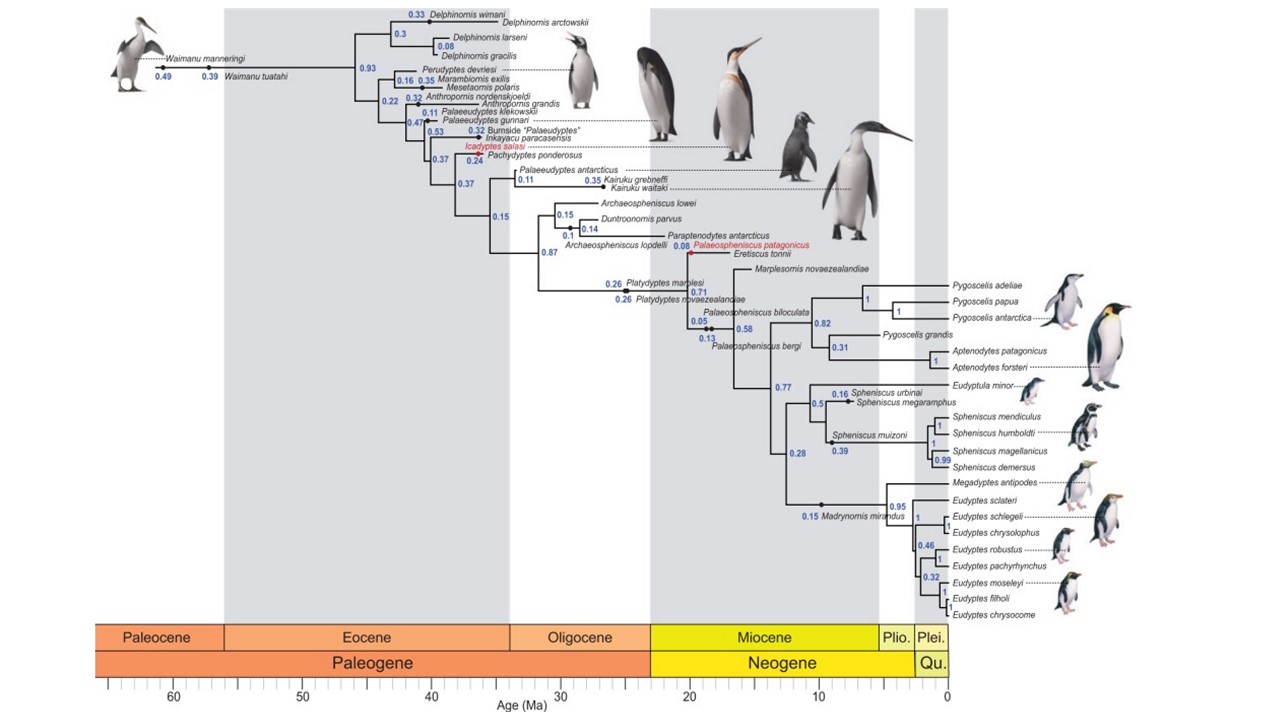
Abb.19: Kladogramm der Pinguine
Eine weitere Gattung vergleichbaren Alters ist Crossvallia aus dem späten Paläozän von Seymour Island (Antarktis), das auf mehreren Knochen eines einzigen Individuums basiert. Die Knochen ähneln denen von Waimanu, aber hinsichtlich einiger Merkmale weist Crossvallia eine etwas abgeleitete Morphologie auf (Jadwiszczak et al. 2013, Acosta Hospitaleche et al. 2013a, Tambussi et al. 2005, siehe Mayr et al. 2019 über die Beschreibung einer neuen, großen Crossvallia-Art, Abb. 18).
Fossilien von Pinguinen aus dem frühen Eozän sind vergleichsweise selten. Kaiika, ein Stammgruppen-Taxon aus dem frühen Eozän Neuseelands (Fordyce & Thomas 2011), war etwas größer als ein Kaiserpinguin und ist von einem Oberarmknochen bekannt, der wiederum dem von Waimanu ähnelt. Überreste von Pinguinen wurden auch aus dem frühen Eozän von Seymour Island gemeldet, darunter einige mittelgroße Arten (Jadwiszczak & Chapman 2011). Wesentlich umfangreicher sind die Funde aus dem mittleren und späten Eozän, die zeigen, dass die Pinguine zu diesem Zeitpunkt bereits sehr diversifiziert waren. Vor allem von der Seymour-Insel wurden Tausende von Knochen in der Nähe ehemaliger Brutplätze gesammelt. Es lassen sich mindestens sechs Gattungen unterscheiden, die insgesamt zehn benannte Arten umfassen (Anthropornis, Palaeeudyptes, Delphinornis, Mesetaornis, Marambiornis und Archaeospheniscus; Myrcha et al. 2002, Jadwiszczak 2006, 2008, 2009, 2012, 2013, Jadwiszczak & Gaździcki 2014, Jadwiszczak et al. 2021, Chavez 2007, Acosta Hospitaleche et al. 2017, Ksepka et al. 2006, Ksepka & Ando 2011, Simpson 1971, für Anthropornis, Palaeeudyptes, Delphinornis siehe Abb. 20-22). Die meisten Pinguinfossilien von Seymour Island bestehen aus isolierten Knochen, aber von einigen Arten wurden Teilskelette berichtet (Jadwiszczak 2012; Acosta Hospitaleche & Reguero 2014). Der Tarsometatarsus von Delphinornis, Marambiornis und Mesetaornis weisen ein distales Gefäßforamen auf. Dieses Merkmal ist bei modernen Pinguinen verloren gegangen und unterstützt die Position dieser drei Taxa außerhalb einer Gruppe (Ksepka & Ando 2011, Abb. 23). Anthropornis, Palaeeudyptes und Archaeospheniscus umfassen sehr große Arten mit einer Standhöhe von mehr als 1,5 Metern.
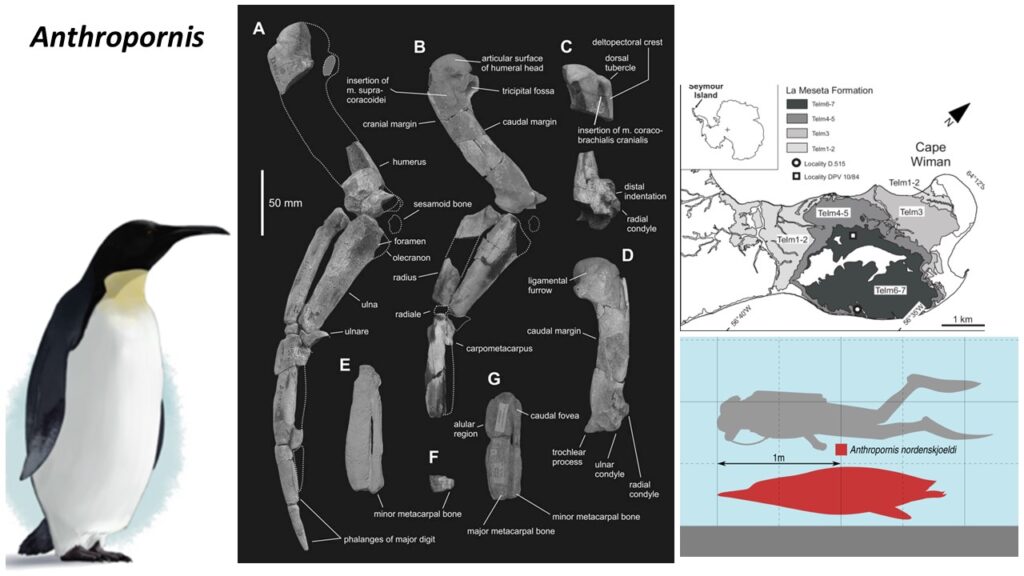
Abb. 20: Anthropornis

Abb. 21: Palaeeudyptes
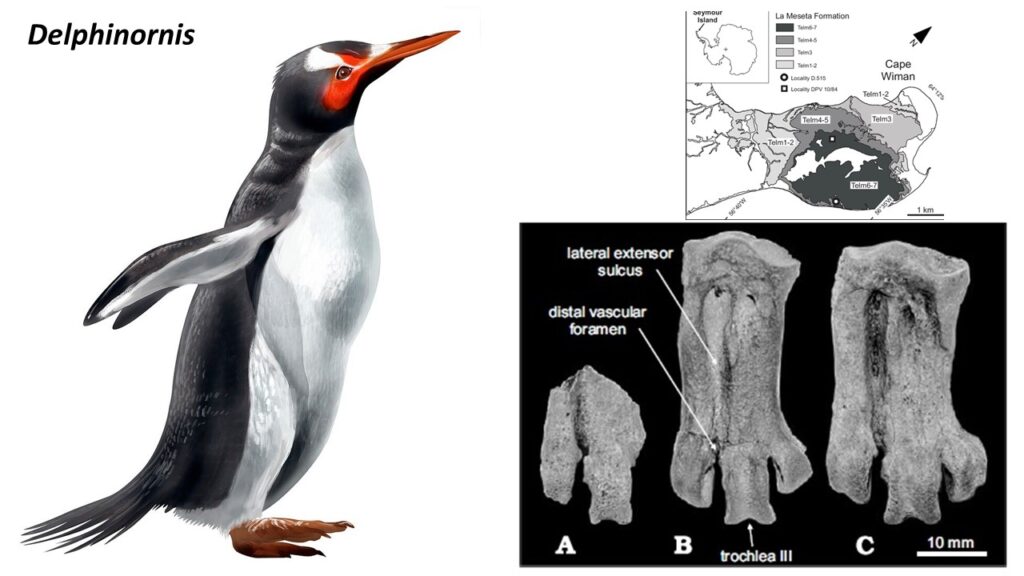
Abb. 22: Delphinornis
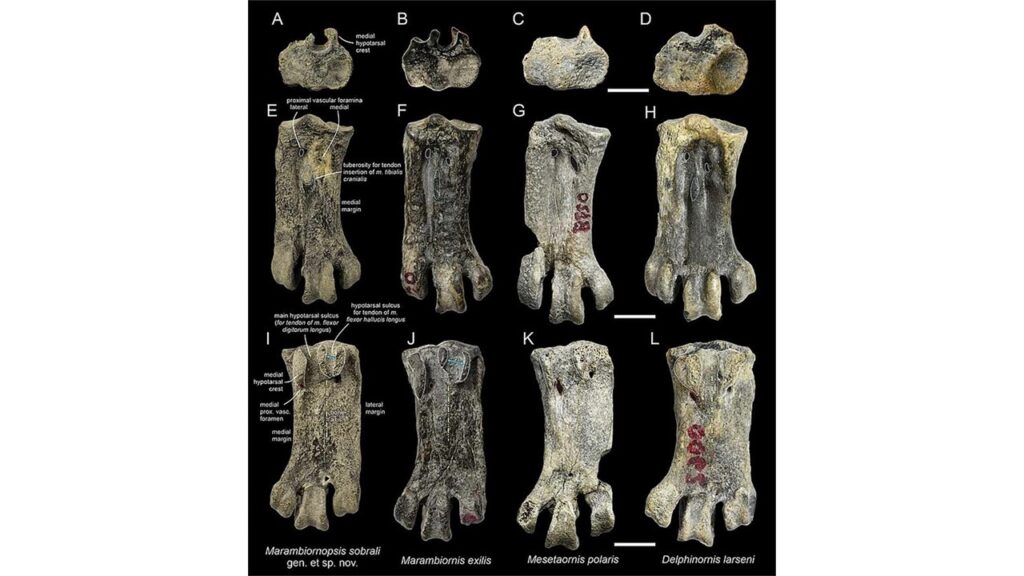
Abb. 23: Metatarsus ausgestorbener Pinguinarten aus Seymor-Island
Auch in Südamerika findet man eine artenreiche Sammlung von Stammgruppen-Pinguinen: Perudyptes aus dem mittleren Eozän, sowie Icadyptes und Inkayacu aus dem späten Eozän Perus. Von Inkayacu ist ein vollständiges Exemplar bekannt, bei dem sogar Teile der Flügelfedern und die Haut der Zehen erhalten sind (Clarke et al. 2007, Ksepka & Clarke 2010, Ksepka et al. 2008, Clarke et al. 2010, Abb. 24 und 25).
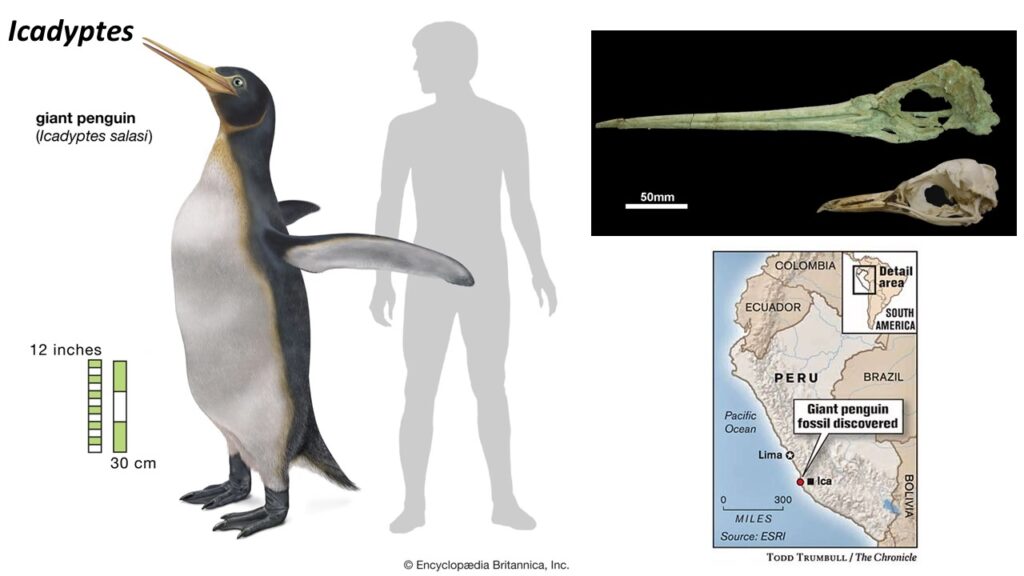
Abb. 24: Icadytptes

Abb. 25: Inkayacu
Die Pinguine setzten ihre Diversifizierung im Oligozän fort, aber die Fossilien aus dieser und späteren Epochen stammen hauptsächlich aus Südamerika und Neuseeland, und aus der Antarktis wurden keine nacheozänen Pinguinfossilien gemeldet (Ksepka & Ando 2011). Insbesondere Südamerika verfügt über eine sehr reiche neogene Überlieferung von Pinguinen, und die dramatischen geologischen Veränderungen, die die Evolution der Pinguine auf diesem Kontinent begleiteten, werden durch die Entdeckung von Palaeospheniscus-Fossilien aus dem frühen Miozän in den patagonischen Kordilleren in einer Höhe von 1400 Metern und etwa 500 Kilometer von der heutigen Atlantikküste entfernt veranschaulicht (Acosta Hospitaleche et al. 2013b). Das bekannte Taxon Paraptenodytes aus dem frühen Miozän Argentiniens ist immer noch ein Stammgruppenvertreter der Pinguine (Bertelli et al. 2006). Der älteste Kronengruppenpinguin stammt aus dem mittleren Miozän (∼11-13 mya) der Pisco-Formation in Peru und wurde der heutigen Gattung Spheniscus (S. muizoni; Göhlich 2007) zugeordnet. Eine weitere ausgestorbene Spheniscus-Art aus dem späten Miozän der Pisco-Formation, S. megaramphus, hat einen viel längeren Schnabel als alle heute lebenden Arten der Gattung (Stucchi et al. 2003, Abb. 26). Madrynornis aus dem späten Miozän (∼10 mya) Argentiniens gilt als Schwestertaxon der heutigen Schopfpinguine (Gattung Eudyptes) (Acosta Hospitaleche et al. 2007), und eine sehr große, ausgestorbene Pygoscelis-Art, zu denen heute Zügel-, Adeli- und Eselspinguin (P. antarctica, P. adeliae, P. papua) gehören, aus dem Pliozän Nordchiles wurde als Schwestertaxon der heutigen Pygoscelis-Arten vermutet (Walsh & Suárez 2006). Molekulare Phylogenien, die mit diesen und anderen Fossilien kalibriert wurden, deuten auf eine Diversifizierung der Kronengruppe der Pinguine vor etwa 20 Millionen Jahren hin (Subramanian et al. 2013).

Abb. 26: ausgestorbene und rezente Arten der Gattung Spheniscus
Evolutionsgeschichte der Pinguine
Selbst die frühesten fossilen Pinguine waren flugunfähig, und diese Vögel müssen ihre Flugfähigkeit schon sehr früh verloren haben, um oder sogar vor der Kreide/Paläogen-Grenze. Obwohl die älteste Stammgruppe der Pinguine bereits die grundlegenden Skelettmerkmale ihrer lebenden Verwandten aufweist, unterscheiden sie sich in zahlreichen plesiomorphen Merkmalen von den heutigen Pinguinen, und erst nach und nach wurden die Merkmale der Kronengruppe erworben. Anders als bei den heute lebenden Pinguinen sind die Flügelglieder des paläozänen Waimanu und des späteozänen Inkayacu nicht mit dem Carpometacarpus verschmolzen, was auf das Vorhandensein einer zumindest rudimentären Alula bei diesen Taxa hinweist (Ksepka et al. 2008; Ksepka & Ando 2011). Bei Kairuku aus dem frühen Oligozän hat das Pygostyl eine plesiomorphere Form als bei der Kronengruppe der Pinguine, was darauf hindeutet, dass der Schwanz nicht wie bei den heutigen Pinguinen zum Abstützen des stehenden Vogels verwendet wurde (Ksepka et al. 2012).
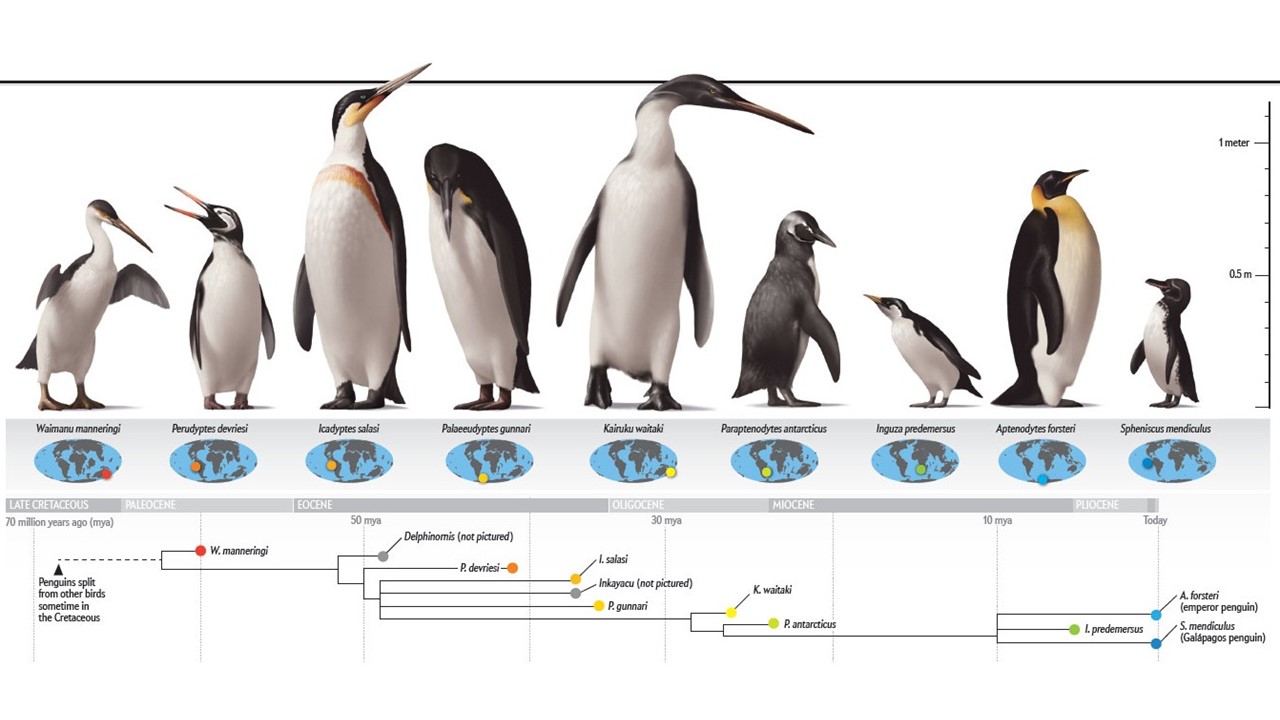
Abb. 27: Riesenwuchs bei Pinguinen
Viele Pinguine aus dem Paläogen sind sehr groß, und selbst die paläozänen Waimanu und Crossvallia erreichten bereits die Größe des Kaiserpinguins. Ab dem frühen Eozän wurden einige Arten wirklich gigantisch, und einige wie Palaeeudyptes erreichten Stehhöhen von 1,5-2 Metern und ein Gewicht bis zu 80 Kilogramm (Jadwiszczak 2001, Ksepka & Ando 2011, Acosta Hospitaleche 2014). Diese Riesenformen, die bis zum Oligozän existierten, koexistierten jedoch mit kleineren Formen, und sicherlich war die flugfähige Stammart der Pinguine ein kleiner bis mittelgroßer Vogel (Clarke et al. 2007, Ksepka & Ando 2011, Abb. 27). Erst nachdem die aerodynamischen Zwänge wegfielen, könnte die Riesengröße der Pinguine positiv selektiert worden sein. Der Flug in Luft und das Schwimmen unter Wasser stellen unterschiedliche Ansprüche an den Vogelflügel – als Folge können die fliegenden und tauchenden Vorfahren der Pinguine wenig größer als etwa die heutigen Zwerg- oder Brillenpinguine gewesen sein. Daraus ergibt sich ein – hypothetisches – Szenario, nach dem die Pinguine von einer Population kleiner Meeresvögel abstammen. Im Zuge einer immer besseren Anpassung an das Meer bildeten sich ihre Flügel immer weiter zu Flossen um, während die Beine nach hinten wanderten, um den Strömungswiderstand beim Schwimmen zu verringern.
Pinguine gelten als Lehrbuchbeispiel für die Bergmannsche Regel, welche besagt, dass Tiere in kälteren Regionen größer sind, da dies zu einem günstigeren Verhältnis von Volumen zu Oberfläche des Tieres und damit zu weniger Wärmeverlust führt (Ashton 2002, Meiri 2011, Meiri & Dayan 2003, Abb. 28). Tatsächlich kommen die größten Arten – Kaiser – und Königspinguin in den kältesten Regionen vor, während Pinguine in den wärmeren Zonen kleiner sind.

Abb. 28: Bergmannsche Regel bei Pinguinen
Die deutliche Größenzunahme in der Stammgruppe der Pinguine fand jedoch vor dem Einsetzen der globalen Abkühlung statt. Fossilien der riesigen Pachydyptes wurden in Verbindung mit Warmwasser-Foraminiferen gefunden, und die ebenso großen Icadyptes lebten in äquatornahen Gewässern (Clarke et al. 2007). Tatsächlich scheint die Durchschnittsgröße der Pinguine während der globalen Abkühlung im Känozoikum abgenommen zu haben, und eher eine erhöhte Produktivität der Ozeane als ein verändertes Klima könnte zu einer Größenzunahme der Pinguine geführt haben (Clarke et al. 2007).
Die heutigen Pinguine ernähren sich sowohl von Fischen als auch von Plankton, und es gibt deutliche Unterschiede in der Schnabelmorphologie zwischen den Arten an den Extremen dieser Nahrungsspektren, wobei der Schnabel der planktonfressenden Schopfpinguine breit und mit einem sehr tiefen Unterkiefer ausgestattet ist, während der der fischfressenden Königs- und Kaiserpinguine (Aptenodytes) lang und spitz ist. Viele Pinguine aus dem frühen Känozoikum haben sehr lange und dolchartige Schnäbel, die bei Icadyptes und Kairuku fast die doppelte Länge des Hirnschädels erreichen. Da Waimanu bereits einen langen Schnabel hat, könnte er plesiomorph für Pinguine sein (Ksepka et al. 2008, Haidr & Acosta Hospitaleche 2012). Die Fossilienaufzeichnungen geben Aufschluss über weitere Aspekte der hochgradig abgeleiteten Anatomie der Pinguine. Der Oberarmknochen der heute lebenden Arten weist beispielsweise ein komplexes Gefäßsystem auf, den Humerus plexus, der als Wärmespeicherstruktur interpretiert wurde. Diese Gefäßstrukturen finden sich jedoch bei allen Arten, die enger mit der Kronengruppe verwandt sind als Waimanu. Sie haben sich also zu einer Zeit entwickelt, als Pinguine noch in tropischem Klima lebten. Das Humerusgeflecht hat es der Stammgruppe der Pinguine möglicherweise ermöglicht, über einen längeren Zeitraum in kalten küstennahen Gewässern nach Nahrung zu suchen, und es war eine der Voranpassungen, die die spätere Ausbreitung dieser Vögel in Gebiete mit sehr kaltem Klima ermöglichte (Thomas et al. 2010, Thomas & Fordyce 2007, Abb. 29).
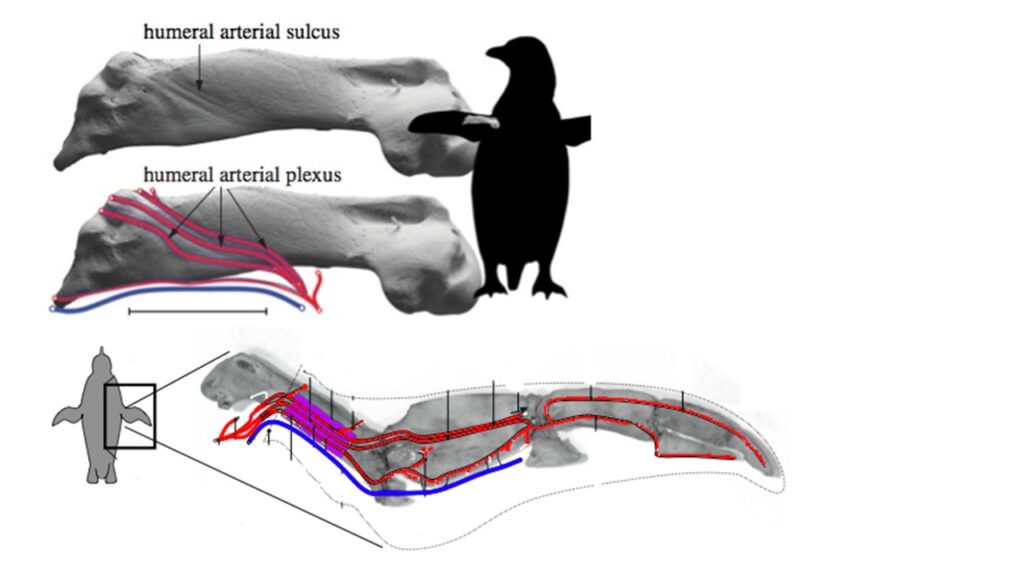
Abb. 29: Humerus plexus bei Pinguinen
Alle Pinguinfossilien stammen aus der südlichen Hemisphäre und wurden innerhalb des geografischen Verbreitungsgebiets der heute lebenden Arten gefunden. Die Fossilien deuten darauf hin, dass sich die Pinguine in der jüngsten Kreidezeit oder im frühesten Känozoikum in Neuseeland entwickelt haben, von wo aus sie sich rasch in die Antarktis und nach Südamerika ausgebreitet haben (Ksepka & Thomas 2012, Pelegrin et al. 2022, Abb. 27). Die Frage, warum Pinguine nie die nördliche Hemisphäre erreicht haben, ist noch immer ungelöst. Die ozeanischen Zirkulationssysteme und die Verteilung produktiver mariner Auftriebsgebiete stellen heute geografische Barrieren dar (Ksepka & Thomas 2012), aber der Ursprung der Pinguine geht auf geologische Perioden mit sehr unterschiedlichen Klimaregimen zurück. Die Pinguine haben die meisten ihrer Merkmale erhalten, bevor die Vergletscherung der Antarktis gegen Ende des Eozäns begann. Mehr als durch klimatische Ereignisse könnte ihre Entwicklung durch das Fehlen von Raubsäugetieren auf einigen Kontinenten der südlichen Hemisphäre geprägt worden sein, was die Entwicklung der Flugunfähigkeit dieser Vögel begünstigte. Es ist daher wahrscheinlich kein Zufall, dass der Ursprung der flugunfähigen Pinguine um die Kreide-Paläogen-Grenze herum liegt und in einen Zeitraum fällt, in dem die meisten großen terrestrischen Raubtiere weltweit ausstarben.
Die paläogenen Pinguin-Faunen waren bemerkenswert diversifiziert, und allein im späten Eozän der Seymour-Insel existierten 10-14 sympatrische Arten nebeneinander (Tambussi & Acosta Hospitaleche 2007, Ksepka & Ando 2011). Das Vorkommen so vieler Arten in einem kleinen geografischen Gebiet könnte durch das weite Größenspektrum dieser Vögel begünstigt worden sein, das von kleinen Arten von der Größe des heutigen Goldschopfpinguin (Eudyptes chrysolophus) bis hin zu riesigen Arten mit einer Standhöhe von fast 2 Metern reicht (Jadwiszczak 2001). Die Nischenaufteilung wird auch durch unterschiedliche Schnabelmorphologien und Schädelspezialisierungen deutlich (Haidr & Acosta Hospitaleche 2012). Pinguine scheinen erst sehr spät nach Afrika gelangt zu sein, wo die frühesten Fossilien vier nicht identifizierte Arten aus dem späten Miozän Südafrikas sind, die sich in ihrer Größe stark unterscheiden und den Größenbereich der größten und kleinsten heute lebenden Pinguinarten abdecken (Thomas & Ksepka 2013). Mindestens drei weitere Arten sind aus dem frühen Pliozän Südafrikas bekannt und gehören ebenfalls zu ausgestorbenen Gattungen (Nucleornis, Inguza, Dege; Ksepka & Ando 2011, Simpson 1979). Keine dieser Arten scheint eng mit dem Afrikanischen Brillenpinguin (Spheniscus demersus) verwandt zu sein, der einzigen noch existierenden Pinguinart, die in Afrika brütet (Ksepka & Thomas 2012). Die frühere Vielfalt der Pinguine in Afrika wurde durch mehrere Ausbreitungsereignisse erklärt, die durch ozeanische Strömungen begünstigt wurden, und zumindest im Fall des Vorfahren des Brillenpinguins erfolgte diese Ausbreitung wahrscheinlich aus Südamerika, da die drei anderen Arten der Gattung Spheniscus, Galapagos,- Magellan- und Humboldtpinguin in Südamerika heimisch sind (Ksepka & Thomas 2012). Wann genau die meisten afrikanischen Pinguinarten ausgestorben sind, ist nicht bekannt, aber die Pinguinvielfalt in Afrika könnte durch die Veränderungen des Meeresspiegels im Pliozän beeinflusst worden sein, die zum Verschwinden sicherer Brutplätze auf vorgelagerten Inseln führten (Ksepka & Thomas 2012).
Die zweite große Gruppe der Aequornithes, die Pelecanimorphae, werden in der nächsten und übernächsten Episode behandelt.
Literatur
Acosta Hospitaleche, C (2014): New giant penguin bones from Antarctica: Systematic and paleobiological significance. Comptes Rendus Palevol 13, 555–560.
Acosta Hospitaleche, C, Reguero, M, Scarano, A (2013a): Main pathways in the evolution of the Paleogene Antarctic Sphenisciformes. Journal of South American Earth Sciences 43, 101–111
Acosta Hospitaleche, C, Griffin, M, Asensio, M, Cione, AL, Tambussi, C (2013b): Restos de Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance, First Edition. Gerald Mayr.
Acosta Hospitaleche, C, Reguero, M (2014): Palaeeudyptes klekowskii, the best preserved penguin skeleton from the Eocene-Oligocene of Antarctica: Taxonomic and evolutionary remarks. Geobios 47, 77–85.
Acosta Hospitaleche, C, Reguero, M, Santillana, S (2017): Aprosdokitos mikrotero gen. et sp. nov., the tiniest Sphenisciformes that lived in Antarctica during the Paleogene. Neues Jahrbuch für Geologie und Paläontologie-Abhandlungen, 283(1), 25-34.
Acosta Hospitaleche, C, Tambussi, C, Donato, M, Cozzuol, M, Hospitaleche, A, Donato, C (2007): A new Miocene penguin from Patagonia and its phylogenetic relationships. Acta Palaeontologica Polonica. 52.
Agnolín, F. L., et al. (2017): Vegaviidae, a new clade of southern diving birds that survived the K/T boundary. The Science of Nature 104(87):1-9
Ancel A, Beaulieu M, Gilbert C. (2013): The different breeding strategies of penguins: a review. C R Biol. 336(1):1-12
Ashton, K. (2002): Patterns of within-species body size variation of birds: strong evidence for Bergmann’s rule. Global Ecology and Biogeography. 11 (6): 505–523.
Baker, AJ, Pereira, SL, Haddrath, OP, Edge, KA (2006): Multiple gene evidence for expansion of extant penguins out of Antarctica due to global cooling, Proc. Royal Soc. B 273, 11-17.
Bertelli, S; Giannini, NP, Ksepka, DT (2006): Redescription and Phylogenetic Position of the Early Miocene Penguin Paraptenodytes antarcticus from Patagonia. American Museum Novitates 3525: 1-36.
Bonadonna, F; Cunningham, G B.; Jouventin, P; Hesters, F; Nevitt, G A. (2003): Evidence for nest-odour recognition in two species of diving petrel. Journal of Experimental Biology. 206 (Pt 20): 3719–3722.
Bried, J et al. (1999): Why Do Aptenodytes Penguins Have High Divorce Rates? The Auk 116, (2), 504–512,
Bried, J, et al. (2007): Population biology of the wandering albatross (Diomedea exulans) in the Crozet and Kerguelen archipelagos, southern Indian Ocean, approached through genetic and demographic methods, J. Zool. 272, 20-29.
Brodkorb, P (1953): A Review of the Pliocene Loons. Condor. 55 (4): 211–214.
Brodkorb, P (1963): Catalogue of fossil birds. Part 1 (Archaeopterygiformes through Ardeiformes). Bulletin of the Florida State Museum, Biological Sciences. 7 (4): 179–293.
Burg, TM, Croxall, JP (2001): Global relationships amongst black-browed and grey-headed albatrosses: analysis of population structure using mitochondrial DNA and microsatellites, Mol. Ecol. 10, 2647-2660.
Burg, TM, Croxall, JP (2004): Global population structure and taxonomy of the wandering albatross species complex, Mol. Ecol. 13, 2345-2355.
Buskirk, R. W. V; Nevitt, G. A. (2008): The influence of developmental environment on the evolution of olfactory foraging behaviour in procellariiform seabirds. Journal of Evolutionary Biology. 21 (1): 67–76
Chambers, GK et al. (2009): Phylogenetic analysis of the 24 named albatross taxa based on full mitochondrial cytochrome b DNA sequences, Notornis 56, 82-94.
Chatterjee, S. (2002): The morphology and systematics of Polarornis, a Cretaceous Loon (Aves: Gaviidae) from Antarctica. Proceedings of the 5th Symposium of the Society of Avian Paleontology and Evolution 125-155
Chavez, M (2007): Fossil birds of Chile and Antarctic Peninsula. Arquivos do Museo Nacional, Rio de Janeiro 65(4):551-572
Clarke, JA; Ksepka, DT.; Salas-Gismondi, R; Altamirano, AJ.; Shawkey, MD.; D’Alba, L; Vinther, J; DeVries, TJ.; Baby, P (2010): Fossil evidence for evolution of the shape and color of penguin feathers. Science 330 (6006): 954–957.
Clarke, JA, Ksepka, DT, Stucchi, M, Urbina, M, Giannini, N, Bertelli, S, Naraez , Y, Boyd, C (2007): Paleogene equatorial penguins challenge the proposed relationship between biogeography, diversity, and Cenozoic climate change. Proceedings of the National Academy of Sciences 104: 11545-11550.
Clarke, JA et al. (2005): Definitive fossil evidence for the extant avian radiation in the Cretaceous. Nature 433(20):305-308
Cole, TL, Zhou, C, Fang, M et al. (2022): Genomic insights into the secondary aquatic transition of penguins. Nat Commun 13, 3912 (2022). https://doi.org/10.1038/s41467-022-31508-9
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliot, A.; Sargatal, J., eds. (1992): Handbook of the Birds of the World, volume 1, Ostrich to Dodos, Lynx Edicions, Barcelona.
De Pietri, VL, Berger, JP, Pirkenseer, C, Scherler, L, Mayr, G (2010): New skeleton from the early Oligocene of Germany indicates a stem-group position of diomedeoidid birds. Acta Palaeontologica Polonica 55, 23–34.
Dyke, GJ, Nudds, RL, Walker, CA (2007): The Pliocene Phoebastria (“Diomedea”) anglica: Lydekker’s English fossil albatross. The Ibis 149, 626–631.
Ferrer-Obiol J, Herranz JM, Paris JR, Whiting JR, Rozas J, Riutort M, González-Solis J (2023): Species delimitation using genomic data to resolve taxonomic uncertainties in a speciation continuum of pelagic seabirds, Mol. Phylogenet. Evol. 179, e:107671.
Ferrer-Obiol J, James HF, Chesser RT, Bretagnolle V, González-Solís J, Rozas J, Riutort M, Welch AJ (2021): Integrating sequence capture and restriction site-associated DNA sequencing to resolve recent radiations of pelagic seabirds, Sys. Biol. 70, 976-996.
Fordyce, RE, Thomas, DB (2011): Kaiika maxwelli, a new Early Eocene archaic penguin (Sphenisciformes, Aves) from Waihao Valley, South Canterbury, New Zealand. New Zealand Journal of Geology and Geophysics. 54: 43-51
Gangloff, B, et al. (2012): The complete phylogeny of Pseudobulweria, the most endangered seabird genus: systematics, species status and conservation implications, Conserv. Genet. 13, 39-52.
Gavryushkina, A, et al. (2017): Bayesian total evidence dating reveals the recent crown radiation of penguins. Systematic Biology 66 (1): 57-73.
Göhlich, UB (2007): The oldest fossil record of the extant penguin genus Spheniscus — a new species from the Miocene of Peru, Acta Palaeontologica Polonica, 52: 285–298,
Grosser S, Buridge, CP, Peucker, AJ, Waters, JM (2015): Coallescent modelling reveals recent secondary-contact of cryptic penguin species, PLoS ONE 10, e0144966.
Grosser, S., Rawlence, NJ, Anderson, CNK, Smith, IWG, Scofield, RP, Waters, JM (2016): Invader or resident? Ancient-DNA reveals rapid species turnover in New Zealand little penguins, Proc. Royal Soc. B 283, 20152879.
Grosser S, Robertson F, Shepherd LD, Tennyson AJD, Miskelly CM, Taylor GA, Robertson BC (2021): Phylogenetic affinities of the Whenua Hou Diving Petrel: implications for conservation, Emu 121, 102-112.
Hackett SJ, et al. (2008): A phylogenetic study of birds reveals their evolutionary history, Science 320, 1763-67.
Hadden PW, Ober WC, Gerneke DA, Thomas D, Scadeng M, McGhee CNJ, Zhang J. (2022): Micro-CT guided illustration of the head anatomy of penguins (Aves: Sphenisciformes: Spheniscidae). J Morphol. 283(6):827-851.
Haidr, N, Acosta Hospitaleche, C (2012): Feeding habits of Antarctic Eocene penguins from a morphofunctional perspective. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 263, 125–131.
Hope, S (2002): The Mesozoic radiation of Neornithes. In L. M. Chiappe and L. M. Witmer (eds.), Mesozoic Birds: Above the Heads of Dinosaurs. University of California Press, Berkeley 339-388
Howard, H. (1978): Late Miocene marine birds from Orange County, California. Contributions in Science. 290: 1–26.
IUCN (2018): Guadalupe Storm-petrel https://www.iucnredlist.org/species/22698530/132651919
Jadwiszczak, P (2001): Body size of Eocene Antarctic penguins. Polish Polar Research 22, 147–158.
Jadwiszczak, P (2006): Eocene penguins of Seymour Island, Antarctica: Taxonomy. Polish Polar Research. 27 (1): 3–62.
Jadwiszczak, P (2008): Short Note: An intriguing penguin bone from the Late Eocene of Seymour Island, Antarctic Peninsula. Antarctic Science, 20(6), pp.589-590.
Jadwiszczak, P (2009): Penguin past: The current state of knowledge. Polish Polar Research 30, 3–28.
Jadwiszczak, P (2012): Partial limb skeleton of a “giant penguin” Anthropornis from the Eocene of Antarctic Peninsula. Polish Polar Research 33, 259–274.
Jadwiszczak, P (2013): Taxonomic diversity of Eocene Antarctic penguins: A changing picture. Geological Society, London, Special Publications 381, 129–138.
Jadwiszczak, P, Acosta Hospitaleche, C, Reguero, M (2013): Redescription of Crossvallia unienviella: The only Paleocene Antarctic penguin. Ameghiniana 50, 545–553.
Jadwiszczak, P, Chapman, SD (2011): The earliest fossil record of a medium-sized penguin.Polish Polar Research 32, 269–277.
Jadwiszczak, P, Gaździcki, A (2014): First report on hind-toe development in Eocene Antarctic penguins. Antarctic Science, 26(3), pp.279-280.
Jadwiszczak, P, Reguero, M, Mörs, T (2021): A new small-sized penguin from the late Eocene of Seymour Island with additional material of Mesetaornis polaris. GFF. 143 (2–3): 283–291.
Jarvis ED et al. (2014): Whole-genome analysis resolve early branches in the tree of life of modern birds, Science 346, 1320-31.
Kessler, E. (1984): Noi contribuţii privind studiul avifaunelor din Paratethys. Crisia. 14: 521–532.
Kimball, RT et al. (2013): Identifying localized biases in large datasets: A case study using the Avian Tree of Life. Mol Phylogenet Evol. 69 (3): 1021–32.
Ksepka, DT (2014): Flight performance of the largest volant bird. Proceedings of the National Academy of Sciences USA 111, 10624–10629.
Ksepka, DT, Ando, T (2011): Penguins past, present, and future: trends in the evolution of the Sphenisciformes. Living Dinosaurs, pp.155-186.
Ksepka, DT, Bertelli, S, Giannini, NP (2006): The phylogeny of the living and fossil Sphenisciformes (penguins). Cladistics 22:412-441
Ksepka, DT, Clarke, JA (2010): The basal penguin (Aves: Sphenisciformes) Perudyptes devriesi and a phylogenetic evaluation of the penguin fossil record. Bulletin of the American Museum of Natural History 337, 1–77.
Ksepka, DT, Clarke, JA, DeVries, TJ, Urbina, M (2008): Osteology of Icadyptes salasi, a giant penguin from the Eocene of Peru. Journal of Anatomy 213, 131–147.
Ksepka, DT, Fordyce, RE, Ando, T, Jones, CM (2012): New fossil penguins (Aves, Sphenisciformes) from the Oligocene of New Zealand reveal the skeletal plan of stem penguins. Journal of Vertebrate Paleontology 32, 235–254.
Ksepka, DT, Thomas, DB (2012): Multiple cenozoic invasions of Africa by penguins (Aves, Sphenisciformes). Proceedings of the Royal Society, B, Biological Sciences 279, 1027–1032.
Ksepka, DT, et al. (2023): Stem albatrosses wandered far: a new species of Plotornis (Aves, Pan-Diomedeidae) from the earliest Miocene of New Zealand. Journal of the Royal Society of New Zealand advance online publication.
Kuhl H, et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-tree of life. Mol. Biol. Evol. 38, 108-127.
Kuramoto T, Nishihara H, Watanabe M, Okada N (2015): Determining the position of storks on the phylogenetic tree of waterbirds by retroposon insertion analysis, Genome Biol. Evol. 7, 3180-89.
Lee L, Tirrell N, Burrell C, Chambers S, Vogel S, Domyan ET. (2018): Genetic tests reveal extra-pair paternity among Gentoo penguins (Pyogoscelis papua ellsworthii) at Loveland Living Planet Aquarium: Implications for ex situ colony management. Zoo Biol. doi: 10.1002/zoo.21432.
Mayr, G (2004): A partial skeleton of a new fossil loon (Aves, Gaviiformes) from the early Oligocene of Germany with preserved stomach content. In: Journal of Ornithology 145, 281–286.
Mayr, G (2009): Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G (2009a): Notes on the osteology and phylogenetic affinities of the Oligocene Diomedeoididae (Aves, Procellariiformes). Fossil Record. 12 (2): 133–140.
Mayr, G (2015): A procellariiform bird from the early Oligocene of North America. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 275, 11–17.
Mayr, G (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G; De Pietri, VL; Love, L; Mannering, A; Scofield, RP (2019): Leg bones of a new penguin species from the Waipara Greensand add to the diversity of very large-sized Sphenisciformes in the Paleocene of New Zealand. Alcheringa. 44: 194–201.
Mayr, G; Goedert, JL (2017): Oligocene and Miocene albatross fossils from Washington State (USA) and the evolutionary history of North Pacific Diomedeidae. The Auk. 134 (3): 659–671
Mayr, G; Kitchener, AC (2022): Oldest fossil loon documents a pronounced ecomorphological shift in the evolution of gaviiform birds. Zoological Journal of the Linnean Society. 196 (4): 1431–1450.
Mayr, G, Pavia, M (2014): On the True Affinities of Chenornis graculoides Portis, 1884 and Anas lignitifila Portis, 1884 – An Albatross and an Unusual Duck form the Miocene of Italy. Journal of Vertebrate Paleontology 34 (4): 914 – 923.
Mayr, G, Peters, S, Rietschel, S (2002): Petrel-like Birds with a Peculiar Foot Morphology from the Oligocene of Germany and Belgium (Aves: Procellariiformes). Journal of Vertebrate Paleontology 22(3), 667–676
Mayr, G, Smith, T (2012): A Fossil Albatross from the Early Oligocene of the North Sea Basin. The Auk 129 (1), 87–95.
Mayr, G, Smith, T (2013): Galliformes, Upupiformes, Trogoniformes, and other avian remains (?Phaethontiformes and ?Threskiornithidae) from the Rupelian stratotype in Belgium, with comments on the identity of “Anas” benedeni Sharpe, 1899. In: U.B. Göhlich & A. Kroh (eds.), Paleornithological Research 2013 – Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution. Vienna: Natural History Museum Vienna, pp. 23–35.
Mayr, G, Tennyson, AJD (2020): A small, narrow-beaked albatross from the Pliocene of New Zealand demonstrates a higher past diversity in the feeding ecology of the Diomedeidae. Ibis. 162 (3): 723–734.
Mayr, G, Zvonok, E (2011): Middle Eocene Pelagornithidae and Gaviiformes (Aves) from the Ukrainian Paratethys.
Mayr, G, Zvonok, E, Gorobets, L (2013): The tarsometatarsus of the middle Eocene loon Colymbiculus udovichenkoi. In: U.B. Göhlich & A. Kroh (eds.), Paleornithological Research 2013 – Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution. Vienna: Natural History Museum Vienna, pp. 17–22.
Meiri, S (2011): Bergmann’s Rule – what’s in a name? Global Ecology and Biogeography 20:203–207.
Meiri, S; Dayan, T (2003): On the validity of Bergmann’s rule. Journal of Biogeography. 30 (3): 331–351.
Mlíkovský, J (1998): A new loon (Aves: Gaviidae) from the middle Miocene of Austria. Annalen des Naturhistorischen Museums in Wien, Serie A: 331–339.
Mlíkovský, J (2002): Cenozoic Birds of the World, Part 1: Europe. Ninox Press, Prague.
Myrcha, A, Jadwiszczak, P, Tambussi, CP, Noriega, JI, Gazdzicki, A, Tatur, A, Valle, RA (2002): Taxonomic Revision of Eocene Antarctic Penguins Based on Tarsometatarsal Morphology. Polish Polar Research, 23(1): 5-46
Norambuena HV, Barros R, Jaramillo Á, Medrano F, Gaskin C, King T, Baird K, Hernández CE (2024): Resolving the conflictive phylogenetic relationships of Oceanites (Oceanitidae: Procellariiformes) with description of a new species, Zootaxa 5486, 451-475.
Nunn, GB, Stanley SE (1998): Body size effects and rates of cytochrome b evolution in tube-nosed seabirds Mol. Biol. Evol. 15, 1360-1371
Nunn, G. et al. (1996): Evolutionary relationships among extant albatrosses (Procellariiformes: Diomedeidae) established from complete cytochrome-b sequences. The Auk 113, 784–801
Olson, SL (1985): Section X.I. Gaviiformes. In Farner, D.S.; King, J.R.; Parkes, Kenneth C. (eds.). Avian Biology. Vol. 8. pp. 212–214.
Olson, SL (1985a): The fossil record of birds. In: D.S. Farner, J.R. King, & K.C. Parkes (eds.), Avian Biology, vol. 8. New York: Academic Press, pp. 79–238.
Olson, SL (2009): A new diminutive species of shearwater of the genus Calonectris (Aves: Procellariidae) from the Middle Miocene Calvert Formation of Chesapeake Bay. Proceedings of the Biological Society of Washington 122, 466–470.
Olson, SL, Hearty, PJ (2003): Probable extirpation of a breeding colony of Short-tailed Albatross (Phoebastria albatrus) on Bermuda by Pleistocene sea-level rise. Proceedings of the National Academy of Sciences. 100 (22): 12825–12829.
Olson, SL, Rasmussen, PC (2001): Miocene and Pliocene birds from the Lee Creek Mine, North Carolina. Smithsonian Contributions to Paleobiology 90, 233–365.
Pan H, et al. (2019): High-coverage genomes to elucidate the evolution of penguins. Gigascience. 8(9):giz117.
Pelegrín, JS; Acosta Hospitaleche, C, (2022): Evolutionary and Biogeographical History of Penguins (Sphenisciformes): Review of the Dispersal Patterns and Adaptations in a Geologic and Paleoecological Context. Diversity 14, 255.
Penhallurick, J, Wink, M (2004): Analysis of the taxonomy and nomenclature of the Procellariiformes based on complete nucleotide sequences of the mitrochondrial cytochrome b gene, Emu 104, 125-147.
Piro, A (2022): Comparative morphology of the compound rhamphotheca of tubenosed seabirds (order Procellariiformes). Zoologischer Anzeiger. 299. 10.1016/j.jcz.2022.05.012.
Piro, A., Acosta Hospitaleche, C. (2019):Skull morphology and ontogenetic variation of the Southern Giant Petrel Macronectes giganteus (Aves: Procellariiformes). Polar Biol 42, 27–45.
Prum RO, et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing, Nature 526, 569-573.
Rains, D, Weimerskirch, H, Burg, TM (2011): Piecing together the global population puzzle of wandering albatrosses: genetic analysis of the Amsterdam albatross Diomedea amsterdamensis, J. Avian Biol. 42, 69-79.
Robertson, CJR, Nunn, GB (1998): Towards a new taxonomy for albatrosses, in “Albatross Biology and Conservation”, (G. Robertson and R. Gales, eds.), Surrey Beatty and Sons, Chipping Norton.
Rozadilla, S, et al. (2016): A new ornithopod (Dinosauria, Ornithischia) from the Upper Cretaceous of Antarctica and its palaeobiogeographical implications. Cretaceous Research 57:311-324
Sachs, G (2005): Minimum shear wind strength required for dynamic soaring of albatrosses. IBIS – international journal of avian science. 147, 1–10.
Sallaberry, M, Rubilar-Rogers, D, Suárez, ME, Gutstein, CS (2007): The skull of a fossil prion (Aves: Procellariiformes) from the Neogene (Late Miocene) of northern Chile. Revista Geológica de Chile 34, 147–154.
Sangster, G; Braun, EL; Johansson, US; Kimball, RT.; Mayr, G; Suh, A (2022): Phylogenetic definitions for 25 higher-level clade names of birds. Avian Research. 13: 100027
Sangster G, Mayr G (2021): Feraequornithes: a name for the clade formed by Procellariiformes, Sphenisciformes, Ciconiiformes, Suliformes, and Pelecaniformes (Aves), Vertebr. Zool. 71, 49-53.
Sausner J, Torres-Mura JC, Robertson J, and Hertel F (2016): Ecomorphological differences in foraging and pattering behavior among storm-petrels in the eastern Pacific Ocean, Auk 133, 397-414.
Seguí, Bartomeu; Qunitana, Josep; Fornós, Joan D. & Alcover, Josep Antoni (2001). “A new fulmarine petrel (Aves: Procellariiformes) from the upper Miocene of the western Mediterranean”. Palaeontology. 44 (5): 933–948.
Simpson, GG (1971): Review of Fossil Penguins from Seymour Island. Proceedings of the Royal Society B. 178 (1053): 357–387.
Simpson, GG (1979): A new genus of Late Tertiary penguin from Langebaanweg, South Africa. Annals of the South African Museum 78: 1–9.
Sivak, J; Howland, HC; McGill-Harelstad, P (1987): Vision of the Humboldt penguin (Spheniscus humboldti) in air and water. Proceedings of the Royal Society of London B. 229 (1257): 467–72.
Slack, KE, Jones, CM, Ando, T, Harrison, GL, Fordyce, RE, Arnason, U, Penny, D (2006): Early penguin fossils, plus mitochondrial genomes, calibrate avian evolution. Molecular Biology and Evolution 23, 1144–1155.
Storer RW (1956): The fossil loon, Colymboides minutus. The Condor. 58 (6): 413–426.
Stucchi, M, Urbina, M, Giraldo, A (2003): Una nueva especie de Spheniscidae del Mioceno Tardío de la Formación Pisco, Perú. Boletín del Instituto Francés de Estudios Andinos 32, 361–375.
Subramanian, S, Beans-Picón, G, Swaminathan, SK, Millar, CD, Lambert, DM (2013): Evidence for a recent origin of penguins. Biology Letters 9, 20130748.
Suh A, Smeds L, Ellegren H (2015), The dynamics of incomplete lineage sorting across the ancient adaptive radiation of Neoavian birds, PLoS Biology 13: e:1002224.
Švec, P. (1982): Two new species of diving birds from the Lower Miocene of Czechoslovakia. Časopis pro mineralogii a geologii. 27: 243–260.
Sydeman, W; Nurr, N; McLaren, E; McChesney, G (1998): Status and Trends of the Ashy Storm Petrel on Southeast Farallon Island, California, based upon capture-recapture analyses. Condor. 100 (3): 438–447.
Tambussi, CP, Acosta Hospitaleche, C (2007): Antarctic birds (Neornithes) during the Cretaceous-Eocene times. Revista de la Asociación Geológica Argentina 62, 604–617.
Tambussi, CP; Reguero, MA; Marenssi, SA; Santillana, SN (2005): Crossvallia unienwillia, a new Spheniscidae (Sphenisciformes, Aves) from the Late Paleocene of Antarctica. Geobios. 38 (5): 667–675
Tambussi, CP, et al. (2019): A stem anseriform from the early Palaeocene of Antarctica provides new key evidence in the early evolution of waterfowl. Zoological Journal of the Linnean Society
Thomas, DB, Fordyce, RE (2007): The heterothermic loophole exploited by penguins. Australian Journal of Zoology. 55 (5): 317–321.
Thomas, DB, Fordyce, RE (2012): Biological plasticity in penguin heat-retention structures. Anatomical Record. 295 (2): 249–256.
Thomas, DB, Ksepka, DT (2013): A history of shifting fortunes for African penguins. Zoological Journal of the Linnean Society 168, 207–219.
Thomas, DB, Ksepka, DT, Fordyce, RE (2010): Penguin heat-retention structures evolved in a greenhouse Earth. Biology Letters doi:10.1098/rsbl.2010.0993
van Tuinen, M, Hedges BS (2004): The effect of external and internal fossil calibrations on the avian evolutionary timescale. In: Journal of Paleontology 48,1, 45–50.
Walsh, SA, Suárez, ME (2006): New penguin remains from the Pliocene of Northern Chile. Historical Biology 18, 115–126.
Warheit, KI (1992): A review of the fossil seabirds from the Tertiary of the North Pacific: Plate tectonics, paleoceanography, and faunal change. Paleobiology 18, 401–424.
Warheit, KI (2002): The seabird fossil record and the role of paleontology in understanding seabird community structure. In: E.A. Schreiber & J. Burger (eds.), Biology of Marine Birds. Boca Raton, FL: CRC Marine Biology Series, pp. 17–55.
Weimerskirch, H et al. (2000): Fast and fuel efficient? Optimal use of wind by flying albatrosses. The Royal Society Proceedings B. Band 267, Nr. 1455
Welch, AJ, Olson, SL, Fleischer, RC (2014): Phylogenetic relationships of the extinct St Helena petrel, Pterodroma rupinarum Olson, 1975 (Procellariiformes: Procellariidae), based on ancient DNA, Zool. J. Linn. Soc. 170, 494-505.
Wetmore, A. (1940): Fossil bird remains from Tertiary deposits in the United States. Journal of Morphology. 66 (1): 25–37.
Wetmore, A. (1941): An unknown loon from the Miocene fossil beds of Maryland. Auk, 58567.
Wetmore, A. (1943): Fossil birds from the Tertiary depositsof Florida. Proc. New Engl. Zool. Club, 22:59-68, pl. 11-12, text-figs. J-2.
Williams, TD (1995): The Penguins – Spheniscidae. Oxford: Oxford University Press.
Wilson, JA (1975): Sweeping flight and soaring by albatrosses. Nature 257, 307–308,
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a): Loons (Gaviidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.gaviid1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b): Albatrosses (Diomedeidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.diomed1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c): Southern Storm-Petrels (Oceanitidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.oceani2.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d): Northern Storm-Petrels (Hydrobatidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.hydrob1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020e): Shearwaters and Petrels (Procellariidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.procel3.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020f): Penguins (Spheniscidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.spheni1.01
Wu S, et al (2024): Genomes, fossils, and the concurrent rise of modern birds and flowering plants in the Late Cretaceous, Proc. Natl. Acad. Sci. 121.
Yuri, T.; et al. (2013): Parsimony and model-based analyses of indels in avian nuclear genes reveal congruent and incongruent phylogenetic signals. Biology. 2 (1): 419–444.



