Text als pdf
Neognathae und Galloanserae
Die modernen Vögel – die Neornithes – werden in zwei Hauptkladen geteilt: die Palaeognathae und die Neognathae (Abb. 1). Ein wichtiger Unterschied liegt in der Anatomie der Gaumenstruktur. Zu den Palaeognathae zählen Steißhühner, Straße, Nandus, Emus, Kasuare und Kiwis, so wie die kürzlich ausgestorbenen Moas und Elefantenvögel. Wir haben sie in der letzten Episode kennengelernt. Die größte Vielfalt der modernen Vögel machen aber die Neognathae aus. Von den ca. 11.500 beschriebenen Vogelarten, die sich heute auf unseren Planeten tummeln, machen die Palaeognathae gerade mal 62 Arten aus, d. h. 99,5% der Vogelarten sind Neognathae. Letztere lassen sich dann weiter in zwei Hauptladen einteilen: die Galloanserae und die Neoaves (Abb. 1). Auch hier gibt es ein Ungleichgewicht der Artenvielfalt. Zu den Galloanserae gehören die Enten- und Hühnervögel (Anseriformes + Galliformes), also jenen Vogelgruppen, die für uns Menschen am wichtigsten sind – zumindest in Bezug zur Nahrungsmittelproduktion. Aber die Galloanserae machen weniger als 500 Arten aus, also etwa 4% aller Vogelarten. Aber diese Gruppe ist die phylogenetisch älteste innerhalb der Neognathae und zeichnet sich durch einen reichhaltigen Fossilbericht aus, der mit Gattungen wie Vegavis auch bis in die Kreidezeit zurückreicht (Clarke et al. 2005, Agnolin et al. 2017, Abb. 2).
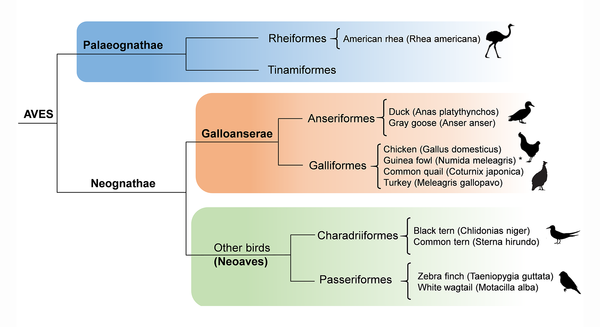
Abb. 1: Stammbaum der Neornithes bzw. Aves.

Abb. 2: der kreidezeitliche Vegavis.
Die wichtigsten Apomorphien der Galloanserae beziehen sich auf die Spezialisierung des Schädels und der Kiefern und umfassen die Basipterygoid-Fortsätze, die eiförmig sind, anstatt gestielt oder fehlend wie bei anderen modernen Vögeln, sowie einen mit zwei Gelenkköpfen (bikondylären) versehenen mandibulären Fortsatz des Quadratums (dieser Fortsatz hat bei den meisten anderen Neognathae drei Gelenkköpfe; trikondylär). Darüber hinaus besitzen die meisten Galloanserae verlängerte Fortsätze am Unterkiefer, die die Hebelwirkung der Kiefermuskeln erhöhen. Ein weiteres Merkmal, welches die Galloanserae, aber auch die Palaeognathae haben, ist das Vorhandensein eines Phallus bei den Männchen. Eine solche penisartige Struktur fehlt bei allen Neoaves oder wird durch nicht-homologe Organe gebildet (Auflistung dieser und weitere Synapomorphien der Galloanserae siehe: Kuo et al. 2023, Mayr 2017, Mayr & Clarke 2003, Ericson et al. 2001, Cracraft 1981, 1988, Dzerzhinsky 1995, Livezey 1997, Livezey & Zusi 2007, Sangster et al. 2022, Herrera et al. 2013; Abb. 3 und 4).
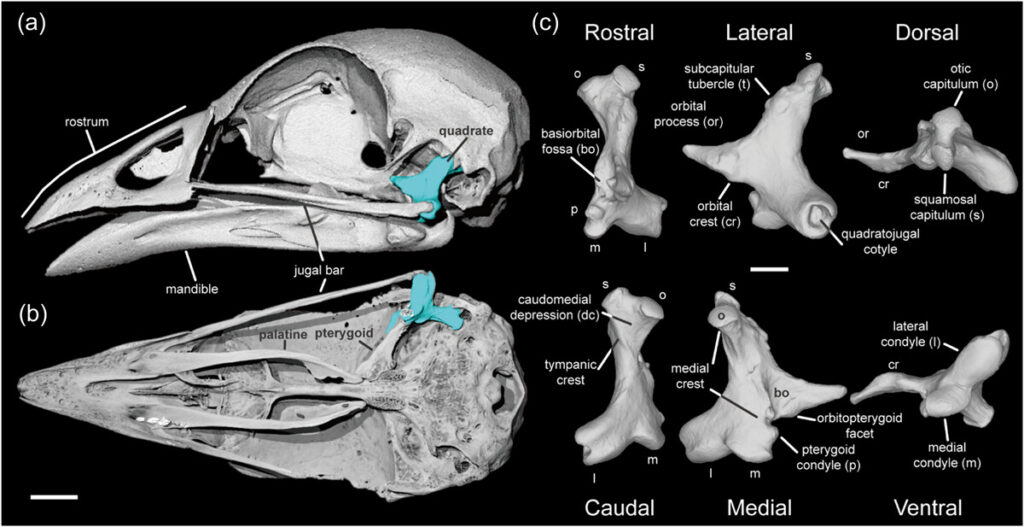
Abb. 3: Der Schädel des Australbuschhuhns (Alectura lathami) in lateraler (a) und ventraler Ansicht (b), und sein Quadratum in rostraler, lateral-dorsaler, kaudaler, medialer und ventraler Ansicht (c). Das Quadratum ist in (a) und (b) hellblau hervorgehoben. Maßstabsbalken in (a) und (b): 5 mm, und in (c): 2,5 mm. Aus Kuo et al. (2023).
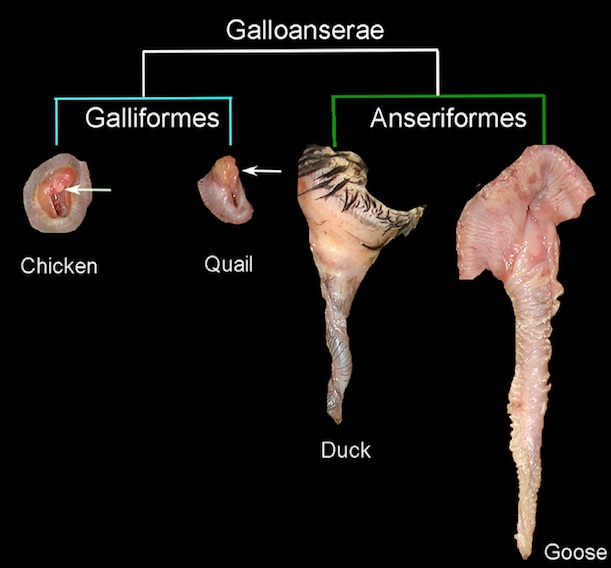
Abb. 4: Anatomische Präparate erwachsener männlicher äußerer Genitalien bei zwei Anseriformes (Gans und Ente) und zwei Galliformes (Huhn und Wachtel). Die Pfeile zeigen auf die reduzierten Phallusse bei den galliformen Arten. Maßstabsbalken entsprechen 1 cm.
Für eine Reihe von ausgestorbenen Gruppen wurde eine Verwandtschaft mit Galloanserae vorgeschlagen. Wenn diese korrekt identifiziert wurden, war die ökologische und morphologische Vielfalt der Galloanserae bemerkenswert und umfasste große flugunfähige Arten mit stark reduzierten Flügeln und extrem langflügelige Arten, die zum Segelflug in der Lage waren.
Galliformes
Die Ordnung der Hühnervögel, Galliformes, umfasst 5 heute lebende Familien; sie sind die Kronengruppe der Galliformes: Die Großfußhühner (Megapodiidae) mit 21 Arten, die hauptsächlich in Australien, Neuguinea und einigen Inseln der Südsee und Indonesiens vorkommen, die Hokkos (Cracidae) aus Mittel- und Südamerika mit 56 Arten, die Fasanenartigen (Phasianidae) mit 186-193 Arten, die in Europa, Nord- und Mittelamerika, Asien, Australien und Afrika vorkommen, die afrikanischen Perlhühner (Numididae) mit 6 Arten und die Zahnwachteln (Odontophoridae) mit 33 (oder 34) Arten, von denen zwei in Zentralafrika und die restlichen in Nord- und Südamerika vorkommen. Fasanenartige, Perlhühner und Zahnwachteln werden auch als Phasianoidea zusammengefasst (Crowe et al. 2006a, b, Cox et al. 2007, Hackett et al. 2008, Meiklejohn et al. 2014, Kaiser et al. 2007, Kriegs et al. 2007, Kimball et al. 2011, 2021, Shen et al. 2010, Abb. 5).
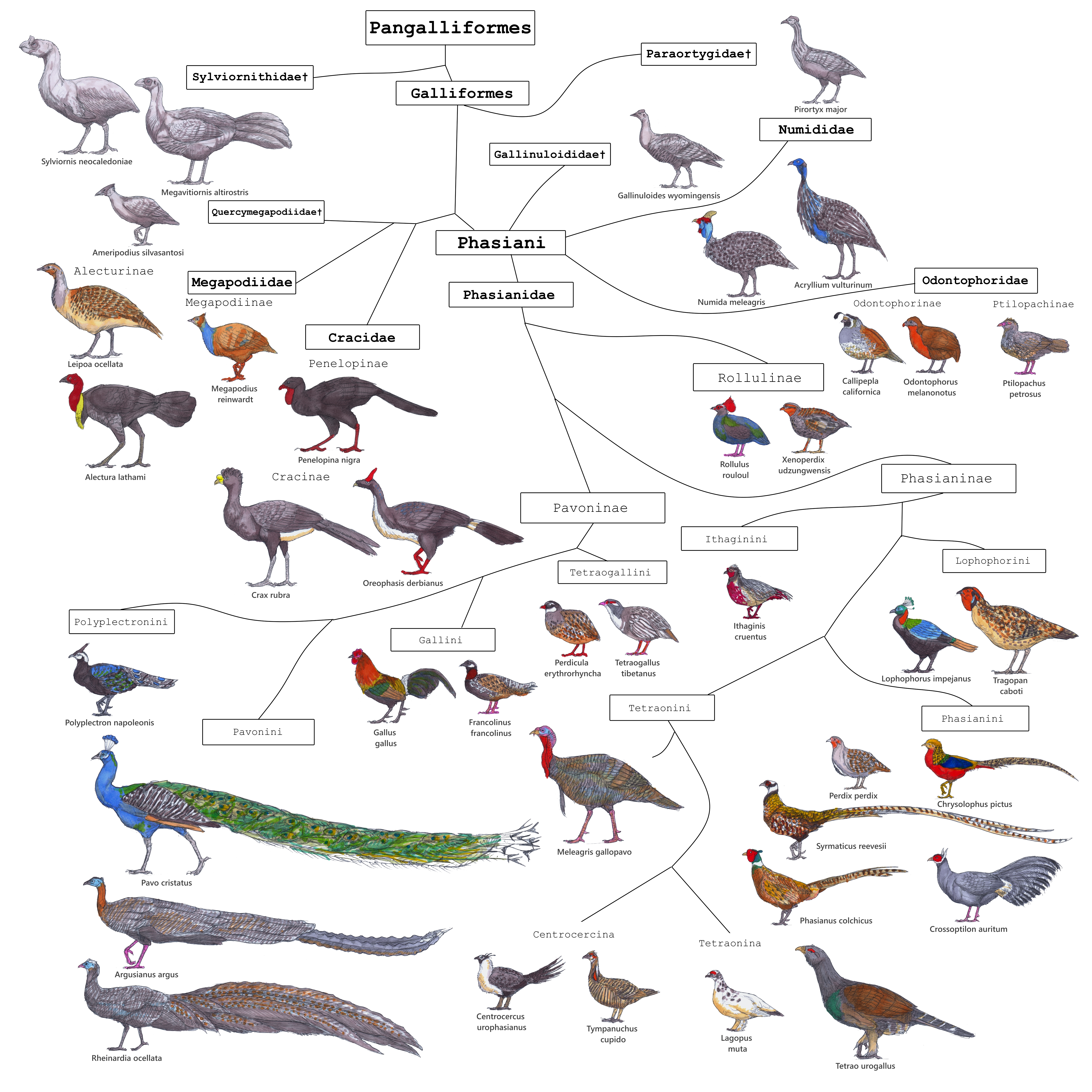
Abb. 5: Galliformes
Hühnervögel sind meist pflanzenfressende Vögel, die eine Reihe von Lebensräumen bewohnen. Sie sind aber vergleichsweise schlechte Flieger, weshalb nur wenige Arten, meistens Vertreter der Großfußhühner, abgelegene ozeanische Inseln erreicht haben. Hühnervögel sind aber nicht automatisch schwache Flieger, denn einige Mitglieder der Fasanenartigen können kräftige Flügelschläge absolvieren.
Stammgruppen der Galliformes
Die ausgestorbenen Vertreter der Hühnervögel umfassen eine Reihe weiterer Formen, die meist zu den Stammgruppen der Galliformes gezählt werden (Abb. 5). Hierzu zählen die nordamerikanische Gattung Gallinuloides (Abb. 6) und die europäische Gattung Paraortygoides (Abb. 7) aus dem Eozän bis Oligozän. Sie gehören zu den phylogenetisch urtümlichsten Vertretern der Galliformes und werden in die Familie der Gallinuloididae eingegliedert (Mayr 2009, Mayr & Weidig 2004, Mayr 2006). Ihre Oberarmknochen ähneln von den Proportionen her eher denen der Entenvögel. Wie bei anderen Stammgruppen innerhalb der Galliformes weist das Rabenbein (Coracoid) eine plesiomorphe, schalenartige Gelenkfacette am Schulterblatt auf. Das Gabelbein (Furcula) ist robust und das Brustbeinkiel reicht weiter zum Schädel hin (kranial). Bei modernen Hühnervögeln ist das Gabelbein hingegen schlanker und die Spitze des Brustbeinkiels ist weiter Richtung Schwanz (caudal) verlagert (Abb. 8). Diese Umgestaltung bei modernen Hühnervögeln ist eine Folge des großen Kropfes dieser Vögel, der zur Speicherung und Verarbeitung schwer verdaulicher Nahrung dient (Stegmann 1964). Bei den Gallinuloididae deuten diese Merkmale darauf hin, dass diese keinen großen Kropf hatten (Mayr 2006). Außerdem nutzen sie keine Magensteine, was zeigt, dass sie sich im Gegensatz zu den modernen Hühnervögeln nicht von Samen oder groben Pflanzenstoffen ernährten. Sie waren wahrscheinlich Allesfresser und ernährten sich von Wirbellosen und Früchten und, wie die Struktur ihrer Füße zeigt, war zumindest Paraortygoides wahrscheinlich ein waldbewohnender Vogel.
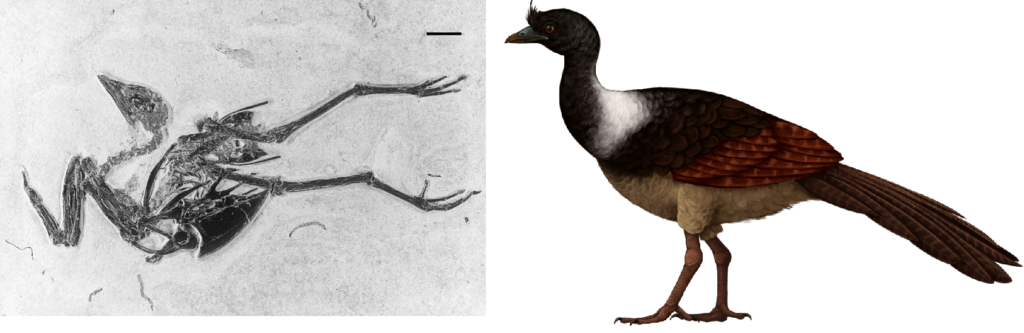
Abb. 6: Gallinuloides

Abb. 7: Paraortygoides
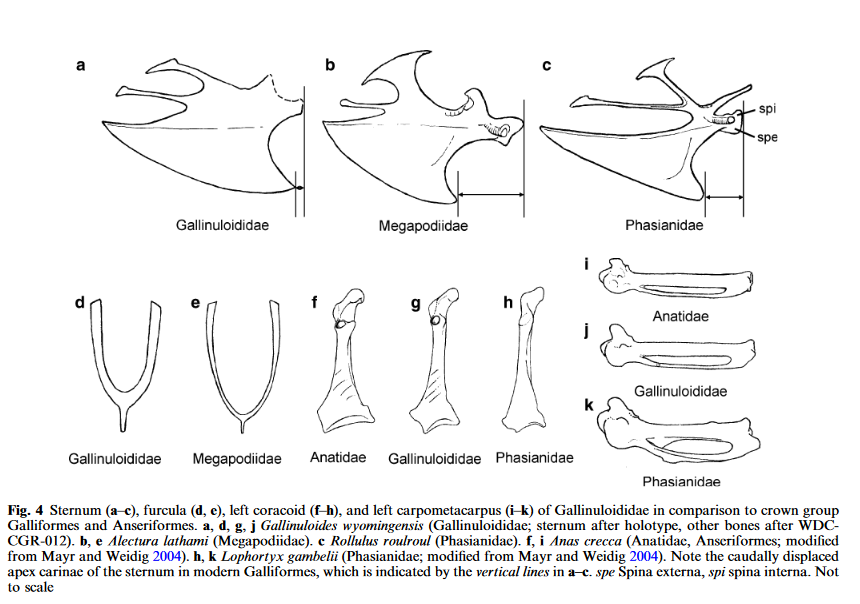
Abb. 8: Sternum (a-c), Furcula (d, e), linkes Coracoid (f-h) und linkes Carpometacarpus (i-k) der Gallinuloididae im Vergleich zur Kronengruppe der Galliformes und Anseriformes. a, d, g, j Gallinuloides wyomingensis (Gallinuloididae; Sternum nach Holotyp, andere Knochen nach WDC-CGR-012). b, e Alectura lathami (Megapodiidae). c Rollulus roulroul (Phasianidae). f, i Anas crecca (Anatidae, Anseriformes; verändert nach Mayr & Weidig 2004). h, k Lophortyx gambelii (Phasianidae; verändert nach Mayr & Weidig 2004). Man beachte die nach kaudal verschobenen Apexcarinae des Sternums bei modernen Galliformes, die durch die vertikalen Linien in a-c angedeutet sind. spe Spina externa, spi spina interna. Nicht maßstabsgetreu
Ein weiteres markantes Taxon der Stammgruppe sind die Quercymegapodiidae, die im späten Eozän und frühen Miozän von Frankreich und dem späten Oligozän oder frühen Miozän Brasiliens vorkommen (z. B. Quercymegapodius, Taubacrex, Ameripodius; Mourer-Chauviré 1992, 2000, Mayr 2009, Abb. 9). Bei dieser Gruppe wurden Magensteine gefunden, woraus zu schließen ist, dass sie sich von groben Pflanzenmaterial und Samen ernährten. Außerdem zeigen weitere Merkmale des Skeletts, z. B. des Oberarmknochens (Humerus), dass sie enger mit modernen Hühnervögeln verwandt sind als die Paraortygidae (Mourer-Chauviré 1992, Mayr 2009). Ihr Carpometacarpus ist aber viel schmaler, was darauf hindeutet, dass sie sich in ihren Flugeigenschaften von den heute lebenden Hühnervögeln unterschieden. Das Vorkommen im damals geographisch isolierten Südamerika entspricht der Tatsache, dass sie zu Langstreckenflügen in der Lage waren.

Abb. 9: Quercymegapodiidae
Außerhalb Europas und Nordamerikas wurden Stammgruppen der Galliformes aus dem frühen Eozän der Mongolei, dem mittleren Eozän von Namibia (Namaortyx, Scopelortyx) und dem frühen oder mittleren Eozän von Tunesien (Chambiortyx; Hwang et al. 2010, Mourer-Chauviré et al. 2011, 2013, 2015) gemeldet. Bei all diesen Fossilien handelt es sich um kleine bis sehr kleine Arten (Abb. 10).
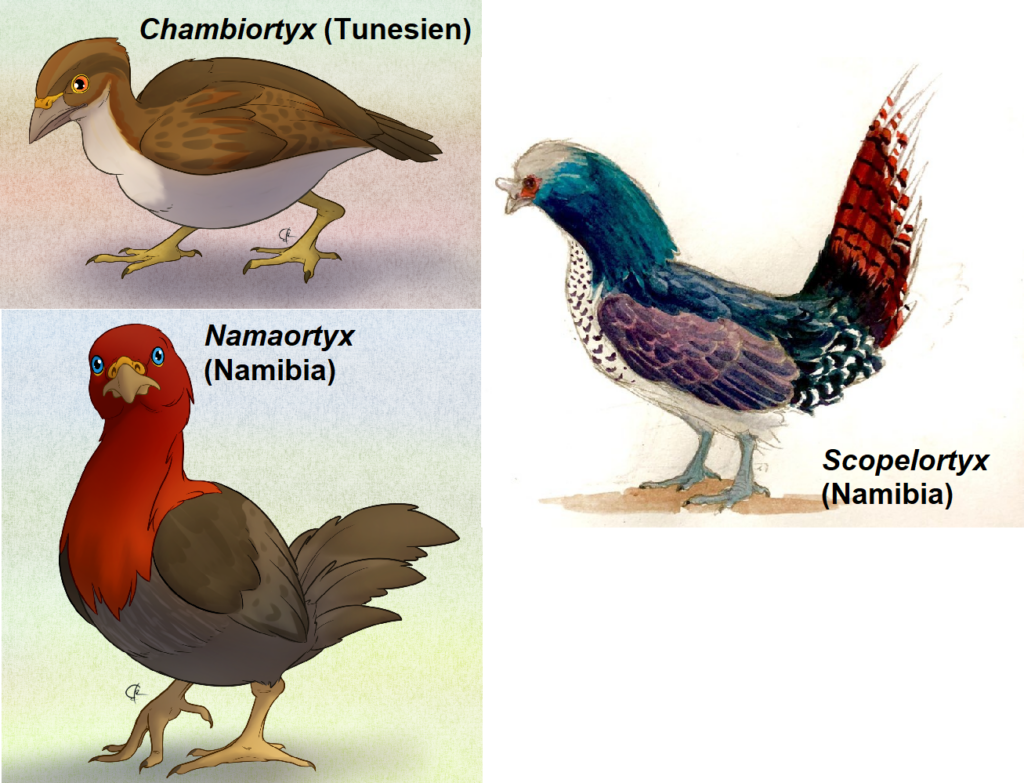
Abb. 10: eozäne Galliformes aus Afrika
Großfußhühner (Megapodiidae)
Die Großfußhühner (Megapodiidae) gelten als die basalste Kronengruppe der Galliformes und sind heute hauptsächlich auf den australasiatischen Raum beschränkt (Harris et al. 2014, Birks & Edwards 2002; del Hoyo 2020, Winkler et al. 2020a; Abb. 12). Diese allesfressenden Vögel sind am besten für ihre Brutbiologie bekannt, wobei die Bebrütung der Eier auf die Nutzung externer Wärmequellen zurückzuführen ist.
Namensgebend sind die vergrößerten Zehen. Da sie im Zusammenhang mit dem Brutverhalten zum Graben und zum Aufschütten von Nisthügeln gebraucht werden, ist die Größe von Vorteil. Im Zusammenhang mit dem Brutverhalten steht auch der Schnabel, der hühnertypisch kurz und unspezialisiert wirkt, aber mit einem empfindlichen Temperatursinn ausgestattet ist, mit dem die Temperatur des Nisthügels kontrolliert wird. Ihre Größe reicht von 28 bis 70 cm, das Gewicht von 500 bis 2450 g. Kleinster Vertreter der Familie ist das Lapérousehuhn (Megapodius laperouse), am größten ist das Buschhuhn (Alectura lathami). Ein Geschlechtsdimorphismus ist kaum vorhanden, die Männchen sind aber etwas größer. Die Flügel der Großfußhühner sind groß und gerundet. Sie ermöglichen einen Flug über kurze Distanzen. Meistens wird die Flugfähigkeit nur bei Gefahr genutzt. Alle Arten bis auf zwei Ausnahmen kommen östlich der Wallace-Linie vor, einer biogeographischen Barriere in Indonesien, die zwischen Borneo und Sulawesi verläuft (Abb. 11; del Hoyo 2020, Winkler et al. 2020a, Dekker 1989, 2007, Wallace 1869, 1876, Mayr 1944, de Lattin 1967, Simpson 1977, Hantoro et al. 1995, Cox 2001, Ali & Heaney 2021, Rueda et al. 2013). Die indonesische Inselwelt östlich dieser Wallace-Linie wird in Bezug zur Verbreitung der Fauna zur Australischen Region gerechnet. Manchmal wird die Inselwelt zwischen der Wallace-Linie und Neuguinea als eigene Tiergeographische Region gerechnet. Westlich der Wallace-Linie lebt das Philippinen-Großfußhuhn (Megapodius cumingii) und das Nikobaren-Großfußhuhn (Megapodius nicobariensis).
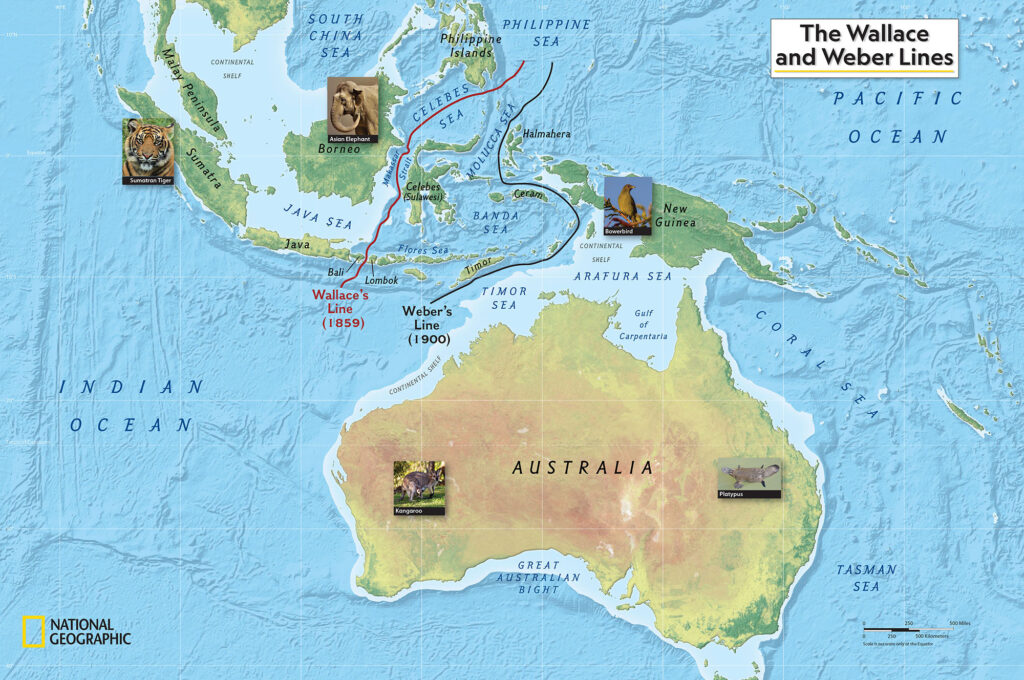
Abb. 11: Wallace-Linie
Großfußhühner sind Allesfresser. Zu ihrer pflanzlichen Nahrung zählen Samen, Knospen, Blüten, Blätter und Früchte; an Tieren werden Insekten, Spinnen, Tausendfüßer, Würmer und Schnecken gefressen. Da Großfußhühner ihre Brut nicht durch ihre Körpertemperatur wärmen, bauen sie Bruthügel oder vergraben ihre Eier (Birks & Edwards 2002, Dekker 1989, 2007, Harris et al. 2014). Daneben kommen die Nutzung der Wärme vulkanischer Erde, der Sonnenhitze und der bei der Verrottung von Baumwurzeln produzierten Wärme vor. Außerdem kommt auch Brutparasitismus vor. Großfußhühner haben extrem große Gelege, beim Buschhuhn werden bis zu 30 Eier gelegt. Die Eiablage kann über einen Zeitraum von mehreren Monaten erfolgen. Die Eier machen 10 – 20 Prozent des Körpergewichtes des Weibchens aus, der Dotteranteil liegt bei über 50%. Die Schale der Eier ist sehr dünn – nämlich um 31 % dünner als bei einem Ei eines anderen Hühnervogels. Dies hat zwei Gründe: Zum einen wird durch die dünne Schale die Sauerstoffversorgung des Inneren erleichtert, so dass auch die wenige Luft, die unter der Erde ankommt, ausreichend ist; zum anderen wird dem Jungen das Aufsprengen der Schale erleichtert, da es keinen Eizahn hat – genau genommen bildet sich beim Embryo zunächst ein Eizahn, der sich aber im entscheidenden Moment des Schlüpfens schon wieder zurückgebildet hat (Clark 1960, 1964). Die Schale wird daher durch Treten mit den Füßen aufgesprengt – hierbei kommt die geringe Dicke der Schale zugute. Junge Großfußhühner sind beim Schlüpfen weiterentwickelt als alle anderen Vögel – ein Resultat des hohen Dotteranteils der Eier und der langen Bebrütungszeit. Das geschlüpfte Großfußhuhn hat kein Daunenkleid und ist vom ersten Tag an fähig, zu fliegen und seine Körpertemperatur zu regeln. Eine Brutpflege findet nun nicht mehr statt. Begegnet das Junge den Elternvögeln am Hügel, nehmen diese keine Notiz von ihm oder scheuchen es davon. Es ist somit sofort ganz auf sich gestellt.
Forschungsgegenstand ist auch, wie sich dieses Brutverhalten evolutiv entwickelt hat, zumal das Verhalten eher an Krokodile oder andere Reptilien erinnert. Daher ging man ursprünglich davon aus, dass Großfußhühner sehr ursprüngliche Vögel sind (Portmann 1938). Dies gilt jedoch als widerlegt, da die Existenz eines Eizahns eine für moderne Vögel typisches Stadium der Embryonalentwicklung ist. Die Ähnlichkeiten zum Brutverhalten von Reptilien sind in konvergenter Evolution entstanden. Unklar ist jedoch, welche der verschiedenen Brutmethoden der Großfußhühner die phylogenetisch ältere ist, so gibt es z. B. keine taxonomische Trennung zwischen Hügelbauern und Vergrabern. Das Vergraben scheint die einfachere Methode zu sein, so dass Ornithologen am Beginn des 20. Jahrhunderts vermutet haben, es müsse die ältere sein. Dem widersprachen andere, weil ein bewachter Bruthügel ein Übergang zwischen dem typischen Vogelnest und einem Loch in der Erde, das nach dem Ablegen der Eier verlassen wird, sei (Clark 1960). Neue phylogenetische Untersuchungen zeigen, dass die niedrigsten Äste im Kladogramm der Großfußhühner alle zu Hügelbauern führen und erst die jüngsten Zweige zu Gräbern.
Unbeantwortet bleibt allerdings die Frage, warum die Methode des Hügelbaus entwickelt wurde. Zwar sparen sich die Großfußhühner das Brüten und die Jungenaufzucht, doch der Bau eines Bruthügels und dessen Pflege ist eine enorme Kraftanstrengung, die den Aufwand einer herkömmlichen Vogelbrut noch übertreffen dürfte. Ein männliches Thermometerhuhn ist beispielsweise elf Monate am Stück mit dem Bau und der fortwährenden Wartung seines Bruthügels beschäftigt. Begünstigt wurde die Entwicklung des Verhaltens wohl durch das weitgehende Fehlen karnivorer Säugetiere in ihrem Verbreitungsgebiet (Dekker 1989).
Die älteste bekannte Gattung der Großfußhühner ist Ngawupodius (Abb. 13) aus dem späten Oligozän Australiens, der nur zwei Drittel der Größe der kleinsten heute lebenden Art erreichte (Dekker 2007, Boles & Ivison 1999). Ansonsten beschränken sich die Fossilien der Großfußhühner auf das Quartär Australiens und Ozeaniens und umfassen bis auf wenige Ausnahmen ausgestorbene Arten der heute lebenden Gattungen (Boles 2008).
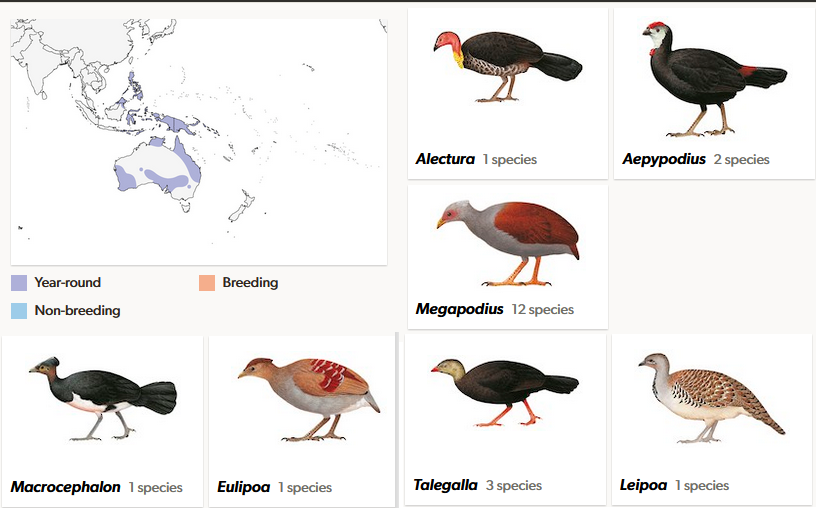
Abb. 12: Gattungen und Verbreitung der Großfußhühner

Abb. 13: Ngawupodius
Hokkos, Zahnwachteln und Perlhühner
Hokkos (Cracidae)
Hokkos kommen nur in den Tropen Süd- und Mittelamerikas vor (Cracidae, Abb. 14; Pereira et al. 2002, 2009, Pereira & Baker 2004, Kimball et al. 2011, Frank-Hoeflich et al. 2006, Grau et al. 2005, Gastañaga et al. 2011, Donegan 2012, 2015, del Hoyo 2020, Winkler et al. 2020b). Sie haben einen plumpen Körper, einen langen Hals, einen kleinen Kopf und kräftige Füße. Die Körperlänge schwankt zwischen 42 cm (Gelbbrauenguan, Ortalis superciliaris) und 95 cm (Hornhokko, Pauxi unicornis). Das Gewicht liegt zwischen 385 g und 4,8 kg. Das Gefieder ist unscheinbar, wenn auch bei einzelnen Arten glänzende Partien vorhanden sind. Ein in dieser Familie häufiges Phänomen ist Polymorphismus, das heißt, Angehörige ein und derselben Art können vollkommen unterschiedlich aussehen. Ein Beispiel hierfür ist der Helmhokko. Die meisten Weibchen sind schwarz mit einer weißen Unterseite. Es gibt bei den Weibchen dieser Art jedoch auch eine dunkelbraune Morphe mit hellbrauner Streifung. Die Hokkos ernähren sich ausschließlich pflanzlich und sind tagaktiv. Sie gelten als gesellige Vögel.
Traditionell werden Hokkohühner in zwei Unterfamilien geteilt, die „echten“ Hokkos (Cracinae) sowie die Schakuhühner und Chakalakas (Penelopinae). Die Unterschiede zwischen diesen Gruppen sind deutlich: Echte Hokkos sind größer, haben einen kräftigeren Schnabel und ein proportional größeres Becken. Zudem sind sie nicht so extreme Baumbewohner wie die Schakuhühner und Chakalakas. Molekulare Untersuchungen haben dieses Bild etwas differenziert. Die echten Hokkos sind zwar eine monphyletsche Gruppe, aber die ursprünglich zu den Penelopinae zählenden Gattungen Ortalis und Oreophasis stehen den echten Hokkos näher als den Penelopinae. Die „echten“ Hokkos fliegen selten und nur kurze Strecken; Schakuhühner und Chakalakas nutzen die Flugfähigkeit dagegen etwas häufiger. In der Regel sind viele kräftige Flügelschläge von einer Gleitphase gefolgt. Eine Eigentümlichkeit der Schakuhühner ist das „Trommeln“ mit den Flügeln, das vor allem während der Balz erklingt. Mit den Großfußhühnern teilen sie einige Gemeinsamkeiten, die Hinterzehe ist auf gleicher Höhe wie die Vorderzehen und es gibt biochemische Gemeinsamkeiten mit den Eiern sowie genetische Ähnlichkeiten (Laskowski & Fitch 1989, Sibley et al. 1988, Chen 2021, Winkler et al. 2015). Die frühesten Fossilien sind fragmentarische Überreste aus dem frühen Miozän von Florida (Olson 1985, Mayr 2009). Der spätere Fossilnachweis von Hokkos ist ebenfalls sehr spärlich und sagt wenig über die Entwicklungsgeschichte dieser Vögel aus.
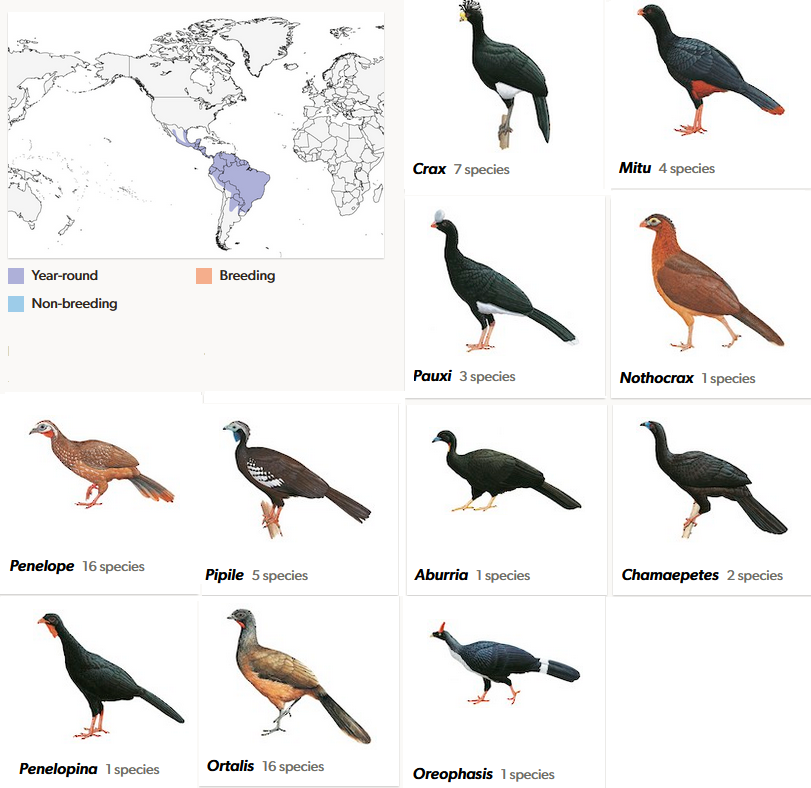
Abb. 14: Hokkos. Die Gattungen Crax, Mitu, Pauxi und Nothocrax zählen zu den „echten Hokkos“ (Unterfamilie Cracinae). Die Gattungen Penelope, Pipile, Aburria, Chamaepetes und Penelopina zur Unterfamilie Penelopinae. Ortalis und Oreophasis wurden früher zur Unterfamilie Penelopinae gestellt, sind aber mit den Cracinae näher verwandt und werden in eigene Unterfamilien gestellt (Unterfamilien Ortalisinae und Oreophasinae).
Zahnwachteln (Odontophoridae)
Die Zahnwachteln (Odontophoridae; Abb. 14; Crowe et al. 2006a, Cohen et al. 2012, Hosner et al. 2015, del Hoyo 2020, Winkler et al. 2020c) kommen hauptsächlich auf dem amerikanischen Doppelkontinent vor, wobei es auch zwei Arten in Zentralafrika (Ptilopachus petrosus, P. nahani) gibt. Namengebend ist der leicht gezähnte Schnabel, ein Merkmal, das nur aus großer Nähe erkannt werden kann. Bekannte fossile Gattungen, die den Zahnwachteln zugeordnet werden sind Miortyx (Miller 1944, Ducey 2012, Abb. 16), Nanortyx (Weigel 1963) und Neortyx (Holman 1961). Die rezente Gattung Cyrtonyx ist fossil bereits aus dem Miozän belegt, die Gattungen Callipepla und Colinus aus dem Pliozän.
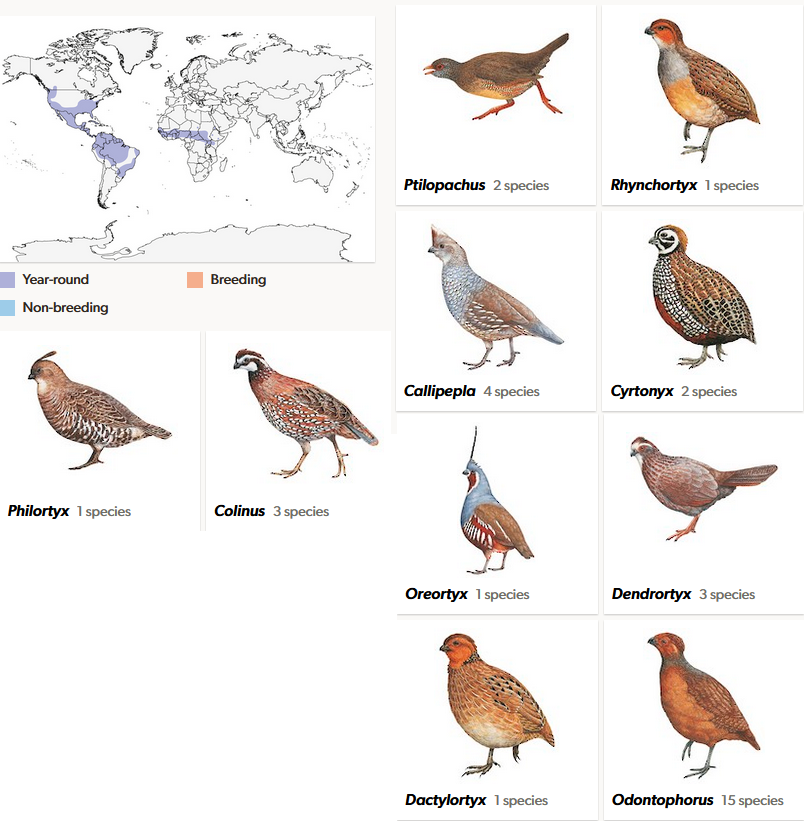
Abb. 15: Zahnwachteln. Ptilopachus kommt in Afrika vor. Die anderen Gattungen kommen in Nord- Mittel und Südamerika vor mit einem Verbreitungsschwerpunkt in der Neotropis.

Abb. 16: Miortyx
Perlhühner (Numididae)
Die sechs bis acht Arten der Perlhühner (Numididae; del Hoyo 2020, Winkler et al. 2020d, Chen 2021, Crowe 2006a, b, Kimball et al. 2011; Abb. 17) kommen nur in Afrika vor. Die bekannteste Art, das Helmperlhuhn (Numida meleagris), wurde auch vom Menschen domestiziert. Ihr Aussehen ist typisch für Hühner, namensgebend sind die weißen Punkte am Gefieder der meisten Arten. Dieses Muster fehlt bei der Gattung Agelastes. Kopf und Hals sind immer unbefiedert, die nackte Haut dieser Partien ist oft sehr farbenfroh und kann mit Kehlsäcken, Warzen, Knochenkämmen oder Schöpfen besetzt sein. Je nach Art sind Perlhühner in sehr unterschiedlichen Habitaten heimisch. Die zwei Arten der Gattung Agelastes und die meisten Arten der Gattung Guttera bewohnen Regenwälder. Das Helmperlhuhn kommt nur in der Savanne vor und das Geierperlhuhn (Acryllium vulturinum) bevorzugt aride Gebiete. Die heute afrikanischen Perlhühner sind fossil durch Telecrex (Olson 1974, Mlikovsky 1986; Abb. 18) aus dem Eozän der Mongolei und Frankreich belegt.

Abb. 17: Perlhühner

Abb. 18: Telecrex
Fasanenartige (Phasianidae)
Das artenreichste Taxon der Hühnervögel, die Fasanenartigen (Phasianidae), sind die evolutionär erfolgreichste und in vielen Lebensräumen zu finden – von der Halbwüste bis zum Regenwald (Wang et al. 2013, zur teilweise widersprüchlichen taxonomischen Gliederung innerhalb der Phasianidae siehe: Bao et al. 2010, Bonilla et al. 2010, Crowe et al. 2006a, b, Chen et al. 2021, Kan et al. 2010, Kimball & Braun 2008, Kimball et al. 1999, 2011, 2014, 2021, Kriegs et al. 2007, Liu et al. 2012, Meng et al. 2008, Shen et al. 2010, del Hoyo 2020, Winkler et al. 2020e).
In ihrer Morphologie und ihrem Verhalten sind die Mitglieder der Fasanenartigen sehr verschieden, doch übereinstimmende Skelettmerkmale weisen sie als zusammengehörige Gruppe aus. Es sind sämtlich bodenbewohnende Vögel mit plumpem Körper, kurzem Schnabel und kurzem Hals. Meistens sind auch Flügel und Schwanz sehr kurz, hier gibt es jedoch bemerkenswerte Ausnahmen wie einige Fasane und vor allem die Pfauen. Alle Fasanenartigen sind flugfähig. Meistens werden fliegend aber nur kurze Strecken zurückgelegt. Ein gemeinsames Merkmal aller Fasanenartigen sind die Sporne der Männchen, der am Tarsometatarsus ansetzt (Abb. 19). Dieses Merkmal teilen Fasanenartige mit den Perlhühnern. Für gewöhnlich gibt es einen Sporn je Bein, bei einigen Arten jedoch auch mehr. Bei den Spornhühnern (Galloperdix) haben auch die Weibchen einen Sporn. Der Sporn kann als Waffe im Kampf mit rivalisierenden Männchen eingesetzt werden, spielt aber wohl auch bei der Balz als Merkmal, das die Entscheidung eines Weibchens begünstigt, eine Rolle. Viele Fasanenartige tragen auffällige Ornamente wie Hauben, Kehlsäcke und nackte Gesichtshaut. Ein Geschlechtsdimorphismus existiert nicht bei allen Arten, wenn er aber auftritt, ist er oft spektakulär. Die Weibchen tragen dann vorwiegend graue und braune Farben, die Männchen leuchtende Farben. Für gewöhnlich sind Männchen zumindest etwas, manchmal bedeutend größer als Weibchen. Bei den Wachteln (Coturnix) kehrt sich das Verhältnis um, hier sind die Weibchen etwas größer.

Abb. 19: Sporn bei einem Hahn.
Die frühesten Fossilien, die unbestreitbar zu den Fasanenartigen gerechnet werden, gehören zu Palaeortyx aus dem frühen Oligozän bis zum frühen Pliozän Europas (Mourer-Chauviré 1992, 2003, Göhlich & Mourer-Chauviré 2005, Göhlich & Pavia 2008, Mayr et al. 2006, Abb. 20). Palaeortyx ist das erste galliforme Taxon mit einem intermetakarpalen Fortsatz des Carpometacarpus, der ein abgeleitetes Merkmal der Zahnwachteln und Fasanenartigen ist. Die Erhaltung von Gastrolithen in einem Skelett belegt eine ähnliche Ernährung wie bei den heutigen Fasanenartigen (Mayr et al. 2006).

Abb. 20: Palaeortyx
Weitere ähnliche Gattungen sind Palaeocryptonyx aus dem Miozän bis Pleistozän Europas und Tologuica aus dem mittleren Miozän der Mongolei (Pavia et al. 2012, Zelenkov & Kurochkin 2009a). Eine weitere Gattung ist Miogallus aus dem Miozän Europas (Mlíkovský 2002). Der Tarsometatarsus der Männchen von Miogallus weist einen ausgeprägten Sporn auf, der sich anscheinend mehrmals unabhängig voneinander innerhalb der Fasananartigen entwickelt hat, z. B. bei den Pfauen (Pavoninae) und den echten Fasanen (Phasianinae). Große Fasanenartige sind auch aus dem mittleren Miozän der Mongolei und Chinas bekannt (z. B. Linquornis, Lophogallus; Zelenkov & Kurochkin 2010).
Echte Pfaue (Abb. 21), die wohl bekanntesten Fasanenartigen, haben eine disjunkte Verbreitung: Die Gattung Pavo, zu der der Blaue Pfau (P. cristatus), aber auch der weniger bekannte Ährenträgerpfau oder Grüne Pfau (P. muticus) gehören, kommt in Südasien vor und Afropavo, zu denen der Kongopfau gehört, im tropischen Afrika (Kimball et al. 2021). Es ist daher bemerkenswert, dass fossile Arten, die Pavo zugeordnet werden, im späten Miozän bis Pliozän in Frankreich und Südosteuropa, sowie im frühen Pliozän von Afrika vorkommen (Mourer-Chauviré 1989, Boev 2002, Louchart 2003, Pickford et al. 2004).

Abb. 21: Gattungsgruppe der Pfaue (Pavonini), von denen nur Afropavo in Zentralafrika vorkommt, die anderen im tropischen Asien.
Die meisten existierenden afrikanischen Fasanenartigen gehören zu den sog. Frankolinen. Zur Gattung der Frankoline (Pternistis, Mandiwana-Neudani et al. 2014; Abb. 22) zählen 23 Arten, die den gesamten afrikanischen Kontinent bewohnen. Auch einige andere kleinere afrikanische Gattungen werden als Frankoline (Ortygornis, Campocolinus, Scleroptila, Peliperdix del Hoyo 2020, Winkler et al. 2020e; Abb. 22) bezeichnet, sind aber nur entfernt mit ihnen verwandt. Des Weiteren leben unter den Fasanenartigen neben den Frankolinen und dem Kongopfau einige Wachtelarten (Gattung Cortunix, Ammoperdix und Synocius, Abb. 24) auf dem afrikanischen Kontinent. Besonders erwähnenswert sind die Udzungwawachtel und Rubehowachtel (Gattung Xenoperdix, Abb. 22), die 1994 beschrieben wurden und nur einige abgelegene Bergregionen in Tansania bewohnen (Bowie & Fjeldsa 2005, Dinesen et al. 1994). In Madagaskar kommt die Perlwachtel (Margaroperdix madagarensis, Abb. 22) vor. Allerdings zeigen Fossilien aus dem frühen Miozän von Namibia, die einigen asiatischen Fasanenartigen ähneln, dass die frühere Vielfalt der afrikanischen Fasanenartigen größer war (Mourer-Chauviré 2003).

Abb. 22: Gattungen der Fasanenartigen, die es nur in Afrika gibt. Von der Gattung Xenoperdix werden mittlerweile zwei Arten anerkannt. Siehe auch Abb. 24 und 21 für weitere Gattungen, die nur oder auch in Afrika vorkommen.
In Asien wurden die Fasanenartigen im mittleren und späten Miozän diversifiziert (Zelenkov & Kurochkin 2009b, 2010), aber die genaue Verwandtschaft dieser Fossilien zu den gleichaltrigen Fossilien aus Europa und zu den heute lebenden Taxa sind schwer zu klären. Im tropischen Asien kommen eine ganze Reihe Fasanenartige vor. Neben den erwähnten Pfauen sind es u. a. (Abb. 23) die Frankolinwachteln (Perdicula), Königshühner (Tetraogallus), Bambushühner (Bambusicola), Pfaufasanen (Polyplectron), Waldrebhühner (Arborophila), Glanzfasanen (Lophophorus), Tragopane (Tragopan) und viele andere. Besonders hervorzuheben ist die Gattung der Kammhühner (Gallus), zu denen das in Südostasien lebende Bankiva-Huhn (Gallus gallus) gehört, der Wildform des Haushuhns.

Abb. 23: Vielfalt der Fasanen-Gattungen, die nur in Asien vorkommen, mit einem Schwerpunkt in den Tropen Asiens, dem Himalaya und Ostasien (siehe hierzu auch Abb. 21, 24 und 25 für weitere Gattungen, die nur bzw. auch in Asien vorkommen).
In Europa und gemäßigten Asien kommen u. a. die Rebhühner (Perdix, Abb. 24) und verschiedene Arten der sog. Raufußhühner (Tetraonini; Abb. 25) vor, zu denen neben anderen der Auerhahn (Tetrao urogallus), Schneehühner (Lagopus) und Birkhühner (Lyrurus) gehören (Winkler et al. 2020e).

Abb. 24: weitere Gattungen der Fasananartigen: Steinhühner (Alectoris) kommen in Europa, Nordafrika und der arabischen Halbinsel sowie in West- und Zentralasien vor. Die Edelfasane (Phasanius) kommen ursprünglich nur in Asien vor, aber der Fasan (Phasianus colchicus) wurde in Europa sei der Antike eingebürgert. Rebhühner (Perdix) leben in Europa und Asien, Wüstenhühner (Ammoperdix) in Nordafrika, der arabischen Halbinsel und Vorderasien. Eine sehr weite Verbreitung hat die Gattung Synoicus, die in Afrika, Asien, Neuguinea und Australien leben. Erdwachteln (Coturnix) haben unter den Fasanenartigen die weiteste Verbreitung. Die Arten haben in Afrika (inklusive Madagaskar), fast ganz Asien und Europa, sowie in Australien ein zu Hause.

Abb. 25: Raufußhühner und Truthühner. Tannenhühner (Canachites), Präriehühner (Tympanuchus), Felsengebirgshühner (Dendragapus), Beifußhühner (Centrocercus) und Kragenhühner (Bonasa) leben nur in Nordamerika. Auerhühner (Tetrao), Birkhühner (Lyrurus) und Haselhühner (Tetrastes) kommen in Europa und Nordasien vor. Sichelhühner (Falcipennis) sind in Ostsibirien endemisch und Schneehühner (Lagopus) leben in der Arktis und in Gebirgen der Nordhalbkugel. Truthühner (Meleagris) sind die einzigen Fasanenartigen, die auch bis nach Mittelamerika vordringen.
Die Fasanenartigen haben Südamerika nie erreicht, aber alle einheimischen Arten, die in Nord- und Mittelamerika vorkommen, gehören entweder zu den Truthühnern (Meleagridinae, Abb. 25) oder den Raufußhühnern (Tetraoninae, Abb. 25), letztere kommen, wie erwähnt, auch in Europa und Asien vor. Beide Gruppen sind tief in die Familie der Fasanenartigen eingeschachtelt (Wang et al. 2013). Der Ursprung der Klade, die diese beiden Taxa umfasst, ist wahrscheinlich in Nordamerika, von wo aus sich die Raufußhühner im späten Känozoikum nach Europa verbreiteten. Das früheste Fossil, das den Truthühnern zugeordnet wird, ist Rhegminornis aus dem frühen Miozän von Florida (Olson 1985), aber dieses Taxon ist nur von einem Tarsometatarsus bekannt und seine Identifizierung kann daher nicht als eindeutig angesehen werden. Die frühesten unumstrittenen Truthähne stammen aus dem Pliozän Nordamerikas (Stidham 2011). Frühere Nachweise von Raufußhühnern aus dem Miozän Nordamerikas müssen noch verifiziert werden (Olson 1985), und aus Europa sind keine Fossilien von Raufußhühnern aus Zeiten vor dem Pliozän beschrieben worden (Mlíkovský 2002).
Gänsevögel (Anseriformes)
Von den heute lebenden Galloanserae sind nur die Anseriformes, also die Gänsevögel, in aquatische Lebensräume vorgedrungen, und die Nutzung dieser neuen ökologischen Zone bildete die Grundlage für die enorme Diversifizierung dieser Vögel. Im Gegensatz zu den meisten anderen Wasservögeln ernähren sich Gänsevögel meistens von Wasserpflanzen oder kleinen wirbellosen Wassertieren.
Die Ordnung der Gänsevögel (Anseriformes) hat drei Familien, die die Kronengruppe dieser Gruppe darstellen: die in Südamerika vorkommen Wehrvögel (Anhimidae) mit drei Arten, die in Australien lebenden Spaltfußgänse (Anseranatidae) mit nur einer Art, sowie die weltweit verbreiteten Entenvögel (Anatidae; inklusive der Gänse und Schwäne) mit über 170 Arten. Neben diesen sind auch einige fossile Taxa bekannt, die als Stammgruppe der Anseriformes gelten, deren phylogenetische Position aber nicht immer eindeutig ist (Abb. 26).
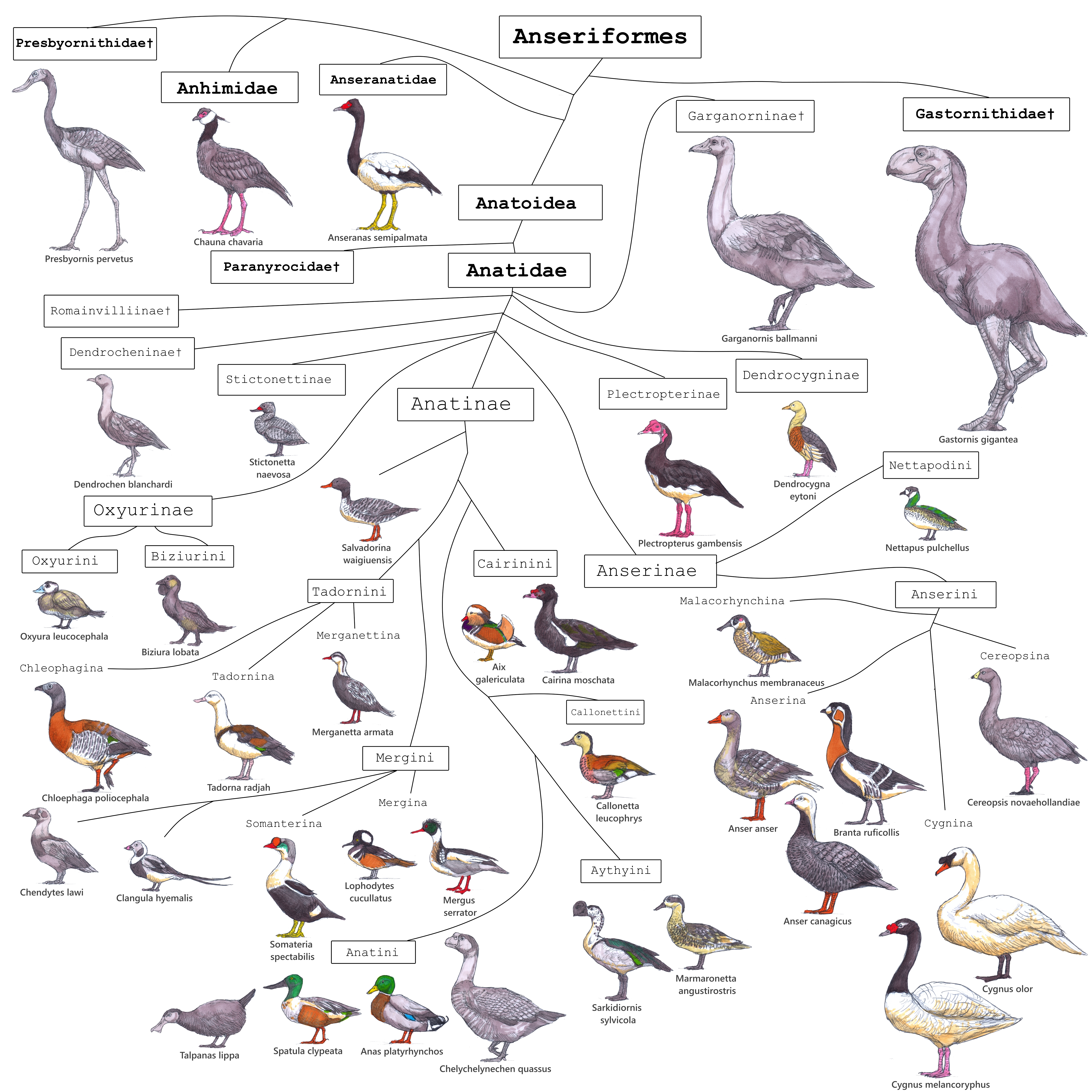
Abb. 26: Stammbaum der Anseriformes
Zu den eigentümlichsten Anseriformen gehören sicherlich die langbeinigen Presbyornithidae, die vor der Beschreibung ihrer entenartigen Schädel fälschlicherweise als Verwandte von Küstenvögeln oder Flamingos eingestuft wurden. Bekannte Vertreter dieser Vögel sind Telmabates (Abb. 27) aus dem frühen Eozän von Patagonien und Presbyornis (Abb. 27) der im Paläozän und frühen Eozän Nordamerikas und der Mongolei reichlich vertreten ist (Howard 1955, Cracraft 1970, de Pietri et al. 2016, Wetmore 1926, Garcia et al. 2020, Worthy et al. 2023, Zelenkov 2021, Olson 1994, Ericson 2000, Kurochkin & Dyke 2010). Einige fragmentarische Fossilien sind aus der Kreidezeit überliefert (Kurochkin et al. 2002). Der Schnabel von Presbyornis ähnelt dem von heutigen filtrierenden Enten, aber es ist unbekannt, ob Hornlamellen – eine Voraussetzung für die Filtrierung – vorhanden waren. Das postkraniale Skelett hingegen unterscheidet sich in vielerlei Hinsicht von dem der heute lebenden Anseriformes. Einige dieser Unterschiede können funktionell mit den stark verlängerten Beinen dieser Vögel zusammenhängen, andere, wie z. B. ein nicht pneumatisierter Oberarmknochen, sind wahrscheinlich eher auf die Beibehaltung plesiomorpher Merkmale zurückzuführen.
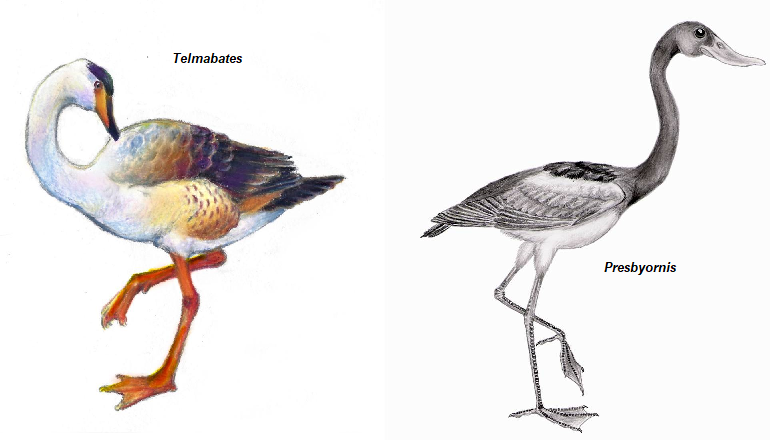
Abb. 27: Telmabates und Presbyornis
Einige Analysen ergaben eine Verwandtschaft zwischen den Presbyornithidae und den Entenvögeln, aber diese Hypothese wird durch die abgeleiteten Merkmale nur schwach unterstützt (Ericson 1997, Livezey 1997, Mayr 2008). Leider wird eine Beurteilung der Verwandtschaftsverhältnisse der Presbyornithidae durch die kaum bekannte Morphologie des Schädels erschwert, der trotz der Verfügbarkeit zahlreicher gut erhaltener Exemplare noch nicht im Detail untersucht wurde. Einige Merkmale des Schädels lassen eine Position außerhalb der Kronengruppe der Anseriformes vermuten (Elzanowski & Stidham 2010). Die phylogenetische Verwandtschaft der Presbyornithidae ist für das Verständnis der Merkmalsentwicklung bei den Anseriformes von Bedeutung. Wenn sie innerhalb der Anseriformes eine basalere Position einnehmen, als derzeit angenommen wird, würde ihre Schnabelform einen Hinweis für die Hypothese liefern, dass sich ein entenartiger Schnabel früh in der Evolution der Anseriformes entwickelt hat und sekundär bei den Wehrvögeln verloren ging (Olson & Feduccia 1980).
Ein weiterer kürzlich entdeckter basaler Verstreter der Anseriformes ist Anachronornis, der Merkmale mit den Wehrvögeln und Entenvögeln teilt, was ihn in die Nähe der Divergenz zwischen den beiden Gruppen stellt (Houde et al. 2023, Abb. 28). Anders als bei Presbyornis ist sein Schnabel – wie bei den Wehrvögeln – hühnerartig. Er lebte im Paläozän vor etwa 56 Mio. Jahren, also etwa zeitgleich mit Presbyornis und seinen Verwandten. Tatsächlich scheint sich also die Frage, ob der Schnabel der frühen Anseriformes hühner- oder entenartig war, nicht anhand des Fossilberichtes klären. Aus molekular- und entwicklungsbiologischer Sicht, ist eine Umwandlung eines hühnerartigen Schnabels in einen entenartigen jedoch kein besonders großer Schritt. Denn eigentlich ist ein Entenschnabel ein abgeflachter Hühnerschnabel (Abb. 29).

Abb. 28: Anachronornis
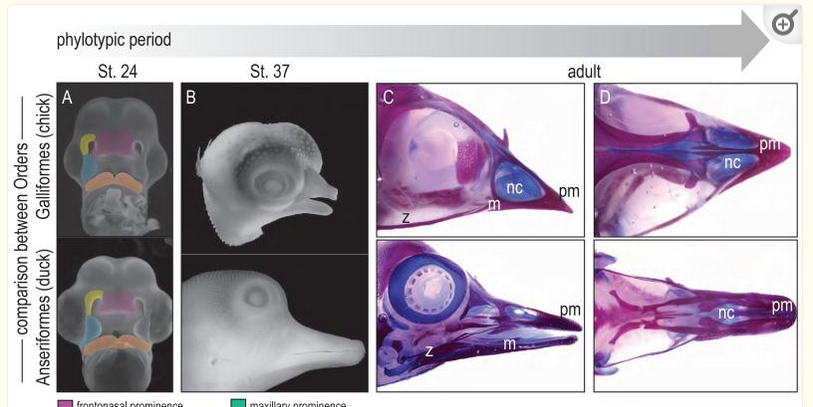
Abb. 29: Entwicklung von Hühner- und Entenschnäbeln.
Eine Untersuchung von Enten- und Hühnerembryonen im Jahr 2004 deckte die Grundlage für diesen Unterschied auf (Wu et al. 2004). Bei beiden Arten weist die frontonasale Gewebemasse (frontonasal tissue mass; kurz FNM-Region) zunächst zwei seitliche Wachstumszonen auf [Hu & Marcucio 2009, Liu et al. 2010). Bei Hühnerembryonen konvergieren diese Zonen und verschmelzen mittig zu einem spitzen Schnabel, während sie bei Entenembryonen länger bestehen bleiben und zu einem breiteren Schnabel führen. Es sind mehrere regulatorische Proteine beteiligt, so die Morphogene Shh und FGF8, aber auch BMP4. Shh und FGF8 sind bei Hühnern und Enten für den distalen Auswuchs verantwortlich, bei Enten wird aber BMP4 in einem höheren Maße exprimiert. Auf diesen Hinweis hin versuchten die Forscher, der FNM-Region eines Hühnerembryos zusätzliches BMP4 hinzuzufügen, und stellten fest, dass sie den Schnabel zu einem Faksimile des Entenschnabels umgestalten konnten. Transplantationen zwischen Enten- und Wachtelembryonen zur Erzeugung von “Wachtel”- oder “Enten”-Chimären (Eames 2008,Trainor 2005) zeigen, dass die Schnabelform durch eingewanderte Zellen aus der Neuralleiste bestimmt wird (Jheon & Schneider 2009) – und nicht durch einheimisches Gesichtsgewebe (Schneider 2005, Schneider & Helms 2003) – und dasselbe gilt für die Kiefermuskeln (Tokita & Schneider 2009). BMP4 steuert die Schnabelform bei anderen Vögeln (Wu et al. 2006), wie z. B. bei Darwinfinken (Abzhanov et al. 2004, Mallarino & Abzhanov 2012), und es reguliert die Kieferform bei Wirbeltieren im Allgemeinen (Grant et al. 2006, Parson & Albertson 2009). Die Schnabellänge wird (im Gegensatz zur Form) zusätzlich zu den oben genannten Morphogenen durch den Calmodulin-Weg beeinflusst (Abzhanov et al. 2006, Parson & Albertson 2009, Schneider 2006).
Wehrvögel (Anhimidae) und Spaltfußgänse (Anseranatidae)
Wehrvögel (Anhimidae)
Die Wehrvögel (Anhimidae) sind mit den Entenvögeln näher verwandt als mit den Hühnervögeln, ihr Erscheinungsbild ist aber hühnerartig (del Hoyo 2020, Winkler et al. 2020f, Stiller et al. 2024, Kuhl et al. 2021; Abb. 30). Zu ihren für Gänsevögel ungewöhnlichen Merkmalen zählen der hühnervogelartige Schnabel, die nur partiell ausgebildeten Schwimmhäute zwischen den Zehen, die allmähliche Mauser der Flugfedern, so dass sie ihre Flugfähigkeit während der Mauser anders als die meisten Gänsevögel nie verlieren und an den Handgelenken verankerte Sporne, die bei Revierkämpfen eingesetzt werden. Bekannt sind Wehrvögel für ihre außerordentlich lautstarken Rufe, die ihnen im Englischen zum Namen Screamers (Schreier) verholfen haben.

Abb. 30: Wehrvögel
Einer der ältesten fossilen Wehrvögel ist Chaunoides (Abb. 31) aus dem Miozän Brasiliens (Alvarenga 1999, Tambussi & Degrange 2012), welcher kleiner war als die heute kleinste Wehrvogelart. Es gibt fossile Belege für einen Ursprung der Wehrvögel außerhalb Südamerikas: Paranyroca aus dem frühen Miozän von South Dakota (Miller & Compton 1939) und Überreste aus dem frühen Eozän Nordamerikas und Europas (Ericson 1997).

Abb. 31: Chaunoides
Spaltfußgänse (Anseranatidae)
Auch die Spaltfußgans (Anseranas semipalmata), welche als eigene Familie (Anseranatidae) gilt, hat einige für Gänsevögel untypische Merkmale, wie verhältnismäßig lange Beine und stark reduzierte Schwimmhäute, während der Schnabel eher typisch Gänse- und Entenförmig ist (Stiller et al. 2024, del Hoyo 2020, Winkler et al. 2020g; Abb. 32). Diese Gruppe dürfte phylogenetisch recht alt sein, ihr Fossilbeleg ist aber spärlich. Die Gattung Anatalavis aus England aus der späten Kreidezeit oder des frühen Paläozäns wird manchmal als der früheste bekannte Vertreter dieser Gruppe angesehen (Dyke 2001, Olson 1999; Abb. 33). Eine weitere paläogene Vogelgattung ist Anserpica aus dem späten Oligozän von Frankreich (Hugueney et al. 2003, Abb. 33). Das früheste bekannte Mitglied der Gruppe in Australien ist Eoanseranas handae. Sie ist durch Fossilien vertreten, die im spätoligozänen Carl-Creek-Kalkstein von Queensland gefunden wurden (Worthy & Scanlon 2009). Weitere Fossilien aus Nordamerika und Europa deuten darauf hin, dass die Familie während des späten Paläogens über den gesamten Globus verbreitet war.

Abb. 32: Spaltfußgans

Abb. 33: Anatalavis und Anserpica
Entenvögel (Anatidae)
Allgemeine Merkmale der Entenvögel (Anatidae)
Die Familie der Entenvögel, Anatidae (del Hoyo 2020, Winkler et al. 2015, 2020h, Gonzalez et al. 2009, Bulgarella et al. 2010, 2014, Johnson & Sorenson 1999, McCracken et al. 1999, 2010, Kear 2005), sind die am weitesten verbreitete und artenreichste Familie der Anseriformes mit fast weltweiter Verbreitung. Die Taxonomie der Entenvögel ist noch nicht endgültig, da einige Gattungsgruppen und Unterfamilien sich als paraphyletisch erweisen. Wir orientieren und hier an der Taxonomie nach Winkler et al. (2015). Hiernach gibt es vier Unterfamilien: Pfeifgänse (Dendrocygninae), Ruderenten (Oxyurinae), Gänse (Anserinae) und Enten (Anatinae).
Die Mitglieder der Entenvögel sind gekennzeichnet durch Hornlamellen entlang der Schnittkanten des Schnabels, die eine Anpassung an das Filterfressen darstellen (Abb. 34). Ihre Zunge fungiert als Kolben und ist eher neben dem Oberkiefer als neben dem Unterkiefer gelagert; Wasser wird an der Schnabelspitze angesaugt und dann über kammartige Lamellen nach außen ausgestoßen. Ursprünglich wurde dieses System für die Filtrationsfütterung in flachen Gewässern verwendet, doch wurden die Komponenten dieses Systems für das Abweiden von Pflanzen, das Ergreifen von Fischen oder anderen Meerestieren wie Krebsen, Muscheln und Korallen modifiziert.

Abb. 34: Schnabel einer Ente mit Lamellen.
Oberhalb der Augen haben alle Entenvögel Salzdrüsen, durch die aufgenommenes Salz wieder ausgeschieden werden kann (Hughes 2003, Abb. 35). Die Flügel der Entenvögel sind kurz und kräftig. Wegen des verhältnismäßig hohen Gewichts der Vögel und der geringen Flügelfläche ist ein permanenter Flügelschlag erforderlich und es sind keine Gleitphasen möglich. Um sich in die Luft zu erheben, müssen vor allem die größeren Arten einige Meter auf der Wasseroberfläche laufen. Einmal in der Luft, können Entenvögel ausdauernd weite Strecken zurücklegen, zum Teil in Höhen bis zu 8000 m. Eine Ausnahme sind drei Arten der Dampfschiffenten (Tachyeres), die völlig flugunfähig geworden sind. Bei der Betrachtung der inneren Organe ist das vergrößerte Herz oft tauchender Enten auffällig. Der Muskelmagen ist bei den Gänsen vergrößert, um die faserhaltigen Pflanzen zerkleinern zu können; eine noch stärkere Vergrößerung findet man bei Meerenten, die Molluskenschalen aufnehmen. Die Pflanzenfresser unter den Entenvögeln haben zudem große Blinddärme.
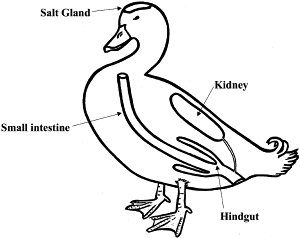
Abb. 35: Osmoregulatorische Organsysteme einer Ente, inklusive der Salzdrüsen.
Der Fossilbericht der Entenvögel (Anatidae)
Die Fossilien der Anatidae sind umfangreich, aber erst in den letzten Jahren wurde versucht, sie in einen phylogenetischen Zusammenhang zu stellen, wobei die frühe Herkunft der Familie unklar ist.
Das früheste unbestrittene Mitglied der Familie ist Romainvillia aus dem späten Eozän Frankreichs. Insgesamt ähnelt die Skelettmorphologie dieses Taxons derjenigen der modernen Anatidae (Abb. 36). Romainvillia steht jedoch außerhalb der Kronengruppe der Anatidae, von denen sie sich zum Beispiel durch ein Coracoid mit einem gut ausgeprägten Foramen für den Nervus supracoracoideus unterscheiden; dieses Foramen ist in der Kronengruppe der Anatidae reduziert (Mayr 2008, Abb. 36). Der kurze Tarsometatarsus von Romainvillia unterscheidet sich von dem der Kronengruppe der Anatidae durch die Form der Trochlea für die zweite Zehe, was als möglicher Beweis dafür interpretiert wurde, dass das Taxon weniger an das Schwimmen angepasst war als seine heutigen Verwandten (Mayr 2008, Abb. 36). Romainvillia-ähnliche Anseriformes wurden auch aus dem frühen Oligozän von England und Belgien entdeckt (Mayr 2009), und mutmaßliche Nachweise gibt es aus dem späten Eozän von China und dem späten Oligozän von Frankreich (Mayr & De Pietri 2013, Stidham & Ni 2014).
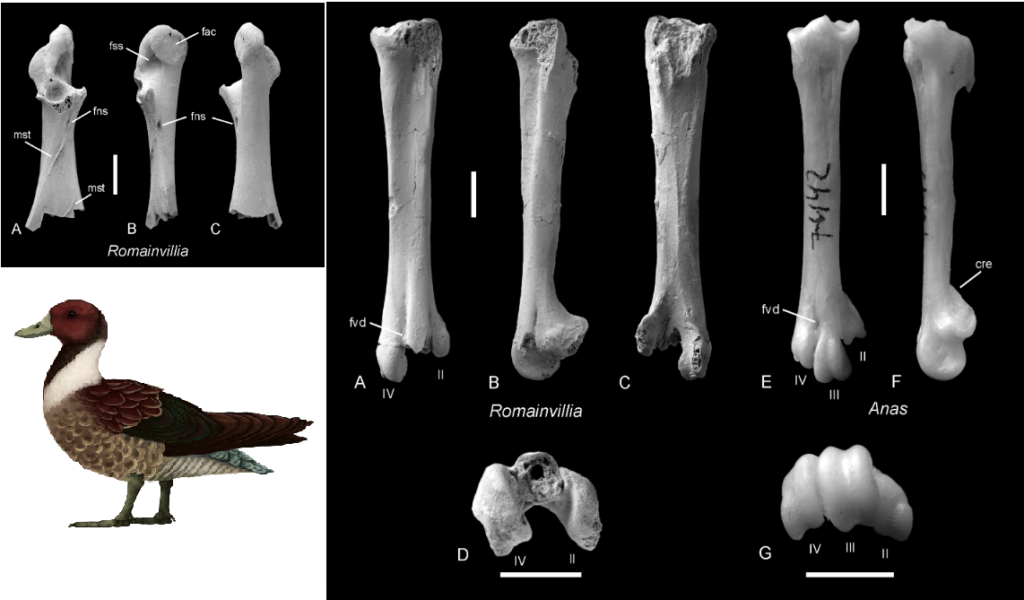
Abb. 36: Romainvillia. Links oben: Coracoid von Romainvillia aus dorsaler (A), medialer (B) und ventraler (C) Sicht. „fns“ steht für das im Text erwähnte Foramen für den Nervus supracoracoideus. Links Unten: Lebensrekonstruktion. Rechts: Tarsometatarsus von Romainvillia stehlini LEBEDINSKY, 1927 aus dem späten Eozän Frankreichs im Vergleich zu der heute lebenden Versicolorente (Anas versicolor). A-D – R. stehlini, rechter Tarsometatarsus (NMB P.G.25.l) in dorsaler (A), medialer (B), plantarer (C) und distaler (D) Ansicht. E-G – A. versicolor, rechter Tarsometatarsus in dorsaler (E), medialer (F) und distaler (G) Ansicht. Abkürzungen: cre – Kamm, der von der Trochlea metatarsi II ausgeht; fvd – foramen vasculare distale. Die Trochleen sind nummeriert; die fossilen Exemplare in A-D sind mit Ammoniumchlorid beschichtet. – Maßstabsbalken entsprechen 5 mm.
Die ältesten modernen Anatidae stammen aus dem frühesten Oligozän Europas, ihre Zugehörigkeit kann jedoch aufgrund der fragmentarischen Beschaffenheit der Exemplare nicht beurteilt werden (Mayr & Smith 2001, Mayr 2009). Insgesamt ähneln diese Fossilien jedoch den nächstältesten Anatidae, die zu dem weit verbreiteten Taxon Mionetta gehören, welcher erstmals im späten Oligozön Europas vorkommt und im Miozän durch zahlreiche Knochenfunde, z. B. in Frankreich, belegt ist (Mlíkovský 2002, Mayr 2009, Zelenkov 2012a, b, Abb. 37). Außerhalb Europas wurde Mionetta aus dem frühen Miozän von Namibia gemeldet (Mourer-Chauviré 2008), wo Anfang des 20. Jahrhunderts ein weiterer Mionetta-ähnlicher Anatidae, “Anas luederitzensis“, beschrieben wurde. Phylogenetische Analysen ordnen Mionetta innerhalb der Kronengruppe der Anatidae ein, entweder als Schwestertaxon zu allen Entenvögel mit Ausnahme der Pfeifgänse (Livezey & Martin 1988) oder der Pfeifgänse und Gänse (Worthy & Lee 2008).

Abb. 37: Mionetta
Die Hauptgruppen der Entenvögel (Anatidae)
Pfeifgänse (Dendrocygninae, Abb. 38), bekannt durch ihre pfeifenden Rufe, haben neun Arten in zwei Gattungen, die weltweit in tropischen und subtropischen Gebieten leben. 3 Arten leben in der Australis, 4 in der Orientalis, in der Afrotropis 3 und in der Neotropis 4. Mehrere Arten kommen dabei auf mehreren Kontinenten und in mehreren Faunenregionen gleichzeitig vor.

Abb. 38: Unterfamilie der Pfeifgänse (Dendrocygninae)
Ruderenten (Oxyurinae, Abb. 39) sind hochspezialisierte Tauchenten, die in vielen Merkmalen so abweichend sind, dass sie in eine eigene Unterfamilie gestellt werden. Z. B. sitzen ihre Beine so weit hinten am Körper an, dass sie beim Gang auf dem Land viel unbeholfener als andere Enten sind. Der Schwanz, der bei anderen Entenvögeln kurz und rechteckig ist, ist bei den Ruderenten lang und spitz und steht oft aufrecht. Er dient beim Tauchen als Steuerruder. Die acht Arten sind weltweit verbreitet, wobei ein Verbreitungsschwerpunkt auf dem amerikanischen Doppelkontinent liegt.

Abb. 39: Unterfamilie der Ruderenten (Oxyurinae)
Zur Unterfamilie der Gänse (Anserinae, Abb. 40) zählen neben den Gänsen (Anser, Branta, Cereopsis) und Schwänen (Cygnus, Coscoroba) nach Winkler et al. (2015) auch die australische Affenente (Stictonetta naevosa), die von manchen Autoren aber als eigene Unterfamilie gezählt werden; auch die in Australien lebende Rosenohrente (Malacorhynchus membranaceus) scheint eher mit den Gänsen zu verwandt sein als mit den Enten. Die frühesten Fossilien dieser Unterfamilie stammen aus dem Miozän. Es gibt Fossilfunde aus Neuseeland, Europa, der Mongolei (Heteroanser, Bonibernicla) und Kalifornien (Presbychen) (Worthy et al. 2008, Mlíkovský 2002 Zelenkov 2012a, Howard 1992). Um die genauen phylogenetischen Beziehungen der meisten dieser Taxa, die nur aus fragmentarischen Überresten bekannt sind, zu enträtseln, sind jedoch weitere Studien erforderlich. Von besonderem biogeographischem Interesse ist das Vorkommen eines ausgestorbenen Taxons der Schwäne (Afrocygnus) im jüngsten Miozän des Tschad und Libyens (Louchart et al. 2005), da Schwäne in Afrika heute nicht natürlich vorkommen (Abb. 41).

Abb. 40: Unterfamilie der Gänse (Anserinae), inklusive der Affenente (Stictonetta naevosa), Rosenohrente (Malacorhynchus membranaceus) und Salvadoriente (Salvadorina waigiuensis), die manchmal als eigene Unterfamilien behandelt werden.

Abb. 41: fossile Vertreter der Unterfamilie der Gänse
Die Enten, genauer die Anatinae, umfassen alle übrigen Entenvögel: Schwimmenten (Anatini, Abb. 43), Tauchenten (Aythyini, Abb. 44), Meerenten und Säger (Mergini, Abb. 45), sowie die Halbgänse (Tadornini, Abb. 42). Manche (Kear 2005) ordnen die Halbgänse jedoch als eigene Unterfamilie ein. Hier werden neben den Sturzbachenten (Merganetta), Dampfschiffenten (Tachyeres), die Brandgans (Tadorna tadorna), die afrikanische Sporngans (Plectropterus gambensis) und die ebenfalls ursprünglich in Afrika vorkommende Nilgans (Alopochen aegyptiaca) vereint.

Abb. 42: Unterfamilie Enten (Anatinae), Tribus Halbgänse (Tadornini), inklusive der Saumschnabel-, Sturzbach-, und Dampfschiffenten (Hymenolaimus, Merganetta, Tachyeres), der Sporn- und Höckerglanzgänse (Sarkidiornis, Plectropterus) und der echten Halbgänse (Cyanochen, Radjah, Alopochen, Tadorna, Chloephaga, Oressochen).

Abb. 43: Unterfamilie Enten (Anatinae), Tribus Schwimmenten (Anatini)

Abb. 44: Unterfamilie Enten (Anatinae), Tribus Tauchenten (Aythyini).

Abb. 45: Unterfamilie Enten (Anatinae), Tribus Meerenten und Säger (Mergini)
Die Beziehungen zwischen den Hauptgruppen der Anatinae sind nur unzureichend geklärt, aber abgeleitete Merkmale des Humerus deuten auf eine Klade hin, die Tauchenten, Schwimmenten, Meerenten und Säger, sowie einige andere Taxa umfasst (Mayr & Pavia 2014). Die für uns bekannteste Schwimmente ist die Stockente (Anas platyrhynchos), eine bekannte Tauchente ist die Tafelente (Aythya ferina), Eiderente (Somateria mollissima) und Gänsesäger (Mergus merganser) sind bekannte Meerenten. Weiterhin sind auch die Verwandtschaftsverhältnisse der fossilen Taxa unzureichend, oft aufgrund der fragmentierten Fossilfunde. Mögliche Meerenten sind Mioquerquedula und Protomelanitta aus dem Miozän der Mongolei, es gibt auch einige Fossilfunde aus dem Miozän von Virginia, USA (Zelenkov & Kurochkin 2012, Zelenkov 2011, 2017, Olson 1985, Abb. 46).

Abb. 46: Mioquerquedula und Protomelanitta
Die Schwimmenten, die artenreichste Gattungsgruppe der Anseriformes mit etwa 60 Arten, scheinen sich vergleichsweise spät diversifiziert zu haben und zuverlässig identifizierte Belege für das weit verbreitete Taxon Anas sind vor dem jüngsten Miozän nicht bekannt (Mayr 2016). Einige fossile Taxa aus dem frühen Mozän, die den Halbgänsen (Tadornini) zugeordnet werden, sind Australotadorna aus Australien und Miotadorna aus Neuseeland (Worthy 2009, Worthy et al. 2007, Worthy & Lee 2008, Abb. 47).
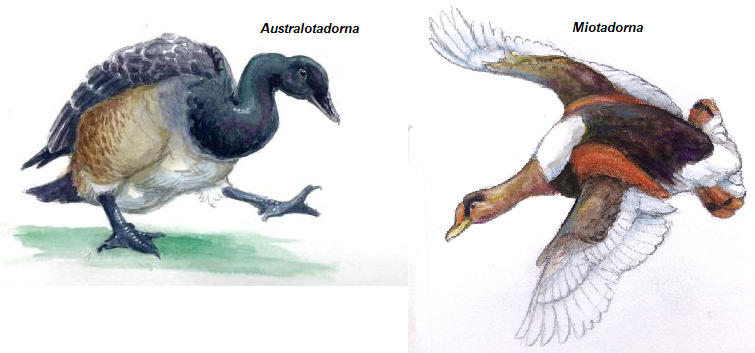
Abb. 47: Australotadorna und Miotadorna
Viele der frühesten Anatinae (Abb. 48) weisen morphologische Merkmale auf, die als Tauchanpassungen interpretiert wurden. Dies gilt für die australische Gattung Pinpanetta und den neuseeländischen Gattungen Dunstanetta und Manuherikia, ebenfalls aus dem Miozän (Worthy 2009, Worthy & Lee 2008). Ähnliche Merkmale mit Tauchanpassungen zeigen zwei miozäne Gattungen aus der Mongolei: Sharganetta und Nogusunna (Zelenkov 2011). Die Verwandtschaft der letztgenannten Fossilien ist ungewiss, aber die neuseeländischen Gattungen werden eher den Ruderenten als den Enten zugeordnet (Worthy & Lee 2008).

Abb. 48: Pinpanetta, Dunstanetta, Manuherikia, Sharganetta und Nogusunna
Es ist aber offen, ob diverse Tauchanpassungen innerhalb der Entenvögel unabhängig voneinander entstanden oder homolog sind, also an der Basis der Familie der Entenvögel stehen. Die genetische Trennung der Unterfamilie der Ruderenten von den eigentlichen Enten, scheint eine unabhängige Entwicklung dieser Merkmale zu begünstigen. Dies gilt insbesondere für eines der markantesten Merkmale, dem Fehlen von pneumatischen Öffnungen im proximalen Ende des Oberarmknochens. Da der Oberarmknochen bei einigen frühen Anseriformen außerhalb der Anatidae, wie Presbyornis, Romainvillia, und Mionetta, ebenfalls nicht pneumatisiert ist, kann das Fehlen von pneumatischen Öffnungen für Anseriformes plesiomorph sein, gleichzeitig ist dieser Knochen bei den Wehrvögeln, Spaltfußgänsen und einigen basalen Entenvögeln pneumatisiert.
Die biogeografische Geschichte der Anatidae ist ebenfalls nur unvollständig bekannt. Obwohl entenartige Anseriformes in einigen europäischen Lokalitäten des frühen Miozäns recht zahlreich vorkommen, ist ihre taxonomische Vielfalt gering. Dies steht im Gegensatz zu den wesentlich vielfältigeren Wasservogelfaunen aus dem Miozän in Neuseeland und der Mongolei (Worthy et al. 2007, 2008, Worthy & Lee 2008, Zelenkov 2011, 2012a, b, Zelenkov & Kurochkin 2012). Ohne einen soliden phylogenetischen Rahmen für diese Fossilien kann jedoch wenig über ihre biogeografische Bedeutung gesagt werden.
Gastornis, Donnervögel und Brontornis – flugunfähige Galloanserae
Innerhalb der Galloanserae gibt es noch drei weitere Gruppen, die zu diesen gerechnet werden, aber ausgestorben sind: Die Gastornithiformes, die Donnervögel und die Pseudozahnvögel (Pelagornithidae)
Gastornithidae
Gastornithiformes (Abb. 49) waren flugunfähige, waldbewohnende Vögel mit robusten Beinen, welche im frühen Paläogen in der nördlichen Hemisphäre verbreitet waren. Die größten Arten erreichten eine Höhe von fast 2 Metern und hatten ein Gewicht von etwa 175 Kilogramm (Andors 1992). Abgesehen von ihrer Größe ist das charakteristischste Merkmal ihr übergroßer Schnabel, der einen stark gekrümmten Rückenkamm hat, aber eine hakenförmige Spitze fehlt. Die stark reduzierten Flügel und das Fehlen eines Brustbeinkiels deuten auf eine lange evolutionäre Geschichte der Fluglosigkeit für diese Vögel hin. Man findet Fossilien in Nordamerika, Europa und Asien (Mayr 2007, 2009, Buffetaut 2013, Martin 1992, Bourdon et al. 2016, Worthy et al. 2017). Alle Arten werden der Gattung Gastornis zugeordnet, wobei die nordamerikanischen Arten früher in die Gattung Diatryma gestellt wurden (Mayr 2009; Buffetaut 2013). Neben Knochenfunden sind auch Eier und Fußspuren von Gastornis nachgewiesen (Mayr 2009, Angst et al. 2015, Mustoe et al. 2012).
Gastornis wird manchmal als Top-Räuber in den Ökosystemen der nördlichen Hemisphäre des Eozäns dargestellt, aber sowohl die anatomischen Belege als auch die Analysen der Kohlenstoffisotope des Knochenapatits deuten auf eine pflanzenfressende Ernährung hin (Andors 1992, Mayr 2009, Angst et al. 2014). Anhand der Merkmale der Gliedmaßenknochen und des Kiefergelenks ist deutlich, dass Gastornis mit den Gänsevögeln (Anseriformes) und den Hühnervögeln (Galliformes) verwandt sind. Laut einer Untersuchung aus dem Jahr 2017 (Worthy et al. 2017) bilden die Gastornithiformes möglicherweise die Schwestergruppe zu den Hühnervögeln. Sie schließen hierin außerdem noch die einst in Australien heimischen Donnervögel (Dromornithidae, Abb. 49) mit ein.
Donnervögel (Dromornithidae)
Die Donnervögel (Dromornithidae, Abb. 49) waren große, flugunfähige Vögel aus Australien und Tasmanien. Der Fossilbericht ist bei den Donnervögeln deutlich reicher als bei Gastornis und die ältesten Funde sind 20 Mio. Jahre alt. Es sind fünf Gattungen mit acht Arten beschrieben: Barawertornis, Bullockornis und Genyornis mit je einer Art, Ilbandornis mit zwei und Dromornis mit drei Arten. Genyornis lebte im Pleistozän und wurde noch von den Ureinwohnern gejagt. Dromornis stirtoni war 2,7m hoch und wog fast 500 Kg. Wie Gastornis waren die Donnervögel Vegetarier und zeigen eine Reihe an Anpassungen für eine sekundäre Flugunfähigkeit. Merkmale der Kiefer deuten ebenfalls auf eine Verwandtschaft mit den Gänse- und Hühnervögeln hin, sie sind aber nicht näher mit Gastornis verwandt: zum einen unterscheiden sich die Donnervögel an mehreren Skelettmerkmalen von Gastornis, zum anderen sprechen auch biogeographische Gründe – die Tatsache, dass die Donnervögel nur in Australien vorkamen – für eine konvergente Entwicklung (Murray & Vickers-Rich 2004, Nguyen et al. 2010, Gunn et al. 2011).

Abb. 49: 1. Gastornis gigantea, 2. Dromornis stirtoni, 3. Barawertornis tedfordi, 4. Bullockornis planei, 5. Ilbandornis lawsoni, 6. Genyornis newtoni
Eine weitere Gattung flugunfähiger Vögel aus dem Miozän von Südamerika – Brontornis – wird neuerdings zu den Galloanserae gestellt (Abb. 50). Ursprünglich wurde er den sog. Terrorvögeln (Phorusrhacidae) zugeordnet. Die Vertreter von Brontornis hatten einen schweren Körperbau, kurze Beine, mächtige Schnäbel und stark zurückgebildete Flügel, allerdings ist die Gattung nur über wenige Funde bekannt. Es ist bisher nicht eindeutig geklärt, ob die Vertreter von Brontornis räuberisch oder pflanzenfressend lebten, der Bau des Unterkiefers und die Gestaltung der Krallen an den Zehen sprechen aber für eine Bevorzugung pflanzlicher Nahrung (Agnolin 2007, 2021 Tambussi & Degrange 2013). Aber die Einordnung von Brontornis zu den Galloanserae wird nicht von allen geteilt und stellen sie als Schwestergruppe der Terrorvögel dar (Worthy et al. 2017).

Abb. 50: Brontornis
Pseudozahnvögel (Pelagornithidae)
Die Pseudozahnvögel (Pelagornithidae) waren sehr große flugfähige Seevögel, die im Tertiär weltweit vorkamen. Etwa ein Dutzend beschriebene Gattungen sind bekannt, wobei einige sehr groß wurden. Osteodontornis orri erreichte eine Flügelspannweite von 4,8 bis 6 Metern, Pelagornis sandersi soll mit einer Flügelspanne von zwischen 6,0 und 7,4 Metern noch größer gewesen sein (Abb. 51). Ihre Knochen waren sehr dünn, das Skelett sehr leicht gebaut und damit an den Segelflug angepasst. Da das Skelett so fragil war, konnten die Pelagornithidae wahrscheinlich nicht tauchen, sondern fingen ihre Nahrung schwimmend oder im Flug direkt von der Wasseroberfläche (Mayr & Rubilar-Rogers 2010, Howard 1957, Mayr 2009, Bourdon et al. 2010, Mayr & Zvonok 2012, Mayr et al. 2013, Ksepka 2014, Olson 1985, Olson & Rasmussen 2001, Fitzgerald et al. 2012).
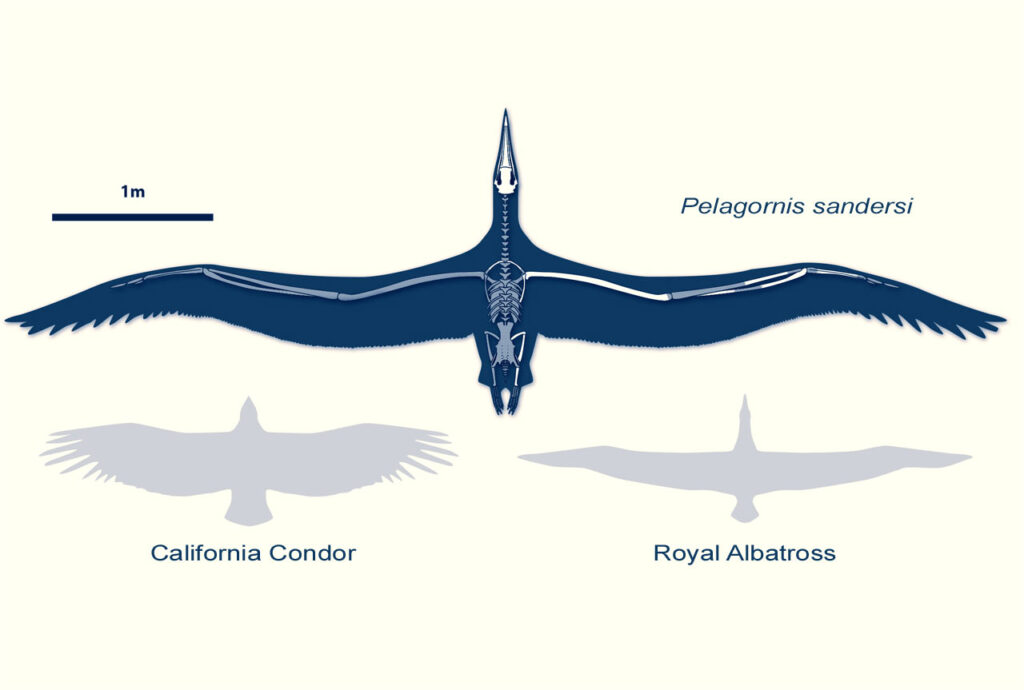
Abb. 51: Pelagornis sandersi
Pseudozahnvögel hatten wie alle modernen Vögel keine Zähne, ihre Schnäbel hatten jedoch zahlreiche zahnartige, knöcherne Auswüchse des Ober- und Unterkiefers von unterschiedlicher Größe (Abb. 52). Gefäßfurchen auf ihrer Oberfläche weisen darauf hin, dass diese Auswüchse vom Hornschnabel bedeckt waren. Pseudozähne lassen sich leicht von echten Vogelzähnen unterscheiden, da sie nicht mit Zahnschmelz bedeckt sind, nicht in Alveolen ruhen und ihre Histologie typisch für Knochen ist (Louchart et al. 2013). Wenn Pseudozähne auf unvollständig ausgeprägte zahnspezifische Entwicklungsprogramme zurückgehen, könnten sie dennoch auf molekularer Ebene homolog zu echten Archosaurierzähnen sein, denn frühe ontogenetische Stadien der Alligatorzähne sind ebenfalls bloße Auswüchse der epithelialen Oberflächenschichten und die Wege der Zahnentwicklung können noch in Hühnerembryonen induziert werden können (Mayr & Rubilar-Rogers 2010, Mayr & Zvonok 2012, Chen et al. 2000, Harris et al. 2006).

Abb. 52: Schnabel der Pseuozahnvögel
Die phylogenetische Verwandtschaft der Pseudozahnvögel ist nicht gut aufgeklärt. Einige Schädelmerkmale sprechen für eine Einordnung in die Galloanserae. Die Hypothese, dass sie das Schwestertaxon der Anseriformes sind (Bourdon 2005), kann nicht aufrechterhalten werden, da ihnen die abgeleiteten Merkmale der Kronengruppe der Galloanserae fehlen. Einige Merkmale der Pseudozahnvögel weisen sogar auf eine Stellung außerhalb der Neognathae hin (Mayr 2011) und werfen die Frage auf, ob die Merkmale mit den Galloanserae möglicherweise plesiomorph für die Neognathen sind.
Literatur
Abzhanov, A., Kuo, W.P., Hartmann, C., Grant, B.R., Grant, P.R., and Tabin, C. (2006). The calmodulin pathway and evolution of elongated beak morphology in Darwin’s finches. Nature 442, 563–567.
Abzhanov, A., Protas, M., Grant, B.R., Grant, P.R., and Tabin, C.J. (2004). Bmp4 and morphological variation of beaks in Darwin’s finches. Science 305, 1462–1465.
Agnolin, F. L. (2007): Brontornis burmeisteri Moreno & Mercerat, un Anseriformes (Aves) gigante del Mioceno Medio de Patagonia, Argentina. Revista del Museo Argentino de Ciencias Naturales Nueva 9, 15–25
Agnolin, F. L. (2021). Reappraisal on the Phylogenetic Relationships of the Enigmatic Flightless Bird (Brontornis burmeisteri) Moreno and Mercerat, 1891. Diversity. 13 (2): 90. doi:10.3390/d13020090. ISSN 1424-2818.
Agnolín, F. L., Egli, F. B., Chatterjee, S., Marsà, J. A. G (2017): Vegaviidae, a new clade of southern diving birds that survived the K/T boundary. The Science of Nature. 104 (87): 87
Ali, J. R.; Heaney, L. R. (2021). Wallace’s line, Wallacea , and associated divides and areas: History of a tortuous tangle of ideas and labels. Biological Reviews. 96 (3): 922–942.
Alvarenga, H.M.F. (1999). A fossil screamer (Anseriformes: Anhimidae) from the middle Tertiary of southeastern Brazil. Smithsonian Contributions to Paleobiology 89, 223–230.
Andors, A. (1992). Reappraisal of the Eocene groundbird Diatryma (Aves: Anserimorphae). Science Series Natural History Museum of Los Angeles County. 36: 109–125.
Angst, D., Buffetaut, E., Lécuyer, C., Amiot, R., Smektala, F., Giner, S., Méchin, A., Méchin, P., Amoros, A., Leroy, L., Guiomar, M., Tomg, H., Martinez, A. (2015). Fossil avian eggs from the Palaeogene of southern France: New size estimates and a possible taxonomic identification of the egg-layer. Geological Magazine 152, 70–79.
Angst, D., Lécuyer, C., Amiot, R., Buffetaut, E., Fourel, F., Martineau, F., Legendre, S., Abourachid, A., Herrel, A. (2014). Isotopic and anatomical evidence of an herbivorous diet in the Early Tertiary giant bird Gastornis. Implications for the structure of Paleocene terrestrial ecosystems. Naturwissenschaften 101, 313–322.
Bao, X., N. Liu, J. Qu, X. Wang, B. An, L. Wen, and S. Song (2010), The phylogenetic position and speciation dynamics of the genus Perdix (Phasianidae, Galliformes), Mol. Phylogenet. Evol. 56, 840-847.
Birks, S.M. and S.V. Edwards (2002), A phylogeny of the megapodes (Aves: Megapodiidae) based on nuclear and mitochondrial DNA sequences, Mol. Phylogenet. Evol. 23, 408-421.
Boev, Z. (2002). Fossil record and disappearance of peafowl (Pavo Linnaeus) from the Balkan Peninsula and Europe (Aves: Phasianidae).
Historia Naturalis Bulgarica 14, 109–115.
Boles, W.E. (2008). Systematics of the fossil Australian giant megapodes Progura (Aves: Megapodiidae). Orytos 7, 195–215.
Boles, W. E., T. J. Ivison. (1999): A New Genus of Dwarf Megapode (Galliformes: Megapodiidae) from the Late Oligocene of Central Australia. Smithsonian Contributions to Paleobiology 89: 199 – 206.
Bonilla, A.J., E.L. Braun, and R.T. Kimball (2010), Comparative molecular evolution and phylogenetic utility of 3′-UTRs and introns in Galliformes, Mol. Phylogenet. Evol. 56, 536-542.
Bourdon, E. (2005). Osteological evidence for sister group relationship between pseudo-toothed birds (Aves: Odontopterygiformes) and waterfowls (Anseriformes). Naturwissenschaften 92, 586–591.
Bourdon, E., Amaghzaz, M., Bouya, B. (2010). Pseudotoothed birds (Aves, Odontopterygiformes) from the early Tertiary of Morocco. American Museum Novitates 3704, 1–71.
Bourdon, E., Mourer-Chauviré, C., Laurent, Y. (2016). Early Eocene birds from La Borie, southern France. Acta Palaeontologica Polonica 61, 175–190.
Buffetaut, E. (2013). The giant bird Gastornis in Asia: A revision of Zhongyuanus xichuanensis Hou, 1980, from the early Eocene of China. Paleontological Journal 47, 1302–1307.
Bulgarella, M., M.D. Sorenson, J.L. Peters, R.E. Wilson, and K.G. McCracken (2010), Phylogenetic relationships of Amazonetta, Speculanas, Lophonetta, and Tachyeres: four morphologically divergent duck genera endemic to South America, J. Avian Biol. 41, 186-199.
Bulgarella, M., C. Kopuchian, A.S. di Giacomo, R. Matus, O. Blank, R.E. Wilson, and K.G. McCracken (2014), Molecular phylogeny of the South American sheldgeese with implications for conservation of Falkland Islands (Malvinas) and continental populations of the Ruddy-headed Goose Chloephaga rubidiceps and Upland Goose C. picta. Bird Conserv. Internat. 224, 59-71.
Chen, D.; Hosner, P.A.; Dittmann, D.L.; O’Neill, J.P.; Birks, S.M.; Braun, E.L.; Kimball, R.T. (2021). Divergence time estimation of Galliformes based on the best gene shopping scheme of ultraconserved elements. BMC Ecology and Evolution. 21 (1): 209.
Chen Y et al. (2000): Conservation of early odontogenic signaling pathways in Aves. Proc. Natl Acad. Sci. USA 97, 10 044–10 049.
Clark, G. A. (1960): Notes on the embryology and evolution of the megapodes (Aves: Galliformes). Postilla 45, 1–7
Clark, G. A. (1964): Ontogeny and evolution in the megapodes (Aves: Galliformes). Postilla 78, S. 1–37.
Clarke, J. A., Tambussi, C. P., Noriega, J. I., Erickson, G. M., Ketcham, R. A. (2005): Definitive fossil evidence for the extant avian radiation in the Cretaceous. Nature. 433 (7023): 305–308.
Cohen, C., J.L. Wakeling, T.G. Mandiwana-Neudani, E. Sande, C. Dranzoa, T.M. Crowe, and R.C.K. Bowie (2012), Phylogenetic affinities of evolutionarily enigmatic African galliforms: the Stone Partridge Ptilopachus petrosus and Nahan’s Francolin Francolinus nahani, and support for their sister relationship with New World quails, Ibis 154, 768-780.
Cox, C. B. (2001): The biogeographic regions reconsidered. Journal of Biogeography, 28: 511–523.
Cox. W.A., R.T. Kimball, and E.L. Braun (2007), Phylogenetic position of the New World quail (Odontophoridae): eight nuclear loci and three mitochondrial regions contradict morphology and the Sibley-Ahlquist tapestry, Auk 124, 71-84.
Cracraft, J. (1970). A New Species of Telmabates (Phoenicopteriformes) from the Lower Eocene of Patagonia. Codor 72 (4): 479 – 480.
Cracraft J (1981). Toward a phylogenetic classification of the recent birds of the world (Class Aves). Auk 98: 681–714.
Cracraft, J. (1988): The major clades of birds. In: Benton, M. J. (1988). Phylogeny and classification of the tetrapods. Published for the Systematics Association by the Clarendon Press.
Crowe, T.M., R.C.K. Bowie, P. Bloomer, T.G. Mandiwana, T.A.J. Hedderson, E. Randi, S. Pereira, and J. Wakeling (2006a), Phylogenetics, biogeography and classification of, and character evolution in, gamebirds (Aves: Galliformes): Effects of character exclusion, data partitioning and missing data, Cladistics 22, 495-532.
Crowe, T.M., P. Bloomer, E. Randi, V. Lucchini, R. Kimball, E. Braun, and J.G. Groth (2006b), Supra-generic cladistics of landfowl (Order Galliformes), Acta Zool. Sinica 52, S358-S361.
Dekker, R. (1989): Predation and the western limits of megapode distribution. In: Journal of Biogeography 16, S. 317–321
Dekker, R. (2007): Distribution and Speciation of Megapodes (Megapodiidae) and Subsequent Development of their Breeding. In: Willem Renema: Biogeography, Time, and Place: Distributions, Barriers, and Islands. Springer.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
de Pietri, V. L., R. P. Scofield, N. Zelenkov, W. E. Boles, T. H. Worthy. (2016). The Unexpected survival of an ancient lineage of anseriform birds into the Neogene of Australia: the youngest record of Presbyornithidae. Royal Society Open Science 3: 150635.
Dinesen, L., Lehmberg, T., Svendsen, J.O., Hansen, L.A., Fjeldså, J. (1994). A new genus and species of perdicine bird (Phasianidae, Perdicini) from Tanzania; a relict form with Indo-Malayan affinities. Ibis 136: 2-11.
Donegan, T.M. (2012), A new group name for the Chachalacas (Aves: Cracidae: Ortalis), Conservación Colombiana 17, 41-44.
Donegan, T.M. (2015), Family-group names based on Ortalis Merrem, 1786 (Aves, CRACIDAE): proposed conservation of either Ortalida-, Ortalis- or Ortalid- as the stem and suppression of family-group names based on Ortalis Fallén, 1810 (Insecta, Diptera) in the latter two instances, and acceptance of the English text of part of Article 29.3.3 of the Code as definitive in the second instance, Bull. Zool. Nomen. 72, 142-151.
Ducey, J. E. (2012). Fossil Birds of the Nebraska Region. Transactions of the Nebraska Academy of Sciences and Affiliated Societies 130: 83 – 96.
Dyke, G. J. (2001). The fossil waterfowl (Aves: Anseriformes) from the Eocene of England. American Museum Novitates 3354: 1 – 15.
Dzerzhinsky, F. Y. (1995). Evidence for common ancestry of the Galliformes and Anseriformes. Courier Forschungsinstitut Senckenberg, 181, 325-336.
Eames, B.F. (2008). The genesis of cartilage size and shape during development and evolution. Development 135, 3947–3958.
Elzanowski, A., Stidham, T.A. (2010). Morphology of the quadrate in the Eocene anseriform Presbyornis and extant galloanserine birds. Journal of Morphology 271, 305–323.
Ericson, P. G.P. (2000). Systematic revision, skeletal anatomy, and paleoecology of the New World early Tertiary Presbyornithidae (Aves: Anseriformes). PaleoBios. 20 (2): 1–23.
Ericson, P.G.P. (1997). Systematic relationships of the palaeogene family Presbyornithidae (Aves: Anseriformes). Zoological Journal of the Linnean Society 121, 429–483.
Ericson, P., Parsons, T., Johansson, U. (2001). Morphological and molecular support for nonmonophyly of the Galloanserae.
Fitzgerald, E.M.G., Park, T., Worthy, T.H. (2012). First giant bony-toothed bird (Pelagornithidae) from Australia. Journal of Vertebrate Paleontology 32, 971–974.
Frank-Hoeflich, K., L.F. Silveira, J. Estudillo-López, A.M. García-Koch, L. Ongay-Larios, and D. Piñero (2006), Increased taxon and character sampling reveals novel intergeneric relationships in the Cracidae (Aves: Galliformes), J. Zool. Syst. Evol. Res. 45, 242-254.
Garcia, G.; Mourer-Chauviré, C.; Adaci, M.; Bensalah, M.; Mebrouk, F.; Valentin, X.; Mahboubi, M.; Tabuce, R. (2020). First discovery of avian egg and bone remains (Presbyornithidae) from the Gour Lazib (Eocene, Algeria. Journal of African Earth Sciences. 162: Article 103666.
Gastañaga, M., R. MacLeod, D.M. Brooks, and B. Hennessey (2011), Distinctive morphology, ecology, and first vocal descriptions of Sira Curassow (Pauxi [unicornis] koepckeae): evidence for species rank, Ornitologia Neotropical 22, 267-279.
Göhlich, U. B. & Mourer-Chauviré, C. (2005). Revision of the phasianids (aves: galliformes) from the Lower Miocene of Saint-Gérand-le-Puy (Allier, France). Palaeontology, 48:1331–1350.
Göhlich, U. B. & Pavia, M. (2008). A New Species of Palaeortyx (Aves: Galliformes: Phasianidae) from the Neo-gene of Gargano, Italy. Oryctos, 7:95–10.
Gonzalez, J., H. Düttmann and M. Wink (2009), Phylogenetic relationships based on two mitochondrial genes and hybridization patterns in Anatidae, J. Zool. 279, 310-318.
Grant, P.R., Grant, B.R., and Abzhanov, A. (2006). A developing paradigm for the development of bird beaks. Biol. J. Linnean Soc. 88, 17–22.
Grau, E.T., S.L. Pereira, L.F. Silveira, E. Höfling, and A. Wajntal (2005), Molecular phylogenetics and biogeography of Neotropical piping guans (Aves: Galliformes): Pipile Bonaparte, 1856 is synonym of Aburria Reichenbach, 1853, Mol. Phylogenet. Evol. 35, 637-645.
Gunn, R.G., Douglas, L.C., Whear, R.L. (2011). What bird is that? Identifying a probable painting of Genyornis newtoni in Western Arnhem land. Australian Archaeology 73, 1–12.
Hackett, S.J., R.T. Kimball, S. Reddy, R.C.K. Bowie, E.L. Braun, M.J. Braun, J.L. Chojnowski, W.A. Cox, K-L. Han, J. Harshman, C.J. Huddleston, B.D. Marks, K.J. Miglia, W.S. Moore, F.H. Sheldon, D.W. Steadman, C.C. Witt, and T. Yuri (2008), A phylogenetic study of birds reveals their evolutionary history, Science 320, 1763-1767.
Hantoro, W. S., H. Faure, R. Djuwansah, L. Faure-Denard, P.A. Pirazzoli (1995): The Sunda and Sahul continental platform: Lost Land of the Last Glacial Continent. S.E. Asia, Quaternary International 29–30: 129–134. doi:10.1016/1040-6182(95)00015-B
Harris, R.B., S.M. Birks, and A.D. Leach (2014), Incubator birds: biogeographical origins and evolution of underground nesting in megapodes (Galliformes: Megapodiidae) , J. Biogeogr. 41, 2045-2056.
Harris MP, Hasso SM, Ferguson MWJ, Fallon JF. (2006): The development of archosaurian first-generation teeth in a chicken mutant. Curr. Biol. 16, 371–377.
Herrera, A. M., S. G. Shuster, C. L. Perriton and M. J. Cohn. 2013. Developmental Basis of Phallus Reduction during Bird Evolution. Current Biology. 23(12): 1065–1074.
Holman, J. A. (1961). Osteology of living and fossil New World Quails (Aves: Galliformes). Bulletin of the Florida State Museum, Biological Sciences 6(2): 131-233.
Hosner, P.A., E.L. Braun, and R.T. Kimball (2015), Land connectivity changes and global cooling shaped the colonization history and diversification of New World quail (Aves: Galliformes: Odontophoridae), J. Biogeogr. 42, 1883-1895.
Houde, P.; Dickson, M.; Camarena, D. (2023). Basal Anseriformes from the Early Paleogene of North America and Europe. Diversity. 15 (2): 233. doi:10.3390/d15020233
Howard, H. (1955). A new wading bird from the Eocene of Patagonia. American Museum Novitates 1710:1-25
Howard, H. (1957). A gigantic “toothed” marine bird from the Miocene of California. Santa Barbara Museum of Natural History Bulletin (Geology Department) 1, 1–23.
Howard, H. (1992). New records of Middle Miocene anseriform birds from Kern County, California. Natural History Museum of Los Angeles County, Science Series 36, 231–237.
Hu, D. and Marcucio, R.S. (2009). Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev. Biol. 325, 200–210.
Hughes, M. R. (2003). Regulation of salt gland, gut and kidney interactions. Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology 136: 507-524.
Hugueney, M.; Berthet, D.; Bodergat, A.-M.; Escuillié, F.; Mourer-Chauviré, C.; Wattinne, A. (2003). La limite Oligocène-Miocène en Limagne: changements fauniques chez les mammifères, oiseaux et ostracodes des différents niveaux de Billy-Créchy (Allier, France) [The Oligocene-Miocene boundary in Limagne: faunal changes in the mammals, birds and ostracods from the different levels of Billy-Créchy (Allier, France)]. Geobios. 36 (6): 719–731. doi:10.1016/j.geobios.2003.01.002.
Hwang, S.H., Mayr, G., & Minjin, B. (2010) The earliest record of a galliform bird in Asia, from the late Paleocene/early Eocene of the Gobi Desert, Mongolia. Journal of Vertebrate Paleontology 30, 1642–1644.
Jheon, A.H. and Schneider, R.A. (2009). The cells that fill the bill: neural crest and the evolution of craniofacial development. J. Dent. Res. 88, 12–21.
Johnson, K.P., and M.D. Sorenson (1999), Phylogeny and biogeography of dabbling ducks (genus: Anas): A comparison of molecular and morphological evidence, Auk 116, 792-805.
Kaiser, V.B., M. van Tuinen, and H. Ellegren (2007), Insertion Events of CR1 Retrotransposable Elements Elucidate the Phylogenetic Branching Order in Galliform Birds, Mol. Biol. Evol. 24, 338-347.
Kan, X.-Z. J.-K. Yang, X.-F. Li, L. Chen, Z.-P. Lei, M. Wang, C.-J. Qian, H. Gao, and Z.-Y. Yang (2010), Phylogeny of major lineages of galliform birds (Aves: Galliformes) based on complete mitochondrial genomes, Genet. Mol. Res. 9, 1625-1633.
Kear, J. (2005): Ducks, Geese and Swans. Oxford University Press.
Kimball, R.T., and E.L. Braun (2008), A multigene phylogeny of Galliformes supports a single origin of erectile ability in non-feathered facial traits, J. Avian Biol. 39, 438-445.
Kimball, R. T.; Braun, E. L. (2014). Does more sequence data improve estimates of galliform phylogeny? Analyses of a rapid radiation using a complete data matrix. PeerJ. 2: e361.
Kimball, R. T.; Braun, E. L.; Zwartjes, P. W.; Crowe, T. M.; Ligon, J. D. (1999). A molecular phylogeny of the pheasants and partridges suggests that these lineages are not monophyletic. Molecular Phylogenetics and Evolution. 11 (1): 38–54.
Kimball, R.T., C.M. St. Mary, and E.L. Braun (2011), A Macroevolutionary Perspective on Multiple Sexual Traits in the Phasianidae (Galliformes), Intl. J. Evol. Biol., #423938.
Kimball, R. T. et al. (2021): A phylogenomic supermatrix of Galliformes (Landfowl) reveals biased branch lengths. Molecular Phylogenetics and Evolution, Volume 158, 107091
Kriegs, J.O., A. Matzke, G. Churakov, A. Kuritzin, G. Mayr, J. Brosius, and J. Schmitz (2007), Waves of genomic hitchhikers shed light on the evolution of gamebirds (Aves: Galliformes), BMC Evol. Biol. 7:190.
Ksepka, D.T. (2014). Flight performance of the largest volant bird. Proceedings of the National Academy of Sciences USA 111, 10624–10629.
Kuhl, H., C. Frankl-Vilches, A. Bakker, G. Mayr, G. Nikolaus, S.T. Boerno, S. Klages, B. Timmermann, and M. Gahr (2021), An unbiased molecular approach using 3′-UTRs resolves the avian family-level tree of life, Mol. Biol. Evol. 138, 108-127.
Kuo, P.-C., Benson, R. B. J., & Field, D. J. (2023). The influence of fossils in macroevolutionary analyses of 3D geometric morphometric data: A case study of galloanseran quadrates. Journal of Morphology, 284, e21594. https://doi.org/10.1002/jmor.21594
Kurochkin, E. N.; Dyke, G. J. (2010). A Large Collection of Presbyornis (Aves, Anseriformes, Presbyornithidae) from the Late Paleocene and Early Eocene of Mongolia. Geological Journal. 45 (4): 375–387.
Kurochkin, E. N.; Dyke, G. J.; Karhu, A. A. (2002). A new presbyornithid bird (Aves, Anseriformes) from the late Cretaceous of southern Mongolia. American Museum Novitates (3386): 1–11.
Laskowski, M., Fitch, W. M. (1989): Evolution of avian ovomucoids and of birds. In: B. Fernholm, K. Bremer, H. Jörnvall: The hierarchy of life: molecules and morphology in phylogenetic analysis. Excerpta Medica, Amsterdam.
Lattin, G. (1967): Grundriss der Zoogeographie. G. Fischer, Stuttgart.
Liu, Z., L. He, H. Yuan, B. Yue, and J. Li (2012), CR1 retroposons provide a new insight into the phylogeny of Phasianidae species (Aves: Galliformes), Gene 502, 125-132.
Liu, B., Rooker, S.M., and Helms, J.A. (2010). Molecular control of facial morphology. Semin. Cell Dev. Biol. 21, 309–313.
Livezey, B. C. (1997). A phylogenetic analysis of basal Anseriformes, the fossil Presbyornis, and the interordinal relationships of waterfowl. Zoological Journal of the Linnean Society, 121(4), 361-428.
Livezey, B. C., L. D. Martin. (1988). The Systematic Position of the Miocene Anatid Anas[?] blanchardi Milne-Edwards. Journal of Vertebrate Paleontology 8 (2): 196 – 211.
Livezey, B. C., Zusi, R. L. (2007): Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. II. Analysis and discussion, Zoological Journal of the Linnean Society, Volume 149, Issue 1, January 2007, Pages 1–95
Louchart, A. (2003). A true peafowl in Africa. South African Journal of Science 99, 368–371.
Louchart, A., Sire, J.-Y., Mourer-Chauviré, C., Geraads, D., Viriot, L., de Buffrénil, V. (2013). Structure and growth pattern of pseudoteeth in Pelagornis mauretanicus (Aves, Odontopterygiformes, Pelagornithidae). PLoS ONE 8, e80372.
Louchart, A., P. Vignaud, A. Likius, H. T. MacKaye, M. Brunet. (2005). A new swan (Aves: Anatidae) in Africa, from the Latest Miocene of Chad and Libya. Journal of Vertebrate Paleontology 25 (2): 384 – 392.
Mallarino, R. and Abzhanov, A. (2012). Paths less traveled: Evo-devo approaches to investigating animal morphological evolution. Annu. Rev. Cell Dev. Biol. 28, 743–763.
Mandiwana-Neudani, T.G., R.C.K. Bowie, M. Hausberger, L. Henry, and T.M. Crowe (2014), Taxonomic and phylogenetic utility of variation in advertising calls of francolins and spurfowls (Galliformes: Phasianidae), Afr. Zool. 49, 54-82.
Martin, L.D. (1992). The status of the Late Paleocene birds Gastornis and Remiornis. Natural History Museum of Los Angeles County, Science Series 36, 97–108.
Mayr, E. (1944): Wallace’s Line in the Light of Recent Zoogeographic Studies. Quarterly Review of Biology. Band 19, S. 1–14.
Mayr, G. (2006). New specimens of the early Eocene stem group galliform Paraortygoides (Gallinuloididae), with comments on the evolution of a crop in the stem lineage of Galliformes. Journal of Ornithology 147, 31–37.
Mayr, G. (2007). The birds from the Paleocene fissure filling of Walbeck (Germany). Journal of Vertebrate Paleontology 27, 394–408.
Mayr, G. (2008). Phylogenetic affinities and morphology of the late Eocene anseriform bird Romainvillia stehlini Lebedinsky, 1927. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 248, 365–380.
Mayr, G. (2009). Paleogene Fossil Birds. Heidelberg: Springer.
Mayr, G. (2011). Cenozoic mystery birds – on the phylogenetic affinities of bony-toothed birds (Pelagornithidae). Zoologica Scripta 40, 448–467.
Mayr, G. (2016). Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G. (2017): Avian Evolution The Fossil Record of Birds and Ist Paleobiological Significance. John Wiley & Sons, Ltd, The Atrium, Southern Gate, Chichester, West Sussex, PO19 8SQ, UK
Mayr, G., Clarke, J. (2003). The deep divergences of neornithine birds: a phylogenetic analysis of morphological characters. Cladistics, 19(6), 527-553.
Mayr, G., De Pietri, V.L. (2013). A goose-sized anseriform bird from the late Oligocene of France: The youngest record and largest species of Romainvilliinae. Paläontologische Zeitschrift 87, 423–430.
Mayr, G., Goedert, J.L., McLeod, S.A. (2013). Partial skeleton of a bony-toothed bird from the late Oligocene/early Miocene of Oregon (USA) and the systematics of Neogene Pelagornithidae. Journal of Paleontology 87, 922–929.
Mayr, G., Pavia, M. (2014). On the true affinities of Chenornis graculoides Portis, 1884 and Anas lignitifila Portis, 1884 – an albatross and an unusual duck from the Miocene of Italy. Journal of Vertebrate Paleontology 34, 914–923.
Mayr, G., Rubilar-Rogers, D. (2010). Osteology of a new giant bony-toothed bird from the Miocene of Chile, with a revision of the taxonomy of Neogene Pelagornithidae. Journal of Vertebrate Paleontology 30, 1313–1330.
Mayr, G., Smith, R. (2001). Ducks, rails, and limicoline waders (Aves: Anseriformes, Gruiformes, Charadriiformes) from the lowermost Oligocene of Belgium. Geobios 34, 547–561.
Mayr, G., Weidig, I. (2004). The Early Eocene bird Gallinuloides wyomingensis – a stem group representative of Galliformes. Acta Palaeontologica Polonica 49, 211–217.
Mayr, G., Zvonok, E. (2012). A new genus and species of Pelagornithidae with well-preserved pseudodentition and further avian remains from the middle Eocene of the Ukraine. Journal of Vertebrate Paleontology 32, 914–925.
Mayr, G. et al. (2006). A nearly complete skeleton of the fossil galliform bird Palaeortyx from the late Oligocene of Germany. Acta Ornithologica, 41(2):129–135.
McCracken, K.G., C.P. Barger, and M.D. Sorenson (2010): Phylogenetic and structural analysis of the HbA (αA/βA) and HbD (αD/βA) hemoglobin genes in two high-altitude waterfowl from the Himalayas and the Andes: Bar-headed goose (Anser indicus) and Andean goose (Chloephaga melanoptera), Mol. Phylogenet. Evol. 56, 649-658.
McCracken, K.G., J. Harshman, D.A. McClellan, and A.D. Afton (1999), Data set incongruence and correlated character evolution: An example of functional convergence in the hind-limbs of stifftail diving ducks, Syst. Biol. 48, 638-714.
Meiklejohn, K.A., M.J. Danielson, B.C. Faircloth, T.C. Glenn, E.L. Braun, and R.T. Kimball (2014), Incongruence among different mitochondrial regions: A case study using complete mitogenomes, Mol. Phylogenet. Evol. 78, 314-323.
Meng, Y., B. Dai, J. Ran, J. Li, B. Yue (2008), Phylogenetic position of the genus Tetraophasis (Aves, Galliformes, Phasianidae) as inferred from mitochondrial and nuclear sequences, Biochem. Syst. Ecol. 36, 626-637.
Miller, A. H. (1944). An avifauna from the lower Miocene of South Dakota. University of California Publications, Bulletin of the Department of Geological Sciences 27(4):85-100
Miller, A.H., Compton, L.V. (1939). Two fossil birds from the lower Miocene of South Dakota. The Condor 41, 153–156.
Mlíkovský, J. (1986). A new guineafowl (Aves: Phasianidae) from the late Eocene of France. Annalen des Naturhistorischen Museums in Wien. 90A: 63–66.
Mlíkovský, J. (2002). Cenozoic Birds of the World. Part 1: Europe. Praha: Ninox Press.
Mourer-Chauviré, C. (1989). A peafowl from thePliocene of Perpignan, France. Palaeontology 32, 439–446.
Mourer-Chauviré, C. (1992). The Galliformes (Aves) of Phosphorites Du Quercy (France): Systematics and Biostratigraphy. Natur. Hist. Mus. Los Angeles County. Sci. Ser., 36:37–95.
Mourer-Chauviré, C. (2000): A new species of Ameripodius (Aves: Galliformes: Quercymegapodiidae) from the Lower Miocene of France. Palaeontology 43, 481–593.
Mourer-Chauviré, C. (2003). Birds (Aves) from the Middle Miocene of Arrisdrift (Namibia). Preliminary study with description of two new genera: Amanuensis (Accipitridae, Sagittariidae) and Namibiavis (Gruiformes, Idiornithidae). Memoir of the Geological Survey of Namibia 19, 103–113.
Mourer-Chauviré, C. (2008). Birds (Aves) from the Early Miocene of the Northern Sperrgebiet, Namibia. Memoir Geological Survey of Namibia 20: 147 – 167.
Mourer-Chauviré, C., M. Pickford. (2015). Stemp group galliform and stemp group psittaciform birds (Aves, Galliformes, Paraortygidae, and Psittaciformes, family incertae sedis) from the Middle Eocene of Namibia. Journal of Ornithology 156 (1): 275 – 286.
Mourer-Chauviré, C., M. Pickford, B. Senut. (2011). The first Palaeogene galliform from Africa. Journal of Ornithology 152 (3): 617 – 622.
Mourer-Chauviré, C., R. Tabuce, L. Marivaux, E. M. Essid, H. Khayati, M. Vianey-Liaud, M. Ben Haj Ali. (2013). A new taxon of stem group Galliformes and the earliest record for stem group Cuculidae from the Eocene of Djebel Chambi, Tunisia. Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution.
Murray, P.F., Vickers-Rich, P. (2004). Magnificent Mihirungs: The Colossal Flightless Birds of the Australian Dreamtime. Bloomington: Indiana University Press.
Mustoe, G.E.; Tucker, D.S.; Kemplin, K.L. (2012). Giant Eocene bird footprints from northwest Washington, USA. Palaeontology. 55 (6): 1293–1305. Bibcode:2012Palgy..55.1293M.
Nguyen, J.M.T., Boles, W.E., Hand, S. (2010). New material of Barawertornis tedfordi, a dromornithid bird from the Oligo-Miocene of Australia, and its phylogenetic implications. Records of the Australian Museum 62, 45–60.
Olson, S. K. (1974). TELECREX RESTUDIED: A SMALL EOCENE GUINEAFOWL. The Wilson Journal of Ornithology. 86 (3): 246–250.
Olson, S.L. (1985): The fossil record of birds. In: D.S. Farner, J.R. King, & K.C. Parkes (eds.), Avian Biology, vol. 8. New York: Academic Press, pp. 79–238.
Olson, S. (1994). A giant Presbyornis (Aves: Anseriformes) and other birds from the Paleocene Aquia Formation of Maryland and Virginia. Proceedings of the Biological Society of Washington. 107: 429–435.
Olson, S.L. (1999). The anseriform relationships of Anatalavis Olson and Parris (Anseranatidae), with a new species from the Lower Eocene London Clay. In: Olson SL (ed) Avian paleontology at the close of the 20th century: Proceedings of the 4th international meeting of the Society of Avian Paleontology and Evolution. Washington, D.C., 4–7 June 1996. Smithson Contrib Paleobiol 89:231–243
Olson, S.L., Feduccia A (1980). Presbyornis and the origin of the Anseriformes (Aves: Charadriomorphae). Smithsonian Contributions to Zoology 323, 1–24.
Olson, S.L., Rasmussen, P.C. (2001). Miocene and Pliocene birds from the Lee Creek Mine, North Carolina. Smithsonian Contributions to Paleobiology 90, 233–365.
Parsons, K.J. and Albertson, R.C. (2009). Roles for BMP4 and CaM1 in shaping the jaw: evo-devo and beyond. Annu. Rev. Genet. 43, 369–388.
Pavia, M., Göhlich, U.B., & Mourer-Chauviré, C. (2012). Description of the type-series of Palaeocryptonyx donnezani Deperet, 1892 (Aves: Phasianidae) with the selection of a lectotype. Comptes Rendus Palevol 11, 257–263.
Pereira, S.L. and A.J. Baker (2004), Vicariant Speciation of Curassows (Aves, Cracidae): A Hypothesis Based on Mitochondrial DNA Phylogeny, Auk 121, 682-694.
Pereira, S.L. A.J. Baker, and A. Wajntal (2002), Combined Nuclear and Mitochondrial DNA Sequences Resolve Generic Relationships within the Cracidae (Galliformes, Aves), Syst. Biol. 51, 946-958.
Pereira, S.L., A.J. Baker, and A. Wajntal (2009), Did increased taxon and character sampling really reveal novel intergeneric relationships in the Cracidae (Aves: Galliformes)?, J. Zool. Syst. Evol. Res. 47, 103-1044.
Pickford, M., Senut, B., & Mourer-Chauviré, C. (2004). Early Pliocene Tragulidae and peafowls in the Rift Valley, Kenya: Evidence for rainforest in East Africa. Comptes Rendus Palevol 3, 179–189.
Portmann, A. (1938): Beiträge zur Kenntnis der postembryonalen Entwicklung der Vögel. Revue Suisse de Zoologie et Annales du Musee d’Histoire Naturelle de Genève 45, S. 273–348
Rauri C.K. Bowie, Jon Fjeldså (2005): Genetic and morphological evidence for two species in the Udzungwa forest partridge. Journal of East African Natural History 94 (1): 191–201. doi:10.2982/0012-8317(2005)94[191:GAMEFT]2.0.CO;2
Rueda, M.; Rodríguez, M. Á.; Hawkins, B. A. (2013). Identifying global zoogeographical regions: lessons from Wallace. Journal of Biogeography. 40 (12): 2215–2225.
Sangster, G. et al. (2022): Phylogenetic definitions for 25 higher-level clade names of birds, Avian Research, Volume 13, 100027 https://doi.org/10.1016/j.avrs.2022.100027.
Schneider, R.A. (2005). Developmental mechanisms facilitating the evolution of bills and quills. J. Anat. 207, 563–573.
Schneider, R.A. (2006). How to tweak a beak: molecular techniques for studying the evolution of size and shape in Darwin’s finches and other birds. BioEssays 29, 1–6.
Schneider, R.A. and Helms, J.A. (2003). The cellular and molecular origins of beak morphology. Science 299, 565–568.
Shen, Y.-Y., L. Liang, Y.-B. Sun, B.-S. Yue, X.-J. Yang, R.W. Murphy, and Y.-P. Zhang (2010), A mitogenomic perspective on the ancient, rapid radiation in the Galliformes with an emphasis on the phasianidae, BMC Evol. Biol. 10:132.
Sibley, C. G., Ahlquist, J. E., Monroe, B. L. (1988): A classification of the living birds of the world based on DNA-DNA hybridization studies. Auk. 105 (3): 409–423.
Simpson , G. G. (1977): Too Many Lines. The Limits of the Oriental and Australian Zoogeographic Regions. Proceedings of the American Philosophical Society Vol. 121, No. 2: 107–120.
Stegmann, B. (1964). Die funktionelle Bedeutung des Schlüsselbeines bei den Vögeln. Journal für Ornithologie 105, 450–463.
Stidham, T.A. (2011). The carpometacarpus of the Pliocene turkey (Galliformes: Phasianidae) and the problem of morphological variability in turkeys. PaleoBios 30, 13–17.
Stidham, T.A., & Ni, X.-J. (2014). Large anseriform (Aves: Anatidae: Romainvilliinae?) fossils from the Late Eocene of Xinjiang, China. Vertebrata PalAsiatica 52, 98–111.
Stiller, J., S. Feng, A.-A. Chowdhury, et al. (2024), Complexity of avian evolution revealed by family-level genomes, Nature 629, 851-860.
Tambussi, C. P., F. J. Degrange. (2012). The Paleogene Birds of South America. South American and Antarctic Continental Cenozoic Birds: 29 – 47.
Tambussi, C. P., F. J. Degrange (2013): Neogene Birds of South America. In: Claudia P. Tambussi und Federico J. Degrange (Hrsg.): South American and Antarctic Continental Cenozoic Birds. Paleobiogeographic Affinities and Disparities. SpringerBriefs in Earth System Sciences, S. 59–86 (S. 64–65)
Tokita, M. and Schneider, R.A. (2009). Developmental origins of species-specific muscle pattern. Dev. Biol. 331, 311–325.
Trainor, P. (2003). The bills of qucks and duails. Science 299, 523–524.
Wallace, A. R. (1869): Der Malayische Archipel. Braunschweig.
Wallace, A. R. (1876): Die geographische Verbreitung der Thiere. Dresden.
Wang, N., Kimball, R.T., Braun, E.L., Liang, B., & Zhang, Z. (2013). Assessing phylogenetic relationships among Galliformes: A multigene phylogeny with expanded taxon sampling in Phasianidae. PLoS ONE 8, e64312.
Weigel, R. D. (1963). Oligocene birds from Saskatchewan. Quarterly Journal of the Florida Academy of Sciences 26(3):257-262
Wetmore, Alexander (1926). Fossil birds from the Green River Deposits of Easter Utah. Annals of the Carnegie Museum. 16 (3–4): 391–402. doi:10.5962/p.231090
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020a). Megapodes (Megapodiidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.megapo1.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020b). Guans, Chachalacas, and Curassows (Cracidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.cracid2.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020c). New World Quail (Odontophoridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.odonto1.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020d). Guineafowl (Numididae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.numidi1.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020e). Pheasants, Grouse, and Allies (Phasianidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.phasia1.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020f). Screamers (Anhimidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.anhimi1.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020g). Magpie Goose (Anseranatidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.ansera1.01
Winkler, D. W., S. M. Billerman, and I. J. Lovette (2020h). Ducks, Geese, and Waterfowl (Anatidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.anatid1.01
Worthy, T. (2009). Descriptions and phylogenetic relationships of two new genera and four new species of Oligo-Miocene waterfowl (Aves: Anatidae) from Australia. Zoological Journal of the Linnean Society 156: 411 – 454.
Worthy, T.H.; Degrange, F.J.; Handley, W.D.; Lee, M.S.Y. (2017). The evolution of giant flightless birds and novel phylogenetic relationships for extinct fowl (Aves, Galloanseres). Royal Society Open Science. 11 (10): 170975.
Worthy, T. H.; De Pietri, V. L.; Scofield, R. P.; Hand, S. J. (2023). A new Eocene species of presbyornithid (Aves, Anseriformes) from Murgon, Australia. Alcheringa: An Australasian Journal of Palaeontology. 47 (4): 416–430.
Worthy, T. H., M. S. Y. Lee. (2008). Affinities of Miocene Waterfowl (Anatidae: Manuherikia, Dunstanetta and Miotadorna) from the St. Bathans Fauna, New Zealand. Palaeontology 51 (3): 677 – 708.
Worthy, T.H.; Scanlon, J.D. (2009). An Oligo-Miocene Magpie Goose (Aves: Anseranatidae) from Riversleigh, Northwestern Queensland, Australia. Journal of Vertebrate Paleontology. 29: 205.
Worthy, T.H., Tennyson, A.J.D., Hand, S.J., Scofield, R.P. (2008). A new species of the diving duck Manuherikia and evidence for geese (Aves: Anatidae: Anserinae) in the St Bathans Fauna (Early Miocene), New Zealand. Journal of the Royal Society of New Zealand 38, 97–114.
Worthy, T. H., A. J. Tennyson, C. Jones, J. A. McNamara, B. J. Douglas. (2007). Miocene waterfowl and other birds from central Otago, New Zealand. ournal of Systematic Palaeontology 5 (1): 1 – 39.
Wu, P., Jiang, T.-X., Shen, J.-Y., Widelitz, R.B., and Chuong, C.-M. (2006). Morphoregulation of avian beaks: comparative mapping of growth zone activities and morphological evolution. Dev. Dynamics 235, 1400–1412.
Wu, P., Jiang, T.-X., Suksaweang, S.,Widelitz, R.B., and Chuong, C.-M. (2004). Molecular shaping of the beak. Science 305, 1465–1466.
Zelenkov, N. V. (2011). Diving Ducks from the Middle Miocene of Western Mongolia. Paleontological Journal 45 (2): 191 – 199.
Zelenkov, N.V. (2012a). Neogene geese and ducks (Aves: Anatidae) from localities of the Great Lakes Depression, western Mongolia. Paleontological Journal 46, 607–619.
Zelenkov, N.V. (2012b). A new duck from the Miocene of Mongolia, with comments on the Miocene evolution of ducks. Paleontological Journal 46, 520–530.
Zelenkov, N. V. (2017). Finds of Fragmentary Bird Skeletons in the Middle Miocene of the NOrthern Caucasus. Doklady Biological Sciences 477: 223 – 226.
Zelenkov, N. V. (2021). A revision of the Palaeocene–Eocene Mongolian Presbyornithidae (Aves: Anseriformes). Paleontological Journal. 55 (3).
Zelenkov, N.V., Kurochkin, E.N. (2009a). Neogene phasianids (Aves: Phasianidae) of Central Asia: 1. Genus Tologuica gen. nov. Paleontological Journal 43, 208–215.
Zelenkov, N.V., Kurochkin, E.N. (2009b). Neogene Phasianids (Aves: Phasianidae) of Central Asia: 2. Genera Perdix, Plioperdix, and Bantamyx. Paleontological Journal 43, 318–325.
Zelenkov, N.V., Kurochkin, E.N. (2010). Neogene phasianids (Aves: Phasianidae) of Central Asia: 3. Genera Lophogallus gen. nov. and Syrmaticus. Paleontological Journal 44, 328–336.
Zelenkov, N.V., Kurochkin, E.N. (2012). Dabbling ducks (Aves: Anatidae) from the middle Miocene of Mongolia. Paleontological Journal 46, 88–95.



