Im letzten Beitrag dieser Reihe befassten wir uns mit Atomen, dem Periodensystem und wie sich Atome miteinander verbinden. Dieses Mal geht es ans Eingemachte, nämlich um unsere Nährstoffe. Wir essen ja eine ganze Menge unterschiedlichsten Kram. Doch alles was wir Essen und uns die Energie gibt, die wir brauchen, um zu überleben – oder dieses Video zu schauen, lässt sich in drei Stoffgruppen einteilen: Proteine, Kohlenhydrate und Lipide.
Wir sind organisch!
Nachdem wir nun so einiges über das Wasser erfahren haben, wenden wir uns größeren Molekülen zu. Abgesehen vom Wasser sind die meisten Moleküle in unserem Körper organische Verbindungen. Aber was heißt organische Verbindung überhaupt? Das sind Verbindungen, die Kohlenstoffatome enthalten. Und tatsächlich: alle größeren Moleküle und Naturstoffe haben das Element Kohlenstoff: ob Zucker, ob Eiweiße oder Fette. Doch warum ausgerechnet Kohlenstoff?
Das hat viel mit den Eigenschaften dieses Elements zu tun, denn Kohlenstoff kann wie kein anderes Element vielfältige und vor allem stabile Verbindungen eingehen. Besonderheiten des Kohlenstoffs sind es, Ketten und Ringe mit sich selbst und anderen Elementen sowie Doppel- und Dreifachbindungen zu bilden. Aufgrund seiner mittelstarken Elektronegativität hat er ein gutes Bindungsvermögen sowohl zu elektropositiveren als auch zu elektronegativeren Elementen. Kohlenstoff ist also das Element, dass am besten mit den anderen Elementen zurechtkommt. Für die biochemischen Vorgänge in Lebewesen sind Kohlenstoffverbindungen mit Wasserstoff (H), Stickstoff (N), Sauerstoff (O) und Schwefel (S) am bedeutendsten. Die letzten drei Elemente sind bei organischen Molekülen Hauptbestandteile der funktionellen Gruppen. In der Chemie versteht man unter funktionellen Gruppen Atomgruppen in organischen Verbindungen, die die Stoffeigenschaften und das Reaktionsverhalten bestimmen. Chemische Verbindungen, die die gleichen funktionellen Gruppen tragen, werden auf Grund ihrer oft ähnlichen Eigenschaften zu Stoffklassen zusammengefasst. Es gibt eine ganze Reihe solcher Stoffklassen, die in Abb. 1 dargestellt werden. Eine sei beispielhaft erwähnt.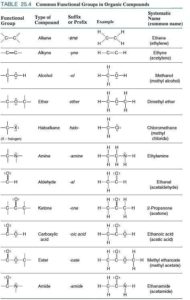
Abb. 1: funktionelle Gruppen
Jeder kennt Alkohol, doch es gibt verschiedene Alkoholarten. Derjenige, den wir gerne im Bier, Wein oder Wodka haben, ist Ethanol (Abb. 2). Ethanol besteht aus zwei Kohlenstoffatomen, 6 Wasserstoffatomen und einem Sauerstoffatom. Die sogenannte Summenformel, also wenn ich alle Atome zusammenzähle, wäre C2H6O. Doch tatsächlich wird am häufigsten die Summenformel C2H5OH verwendet; also wird ein Wasserstoffatom (H) gesondert hinter dem Sauerstoffatom gestellt. Warum? Das OH stellt nämlich die funktionelle Gruppe der Alkohole dar; an dieser OH-Gruppe erkennt man also die Alkohole, stellen sie in diese Stoffklasse mit den entsprechenden Eigenschaften. In der offiziellen Namensgebung der Chemie werden Alkohole mit der Endung „-ol“ genannt; wie bei Ethanol. Es gibt natürlich eine Reihe weiterer Alkohole; bekannt ist z. B. das Methanol, der einfachste Alkohol mit der Summenformel CH3OH. Es hat also anders als das Ethanol nur einen Kohlenstoff. Aber dieser kleine Unterschied hat enorme Effekte, denn Methanol ist in homöopathischen Dosen tödlich. Würden also Wunderheiler in ihre Globuli Methanol reintun, hätten diese tatsächlich einen Effekt, wenn auch keinen positiven.
Soweit das wichtigste zu den funktionellen Gruppen.
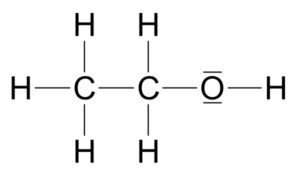
Abb. 2: Ethanol
Die wichtigsten Biomoleküle die wir haben sind Proteine, Kohlenhydrate, Fette und Nukleinsäuren. Wir werden uns in diesem Kapitel mit den ersten drei beschäftigen, die Nukleinsäuren, wozu auch die DNS gehört, verdient eine gesonderte Folge.
Eine Zelle, in Abb. 3 dargestellt am Beispiel einer Bakterienzelle, besteht zu 70% aus Wasser. Die restlichen 30% machen verschiedene Moleküle aus: davon u. a. 15% Proteine, jeweils 2% Fette und Kohlenhydrate, 7% Nukleinsäuren (DNS und RNA) und 4% besteht aus Ionen (z. B. Salzen) und anderen kleinen Molekülen.
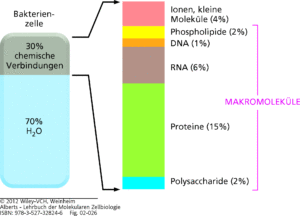
Abb. 3: Makromoleküle kommen in Zellen sehr häufig vor. Hier ist die ungefähre Zusammensetzung einer Bakterienzelle dargestellt. Die Zusammensetzung einer tierischen Zelle ist ähnlich.
Unsere Biomoleküle sind Makromoleküle, die aus einzelnen Bausteinen bzw. Untereinheiten aufgebaut sind. Man bezeichnet sie auch als Monomere. Monomere verbinden sich dann durch kovalente Bindungen zu Polymeren, also den Makromolekülen (Abb. 4). Wir werden nun die Monomere und Polymere unserer Biomoleküle kennenlernen.
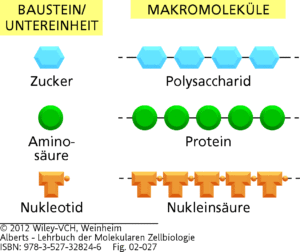
Abb. 4: Polysaccharide, Proteine und Nukleinsäuren werden aus monomeren Untereinheiten gebildet. Jedes Makromolekül ist ein Polymer aus kleinen Molekülen (genannt Monomere, Bausteine oder Untereinheiten), die durch kovalente Bindungen miteinander verbunden sind.
Aminosäuren
Proteine machen den größten Anteil unserer Makromoleküle aus und sie bestehen aus Aminosäuren. Aminosäuren sind also die Monomere, Proteine die Polymere.
Wie ist der Grundaufbau einer Aminosäure? Schauen wir uns dazu Abb. 5 an:
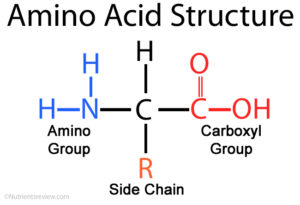
Abb. 5: Grundaufbau der Aminosäure.
Zum einen haben wir ein Kohlenstoffatom, es ist das zentrale Kohlenstoffatom. An diesem befinden sich 4 Bindungsmöglichkeiten. Am oberen Ende ist eine Verbindung mit dem Wasserstoff. Auf der linken Seite findet sich eine Aminogruppe, die aus einem Stickstoffatom und zwei Wasserstoffatomen besteht. Rechts befindet sich die Carboxylgruppe. Eine Carboxylgruppe ist ein Kohlenstoffatom, dass eine Doppelbindung mit einem Sauerstoff eingeht und eine Verbindung mit einer Alkoholgruppe (Sauerstoff + Wasserstoff). Die Aminogruppe und die Carboxylgruppe sind die zwei funktionellen Gruppen der Aminosäure, die jede besitzt. Die vierte Bindung des zentralen Kohlenstoffatoms wird mit R abgekürzt. Sie steht für Rest bzw. Seitenkette. Diese ist bei verschiedenen Aminosäuren unterschiedlich aufgebaut. Die einfachste Aminosäure ist Gylcin dessen Seitenkette nur aus einem Wasserstoffatom besteht.
Insgesamt kennt man über 250 Aminosäuren, für biologische Systeme sind aber nur 20 relevant, die die Proteine bilden. Nebenbei: während meines Studiums musste ich nicht nur alle 20 Aminosäuren auswendig können, sondern auch ihre Formeln aufzeichnen können … also das was als R in der Abbildung abgekürzt wurde. Das war echt Folter …
Aminosäuren sind übrigens auch Zwitterionen (Abb. 6). Das Spannende ist nämlich, dass die Aminogruppe (NH2) eine leicht basische, die Carboxylgruppe eine leicht saure Funktion hat. Das Vorhandensein beider solch gegensätzlicher Gruppen führt unweigerlich zu Wechselwirkungen. Dabei gibt nämlich die Carboxylgruppe ein Proton an die Aminogruppe ab. Dadurch wird die Carboxylgruppe negativ geladen (COO–) und die Aminogruppe positiv (NH3+). Eine Aminosäure hat somit zwei Ladungen, die sich aber gegenseitig aufheben, wenn sich die Aminosäure im isoelektrischen Punkt befindet. Das ist ein exakt definierter pH-Wert einer wässrigen Lösung, bei dem sich bei Zwitterionen die positive und negative Ladung ausgleichen. Dieser pH-Wert ist von Aminosäure zu Aminosäure unterschiedlich, abhängig von der Rest-Seitenkette. Durch diese Ladungsverteilung wird die Aminosäure wasserlöslich.
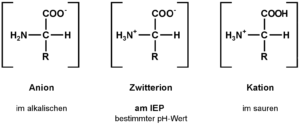
Abb. 6: Zwitterionen der Aminosäuren
Innerhalb der organischen Chemie gibt es noch das Phänomen der Isomerie. Isomiere bedeutet, dass die Summenformel des Moleküls die gleiche ist, die Strukturformel jedoch eine andere. Das heißt im Grunde genommen nur, dass ein Molekül die gleiche Anzahl von Atomen haben kann, diese aber unterschiedlich angeordnet sein können. Das kann man z. B. beim Propanol, einem Alkohol mit drei Kohlenstoffatomen, ansehen (Abb. 7). Alkohole haben als funktionelle Gruppe die OH-Gruppe.
Beim Propanol kann aber die OH-Gruppe entweder am mittleren C-Atom oder am ersten C-Atom sein. Die Zahl der Atome ist die gleiche. Die Position der funktionellen Gruppe jedoch eine andere. Dadurch haben die Moleküle auch verschiedene chemische und physikalische Eigenschaften. Solche Isomere werden vor allem bei den Kohlenhydraten wichtig sein – schon als Vorwarnung.
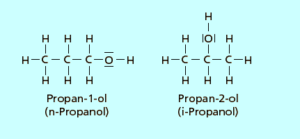
Abb. 7: Isomere von Propanol
Eine weitere Form der Isomerie ist die Chiralität, auch Händigkeit genannt. Vielleicht hat jemand schon von linksdrehenden und rechtsdrehenden Aminosäuren etwas gehört. Das ist die besagte Chiralität. Das ist wie mit unseren Händen vergleichbar: dieselbe Anzahl an Fingern, Knochen, Muskeln etc. Und doch können wir unsere Hände in eine linke und eine rechte Hand unterscheiden. Vereinfacht ausgedrückt: links ist, wo der Daumen rechts ist. Dasselbe kann auch auf Moleküle zutreffen, doch da geht es nicht um Finger, sondern um die Lage funktionellen Gruppen. Bei den Aminosäuren kommt es darauf an, an welcher Seite die Aminogruppe und die Carboxylgruppe liegen (und sich im dreidimensionalen Raum das Molekül natürlich bewegt). Abb. 8 zeigt dies an einem Beispiel:
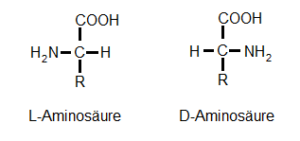
Abb. 8: Chiralität der Aminosäuren
Befindet sich die Aminogruppe in dieser Darstellung (das ist die sog. Fischer-Projektion) links, haben wir die L-Form (von levo, links), steht sie rechts haben wir die D-Form (von dextro, rechts). Die Fischer-Projektion ist eine Methode, die Raumstruktur einer linearen, chiralen chemischen Verbindung eindeutig zweidimensional abzubilden.
Da es sich um gleiche Moleküle handelt, die sich lediglich im räumlichen Aufbau unterscheiden, haben sie auch identische chemische und physikalische Eigenschaften, sie unterscheiden sich aber in der Brechung und Polarisierung des Lichts. Aber so wie eine linke Hand nur in einen linken Handschuh passt, können sich beide Formen, L- und D-Aminosäuren nicht ineinander überführen. Lebewesen bevorzugen daher eine der Formen. Proteine sind bei Lebewesen fast ausschließlich aus L-Aminosäuren aufgebaut. Diese Übereinstimmung bei allen Lebewesen wird auch als ein wichtiger Hinweis für den gemeinsamen Ursprung allen Lebens gedeutet. Lediglich bei einigen Bakterien hat man in ihrer Zellwand einige Proteine mit rechtsdrehenden Aminosäuren gefunden, möglicherweise als Anpassung gegen bestimmte Antibiotika, die die Zellwände der Bakterien zerstören.
Wie schon erwähnt sind 20 verschiedene Aminosäuren am Aufbau unserer Proteine beteiligt, die sich in ihrer Seitenkette unterscheiden. Je nachdem aus welchen Atomen diese Seitenketten bestehen, kann man sie in verschiedene Untergruppen einteilen (Abb. 9):
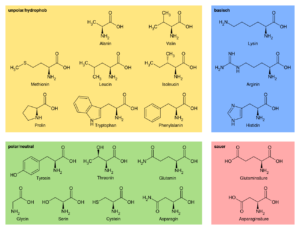
Abb. 9: die 20 Aminosäuren
- unpolar und neutral, dazu gehören Aminosäuren wie Alanin oder Leucin
- polar und neutral, dazu gehören Aminosäuren wie Glyzin und Glutamin
- sauer, dazu gehören Aminosäuren wie die Asparaginsäure
- basisch, dazu gehören Aminosäuren wie Arginin oder Lysin
Wie die Einteilung vermuten lässt, haben diese Gruppen der Aminosäuren verschiedene chemische Eigenschaften, die sich dann auf die Eigenschaften der Proteine auswirken.
Wenn Aminosäuren eine Verbindung eingehen, spricht man von Peptidbindung. Verbinden sich zwei Aminosäuren, hat mein ein Dipeptid, bei drei Aminosäuren ein Tripeptid … und irgendwann zählt man nicht mehr so genau und man hat Polypeptide. Proteine sind Polypeptide. Wie läuft eine Peptid-Bindung ab? Die Carboxylgruppe von Aminosäure 1 geht eine Verbindung mit der Aminogruppe von Aminosäure 2 ein. D. h. beide Enden reagieren miteinander, dabei spaltet sich ein Wassermolekül ab und die Amino- und Carboxylgruppe verbinden sich miteinander, bilden eine Peptidbindung (Abb. 10). Hier kann man sich merken: wenn Aminosäuren, Kohlenhydrate oder andere Monomere sich zu Polymeren vereinigen, geschieht dies unter Wasserabspaltung. Man spricht auch von Kondensationsreaktion. An der Verbindung sind Enzyme beteiligt, die die Monomere miteinander verbinden und dieser Prozess kostet Energie. Die umgekehrte Reaktion – der Abbau des Polymers – erfolgt durch die Aufnahme von Wasser (Hydrolyse) und wird ebenfalls von Enzymen unter Energieverbrauch durchgeführt. Das werden wir genauer im nächsten Beitrag behandeln.
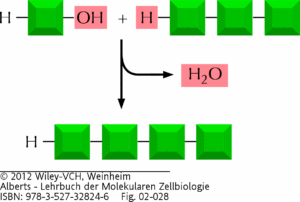
Abb. 10: Makromoleküle werden durch die Anlagerung von Untereinheiten an ein Ende gebildet. In einer Kondensationsreaktion wird pro Anlagerung eines Monomers an ein Ende der wachsenden Kette ein Molekül Wasser abgespaltet. Die umgekehrte Reaktion – der Abbau des Polymers – erfolgt durch die Aufnahme von Wasser (Hydrolyse).
Proteine
Aminosäuren sind also die Grundbausteine der Proteine. Ein Protein jedoch nur als eine lange Kette von Aminosäuren zu definieren, wird diesem nicht gerecht.
Es gibt zwei Proteinklassen: Faserproteine und globuläre Proteine (Abb. 11). Faserproteine gibt es nur bei Tieren. Sie dienen oft als Strukturbildner, z. B. in Form von Bindegewebe oder Muskelfasern. Globuläre Proteine dienen für gewöhnlich nicht der Formgebung, sondern sind hautsächlich für den Stoffwechsel und Transport zuständig. Membranproteine, Enzyme oder z. B. das Hämoglobin gehören zu den globulären Proteinen.
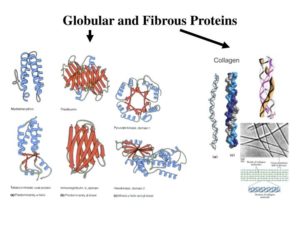
Abb. 11: globuläre und Faserproteine
Proteine erfüllen damit eine wichtige Funktion bei Lebewesen. Faserproteine dienen der Struktur, Enzyme spalten Nährstoffe, Muskelproteine sorgen für die Bewegung, andere Proteine wie das Hämoglobin für den Transport anderer Moleküle, andere Proteine dienen der Regulation der Genaktivität, andere wie Antikörper dem Schutz und wieder andere für die Wahrnehmung, so z. B. das Rhodopsin, welches für den Sehprozess verantwortlich ist.
Die Funktion eines Proteins ist eng mit seiner Struktur verbunden. Nach der Struktur der Proteine lassen sich diese auf vier verschiedenen Ebenen betrachten: Primärstruktur, Sekundärstruktur, Tertiärstruktur und Quartärstruktur (Abb. 12).
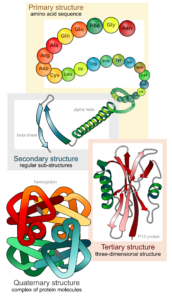
Abb. 12: Die dreidimensionale Struktur der Proteine
Die Primärstruktur beschreibt die Abfolge der Aminosäuren in einem Protein.
Die Sekundärstruktur entsteht durch Wasserstoffbrückenbindungen zwischen benachbarten Proteinbereichen. Die bekanntesten Sekundärstrukturen sind die a-Helix und das ß-Faltblatt.
Tertiärstrukturen entstehen durch Bindungen oder Wechselwirkungen in weiter entfernt liegenden Bereichen eines Proteins.
Eine Quartärstruktur besitzen nur Proteine, die aus mehreren Untereinheiten bestehen, wie beim Hämoglobin.
Die Sekundär-, Tertiär- und Quatärstrukturen lassen sich relativ einfach zerstören; z. B. durch Erhitzen. Jeder, der ein Ei gekocht oder ein Schnitzel gebraten hat, weiß das.
Kohlenhydrate
Die zweite Gruppe von Biomolekülen, mit denen wir uns näher befassen, sind die Kohlenhydrate. Zu den Kohlenhydraten gehören die verschiedenen Zucker, Stärke, Cellulose usw. Kohlenhydrate sind das Produkt der Photosynthese bei Pflanzen und einigen Bakterien, die aus CO2 mithilfe von Lichtenergie Kohlenhydrate herstellen können. Kohlenhydrate sind die zentrale Energiequelle, auf der fast alle Stoffwechselprodukte beruhen. Kohlenhydrate sind eine Verbindung von Kohlenstoff, Wasserstoff und Sauerstoff.
Das Thema klingt erstmal ganz süß, kann aber, wenn man sich mit der verwirrenden chemischen Struktur der Kohlenhydrate auseinandersetzen muss, das Ganze einem versalzen.
Also: Chemisch handelt es sich bei Kohlenhydraten um Oxidationsprodukte mehrwertiger Alkohole, Also Alkohole, die mehr als eine OH-Gruppe als funktionelle Gruppe haben (unser Trinkalkohol Ethanol ist ein einwertiger Alkohol, weil er nur eine OH-Gruppe hat). Hierbei unterscheidet man Aldosen, z. B. Glucose) und Ketosen, z. B. Fruchtzucker (Abb. 13).
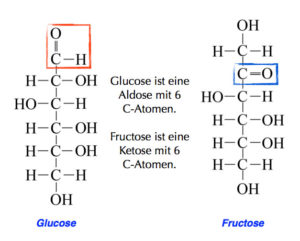
Abb. 13: Aldosen und Ketosen beim Zucker
Glucose und Fructose sind beides Zucker mit 6 C-Atomen. Glucose als Aldose hat eine Aldehyd-Bindung als funktionelle gruppe, bestehend aus einer Doppelbindung von Kohlenstoff und Sauerstoff und zusätzlich hat das Kohlenstoffatom eine weitere Bindung mit einem Wasserstoff. Fructose als Ketose hat eine Ketogruppe als funktionelle Gruppe. Das ist eine Doppelbindung des Kohlenstoffs mit einem Sauerstoff.
Auch bei Kohlenhydraten gibt es isomere Formen, je nachdem an welcher Stelle sich die OH-Gruppen befinden. Zusätzlich haben Kohlenhydrate auch eine Chiralität. Nehmen wir das Beispiel der C6-Aldose, dessen bekanntestes Isomer die Glucose ist (Abb. 14).
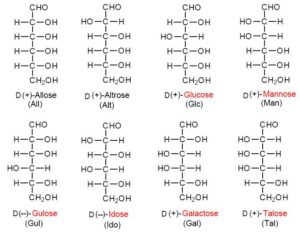
Abb. 14: Isomere der D-C6-Aldosen
Man unterscheidet bei einer C6-Aldose 16 Varianten, je nachdem wo sich die OH-Gruppen befinden. Die 16 Isomere teilen sich auf in 8 Strukturisomere, die jeweils eine Chiralitätsform haben. Anders als bei den Aminosäuren dominieren bei Lebewesen die D-Formen. Die bekanntesten C-6 Aldosen sind die D-Glucose, D-Galactose und D-Mannose. Unter den Ketosen ist die D-Fructose unser wichtigstes.
Neben C-6-Kohlenhydraten gibt es auch einige wichtige, die nur 5 Kohlenstoffatome haben. Hierzu zählen die Ribose und Desoxyribose, die das Grundgerüst von RNA und DNA ausmachen. Zucker mit 5 C-Atomen nennt man Pentose, Zucker mit 6 C-Atomen nennt man Hexosen.
Pentosen und Hexosen neigen dazu Ringformen zu bilden (Abb. 15). Bei solch einer Ringbildung kann die OH-Gruppe des ersten C-Atoms in zwei verschiedene Richtungen zeigen. Zeigt bei der Ringform die OH-Gruppe des ersten C-Atoms nach unten, haben wir eine alpha-Form, zeigt die OH-Gruppe nach oben, haben wir die beta-Form.
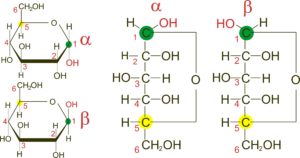
Abb. 15: Ringbildung bei der D-Glucose
Die Monomerke der Kohlenhydrate bezeichnet man als Monosaccharide (Einfachzucker). Verbinden sich zwei Monosaccharide (unter Wasserabspaltung, wie bei den Aminosäuren) werden sie zu Disacchariden. Kohlenhydrate mit bis zu 10 Monomeren bezeichnet man als Oligosaccharide, mit mehr als 10 Monomeren als Polysaccharide. Verbinden sich Zuckermoleküle miteinander, spricht man von glykosidische Bindung. Eine glykosidische Bindung wird immer mit 2 Ziffern angegeben, welche die beiden C-Atome angeben, zwischen denen, die Bindung besteht. Beispiel Maltose ist ein Disaccharid mit einer 1,4 glykosidischen Bindung zwischen zwei α-D-Glucose (Abb. 16).
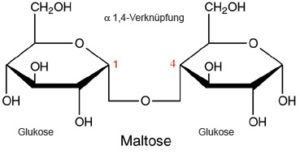
Abb. 16: 1,4 glykosidischen Bindung zwischen zwei α-D-Glucose führen zum Disaccharid Maltose
Die Monosaccharide, Disaccharide und Oligosaccharide sind in der Regel wasserlöslich, haben einen süßen Geschmack und werden im engeren Sinne als Zucker bezeichnet. Die Polysaccharide sind hingegen oftmals schlecht oder gar nicht in Wasser löslich und geschmacksneutral.
Wir haben ja einige Einfachzucker kennengelernt.
Die wichtigsten Zweifachzucker sind:
Saccharose (Rübenzucker, Glucose & Fructose)
Lactose (Milchzucker, Glucose + Galaktose)
Maltose (Malzzucker, Glucose + Glucose)
Die wichtigsten Polysaccharide sind Stärke, Glykogen (in unserer Leber gespeichert), Cellulose und Chitin.
Stärke und Cellulose bestehen beide aus D-Glucose, wobei Stärke aus alpha-1,4- und alpha-1,6 glycosidischen Verbindungen besteht und Cellulose aus ß-1,4-Bindungen.
Lipide
Lipide sind chemisch heterogene Substanzen, die sich schlecht in Wasser (Hydrophobie), gut dagegen in unpolaren Lösungsmitteln (Lipophilie) lösen. In lebenden Organismen werden Lipide hauptsächlich als Strukturkomponente in Zellmembranen, als Energiespeicher oder als Signalmoleküle gebraucht. Die meisten biologischen Lipide sind amphiphil, besitzen also einen lipophilen Kohlenwasserstoff-Rest und eine polare hydrophile Kopfgruppe, deshalb bilden sie in polaren Lösungsmitteln wie Wasser Micellen oder Membranen. Oft wird der Begriff Fett als Synonym für Lipide gebraucht, jedoch stellen die Fette nur eine Untergruppe der Lipide dar (nämlich die Gruppe der Triglyceride).
Die Lipide können in sieben Gruppen eingeteilt werden: Fettsäuren, Triglyceride (Neutralfette), Wachse, Phospholipide, Sphingolipide, Glycolipide und Isoprenoide (Steroide, Carotinoide etc. Abb. 17).
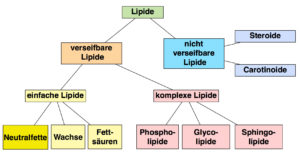
Abb. 17: Einteilung der Lipide
Neutralfette bzw. Triglyceride machen mit >90 % den Hauptanteil der Nahrungslipide aus. Sie sind ein wichtiger Energielieferant (1 g Fett enthält 39 kJ Energie, 1 g Zucker nur 17 kJ). Außerdem bilden sie den wichtigsten Energiespeicher des Körpers (Zucker, d. h. Glucose, wird dagegen in viel geringerer Menge als Glycogen in der Leber gespeichert), sie sind ein guter Kälteschutz in der Haut und schützen diese auch vor Verletzungen. Alle wichtigen Organe werden durch einen Fettmantel geschützt. Triglyceride bestehen aus dem dreiwertigen Alkohol Gylcerin und drei Fettsäuren (Abb. 18):
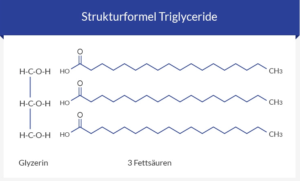
Abb. 18: Struktur eines Triglycerids
Fettsäuren sind meist unverzweigte Monocarbonsäuren, die aus einer Kette aus Kohlenstoffatomen bestehen, an deren einem Ende sich eine Carboxylgruppe befindet (siehe Abb. 18).
Unterschieden wird zwischen gesättigten Fettsäuren, in denen keine Doppelbindungen vorkommen, und ungesättigten Fettsäuren, die eine oder mehrere Doppelbindungen besitzen. Die einfachste gesättigte Fettsäure ist die Buttersäure und enthält nur vier Kohlenstoffatome. Ein wichtiger Vertreter der ungesättigten Fettsäuren ist z. B. die Ölsäure (einfach ungesättigt) und Arachidonsäure (vierfach ungesättigt). Je mehr Doppelbindungen Fettsäuren enthalten, desto niedriger liegt ihr Schmelzpunkt, sind also bei Raumtemperatur eher flüssig, z. B. bei Ölen. Ungesättigte Fettsäuren können vom tierischen Organismus nur unter Einschränkung synthetisiert werden. Man bezeichnet daher all jene Fettsäuren, die mit der Nahrung aufgenommen werden müssen als ‘essenzielle Fettsäuren’
Wachse unterscheiden sich von den Fetten dadurch, dass anstelle des Glycerins andere Alkohole als Grundsturktur eintreten (z. B. Myricylalkohol). Wachse sind ebenso wie Fette neutrale Verbindungen, die unpolare langkettige Kohlenwasserstoffreste enthalten. Daher sind sie nicht in Wasser löslich.
Neben tierischen Wachsen (z. B. Bienenwachs, Walrat) sind auch Pflanzenwachse bekannt, z. B. das Carnauba-Wachs, das für Autopolituren Verwendung findet.
Membranbildende Lipide sind Lipide, die einen hydrophilen und einen hydrophoben Teil besitzen – also amphiphil sind (Abb. 19). Dies erlaubt es ihnen, in polaren Lösungsmitteln wie Wasser je nach Beschaffenheit entweder Mizellen (kugelförmige Aggregate aus amphiphilen Molekülen, die sich spontan zusammenlagern) oder Doppellipidschichten bilden – wobei immer der hydrophile Teil mit dem polaren Lösungsmittel interagiert. Aus diesen Doppellipidschichten sind alle Biomembranen aufgebaut, welche den Inhalt einer Zelle gegen die Umgebung abgrenzt und somit membranbildende Lipide zu einer der Grundvoraussetzungen allen Lebens macht. Phospholipide haben eine Phosphatgruppe und bilden den Hauptbestandteil von Biomembranen. In diesen Substanzen ist Glycerin mit zwei Fettsäuren und Phosphorsäure verestert. Der Phosphorsäurerest besitzt eine negative elektrische Ladung und ist mit einem Alkoholrest (z. B. Ethanolamin, Cholin, Colamin, Serin, Inosit oder Glycerin) verbunden.
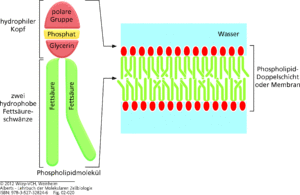
Abb. 19: Phospholipide lagern sich zusammen und bilden so die Zellmembranen. Phospholipide bestehen aus zwei hydrophoben Fettsäureschwänzen, die mit einem hydrophilen Kopf verbunden sind. In wässriger Umgebung lagern sich die hydrophoben Schwänze der Fettsäurelipide zusammen, um Wasser auszuschließen. Dadurch entsteht eine Doppelschicht, bei der die hydrophilen Köpfe jedes Phospholipids zum Wasser gerichtet sind.
Sphingolipide sind komplex aufgebaute Phospholipide, die gehäuft im Gehirn und im Nervengewebe anzutreffen sind. Im wichtigsten Vertreter, dem Sphingomyelin, ist anstelle des Glycerinrests der Aminoalkohol Sphingosin enthalten.
Als Isoprenoide (auch Terpenoide) werden Verbindungen bezeichnet, die auf Isopreneinheiten aufbauen. Zu diesen Lipiden zählende Verbindungen sind die Steroide und die Carotinoide. Der bekannteste Vertreter der Steroide ist das zu den Sterinen zählende Cholesterin. Es ist unter anderem auch ein essentieller Bestandteil aller Zellmembranen mit Ausnahme der Innenmembran der Mitochondrien, und kann somit im erweiterten Sinne auch zu den Membranlipiden gezählt werden. Auch die Sexualhormone sind Steroide.
Carotinoide sind Polymerisationsprodukte von Isopren, die ausschließlich in Pflanzen hergestellt werden und dort als gelb bis rötliche Farbstoffe fungieren.


