Im vorherigen Beitrag haben wir uns die verschiedenen Biomoleküle angesehen: Proteine, Kohlenhydrate und Lipide. Sie bilden den Grundaufbau unserer Zellen und liefern uns die Energie für unsere Lebenserhaltung. Sie sind also essentieller Bestandteil des Stoffwechsels.
Als Stoffwechsel oder Metabolismus bezeichnet man die gesamten chemischen und physikalischen Vorgänge der Umwandlung chemischer Stoffe bzw. Substrate in Zwischenprodukte und Endprodukte im Organismus von Lebewesen.
Chemische Reaktion, Oxidation & Reduktion
Chemisch betrachtet sind Stoffwechsel chemische Reaktionen. Eine chemische Reaktion ist ein Vorgang, bei dem eine oder meist mehrere chemische Verbindungen in andere umgewandelt werden und Energie freigesetzt oder aufgenommen wird.
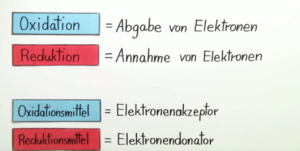
Zwei wichtige Begriffe hierbei sind Oxidation und Reduktion. Beide gehen immer mit einer Übertragung von Elektronen einher. Unter einer Reduktion versteht man die Aufnahme von Elektronen und eine Erniedrigung der Oxidationszahl.
Eine Oxidation ist eine Abgabe von Elektronen und eine Erhöhung der Oxidationszahl. Oxidation und Reduktion sind immer aneinandergekoppelt. Eine Oxidation kann nicht ablaufen, wenn die abgegebenen Elektronen nicht sofort in einer Reduktion aufgenommen werden können. Man kann zwar die beiden Prozesse räumlich voneinander trennen, jedoch müssen sie immer in Kontakt zueinanderstehen. Entsprechend spricht man von einer Redoxreaktion. Schauen wir uns das an einem einfachen Beispiel an.
Chemische Reaktionen werden in einer Reaktionsgleichung dargestellt. Links stehen die Ausgangsstoffe, die Edukte, rechts das Ergebnis, die Produkte. Bei einer Reaktionsgleichung müssen links und recht die gleiche Anzahl an Atomen stehen. Wir haben links als Edukte zwei Natriumatome und eine Chlor-Verbindung, die aus zwei Chloratomen zusammengesetzt sind. Natrium und Chlor reagieren zu NaCl. Da auf der Seite der Edukte je zwei Natrium und zwei Chloratome zu finden sind, entstehen bei den Reaktionsprodukten 2 NaCl. Die chemische Reaktion wird durch einen Reaktionspfeil dargestellt. Wir sehen hier aber, dass es zwei Pfeile gibt: einer zeigt in Richtung Reaktionsprodukt, der andere in Richtung der Edukte. Es handelt sich hierbei also um eine Redoxreaktion, die Reaktion kann also in beide Richtungen ablaufen.
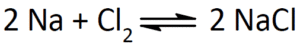
Abb. 1: Darstellung von Natriumchlorid aus den Elementen
Schauen wir uns daher an, wie in dieser Reaktion die Oxidation und wie die Reduktion verläuft (Abb. 2).
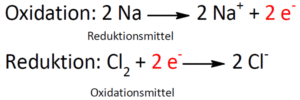
Abb. 2: Redoxreaktion von Natriumchlorid
Wir wissen aus dem Beitrag über die Grundlagen der Chemie, dass Natrium im Periodensystem in der ersten Hauptgruppe steht. Schaut euch dieses Video nochmal an, um den Rest zu verstehen. Es hat also ein Elektron auf der äußersten Schale und um den Edelgaszustand zu erreichen, gibt es gerne sein äußerstes Elektron ab. D. h. hier findet eine Oxidation statt: Natrium gibt sein Elektron ab. Die Natriumatome liefern die Elektronen und werden somit oxidiert. Aus den Natriumatomen entstehen zwei Natriumionen und zwei Elektronen. Dabei wird das Natrium zum Reduktionsmittel. Reduktionsmittel sind Verbindungen, die durch Abgabe von Elektronen eine Reduktion einer anderen Verbindung bewirken. Dabei werden sie selbst oxidiert.
Chlor steht in der VII. Hauptgruppe im Periodensystem, hat also sieben Elektronen auf der Außenbahn. Dem Chlor fehlt nur noch ein Elektron zum Edelgaszustand. Dieses nimmt entsprechend Elektronen auf, wird also reduziert. Damit fungiert Chlor als Oxidationsmittel. Oxidationsmittel sind die Verbindungen, die durch Aufnahme von Elektronen eine Oxidation einer anderen Verbindung bewirken. Dabei werden sie selbst reduziert.
Fassen wir also zusammen: Natrium gibt Elektronen ab, wird also oxidiert und zum Reduktionsmittel (weil es für die Reduktion des Chlors sorgt). Chlor nimmt Elektronen auf, wird reduziert und agiert als Oxidationsmittel, weil es für die Oxidation des Natriums sorgt.
In Redoxprozessen müssen immer alle abgegebenen Elektronen wieder aufgenommen werden. Es gibt keine frei diffundierenden Elektronen im Reaktionsmedium.
Exotherm, endotherm und Aktivierungsenergie
Soweit zu den Redoxreaktionen. Eine chemische Reaktion zwischen Natrium und Chlor läuft relativ schnell ab und quasi von selbst. Bei den Biomolekülen ist es etwas komplizierter.
Jede chemische Reaktion ist nicht nur mit einer Stoffumwandlung verbinden, sondern auch mit einer Energieumwandlung. Diese Energieumwandlung “ermöglicht” es, unter energetischen Gesichtspunkten eine chemische Reaktion zu unterteilen. Je nachdem, ob Energie (in Form von Wärme) an die Umgebung abgegeben oder aufgenommen wird, teilt man eine chemische Reaktion in eine exotherme oder endotherme Reaktion ein. Diese Einteilung in exotherm und endotherm hat aber keinen Einfluss auf die Aktivierungsenergie. In der Regel muss Aktivierungsenergie hinzugeführt werden, um die Reaktion zu aktivieren (so dass die Stoffe in einer messbaren Geschwindigkeit miteinander reagieren). Die Aktivierungsenergie ist also eine energetische Barriere, die bei einer chemischen Reaktion von den Reaktionspartnern überwunden werden muss. Wird diese Barriere überwunden, kommt es erst dann zur chemischen Reaktion. Allgemein gilt: Je niedriger die Aktivierungsenergie, desto schneller verläuft die Reaktion.
Sehen wir uns nun Beispiele für exotherme und endotherme Reaktionen an.
Exotherme Reaktion: Bei einer exothermen Reaktion wird Wärmeenergie an die Umgebung abgegeben. Eine typische exotherme Reaktion ist eine Verbrennungsreaktion. Der Ausgangsstoff, z. B. das Holz, das verbrannt werden soll, hat ein gewisses Energielevel. Aber das Holz alleine brennt nicht, es braucht eine Aktivierungsenergie. Das ist zum Beispiel die Energie, die du zuführst, wenn du das Holz anzündest. Dadurch fügst du dem System die Aktivierungsenergie zu und die Reaktion läuft ab: Das Holz verbrennt. Hierbei wird Energie freigesetzt in Form von Wärme, die Luft wird nämlich wärmer. Als Produkt der chemischen Reaktion entsteht die Holzkohle, das verbrannte Holz bzw. die Asche, die ein niedrigeres Energieniveau hat, als das Edukt Holz.
Endotherme Reaktion: Bei einer endothermen Reaktion wird Wärmeenergie aus der Umgebung aufgenommen. Daher laufen endotherme Reaktionen in der Regel nur solange ab, wie aus der Umgebung Energie zugeführt wird bzw. noch Ausgangsstoffe vorhanden sind. Stoppt bei einer endothermen Reaktion die Energiezufuhr aus der Umgebung, kommt in der Regel die Reaktion zum Stillstand. Ein Beispiel kennt, wenn ihr Kopfschmerzen habt und nen Aspirin nehmen müsst: die Braustablette. Beim Auflösen des Brausepulvers wird die Lösungsenergie für die Reaktion dem Wasser entzogen. Das Wasser kühlt sich bei diesem Vorgang etwas ab. Folglich wird Energie in Form von Wärme aus der Umgebung aufgenommen und die Reaktion ist damit endotherm.
Abb. 3 zeigt die Energiekurve von endothermen und exothermen Reaktionen.
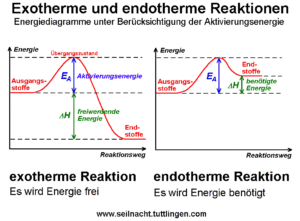
Abb. 3: Energieniveau von endothermen und exothermen Reaktionen.
Enzyme
Dasselbe Prinzip läuft auch in unseren Zellen ab. Merkt euch aber eines alle chemischen Reaktionen brauchen eine Aktivierungsenergie. Aber hier stehen wir vor einem gewaltigen Problem: Gerade unsere Biomoleküle: ob wir sie nun abspalten oder aufbauen brauchen eine sehr hohe Aktivierungsenergie. Sich selbst überlassen bei Raumtemperatur oder gar Körpertemperatur reagieren unsere Proteine, Fette und Zucker überhaupt nicht, weil es eine hohe Aktivierungsenergie braucht. Man braucht also etwas, was die chemischen Reaktionen schneller ablaufen lassen würde. Man spricht hierbei von Katalysatoren. Das sind Stoffe, die eine chemische Reaktion beschleunigen können, ohne aber selbst Teil der chemischen Reaktion zu werden, also selbst umgewandelt zu werden. Katalysatoren setzen die Aktivierungsenergie herab und ermöglichen die chemische Reaktion. Katalysatoren kennt ihr vielleicht am besten aus Autos, der gesundheits- und umweltschädliche Abgase in ungiftige Stoffe umwandelt. Doch die meisten unserer Stoffwechselreaktionen brauchen auch Katalysatoren. Unsere Katalysatoren, zumindest die wichtigsten, sind die Enzyme.
Enzyme sind Proteine, die als Biokatalysator biochemische Reaktionen im Organismus steuern und beschleunigen, ohne dabei selbst verändert zu werden. Sie sind in allen Körperzellen enthalten und sind unerlässlich für alle Körperfunktionen. So steuern Enzyme nicht nur die Verdauung, sondern den gesamten Stoffwechsel und sind damit ein wesentlicher Faktor für die Gesundheit.
Enzyme binden spezifisch ein oder einige wenige Substrate, indem sie mit ihnen einen reversiblen Enzym-Substrat-Komplex bilden. Als Enzym-Substrat-Komplex bezeichnet man den Übergangzustand aus Enzym und gebundenem Substrat, der bei einer enzymkatalysierten Reaktion im ersten Schritt gebildet wird (Abb. 4).

Abb. 4: Enzym-Substrat-Komplex
Die spezielle Hohlstruktur im Enzym bewirkt, dass das aktive Zentrum mit einem passenden Substrat in Kontakt treten kann. Enzyme können dadurch nur ein bestimmtes oder einige weniger Substrate umsetzen, was Substratspezifität genannt wird. Des Weiteren ist ein Enzym nur in der Lage, eine bestimmte Reaktion zu katalysieren, was man Reaktionsspezifität nennt. Ein Substrat kann dagegen von unterschiedlichen Enzymen umgesetzt werden. Es funktioniert also nach dem Schlüssel-Schloss-Prinzip.
Bei der Reaktion ist die Substratbindungsstelle, das aktive Zentrum, von Bedeutung, also der Ort, an dem das Substrat gebunden wird.
Oft können Enzyme ihre Wirkung erst dann entfalten, wenn sie von einem sogenannten Cofaktor oder mehreren Cofaktoren aktiviert werden. Das können Metall-Ionen (wie Eisen-, Kupfer- oder Zink-Ionen) oder aber organische Moleküle (wie Vitamine) sein.
Enzyme lassen sich in sechs Hauptgruppen einteilen, je nachdem, welche Art von chemischer Reaktion sie katalysieren. Diese Enzymklassen (und einige ihrer Untergruppen) sind:
1. Oxidoreduktasen: Sie katalysieren Reaktionen, bei denen Elektronen übertragen werden (Redoxreaktionen); z.B. Dehydrogenasen, Oxidasen, Reduktasen, Katalasen
2. Transferasen: Sie katalysieren Reaktionen, bei denen ganze funktionelle Gruppen (wie Phosphat-Gruppe) von einem Molekül auf ein anderes übertragen werden; z.B. Transaminasen, Kinasen, DNA-Polymerasen
3. Hydrolasen: Sie katalysieren Reaktionen, bei denen eine chemische Bindung entweder unter Wasseraustritt entsteht oder unter Wasseranlagerung gespalten wird; z.B. Peptidasen, Phosphatasen, Proteasen
4. Lyasen: Sie katalysieren Reaktionen, bei denen chemische Bindungen ohne Energieverbrauch gespalten oder gebildet werden; z.B. Aldolase
5. Isomerasen: Sie sorgen dafür, dass Bindungsverhältnisse innerhalb eines Moleküls neu geordnet werden; z.B. Racemasen, Topoisomerasen
6. Ligasen (Synthetasen): Sie katalysieren Reaktionen, bei denen zwei Moleküle unter Energieverbrauch miteinander verbunden werden; z.B. Carboxylasen
Enzymkinetik
Die Enzymkinetik beschäftigt sich mit dem zeitlichen Verlauf enzymatischer Reaktionen. Eine zentrale Größe hierbei ist die Reaktionsgeschwindigkeit. Sie ist ein Maß für die Änderung der Substratkonzentration mit der Zeit, also für die Stoffmenge Substrat, die in einem bestimmten Reaktionsvolumen pro Zeiteinheit umgesetzt wird (Abb. 5).
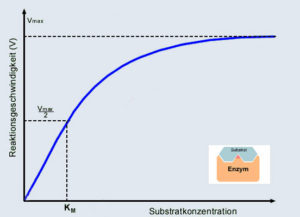
Abb. 5: Reaktionsgeschwindigkeit von Enzymen
Neben den Reaktionsbedingungen wie Temperatur, Salzkonzentration und pH-Wert der Lösung, hängt sie von den Konzentrationen des Enzyms, der Substrate und Produkte sowie von Effektoren (Aktivatoren oder Inhibitoren) ab (Abb. 6).
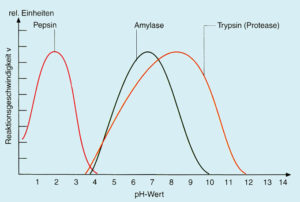
Abb. 6: Enzymaktivität in Abhängigkeit vom pH-Wert
Die gemessene Enzymaktivität ist proportional zur Reaktionsgeschwindigkeit und damit stark von den Reaktionsbedingungen abhängig. Sie steigt mit der Temperatur entsprechend der RGT-Regel an: eine Erhöhung der Temperatur um ca. 5-10 °C führt zu einer Verdoppelung der Reaktionsgeschwindigkeit und damit auch der Aktivität. Dies gilt jedoch nur für einen begrenzten Temperaturbereich. Bei Überschreiten einer optimalen Temperatur kommt es zu einem steilen Abfallen der Aktivität durch Denaturierung des Enzyms. Änderungen im pH-Wert der Lösung haben oft dramatische Effekte auf die Enzymaktivität, da dieser die Ladung einzelner für die Katalyse wichtiger Aminosäuren im Enzym beeinflussen kann (Abb. 6). Jenseits des pH-Optimums vermindert sich die Enzymaktivität und kommt irgendwann zum Erliegen.
Ein Modell zur kinetischen Beschreibung einfacher Enzymreaktionen ist die Michaelis-Menten-Theorie (Abb. 5 & 7).
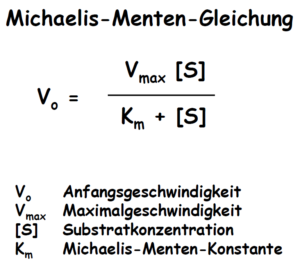
Abb. 7: Michaelis-Menten-Theorie
Sie liefert einen Zusammenhang zwischen der Reaktionsgeschwindigkeit v einer Enzymreaktion sowie der Enzym- und Substratkonzentration [E0] und [S]. Grundlage ist die Annahme, dass ein Enzym mit einem Substratmolekül einen Enzym-Substrat-Komplex bildet und dieser entweder in Enzym und Produkt oder in seine Ausgangsbestandteile zerfällt. Was schneller passiert hängt von den jeweiligen Geschwindigkeitskonstanten k ab.
Das Modell besagt, dass mit steigender Substratkonzentration auch die Reaktionsgeschwindigkeit steigt. Das geschieht anfangs linear und flacht dann ab, bis eine weitere Steigerung der Substratkonzentration keinen Einfluss mehr auf die Geschwindigkeit des Enzyms hat, da dieses bereits mit Maximalgeschwindigkeit Vmax arbeitet.
Enzyme können auch gehemmt werden, man spricht von Enzymhemmung und bezeichnet die Herabsetzung der katalytischen Aktivität eines Enzyms durch einen spezifischen Hemmstoff (Inhibitor, Abb. 8). Es gibt die irreversible Hemmung, bei der ein Hemmstoff eine unter physiologischen Bedingungen nicht umkehrbare Verbindung mit dem Enzym eingeht.
Und es gibt die reversible Hemmung, bei der der gebildete Enzym-Inhibitor-Komplex wieder in seine Bestandteile zerfallen kann. Bei der reversiblen Hemmung unterscheidet man wiederum zwischen
- kompetitiver Hemmung – das Substrat konkurriert mit dem Hemmstoff um die Bindung an das aktive Zentrum des Enzyms. Der Hemmstoff ist aber nicht enzymatisch umsetzbar und stoppt dadurch die Enzymarbeit;
- unkompetitiver Hemmung – der Hemmstoff kann ausschließlich an den Enzym-Substrat-Komplex binden. Er verhindert die katalytische Umsetzung des Substrates zum Produkt – und
- nicht-kompetitiver Hemmung – der Hemmstoff bindet sowohl an das freie Enzym als auch an den Enzym-Substrat-Komplex. Der Enzym-Substrat-Inhibitor-Komplex ist katalytisch inaktiv.
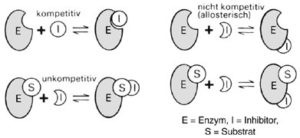
Abb. 8: Enzymhemmung
ATP
Für die in Zellen ablaufenden Prozesse wird Energie benötigt, da dabei chemische, osmotische oder mechanische Arbeit geleistet wird. Diese Energie muss in irgendeiner Form bereitgestellt werden. Dies geschieht über das Molekül Adenosintriphosphat, kurz ATP. Alle Abbauprozesse des Organismus dienen hauptsächlich der Erzeugung von Energie, die in Form des ATP gespeichert wird. Ein erwachsener braucht täglich etwa 70 kg ATP. Aber die Menge an ATP in unserem Körper beträgt etwa 50g. Das bedeutet letztendlich, dass ein Gramm ATP täglich etwa 1400mal recycelt werden muss. Aber was ist ATP genau?
Das Molekül des Adenosintriphosphats besteht aus einem Adeninrest, dem Zucker Ribose und drei Phosphaten (Abb. 9). Die Bindungen der drei Phosphatreste sind sehr energiereiche chemische Bindungen. Werden diese Bindungen durch Enzyme hydrolytisch gespalten, entsteht das Adenosindiphosphat (ADP) bzw. das Adenosinmonophosphat (AMP). Dabei werden jeweils etwa 32,3 kJ/mol oder 64,6 kJ/mol Energie frei. Diese freiwerdende Energie ermöglicht die Arbeitsleistungen in den Zellen. Aus dem bei der Energieabgabe aus ATP entstandenen AMP bzw. ADP regeneriert die Zelle das ATP. Die Regeneration des ATP geschieht über die Zellatmung.
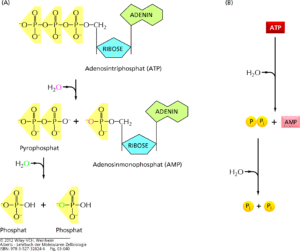
Abb. 9: ATP
Bei der Zellatmung werden Glukose, Sauerstoff und Wasser in den Mitochondrien zu Wasser und Kohlenstoffdioxid abgebaut. Durch diesen Abbau entsteht Energie in Form von Adenosintriphosphat.
Enzyme spalten dieses ATP in den Mitochondrien in ein Adenosindiphosphat (ADP) und ein freies Phosphat auf. Die dabei freigesetzte Energie wird in Form von Wärme abgegeben, überwiegend jedoch für die Muskelfunktion verwendet.
Anschließend muss das ADP jedoch wieder in ATP umgewandelt werden. So entsteht ein ewiger Kreislauf, der nur bei einer optimalen Versorgung mit Nährstoffen einwandfrei funktioniert.
Wir werden uns im nächsten Kapitel die entscheidenden Schritte der Zellatmung näher anschauen.


