Im ersten Kapitel befassten wir uns mit dem grundlegenden Aufbau der Zelle. Dort erwähnte ich, dass wir uns danach mit den biochemischen Grundlagen befassen werden. Doch vorher müssen wir sogar noch weiter ins Detail gehen. Wir starten nämlich mit den chemischen Grundlagen. Etwas, was vielen nicht behagt und manche sogar eine gewisse Abneigung verspüren. Aber diese nicht-biologischen Grundlagen sind insofern wichtig, um später bestimmte Stoffwechselprozesse leichter verstehen zu können.
Keine Angst: Ich werde mich auch hier nicht zu weit aus dem Fenster ragen und nur das wichtigste erklären.
In diesem Teil lernen wir, wie Atome aufgebaut sind und sie sich miteinander verbinden, etwas über das Periodensystem der Elemente und zum Ende wird es ein wenig nass, denn es geht ums Wasser.
Atome – Grundaufbau
Doch fangen wir ganz klein an. Wir haben gelernt, dass die Zelle die kleinste Einheit des Lebens ist. Doch in der Welt der Materie geht es natürlich kleiner. Zellen bestehen aus verschiedenen Verbindungen: Wasser, Proteine, Fette, Zucker, Vitamine usw. usf. Hierbei sprechen wir von Molekülen. Moleküle sind wiederrum aus Atomen zusammengesetzt.
Das Atom ist jeweils der kleinste Teil der Materie eines Elementes. Eine lange Zeit nahm man an, dass Atome der kleinste überhaupt existierende Teil der Materie sind. Atom heißt nämlich: unteilbar. Heute wissen wir natürlich, dass Atome ihrerseits aus subatomaren Teilchen bestehen. Die für uns bekanntesten subatomaren Teilchen und die, die für unsere Videoreihe völlig ausreichen, sind die Protonen und Neutronen, sowie die Elektronen (Abb. 1).
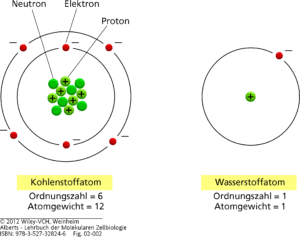
Abb. 1: Schematische Darstellung eines Kohlenstoffatoms und eines Wasserstoffatoms. Der Kern jedes Atoms außer Wasserstoff besteht aus positiv geladenen Protonen und elektrisch neutralen Neutronen. Die Zahl der Elektronen eines Atoms ist gleich der Protonenzahl, sodass das Atom keine Nettoladung trägt. Die Neutronen, Protonen und Elektronen sind in Wirklichkeit winzig im Vergleich zum Gesamtatom; ihre Größen sind hier stark übertrieben.
Also: Schauen wir uns die Abbildung 1 genauer an: Die Protonen sind die positive Ladung des Atoms und befinden sich im Atomkern. Ebenfalls im Atomkern befinden sich die Neutronen, die, wie ihr Name schon sagt, keine Ladung haben. Auf der Atomhülle befinden sich die negativ geladenen Elektronen. Der Atomkern bildet die größte Masse eines Atoms, nimmt aber den kleinsten Platz im Atom ein. Die Atomhülle mit ihren Elektronen nimmt hingegen das größte Volumen des Atoms an, wiegt aber nur einen verschwindend kleinen Bruchteil des Atomkerns. Die jeweiligen Elektronen bewegen sich auf bestimmten bahnen, die man als Orbitale oder in der vereinfachten Form Schalen bezeichnet. Die in Abb. 1. konzentrischen schwarzen Kreise repräsentieren stark schematisiert die „Orbitale“ (also die Verteilungen der Elektronen in der Atomhülle) der Elektronen.
Dieser Grundaufbau bei Atomen ist gleich: der Unterschied liegt in der Anzahl dieser subatomaren Teilchen. Das leichteste und kleinste Atom ist der Wasserstoff. Es hat im Kern ein Proton und in der Hülle ein Elektron. Würde man ein zweites Proton und ein zweites Elektron hinzufügen erhält man Helium, fügt man ein drittes Proton und ein drittes Elektron hinzu, erhält man Lithium usw. usf. Wie viele Elektronen sich in der Hülle befinden, hängt von der Anzahl der Protonen im Kern ab. Es befinden sich nämlich genauso viele negativ geladene Elektronen in der Atomhülle wie positiv geladene Protonen im Atomkern. Das gibt die sogenannte Ordnungszahl an. sie ist beim Wasserstoffatom 1, weil dieser je 1 Proton und 1 Elektron hat. Dadurch ist ein Atom insgesamt ungeladen. Je mehr Elektronen und Protonen hinzugefügt werden, desto schwerer wird das Atom und es entsteht ein anderes Element. Dies zeigt sich am Beispiel des Kohlenstoffatoms. Es hat die Ordnungszahl 6, hat also 6 Protonen und 6 Elektronen. Neben der Ordnungszahl gibt es das Atomgewicht. Elektronen sind sehr klein und haben vielleicht 0,0005% der Atommasse, sind also vernachlässigbar. Die Hauptmasse des Atoms befindet sich im Atomkern, dabei sind Protonen und Neutronen etwa gleich schwer. Kohlenstoff hat ein Atomgewicht von 12. Es hat 6 Protonen im Atomkern und 6 Neutronen. Beide zusammen ergeben das Atomgewicht.
Die Elektronen bewegen sich auf sogenannten Orbitalen, die oft in einem Schalenmodell vereinfacht dargestellt werden. Die innerste Schale trägt den Kennbuchstaben K. Jede weitere Schale ist dann mit fortlaufenden Buchstaben des Alphabets (L, M, N, usw.) betitelt. In jeder Schale gibt es eine maximale Anzahl an Elektronen. Für die K-Schale sind das zwei Elektronen. In die L-Schale passen höchstens acht Elektronen bis sie gefüllt ist und für die M-Schale beträgt die Maximalzahl 18 Elektronen, in der N-Schale haben 32 und in der O-Schale 50 Elektronen Platz.
Periodensystem der Elemente (PSE)
Auf diesem Prinzip beruht übrigens das Periodensystem der Elemente (Abb. 2). Dies ist das Ordnungssystem, die verschiedenen Elemente zu gruppieren. Der russische Chemiker Dimitri Mendelejew und der deutsche Chemiker Lothar Meyer haben dies unabhängig voneinander fast zeitgleich in den 1860er Jahren erkannt. Beide haben ihre Erkenntnisse Jahr 1869 in einer wissenschaftlichen Zeitschrift veröffentlicht.
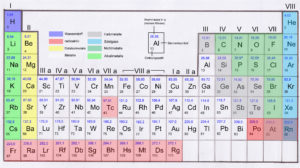
Abb. 2: Periodensystem
Grundsätzlich kann man den Aufbau des Periodensystems wie folgt beschreiben:
Alle Elemente werden durch ein Elementsymbol beschrieben. Wasserstoff wird mit H abgekürzt, Sauerstoff mit O, Kohlenstoff mit C und Stickstoff mit N. In Abb. 2 wird das Element Aluminium, abgekürzt durch Al hervorgehoben. An diesem werden wir den Rest des Periodensystems erklären.
Neben den Elementen stehen zwei Zahlen. Die untere Zahl ist die Ordnungszahl. Sie gibt die Zahl der Protonen im Atomkern an. Aluminium hat die Ordnungszahl 13. Damit hat es 13 Protonen im Atomkern – und folgerichtig 13 Elektronen in der Atomhülle. Die obere Zahl gibt die Atommasse an. Ihre Einheit ist Unit, abgekürzt u. 1 u ist ungefähr 1,66 x 10 -27 kg. 10 -27 bedeutet, dass hinter der null, 27 Nachkommastellen sind: 1u = 0,00000000000000000000000000166 kg.
Aluminium hat eine Atommasse von 26,96 u, also gerundet etwa 27. Wenn Aluminium schon 13 Protonen hat, beträgt die Differenz zu 27 u, die Anzahl der Neutronen. 27 – 13 = 14 Neutronen.
Das Periodensystem ist angeordnet in Zeilen und Spalten.
Die Zeilen sind die Perioden und sagen aus, wie viele Elektronenschalen das Element hat. Aluminium ist in der dritten Periode, hat also 3 Elektronenschalen, die letzte Schale ist die M-Schale.
Die Spalten stellen die Gruppen da. Es gibt 8 Hauptgruppen, dargestellt durch die römischen Zahlen. Zwischen Hauptgruppe II und III befinden sich die Nebengruppen, die wir erstmal ignorieren können. Gruppen sind Elemente mit ähnlichen Eigenschaften. Die Gruppe gibt an, wie viele Elektronen sich auf der äußersten Schale befinden. Aluminium ist in Hauptgruppe III. Auf seiner äußersten M-Schale befinden sich also 3 Elektronen. Das macht Sinn: Aluminium hat 13 Elektronen (siehe Ordnungszahl) und ist in Periode drei, hat also die K, L und M-Schale. Die K-Schale kann maximal 2 Elektronen aufnehmen, die L-Schale maximal 8. Damit hätten wir schon 10 Elektronen. Fehlen noch 3 Elektronen, um auf die 13 zu kommen. Die befinden sich nun auf der dritten Schale, also der M-Schale.
Übrigens hatte ich erwähnt, dass die M-Schale bis zu 18 Elektronen aufnehmen kann, die N-Schale (Periode 4) 31 und die O-Schale (Periode 5) sogar 50. Doch bei den 8 Hauptgruppen hat die äußerste Schale maximal 8 Elektronen (also Valenz- oder Außenelektronen).
Die verschiedene Farbgebung zeigt des Weiteren den Unterschied zwischen Metallen, Nichtmetallen etc. an. Für die Chemie des Lebens sind von den 111 Elementen tatsächlich ungleichverteilt. Abb. 3 zeigt den Anteil der wichtigsten Elemente im menschlichen Körper (rot) und auf der Erdkruste (blau).
Es fällt auf: der menschliche Körper besteht zu 60% aus Wasserstoffatomen.
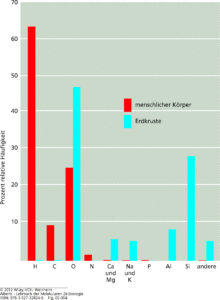
Abb. 3: Die Häufigkeit jedes Elements ist als Prozent der Gesamtzahl der Atome in einer biologischen oder geologischen Probe angegeben, einschließlich Wasser. Demnach sind mehr als 60 % der Atome in einem lebenden Organismus Wasserstoffatome.
Soweit das wichtigste zum Periodensystem.
Ionen und Ionenbindung
Atome haben den Drang dazu, ihre äußerste Schale voll zu kriegen, das wäre bei den Hauptgruppen 8 Elektronen auf der Außenschale (mit Ausnahme der ersten Schale, die maximal zwei Elektronen aufnehmen kann). Dies bezeichnet man als Edelgaszustand. Wenn man sich das PSE (Abb. 2) anschaut, sind die Edelgase Helium, Neon, Argon, Krypton und Xenon in der Hauptgruppe VIII. Damit ist ihre äußerste Stelle mit 8 Elektronen besetzt – diese Atome sind, wenn man es so will, glücklich. Doch was machen die anderen Elemente, die ebenfalls nach diesem Edelgaszustand streben? Es gibt mehrere Möglichkeiten:
Eine Möglichkeit wäre, überzählige Außenelektronen abzugeben oder fehlende aufzunehmen. Das ist bei Ionen der Fall. Denn geben sie Elektronen ab oder nehmen welche auf, entspricht ihre Zahl an Elektronen nicht mehr der Zahl der Protonen. Damit sind sie nicht mehr elektrisch neutral geladen, sondern positiv geladen (wenn sie zu wenig Elektronen haben) oder negativ (wenn sie mehr Elektronen als Protonen haben). Positiv geladene Ionen heißen Kationen, negativ geladene Ionen Anionen. Die Ladung eines Ions steht dann oben rechts am Atomsymbol.
Wenn man das Periodensystem soweit verstanden hat, kann man sich – zumindest was die Hauptgruppen angeht – gut vorstellen, welche Elemente eher Elektronen abgeben und welche aufnehmen.
Für die Elemente der ersten und zweiten Hauptgruppe ist es z. B. leichter ihre eine bzw. zwei Elektronen auf der Außenschale abzugeben. Elemente in den Hauptgruppen VI und VII neigen dann eher zusätzliche Elektronen aufzunehmen. Das kann man sehr gut an zwei Elementen zeigen: Natrium und Chlor (Abb. 4).
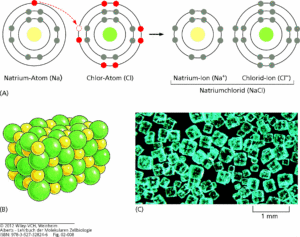
Abb. 4: Natrium und Chlor-Ionen. A) Ein Natriumatom (Na) reagiert mit einem Chloratom (Cl). Die Elektronen jedes Atoms sind in ihren verschiedenen Energieniveaus dargestellt. Die Elektronen in den chemisch reaktiven (unvollständig gefüllten) Schalen sind rot gezeichnet. Die Reaktion findet durch die Übertragung eines einzelnen Elektrons von Natrium auf Chlor statt. Dabei entstehen zwei elektrisch geladene Atome, oder Ionen, mit jeweils vollständigem Elektronensatz in der äußeren Schale. Die beiden Ionen mit entgegengesetzten Ladungen werden durch elektrostatische Anziehung zusammengehalten. (B) Das Produkt der Reaktion zwischen Natrium und Chlor ist das kristalline Natriumchlorid. Es besteht aus Natrium- und Chloridionen, die in einer regelmäßigen Anordnung dicht gepackt sind; dabei gleichen sich die Ladungen genau aus. (C) Farbphotographie von Natriumchloridkristallen.
Natrium befindet sich in der ersten Hauptgruppe und Periode 3. Es hat also 3 Elektronenschalen ein Außenelektron auf der dritten Schale. Dieses gibt er dann ab, so dass die dritte Schale leer wird und er mit der zweiten Schale den Edelgaszustand erreicht. Nun hat er aber ein Elektron zu wenig und wird dadurch positiv, also Na+. Chlor ist in der siebten Hauptgruppe und Periode drei. Es hat also 3 Elektronenschalen und auf der äußerten befinden sich 7 Elektronen. Um den Edelgaszustand zu erreichen, fehlt nur ein Elektron auf der äußersten Schale. Nimmt es ein zusätzliches Elektron auf, hat es den Edelgaszustand erreicht und ist negativ geladen: Cl–.
Die Fähigkeit zusätzliche Elektronen aufzunehmen, bezeichnet man als Elektronegativität.
Positive und negative Ladungen ziehen sich gegenseitig an. Wenn dies geschieht entstehen Ionenbindungen. Das ist vor allem bei Salzen der Fall. Wenn sich Natrium und Chlor gegenseitig anziehen, entsteht Natriumchlorid. Das ist das Salz welches wir in unserem Essen benutzen: übrigens macht es da keinen Unterschied ob wir Himalaya-Salz oder Meersalz nutzen. Wie andere rohe (unraffinierte) Steinsalze besteht es zu 97 bis 98 Prozent aus Natriumchlorid und einem geringen Anteil von anderen Mineralen wie Gips und Kaliumchlorid. Seine rötliche Färbung verdankt es den Eisenionen eines geringfügigen Anteils an Eisenoxidverunreinigungen. Einen gesundheitlichen Vorteil bietet das Himalayasalz nicht.
Wasserstoff z. B. gibt auch häufig sein Elektron ab und ist dadurch positiv geladen. Da ein positiv geladenes Wasserstoff-Atom (H+) nur aus einem Proton besteht, werden sie auch oft nur Protonen genannt.
Atombindung
Eine weitere Möglichkeit den Edelgaszustand zu erreichen ist die Elektronenpaarbindung, auch Atombindung oder kovalente Bindung genannt. Dies kann am Beispiel des Wassers verdeutlicht werden.
Wasser besteht aus einem Sauerstoffatom und zwei Wasserstoffatomen. Seine Verbindung wird entsprechend H2O genannt. H steht für das Wasserstoff, weil es zwei davon gibt, ist die Zahl zwei unten eingefügt, O steht für das Sauerstoff. Aber warum diese Verbindung?
Nun schauen wir ins Periodensystem: H steht in der Hauptgruppe 1 und hat 1 Außenelektron. Auf seine Schale passen maximal zwei Elektronen, dann hätte es den Edelgaszustand, ähnlich wie Helium erreicht. Sauerstoff steht in Hauptgruppe VI. Es hat also auf seiner Außenschale sechs Elektronen. Um den Edelgaszustand zu erreichen, tun sich die zwei Wasserstoffatome mit einem Sauerstoffatom zusammen (Abb. 5). Wasserstoff und Sauerstoff teilen sich entsprechend ein Elektronenpaar, so dass alle drei Atome jeweils eine volle Schale haben. Der Sauerstoff stellt zwei seiner sechs Außenelektronen den beiden Wasserstoffatomen zu Verfügung. Die vier verbliebenen Außenelektronen des Sauerstoffs bilden zwei freie Elektronenpaare. Im Gegensatz stellt das Wasserstoffatom dem Sauerstoffatom sein Elektron zu Verfügung. Mit jedem Wasserstoff geht der Sauerstoff jeweils eine Einfachbindung ein, da sie sich ein Elektronenpaar teilen.
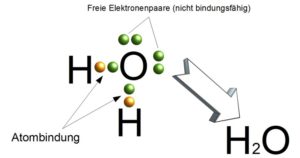
Abb. 5: Atombindung des Wassers
Neben einer Einfachbindung gibt es auch Doppel- und Dreifachbindungen.
Eine Doppelbindung kommt z. B. beim CO2 vor, dieses besteht aus einem Kohlenstoffatom, abgekürzt durch das C und zwei Sauerstoffatomen. Sauerstoff hat wie gesagt 6 Außenelektronen, hätte gerne zwei weitere für den Edelgaszustand. Kohlenstoff befindet sich in der IV. Hauptgruppe, hat also vier Außenelektronen. Um den Edelgaszustand zu erreichen, also 8 Elektronen auf der Außenschale zu besitzen, teil das Kohlenstoffatom seine 4 Außenelektronen mit Zwei Sauerstoffatomen. Mit jedem Sauerstoffatom teil es dann zwei Elektronenpaare (Abb. 6). Ein gemeinsames Elektronenpaar kann statt durch zwei Punkte auch durch einen Strich dargestellt werden, wie Abb. 6 zeigt.
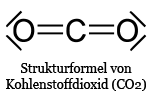
Abb. 6: Strukturformel des CO2
Isotope
Isotope sind Elemente mit gleicher Ordnungszahl, aber unterschiedlicher Massenzahl. D. h. zwei Isotope haben die gleiche Anzahl an Protonen (und Elektronen), aber die Zahl der Neutronen im Kern ist unterschiedlich. Dies kann am Beispiel des Wasserstoffs (H) verdeutlicht werden, von dem es drei Isotope gibt (Abb. 7):
Es gibt das „gewöhnliche“ Wasserstoff auch Protium genannt, das nur ein Proton im Atomkern hat. Es stellt übrigens 99,99% aller Wasserstoffisotope dar. Deuterium hat im Atomkern ein zusätzliches Neutron, Tritium zwei zusätzliche Neutronen. Deuterium und Tritium kommen in sehr geringen Mengen auf der Erde vor.
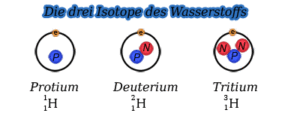
Abb. 7: Isotope des Wasserstoffes
Wasser
Das für uns wichtigste Molekül ist Wasser. Wasser zählt nicht nur für den Menschen zu den wichtigsten Stoffen auf der Erde, sondern das Leben ist untrennbar mit der Existenz von Wasser verbunden. Unser Körper besteht zu 70% aus Wasser. Klingt viel ist es aber nicht, wenn man bedenkt, dass Quallen zu 98-99% aus Wasser bestehen.
Mehr als die Hälfte des Wassers, etwa 55%, befindet sich innerhalb unserer Zellen. Der Rest des Wassers ist extrazellulär und findet sich im Blutplasma (8%), der Lymphflüssigkeit (22%), sowie im Bindegewebe, Knochen und Knorpel (15%).
Wasser wird auch als Lösungsmittel für biochemische Reaktionen gebraucht, sei es beim Stofftransport durch die Zellmembranen, der Erhaltung unserer Körpertemperatur oder als Lösungsmittel für unsere Ausscheidungen.
Chemisch betrachtet besteht Wasser, wie wir nun wissen, aus zwei Wasserstoffatomen und einem Sauerstoffatom. Diese Verbindung, obwohl sie so einfach ist, hat entscheidende physikalische Eigenschaften, die das Leben ermöglichen.
Wasser ist ein polares Molekül. Polarität bezeichnet in der Chemie eine durch Ladungsverschiebung in Atomgruppen entstandene Bildung von getrennten Ladungsschwerpunkten, die bewirken, dass eine Atomgruppe nicht mehr elektrisch neutral ist.
Schauen wir uns das Wassermolekül näher an (Abb. 5). Wir sehen, dass die Wasserstoffatome am Sauerstoffatom angewinkelt sind. Der Bindungswinkel zwischen den drei Atomen beträgt ungefähr 104-105°. Aber warum diese Winkelung? Das hat mit den zwei freien Elektronenpaaren des Sauerstoffs zu tun, die nicht in die Bindung mit dem Wasserstoff eingehen. Die brauchen ja Platz und entsprechend der Winkel. Das hat aber Konsequenzen für die Ladung des Wassermoleküls.
Beim Wassermolekül ist der mittlere Teil, also in der Nähe des Sauerstoffatoms mit den zwei freien Elektronenpaaren, negativer geladen, nach außen hin, in Richtung Wasserstoff, positiver. Die negativ geladenen Elektronen der Wasserstoffatome neigen also in Richtung des Sauerstoffatoms. Wasser ist also polar. Das hat mit der sog. Elektronegativität zu tun. Elektronegativität ist ein Maß für die Fähigkeit, von beiden Bindungspartnern geteilten Elektronen wie beim Tauziehen auf seine Seite zu holen. Und Sauerstoff hat eine höhere Elektronegativität als Wasserstoff, ist also beim Elektronentauziehen gegenüber dem Wasserstoff auf der Gewinnerseite. Diese Eigenschaft des Wassers macht ihn zu einem ganz besonderen Molekül. CO2 hingegen ist unpolar. Seine Bindungswinkel liegen bei 180° (Abb. 8).
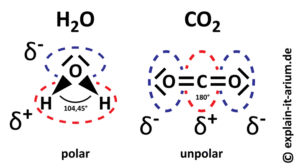
Abb. 8: Polarität des Wassers.
Zwischen den Wassermolekülen mit ihren teilweise positiven und teilweise negativen Ladungsenden treten Wechselwirkungen auf, die man als Wasserstoffbrückenbindungen bezeichnet werden. Das heißt eigentlich nur, dass ein Wassermolekül ein anderes Wassermolekül anzieht. Der teilweise positiv geladene Wasserstoffteil des einen Wassermoleküls zieht den teilweise negativ geladenen Sauerstoffatom des anderen Wassermoleküls an (Abb. 9). Solche Wasserstoffbrückenbindungen kommen auch bei anderen Molekülen vor, die für die Zellbiologie sehr wichtig sind, so bei der DNA.
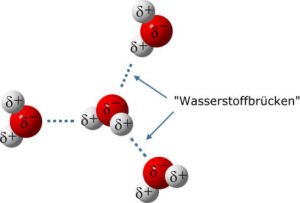
Abb. 9: Wasserstoffbrückenbindung
Diese Wasserstoffbrückenbindungen spielen in der Biochemie eine sehr wichtige Rolle, da sie die Reaktionsfähigkeit der Moleküle stark beeinflussen. Für das Wasser hat es besonders wichtige Konsequenzen:
Wasser hat eine besondere Eigenschaft, die es von fast allen anderen Flüssigkeiten unterscheidet. Es hat bei 4 °C sein kleinstes Volumen und damit seine größte Dichte. Bei 0 °C wird Wasser fest, also zu Eis. Bei anderen Stoffen haben feste Aggregatzustände eigentlich eine höhere Dichte. Nicht so beim Wasser. Eis hat eine geringere dichte als 4°C warmes flüssiges Wasser. Deswegen schwimmt in einem gefrorenen Gewässer Eis oben. Die Eisschicht, die sich an der Oberfläche kalter Gewässer bildet, isoliert die flüssige Phase von einer noch kälteren Luft und bewahrt somit das Leben unter dem Eis vor dem Erfrieren! Dieses nicht normale thermische Verhalten von Wasser wird in der Physik als Anomalie des Wassers bezeichnet (Abb. 10)
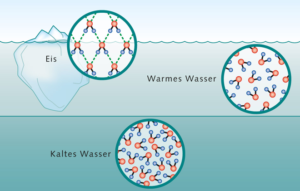
Abb. 10: Dichte des Wassers. Wasser mit 4°C hat die höchste Dichte
Wasser besitzt eine hohe spezifische Wärmekapizität. Das ist die Energie, die nötig ist, um die Temperatur von einem kg Wasser um ein Grad Celsius zu erhöhen. Eine hohe Wärmekapizität bedeutet, dass es nicht so leicht ist, Wasser zu erhitzen. Außerdem hat Wasser eine hohe Verdampfungsenthalpie. Die Verdampfungsenthalpie ist die Energie, die aufgebracht werden muss, um eine gegebene Menge einer Flüssigkeit bei gegebener Temperatur zu verdampfen (Abb. 11). Aufgrund der hohen Verdampfungsenthalpie und Wärmekapizität des Wassers können Meere und Seen eine beträchtliche Menge Energie aufnehmen und abgeben, ohne dass sich die Temperaturen drastisch ändern würden. Dieses Phänomen hilft auch bei der Kontrolle der Körpertemperatur der Organismen.
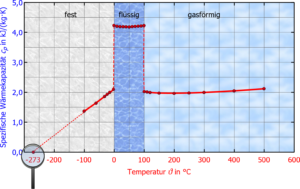
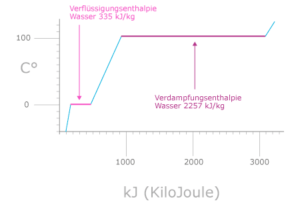
Abb. 11: Wäremkapazität und Verdampfungsenthalpie von Wasser
Aber die wichtigste Eigenschaft des Wassers: Es ist ein optimales Lösungsmittel. Im Wasser können sich problemlos andere polare Substanzen oder Ionen auflösen. Deswegen löst sich Salz im Wasser, denn Salze sind Ionenverbindungen. Und deswegen können wir Bier und Cola trinken: denn Alkohol und Zucker haben ebenso polare Eigenschaften. Unpolare Stoffe, z. B. Fette und Öle, sind nicht polar und lösen sich nicht im Wasser. Polare Moleküle werden aufgrund ihrer Fähigkeit sich im Wasser zu lösen als hydrophil bezeichnet, unpolare Moleküle, die sich nicht im Wasser lösen, als hydrophob. Haben Moleküle sowohl hydrophile wie hydrophobe Eigenschaften oder Enden, sind sie amphipathisch. Hört sich alles irgendwie nach psychologischen Störungen an …
In wässrigen Lösungen – besonders in biologischen Systemen – ist die Konzentration der Wasserstoffionen, also der Protonen (H+) von Bedeutung. In wässrigen Lösungen neigt das Wassermolekül (H2O) in äußerst geringem Maße der sog. elektrolytischen Dissoziation. Unter Dissoziation versteht man in der Chemie den angeregten oder den selbsttätig ablaufenden Vorgang der Zerlegung eines Moleküls in zwei oder mehrere einfachere Moleküle, Atome oder Ionen. Das Wassermolekül dissoziiert in ein Wasserstoff-Ion (H+) und ein Hydroxid-Ion (OH-) -> H2O = H+ + OH- (Abb. 12)
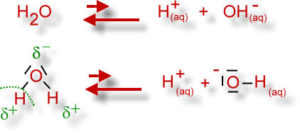
Abb. 12: Dissoziation von Wasser
Diese Ionen haben bestimmte Eigenschaften: Die Protonen (H+,) wirken als starke Säure, die Hydroxid-Ionen (OH-) als starke Base. In reinem Wasser liegen diese Ionen bei 25 °C in gleicher Konzentration vor, d.h. im Verhältnis 1:1. Der pH-Wert hat den Wert 7, Wasser ist also neutral. Wenn sich dieses Verhältnis verändert, ändert sich auch der pH-Wert: mehr Protonen (H+) und weniger Hydroxid-Ionen (OH-) => Lösung wird saurer => pH-Wert sinkt. Weniger Protonen (H+) und mehr Hydroxid-Ionen (OH-) => Lösung wird basischer/alkalischer => pH-Wert steigt (Abb. 13).

Abb. 13: pH-Werte
Biologische Systeme sind damit beschäftigt ihren pH-Wert aufrechtzuerhalten. In unserem Blut finden alle lebenswichtigen Stoffwechselvorgänge in einem sehr begrenzten pH-Bereich von 7,35-7,45 statt. Wird dieser Bereich über- oder unterschritten, kommt es zu ernsten Problemen, die im schlimmsten Fall zum Tode führen können. Sinkt der pH-Wert im Blut um mehr als 0,2 Einheiten, das Blut wird also „saurer“, spricht man von Azidose. Ein entsprechender Anstieg führt zur Alkalose (Abb. 14). Wie der pH-Wert im Blut konstant gehalten wird, wird ein anderes Mal behandelt.
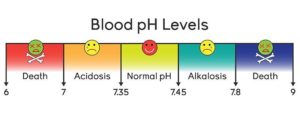
Abb. 14: pH-Wete des Blutes


