Gesteine gehören zu unserem Leben, bilden teilweise eine Lebensgrundlage. Wir bauen damit Häuser, manche schreiben ihnen eine heilende Wirkung zu, für andere sind sie gerade gut genug, um damit zu werfen. In diesem Beitrag befassen wir uns mit den Grundlagen der Mineralogie.
Text als pdf (deutsch)
English Version (pdf)
Die Elemente der Erdkruste
Für das bessere Verständnis, ist es ratsam sich über die Grundlagen des Aufbaus von Atomen schlau zu machen. Hierzu gibt es auch einen Beitrag meinerseits, den ich ihr anschauen könnt.[1]
Es gibt über 100 Elemente im Periodensystem, aber die meisten von ihnen sind in geologischen Umgebungen äußerst selten. Es stellt sich heraus, dass es nur acht Elemente in der Erdkruste gibt, die über 99% aller Gesteine auf der Erde ausmachen. Diese sind Sauerstoff, Silizium, Aluminium, Eisen, Calcium, Natrium, Kalium und Magnesium. Das sind die „Big Eight“ (Abb. 1).

Abb. 1: Elemente der Erdkruste
Ein durchschnittliches Gestein enthält 46 Gewichtsprozent, aber 94 Volumenprozent Sauerstoff! Warum ist das so? Sauerstoff ist nicht nur ein leichtes Element, sondern sein Ion hat auch einen großen Radius. Warum ist Sauerstoff mit Abstand am häufigsten? Wenn wir uns die anderen häufigen Elemente der Erdkruste ansehen, stellen wir fest, dass Sauerstoff als einziges ein Anion bildet (Abb. 2); und etwas muss alle positiven Ladungen der verbleibenden sieben Kationen ausgleichen. Sauerstoff ist in Luft und Wasser sehr reichlich vorhanden und verbindet sich daher mit fast jedem Kation.

Abb. 2 Ionenradien einiger Anionen und Kationen
Als nächstes im Überfluss kommt Silizium, das (wie Kohlenstoff) ein Element ist, das sich leicht zu langen Ketten verbindet und komplexe dreidimensionale Strukturen bildet. Dies ist wichtig bei der Herstellung der üblichen gesteinsbildenden Mineralien, die meist Kombinationen aus Silizium und Sauerstoff, also Silikate, sind.
An dritter Stelle liegt Aluminium, das ebenfalls ein Element ist, das sich leicht mit Silizium zu komplexen dreidimensionalen Anordnungen verbindet, so dass viele Silikatmineralien reich an Aluminium sind. Diese drei Elemente waren bei der Erdentstehung zufällig die häufigsten gesteinsbildenden Elemente.
Die verbleibenden fünf häufigen Elemente kommen viel seltener vor als die „Großen Drei“, und machen nur jeweils 5% oder weniger der Erdkruste aus. Alle fünf sind metallische Kationen, die sich mit Sauerstoff oder mit komplexen Silikatstrukturen verbinden, um die große Vielfalt an Mineralien zu bilden. Beachtet, dass sie unterschiedliche Ladungen haben: Natrium und Kalium sind beide Kationen mit einer Ladung von +1. Sie können sich manchmal in einem Mineral ersetzen, da sie die gleiche Ladung haben. Ebenso sind Calcium und Magnesium sowie Eisen (Fe2+) gängige +2-Kationen und können in vielen Mineralien einander ersetzen. Etwa 1,5% der Erdkruste bestehen aus Elementen, die nicht zu diesen „Großen Acht“ gehören.
Noch überraschender ist, welche Elemente in den „Großen Acht“ nicht enthalten sind. Wasserstoff und Helium sind die häufigsten Elemente in einem Großteil des Sonnensystems, insbesondere der Sonne und der äußeren Planeten (Jupiter, Saturn, Uranus, Neptun). Aber sie sind auf der Erde selten, außer dort, wo Wasserstoff mit Sauerstoff zu Wasser verbunden wird.
Warum? Als sich die Erde bildete, war sie nicht groß genug, um eine starke Schwerkraft zu haben, um diese Elemente festzuhalten, und sie schwebten in den Weltraum. Riesenplaneten wie Jupiter und Saturn haben viel mehr Masse und damit mehr Gravitation, und sie haben Wasserstoff und Helium in sich. Phosphor und Schwefel sind ebenfalls relativ selten und nur in speziellen Umgebungen konzentriert. Am überraschendsten ist vielleicht, wie selten Kohlenstoff in Krustengesteinen ist. Kohlenstoff ist schließlich der Baustein allen Lebens! Es gibt einige Mineralien und Gesteine, die Kohlenstoff enthalten, aber im Vergleich zu Silikaten sind sie selten.
Minerale
Jetzt, da wir die Grundlage der in der Erdkruste verfügbaren Elemente haben, wollen wir sehen, wie sie zu komplexeren Molekülen, die als Mineralien bekannt sind, kombiniert werden. Das Wort „Mineral“ hat in der Populärkultur alle möglichen beiläufigen und inkonsistenten Bedeutungen, aber für Geologen und Chemiker hat es eine sehr strenge und klare Definition. Ein Mineral kommt natürlich vor, ist anorganisch, hat eine bestimmte kristalline Struktur, hat eine bestimmte chemische Zusammensetzung und hat charakteristische physikalische Eigenschaften.
Besprechen wir diese Eigenschaften einzelnen.
Natürlich vorkommend: Es gibt viele komplexe Verbindungen auf der Welt, aber wenn sie nicht natürlich produziert werden, sind sie keine Mineralien. Ein in einem Labor hergestellter synthetischer Diamant hat also alle Eigenschaften eines aus der Erde gewonnenen Diamanten, ist aber technisch gesehen kein Mineral. Als Eiskristalle oder Schneeflocken gebildetes Eis ist mineralisch, aber nicht das Eis in unseren Eiswürfeln im Colaglas. Die meisten Dinge, die in einem Reformhaus verkauft werden und die als „Mineralstoffe“ bezeichnet werden, wurden synthetisch hergestellt und sind daher kein Mineral, wie ein Wissenschaftler das Wort verwendet.
Anorganisch: Organische Stoffe bestehen aus dem Element Kohlenstoff, daher bestehen Mineralien normalerweise nicht aus Kohlenstoff. Es gibt jedoch eine Handvoll wichtiger Mineralien mit Kohlenstoff (wie das Mineral Calcit oder CaCO3), daher verwenden wir in diesem Zusammenhang „organisch“ für Stoffe mit Kohlenstoff-Wasserstoff-Bindungen, wie wir es bei den Nährstoffen wie Zuckern, Aminosäuren und Fetten kennen. Zucker bildet zwar schöne Kristalle, ist aber aufgrund seiner Kohlenwasserstoff-Verbindungen organisch und daher nicht mineralisch.
Eindeutige kristalline Struktur: Wie das Wort „Mineral“ hat das Wort „Kristall“ für einen Wissenschaftler eine andere Bedeutung als in der Populärkultur. Normalerweise verwenden die Leute das Wort “Kristall”, um alles zu beschreiben, was funkelt. Nach wissenschaftlicher Definition muss ein Kristall in seiner inneren Struktur eine regelmäßige dreidimensionale Anordnung von Atomen aufweisen, die sich immer wieder wiederholt. Diese dreidimensionale Anordnung wird als Gitter bezeichnet. Es ist analog zum sich regelmäßig wiederholenden Muster in Tapeten. Zum Beispiel sind die Atome des Salzkristalls (Natriumchlorid oder NaCl, Abb. 3) in einem kubischen Muster angeordnet, wobei jedes Natrium- oder Chloratom einen 90°-Winkel mit den anderen bildet. Das gleiche Gitter findet sich im Mineral Bleiglanz, das zu gleichen Teilen aus Blei und Schwefel besteht (Bleisulfid oder PbS). Alle Minerale haben ein regelmäßiges dreidimensionales Gitter, oft sehr komplex und mit vielen anderen Winkeln zwischen den Atomen außer den 90°, die man im einfachen kubischen Gitter sieht.
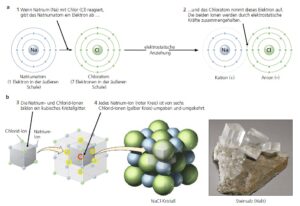
Abb. 3: Kristallstruktur von NaCl
Einige Dinge in der Natur können eine dreidimensionale Anordnung von Atomen haben, aber sie sind nicht regelmäßig und wiederholen sich nicht. Nehmen wir zum Beispiel vulkanisches Glas oder Obsidian. Auf molekularer Ebene befinden sich die Atome in keinem sich wiederholenden Muster, sondern in einem zufälligen Knäuel langer Ketten, wie eine Schüssel Spaghetti. Technisch gesehen ist ein Glas eigentlich gar kein Feststoff, sondern eine unterkühlte Flüssigkeit. Über sehr lange Zeiträume fließt das Glas langsam und verändert seine Form. Dies wird klar, wenn Sie jemals ein Stück Fensterglas in einem sehr alten Haus sehen. Wenn es etwa ein Jahrhundert in seinem Fensterrahmen liegt, wird das Glas unten dicker, weil es im Laufe der Jahrzehnte langsam bergab geflossen ist. Somit ist ein Glas per Definition kein Kristall. Ein beliebter Artikel in vielen Souvenirläden sind Trinkkelche und Kronleuchter aus „geschliffenem Kristall“, aber dies ist nicht die Definition von „Kristall“, die Wissenschaftler verwenden.
Bestimmte chemische Zusammensetzung: Die meisten Mineralien haben eine einfache chemische Formel. Es ist ein bisschen Substitution, also ein Austausch eines Ions durch ein anderes, erlaubt, Zum Beispiel kann das Mineral Calcit (Calciumcarbonat oder CaCO3) einen bestimmten Prozentsatz an Magnesium aufweisen, das Calciumstellen in seinem Gitter ersetzt und immer noch Calcit ist. Wird es jedoch 50:50 Ca/Mg, dann ist es kein Calcit mehr, sondern ein anderes Mineral, Dolomit.
Charakteristische physikalische Eigenschaften: Die meisten der von uns diskutierten Eigenschaften der Mineralien treten auf atomarer Ebene auf. Um das Mineral zu identifizieren, muss man jedoch wissen, welche physikalischen Eigenschaften für ein kleines Stück des Minerals typisch sind. Dazu gehören seine Farbe, seine Härte (von weichen Mineralien wie Gips bis zum härtesten Mineral Diamant), ob es mit einer unregelmäßigen Oberfläche bricht oder eine Spaltung aufweist und in viele parallele Ebenen bricht (Abb. 4), sowie weniger häufig verwendete Eigenschaften wie die Dichte (Bleisulfid oder Bleiglanz beispielsweise ist ungewöhnlich dicht, weil es Blei enthält), Reaktion auf Säure (das Mineral Calcit sprudelt in verdünnter Salzsäure) und Magnetismus (das Mineral Magnetit ist von Natur aus magnetisch). Viele dieser Eigenschaften von Mineralien können durch die Kenntnis des Kristallgitters verstanden werden.
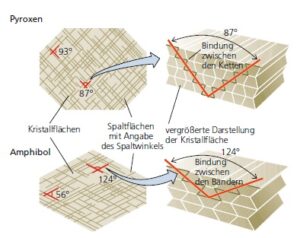
Abb. 4: Spaltbarkeit von Mineralen
Die atomaren Eigenschaften und das Kristallgitter können das Verhalten eines Minerals auf makroskopischer Ebene stark beeinflussen. Nehmen wir als Beispiel die beiden gängigen Mineralien aus reinem Kohlenstoff: Diamant und Graphit (Abb. 5). Der eine ist der härteste Stoff der Natur und der andere der weichste, dennoch sind sie chemisch identisch. Warum sind sie so unterschiedlich? Diamant hat ein Kristallgitter, bei dem alle Kohlenstoffatome fest miteinander verbunden sind und sehr kurze, starke chemische Bindungen haben. Diese Struktur hält großen Belastungen stand, und ein erfahrener Diamantschleifer muss genau wissen, wie man einen großen Stein in mehrere kleinere teilt. Graphit (die „Mine“ in einem Bleistift) hingegen hat alle seine Kohlenstoffatome in Schichten angeordnet, mit sehr langen, sehr schwachen molekularen Bindungen zwischen den Schichten. Es reicht aus, die Graphitspitze eines Bleistifts über das Papier zu schieben, um diese schwachen Bindungen zu lösen, und hinterlassen winzige Graphitflocken als Bleistiftmarkierungen auf dem Papier.
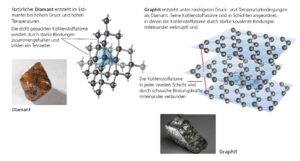
Abb. 5: Diamant und Graphit
Ein weiteres Beispiel ist Calciumcarbonat oder CaCO3 in zwei verschiedenen Mineralgittern: Calcit (das häufigste Mineral in Kalksteinen und Marmor) und Aragonit (auch bekannt als „Perlmutt“, Abb. 6). Sie haben die gleiche Chemie, aber ihre Gitter sind sehr unterschiedlich und führen zu sehr unterschiedlichen Eigenschaften. Die offensichtlichste davon ist, dass Aragonit viel besser löslich ist als Calcit, sodass sich Aragonit unter schwach sauren Bedingungen auflöst, Calcit jedoch nicht.
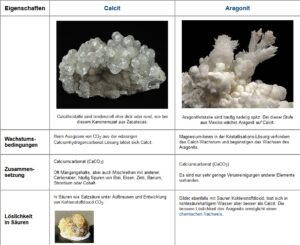
Abb. 6: Calcit und Aragonit
Bei einigen Mineralien reicht es also nicht aus, die chemische Zusammensetzung zu kennen; Das Kristallgitter macht auch einen großen Unterschied in den Eigenschaften des Minerals.
Mineralklassen
Es gibt buchstäblich Tausende von verschiedenen Arten von Mineralien, aber die meisten lassen sich aufgrund ihrer chemischen Zusammensetzung in nur wenige Klassen einteilen. Es gibt keinen Raum, sie alle in einer kurzen Einführung wie dieser zu besprechen, aber ihre wichtigsten Merkmale sollten besprochen werden. Die Mineralklassen sind: Oxide, Halogenide, Sulfide, Sulfate, Carbonate und Silikate (Abb. 7).
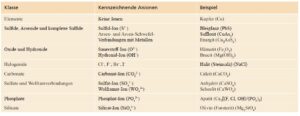
Abb. 7: Mineralklassen
Oxide bestehen aus einem Kation und Sauerstoff, wie es bei verschiedenen Eisenoxiden der Fall ist.
Halogenide aus einem Kation und einem Halogen, wie Chlor. Kochsalz (NaCl) wäre hierfür ein Beispiel.
Sulfide sind eine Verbindung von Kationen mit Schwefel, wie es bei Pyrit (FeS2) der Fall ist.
Sulfate hingegen bestehen aus einem Kation und Schwefelsäure, wie es bei Gips der Fall ist.
Carbonate bestehen aus einem Kation mit Verbindung von Kohlensäure, wie wir es von Calcit und Aragonit kennen.
Silikate sind hingegen Verbindungen aus Silizium, Sauerstoff und einem Kation und bilden die häufigsten Minerale der Erdkruste.
Hinzu kommen die reinen Elemente wie Kupfer, Gold, Silber und Diamanten, die aus nur einem Element bestehen.
Alle Silikate haben den gleichen Grundbaustein: das Silizium-Sauerstoff-Tetraeder oder die SiO4-Einheit (Abb. 8). Jede Klasse von Silikatmineralien verwendet diese grundlegenden Bausteine immer wieder und verknüpft sie zu immer komplexeren Strukturen.
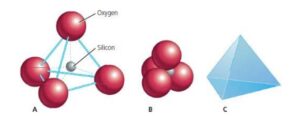
Abb. 7: Silizium-Sauerstoff-Tetraeder
Die einfachsten silikatischen Mineralstrukturen (Abb. 8a) sind aus isolierten Tetraedern aufgebaut, bei denen die Silizium-Sauerstoff-Bausteine (SiO4) nicht direkt aneinanderbinden, sondern durch die elektrostatischen Ladungen der Kationen (insbesondere Magnesium und Eisen) zwischen ihnen in dem Gitter. Gemeinsame einzelne tetraedrische Mineralien sind das grüne Mineral Olivin, [(Mg, Fe)SiO4] ist, und Granat, das aus SiO4-Tetraedern mit einer Vielzahl von Kationen aufgebaut ist, um die sechs Hauptarten von Granaten herzustellen (von rotbraunem Almandin bis grünem Grossular und mehrere andere).
Die nächst komplexere Anordnung findet sich bei den Pyroxene (Abb. 8b), die die SiO4-Tetraeder zu langen Einzelketten verknüpft haben. Zu den üblichen Pyroxenen gehört das matt grünlich-schwarze Mineral Augit (MgSiO3) sowie Jadeit, eines der beiden Mineralien, die den schönen Edelstein Jade ausmachen. Die Spaltwinkel bei Pyroxenen liegen bei 90 Grad.
Der nächste Schritt in der Silikatkomplexität besteht darin, zwei Einzelketten nebeneinander zu verbinden, um eine zweikettige Silikatstruktur zu erzeugen, ähnlich wie die Schienen einer Eisenbahnstrecke miteinander verbunden sind. Doppelkettige Silikate sind als Amphibole (Abb. 8c) bekannt und ihre Gitterstruktur verleiht den Handproben durch Spaltwinkel von etwa 60° oder 120° (technisch 56° und 124°), ihre diagnostischste Eigenschaft. Das häufigste Amphibol ist das glänzende pechschwarze prismatische Mineral, das als Hornblende bekannt ist und in vielen magmatischen und metamorphen Gesteinen vorkommt.
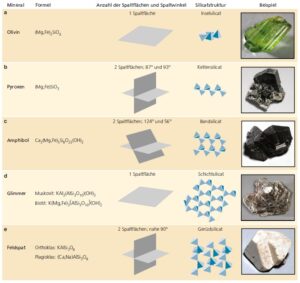
Abb. 8: silikatische Mineralstrukturen
Sobald wir eine Doppelkettenstruktur haben, besteht die nächst komplexere Anordnung darin, die Doppelketten nebeneinander zu verbinden, um Schichtsilikate zu bilden. Schichtsilikate bestehen aus zwei Schichten Silizium-Sauerstoff-Tetraeder („t“), die eine Schicht aus Aluminium-Sauerstoff-Oktaedern („o“) einschließen. Diese “t-o-t” -Struktur kann mit einem Oreo-Keks verglichen werden, wobei die “t” -Schichten durch die Schokoladenkeksschichten und die “o” -Schicht die cremige Füllung repräsentieren. Die meisten Schichtsilikate bestehen aus Stapeln von „t–o–t“-Strukturen mit anderen Materialien (verschiedene Arten von Kationen, Wassermolekülen), die zwischen den „t–o–t“-Schichten eingeschlossen sind. Die bekanntesten Schichtsilikate sind eine Klasse von Mineralien, die als Glimmer (Abb. 8d) bekannt sind und sich dadurch auszeichnen, dass sie sich in große, flache, dünne Schichten spalten. Der silberweiße Glimmer ist als Muskovit bekannt, und bevor es möglich war, Glasfenster herzustellen, wurden große Muskovit-Platten (genannt „Singlass“) als Fenster und Vorhänge verwendet. Es gibt auch einen gewöhnlichen schwarzen Glimmer, der als Biotit bekannt ist, einen grünen Glimmer, der als Chlorit bezeichnet wird, und einen lithiumreichen lavendelfarbenen Glimmer, der als Lepidolith bekannt ist, den wir in vielen verschiedenen Gesteinsarten sehen können. Neben den Glimmern sind alle Tonmineralien, aus denen die Schlämme der Welt bestehen, Schichtsilikate; Aus diesem Grund sind sie die am häufigsten vorkommenden Minerale auf der Erde.
Wir haben uns die Silikate von isolierten Tetraedern zu Einzelketten über Doppelketten hin zu Schichten angesehen, wobei jede Struktur immer komplexer wird. Der letzte Schritt besteht darin, das Silizium-Sauerstoff-Tetraeder zu einer komplexen dreidimensionalen Gerüststruktur zu verbinden. Einige der häufigsten und wichtigsten Mineralien sind Gerüstsilikate. Das wichtigste davon ist Quarz aus reinem Siliziumdioxid (SiO2), einem der am häufigsten vorkommenden Sedimentmineralien der Erde. Die andere wichtige Klasse von Gerüstsilikaten umfasst die aluminiumreichen Feldspäte (Abb. 8e), die am häufigsten vorkommenden Mineralien in magmatischen Gesteinen. Zwei Arten von Feldspäten sind besonders wichtig: die rosafarbenen Kaliumfeldspäte (KAlSi3O8), die in drei Mineralformen (Orthoklas, Mikroklin und Sanidin) vorkommen, und die Plagioklas-Feldspäte. Sie wandeln sich kontinuierlich von reinem kalziumreichem Plagioklas, bekannt als Anorthit, zu intermediären Plagioklasen mit einer Mischung aus Calcium und Natrium hin zu reinem, natriumreichem Plagioklas, bekannt als Albit, um. Plagioklas-Kristalle zeigen typischerweise viele feine parallele Linien, die als Streifen auf ihren Spaltflächen bekannt sind. Plagioklase sind typischerweise die am häufigsten vorkommenden Mineralien in den meisten magmatischen Gesteinen.
Dies sind viele Mineralnamen, die es zu meistern gilt, insbesondere für Studienanfänger, aber dies ist die Mindestanzahl an Mineralien, die erforderlich ist, um die Gesteine zu verstehen, die auf der Erdoberfläche und in ihrem Inneren vorkommen. Wenn man die Möglichkeit hat, von jedem dieser Mineralien Handproben zu studieren, ihre Eigenschaften zu testen und miteinander zu vergleichen, machen die Namen mehr Sinn und werden mit viel Erfahrung und Übung leicht zu merken. Fast jeder Geologiestudent beherrscht diese Mineralien nach den ersten paar Stunden, also ist es gar nicht so schwer zu lernen. Es braucht nur Übung! Sobald wir Ihre Mineralien kennen, können wir die Gesteine verstehen, die daraus entstehen.
Die Gesteine, die Mineralien bilden, werden wir uns im nächsten Beitrag näher ansehen.
Literatur
Bahlburg, H. & Breitkreuz, C. (2017): Grundlagen der Geologie, 5.Auflage. Springer Verlag; Kapitel 1 und 9
Grotzinger, J. & Jordan, T. (2017): Press/Siever Allgemeine Geologie, 7. Auflage, Springer Verlag; Kapitel 3
Prothero, D. (2021): The Evolving Earth. Oxford University Press, Kapitel 2
[1] https://internet-evoluzzer.de/molekularbiologie-der-zelle-teil-2-atome-periodensystem-und-atombindung/