Wir befassten uns in den vorherigen Abschnitten mit der Frage ob Arten real sind und wie wir diese definieren. Des Weiteren kam auch der Prozess der Artbildung zur Sprache. Gerade dieser Aspekt soll in diesem Teil näher untersucht werden, indem aktuelle Beispiele für Isolationsmechanismen und Artbildungsprozesse dargestellt werden.
Beispiele für Isolationsmechanismen
Viele Arten haben unterschiedliche Fortpflanzungszyklen. Zwei verwandte Arten der Feldgrillen (Gryllus pennsykvanicus und G. veletis) paaren sich zu unterschiedlichen Jahreszeiten, eine im Herbst, die andere im Frühjahr (Harrison 1979). Viele Arten haben auch unterschiedliche Habitatansprüche. Zwei Marienkäfer der Art Henosepilachna nipponica und H. yasutomii auf Japan nutzen unterschiedliche Nahrungspflanzen. Beide Arten pflanzen sich auch nur auf der bevorzugten Nahrungspflanze fort, sodass ein Genaustausch verhindert wird (Katakura & Hosogai 1994). Zwei Korallenarten im Atlantik, Montastraea annularis und M. franksi, geben im Abstand von 1,5 – 3 Stunden ihre Gameten ins Wasser ab. Diese Zeit reicht aus, dass die Gameten der einen Art nicht die Gameten der anderen Art, die ihre Gameten zu einem etwas späteren Zeitpunkt ins Wasser gibt, befruchten kann (Knowlton et al. 1997).
Viele Arten sind voneinander isoliert, weil sie unterschiedliche Lebensräume oder unterschiedliche ökologische Nischen einnehmen. Lynch (1978) beschrieb die Habitatisolation bei den Fröschen Rana blairi und R. pipiens, deren Verbreitung im US-Bundesstaat Nebraska überlappt. Während R. blairi schlammige Gewässer bevorzugt, präferiert R. pipiens klare Gewässer.
Mayr (1947) entdeckte, dass der Geradschwanzdrongo (Dicrurus ludwigii), eine Vogelart aus Afrika, sich hauptsächlich am Waldrand und in Lichtungen aufhält. Der nah verwandte Trauerdrongo (Dicrurus adsimilis) hält sich eher in bewaldeten Gebieten auf.
Viele Tierarten erkennen sich an äußeren Merkmalen, z. B. der Farbe des Gefieders, Duftstoffen oder Balzverhalten. Fitis (Phylloscopus trochilus) und Zilpzalp (Phylloscopus collybita) sind zwei unscheinbare bräunliche Vogelarten, die in Europa brüten (vgl. Abb. 1). Beide Arten sind einander sehr ähnlich, lassen sich aber durch ihren Gesang leicht voneinander unterscheiden. Entsprechend reagieren diese Vogelarten auf den Gesang ihrer Paarungspartner und sind so voneinander isoliert.
Solch eine „auditorische“ Isolation liegt nicht nur bei Vögeln vor, sondern z. B. auch bei Fröschen (für die Froschgattung Physalaemus siehe Ryan & Rand 1993). Aufgrund verschiedener Unterschiede in der Gefiederfärbung und im Balzverhalten erkennen sich die verschiedenen Entenarten untereinander. Tatsächlich kommen aber Hybriden bei verschiedenen Enten- und Gänsearten vor. Von 67 von 161 Arten weiß man, dass Hybriden auftreten. Doch hier herrscht im Wesentlichen eine postzygotische Isolation vor, wodurch die Arten als diskrete Einheiten bestehen bleiben (Grant & Grant 1992, Price & Bouvier 2002).

Abb. 1: Fitis (Phylloscopus trochilus) und Zilpzalp (Phylloscopus collybita), zwei einander ähnlich sehende Arten, die sich am besten durch ihren Gesang voneinander unterscheiden lassen.
Affenblumen der Gattung Mimulus haben unterschiedliche Bestäuber. Mimulus lewisii hat pinke Blüten mit weiter Blütenkrone und gelben Staubblättern und wird von Bienen bestäubt. Mimulus cardinalis hat rote, enge und röhrenförmige Blüten und wird von Kolibris bestäubt (Schemske & Bradshaw 1999, Abb. 2). Hybridisierungs-Experimente dieser Arten zeigen, dass die Bestäuber auf entsprechende Blütenmerkmale reagieren (vgl. Abb. 2). Pflanzenarten sind auch dadurch genetisch voneinander isoliert, an welcher Körperstelle der Pollen an den Bestäuber abgesetzt wird. Die schwedischen Orchideenarten Planathera bifolia und P. chlorantha unterscheiden sich u. a. im Abstand zwischen den Pollenpaketen voneinander. So gelangt der Pollen bei P. bifolia an den Saugrüssel von Schmetterlingen, der Pollen von P. chlorantha haftet hingegen an den Augen von Motten. Durch Unterschiede in der Blütenmorphologie locken diese Orchideenarten jeweils andere Bestäuber an (Nilsson 1983). Isolation durch verschiedene Bestäuber wird als eine der bedeutendsten Isolationsmechanismen bei Orchideen angesehen (Paulus & Gack 1990). Aber auch andere Isolationsfaktoren wirken, z. B. Blütezeiten, Habitat-Isolation und postzygotische Isolation durch das Scheitern der Hybriden Bestäuber anzulocken (z. B. Dressler 1981). Die Orchideenart Satyrium hallackii kommt im südlichen Afrika vor und hat zwei Unterarten: S. h. ocellatum in den Grasländern und S. h. hallackii in den Küstengebieten. Die Unterart im Grasland wird von Schwärmern bestäubt, die Unterart an der Küste von Bienen. Die Unterschiede zeigen sich auch in der Blütenmorphologie. Hier ist also eine Isolation durch Bestäuber mit einer geographischen Isolation verbunden (Johnson 1997). Auch bei anderen Pflanzengruppen besteht ein Zusammenhang zwischen Bestäuber und Pflanze. Die 750 Feigenarten (Gattung Ficus) werden nur durch Wespen der Familie Agaoinidea bestäubt (Janzen 1979), Yucca-Palmen durch Yucca-Motten (Powell 1992).

Abb. 2: A Mimulus lewisii, C M. cardinalis, B, D, E, F: Hybriden der beiden Arten
Eine andere Form der Isolation liegt vor, wenn die Geschlechtsorgane von Sexualpartnern nicht nach dem „Schlüssel-Schloss-Prinzip“ vorliegen. Man spricht von mechanischer Isolation. Hierzu liegen aber nur wenige Studien vor, die diese Hypothese belegen. Aber Eberhard (1996) konnte bei verschiedenen Drosophila-Arten belegen, dass Weibchen den Paarungsakt und somit den Spermientransfer beenden, wenn die männlichen Genitalien die des Weibchens nicht lange genug durch taktile Stimulation versorgen. Aber selbst der Spermientransfer ist keine Garantie für eine Befruchtung. Von einigen Waldgrillen (Gattung Nemobius) ist bekannt, dass bei einer Befruchtung artfremdes Sperma gegenüber des Spermas der gleichen Art unterlegen ist. Dieses Phänomen wird als Spermienpriorität unter Artgleichen bezeichnet (Howard 1999).
Eine gametische Isolation liegt vor, wenn Keimzellen zweier Arten sich nicht verschmelzen können, also eine Befruchtung verhindert wird, selbst wenn sich Ei- und Spermazelle begegnen. Eine Form der Isolation, die besonders bei Arten wichtig ist, die eine äußere Befruchtung aufweisen, wie bei vielen marinen Wirbellosen und Fischen der Fall. Unterschiede in Zelloberflächenproteinen sorgen dafür, dass sich Spermien nicht an die Eizelle anheften oder in diese eindringen können (Palumbi 1998). Palumbi & Metz (1991) belegten dies u. a. bei vier sympatrisch lebenden Seegurkenarten der Gattung Echinometra, deren Artbildung zu einer hohen Wahrscheinlichkeit durch eine Inkompatibilität der Keimzellen hervorgegangen ist. Bei Seeohren, einer Gruppe großer Meeresschnecken (Gattung Haliotis), ist bekannt, dass Spermienproteine nur die Dotterhülle der Eizelle der gleichen Art auflösen können, was das Eindringen des Spermiums ermöglicht. Verschiedene Haliotis-Arten haben in ihren Keimzellen entsprechende Unterschiede in der Aminosäuresequenz in den Membranproteinen (Galindo et al. 2003).
Kommt es jedoch tatsächlich zu einer Verschmelzung der Keimzellen verschiedener Arten, so liegt eine postzygotische Isolation vor. Die entstehenden Hybriden sind entweder nicht lebensfähig, steril oder haben eine andere Fitness. In teil eins haben wir in Bezug zur Hybridisierung festgestellt, dass, wenn Hybriden lebensfähig sind, häufig das heterogametische Geschlecht steril ist. Heterogametisch sind jene Organismen, die über zwei unterschiedliche Geschlechtschromosomen verfügen, bei Säugetieren sind das die Männchen (XY). Dieses Phänomen wird nach ihrem Entdecker „Haldane’s rule“ (Haldanes Regel) genannt (Haldane 1922). Das hat übrigens zur Konsequenz, dass sich die fruchtbaren, homogametischen, Hybriden nur mit den Elternarten paaren können (z. B. weibliche Mulis nur mit männlichen Pferden oder männlichen Eseln), nicht aber mit den heterogametischen Hybriden des anderen Geschlechtes. Bei Vögeln sind die Weibchen heterogametisch und bei einer Hybridisierung entsprechend steril oder haben eine geringe Fitness. Buckley (1969) hat dies bei den sog. Unzertrennlichen, also der Papageiengattung Agapornis beobachten können. Weibliche Hybriden von Rosenköpfchen (Agapornis roseicollis) und Schwarzköpfchen (Agapornis personatus) reagierten nicht auf das Balzverhalten von Männchen und waren nicht in der Lage ein Nest zu bauen.
Genetische Grundlagen der prä- und postzygotischen Isolation
Die graduelle Divergenz der Arten wurde in mehreren Studien belegt. Bei Drosophila willistoni konnten größere Unterschiede bei Allozymen (=Enzyme, die von einem Genlocus/Genort codiert werden, für den es mehrere Allele gibt) zwischen den Unterarten festgestellt werden, als innerhalb derselben Unterart. Die genetische Distanz (D) zwischen den einzelnen Populationen, gemessen anhand der Allozym-Allelen-Frequenz, kann als molekulare Uhr genutzt werden, um die Abweichung zeitlich zu rekonstruieren (Ayla et al. 1974). Coyne & Orr (1989, 1997) nutzten solche Informationen, um die Zeitspanne der reproduktiven Isolation graphisch darzustellen und nutzen dabei die Studien zu Drosophila, die im Zeitraum von 60 Jahren durchgeführt wurden. Sie kamen dabei zu wichtigen Schlussfolgerungen:
- Die Stärke der prä- und postzygotischen Isolation nimmt, nachdem Populationen voneinander getrennt wurden, graduell zu. Damit ist die Artbildung ein gradueller Prozess.
- Die Zeit, bis eine völlige Fortpflanzungsbarriere erreicht ist, variiert, liegt aber bei einem durchschnittlichen Wert von 1,5-3,5 Mio. Jahren (bei Drosophila). Aber eine ganze Anzahl an Arten entwickelte sich innerhalb von einer Millionen Jahren.
- Zwischen kürzlich aufgespaltenen Populationen oder Arten ist die präzygotische Isolation (also bevor eine Fortpflanzung stattfindet) stärker als eine postzygotische. Dies trifft aber im besonderen Maße für sympatrisch lebende Taxa bzw. Arten zu.
- In den frühen Phasen der Artbildung zeigt sich die Sterilität der Hybriden fast immer bei männlichen Tieren. Postzygotische Isolationsmechanismen evolvieren also bei Männchen schneller als bei Weibchen.
Die meiste Forschung über die Genetik der Fortpflanzungsbarrieren wurde an Drosophila-Arten durchgeführt, nicht zuletzt aufgrund der intensiven Erforschung dieses Modellorganismus der klassischen Genetik. Coyne (1984) analysierte die Sterilität bei Kreuzungen von Drosophila simulans und D. mauritiana, bei der die Männchen der ersten Generation steril sind, die Weibchen jedoch fruchtbar. Rückkreuzungsexperimente konnten zeigen, dass die entstandenen männlichen Hybriden Genregionen in den Chromosomen aufwiesen (5 genetische Marker), die die Spermienbeweglichkeit beeinträchtigen und so zu ihrer Sterilität führen. Bei Rückkreuzungsexperimenten werden die (mischerbigen und fruchtbaren) weiblichen Hybriden mit den Männchen der Elterngenerationen gekreuzt, um so die Auswirkungen von rezessiven (= nicht in Erscheinung tretenden) Mutationen ermitteln zu können. Wu & Hollocher (1998) entdeckten mehrere molekulare Marker – 40 auf dem X-Chromosom und 120 im gesamten Genom – bei D. mauritiana und D. sechellia, die zur Sterilität führen. Presgraves et al. (2003) ermittelten sogar 200 Gene, die zur Sterilität der Hybriden bei D. simulans und D. melanogaster führen. Einer dieser Gene codiert für ein Kernporen-Protein (NPC-Protein), nämlich das Nup96. Kernporen sind jene Verbindungsstellen zwischen Zellkern und Zellplasma, die u. a. den Transport von Molekülen (u. a. auch der mRNA) zwischen Zellkern und Zellplasma ermöglichen. Dieses Gen und auch das Protein unterscheiden sich bei D. simulans und D. melanogaster, weshalb Kreuzungen beiden Arten dazu führten, dass die Hybriden nicht lebensfähig sind. Bei Fischen der Gattung Xiphophorus sind die Hybriden nicht lebensfähig, weil diese Melanome ausbilden (Wittbrodt et al. 1989).
Tatsächlich sind aber so viele Gene gar nicht notwendig, damit Hybriden steril werden. Bei einer Unterart von D. pseudoobscura in Kolumbien, die vor weniger als 200.000 Jahren sich von einer nordamerikanischen Unterart abgespalten hat, zeigen Kreuzungsexperimente, dass 4 Genregionen für die Sterilität der männlichen Hybriden ausreichend sind (Orr & Irving 2001). Während diese genetischen Marker bei den Hybriden zur Sterilität führen, haben sie bei den einzelnen Arten keinerlei Auswirkungen. Die Sterilität ist also Folge der Wechselwirkung zwischen den Genen der einzelnen Arten (Wu & Hollocher 1998). Dies ist u. a. ein Beleg für Mayrs (1963) Hypothese, dass Arten mit einem getrennten, angepassten Genpool übereinstimmen und dass die Interaktion solcher verschiedenen Genpools zu Problemen für die Hybriden führt.
Auch die präzygotische Isolation kann durch genetische Marker festgestellt werden. Die männlichen Genitalien unterscheiden sich bei Drosophila simulans und D. mauritiana, die so zu einem vorzeitigen Kopulationsabbruch führen, korrelieren mit 19 Genloci (Zeng et al. 2000). Sexuelle Isolation, die auf Pheromone basiert, korreliert ebenso mit wenigen genetischen Loci, so z. B. bei der Motte Ostrichia nubilalis (Roelofs et al. 1987).
Am Beispiel von Mimulus cardinalis und Mimulus lewisii (vgl. Abb. 2) konnten Wissenschaftler jüngst zeigen, dass für die Entstehung neuer Arten Änderungen in nur wenigen Genen ausreichen. Beide Arten können sich unter natürlichen Bedingungen nicht mehr gegenseitig befruchten, im Gewächshaus dagegen ist eine Kreuzung möglich. Um zu klären, welche Gene die Entwicklung der ersten Art aus der zweiten bewirken, wurde die gekoppelte Vererbung von ca. 150 Gensequenzen, die auf 8 Chromosomen liegen und sich bei beiden Arten unterscheiden, untersucht. Nachdem ermittelt worden war, welche der Sequenzen mit 8 ausgewählten Merkmalen zusammen vererbt werden, konnte festgestellt werden, wie viele Gene nötig sind, damit sich die eine Art aus der anderen entwickelt. Anhand der genetischen Karten konnte festgestellt werden, dass schon 3 Erbänderungen eine große Wirkung auf die Blütenmerkmale haben können (Bradshaw et al. 1998).
Auch das Zellplasma kann an der Isolation von Arten beteiligt sein. Wolbachia ist eine parasitisch lebende Bakteriengattung, die hauptschlich Insekten, aber auch andere Arthropoden und Nematoden befällt. Man schätzt, dass 25-70% aller Insektenarten von dieser Bakterienart befallen sind (Taylor 2018, Kozek & Rao 2007). Sie sind auch dafür bekannt, dass sie häufig in den Geschlechtsorganen ihrer Wirte leben und so deren Fortpflanzung beeinflussen können. Dabei bevorzugen sie Eizellen, nicht jedoch Spermazellen. Um die Verbreitung von Wolbachia zu fördern, hat diese Bakteriengattung eine Reihe von Strategien entwickelt (Abb. 3).
– das Töten infizierter Männchen während der Larvenentwicklung, wodurch die Rate der geborenen und infizierten Weibchen erhöht wird (Hurst et al. 1999).
– Feminisierung infizierter Männchen, was häufig bei Schmetterlingen vorkommt (Fuji et al. 2001).
– Förderung der Parthenogenese. So z. B. bei der Wespen-Gattung Trichogramma, welche sich durch die Präsenz von Wolbachia ohne Männchen fortpflanzt (Murray 2009).
– Verhinderung einer Befruchtung nicht infizierter Weibchen durch cytoplasmatische Inkompatibilität (Werren 1998).

Abb. 3: links: Wolbachia-Bakterien innerhalb einer Insektenzelle, rechts: Einfluss von Wolbachia auf die Fortpflanzung
Beispiele der Artbildung
Die oben beschriebenen Beispiele zur Isolation verdeutlichen, wie einzelne Arten voneinander reproduktiv isoliert sind. An dieser Stelle soll es nun darum gehen, wie diese Isolationsmechanismen entstehen, wie es also zur Bildung neuer Arten kommt. In Teil 2 hatten wir die verschiedenen Möglichkeiten der Artbildung vorgestellt (vgl. auch Abb. 4):
- Allopatrische Artbildung (Populationen sind vollständig voneinander isoliert, z. B. durch geographische Barrieren wie Berge, Flüsse, Klimazonen etc.
- Peripatrische Artbildung, auch als Gründereffekt-Speziation bezeichnet: Sie ist eine hypothetische Form der allopatrischen Artbildung, bei der eine isolierte Population mit kleinem Verbreitungsgebiet in der Peripherie der Elternpopulation entsteht.
- Parapatrische Artbildung: In biogeographisch benachbarten Teilregionen des räumlich zusammenhängenden Verbreitungsgebiets der Ursprungsart entsteht durch die Besetzung einer neuen ökologischen Nische eine neue Art.
- Sympatrische Artbildung: Es entsteht eine Fortpflanzungsbarriere innerhalb einer Population ohne gleichzeitige geografische Isolation.
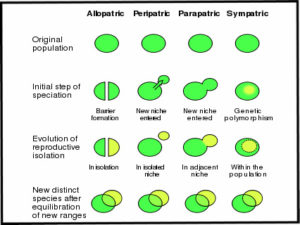
Abb. 4: Formen der Artbildung
Die allopatrische Artbildung ist die am besten dokumentierte Form der Artbildung. Einige Beispiele sollen erwähnt werden. Allopatrische Artbildung wird immer mit dem Entstehen geographischer Barrieren in Verbindung gebracht.
Die Entstehung der mittelamerikanischen Landbrücke (Isthmus von Panama) vor 3 Mio. Jahren im Pliozän trennte viele Meeresorganismen in eine pazifische und eine karibische Population. Im pazifischen, wie auch im karibischen Teil, herrschen unterschiedliche Temperaturen, Lebensgemeinschaften, Salzgehalt und Gezeitenschwankungen (Rubinoff 1968), sodass sich bei vielen Gruppen getrennte Arten entwickeln. Hierzu zählen z. B. die Pistolenkrebse der Gattung Alephus (Knowlton et al. 1993).
In vielen Regionen ersetzen sich allopatrische Arten einander, bilden sogenannte Schwesterarten, so die Leopardenfrösche in Nordamerika (Hillis et al. 2004, 2007, Hillis 1988). Die Arten sind durch verschiedene Habitate, Paarungszeiten, Paarungsrufe und geringerer Lebensfähigkeit der Hybriden voneinander isoliert.
Die Flora Ostasiens und des östlichen Nordamerikas zeigen eine ganze Reihe von Gemeinsamkeiten auf, mit vielen gemeinsamen Gattungen und Familien, die interessanterweise im westlichen Nordamerika fehlen (Xiang et al. 1998, Wen 1999). Diese Tatsache wirkt erstmal befremdlich, dann wenn es einzelne Pflanzenfamilien gibt, die z. B. in China und der amerikanischen Ostküste vorkommen, wieso fehlen diese dann an der Westküste Nordamerikas (welches geographisch näher an Ostasien liegt und durch den Pazifik getrennt ist)? Fossile Befunde zeigen jedoch auf, dass im späten Miozän das Klima an der Westküste Nordamerikas trockener wurde und Wälder durch Graslandschaften ersetzt wurden und viele Arten sich nur noch an der Ostküste halten konnten. Xiang et al. (2000) untersuchten elf nah verwandte Artenpaare, mit je einer Art in Nordamerika und einer Art in Ostasien.
Ein weiteres Beispiel der allopatrischen Artbildung sind die Wüstenkärpflinge (Gattung Cyprinodon), die im Death Valley und benachbarten Gebieten Kaliforniens vorkommen. In dieser Gegend gibt es mehrere kleine Seen, die Reste eins ehemals größeren Gewässers darstellen. In dieser Region gibt es nach Duvernell & Turner (1998,1999) mindestens drei allopatrisch lebende Arten und 7 Unterarten.
Avise et al. (1994, 2000) konnten herausfinden, dass die Florida-Halbinsel in Nordamerika als eine geographische Barriere für einen genetischen Austausch dient. Neun Arten aus verschiedenen Gruppen kommen entlang der Nordost-Küste der USA über Florida hin zum Golf von Mexiko vor (. Z. B. der Pfeilschwanzkrebs Limulus polyphemus oder die Strandammer Ammodramus maritimus). Untersuchungen der mitochondrialen DNA (mtDNA) zeigen, dass die Florida-Halbinseleinen scharfen Bruch darstellt.
In Südamerika gibt es viele Regionen, bei der die Verbreitungsgebiete diverser Tiergruppen übereinstimmen, z. B. bei Vögeln und Tagfaltern. Diese Übereinstimmung wird u. a. auf diverse Refugien zurückgeführt: Während der Eiszeit wurden die Regenwaldgebiete kleiner und es blieben mehrere isolierte Waldinseln zurück. In diesen Waldinseln entwickelten sich die dortigen Tier- und Pflanzengruppen in neue Arten. Mit Ausbreiten der Wälder während der Warmperioden konnten sich die Arten ebenfalls ausbreiten. Diese Waldrefugien zeichnen sich auch durch einen höheren Grad der Artenvielfalt und einen höheren Grad an nur in diesen ehemaligen Refugien vorkommenden Arten (sog. Endemiten) aus. Solche Waldrefugien sind für Südamerika (z. B. Haffer 1969) und Afrika (z. B. Bollig & Bünnagel 1992, Martin 1989, Maley et al. 2017) gut dokumentiert. Abb. 5 dokumentiert die Verbreitung der Waldrefugien im Amazonas-Regenwald mit der Verbreitung der Kurzschnabel-Tukane (Gattung Selenidera), Abb. 6 zeigt die Waldrefugien Zentralafrikas.
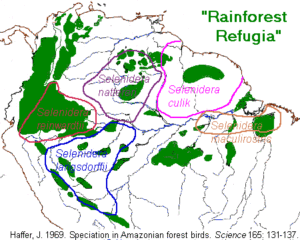

Abb. 5: Verbreitung der Waldrefugien und der Kurzschnabel-Tukane (Gattung Selenidera) in Südamerika
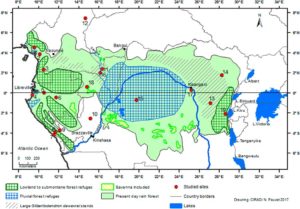
Abb. 6: Verbreitung der Waldrefugien (schraffiert in blau und grün) innerhalb Afrikas nach Maley et al. 2017).
Haffer (1969) untersuchte dabei die Verbreitung der Vögel im Amazonasgebiet im Zusammenhang der Refugien (Vgl. Abb. 5). Für Pflanzen, Säugeitere und Schmetterlinge liegen weitere Studien vor (Prance 1982, Hall & Harvey 2002). Hall & Harvey untersuchten die Phylogenie und Verbreitung der monophyletischen Schmetterlings-Gattung der Charis cleonus Gruppe, die 19 Arten aufweist. Innerhalb dieser Gruppe bewohnen Schwesterarten geographisch getrennte Gebiete. Es wurden 7 Endemismus-Zentren für die Gattung Charis ausgemacht, die identisch sind mit den Endemismus-Zentren für Reptilien, Primaten, Nagetiere, Beuteltiere, Vögel und andere Schmetterlinge. Somit liegen kräftige Indizien für die Bedeutung von Wald-Refugien für den Amazonas vor. Dennoch spielen auch weitere Isolationsfaktoren eine bedeutende Rolle: Gebirgszüge (Anden, Hochland von Guyana), Flüsse oder klimatische Unterschiede (Räsänen et al. 1995). Für Westafrika sind Waldrefugien u. a. für die Artbildung bei Kapuzenspinnen (Murienne et al. 2013), Spitzmäusen (Jacquet et al. 2013), Lianen (Illoh 2017) und Gorillas (Anthony et al. 2007) verantwortlich.
Coyne & Price (2000) untersuchten die endemischen Vogelarten in 51 ozeanischen Inseln (also Inseln, die niemals mit dem Festland verbunden waren) und entdeckten, dass deren Artbildung allopatrisch verlief. Losos & Schluter (2000) kamen zum selben Ergebnis bei den Anolis-Leguanen auf den karibischen Inseln, auch diese entstanden durch allopatrische Artbildung.
Die peripatrische Artbildung oder Artbildung durch den Gründereffekt (Mayr 1954, 1982) ist eine Form der allopatrischen Artbildung durch Gründung einer kleinen, abgetrennten Population, in der es wegen des verarmten Genpools der wenigen Gründerindividuen zur Bildung einer neuen Art kommt. Dies trifft vor allem auf isolierte Insel zu. Die Umweltbedingungen solcher Randpopulationen unterscheidet sich deutlich von jenen, der „zentraleren“ Populationen (z. B. Klima, Vorhandensein von Nahrung, Nahrungskonkurrenten, Raubfeinde etc.). Mayr (1954) geht davon aus, dass sich solche kleinen Populationen sehr schnell in neue Arten entwickeln können, weil sich genetische Veränderungen durch die geringe Populationsgröße viel schneller verbreiten können. Es tritt ein sog. Flaschenhalseffekt auf (auch bottleneck genannt), bei dem die isolierte und kleine Population nicht mehr die genetische Vielfalt der Ausgangspopulation repräsentiert und ein Großteil der genetischen Vielfalt verloren geht. Häufig kommt es zu einem sog. Gendrift, also die zufällige Veränderung der Allelhäufigkeit (Allelenfrequenz) in kleinen Populationen. Ist eine Population über einen längeren Zeitraum von einem Flaschenhalseffekt betroffen, verliert diese einen Großteil ihrer genetischen Variation (Variabilität). Durch die Gendrift gehen Gene aus dem Genpool der Ursprungspopulation verloren, und der Genpool der resultierenden Population kann sich, je nach der genetischen Variation der Ursprungspopulation, erheblich vom früheren Genpool unterscheiden (vgl. Futuyma 2007, S. 225f).
Die Fliegenart Drosophila sechellia kommt auf den Seychellen im indischen Ozean vor. Ihre nächsten Verwandten sind D. mauritiana aus Mauritius und D. simulans aus dem afrikanischen Festland. Studien legen nahe, dass D. sechellia aus einer Population entstammt, die aus dem afrikanischen Festland kam. Außerdem ist die genetische Diversität bei D. sechellia geringer, als bei den anderen Arten, was auf eine kleine Populationsgröße schließen lässt (Kliman et al. 2000). Die mit Abstand meisten Drosophila-Arten kommen auf Hawaii vor, etwa 400 – 800 Arten sind aus diesem Insel-Archipel bekannt (Carson & Kaneshiro 1976, Carson & Templeton 1984). Fast alle Arten sind auf nur einer der Hawaii-Inseln endemisch (Carson & Clague 1995). Molekulare Studien belegen, dass all diese Arten auf einen gemeinsamen Vorfahren zurückgehen (DeSalle 1995). Weiterhin zeigt sich, dass die Besiedlung von 97 Drosophila-Arten immer von älteren Inseln hin zu jüngeren erfolgte, insgesamt gab es mindestens 45 Besiedlungen innerhalb des Inselarchipels. Aus diesen und weiteren Befunden schlussfolgert Carson (1983), dass etwa 50% der Arten durch peripatrische Artbildung entstanden sind. Eine peripatrische Artbildung auf den Hawaii-Inseln fand auch bei den flugunfähigen Grillen der Gattung Laupala (Otte 1994, Shaw 2002) und der Lobelien-Gattung Cyanea (Givnish et al. 1995) statt. Die Kolonialisierung von Drosophila und Cyanea auf den Hawaii-Inseln ist in Abb. 7 dargestellt.
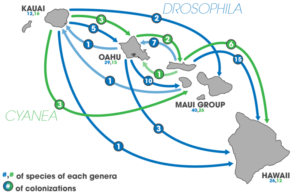
Abb. 7: Besiedlungsgeschichte von Drosophila und Cyanea auf Hawaii
Populationen des Seitenstreifenleguans (Uta stansburiana) auf dem amerikanischen Festland unterscheiden sich nur wenig voneinander, während die Populationen auf den Inseln des Golfes von Kalifornien sich so sehr von den Festland-Populationen unterscheiden, dass man sie in eigene Arten einstuft (Soule 1966).
Die Baumarten Petrobium arboreum auf St. Helena und Dendrosicyos socotrana auf Socrota gelten ebenfalls als Beispiele für eine peripatrische Artbildung (Carlquist 1965), wie auch der Kokos-Insel-Darwinfink (Pinaroloxias inornata, Stattersfield et al. 1998).
Eine parapatrische Artbildung (nicht zu verwechseln mit der peripatrischen Artbildung) hat eine Art als Ausgangspunkt, die ein bestimmtes Verbreitungsgebiet mit relativ einheitlichen Umweltbedingungen besiedelt. Ändern sich nun in einem bestimmten Teilbereich des Verbreitungsgebiets die Umweltfaktoren oder treten neue hinzu, so besiedelt die Art nunmehr Areale mit unterschiedlichen Umweltbedingungen. Die Teilpopulationen unterliegen in diesen Arealen unterschiedlichen Selektionsdrücken und entwickeln sich daher zunehmend unabhängig voneinander weiter (vgl. hierzu auch Endler 1977). Coyne & Orr (2004) gehen davon aus, dass eine parapatrische Artbildung durchaus häufig vorkommen dürfte, diese aber schwer nachzuweisen ist, vor allem gegenüber einer allopatrischen Artbildung. Aber möglicherweise liefert die Grasart Anthoxanthum odoratum ein Beispiel hierfür, da einige Populationen in der Nähe von Bergwerken eine Toleranz für Schwermetalle entwickelt haben. Solch entwickelte Schadstoff-Toleranzen führen auch zu veränderten Blütenzeiten und erhöhter Selbstbestäubung (McNeily & Antonovics 1968, Antonovics 1968).
Die sympatrische Artbildung gilt als ein unter Evolutionsbiologen heiß umstrittenes Thema. Es entsteht hierbei eine neue Art innerhalb einer Population ohne gleichzeitige geografische Isolation. Die Schwierigkeit dieses Artbildungs-Mechanismus ist, wie eine nicht isolierte Population den Genaustausch verhindern kann. Mayr (1942, 1963) gehört zu den größten Kritikern der sympatrischen Artbildung. Die meisten Modelle der sympatrischen Artbildung schlagen eine sogenannte disruptive, oder abspaltende Selektion innerhalb einer Population vor. Hierbei werden phänotypische extreme in einer diversen Population bevorzugt, die dadurch erhalten und verstärkt werden. Individuen mit einer Merkmalsausprägung, die dem Mittel der Population entspricht, haben folglich einen Nachteil. Weitere Formen der Selektion wären die stabilisierende Selektion, bei der der Mittelwert einer Merkmalsausprägung bevorzugt wird und die gerichtete Selektion, bei der Merkmale bevorzugt werden, die einseitig von der mittleren Merkmalsausprägung in der Population abweichen und fördert daher eine Verschiebung der Merkmale in die bevorzugte Richtung. Abb. 8 zeigt die verschiedenen Formen der Selektion am Beispiel der Flügelgröße eines Insekts. Dieser disruptive Selektionsdruck muss jedoch zum einen sehr stark sein und die Wahl des Sexualpartners muss mit jenem Faktor korreliert sein, der die Selektion bedingt (Turner & Burrows 1995).
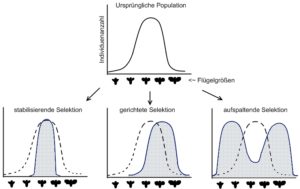
Abb. 8: Unterschiedliche Wirkungen der Selektion bei einer Insektenpopulation in Bezug zur Flügelgröße. Die aufspaltende Selektion wird gerne als Modell für die sympatrische Artbildung genutzt.
Das berühmteste und wohl kontroverseste Experiment zur sympatrischen Artbildung ist das von Thoday & Gibson (1962), bei der nach 12 Generationen die Untersuchungsart Drosophila melanogaster sich wie zwei Arten verhielten. Experimentell wurde eine moderate disruptive Selektion in Richtung geringer und hoher Zahl an Borstenhaaren durchgeführt. Individuen beider Extreme wurde die Möglichkeit gegeben sich fortzupflanzen, wobei sich Individuen mit ähnlicher Borstenhaarzahl untereinander fortpflanzten; es entstanden also zwei Populationen mit „geringer“ und „hoher“ Borstenzahl. Das Problem dieses Experimentes ist, dass es nicht wiederholt werden konnte. 19 Versuchsreihen bei Drosophila melanogaster, bei der auf die Zahl der Borstenhaare selektiert wurde, konnten keine Fortpflanzungsbarriere zwischen beiden Extremen (hohe und niedrige Borstenhaarzahl) nachweisen (Thoday & Gibson 1970, Spiess & Wilke 1984).
Das erfolgreichste Experiment zu sympatrischen Artbildung wurde von Rice & Salt (1990) durchgeführt. Beide bauten ein ausgeklügeltes Labyrinth (vgl. Abb. 9), in das Fliegenlarven von Drosophila melanogaster gelegt wurden. Innerhalb des Labyrinths konnten Fliegen zwischen Helligkeit oder Dunkelheit durch Bewegen nach links oder rechts (Selektion auf Phototaxis), oben und unten (Selektion für Geotaxis) sowie zwischen Acetaldehyd (weiße Ampulle) oder Ethanol (schwarze Ampulle) wählen (Selektion für Chemotaxis). Zusätzlich wurden Fliegen aus den acht “Habitaten” in drei Zeiträumen gesammelt: früh (E), mittel (M) und spät (L), es erfolgte also auch eine Selektion nach Entwicklungsstadien. Die Fliegen durften sich im Labyrinth paaren (die Weibchen paaren sich nur, wenn sie Futter gefunden haben). Für die Kontrolllinien wurden alle Fliegen innerhalb der Habitate gemischt und 120 Weibchen ausgewählt. Für die ausgewählten Linien wurden 60 weibliche Fliegen aus Habitat 5E (dunkel, oben, Acetaldehyd, frühe Entwicklung) und 60 aus Habitat 4L (hell, unten, Ethanol, späte Entwicklung) genommen. Die Larven der Versuchs-Weibchen wurden gemischt und zusammen in das Labyrinth gestellt, um die nächste Generation zu starten. Nachkommen von Müttern aus 5E und die Hälfte der Kontroll-Individuen wurden mit einer Chemikalie aufgezogen, die ihre Augen braun färbte. In den 35 Generationen des Experiments hat sich die Habitatspezialisierung in den ausgewählten Linien entwickelt: Die Nachkommen von Weibchen, die aus dem Habitat 5E gesammelt wurden, kehrten mit größerer Wahrscheinlichkeit nach 5E zurück und die Nachkommen von Weibchen, die von 4L gesammelt wurden, kehrten eher zu 4L zurück. Bei den Kontrollfliegen hat sich keine Habitatspezialisierung herausgebildet. Da Weibchen von Drosophila dazu neigen, sich in der Nähe der Futterfläschchen zu paaren, war der Genfluss zwischen 5E- und 4L-Fliegen am Ende des Experiments praktisch zum Erliegen gekommen. Der erste Schritt der Artbildung (Speziation) war vollzogen!
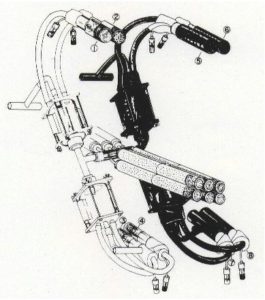
Abb. 9: Versuchs-Labyrinth für eine sympatrische Artbildung bei Drosophila melanogaster nach Rice & Salt (1990).
Es liegen aber auch einige Fälle vor, bei denen eine sympatrische Artbildung in der Natur sehr wahrscheinlich ist.
Die Insel Rapa Iti in Französisch-Polynesien ist mit knapp 40 km2 und etwa 560 km von der nächsten Insel entfernt eine sehr kleine Insel. Auf dieser Insel kommen 41 endemische Käfer-Arten der Gattung Microcryptorhynchus vor, die sich oft auf nur eine Nahrungspflanze spezialisiert haben. Die geringe Größe der Insel lässt vermuten, dass sympatrische Artbildung hier sehr wahrscheinlich ist, doch das Terrain von Rapa Iti ist sehr vielgestaltig mit vielen Tälern und Bergen, sodass eine mikro-allopatrische Artbildung nicht auszuschließen ist. Weiterhin ist selbst diese kleine Insel für einen nur 2 mm kleinen Käfer riesig (Paulay 1985).
Eine sympatrischen Artbildung auf der isoliert liegenden Lord-Howe-Insel nahe Australien ließ zwei Palmenarten aus einer Ausgangsart entstehen (Kentia-Palmen, Gattung Howea). Anpassung an unterschiedliche Substrate und Verschiebung des Blühzeitraums spielten in diesem Fall eine wichtige Rolle (Savolainen et al. 2006).
Sympatrische Artbildung findet sich auch bei Buntbarschen in kleinen Seen auf Nicaragua (Barluenga et al. 2006) und Kamerun (Schliewen & Klee 2004, Schliewen, Tautz & Pääbo 2004). Diese Kraterseen sind kleine, konische Becken mit geringer Habitatheterogenität und räumlicher Isolation, weswegen eine sympatrische Artbildung ein sehr wahrscheinlicher Kandidat ist. Die Buntbarsche der ostafrikanischen Seen (Victoriasee, Malawisee und Tanganyikasee) weisen eine ungewöhnlich hohe Artenvielfalt auf, mit geschätzten 250 bis 1000 Arten pro See. Bei diesen ostafrikanischen Buntbarschen wurde postuliert, dass die Arten innerhalb eines Sees durch sympatrische Artbildung entstanden sein könnten. Es gibt jedoch in diesen großen Seen viele Möglichkeiten der geographischen Isolation durch unterschiedliche Habitate und Wassertiefen. Es gibt des Weiteren verschiedene Uferzonen als auch Verbindungen zu Flüssen, was Auswirkungen auf die Strömung und Wassertemperatur hat. Außerdem enthält jeder dieser Seen eine Reihe an Inseln, die als geographische Barrieren dienen können. Tatsache bleibt also, dass die ostafrikanischen Seen keineswegs ein einzelnes Habitat darstellen. Man geht davon aus, dass der Victoriasee vor etwa 15.000 Jahren komplett ausgetrocknet war. Molekularbiologische Untersuchungen an Buntbarschen dieses Sees zeigten aber, dass diese Arten vor etwa 100.000 Jahren entstanden sind und sich aus einer benachbarten und älteren Buntbarsch-Gruppe aus dem etwa 200 km entfernten Kivu-See ableiten lassen (Salzburger & Meyer 2004). Geologische Beweise deuten darauf hin, dass die drei großen ostafrikanischen Seen häufiger Schwankungen im Wasserstand hatten, sodass mehrere kleinere isolierte Seen entstanden sind, die eine allopatrische Artbildung begünstigen (Owen et al. 1990, Sturmbauer et al. 2001).
Eine weitere Form sympatrischer Artbildung liegt z. B. auch bei wirtsspezifischen Rassen spezialisierten Insekten vor. Die Apfelfruchtfliege (Rhagoletis pomonella) ist diesbezüglich der bekannteste Fall. Erwachsene Tiere schlüpfen im Juli und August und pflanzen sich auf ihrer Wirtspflanze fort. Die Larven entwickeln sich in reifen Früchten und im Herbst, wenn dann die Früchte zu Boden fallen, überwintern die Larven im Puppenstadium. Die wichtigste Wirtspflanze im Osten Nordamerikas ist der Weißdorn (Gattung Crataegus). Vor etwa 150 Jahren wurde die Apfelfruchtfliege in den USA als Schädling auf Apfelbäumen (Gattung Malus), die mit dem Weißdorn verwandt sind, entdeckt (Apfelbäume waren erst durch den Menschen in die USA eingeführt worden). Genetische Untersuchungen belegen, dass die Apfel-liebenden und Weißdorn-liebenden Apfelfruchtfliegen genetische Unterschiede aufweisen. Der genetische Unterschied beruht u. a. auf die Tatsache, dass die Fortpflanzung auf Apfelbäumen und beim Weißdorn in einem Abstand von drei Wochen stattfindet (Feder 1998, Feder et al. 2003). Der Unterschied in der Präferenz für Wirtspflanzen entstand wahrscheinlich sympatrisch (Futuyma 2007).
Sympatrische Artbildungen können auch durch Polyploidisierungen entstehen, wenn also Zellen nicht den doppelten (diploiden) Chromosomensatz haben, sondern dieser mehrfach vorliegt. Dies kann durch Allopolyploidie (Chromosomensätze aus verschiedenen Arten verschmolzen) oder durch Autopolyploidie, die auf der Verdopplung von Chromosomensätzen innerhalb einer Art beruht. Bei der Allopolyploidisierung entstehen nach einer Artkreuzung, die normalerweise zu unfruchtbaren (sterilen) Mischlingen führt, durch (zufällige) Verdoppelung des Chromosomenbestandes (Genom-Mutation) ein polyploides Lebewesen, das normale Fruchtbarkeit zeigt. Weizen (Gattung Triticum) ist ein Beispiel für solch eine Allopolyploidisierung. Beim Weizen gibt es allotetraploide Arten (vierfacher Chromosomensatz, z. B. bei Dinkel, Hartweizen, AABB). Durch eine weitere zufällige Additions-Kreuzung des Emmers (AABB) mit dem diploiden Gänsefußgras (Aegilops squarrosa, Genom DD) entstanden allohexaploide Formen wie Dinkel (Triticum spelta) und durch Züchtung daraus der Saat- oder Brotweizen (Triticum aestivum). Hexaploid bedeutet, dass diese Pflanzen einen sechsfachen Chromosomensatz (2n = 6x = 42) besitzen. Die Buchstaben A, B und D stehen dabei für die drei verschiedenen Genome, die sich innerhalb der DNA befinden und miteinander agieren (Quelle). Abb. 10 zeigt schematisch eine vergleichbare Hybridisierung.
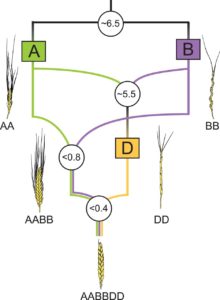
Abb. 10: Allopolyploidisierung bei Weizen
Eine Autopolyploidisierung, d. h. Verdoppelung des eigenen Chromosomensatzes findet sich z. B. bei Zuckerrüben (Gattung Beta). Bei Zuckerrüben der Ertrag von triploiden (Triploidie) am höchsten. Triploide sind jedoch häufig völlig steril, da die Aufteilung der Chromosomen nur äußerst selten zu normalen Gameten führt. So wird das Saatgut für die triploide Zuckerrübe (AAA) durch Kreuzung von Diploiden und Tetraploiden (AA × AAAA) gewonnen.
Ringspezies
Eine Ringspezies besteht aus mehreren meist morphologisch deutlich unterscheidbaren Populationen, bei denen Individuen benachbarter Populationen sich kreuzen und Gene austauschen können, dies jedoch zumindest bei einigen der nicht-benachbarten Populationen nicht mehr möglich ist. Ringarten bilden eine große und angeblich kontinuierliche Population, in der die Erreichung der biologischen Speziation keine vollständige geografische Isolierung dieser Populationen erfordert. Die Artbildung in dieser kontinuierlichen Population erfolgt vielmehr durch eine allmähliche Ausbreitung des Verbreitungsgebiets der Tiere, verbunden mit einer Selektion an verschiedenen Orten, die ihre genetische Divergenz verursacht. Eine Ringspezies ist also ein Fall der Artbildung, der ohne geografische Isolation auftreten soll.
Das funktioniert in etwa so: Eine Art erweitert ihr Verbreitungsgebiet und stößt auf eine ungefähr runde geografische Barriere wie ein Tal, die arktische Eiskappe oder ein unbewohnbares Plateau. Die Population teilt sich und breitet sich um die Ränder der Barriere aus, so dass ihre Reichweite kreisförmig wird, wenn sie sich ausdehnt. Und wenn sich das Verbreitungsgebiet zu einem Kreis zusammenzieht, beginnen sich die Populationen innerhalb des Verbreitungsgebiets genetisch zu verändern, da sie auf den lokalen Selektionsdruck reagieren. Der Kreislauf wird jedoch nie unterbrochen, so dass sich zwar jeder Teil der expandierenden Arten genetisch unterscheidet, aber dennoch Gene mit benachbarten Populationen austauscht. Obwohl sich die Populationen am Ende des Rings wie zwei verschiedene Arten verhalten, sind sie durch den Genfluss rund um den Ring verbunden (vgl. Coyne & Orr 2004, S. 102-105). Solche Arten werden als “Ringarten” bezeichnet. Sie sind aus zwei Gründen interessant. Erstens zeigen sie, dass die Entwicklung zu neuen Arten mit vollständiger reproduktiver Isolation ohne geografische Isolation erfolgen kann. Zweitens bleibt die Frage offen ob man solch eine Ringspezies als eine oder zwei Arten auffasst. Wenn man sie als zwei Arten definiert, wo zieht man die Grenze zwischen den beiden, vorausgesetzt, dass benachbarte Populationen um den Ring eindeutig Mitglieder derselben Art sind? Bekannte Lehrbuchbeispiele für Ringspezies sind die Kohlmeise (Parus major, Abb. 11), die Silber- und Heringsmöve (Larus argentatus und L. fuscus, Abb. 11), der Grünlaubsänger (Phylloscopus trochiloides, Abb. 12) und die Salamanderart Ensatina eschscholtzii (Abb. 13).
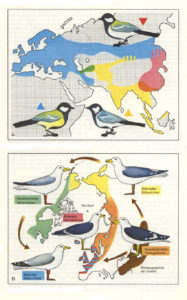
Abb. 11: Kohlmeise und Silbermöwe als Beispiel für das Konzept der Ringspezies
Tatsächlich wurde aber das Konzept der Ringspezies durch neuere Forschungen in Frage gestellt. Bei der Kohlmeise (Parus major) kamen aktuellere Untersuchungen zu dem Ergebnis, dass sie eine falsch klassifizierte Ringspezies darstellt (Päckert et al. 2005). Diese Studie kombinierte molekulare Marker (in diesem Fall Cytochrom b, ein Membranprotein, welches sich in den Mitochondrien befindet und an der Zellatmung beteiligt ist; es handelt sich hierbei um ein stark konserviertes Protein, welches sich im Verlauf der Evolution nur wenig änderte und so ein geeigneter Kandidat für phylogenetische Analysen ist) mit bioakustischen (Gesang der Vogelarten) Analysen und morphologischen Merkmalen, um den Artstatus zu überprüfen. Die Ergebnisse zeigten, dass die Introgression und Hybridisierung zwischen den benachbarten Populationen im Amur-Gebiet relativ gering war (und im Falle mitochondrialer DNA nicht vorkam), was darauf hindeutet, dass es zwischen den beiden Gruppen einige Fortpflanzungsbarrieren gab. Es gab auch Unterschiede im Gesang und der Morphologie.
In der Studie wurde empfohlen, die beiden östlichen Gruppen als neue Arten aufzuteilen: Parus cinereus in Indien und Südostasien Parus minor in China, Korea, Amurgebiet und Japan. Die Populationen in Zentralasien (Turkestan etc.) stellen eine Unterart der eigentlichen Kohlmeise (Parus major bokharensis) dar und gehören nicht wie in Abb. 11 zu Parus cinereus.
Auch Herings- und Silbermöwen erfüllen nicht das Konzept einer Ringspezies. Liebers et al. (2004) konnten aufgrund genetischer Untersuchungen etwas Licht in die Verwandtschaftsverhältnisse dieses „Larus argentatus-fuscus-Formenkreises“ bringen. Die früher aufgestellte These, es handele sich bei diesem Formenkreis um eine Ringspezies, deren Formenkette um den Nordpol herumreiche und deren beiden Enden Silber- und Heringsmöwe bilden, konnte in Teilen widerlegt werden. Mayrs (1942) nahm an, dass das Refugium dieses Formenkreises sich am Kaspischen Meer befand und sich nach der Eiszeit die Populationen um den Nordpol herum verbreitet haben. Liebers et al. (2004) bemerkten, dass es aber mindestens ein zweites Refugium gegeben hat, nämlich im Nordatlantik. Aus diesem westlichen Refugium entwickelte sich die Europäische Silbermöwe Larus argentatus (nebst anderen verwandten Arten wie Mantelmöwe Larus marinus und Mittelmeermöwe Larus michahellis). Im östlichen Refugium am Kaspischen Meer entwickelten sich die Heringsmöwe Larus fuscus, Steppenmöwe Larus cachinnans, Ostsibirienmöwe Larus vegae, Kamtschatkamöwe Larus schistisagus und die Amerikanische Silbermöwe Larus smithsonianus, die früher als Unterart der Silbermöwe Larus argentatus angesehen wurde. Zum einen belegt die Studie, dass es zwei Gründerpopulationen gab, aus denen sich die Populationen unterschiedlich ausbreiteten und zum anderen werden die einzelnen Populationen als eigene Arten anerkannt. Im Gegensatz zum Ringartenmodell finden sich keine genetischen Hinweise auf eine Schließung des zirkumpolaren Rings durch die Besiedlung Europas durch nordamerikanische Silbermöwen.
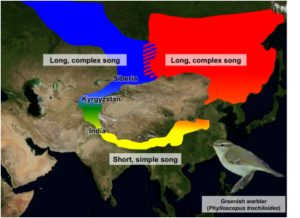
Abb. 12: Grünlaubsänger (Phylloscopus trochiloides) als Modell der Ringspezies
Der Grünlaubsänger hat in Europa und Asien ein weites Verbreitungsgebiet. Populationen in Sibirien kreuzen sich jedoch nicht untereinander. Irwin et al. (2001) gehen davon aus, dass die Art sich vom Tibetanischen Plateaus ausbreitete und die nördlichen Populationen sich in Gesang und Morphologie zunehmend unterschieden, sodass die zwei nördlichen Populationen ich wie zwei Arten verhalten. Sie stellen somit ein klassisches Beispiel für eine Ringspezies dar. Untersuchungen der mitochondrialen DNA von Alcaide et al. (2014) verkomplizierten jedoch das Bild. Die genetische Analyse von 95 Vögeln und mehr als 2.000 Stellen im gesamten Genom ergab vier genetische Cluster rund um den Ring, die sich stark voneinander unterscheiden. Historische Trennungen des Genflusses gab es an mehr als einer Stelle um den Ring. Aber interessanterweise entdeckten die Forscher, dass die beiden sibirischen Formen sich gelegentlich gekreuzt haben, sodass sie sich nicht viel zwei komplett andere Arten verhalten. Lange Perioden der geografischen Isolation ereigneten sich auch im westlichen Himalaya, wo es jetzt eine ausgedehnte Hybridzone zwischen genetisch unterschiedlichen Formen gibt.
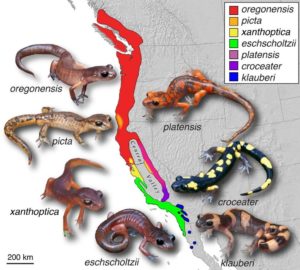
Abb. 13: Die Salamanderart Ensatina eschscholtzii als Modell der Ringspezies
Die Salamanderart Ensatina eschscholtzii wurde zuerst von Robert Stebbins, später und am intensivsten von David Wake von der University of California in Berkeley und seinen Kollegen untersucht.
Eine ursprüngliche Population von Salamandern aus dem heutigen Nordkalifornien oder Oregon sollte sich nach Süden ausgebreitet haben und teilte sich dann am Central Valley in Kalifornien auf, wobei sich eine Gruppe entlang der Küste und eine zweite nach Osten bis zur Küste von Sierra Nevada ausdehnte. Das dazwischen liegende „Zentrum“ des Rings war das Central Valley in Kalifornien, das grasbewachsen, trocken und für diese plethodontiden Salamander, die einen feuchten Lebensraum benötigen, unbewohnbar ist. Die Art bildete so einen klassischen Ring, der sich genetisch unterschied, wenn sich beide Zweige nach Süden ausbreiteten. Tatsächlich unterscheiden sie sich in Farbe und Morphologie und wurden in sieben Unterarten eingeteilt. Dieses Beispiel wurde lange Zeit als Paradebeispiel einer Ringspezies angesehen, doch auch das trifft nicht zu. Genetische Studien von Highton (1998) sowie von Wake (1997) und Wake et al. (1998) ergaben, dass an Stellen rund um den Ring scharfe genetische Brüche auftraten, was darauf hindeutete, dass in den 5 bis 10 Millionen Jahren, in denen der Ring geschlossen wurde, kein kontinuierlicher Genfluss stattfand, sondern sporadische geografische Trennungen im Ring, so dass die Salamander begannen sich ohne ständigen Genfluss mit benachbarten Populationen zu unterscheiden. Geologische Daten geben ebenfalls darüber Auskunft, dass ein kontinuierlicher Genfluss bei den Salamandern nicht möglich war. Basierend auf diesen Ergebnissen sind alle Autoren zu dem Schluss gekommen, dass die Bildung dieses “Rings” sporadische und wichtige Episoden der geografischen Isolation zwischen Populationen mit sich brachte. Es handelt sich also nicht um das klassische Szenario eines “kontinuierlichen Genflusses“, welches für die Bildung von Ringspezies Voraussetzung ist.
Die Ergebnisse zeigen also, dass es das Konzept der Ringspezies nicht gibt. Das tut jedoch weder der Definition von Arten, noch der Artbildung einen Abbruch. Dass Ringspezies nicht existieren ist jedoch kein großer Verlust, da sie keine neuen evolutionären Prinzipien demonstrierten. Sie zeigten etwas, was wir bereits wussten – dass die reproduktive Isolation durch alles gefördert wird, was den Genfluss zwischen Populationen verringert. Aber sie zeigten es auf eine interessante und neuartige Weise.
Warum entstehen Arten?
In den drei Teilen der Artikelreihe über die Art befassten wir uns mit der Realität, Definition und der Entstehung von Arten. Die Menge an ausgewerteter Literatur dieser drei Artikel (über 230 wissenschaftliche Arbeiten, plus weitere Blog- und Homepage-Einträge) haben es nicht erlaubt uns mit den Vorwürfen der Kreationisten zu befassen, was in einem gesonderten Artikel erscheinen soll. Zum Abschluss soll aber beantwortet werden, warum überhaupt Arten entstehen. Diese Frage mag trivial klingen und tatsächlich haben sich sehr wenige Arbeiten damit befasst. Einer der wenigen Lehrbücher, die dieser Frage nachgehen, ist das von John Maynard Smith & Eörs Szathmary (1995), welches sich mit interessanten Fragen, wie den Ursprüngen des Lebens, des genetischen Codes, der Zellen und der Sexualität befassen. In ihrem Kapitel über die sexuelle Fortpflanzung stellen sie fest, dass „zumindest bei höheren Tieren (…) innerhalb einer geographischen Region keine kontinuierliche Variation“ (S. 167) bestehe, man also Arten klar unterscheiden kann. Sie nennen drei mögliche Gründe weshalb Arten entstehen (s. 168):
- Die Existenz der Arten habe die gleichen Ursachen wie die der chemischen Elemente. Arten stellen dabei stabile Zustände belebter Materie dar, die durch „Formgesetze“ (vgl. Webster 1984) determiniert sind. Smith & Szathmary (1995) kommentieren hierzu, dass diese „Formgesetze“ bisher unbekannt seien und die Variabilität innerhalb von Taxa eine derartige Erklärung auszuschließen scheinen; empirische Daten hierzu fehlen auch (S. 168, 172)
- Arten existieren, weil es diskontinuierliche ökologische Nischen gibt, an die Arten angepasst sind. Z. B. können pflanzenfressende Arten an unterschiedliche Pflanzen angepasst sein und Parasiten an unterschiedliche Wirte. Aber die Anpassung an ökologische Nischen biete nach Smith & Szathmary (1995) keine generelle Erklärung, weil die Existenz von Arten eines Taxons durch die von Arten eines anderen Taxons erklärt werde, was zu einem Zirkelschluss führe (S. 168).
- Ursache für die Existenz von Arten sei die sexuelle Fortpflanzung. Hier besteht aber das schon angesprochene Problem der asexuell vermehrenden Arten von Pflanzen wie dem Löwenzahn (Taraxacum) und den Bakterien. Eine klare Aufteilung der Arten ist nach Smith & Szathmary (1995, S. 171) nur bei Organismen mit meiotischer Sexualität in einer Region möglich. Das Problem dieser Sichtweise ist jedoch, dass es nur das biologische Artkonzept berücksichtigt. In Teil 2 wurden die weiteren Artkonzepte festgestellt, die aufzeigen, dass auch Bakterien nicht nur diskrete Cluster bilden, sondern als Arten beschrieben werden können. Das phylogenetische Artkonzept hat ebenfalls seine Vorteile, da es die Merkmale der Organismen qualitativ beschreibt und deren Evolutionsgeschichte berücksichtigt. Coyne & Orr (2004, 52-54), die Anhänger des biologischen Artkonzeptes sind, kommentieren, dass bei unterschiedlichen Gruppen verschiedene Artkonzepte verwendet werden müssen, bei der z. B. die ökologische Nische eher im Vordergrund stehe, als die Form der Fortpflanzung.
Auch wenn die Theorien von Webster (1984) von Smith & Szathmary (1995), wie auch von Coyne & Orr (2004) abgelehnt werden, lohnt es sich diese Gedankengänge nochmal näher anzuschauen.
Darwin (1859) versuchte die Ähnlichkeit wie auch die Unterschiede von Taxa damit zu erklären, dass die Ähnlichkeit von Arten ihre Ursache in der gemeinsamen Abstammung von Arten habe, die Verschiedenheit aber eine Folge der Anpassung an die Umwelt (natürliche Selektion) sei. Die Problematik, die Webster (1984) hierin sieht, ist die Tatsache, dass daraus geschlussfolgert wurde, dass eigentlich nur Individuen natürlich seien und dass es keine Gesetzmäßigkeiten bezüglich Formbildung, innerer Zwänge etc. gäbe. Organismen entstehen nicht aufgrund „interner Prinzipien“, sondern werden nur von außen durch die Umwelt „geformt“. Daher kritisiert Webster (1984, S. 203), dass wenn nur Individuen und Population (und somit keine klar diagnostizierbaren Arten) existieren, der Bereich natürlicher Formen irreduzierbar divers ist, wo grundsätzlich alles möglich wäre. Daraus folge, dass die Unterschiede in der Form (z. B. Artunterschiede) nur historisch zu ermitteln seien, aber keine natürliche Gesetzmäßigkeit darstellen. Organismen haben damit keine eigene Natur, sondern nur ihre Geschichte und die Notwendigkeit sich anzupassen. Artnamen seien daher nicht die Namen natürlicher Beschaffenheiten. Unabhängig davon, ob Websters Kritik in sich schlüssig ist (dafür ist der Artikel viel zu abstrakt), erinnert seine Kritik an jene der Frankfurter Konstruktionsmorphologie, die gerade diese „internen Prinzipien“ der Organismen heraufgefunden hat (dazu wurde auf Internet-Evoluzzer ein Artikel veröffentlicht). Auch die sogenannte evolutionäre Entwicklungsbiologie (kurz Evo-Devo, vgl. hierzu das Lehrbuch von Gilbert & Epel 2015) erkennt interne Gesetzmäßigkeiten an und spricht z. B. von „developmental constrains“ (entwicklungsbedingte Beschränkung, Entwicklungszwänge). Dass Organismen nicht einfach nur von der Umwelt „geformt“ werden, sondern aktiv in neue Lebensräume eindringen und diese mitgestalten wird als Nischenkonstruktion definiert (vgl. hierzu Sultan 2015). Tatsächlich ist in der Natur nicht „alles möglich“, weil die natürliche Selektion nur dann funktionieren kann, wenn wir lebensfähige Organismen haben. D. h. die Selektion kann nur von außen auf die Organismen einwirken (durch Sicherung des Fortpflanzungserfolges). Bevor aber die Selektion wirken kann, muss ein Organismus überhaupt erstmal entstehen. Folgerichtig bestehen innere Zwänge, innere Notwendigkeiten, die „Logik der Morphologie“ (Webster 1984, S. 208). Leider liefert Webster (1984) keine Konkretisierungen für seine Überlegungen, weshalb seine Kritik teilweise spekulativ bleibt. Die Erkenntnisse der Konstruktionsmorphologie, Evo-Devo und Nischenkonstruktion können hier aber Abhilfe leisten.
Wenn Arten keine natürlichen Einheiten der Evolution darstellen, bliebe nicht nur die Frage zu stellen, warum man sich die Mühe macht diese zu definieren, zu bestimmen und zu schützen, sondern auch die Frage, warum dann Individuen und Populationen natürliche Einheiten sein sollen. Wir haben schon in Teil 2 bemerkt, dass, je nach Betrachtungsschwerpunkt auch das Individuum oder die Population ein künstliches Kriterium darstellen. Wenn die Entstehung von Arten keine Gesetzmäßigkeit darstelle, sondern Arten allerhöchstens historisch durch ausgestorbene Formen erkennbar seien, bliebe auch die Frage zu stellen, warum dann immer in der Evolution Arten entstehen. Halten wir folgendes fest:
- Natürlich sind Arten bzw. deren Entstehung auch historisch, nicht zuletzt, weil die Evolutionsbiologie auch historisch arbeitet und alle Arten gehen auf eine gemeinsame Abstammung, einen gemeinsamen Vorfahren zurück. Gleichzeitig sind aber Veränderungen nicht beliebig. Tatsache an der Evolution ist die Konsequenz, dass man sein „historisches Erbe“ nicht loswerden kann. Wenn z. B. erste Fischkonstruktionen an Land gehen und reine Luftatmer werden, so können nachfolgende lungenatmende Landformen (z. B. Wale) nicht einfach Kiemen entwickeln, wenn sie wieder Wasserbewohner werden.
- Neue Arten entstehen immer aus ihren Vorgängerformen, niemals beliebig. Eine Regel der Taxonomie und phylogenetischen Systematik ist, dass jede neue hierarchische Ebene der Nomenklatur (z. B. Klasse, Ordnung, Familie, Art etc.) immer die höheren Hierarchien in sich trägt. Als Beispiel: Wir gehören zur Art Mensch (Homo sapiens), mit anderen Affenarten (z. B. Schimpansen Pan troglodytes) gehören wir zu den Menschenaffen (Familie Hominidae). Alle Menschenaffen gehören wiederrum zu den Säugetieren (Klasse Mammalia), diese wiederrum mit anderen Wirbeltieren und nahen Verwandten zum Stamm der Chordata etc. D. h. Wir sind immer noch Teil der höheren Hierarchien: Wir sind immer noch Chordaten, Säugeitere und Affen. Das haben wir mit anderen Lebewesen der gleichen Hierarchie zusammen. Dies wissen wir zum einen aufgrund der Analyse der Merkmale (Anatomie, Stoffwechsel, inklusive Bauplan, Konstruktionsmorphologie und Entwicklungsbiologie) und unserer Evolutionsgeschichte. Gleichzeitig haben wir aber durch besondere Merkmale unsere eigene Kategorie, die uns von den anderen in derselben Kategorie unterscheidet: die Art als kleinste Einheit. Folgerichtig teilen wir mit den Menschenaffen einen gemeinsamen Vorfahren (und sind nicht aus diesen entstanden), nämlich den Vorfahren aller Hominidae, der wiederrum aus der Gruppe anderer Primaten hervorgegangen ist. Diese Grundregel der phylogenetischen Systematik werden wir in unserer Abarbeitung mit den kreationistischen Logikfallen in Bezug zur Taxonomie und Systematik näher erläutern. Festzuhalten bleibt: Arten entstehen immer aus Vorgängerarten (ihren gemeinsamen Vorfahren) und nicht einfach aus irgendeiner beliebigen Gruppe (Aus Mücken werden eben doch nicht einfach Elefanten gemacht!).
- Damit Arten überhaupt entstehen können, müssen zwei Bedingungen erfüllt sein: Erstens müssen sich Lebewesen fortpflanzen können – ob nun sexuell oder asexuell spielt keine Rolle; das Leben muss über das Individuum hinaus weitergehen, oder man stirbt aus. Damit sich aber Individuen sich zunehmend unterscheiden, muss eine Form der Isolation vorherrschen, muss der Genaustausch begrenzt werden. So kann die natürliche Selektion auf die vorhandene Variation unterschiedlich auswirken. In diesem Teil wurden verschiedene Möglichkeiten der Isolation angesprochen, genauso auch welche Formen der Artbildung möglich sind. Aus isolierten Populationen entstehen mit der Zeit neue Arten, aus denen wiederrum durch erneute Isolation weitere Arten entstehen. Je weiter dieser Prozess der Artaufspaltung zurückgeht, desto eher steigt die Wahrscheinlichkeit, dass sich die Populationen (und damit Arten) nicht mehr untereinander fortpflanzen können. War der Isolationsprozess erdgeschichtlich nicht lange her und die Wirkungen der Selektion nicht all zu stark, können bei den noch nah verwandten Arten gelegentliche Hybridisierungen vorkommen. Liegt aber die Artaufspaltung schon länger zurück und lagen etliche vorherige Artaufspaltungen zur Ursprungsart dazwischen, wird eine Hybridisierung nicht mehr stattfinden. So ist es nicht verwunderlich, dass Arten, die sich vor relativ kurzer Zeit aus einer Stammart entwickelt haben (z. B. Wolf und Kojote) noch miteinander kreuzen können. Wolf und Tannenbaum (als Extrembeispiel) jedoch nicht, da die Artaufspaltung zwischen den ersten Tieren und den ersten Pflanzen so lange zurückliegt (mehrere Milliarden Jahre) und dazwischen so viele Artaufspaltungen herrschten (Entstehung mehrerer Milliarden Arten), dass eine Fortpflanzung untereinander absurd wäre. Gerade hier liegt also die Gesetzmäßigkeit der Arten vor: sie sind eine Konsequenz daraus, dass sich nicht jeder mit jedem fortpflanzen kann (biologisches Artkonzept), da sie historisch voneinander isoliert waren und evolutionsgeschichtlich diagnostizierbare Merkmale entwickeln konnten, sodass wir sie unterscheiden können (phylogenetisches Artkonzept). Dass nah verwandte Arten gelegentlich hybridisieren, ändert an dieser Tatsache erstmal nichts.
Literatur
Alcaide, M., E. S. C. Scordato, et al. (2014): Genomic divergence in a ring species complex. Nature 511: 83-85.
Anthony, N. et al. (2007): The role of Pleistocene refugia and rivers in shaping gorilla genetic diversity in central Africa. PNAS December 18, 2007 104 (51) 20432-20436
Antonovics, J. (1968): Evolution in closely adjacent plant populations. V. Evolution of self-fertility. Heredity 23: 219-238
Avise, J. C. et al. (1994): Molecular Markers, Natural History and Evolution. New York: Chapman & Hall
Avise, J. C. et al. (2000): Phylogeography: The History and Formation of Species. Cambridge: Harvard University Press
Ayla, F. J. et al. (1974): genetic differences during the speciation process in Drosophila. Evolution 28:576-592
Barluenga, M. et al. (2006): Sympatric speciation in Nicaraguan crater lake cichlid fish. Nature 439:719–723
Bollig, M. & Bünnagel, D. (Hrsg., 1992): Der zentralafrikanische Regenwald. Lit-Verlag
Bradshaw, H. D. et al. (1998): Quantitaive trait loci affecting differences in floral morphology between two species of monkeyflower. Genetics 149: 367-382
Buckley, P. A. (1969): Disruption of species-typical behavoir patterns in F1 hybrids Agapornis parrots. Zeitschrift für Tierpsychologie 26: 737-743
Carlquist, S. (1965): Island Life: A Natural History of the Islands of the World. Natural History Press, Garden City, New York.
Carson, H. L. (1983): Chromosomal sequence and inter-island colonisations in Hawaiian Drosophila. Genetics 103: 465-482
Carson, H. L. & Clague, D. A. (1995): Geology and biogeography of the Hawaiian Islands. In W. L. Wagner & V. A. Funk (eds): Hawaiian Biogeography: Evolution on a Hot-Spot Archipelago, S. 14-29. Wahsington: Smithonian Institution Press
Carson, H. L. & Kaneshiro, K. Y. (1976): Drosophila of Hawaii: Systemtics and ecological genetics. Annu. Rev. Ecol. Syst. 7: 311-346
Carson, H. L. & Templeton, A. R. (1984): Genetic revolutions in relation to speciation phenomena: The founding of new populations. Annu. Rev. Ecol. Syst.15: 97-131
Coyne, J. A. (1984): Genetic basis of male sterility in hybrids between two closely related species of Drosophila. Proc. Natl. Acad. Sci. USA 81: 4444-4447
Coyne, J. A. & Orr, H. A. (1989): Patterns of Speciation in Drosophila. Evolution 43: 362-381
Coyne, J. A. & Orr, H. A. (1997): Patterns of Speciation in Drosophila. Revisited. Evolution 51:295-303
Coyne, J. A. & Orr, H. A (2004): Speciation. Sunderland: Sinauer Associates, Inc.
Coyne, J. A. & Price, T. D. (2000): Little evidence for sympatric speciation in island birds. Evolution 54: 2166-2171
Darwin, C. (1859): On the Origin of Species by Means of Natural Selection
DeSalle, R. (1995): Molecular Approaches to biogeographic analysis of Hawaiian Drosophilidea. In W. L. Wagner & V. A. Funk (eds): Hawaiian Biogeography: Evolution on a Hot-Spot Archipelago, S. 72-89. Wahsington: Smithonian Institution Press
Dressler, R. L. (1981): The Orchids: Natural History and Classification. Cambrdige: Harvard University Press
Duvernell, D. D. & Turner, B. J. (1998): Evolution genetics of Death Valley pupfish populations: Mitochondrial DNA sequence variation and population structure. Mol. Ecol. 7: 279-288
Duvernell, D. D. & Turner, B. J. (1999): Variation and divergence of Death Valley pupfish populations at retrotransposons-defined loci. Mol. Biol. Evol. 16: 363-371
Eberhard, W. G. (1996): Female control: Sexual Selection by Cryptic Female Choice. Princeton University Press
Endler, J. A. (1977): Geographic Variation, Speciation, and Clines. Princeton University Press
Feder, J. L. (1998): The apple maggot fly Rhagoletis pomonella: Flies in the wisdom about speciation? In D. J. Howard & S. H. Berlocher (eds): Endless forms: Species and Speciation, S. 130-144. Oxford University Press
Feder, J. L. et al. (2003): Allopatric genetic origins for sympatric host-plants shifts and race formations in Rhagoletis. Proc. Natl. Acad. Sci. USA 100: 10314-10319
Fujii, Y. et al. (2001): “Transfection of Wolbachia in Lepidoptera: the feminizer of the adzuki bean borer Ostrinia scapulalis causes male killing in the Mediterranean flour moth Ephestia kuehniella”. Proceedings of the Royal Society of London B: Biological Sciences. 268 (1469): 855–859.
Futuyma, D. J. (2007): Evolution. Elsevier, Spektrum, Akademischer Verlag, München
Galindo, B. E. et al. (2003): Positive Selection in the egg receptor for abalone sperm lysin. Proc. Natl. Acad. Sci. USA 100: 4639-4643
Gilbert, S. F. & Epel, D. (2015): Ecological Developmental Biology. Integrating Epigenetics, Medicine and Evolution. 2nd Edition. Sinauer Associates Inc. Publishers, Sunderland, Massachusetts USA
Givnish, T. J. et al. (1995): Molecular Evolution, adaptive radiation, and geographic speciation in Cyanea. In W. L. Wagner & V. A. Funk (eds): Hawaiian Biogeography: Evolution on a Hot-Spot Archipelago, S. 259-301. Wahsington: Smithonian Institution Press
Grant, P. R. & Grant, B. R. (1992): Hybridization of bird species. Science 256:193-197
Haffer, J. (1969): Speciation in Amazonian Forest Birds. Science 165: 131-137
Haldane, J. B. S. (1922): Sex ratio and unisexual sterility in hybrid animals In: J. Genet. 12, S. 101–109
Hall, J. P. W & Harvey, D. J. (2002): The phylogeography of Amazonia revisited: New evidence from riodinid butterflies. Evolution 56: 1489-1497
Harrison, R. G. (1979): Speciation in North American field crickets: Evidence from elecrophoretic comparisons. Evolution 33: 1009-1023
Hillis, D. M. (1988): Systematics of the Rana pipiens complex: Puzzle and paradigm. Annu. Rev. Ecol. Syst. 19:39-63
Hillis, D. M. et al. (2004): Phylogeny of the New World true frogs (Rana) Mol. Phylogenet. Evol. 34(2): 299–314.
Hillis, D. M. et al. (2007): Constraints in naming parts of the Tree of Life. Mol. Phylogenet. Evol. 42: 331–338
Highton, R. (1998): Is Ensatina eschscholtzii a ring species? Herpetologica 54: 254-278.
Ho, M.-W. & Saunders, P. T. (eds. 1984): Beyond Neo-Darwinism, An introduction to the new evolutionary paradigm. London: Academic Press
Howard, D. J. (1999): Conspecific sperm and pollen precendence and speciation. Annu. Rev. Ecol. Syst. 30: 109-132
Howard, D. J. & Berlocher, S. H. (eds. 1998): Endless forms: Species and Speciation. Oxford University Press
Hurst G. et al. (1999): “Male killing Wolbachia in two species of insects“. Proceedings of the Royal Society B. 266 (1420): 735–740.
Huxley, J, Hardy, A. C. & Ford, E. B. (eds., 1954): Evolution as a Process. London: Allen and Unwin
Illoh, A. C. (2017): Pleistocene refugia and genetic diversity patterns in West Africa: Insights from the liana Chasmanthera dependens (Menispermaceae). PLoS ONE 12(3): e0170511.
Irwin, D. E., S. Bensch, et al. (2001): Speciation in a ring. Nature 409: 333-337.
Jacquet, F. et al. (2013): Forest refugia and riverine barriers promote diversification in the West African pygmy shrew (Crocidura obscurior complex, Soricomorpha). Zoologica Scripta · August 2013
Janzen, D. H. (1979): How to be a fig. Annu. Rev. Ecol. Syst. 10: 13-51
Johnson, S. D. (1997): Pollination ecotypes of Satyrium hallackii (Orchidaceace) in South Africa. Bot. J. Linn. Soc. 123: 225-235
Katakura, H. & Hosogai, T. (1994): Performance of hybrid ladybirds beetles (Epilachna) on the host plants of parental species. Entomol. Exp. Appl. 71: 81-85
Kliman, R. M. et al. (2000): The population genetics of the origin and divergence of the Drosophila simulans complex species. Genetics 156: 1913-1931
Knowlton, N. et al. (1993): Divergence in proteins, mitochrondrial DNA, and reproductive compatibility across the Isthmus of Panama. Science 260: 1629-1632
Knowlton, N. et al. (1997): Direct evidence for reproductive isolation among the three species of Motastraea annularis compley in Central America (Panama and Honduras). Mar. Biol. 127: 705-711
Kozek, Wieslaw J.; Rao, Ramakrishna U. (2007): “The Discovery of Wolbachia in Arthropods and Nematodes – A Historical Perspective“. Issues in Infectious Diseases. Issues in Infectious Diseases. 5 (Wolbachia: A Bug’s Life in another Bug): 1–14.
Liebers, D. et al. (2004): The herring gull complex is not a ring species. Proc Biol Sci. 2004 May 7; 271(1542): 893–901
Losos, J. B. & Schluter, D. (2000): Analysis of an evolutionary species-area relationship. Natue 408: 847-850
Lynch, J. D. (1978): The distribution of leopard frogs (Rana blairi and R. pipiens) (Amphibia, Anura, Ranidae) in Nebraska. J. Herpetol. 12: 157-162
Maley, J. et al. (2017): Late Holocene forest contraction and fragmentation in central Africa. Quaternary Research, 89(1), 43-59.
Martin, C. (1989): Die Regenwälder Westafrikas. Basel: Birkhäuserverlag
Mayr, E. (1942): Systematics and the Origin of Species.
Mayr, E. (1947): Ecological factors in speciation. Evolution 1: 263-288
Mayr, E. (1954): Change of genetic environment and evolution. In J. Huxley, A. C. Hardy, and E.B. Ford (eds): Evolution as a Process, S. 157-180. London: Allen and Unwin
Mayr, E. (1963): Animal Species and Evolution
Mayr, E. (1982): Process of Speciation in animals. In C. Barigozzi (ed): Mechanisms of Speciation, S. 1-19. New York: Alan R. Liss
McNeily, T. & Antonovics, J. (1968): Evolution in closely adjacent plant populations. IV barriersd to gene flow. Heredity 23: 205-218
Murienne, J. et al. (2013): Forest refugia in Western and Central Africa as ‘museums’ of Mesozoic biodiversity. Biol. Lett. 9: 20120932
Murray, T. (2009): Garden Friends & Foes: Trichogramma Wasps. Weeder’s Digest. Washington State University Whatcom County Extension. Archived from the original on 2009-06-21. Retrieved 16 July 2009.
Nilsson, L. A. (1983): Processes of isolation and introgressive interplay between Planathera bifolia (L.) Rich. and P. chlorantha (Cluster) Reichb. (Orchidaceae). Bot. J. Linn. Soc. 87:325-350
Orr, H. A. & Irving, S. (2001): Compley epistasis and the genetic basis of hybrid sterility in the Drosophila pseudoobscura Bogota-USA hybridization. Genetics 158: 1089-1100
Otte, D. (1994): The Crickets of Hawaii: Origin, Systematics, and Evolution. Orthoptera Society/ Academy of Natural Sciences of Philadelphia
Owen, R. B. et al. (1990): Major low levels of Lake Malawi and their implications for speciation rates in cichlid fishes. Proc. R. Soc. Lond. B 240: 519-553
Päckert, M. et al. (2005): The great tit (Parus major) – a misclassified ring species. Biological Journal of the Linnean Society. 86 (2): 153–174.
Palumbi, S. R. (1998): Species formation and the evolution of gamete recognition loci. In D. J. Howard & S. H. Berlocher (eds): Endless forms: Species and Speciation, S. 271-278. Oxford University Press
Palumbi, S. R. & Metz, E. C. (1991): Strong reproductive isolation between closely related tropical sea urchins (genus Echinometra). Mol. Biol. Evol. 8:227-239
Paulay, G. (1985): Adaptive radiation on an isolated oceanic island: The Cryptorhynchinae (Curculionideae) of Rapa revisitied. Biol. J. Linn. Soc. 26: 95-187
Paulus, H. F. & Gack, C. (1990): Pollinators as prepollinating isolation factors: Evolution and specialisation in Ophrys (Orchidaceae). Israel J. Bot. 39: 43-79
Powell, J. A. (1992): Interrelationships between yuccas and yucca moths. Trends. Ecol. Evol. 7: 10-15
Prance, G. T. E. (1982): Biological Diversification in the Tropics. New York: Columbia University Press
Presgraves, D. E. L. et al (2003): Adaptive evolution drives divergence of a hybrid inviability gene between two species of Drosophila. Nature 423: 715-719
Price, T. D. & Bouvier, M. M. (2002): The evolution of F1 post-zygotic incompatibilities in birds. Evolution 56: 2083-2089
Räsänen, M. E. et al. (1995): Late miocene tidal deposits in the Amazonian forest basin. Science 269: 386-390
Rice & Salt (1990) The evolution of reproductive isolation as a correlated character under sympatric conditions: Experimental evidence. Evolution 44: 1140-1152.
Roelofs, W. L. et al. (1987): Sex pheromone production and perception in European corn borer moth is determined by both autosomal and sex-linked genes. Proc. Natl. Acad. USA 84: 7585-7589
Rubinoff, I. (1968): Central American sea-level canal: Possible biological effects. Science 161: 857-861
Ryan, M. J. & Rand, A. S. (1993): Species recognition and sexual selection as a unitary problem in animal communication. Evolution 47: 647-657
Salzburger, W. & Meyer, A. (2004): The species flocks of East African cichlid fishes: recent advances in molecular phylogenetics and population genetics. Naturwissenschaften 91: 277-290
Savolainen, V. et al. (2006): Sympatric speciation in palms on an oceanic island. Nature 441(7090):210-213
Schemske, D. W. & Bradshaw, H. D. (1999): Pollinator preference and the evolution of floral traits in monkeyflowers (Mimulus). Proc. Natl. Acad. Sci. USA 96: 11910-11915
Schliewen, U. & Klee, B. (2004): Reticulate sympatric speciation in Cameroonian crater lake cichlids. Frontiers in Zoology 2004, 1:5
Schliewen, U., Tautz, D. & Pääbo, S. (1994): Sympatric speciation suggested by monophyly of crater lake cichlids. Nature 368, 629–632
Shaw, K. L. (2002): Conflict between nuclear and mitrochondrial DNA phylogenies of a recent species radiation: What mitochondrial DNA reveals and conceals about modes of speciation in Hawaiian crickets. Proc. Natl. Acad. Sci. USA 99: 16122-16129
Smith, M. & Szathmary, E. (1995): Evolution. Prozesse, Mechanismen, Modelle. Heidelberg: Spektrum Akademischer Verlag
Soule, M. (1966): Trands in the insular radiation of a lizard. Am. Nat. 100: 47-64
Spiess, E. B. & Wilke, C. M. (1984): Still another attempt to achieve assortative mating by disruptive selection in Drosophila. Evolution 38: 505-515
Stattersfield, A. J. et al. (1998): Endemic Bird Areas of the World: Priorities for Biological Conservation. Birdlife International, Cambridge, UK
Sturmbauer, C. et al. (2001): Lake level fluctuations synchronize genetic divergences of cichlid fishes in African lakes. Mol. Biol. Evol. 18: 144-154
Sultan, S. E. (2015): Organism & Environment; Ecological Development, Niche Construction, and Adaption. Oxford University Press
Taylor, M.J. (2018): “Microbe Profile: Wolbachia: a sex selector, a viral protector and a target to treat filarial nematodes”. Microbiology 164: 1345-1347
Thoday, J. M. & Gibson, J. B. (1962): Isolation by disruptive selection. Nature 193: 1164-1166
Thoday, J. M. & Gibson, J. B. (1970): The propability of isolation by disruptive selection. Am. Nat. 104: 219-230
Turner, G. F. & Burrows, M. T. (1995): A Model of Sympatric Speciation by Sexual Selection Proceedings of the Royal Society B, 260(1359), S. 287–292
Wagner, W. L. & Funk, V. A. (eds., 1995): Hawaiian Biogeography: Evolution on a Hot-Spot Archipelago. Wahsington: Smithonian Institution Press
Wake, D. B. (1997): Incipient species formation in salamanders of the Ensatina complex. Proc. Natl. Acad. Sci. USA 94: 7761-7767.
Wake, D. B. & C. J. Schneider (1998): Taxonomy of the plethodontid salamander genus Ensatina. Herpetologica 54: 279-298.
Webster, G. (1984): The relations of natural forms, S. 193-218. In Ho, M.-W. & Saunders, P. T. (eds. 1984): Beyond Neo-Darwinism, An introduction to the new evolutionary paradigm. London: Academic Press
Wen, J. (1999): Origin and evolution of the eastern Asian and eastern North American distinct distributions of flowering plants. Annu. Rev. Ecol. Syst. 30: 421-455
Werren, J. H. (1998): Wolbachia and speciation. In D. J. Howard & S. H. Berlocher (eds): Endless forms: Species and Speciation, S. 245-260. Oxford University Press
Wittbrodt. J. et al. (1989): Novel putative receptor tyrosine kinase encoded by the melanoma-inducing Tu-locus in Xiphophorus. Nature 341: 415-421
Wu, C. I. & Hollocher, H. (1998): subtle is nature: Differentiation and Speciation. In: D. J. Howard & S. H. Berlocher 8eds.) Endless Forms: Species and Speciation, S. 339-351. New York: Oxford University Press
Xiang, Q.-Y., et al. (1998): The eastern Asian and eastern and western North American floristic disjunction: Congruent phylogenetic patterns in seven diverse genera. Mol. Phylogenet. Evol. 10: 178-190
Xiang, Q.-Y., et al. (2000): Timing in the eastern Asian-eastern North American floristic disjunction: Molecular clocks confirm paleontological estimates. Mol. Phylogenet. Evol. 15: 462-472
Zeng, Z. B. et al. (2000): Genetic architecture of a morphological shape difference between two Drosophila species. Genetics 154: 299-310


