Teil eins unserer dreiteiligen Reihe zur Frage, was (biologische) Arten eigentlich sind, befasste sich mit der Fragestellung, ob Arten real sind oder eine sprachliche Konstruktion, die die Realität nicht widerspiegele. Es wurde festgestellt, dass Arten eine reale Beschreibung der biologischen Vielfalt darstellen. Teil zwei widmet sich der Frage, wie aber Arten in der Biologie definiert werden und wie diese entstehen.
Die Zahl der bekannten Arten wirkt schier unüberschaubar. Es sind z. B. etwa 5.500 Säugetier- 10.000 Vogel- und 30.000 Fischarten bekannt. Diese schon groß wirkenden Zahlen werden von den Insekten mit etwa 1 Mio. beschriebenen Arten weit übertroffen (Zahlen nach Chapman 2009). Hinzu kommen etwa 250.000 beschriebene ausgestorbene Tierarten, die wir als Fossilien kennen (Raup 1986). Diese Zahlen sind keineswegs vollständig. Das International Institute for Species Exploration (IISE) berichtet, dass jährlich etwa 18.000 neue Arten beschrieben werden. Die Zahl der unentdeckten Arten schwankt zwischen 8 Millionen und nach neuesten Ergebnissen eine Billion (1.000.000.000.000)! Bei dieser unglaublichen Menge an Arten gibt es eine ganze Reihe von Artkonzepten, also wie bzw. nach welchen Kriterien man Arten definiert.
1686 hatte John Ray das Konzept der Art als erster beschrieben, indem er feststellte, dass die Nachkommen ihren Eltern ähnlichsehen (Wilkins 2011). Diese Definition fußt auf einfachen Beobachtungen, schließt aber den Entwicklungsgedanken und die Evolutionsgeschichte aus.
Wilkins (2011) notiert, dass es zwischen 20 und 30 verschiedene Artkonzepte gibt, die sich aber auf sieben Grunddefinitionen zusammenfassen lassen. Dabei beschreiben aber viele dieser Konzepte nicht, was Arten sind, sondern nach welchen Kriterien man sie beschreibt: morphologische, genetische oder über Fortpflanzungsschranken. Die wichtigsten Artkonzepte sollen hier vorgestellt werden (vgl. auch Futuyma 2007, S. 354 f.).
Morphologisches oder typologisches Artkonzept:
Typologisch definierte Arten sind Gruppen von Organismen, die in der Regel nach morphologischen Merkmalen unterschieden werden. Eine nach morphologischen Kriterien definierte Art wird Morphospezies genannt. Morphologie ist ein Teilbereich der Biologie und beschreibt die Form und Struktur von Lebewesen. So lassen sich z. B. Tiger und Löwe morphologisch klar abgrenzen und gelten als Morphospezies (Tiger haben Streifen, Löwen keine etc.). In der Paläontologie, also bei der Benennung fossiler Arten, wird dieses Artkonzept ebenfalls verwendet. Jedoch weist das morphologische Artkonzept eine Reihe von Problemen auf: Einige Arten sind morphologisch einander sehr ähnlich, pflanzen sich aber z. B. nicht miteinander fort, verhalten sich also wie Arten. Man spricht hier von kryptischen Arten. Z. B. kennt man von der Moskitoart Anopheles maculipennis sechs kryptische Arten. Dies hat insofern Bedeutung, da einige dieser kryptischen Arten Malaria übertragen, andere jedoch nicht (Futuyma 2007: S. 356).
Es gibt jedoch weitere Probleme des morphologischen Artkonzeptes. Z. B. durchlaufen viele Arten in ihrer Individualentwicklung verschiedene Stadien, bei denen die Morphologie komplett umgebaut wird. Hier sei als Beispiel die Metamorphose der Raupe zum Schmetterling erwähnt. Viele Arten weisen auch einen auffälligen Sexualdimorphismus auf, also eine starke Unterscheidung der Geschlechter jenseits der Geschlechtsorgane, z. B. der Geschlechtsunterschied bei vielen Vogelarten. Populationen und damit Arten reagieren auch auf sich ändernde Umweltbedingungen, die mit einer Änderung ihrer Morphologie einhergehen kann, man spricht hier von phänotypischer Plastizität. Generell weisen auch einzelne Arten geographische Variationen auf, sodass eine Einteilung der Arten nach morphologischen Merkmalen sich als schwierig erweist. Nicht zu vergessen ist, dass die Arten selbst einem evolutionären Wandel unterliegen, sich ihre Merkmale also im Verlauf der Generationen ändern.
Biologisches Artkonzept und die Entstehung von Arten:
Wesentlich bekannter als das morphologische Artkonzept ist das biologische. Es geschieht frei nach dem Motto: „Alles was sich schart und paart, ist eine Art“. Arten werden also als Populationen aufgefasst, die sich untereinander fortpflanzen und fruchtbare Nachkommen erzeugen. Zwei wichtige Zitate von Ernst Mayrs (1979) sollen diese Definition untermauern:
„Sie [die biologische Artdefinition – Internet-Evoluzzer] heißt ‚biologisch‘ nicht deshalb, weil sie mit biologischen Taxa zu tun hat, sondern weil ihre Definition eine biologische ist. Sie verwendet Kriterien, die, was die unbelebte Welt betrifft, bedeutungslos sind.“ (S. 234)
„Die [biologische] Art besitzt zwei Eigenschaften, durch die sie sich grundlegend von allen anderen taxonomischen Kategorien, etwa dem Genus, unterscheidet. Erstens einmal erlaubt sie eine nichtwillkürliche Definition – man könnte sogar so weit gehen, sie als ‚selbstoperational‘ zu bezeichnen –, indem sie das Kriterium der Fortpflanzungsisolation gegenüber anderen Populationen hervorhebt. Zweitens ist die Art nicht wie alle anderen Kategorien auf der Basis von ihr innewohnenden Eigenschaften, nicht aufgrund des Besitzes bestimmter sichtbarer Attribute definiert, sondern durch ihre Relation zu anderen Arten.“ (S. 234f.)
Der Vorteil dieser Definition im Gegensatz zum morphologischen Artkonzept ist, dass sie „objektiver“ ist. Objektiver in dem Sinne, dass die Unterscheidung von Arten nicht auf abstrakter Unterschiedlichkeit oder subjektiver Einschätzung einzelner Wissenschaftler basiert, sondern auf eine objektiv messbare Tatsache: der Fähigkeit sich untereinander fortzupflanzen. Damit Populationen zu einer Art werden, müssen sich fortpflanzungstechnisch voneinander isoliert sein. Isolationsmechanismen sind eine Voraussetzung hierfür, dass neue Arten entstehen können. Abb. 1 zeigt eine stark vereinfachte Darstellung dieses Prozesses:
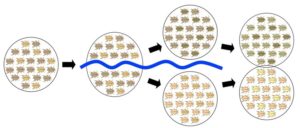
Abb. 1: Artbildung
Eine Population einer Käferart wird durch die Entstehung eines Flusslaufes in zwei Teilpopulationen separiert. Der Fluss fungiert als Fortpflanzungsbarriere, sodass es zu keinem Genaustausch zwischen den beiden Käfer-Populationen kommt. Nach mehreren Generationen mit verschiedenen Mutationen und natürlicher wie sexueller Selektion entwickeln sich beide Populationen in unterschiedliche Richtungen. Wenn nach ausreichend Zeit die Fortpflanzungsbarriere verschwindet (z. B. trocknet der Fluss aus) und die beiden Populationen sich begegnen, sind die Unterschiede zwischen den Populationen so groß, dass sie sich untereinander nicht fortpflanzen; zwei Arten sind aus einer ursprünglichen Art hervorgegangen.
Der in Abb. 1 vorliegende Isolationsmechanismen ist die geographische Isolation. Die dargestellte Artbildung wäre allopatrisch. Die allopatrische Artbildung ist die Evolution genetischer Fortpflanzungsbarrieren zwischen Populationen, die geographisch vollständig getrennt sind. Sie kann eintreten, wenn das Verbreitungsgebiet einer Art durch äußere Prozesse wie beispielsweise Gebirgsbildung, Flüsse oder klimatisch bedingte Landschaftsänderungen in zwei oder mehr Teile aufgespalten wird. Die Teilpopulationen unterliegen dann nicht den exakt gleichen Selektionsfaktoren und auch die jeweils zugehörigen Selektionsdrücke sind verschieden. So entwickeln sie sich aufgrund der geographischen Isolation in den voneinander getrennten Teilen des Verbreitungsgebietes zunehmend unabhängig voneinander weiter (Futuyma 2007, S. 381). Andere Formen der Artbildung sind die peripatrische Artbildung (isolierte Populationen mit kleinem Verbreitungsgebiet in der Peripherie der „Elternart“), parapatrische Artbildung (in biogeographisch benachbarten Teilregionen des räumlich zusammenhängenden Verbreitungsgebiets der Ursprungsart) und sympatrische Artbildung (Fortpflanzungsbarriere innerhalb einer Population ohne gleichzeitige geografische Isolation). Die schematischen Darstellungen dieser Artbildungsprozesse sind in Abb. 2 zu sehen; im dritten Teil unserer Artikelreihe werden wir darauf näher eingehen.
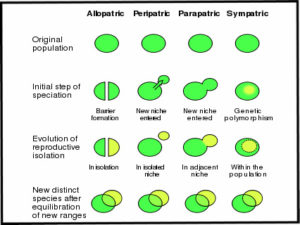
Abb. 2: Formen der Artbildung
Es können unterschiedliche Isolationsmechanismen vorliegen, die bekannteste und am besten untersuchte die ist geographische Isolation. Es gibt aber z. B. auch die phänologische Isolation, wenn z. B. Arten dasselbe geographische Gebiet bewohnen, aber aufgrund unterschiedlicher Aktivitätszeiten (z. B. tag- oder nachtaktive Arten oder unterschiedliche Fortpflanzungszeiten) keinen Kontakt (und damit Fortpflanzung) haben. Des Weiteren gibt es noch die ökologische Isolation (Lebewesen bewohnen unterschiedliche Lebensräume), Isolation aufgrund sexueller Selektion (potentielle Paarungspartner finden sich nicht attraktiv aufgrund falscher Färbungen, falschen Balzverhaltens etc.) und die mechanische Isolation (Unterschiedlicher Bau der Begattungsorgane, sodass eine Fortpflanzung nicht funktionieren kann). Bei diesen genannten Isolationsmechanismen handelt es sich um sog. präzygotische Isolationsmechanismen, weil die Fortpflanzungsbarriere stattfindet, bevor sich eine Zygote (Verschmelzung von Ei und Samenzelle; Befruchtung) bilden kann (Futuyma 2007, S. 362; Abb. 3).
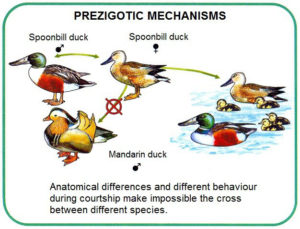
Abb. 3: Präzygotische Isolation am Beispiel zweier Entenarten Löffelente (Spatula clypeata) und Mandarinente (Aix galericulata). Aufgrund anatomischer Unterschiede und Unterschiede im Balzverhalten pflanzt sich die weibliche Löffelente nur mit ihrem männlichen Gegenstück fort und nicht mit der männlichen Mandarinente. So wird eine Kreuzung der beiden Arten verhindert (Beispiel für Isolation aufgrund sexueller Selektion).
Neben einer präzygotischen Isolation gibt es auch eine postzygotische. Hier wirken die Isolationsmechanismen, nachdem eine Befruchtung stattgefunden hat. So kommen zwar Kreuzungen zwischen den Arten (Hybride) zwar vor, die Embryonen sind aber nicht lebensfähig (intrinsisch wirkende postzygotische Isolation) oder es kommen Hybriden vor, diese sind aber steril oder haben eine geringere Fitness (extrinsisch wirkende postzygotische Isolation, vgl. Futuyma 2007, S. 362-363). Abb. 4 verdeutlicht die extrinsisch wirkende postzygotische Isolation am Beispiel der Kreuzung zwischen Pferd und Esel.
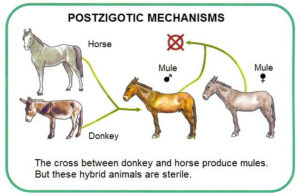
Abb. 4: Postzygotische Isolation am Beispiel der Kreuzung zwischen Pferd und Esel. Mulis sind zwar lebensfähig, aber steril.
Das biologische Artkonzept liefert im Gegensatz zum morphologischen Artkonzept einige Vorteile und konnte viele Mechanismen der Artentstehung erklären (zur weiteren Literatur zur Artentstehung siehe Coyne & Orr 2004, vgl. auch Mayr 1942, 1963). Doch hat auch das biologische Artkonzept seine Grenzen. So gibt es geographisch eindeutig getrennte Populationen, die eindeutig zu einer Art gehören, sich aber nicht kreuzen können. So sind einige Arten klar über mehrere Kontinente verteilt; Löwen gibt es z. B. (noch) in Afrika und Asien und sie werden sich sicherlich unter natürlichen Bedingungen nicht miteinander fortpflanzen können, gelten aber trotzdem als eine Art. Dieser Gedanke ist jedoch für das biologische Artkonzept nicht von Bedeutung, da solche Gegebenheiten experimentell überprüft werden können. Doch bei asexuell vermehrenden Arten scheint das biologische Artkonzept nicht mehr zu greifen.
Gruppen mit kaum oder gar keiner sexuellen Reproduktion
Ein weiteres Problem des biologischen Artkonzeptes ist der Umstand, dass sich dieses auf nur sich sexuell fortpflanzende Arten anwenden lässt. Sich ungeschlechtlich (asexuell) vermehrende Arten, wie z. B. Bakterien, können nach dieser Definition nicht in Arten kategorisiert werden. Ernst Mayr sprach sich sogar dafür aus, Bakterien und andere sich asexuell vermehrende Arten gar nicht als Arten zu bezeichnen. Eine Forderung, die sicherlich zu weit geht, denn man kann, will man biologisches Leben generell klassifizieren, nicht einen Großteil ausschließen. Sich asexuell fortpflanzende Arten werden als Agamospezies bezeichnet. Asexuelle Vermehrung kommt aber nicht nur bei Bakterien vor, sondern liegt auch bei einigen Pflanzen- und Tiergattungen vor. Eine komplette asexuelle Vermehrung bei Tieren und Pflanzen ist jedoch selten, da viele asexuelle Arten sich hin und wieder auch sexuell fortpflanzen. Lediglich die Bdelloidea, einer Ordnung der Rädertierchen (Rotatoria, Rotifera) mit etwa 300 Arten, pflanzen sich seit langer Zeit asexuell durch Parthenogenese fort (Westheide & Rieger 2007, S 269f). Bei der Parthenogenese entstehen die Nachkommen aus unbefruchteten Eizellen. Interessanterweise lassen sich die asexuellen Bdelloidea leichter in Clusteranalysen abtrennen als ihre sich sexuell vermehrenden Verwandten der Ordnung der Monogononta (Holman 1987). Asexuelle Vermehrung kommt auch bei etwa 70 Wirbeltierarten vor, die aber fast alle aus der Hybridisierung sich sexuell fortpflanzender Arten entstanden sind und sich durch Parthenogenese weiter asexuell fortpflanzen (Vrijenhoek et al. 1989, Avise et al. 1992). Diese, sich parthenogenetisch fortpflanzenden, Wirbeltierarten werden auch in Clusteranalysen als abgegrenzte Einheiten erkennbar, da sie von sich sexuell vermehrenden Arten abstammen. Dies kann auch auf sich asexuell fortpflanzende Pflanzenarten zutreffen, wenn sie von sich sexuell fortpflanzenden Arten abstammen (Coyne & Orr 2004, S. 18). Einige Pflanzengattungen bilden jedoch „agamische Komplexe“, lassen sich also schwer klar erkennbaren Arten zuordnen. Hierzu gehört z. B. die Gattung Taraxacum, wozu auch der Löwenzahn gehört (Abb. 5). Aufgrund der Problematik wurden viele ehemalige Arten schon in Sammelarten gestellt, doch da sich auch diese wegen vieler Übergangspopulationen kaum voneinander trennen lassen, werden sie nun zu Sektionen zusammengefasst. So gibt es derzeit neben wenigen „guten“ Arten eine Vielzahl von Pflanzen, die sich nur durch ihre ungefähre systematische Stellung erfassen und benennen lassen. Nach Richards (1973) gibt es bis zu 2000 beschriebene „Mikroarten“ bei Taraxacum. Doch damit nicht genug: Wie schwer die Benennung von Arten bei Taraxacum fällt, zeigt sich daran, dass verschiedene Autoren zu anderen Ergebnissen kommen. Richards (1972) listet 132 Taraxacum-Arten für die Britischen Inseln auf. Als er aber seinen Bestimmungsschlüssel anderen Autoren überreichte, erkannten diese nur 40% der beschriebenen Arten korrekt. Auch bei einigen anderen Pflanzengattungen erweist sich die Artbeschreibung als schwierig, so. z. B. bei den Brombeeren (Rubus), Frauenmantel (Alchemilla), Weißdorne (Crataegus) und bei den Habichtskräutern (Hieracium) (Grant 1981, Richards 1997, Sepp & Paal 1998). Interessant ist hier festzuhalten, dass Hieracium relativ nah verwandt mit Taraxacum ist; beide gehören zur außerordentlich vielfältigen Familie der Korbblütler (Asteraceae, etwa 1.700 Gattungen mit 24.000 beschriebenen Arten). Die anderen „problematischen Gattungen“ gehören zur Familie der Rosengewächse (Rosidae, 90 Gattungen mit 3000 Arten). Bei etwa 620 Pflanzenfamilien mit 16.167 Gattungen und etwa 390.000 Arten fallen die Hand voll „problematischen“ Gattungen nicht ins Gewicht. Zumindest für Alchemilla scheinen einige Untersuchungen mehr Klarheit über die einzelnen Arten und Mikrospecies zu verschaffen (Pihu et al. 2009). Selbstbestäubende Arten, z. B. Vertreter der Gattungen Linanthus und Mimulus sind als diskrete Arten erkennbar und abgrenzbar (Macnair & Gardner 1998, Goodwillie 1999).

Abb. 5: Bei der Gattung Löwenzahn (Taraxacum) lassen sich schwer klar erkennbare Arten zuordnen
Bakterielles Artkonzept – Auch Bakterien haben Arten!
Wie sieht es bei Bakterien aus? Sie als völlig asexuell zu bezeichnen trifft insofern nicht zu, da gerade auch bei ihnen horizontaler Gentransfer sehr häufig vorkommt. So entstanden z. B. 18% der DNA-Regionen des Darmbakteriums Escherichia coli durch horizontalen Gentranfer über einen Zeitraum von etwa 200 Mio. Jahren (Lawrence & Ochman 1998). Aufgrund solcher Tatsachen könnte man behaupten, dass sich Bakterien schwer in diskrete, also klar abzugrenzende Gruppen, einteilen lassen. Jedoch stimmen die meisten Mikrobiologen darin überein, dass sich viele Bakterien anhand phänotypischer Merkmale und DNA-Sequenzen klar in diskrete Einheiten clustern lassen (Cohan 2001, 2002). Z. B. konnten aus einer Bodenprobe in einer Region problemlos zwei Arten der Gattung Bacillus unterschieden werden (Roberts & Cohan 1995, Roberts et al. 1996). Eine Analyse verschiedener Gene konnten klar zwischen Klonen von Neisseria meningitidis und Streptococcus pneumoniae unterscheiden (Feil et al. 1999, 2000). In einer anderen Studie wurden 315 Bakterienstämme der Gattung Neisseria unter Einbeziehung von 155 phänotypischen Merkmalen untersucht. Die Clusteranalysen konnten 31 diskrete Gruppen unterscheiden (Abb. 6, Barrett & Sneath 1994).
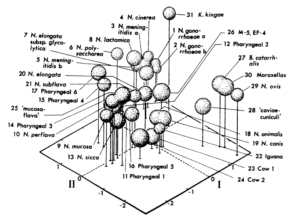
Abb. 6: Cluster-Analyse bei Neissneria nach Barrett & Sneath (1994)
Offensichtlich lassen sich also die asexuellen Bakterien in klare Cluster trennen, also wie die biologischen Arten trennen. Aber das biologische Artkonzept lässt sich aufgrund des Fehlens an Sex nicht wirklich anwenden. Hier stößt das Konzept der biologischen Art also auf seine Grenzen. Die Schlussfolgerung von Ernst Mayr, dass Bakterien daher keine echten Arten darstellen, ist aber abzulehnen. Wenn Arten eine biologische Realität darstellen, ist es ungünstig sie komplett auszuschließen, nur weil ihnen die Sexualität fehlt. Vor allem wenn sich Bakterien leichter in diskrete Cluster zerlegen lassen, als die Arten der Gattung Taraxacum, die zwischen sexueller und asexueller Fortpflanzung wechseln. Wenn sich solche Cluster bilden, dann gibt es auch bei Bakterien eine evolutionäre Entwicklung, die zu diesen Aufspaltungen geführt haben muss. Außerdem ist es auch von medizinischer Bedeutung zu wissen, was man für Bakterien hat, denn keiner würde auf die Idee kommen, dass ein Meningitis-Erreger (Neisseria meningitidis) oder für den Menschen nützliche Bakterien der Darmflora, wie Laktobakterien, dasselbe sind. Welche Möglichkeiten gibt es aber Bakterien als Arten zu klassifizieren. Hier ist das bakterielle Artkonzept eine wichtige Hilfe.
Warum bilden Bakterien diskrete Cluster, lassen sich also als Arten unterscheiden, obwohl sie keine Fortpflanzungsschranken haben? Cohan (2001,2004) geht davon aus, dass natürliche Selektion, gekoppelt mit der Diversität ökologischer Nischen solche Cluster in Symaptrie entstehen lassen.
Rosselló-Mora & Amann (2001) geben folgende Definition zur Bestimmung von Bakterienarten:
„Eine monophyletisch und genomisch kohärentes Cluster einzelner Organismen, die in vielen unabhängigen Merkmalen ein hohes Maß an Ähnlichkeit aufweist und durch eine unterschiedliche phänotypische Eigenschaft diagnostiziert werden kann.”
Folgendes ist als Erklärung hilfreich:
- Ein monophyletisches Cluster ist eine Gruppe eines Bakterienstammes, die auf einen gemeinsamen Vorfahren zurückgeht.
- Bakterienstämme, die ein genomisch kohärentes Cluster bilden, haben eine ähnliche Gensequenz und damit ähnliche Phänotypen.
- In vielen unabhängigen Merkmalen ein hohes Maß an Ähnlichkeit aufweisen heißt, dass zwei Bakterienstämme phänotypische Merkmale aufweisen, die nicht miteinander im Zusammenhang stehen.
- Durch eine unterschiedliche phänotypische Eigenschaft diagnostiziert werden heißt, dass zwei Arten durch bestimmte Merkmale (biochemische Eigenschaften, Morphologie, DNA) klar voneinander abzugrenzen sind.
Um die Bestimmung von Bakterienarten zu verfeinern, führten Bakterien-Taxonomen sog. Typus-Stämme ein (so wie bei der Beschreibung von Tier- und Pflanzenarten es ein sog. Typus-Exemplar gibt, also das Exemplar, welches zur Erstbeschreibung einer Art genommen wurde). Hierbei handelt es sich um einen lebenden bakterienstamm, der als Typus-Exemplar genutzt werden kann, um schwer zu bestimmende Bakterienstämme besser klassifizieren zu können. Im Jahr 1987 versammelten sich wichtige Spezialisten auf dem Gebiet der bakteriellen Taxonomie in Paris, um nach objektiven und stabilen Kriterien für die zukünftige Klassifizierung und Identifizierung von Bakterien zu suchen. Sie sahen voraus, dass Genomdaten den phänotypischen Daten (Physiologie und Biochemie) überlegen sind. Doch die Sequenzierung des Genoms war erst 1995 ohne weiteres möglich. Damals gab es jedoch andere molekulare Methoden, die DNA-DNA-Hybridisierung (DDH), um den Hybridisierungsgrad von Genomen zu messen. Wenn zwei Genome gut hybridisieren, sollten sie ähnliche Nukleotidsequenzen gemeinsam haben.
In einer wegweisenden Arbeit empfehlen Wayne und andere Taxonomen die DDH als Methode zur Definition der Bakterienspezies und ein 70%ige Verwandtschaft als Grenzwert für die Artengrenze (Wayne et al., 1987). Die Arbeit von Wayne et al. wurde mehr als 4.000 Mal zitiert, was bedeutet, dass dieser Vorschlag gut aufgenommen wurde. Zusammenfassend sollte ein Bakterienstamm zu 70% oder mehr mit der DNA des Typus-Stammes hybridisieren, um zu dieser Art zu gehören. Durch weitere genetische Methoden konnte dieses System verfeinert werden. Z. B. kann die „Overall genome relatedness index (OGRI)“ nach Chun & Rainey (2014) die Ähnlichkeit zwischen zwei Genomsequenzen berechnen. Mehrere Algorithmen, wie die „Orthologous Average Nucleotide Identity (OrthoANI)“ nach Lee et al. (2015) sollen dies erleichtern. Der allgemein akzeptierte Grenzwert für die Artengrenze liegt bei 95 bis 96%. Hat man diesen Wert erreicht, sind weitere Methoden notwendig, um sicherzustellen, dass es sich wirklich um eigenständige Arten handelt (Suche nach biochemischen, physiologischen und morphologischen Merkmalen).
Neben den oben erwähnten Artkonzepten soll noch ein weiteres vorgestellt werden, dessen Verwendung immer größere Bedeutung erlangt: das phylogenetische Artkonzept.
Phylogenetisches Artkonzept
Erste phylogenetische Artkonzepte wurden u. a. von Eldredge & Cracraft (1980), Nelson & Platnick (1981), de Queiroz & Donogue (1988) und Cracraft (1983, 1989) entwickelt. Hierbei wird eine Art als eine irreduzierbare Gruppe angesehen, deren Mitglieder von einem gemeinsamen Vorfahren abstammen und die alle eine Kombination bestimmter definierender oder abgeleiteter Merkmale besitzen (Apomorphien). Es basiert also nach den Prinzipien der phylogenetischen Systematik.
In den 1960er Jahren hatte der deutsche Morphologe Willi Hennig ein System ausgearbeitet, welches die verwandtschaftlichen Beziehungen zwischen den Organismen anhand von Merkmalsvergleichen ermitteln konnte. Man spricht von Kladistik oder Phylogenetische Systematik (Hennig 1966). Ein jeder Organismus, will man ihn beschreiben, hat für ihn typische charakteristische Eigenschaften, die man als Merkmale definiert. Diese können Strukturmerkmale sein (also die Anatomie), aber auch physiologische (z. B. Warmblütigkeit), ökologische (wasser- oder landlebend) oder ethologische (Verhaltensweisen). Durch einen Vergleich diverser Merkmale lassen sich die Verwandtschaftsgrade der Organismen ableiten. Gehen die Merkmale auf einen gemeinsamen evolutionären Ursprung zurück, spricht man von Homologien. Der Vergleich der homologen Organe zeigt schon, dass nicht alle Merkmale für die Bestimmung von evolutionären Verwandtschaftsbeziehungen geeignet sind. Man unterscheidet zwischen Plesiomorphien und Apomorphien. Apomorphien sind abgeleitete Merkmale, also welche die, im Vergleich zum Vorfahren der jeweils betrachteten Stammlinie, neu erworben wurden. Plesiomorphien hingegen sind ursprüngliche Merkmale, die schon die Vorfahren hatten. Beim phylogenetischen Artkonzept gelten eben diese Apomorphien als ausschlaggebend.
Daher definiert dieses Konzept eine Art als eine Gruppe mit einer gemeinsamen und einzigartigen Evolutionsgeschichte. Es ist weniger restriktiv als das Konzept der biologischen Arten, da die Fortpflanzung zwischen Mitgliedern verschiedener Arten kein Problem darstellt. Außerdem können aufeinanderfolgende Arten definiert werden, auch wenn sie sich in einer ununterbrochenen Abstammungslinie entwickelt haben und die sexuelle Fruchtbarkeit weiterhin besteht. Das Problem des biologischen Artkonzeptes besteht nämlich darin, dass es nur für heute lebende Arten angewendet werden kann, jedoch für ausgestorbene, fossile Arten nicht überprüfbar ist, da nicht feststellbar, ob diese sich untereinander fortpflanzen würden. Dieses Problem hatte schon Hennig (1966) festgestellt, indem er darlegte, dass die vom biologischen Artkonzept geforderten Fortpflanzungsbarrieren nicht existieren, wenn man die geologische Zeitskala verfolgt. Da Fortpflanzungsbarrieren sich im Verlauf der Evolutionsgeschichte entwickeln, müssen und selbst Anhänger des biologischen Artkonzeptes wie Coyne & Orr (2004) anerkennen, dass Hybridisierungen zwischen verschiedenen Arten gelegentlich vorkommen dürfen. Folgerichtig ist die Kritik vieler Anhänger anderer Artkonzepte berechtigt, Arten nur als Fortpflanzungsgemeinschaften zu definieren. Weiterhin seien für viele beschriebene Arten keine oder kaum reale oder potentielle Fortpflanzungsbarrieren beschrieben (Wheeler 1999). Die Beschreibung der Arten folgt in den seltensten Fällen der Untersuchung nach Fortpflanzungsbarrieren, sondern hauptsächlich nach Kriterien der Morphologie, Physiologie oder genetischer Unterschiede. D. h., wenn man neue Arten entdeckt oder beschreibt, geht man nach typologischen oder phylogenetischen Methoden vor (Futuyma 2007, S. 363). Mit dem phylogenetischen Artkonzept besteht dieses Problem nicht, da es Arten nicht nur auf die (sexuelle) Fortpflanzung reduziert. Weil sexuelle Fortpflanzung kein Universalkriterium des Lebens ist (da sich viele Arten auch asexuell vermehren), besteht auch kein Grund weshalb Arten als natürliches Produkt der Evolution ausschließlich durch sexuelle Fortpflanzungsbarrieren definiert werden sollen. Diese Definition mag für viele Organismengruppen hinreichend sein, aber eben nicht für alle.
Schlüsselprinzip des phylogenetischen Artkonzeptes ist es, dass Organismen eindeutig „diagnostizierbar“ sein müssen, d. h. sie müssen über Eigenschaften verfügen, die andere Arten nicht haben. Arten müssen dabei zu 100% diagnostizierbar sein, also als klar voneinander getrennte Einheiten bzw. Populationen erkennbar sein. Mit anderen Worten, Mitglieder der Art sollten eine Kombination von Merkmalen teilen, die anderen Arten fehlen. Das phylogenetische Artenkonzept verlangt, dass alle Mitglieder einer Art ein bestimmtes Merkmal haben, welches kein Mitglied einer anderen Art hat. Wie Anhänger des phylogenetischen Artkonzeptes hervorheben, gehören verschiedene Populationen innerhalb einer Art an, wenn diese durch dieselben Merkmale und dieselbe Evolutionsgeschichte definiert sind und aus demselben Vorfahren hervorgehen.
Entsprechend sind sie genetisch voneinander isoliert, aber nicht gezwungenermaßen durch Fortpflanzungsbarrieren. Die Bezeichnung „phylogenetisch“ wurde vergeben, weil nach diesem Konzept Arten die Endpunkte eines Kladogramms sind; das heißt, sie sind die am wenigsten einschließenden phylogenetischen Einheiten. Das phylogenetische Artkonzept steht in vielerlei Hinsicht als Konkurrenz zum biologischen Artkonzept. Das liegt nicht zuletzt daran, dass Taxa, die unter dem biologischen Artkonzept als eine Art definiert wurden, mithilfe des phylogenetischen Artkonzeptes in mehrere Arten aufgespalten wurden. Während das biologische Artkonzept das Konzept derjenigen ist, die mehrere Arten zu einer zusammenfassen („Lumpers“), neigt das phylogenetische Artkonzept zur Artaufspaltung. Man wirft dem phylogenetischen Artkonzept eine taxonomische Inflation vor. Dazu gleich mehr.
Die Idee, dass Arten genetisch differenzierter sein sollten als infraspezifische Gruppen (bloße Unterarten oder Populationen), geht auf Ayala et al. (1974) zurück, der Werte für die genetische Distanz unter Verwendung verschiedener Proteine für verschiedene Tiergruppen verglich. Anhand von Wirbellosen, Fischen, Salamandern, Eidechsen und Nagetieren als Testfälle zeigte er, dass sich Arten tendenziell stärker unterscheiden als Unterarten, die sich wiederum stärker unterscheiden als verschiedene lokale Populationen. Es gibt jedoch Überschneidungen. Man kann einfach nicht sagen, dass ein gewisser Grad an Unterschied Arten anzeigt, ein geringerer Grad Unterarten und so weiter. In jüngerer Zeit hat die Verfügbarkeit der DNA-Sequenzierung eine enorme Menge an Daten geliefert, mit denen ähnliche Übungen durchgeführt werden können. Leider wurde das, was als Faustregel begann, häufig auf eine ziemlich starre Art und Weise verwendet. Obwohl wir davon ausgehen können, dass sich Arten durchschnittlich genetisch stärker voneinander unterscheiden als Unterarten, ist es nicht möglich zu sagen, dass bei einem gewissen Grad an Sequenzunterschieden (sagen wir mal 1%) es sich um Arten und darunter um Unterarten, Populationen etc. derselben Art handelt. Entscheidend nach dem phylogenetischen Artkonzept ist nicht die quantitative Anzahl der Unterschiede, sondern, ob es sich um genetisch isolierte (also mit Vorhandensein erblich fixierter Unterschiede) Einheiten handelt. Hierin unterscheidet sich das phylogenetische Artkonzept vom genetischen Artkonzept (sensu Bradley & Baker 2001, Baker & Bradley 2006), welches Arten zwar als isolierte, sich miteinander fortpflanzende genetische Einheiten betrachtet, ihren Betrachtungsschwerpunkt jedoch auf die eher subjektive Einschätzung quantitativer genetischer Unterschiede legen. Grovers & Grubb (2011) verfeinern daher das phylogenetische Artkonzept, indem sie betonen, dass eine Art „eine Population oder eine Ansammlung von Populationen, die vererbbare Unterschiede zu anderen Populationen oder Ansammlungen von Populationen aufweist“, ist.
Taxonomische Inflation?
Tatsächlich sind solche Aufspaltungen von Arten durch das phylogenetische Artkonzept geschehen. Anhand einiger aktueller Beispiele soll dies erläutert werden.
Das phylogenetische Artkonzept hat bei einigen Tiergruppen quasi zu einer „Explosion“ neuer anerkannter Arten geführt – und zwar bei Tiergruppen, die sonst als relativ gut beschrieben gelten. Phylogenetische Analysen einer Familie der Huftiere, die man als „Boviden“ (Familie Bovidae, auch Hornträger, Vgl. Abb. 7) bezeichnet, führte zu einer Verdoppelung der Artenzahl (Groves & Leslie 2011, Groves & Grubb 2011, Castello 2015). Zu den Boviden zählen bekannte Huftiere wie Antilopen, Rinder, Schafe und Ziegen. Waren nach „traditioneller“ Sichtweise etwa 140 Boviden-Arten anerkannt, sind es nun über 279 Arten (nach Castello 2015). Dies ist dem Umstand zu verdanken, dass einige Unterarten und geographischen Variationen in den Artstatus erhoben wurden. Bei einigen Arten kam es regelrecht zu einer Potenzierung. Zwei Beispiele sollen dies verdeutlichen: eine kleine Antilopenart aus Afrika, der Blauducker (Philantomba monticola) wird nun in etwa 10 kaum unterscheidbare Arten aufgetrennt. Der ebenfalls in Afrika vorkommende Buschbock (Tragelaphus scriptus) wird nun in 8 Arten unterschieden. Eine Erweiterung der Artenzahl wurde auch bei anderen Huftieren beschrieben, so bei Elefanten (Rohland et al. 2010, Meyer et al. 2017; vgl. Abb. 7) und Giraffen, die nun in 4 Arten unterschieden werden (Fennessy et al. 2015 Abb. 8). Diese Aufspaltung in mehrere Arten findet sich nicht nur bei Huftieren, sondern auch bei anderen Säugetieren (z. B. Primaten), Vögeln, Amphibien und anderen Tiergruppen.

Abb. 7: Nach dem phylogenetischen Artkonzept gibt es in Afrika zwei Elefantenarten: Savannenelefant (Loxodonta africana) und Waldelefant (Loxodonta cyclotis).

Abb. 8: Giraffen werden nun in vier Arten unterschieden: Nordafrikanische Giraffe (Giraffa camelopardalis), südafrikanische Giraffe (G. giraffa), Massai-Giraffe (G. tippelskirchi) und Netzgiraffe (G. reticulata).
Eine Reihe von Wissenschaftlern kritisiert diese „taxonomische Inflation“ (z. B. Heller et al. 2013, Zachos 2014a, b, Zachos et al. 2013), d. h. es würden mehr Arten anerkannt, als tatsächlich existieren würden. Diese Aufspaltungen seien, zumindest bei den Boviden, morphologisch nicht nachvollziehbar. Treffen diese Vorwürfe soweit zu? Liegt eine taxonomische Inflation vor?
Die zwei afrikanischen Elefantenarten, z. B., – Wald-Elefant und Savannen-Elefant (Abb. 7) – unterscheiden sich in mehreren Merkmalen voneinander, wenn man genauer hinsieht: Der Wald-Elefant ist deutlich kleiner, hat weniger gebogene Stoßzähne und rundere Ohren. Die oben zitierten Studien (Rohland et al. 2010, Meyer et al. 2017) belegen aber weiterhin, dass die zwei afrikanischen Elefantenarten sich genetisch so stark voneinander unterscheiden wie asiatischer Elefant (Gattung Elephas) und Mammut (Gattung Mammuthus). Zwar kommen in einigen Gebieten Zentralafrikas Hybridisierungen zwischen Wald- und Savannen-Elefant vor (Groves & Grubb 2000), doch sind diese Hybridisierungen regional beschränkt, relativ selten und es zeigen sich zwei genetisch klar trennende Linien (Murata et al. 2009, Ishida et al. 2011). Wir haben im ersten Teil kennengelernt, dass eine gelegentliche Hybridisierung zweier nah verwandter Arten keineswegs den Artstatus aufhebt, etwas, was selbst vom biologischen Artkonzept mittlerweile anerkannt wird.
Verteidiger des phylogenetischen Artkonzeptes heben hervor, dass der Vorwurf der taxonomischen Inflation nicht berechtigt ist, sondern versteckte und tatsächlich vorhandene Unterschiede zwischen Arten entdeckt werden, die sonst unerschlossen blieben. Cotterill et al. (2014) betonen, dass die „traditionelle“ Systematik, die den Vorwurf der taxonomischen Inflation bringt, unter der numerischen Taxonomie (=Phänetik) leidet. Hierbei handelt es sich um eine nach Sokal & Sneath (1963) entwickelte Arbeitsrichtung, die sich, mithilfe computergestützte Verfahren, auf nach möglichst vielen Merkmalen berechnete Ähnlichkeitswerte (overall-similarity) stützt. Die phylogenetischen Systematiker kritisieren hieran, dass alle Merkmale gleich gewertet werden und nicht nach ursprünglichen und abgeleiteten Merkmalen unterschieden wird. Nur letztere sind für die Erschließung der verwandtschaftlichen Beziehungen verwertbar. Gerade dies bezieht die phylogenetische Systematik mit ein. In Bezug zur Taxonomie der Boviden bemerken Cotterill et al. (2014), dass geographische Variationen nicht einfach auf den Status einer Art erhoben wurden, sondern die vorhandenen taxonomischen Daten qualitativ neu untersucht und durch neuere Daten ergänzt wurden. Dadurch konnten erst neue Arten unterschieden werden. Weiterhin betonen sie, dass es an praktikablen Beweisen mangele reproduktive Isolation als einziges Kriterium zur Artdefinition zu nutzen. Dadurch werden unbegründete taxonomische Entscheidungen getroffen, wie die Unterscheidung von Ökotypen oder polytypen Formen innerhalb einer Art, deren systematische Abgrenzung willkürlich ist und subjektiven Charakter trägt.
Viele Arten wurden durch die numerische Taxonomie als polytypische Arten angesehen. D. h. Arten bestanden aus mehreren Unterarten, bilden einen sog. Rassen- oder Formenkreis. Der Grundgedanke polytypischer Arten ist, dass zwar Arten als diskrete Einheiten erkennbar sind, Variationen – zu denen auch Unterarten gehören – jedoch ein Kontinuum innerhalb einer Art bilden. Unterarten werden dabei als geographische Variationen derselben Art verstanden. Unterarten sollten unmittelbar der Art untergeordnet und mit ihrem eigenen Status in der Nomenklatur, dem Trinomial, versehen werden: Jede Unterart innerhalb jeder Art fügt nach dem Binomial einen dritten Namen hinzu. Vom Löwen werden z. B. verschiedene Unterarten anerkannt; der Indische Löwe heißt dann z. B. Panthera leo persica, der eiszeitliche ausgestorbene Höhlenlöwe hat den Namen Panthera leo spelaea, der ostafrikanische Massai-Löwe Panthera leo massaicus. Es handelt sich hierbei um ein und dieselbe Art, die jedoch in geographische Populationen eingeteilt wird. Dabei ging die numerische Taxonomie sehr konservativ vor und hatte unberechtigterweise mehrere Arten zu einer zusammengefasst, indem man aus einzelnen Arten Unterarten machte, obwohl diese nicht durch Zwischenformen verbunden wurden.
Mit der phylogenetischen Systematik und dem phylogenetischen Artkonzept gerieten die hauptsächlich numerisch klassifizierten polytypischen Arten einer kompletten Revision. Die Problematik bestand schon in der Vorstellung wie allopatrische, also geographisch getrennte Populationen, Taxa auf ihren biologischen Artstatus (Kriterium der Fortpflanzung) überprüft werden sollten.
Aufgrund der Unterscheidung zwischen ursprünglichen (plesiomorphen) und abgeleiteten (apomorphen) Merkmale konnten bei vielen Unterarten neue Daten ermittelt werden, die aus diesen Unterarten eigenständige Arten machten. In anderen Fällen wurden polytypische Arten revidiert. Während der Unterartstatus des Asiatischen Löwen (Panthera leo persica) als gesichert gilt, sind die genauen genetischen Verhältnisse der afrikanischen Löwen noch nicht restlos geklärt. Neuere molekulargenetische Untersuchungen ergaben allerdings, dass die Löwen Afrikas sich genetisch in zwei deutlich verschiedene Populationen aufspalten lassen, wobei sich jene im Westen und den Zentralteilen Afrikas deutlich von jenen in Süd- und Ostafrika unterscheiden. Erstere sind den Analysen zufolge näher mit Asiatischen Löwen als mit den afrikanischen Formen im Süden und Osten des Kontinents verwandt. Als mögliche Erklärung hierfür wird angeboten, dass der Löwe im späten Pleistozän in Westafrika ausstarb und diese Gebiete später von Asien herkommend neu besiedelte. Für diese Hypothese spricht auch die nahe genetische Verwandtschaft der Westafrikanischen Löwen untereinander (Bertola et al. 2011)
Der Vorwurf der taxonomischen Inflation kann durch die Kritik der numerischen Taxonomie entkräftet werden. Sangster (2009) bemerkt, dass die Erhöhung der Artenzahl bei Vögeln nicht das Resultat einer taxonomischen Inflation darstelle, sondern Ergebnis neuer taxonomischer Fortschritte ist. Er untersuchte dabei 747 Vorschläge den taxonomischen Rang von Vögeln im Zeitraum von 1950-2007 zu revidieren (z. B. Unterarten als Arten anzuerkennen). Dabei wurden 84,6% der neuen Arten durch neue taxonomische Daten unterstützt und viele neu beschriebene Arten (63,4%) wurden nicht nach den Kriterien des phylogenetischen Artkonzeptes beschrieben. Daher findet diese Studie keine Unterstützung für die Idee, dass die Zunahme der Arten in erster Linie erkenntnistheoretisch und nicht durch neue empirische Daten erfolgt ist. Diese Studie zeigt, dass frühere Behauptungen über die Ursachen und Auswirkungen der taxonomischen Inflation keine empirische Unterstützung haben.
Dass es sich bei den Neubeschreibungen nicht um eine taxonomische Inflation, sondern um reale Arten handelt, konnte Groves (2014) auch anhand von Primaten feststellen. Hier gab es lange Zeit sogar das absolute Gegenteil der taxonomischen Inflation: Die Primaten-Taxonomie war lange Zeit extrem konservativ und hat verschiedene Arten in eine zusammengefasst (sog. „lumping“). Ernst Schwarz befasste sich in den 1920er Jahren mit den Primaten Afrikas (Schwarz 1928a,b,c, 1929, 1931a, b, c, 1934). Er vertrat die Ansicht, dass viele Arten polytypisch sind. Das zeigt sich besonders bei seiner Einteilung der Gattung Schwarz-weißer Stummelaffen (Gattung Colobus). Diese 5 Arten (Abb. 9), die die Regenwaldgebiete West- und Zentralafrikas bewohnen und deren Verbreitungsgebiete sich teilweise überlappen, fasste Schwarz (1929) zu einer Art (C. polykomos) zusammen. Während der „echte“ C. polykomos in Westafrika vorkommt (Liberia, Sierra Leone, Elfenbeinküste), wurden die anderen 4, hauptsächlich zentralafrikanischen Arten als Unterarten von C. polykomos aufgefasst. Diese Einteilung macht jedoch wenig Sinn: zum einen gibt es Überlappungsgebiete bei einzelnen Arten, wo keine Hybridisierungen vorkommen, zum anderen unterscheiden sich diese Arten in Morphologie, Ernährungsweise, Verhalten, Darmflora und Genetik (Groves 2014). Diese Merkmale näher zu untersuchen und zu dem Ergebnis zu kommen, dass es sich um mehrere Arten handeln muss, ist keine taxonomische Inflation, sondern eine Anerkennung von Tatsachen. Untersuchungen der Sifaka-Lemuren (Gattung Propithecus) aus Madagaskar, der roten Stummelaffen (Gattung Piliocolobus) und der Schwarzmangaben (Gattung Lophocebus) aus Afrika kamen ebenfalls zu dem Ergebnis, dass in diesen Gruppen zu wenige Arten beschrieben wurden, da es auffällige Unterschiede in der Ernährung, Verhalten und weiteren Merkmalen gibt.

Abb. 9: Die Gattung der Schwarz-weißen Stummelaffen (Colobus). 1: Geoffry-Stummelaffe (C. vellerosus), 2. Angola-Stummelaffe (C. angolensis), 3. Schwarzer Stummelaffe (C. satans), 4, 5, & 6: Guereza (C. guereza), 7: Bärenstummelaffe (C. polykomos).
Abschließende Betrachtung: kritische Unterstützung des phylogenetischen Artkonzeptes
Eine der entscheidendsten Kritiken an der phylogenetischen Systematik und ihrer Diagnose zur Artunterscheidung machten Zachos et al. (2013a). Sie kritisieren das Konzept, weil quasi jede Population durch die Diagnose kleinster Fragmente oder Merkmale zur Art erhoben werden kann, wenn die Marker über ein ausreichendes Auflösungsvermögen verfügen. Da sich bei praktisch jeder Organismengruppe geringfügige Unterschiede ergeben, fördere das Konzept die extreme Aufteilung der Arten in immer kleinere Gruppen (vgl. Coyne & Orr 2004, S. 459f.). Jede Population, bei denen z. b. genetische Unterschiede fixiert sind – und sei es nur der Austausch eines DNA-Basenpaares – könnte als Art definiert werden (Futuyma 2007, S. 355). Das Problem dieser Kritiken ist jedoch, dass sie zwar genannt, nicht aber empirisch belegt werden. Die grundsätzliche Frage, ob schon der Austausch eines Basenpaares zur Beschreibung einer neuen Art führt, wirkt unter diesen Umständen wie ein Strohmannargument, welches nicht näher untermauert werden muss. Zweifelsohne ist das phylogenetische Artkonzept nicht perfekt. Natürlich besteht auch die Gefahr, dass durch die falsche Auswahl von Merkmalen zu viele (oder zu wenige) Arten beschrieben werden – und es wurde ja im Artikel zur Konstruktionsmorphologie dargelegt, dass die phylogenetische Systematik daran schwächelt, den Organismus als eine Ansammlung von Merkmalen aufzulösen und ggfs. nicht immer Apomorphien von Plesiomorphien unterscheiden kann. Doch diese Problematik kann durch neue empirische Daten, intensivere Diskussionen und Analysen der biologischen Vielfalt prinzipiell gelöst werden. Das phylogenetische Artkonzept hat auch im Vergleich zum biologischen (und aller anderen Artkonzepte) eine Reihe an Vorteilen:
- Es schließt – anders als das biologische Artkonzept – asexuell vermehrende Arten mit ein
- Es hat kein Problem mit gelegentlicher Hybridisierung zwischen nah verwandten Arten – etwas, was das biologische Artkonzept eingestehen musste
- Es schließt die Evolutionsgeschichte der Arten mit ein
- Durch seine Einteilung in apomorphe und plesiomorphe Merkmale gibt es den Merkmalen eine besondere Qualität
- Es ist sowohl bei allopatrischen wie sympatrischen Arten anwendbar
- Es reduziert die Arten nicht als reine Fortpflanzungsgemeinschaften, oder – wie beim genetischen Artkonzept – auf den prozentualen Anteil genetischer Unterschiede, sondern misst ihnen auch andere Qualitäten zu. Damit ist es in seiner Analyse „objektiver“ und im wissenschaftlichen Sinne sind die Hypothesen besser zu überprüfen
Natürlich hat auch das phylogenetische Artkonzept seine Grenzen, vor allem in der Auswahl der Merkmale. Doch keineswegs ist das ein unlösbares Problem. Auch ist bei weitem nicht gesagt, dass die oben erwähnten Artaufspaltungen bei Boviden, Elefanten, Giraffen und Schwarz-weißen Stummelaffen völlig abgeschlossen sind. Vielleicht lassen sich weitere Arten entdecken, vielleicht lassen sich einzelne doch wieder zu einer Art zusammenfassen. Tatsache bleibt aber, dass das phylogenetische Artkonzept entdeckt hat, dass die Arten reichhaltiger sind, also eine “kryptische” Diversität vorliegt, die unbedingt erforscht werden muss.
Das hat auch Konsequenzen für den Artenschutz. Biologie ist Wissenschaft; Artenschutz ist (leider) politisch motiviert. Es wurde behauptet, dass die Folgen der phylogenetischen Artkonzeptes für die Erhaltung gravierend sind, weil bedrohte Arten fälschlicherweise in mehrere Einheiten aufgeteilt werden, was für die Erhaltungszucht die Gefahr birgt, dass es zum Verlust der genetischen Vielfalt führen würde. Das wiederrum erhöhe das Risiko des Aussterbens dieser Arten (Zachos et al. 2013b). Das Problem hierbei ist aber, dass keine empirischen Daten und plausiblen Annahmen für diese Behauptung vorliegen. Tatsächlich birgt das unnötige Zusammenfassen von Arten die Gefahr den Artenschutz zu gefährden und eine große Anzahl an Arten vor Erhaltungsbemühungen verborgen blieb (vgl. Gutierrez & Helgen 2013). Rylands & Mittermeier (2014) haben sich auch gegen die Behauptungen eines schädlichen Einflusses des phylogenetischen Artkonzeptes auf die Erhaltung ausgesprochen. Die Erhöhung der Anzahl der Boviden-Arten unterstreicht die hohe Priorität des Schutzes sowohl der Antilopen in den Hotspots der biologischen Vielfalt Afrikas als auch der evolutionär unterschiedlichen Abstammungslinien von Ziegen und Schafen in den Gebirgen der nördlichen Hemisphäre (Cotterill, Groves & Taylor 2017). Würden z. B. die mindestens 5 realen Arten der Schwarz-weißen Stummelarten als eine Art zusammengefasst, bestünde da überhaupt die Notwendigkeit des Artenschutzes für diese bedrohten Affen?
Zachoes et al. (2013a, S. 3) führen aber noch eine weitere Kritik ein: „Wie viele Arten gäbe es, wenn diese Überlegung [der phylogenetischen Systematik – I. E.] beispielsweise auf Haushunde oder sogar auf Menschen angewandt würde? Besonders aufschlussreich sind häusliche Formen, da sich viele Rassen morphologisch völlig unterscheiden (100% Diagnosefähigkeit!) und sich dennoch leicht und frei miteinander kreuzen.“ Doch auch diese Kritik ist ein Missverständnis des phylogenetischen Artkonzeptes. Wie oben schon erwähnt, geht es nicht um die Anzahl der Unterschiede, sondern darum, ob Populationen klar diagnostizierbar sind. In Bezug zu Menschen lässt sich klar belegen, dass die Menschheit ein globales Bevölkerungskontinuum bildet; anders als die Extreme des Spektrums erscheinen mögen, bilden sie ein genetisches Kontinuum, und es gibt keine Punkte, an denen dieses Kontinuum in diagnostizierbare Segmente unterteilt werden kann, und es kann auch nicht behauptet werden, dass es jemals solche Bruchstellen in der gesamten Region gegeben in unserer Geschichte seit dem späten Pleistozän (vor 126.000 Jahren) gegeben hat (Groves 2014). Um es zu wiederholen:
Schlüsselprinzip des phylogenetischen Artkonzeptes ist es, dass Organismen eindeutig „diagnostizierbar“ sein müssen, d. h. sie müssen über Eigenschaften verfügen, die andere Arten nicht haben. Arten müssen dabei zu 100% diagnostizierbar sein, also als klar voneinander getrennte Einheiten bzw. Populationen erkennbar sein. Mit anderen Worten, Mitglieder der Art sollten eine Kombination von Merkmalen teilen, die anderen Arten fehlen. Das phylogenetische Artenkonzept verlangt, dass alle Mitglieder einer Art ein bestimmtes Merkmal haben, welches kein Mitglied einer anderen Art hat. Wie Anhänger des phylogenetischen Artkonzeptes hervorheben, gehören verschiedene Populationen innerhalb einer Art an, wenn diese durch dieselben Merkmale und dieselbe Evolutionsgeschichte definiert sind und aus demselben Vorfahren hervorgehen. Nun gibt es kein Merkmal, kein Charakteristikum, welches es erlaubt Menschen in verschiedene Rassen oder gar Arten einzuteilen – gerade auch aus dem Blickwinkel des phylogenetischen Artkonzeptes. Kurzum: Menschen sind keine polytypische Art und das phylogenetische Artkonzept fasst uns als eine Art zusammen. In Bezug zu den Haushunden – und bei domestizierten Tieren allgemein – sei erwähnt, dass es sich hierbei nicht um Produkte der natürlichen Evolution handelt, sondern das Ergebnis der menschlichen Zucht darstellen. Haustiere fallen daher nicht in ein anerkanntes und kohärentes Taxonomiesystem (Gentry et al.2004, p. 646).
Grundsätzlich sollten wir uns bei der Untersuchung und Beschreibung von Arten nicht durch gewisse Vorurteile blenden lassen. Aus unserer Sicht mögen die in Abb. 9 dargestellten Arten der Schwarz-Weißen Stummelaffen ähnlich aussehen, doch der genaue Blick, die genaue Analyse zeigt, dass es sich hierbei tatsächlich um verschiedene Arten handelt. Wie ähnlich oder verschieden die Individuen einer Art uns vorkommen bzw. erscheinen, sollten kein Kriterium zur Einstufung von Arten sein – und genau solche „numerischen“ Fehleinschätzungen meidet das phylogenetische Artkonzept.
Bezüglich der Vorteile der phylogenetischen Artdefinition lesen wir bei Zrzavy et al. (2009, S. 363-364):
“Dieses pragmatische Konzept (eine Art ist in einem bestimmten Merkmal uniform und gleichzeitig auch einzigartig) entspricht merkwürdigerweise am besten der ursprünglichen Absicht, eine Art als eine unabhängige evolutionäre Linie zu erfassen. (…) Gerade die Tatsache, dass Genfluss innerhalb von phylogenetischen Arten stattfindet, aber nicht zwischen verschiedenen Arten, führt zum Vorkommen von einzigartigen, aber im Rahmen einer Art uniform verbreiteten Merkmalen. Dadurch kommen wir zwar auf einem Umweg wieder zu Mayrs biologischer Art zurück, die Artzugehörigkeit stellen wir allerdings durch die Analyse der Eigenschaften der Individuen fest, also durch etwas Reales, das wir tatsächlich vor uns sehen, und nicht anhand von Spekulationen über die Populationsgenetik der betreffenden Organismen, über die wir üblicherweise gar nichts wissen.”
Viele Artkonzepte – also doch nicht real?
Wir hatten in Teil eins festgestellt, dass Arten eine biologische Realität darstellen. Doch wenn sie so real sind, warum gibt es dann so viele konkurrierende Artkonzepte? Es sollte hier nochmal verdeutlicht werden, dass jedes Artkonzept von der Prämisse ausgeht, dass Arten eine reale Einheit sind, d. h. die Anhänger verschiedener Artkonzepte debattieren über reale Dinge. Die Debatte über die Artkonzepte setzt also die Realität der Arten voraus, um diese dann definieren zu können. Dass es so viele Artkonzepte gibt, hat schlicht und einfach mit der Komplexität der biologischen Vielfalt zu tun: Wir haben die verschiedensten Organsimen, Pflanzen, Tiere, Pilze, Bakterien. Die einen vermehren sich sexuell, andere wiederrum asexuell und einiges können beides. Hinzu müssen ökologische Nische, Evolutionsgeschichte, Entwicklungsbiologie, Stoffwechselprozesse, Genetik und die verschiedenen Baupläne berücksichtigt werden. Bei dieser Vielfalt des Lebens ist es offensichtlich, dass nicht jedes Artkonzept auf alle Lebewesen gleich gut angewendet werden kann. Grundsätzlich kann ein jedes Lebewesen – je nach Forschungsschwerpunkt – unterschiedlich betrachtet werden. Das trifft nicht zwangsweise nur auf das Konzept der Art zu. Wir sehen uns z. B. gerne als Individuen und beschreiben uns als solche. Nichtsdestotrotz leben wir in einer Gesellschaft, wo Individuen miteinander interagieren und Familie, Gesellschaft und Staat bilden. Zum anderen sind wir auch jenseits von Staat und Gesellschaft keineswegs alleine. In unseren Gedärmen tummelt sich eine fast unendlich wirkende Anzahl von Mikroorganismen, die die Zahl unserer eigenen Körper bei weitem übertrifft. Außerdem ist selbst jede unserer Körperzelle das Produkt einer Symbiose, da einige unserer Zellorganellen (z. B. die Mitochondrien) ursprünglich Bakterienzellen waren …
Wenn wir also von Symbiosen oder von Gesellschaftswissenschaften reden, wird dadurch das Konzept des Individuums zur Illusion? Warum sollte das mit Arten anders sein?
Wenn wir Berge, Flüsse und Menschen identifizieren können, können wir auch Arten identifizieren. Nur weil sie komplex sind, heißt es nicht, dass sie nicht existieren. Offensichtlich wird eine Ein-Satz-Definition nicht alles abdecken und die Gründe, warum und wie wir eine Gruppe von Lebewesen als eine Art beschreiben, ändern sich aufgrund neuer Informationen ständig. Nur weil es nicht immer einfach ist, heißt das nicht automatisch, dass es das nicht gibt. Alle diese Kommentare, die sagen “oh Leute mögen es einfach zu kategorisieren” oder Unsinn wie “die Natur lässt sich nicht kategorisieren“, entscheiden sich dafür, nicht wirklich darüber nachzudenken, warum wir Dinge tun, um zu bestimmen, was verschiedene Arten sind. Dass eine Ziege und ein Tannenbaum sich nun mal nicht untereinander fortpflanzen können, ist eine biologisch sehr relevante Tatsache. Evolution als Wissenschaft lässt ihre Hypothesen auf den Wahrheitsgehalt überprüfen und auf diese Weise können wir die Geschichte des Lebens und die verwandtschaftlichen Beziehungen der Lebewesen untereinander rekonstruieren. Leider ist das taxonomische Wissen außerhalb biologisch versierter Menschen sehr gering, was Vorurteile über die „Nicht-Realität“ der Arten vergrößert. Z. B. werden Pilze gerne als Pflanzen bezeichnet, obwohl Pilze mit Tieren viel enger verwandt sind als mit Pflanzen. Die Kategorisierung des Lebens in Arten ist keine menschliche Erfindung, sondern Menschen sind in der Lage (bzw. haben damit begonnen), diese biologische Tatsache zu ergründen. Arten sind die Einheit, bei der die Evolution ihre Wirkung entfaltet, z. B. als Gruppe von Lebewesen, die gemeinsame Merkmale hat und die selektiert werden. In diesem Sinne sind Arten nicht nur ein nützliches Konzept, sondern für das Evolutionsgeschehen fundamental. Differenzen der Artdefinitionen können nur durch weitere Forschung gelöst werden und nicht darüber, ob sie real sind oder eine Erfindung des menschlichen Geistes.
Bei Zrzavy et al. (2009, S. 364) lesen wir:
“Die Versuche, die Arten durch irgendeine erschöpfende Defi nition zu erfassen, sind wahrscheinlich schon von vorneherein zum Scheitern verurteilt. Die Probleme mit der ‘Artdefinition’ entstehen aber nicht etwa, weil es keine Arten gäbe und weil sie nur die durch uns gebildeten Kategorien wären, mit deren Hilfe wir uns in der komplizierten Welt orientieren. Gerade im umgekehrten Fall – wenn die Arten nur logische Klassen wären (wie ‘Obst’ und ‘Gemüse’) – würden wir uns schon irgendwie einigen. Die Schwierigkeit liegt nur darin, dass die Arten als unabhängige evolutionäre Individuen der höheren Ordnung wirklich existieren, und gerade weil die Arten lebendig, veränderlich und unbeständig sind, vor unseren Augen entstehen, langfristig existieren und aussterben oder langsam verschmelzen, kann man sie nicht dadurch festmachen, dass man
sie in irgendeine Schublade steckt, die sie alle genau abgrenzen würde. Unsere Neigung, die Dinge um uns zu sortieren, stößt hier auf eine reale und sich stets verändernde Realität. Auf den ersten Blick kann man also, paradoxerweise, die Arten genau deswegen nicht definieren, weil es sie wirklich gibt.” (Hervorhebung von Iinternet-Evoluzzer)
PS: In Teil eins haben wir kennengelernt, dass diverse Volksstämme ähnlich wie Wissenschaftler ein Großteil der Arten bestimmen können. Das ist natürlich ein Argument dafür, dass wir Arten als diskrete Einheiten erkennen können. Doch es soll aber nochmal betont werden, dass die wissenschaftliche Beschreibung der Arten natürlich viel präziser verläuft als einfache Volksweisheiten, da Wissenschaftler natürlich über bessere Methoden verfügen Arten zu erkennen und zu bestimmen. Daher sind ja diverse Artdefinitionen entwickelt worden.
Literatur
Avise, J. C. et al. (1992): Molecular clones within organismal clones. Mitochondrial DNA phylogenies and the evolutionary histories of unisexual vertebrates. J. Evol. Biol. 26: 225-246
Ayla, F. J. et al. (1974): genetic differences during the speciation process in Drosophila. Evolution 28:576-592
Baker, R. & Bradley, R. (2006): “Speciation in Mammals and the Genetic Species Concept”. Journal of Mammalogy. 87 (4): 643–662.
Barrett, S. J. & Sneath, P. H. (1994): A numerical phenotypic taxonomic study oft he genus Neisseria. Microbiology 140:2867-2891
Bertola et al.: Genetic diversity, evolutionary history and implications for conservation of the lion (Panthera leo) in West and Central Africa. In: Journal of Biogeography. Volume 38, Issue 7, 2011. S. 1356–1367
Bradley, R. & Baker, R. (2001): A test of the Genetic Species Concept: cytochrome-b sequences and mammals. Journal of Mammalogy. 2001;82:960–973.
Castello, J. R. (2015): Bovids of the World. Princeton University Press
Chapman, A. D. (2009). Numbers of Living Species in Australia and the World (PDF) (2nd ed.). Canberra: Australian Biological Resources Study. pp. 1–80.
Chun, J. & Rainey, F.A. (2014): Integrating genomics into the taxonomy and systematics of the Bacteria and Archaea. Int J Syst Evol Microbiol 64, 316-24
Cohan, F. M (2001): Bacterial species and speciation. Syst. Biol. 50: 513-524
Cohan, F. M (2002): What are bacterial species? Annu. Rev. Microbiol. 56: 513-524
Cohan, F. M (2004): Periodic selection and the ecological diversity in bacteria. In: D. Nurminsky (ed.): Selective sweeps. Landes Bioscience, Georgetown, Tx.
Cotterill, F. et al. (2014): Why One Century of Phenetics is Enough: Response to “Are There Really Twice As Many Bovid Species As We Thought?” Syst. Biol. 63(5):819–832
Cotterill, F., Groves, C. & Taylor, P. Taxonomy: refine rather than stabilize. Nature 547, 162
Coyne, J. A. & Orr, H. A (2004): Speciation. Sunderland: Sinauer Associates, Inc.
Cracraft, J. (1983): Species concepts and speciationanalysis. Current Ornithology 1:159–187.
Cracraft, J. (1989): Speciation and ist ontology: The empirical consequences of alternative species concepts for understanding patterns and process of differentiation. In: D. Otte & J. A. Endler (eds.) Speciation and ist conequences. Sunderland: Sinauer Associations, S. 28-59de
Eldredge, N. & Cracraft, J. (1980): Phylogenetic pat-terns and the evolutionary process. New York: Colum-bia University Press.
Feil, E. J. et al. (1999): The relative contributions of recombination and mutation tot he divergence of clones of Neisseria miningitidis. Mol. Biol. Evol. 16: 1496-1502
Feil, E. J. et al. (2000): Estimating recombinational parameters in Streptococcus pneumoniae from multilocus sequence typing data. Genetics 154: 1439-1502
Fennessy et al. (2015): Multi-locus Analyses Reveal Four Giraffe Species Instead of One. Current Biology Volume 26, ISSUE 18, P2543-2549
Futuyma, D. J. (2007) Evolution. Elsevier, Spektrum, Akademischer Verlag, München
Gentry, A. et al. (2004): The naming of wild animal species and their domestic derivatives.J. Archaeol. Sci.31:645–51
Goodwillie, C. (1999): Multiple origins of self-compatibility in Linanthus sectio Leptosiphon (Polemoniaceae): Phylogenetic evidence from intral-transcribed-spacer sequence data. Evolution 53: 1387-1395
Grant, V. (1981): Plant Speciation (Second edition). New York: Columbia University Press
Groves, C. (2014): Primate Taxonomy: Inflationon Real? Annu. Rev. Anthropol. 2014. 43:27–36
Groves, C & Grubb, P. (2000): Do Loxodonta cyclotis and L. africana interbred? Elephant 2 (4), 2000, S. 4–7.
Groves, C. & Grubb, P. (2011): Ungulate Taxonomy. Johns Hopkins University Press
Groves, C & Leslie, D. (2011): Family Bovidae (Hollow-horned Ruminants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 444–779
Gutierrez, E. E. & Helgen, K. M. (2013): Mammology: outdated taxonomy blocks conservation. Nature 495:314
Heller, R. et al. (2013): Are There Really Twice as Many Bovid Species as We Thought? Systematic Biology 62 (3), 2013, S. 490–493
Hennig, W. (1966). Phylogenetic systematics. Urbana,IL: University of Illinois Press.
Holman, E. W. (1987): Recognizability of sexual and asexual species of rotifers. Syst. Zool. 36:381-386
Ishida, Y. et al. (2011): Reconciling Apparent Conflicts between Mitochondrial and Nuclear Phylogenies in African Elephants. PloS ONE 6 (6), 2011, S. e20642
Lawrence, J. G. & Ochman, H. (1998): Molecular archaeology of the Escherichia coli genome. Proc. Natl. Acad. Sci. USA 95: 9413-9417
Lee, I., Kim, Y.O., Park, S.C. & Chun, J. (2015): OrthoANI: An improved algorithm and software for calculating average nucleotide identity. Int J Syst Evol Microbiol 66: 1100-1103
Macnair, M. R. & Gardner, M. (1998): The evolution of edaphic endecmis. In D.J. Howard & S. H. Berlocher (eds): Endless Forms: Species and Speciation. New York: Oxford University Press, S. 157-171
Mayr, E. (1942): Systematics and the Origin of Species.
Mayr, E. (1963): Animal Species and Evolution
Mayr, E. (1979): Evolution und die Vielfalt des Lebens. Springer-Verlag
Meyer, M. et al. (2017): Palaeogenomes of Eurasian straight- tusked elephants challenge the current view of elephant evolution. eLife; 06 June, 2017
Murata, Y. et al. (2009): Chronology of the extant African elephant species and case study of the species identification of the small African elephant with the molecular phylogenetic method. Gene 441, 2009, S. 176–186.
Nelson, G. & Platnick, N. I. (1981): Systematics andbiogeography: Cladistics and vicariance. New York: Co-lumbia University Press.
Pihu, S. et al. (2009): Environmentally Dependent Morphological Variability in Seven Apomictic Microspecies from Alchemilla L. (Rosaceae). Folia Geobotanica Vol. 44, No. 2 (2009), pp. 159-176
Queiroz, K. & Donogue, M. J. (1988): Phylogenetic systematics and the species problem. Cladistics 4: 317–338.
Raup. D.M. (1986). “Biological extinction in earth history”. Science. 231 (4745): 1528–1533.
Richards, A. J. (1972): The Taraxacum flora of the British Isles. Watsonia 9 (Suppl.): 1-141
Richards, A. J. (1973): The origin oft he Taraxacum agamospecies. Bot. J. Linn. Soc. 66:189-211
Richards, A. J. (1997): Plant Breeding Systems. London: Chapman & Hall
Roberts, M. S. & Cohan, F. M. (1995): Recombination and migration rates in natural populations of Baciullus subtilis and Bacillus mojavensis. Evolution 49: 1081-1094
Roberts, M. S. et al. (1996): Bacillus vallismortis sp. Nov., a close relative of Bacillus subtilis, isolated from soil in Death Valley, California. Int. J. Syst. Bacteriol. 46: 470-475
Rohland, N. et al. (2010): Genomic DNA Sequences from Mastodon and Woolly Mammoth Reveal Deep Speciation of Forest and Savanna Elephants. PLoS Biol 8(12): e1000564.
Rossello-Mora, R. & Amann, R. (2001): The species concept for prokaryotes. FEMS Microbiol Rev 25, 39-67 Sepp & Paal 1998
Rylands, A. B. & Mittermeier, R. A. (2014): Primate taxonomy: species and conservation. Evol. Anthropol.23:8–10
Sangster, G. (2009): Increasing numbers of bird species result from taxonomic progress, not taxonomic inflation. Proc. R. Soc. B 276, 3185–3191
Schwarz E. (1928a): Bemerkungen ̈über die roten Stummelaffen. Zeits Säugetierk.3:92–97
Schwarz E. (1928b): Notes on the classification of the African monkeys of the genus Cercopithecus, erxleben. Ann. Mag. Nat. Hist.1(10):649–63
Schwarz E. (1928c): The species of the genus Cercocebus. Ann. Mag. Nat. Hist.1(10):664–70
Schwarz E. (1929): On the local races and distribution of the Black and White Colobus monkeys. Proc. Zool.Soc. Lond.1929:585–98
Schwarz E. (1931a): On the African long-tailed lemurs or galagos. Ann. Mag. Nat. Hist.7(10):41–66
Schwarz E. (1931b): On the African short-tailed lemurs or pottos. Ann. Mag. Nat. Hist.8(10):249–56
Schwarz E. (1931c): A revision of the genera and species of Madagascan Lemuridae. Proc. Zool. Soc. Lond.1931:399–428
Schwarz E. (1934): On the local races of the chimpanzee. Ann. Mag. Nat. Hist.13(10):576–83
Sokal, R. R. & Sneath, P. H.: Principles of Numerical Taxonomy. Freeman Books, San Francisco 1963
Vrijenhoek, R. C. et al. (1989): A list of the known unisexual vertebrates. NY State Univ. Mus. Bull. 466: 19-23
Wayne, L.G. et al. (1987): Report of the ad hoc committee on reconciliation of approaches to bacterial systematics. Int J Syst Bacteriol 37, 463-464
Westheide, W. & Rieger, R. (2007): Spezielle Zoologie. Teil 1: Einzeller und wirbellose Tiere. Gustav Fischer Verlag
Wheeler, Q. (1999): Why the Phylogenetic Species Concept? —Elementary. Journal of Nematology 31(2):134–141.
Wilkins, J. S. (2011): Philosophically speaking, how many species concepts are there? Zootaxa 2765: 58–60
Zachos, F. E et al. (2013a): Species inflation and taxonomic artefacts — A critical comment on recent trends in mammalian classification. Mammalian Biology 78, 2013, S. 1–6
Zachos, F. et al. (2013b): Taxonomy:Species splitting puts conservation at risk.Nature494:35
Zachos, F. E (2014a): Taxonomic inflation, the Phylogenetic Species Concept and lineages in the Treeof Life–a cautionary comment on species splitting. J Zoolog Syst Evol Res. S. 1-5
Zachos, F. E (2014b): Commentary on taxonomic inflation, species delimitation and classification in Ruminantia. Zitteliana B 32, 2014, S. 213–216


