Text als pdf
Die Strisores sind eine recht vielfältige Gruppe mit 6 Ordnungen und 8 Familien. 5 dieser Ordnungen mit 5 Familien wurden in der letzten Episode behandelt. Es handelt sich hierbei um nachtaktive Vögel. Diese 5 Familien wurden früher in eine eigene Ordnung, die Schwalmartigen, gestellt. Ihre Schwestergruppe sind die Apodiformes, die Segler und Kolibris, die tagaktive Flieger sind. Doch es stellte sich heraus, dass die Schwalmartigen paraphyletisch sind, da einige Familien näher mit den Seglern verwandt sind als mit den übrigen Schwalmartigen (Ericson et al. 2006, Hackett et al. 2008, Jarvis et al. 2014, Prum et al. 2015, Kuhl et al. 2021, Wu et al. 2024, Stiller et al. 2024, Chen & Field 2020, Mayr 2009, Chen et al. 2019, Winkler et al. 2015; Abb. 1).
Die Ordnung der Seglervögel (Apodiformes) umfasst drei Familien: Baumsegler (Hemiprocnidae), Segler (Apodidae) und Kolibris (Trochilidae). Diese Luftspezialisten zeichnen sich durch einen ungewöhnlich langen Handteil des Flügels aus und haben oft schwache Beine. Ihr wissenschaftlicher Name: Apodiformes bedeutet so viel wie „die Füße nicht gebrauchend, schlecht zu Fuß“. Damit unterscheiden sie sich deutlich von ihrem Schwestertaxon, den Höhlenschwalmen, die eher kurze und abgerundete Flügel und lange Hinterbeine besitzen (wie auch Flamingos und Haubentaucher zeigen, sind sehr unterschiedliche Morphologien von Schwestertaxa keine Seltenheit und können das Ergebnis von Anpassungsprozessen aufgrund von Wettbewerb und Nischenbildung sein).
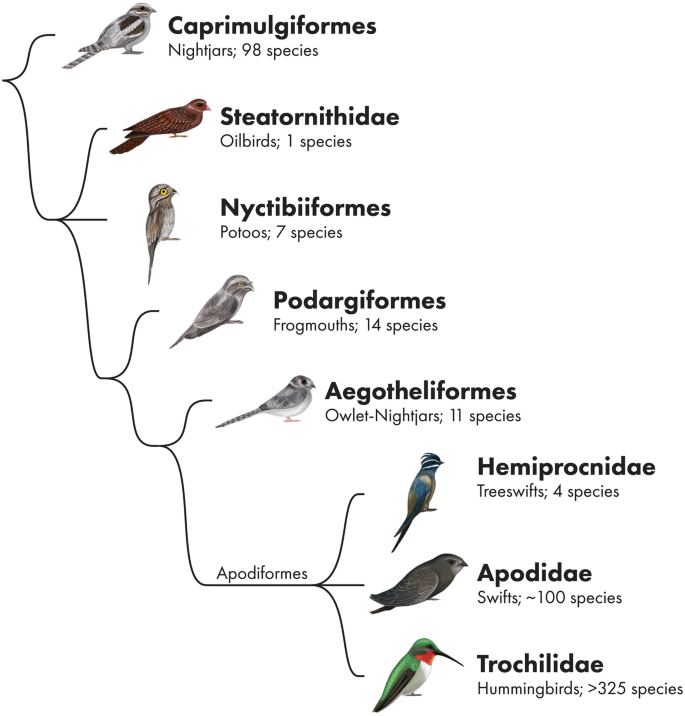
Abb. 1: Strisores
Segler (Apodidae)
Merkmale der Apodidae
Die Segler (Apodidae), Namensgeber für die Ordnung der Seglervögel, kommen mit 112-114 Arten in 19 Gattungen fast weltweit vor, mit einem Verbreitungsschwerpunkt in den Tropen (Del Hoyo 2020, del Hoyo et al. 1999, Chantler & Driessens 2000, von Boltzheim & Bauer 1994, Winkler et al. 2024a, Thomassen et al. 2003, 2005, Price et al. 2004, 2005). Außerhalb der Tropen sind alle Segler Zugvögel. Ihr Körper ist stromlinienförmig und länglich mit kurzem Hals, nach vorn gestrecktem Kopf und langen, meist sichelförmigen Flügeln. Die Knochen der Hand leisten bei Seglern einen überproportionalen Beitrag zur Flügellänge, was sich auch am deutlichen Längenunterschied zwischen Hand- und Armschwingen widerspiegelt (Abb. 2). Die längste Handschwinge kann dreimal so lang sein wie die kürzeste Armschwinge – im Vergleich zur lediglich doppelten Länge bei den eine ähnliche ökologische Nische besetzenden Schwalben. Die Flügelform ermöglicht den Seglern hohe Fluggeschwindigkeiten. Als schnellster Segler gilt der Stachelschwanzsegler (Hirunsapus caudacutus) mit 170 km/h im horizontalen Schlagflug. Verglichen mit den Schwalben fehlt es den Seglern allerdings an Manövrierfähigkeit.
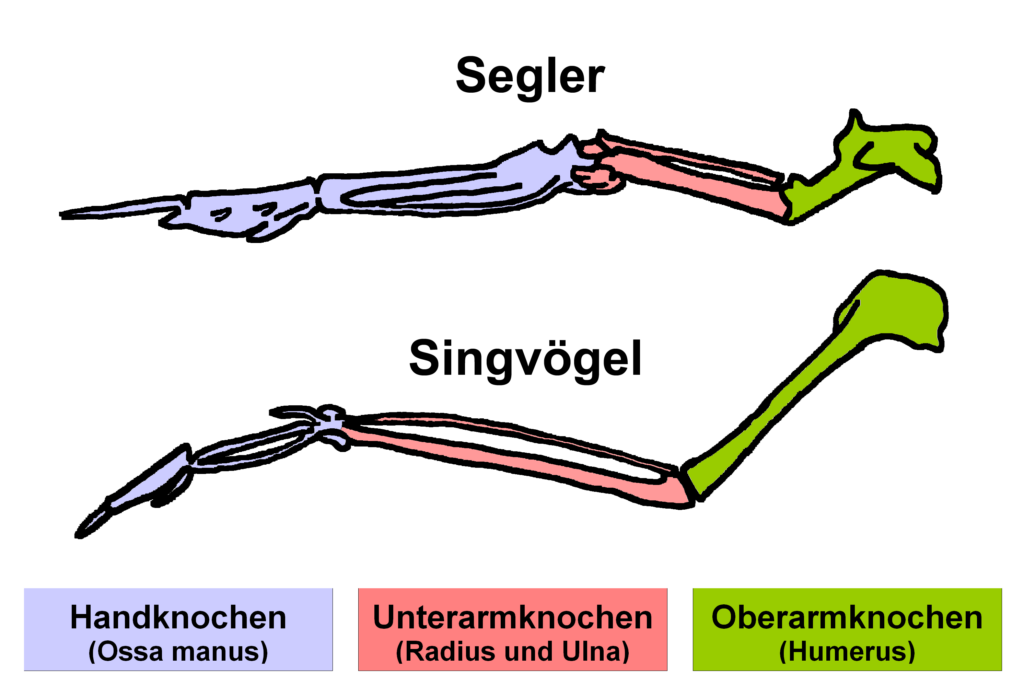
Abb. 2: Vergleich der Flügelknochen der Segler mit den Singvögeln (z. b. Schwalben)
Der Schnabel ist kurz und breit, mit dem sie nach Kleintieren in der Luft jagen. Die relativ großen Augen werden bei allen Arten durch eine oberhalb des Auges vorstehende Federreihe geschützt. Das Gefieder ist meist dunkel, häufig schwarz, bei vielen Arten aber auch dunkelgrau oder braun. Häufig finden sich hellere oder weiße Gefiederteile, z. B. als Kehlfleck. Viele Arten haben ein stark glänzendes Gefieder, manche davon mit einem bläulichen oder grünlichen Schimmer. Der kurze, kräftige Klammerfuß mit seinen scharfen Krallen und der sehr kurze Lauf eignen sich hervorragend, um sich an senkrechten Oberflächen festzuklammern, was durch die steifen Schwanzfedern unterstützt wird. Zur Fortbewegung am Boden dagegen eignen sich die Füße der Segler kaum – auf Zweigen können sie nicht sitzen, nur daran hängen.
Eine weitere sehr außergewöhnliche Anpassung der Segler sind die Klicklaute zur Echoortung, die vor allem bei vielen Salanganenarten zu vernehmen sind (Fullard 1993, Thomassen et al. 2005, Price et al. 2004, Abb. 3). Bei den Vögeln ist diese Fähigkeit sonst nur vom südamerikanischen Fettschwalm (Steatornis caripensis) bekannt. Die Klicklaute der Segler liegen im hörbaren Frequenzbereich des Menschen, sie wurden verglichen mit dem Geräusch, wenn man mit dem Finger über die Zinken eines Kamms fährt. Die Echoortung ermöglicht den Seglern, sich in tiefen, weit verzweigen Höhlensystemen zurechtzufinden. Aufgrund der niedrigeren Frequenz im Vergleich zum Ultraschall der Fledermäuse ist die Auflösung nicht ausreichend, um in der Dunkelheit Insekten zu jagen.
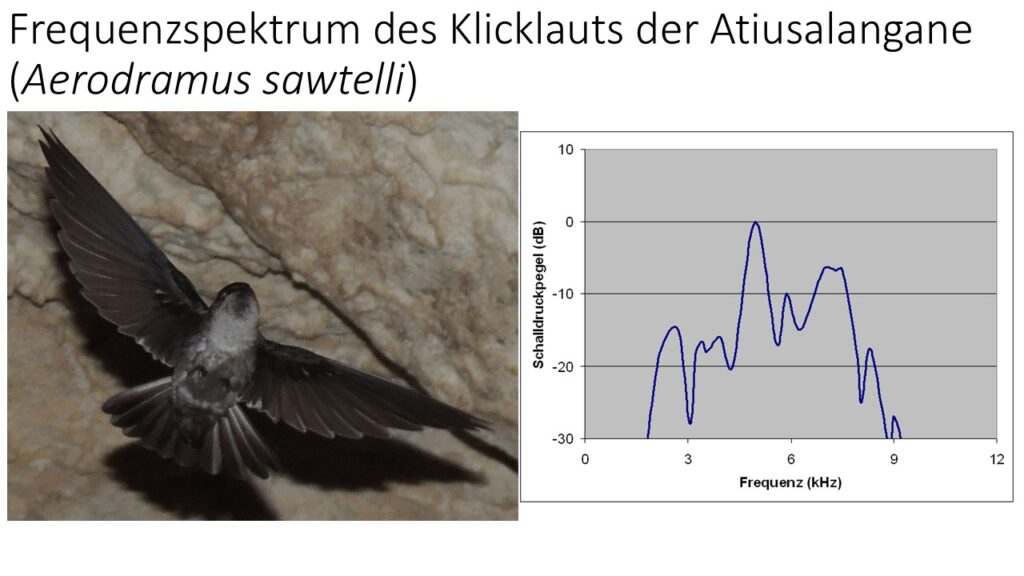
Abb. 3: Klicklaute der Salanganen
Die Ernährungsweise der Segler ist hoch spezialisiert, sie benötigen Gebiete, in denen sich in ausreichender Dichte verwertbare Insekten oder Spinnentiere in der Luft befinden. Andererseits bevorzugen Segler auch artspezifische, gut geschützte Nistplätze; diese beiden Bedürfnisse lassen sich oft nicht an einem Ort befriedigen und zwingen die Segler, je nach Art, zu täglichen Wanderungen. Da Wasser im Lebenszyklus vieler Insekten von besonderer Bedeutung ist, befinden sich auch die Lebensräume der Segler in der Nähe von Wasserflächen. Besonders deutlich wird das bei den Arten, die trockene Lebensräume im Landesinneren nutzen – wie beispielsweise dem Fahlsegler (Apus pallidus), der in der Sahara in der Umgebung von Oasen anzutreffen ist (Del Hoyo et al. 1999). In ihrer Wahl der Insekten als Nahrung sind sie nicht besonders wählerisch. Vom Mauersegler (Apus apus) kennt man mindestens 500 Insektenarten, die von ihm verspeist werden.
Segler bevorzugen für Nesträuber besonders unzugängliche Nistplätze, da sie sich kaum gegen Feinde verteidigen können. Die meisten Arten bevorzugen dunkle Orte. Dies ist besonders evident bei den zur Echoortung fähigen Salanganen, die oft weite Strecken in Höhlen bei totaler Dunkelheit zurücklegen. Einige Seglerarten übernehmen auch Nester anderer Arten. Das typische Seglernest ist eine flache, selbsttragende Schale, oft an einer senkrechten Oberfläche befestigt. Das Nistmaterial – hauptsächlich pflanzliche Bestandteile und Federn – wird meist im Flug mit dem Schnabel gesammelt. Die meisten Segler verwenden Speichel, um das Nistmaterial zu verkleben, weshalb die Speicheldrüsen der Vögel während der Brutzeit vergrößert sind. Die Verwendung von Speichel erreicht bei den Salanganen ihr Extrem, insbesondere bei der Weißnestsalangane (Aerodramus fuciphagus), deren Nest ausschließlich aus Speichel besteht (Abb. 4). Diese Nester sind die wichtigste Zutat für die Schwalbennestersuppe, einer Delikatesse der Chinesischen Küche. Der Palmensegler (Cypsiurus parvus) aus Afrika verwendet Speichel zudem, um die Eier, die in vergleichsweise exponierter Stelle gelegt werden, mit dem Nest zu verkleben (Abb. 5). Einige Arten weichen aber von diesem typischen Seglernest ab, z. B. die amerikanischen Schwalbensegler (Panyptila) und Schwarzsegler (Cypseloides niger). Letzterer verwendet keinen Speichel für den Nestbau (Abb. 6). Segler bilden monogame Brutpaare und beim Mauersegler ist nachgewiesen, dass auch die Kopulation in der Luft stattfindet. Die Eier aller Segler sind übereinstimmend weiß und matt. Sie sind in Relation zur Größe der Vögel klein, haben aber einen hohen Dotteranteil. Die Gelegegröße ist sehr unterschiedlich und reicht je nach Art von einem bis sieben Eiern. Die meisten Segler ruhen nachts, oft in der Nähe ihrer Nester. Beim Mauersegler – und wahrscheinlich anderen Arten – kommt die sogenannte Luftübernachtung vor. Man vermutet eine Art Halbhirnschlaf, wie er ähnlich von anderen Tierarten bekannt ist (Del Hoyo et al. 1999).

Abb. 4: Die Nester der Weißnestsalangane gelten in Asien als Delikatesse
Abb. 5: Palmsegler
Abb. 6: Schwarzsegler
Die Familie der Segler wird in zwei Unterfamilien aufgeteilt: die Cypseloidinae (Abb. 7), die mit zwei Gattungen und 13 Arten nur auf dem amerikanischen Doppelkontinent vorkommen und die Apodinae mit weltweiter Verbreitung (Abb. 8 – 10). Letztere teilt man in drei Gattungsgruppen.
Zum einen haben wir die Salanganen (Collocaliini; Abb. 8), die mit vier Gattungen (Collocalia, Aerodramus, Hydrochous, Schoutedenapus) und 41 Arten fast ausschließlich in Asien, Ozeanien, den Inseln des indischen Ozeans und Australien vorkommen; nur eine Gattung mit einer Art findet sich auf dem afrikanischen Festland (Schoutedenapus).
Zum anderen haben wir mit den Stachelschwanzseglern (Chaeturini; Abb. 9) sieben Gattungen, von denen sechs Gattungen mit 15 Arten in Afrika, Asien und Ozeanien vorkommen (Mearnsia, Zoonavena, Telacanthura, Rhaphidura, Neafrapus, Neafrapus – Verbretungsschwerpunkt Afrika) und eine Gattung mit 11 Arten auf dem amerikanischen Doppelkontinent (Hirundapus). Hier finden sich einige Insel-Endemiten, wie der Phlippinensegler (Mearnsia picina) und der Sao-Tome-Segler (Zoonavena thomensis) vor der Atlantikküste Afrikas.
Die dritte Gattungsgruppe sind die eigentlichen Segler (Apodini, Abb. 10) mit sechs Gattungen und 32 Arten. Drei Gattungen (Aeronautes, Tachornis, Panyptila) sind mit acht Arten auf Nord- und Südamerika beschränkt. Eine weitere Gattung, Cypsiurus, hat drei Arten, von denen eine – der erwähnte Palmsegler (Abb. 5) – in Afrika vorkommt und je eine weitere Art in Asien und Madagaskar lebt. Die Gattung Tachymarptis hat zwei Arten: eine in Afrika und den in Europa vorkommenden Alpensegler (Tachymarptis melba). Die größte Gattung Apus kommt mit 19 Arten in der alten Welt vor, mit Verbreitungsschwerpunkt in Afrika. In diese Gattung gehört auch der in Europa heimische Mauersegler (Apus apus, Abb. 11).

Abb. 7: Cypseloidinae

Abb. 8: Salanganen (Collocaliini)

Abb. 9: Stachelschwanzseglern (Chaeturini)

Abb. 10: Segler (Apodini)

Abb. 11: Mauersegler
Fossile Apodiformes
Seglervögel haben einen relativ gut dokumentierten Fossilnachweis, der es ermöglicht ihre Evolutionsgeschichte nachzuvollziehen.
Eocypselus aus dem Eozän (Eocypselidae) weist viele plesiomorphe Ähnlichkeiten mit den Höhlenschwalmen auf und ist einer der frühesten apodiformen Vögel, die bisher bekannt sind, sowie das basalste Taxon der Seglervögel (Mayr 2003, 2004, 2009, 2010, 2016, Mayr & Kitchener 2024, Ksepka et al. 2013, Harrison 1984, Dyke et al. 2004, Chen et al. 2019 Abb. 12). Eocypselus umfasst zwei Arten, die in Europa und Nordamerika vorkamen und sich in einer Reihe von Merkmalen von der Kronengruppe Seglervögel unterscheiden (Mayr 2010, Ksepka et al. 2013). Der Oberarmknochen von Eocypselus ist weniger verkürzt als bei der der Kronengruppe der Apodiformes. Auch die Elle ist schlanker und proportional länger, und mehrere andere Unterschiede im Skelett der Flügel und des Brustgürtels deuten darauf hin, dass Eocypselus weniger flugfähig war als die heutigen Apodiformes (Abb. 13). Außerdem hat er im Vergleich zu den heutigen Seglern einen relativ langen Schnabel und verhältnismäßig längere Beine. Eocypselus könnte daher Insektenbeute auf ähnliche Weise gefangen haben wie Höhlenschwalme, die von Sitzstangen aus auf die Jagd nach fliegenden Insekten gehen oder Beutetiere vom Boden aufschnappen (Mayr 2010).
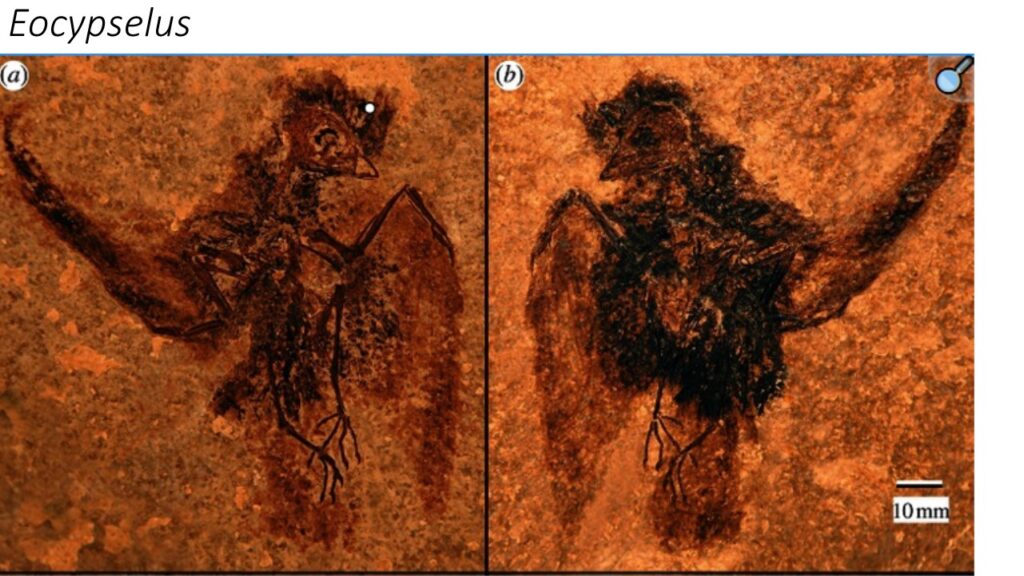
Abb. 12: Eocypselus
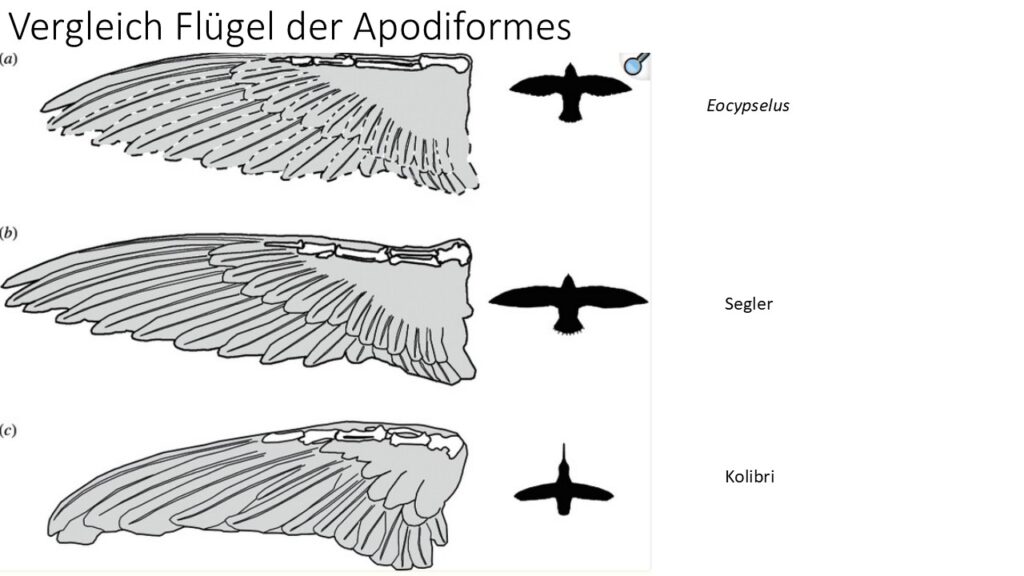
Abb. 13: Vergleich der Flügellänge der Apodiformes
Die Aegialornithidae bilden ein weiteres Taxon von vermutlich früh divergierenden Apodiformes (Abb. 14). Diese Vögel traten erstmals im Eozän in Deutschland auf und sind besonders häufig in fossilen Fundstellen des späten Eozäns in Frankreich zu finden, wo vier Aegialornis-Arten unterschieden wurden. Einige Merkmale der Aegialornithidae sind im Vergleich zu denen der Eocypseliden stärker abgeleitet, aber Oberarmknochen und Elle sind weniger verkürzt als bei der Kronengruppe der Apodiformes (Mourer-Chauviré 1978, 1980, 1988, Peters 1998, Mayr 2003, 2009, 2010, 2016). Ein sehr bekanntes Fossil eines seglerähnlichen Vogels stammt aus dem Londoner Becken und wird auf das frühe Eozän datiert. Die Art wurde Primapus lacki getauft (Boles 2001, Mayr 2009, 2016; Abb. 14).
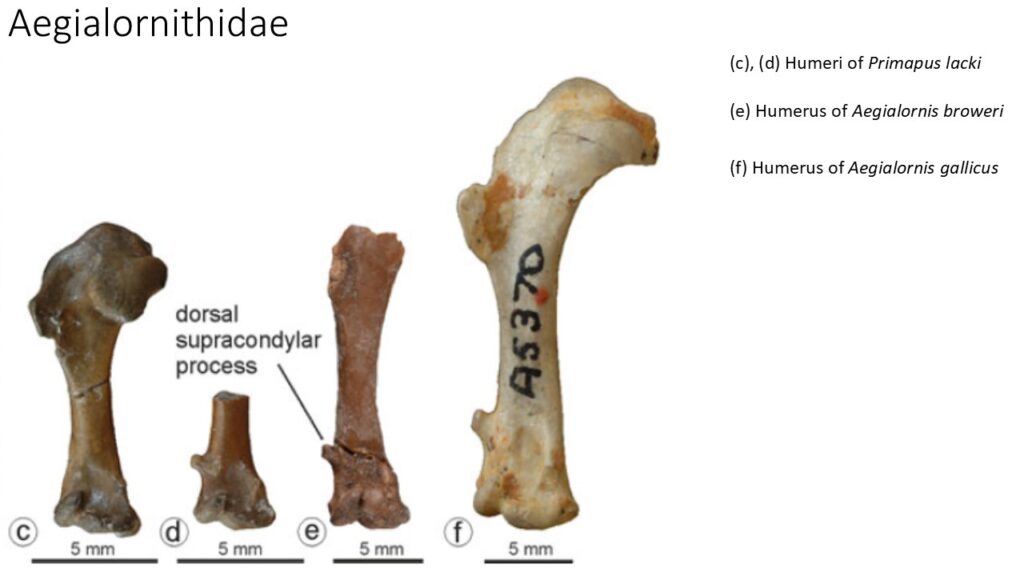
Abb. 14: Aegialornithidae
Das früheste bekannte Fossil, das der Stammgruppe der Segler zugerechnet wird, ist der in Dänemark gefundene Scaniacypselus wardi aus dem Eozän (Abb. 15). Scaniacypselus szarski wurde in der Grube Messel entdeckt. Bei einigen Exemplaren sind die Federn sehr gut erhalten und geben einen anschaulichen Eindruck des Aussehens dieser Vögel. Diese Gattung war noch nicht so stark auf das Fliegen spezialisiert wie moderne Segler (Mayr 2003, 2009, 2015a, 2016, Mayr & Peters 1999, Peters 1985, Mourer-Chauviré & Sigé 2006). Im Australischen Riversleigh-Gebiet wurde ein der Salanganengattung Collocalia zugerechnetes Fossil gefunden (C. buday), welches im späten Oligozän lebte (Boles 2001, Mayr 2016).

Abb. 15: Scaniacypselus
Baumsegler (Hemiprocnidae)
Die Baumsegler kommen mit vier Arten in einer Gattung (Hemiprocne) in Südostasien vor. Im Gegensatz zu den Seglern (Apodidae) sind ihre Beine gut ausgebildet, sodass sie in der Lage sind, auf den Ästen der Bäume zu sitzen. Dadurch bewegen sie sich weniger fliegend voran und kehren nach erfolgreicher Jagd in regelmäßigen Abständen zu ihren Sitzplätzen zurück. Damit vermittelt diese Familie zwischen den Höhlenschwalmen und den Seglern (Del Hoyo 2020, Del Hoyo et al. 1999, Winkler et al. 2024b, Abb. 16).

Abb. 16: Baumsegler
Kolibris (Trochilidae)
Innerhalb der Strisores sind die Kolibris mit 363-377 Arten die mit Abstand artenreichste Familie (Del Hoyo 2020, Del Hoyo et al. 1999, Winkler et al 2024c). Sie sind heute auf Nord- und Südamerika beschränkt, wobei in den Tropen die höchste Artenzahl zu finden ist. Während aus den Vereinigten Staaten weniger als 25 verschiedene Kolibriarten und aus Kanada und Chile jeweils weniger als 10 Arten bekannt sind, gibt es allein in Kolumbien mehr als 160 und im vergleichsweise kleinen Ecuador etwa 130 Arten (Jaramillo & Barros 2010, Salaman et al. 2009, Freile 2009, Del Hoyo et al. 1999, Del Hoyo 2020, Winkler et al. 2024c, Abb. 17). Die meisten nordamerikanischen Kolibris ziehen im Herbst nach Süden, um in Mexiko, auf den Karibischen Inseln oder in Mittelamerika zu überwintern. Einige Arten im südlichen Südamerika ziehen im Winter ebenfalls nach Norden in die Tropen. Rubinkehlkolibris (Archilochus colubris) sind entlang der atlantischen Flugroute häufig anzutreffen und ziehen im Sommer in den Norden bis ins atlantische Kanada (Lopez-Segoviano et al. 2018, McKinney et al. 2012, Del Hoyo et al. 1999).
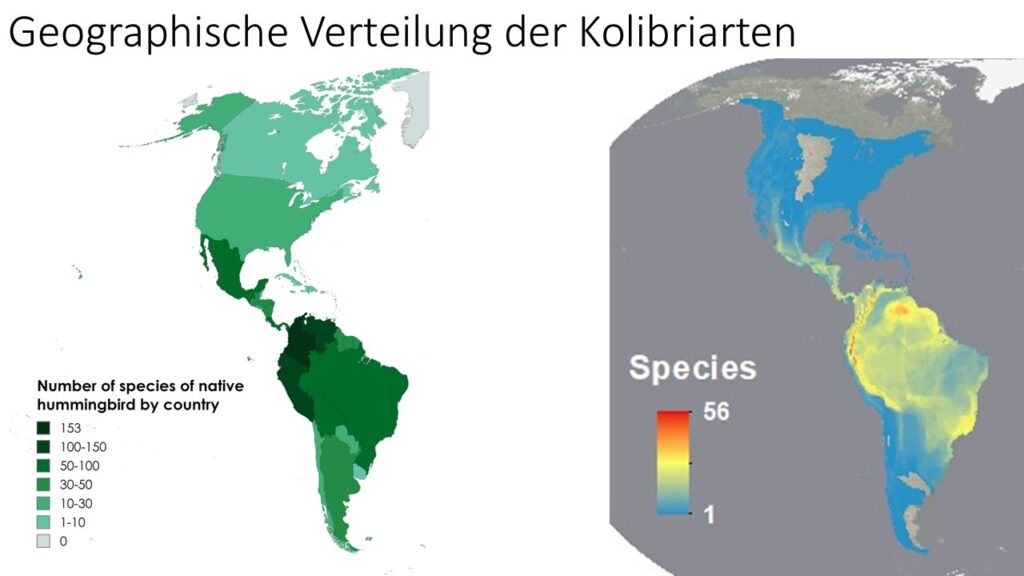
Abb. 17: Verbreitung der Kolibris
Unter den Kolibris findet man die kleinste Vogelart überhaupt; die Bienenelfe (Mellisuga helenae) misst samt Schnabel und Schwanzfedern nur 6 cm und wiegt gerade mal 2 g. Hiermit haben wir den kleinsten Dinosaurier der Welt (Del Hoyo et al. 1999, Bruasatte et al. 2015, Chiappe 2009, Hendry 2023; Abb. 18). Der Riesenkolibri (Patagona gigas) ist mit ca. 22-23 cm Länge und 20 g der größte Vertreter der Familie (Del Hoyo et al. 1999, Abb. 19).

Abb. 18: Bienenelfe

Abb. 19: Riesenkolibri
Kolibris als Bestäuber
Kolibris ernähren sich vorwiegend von Blütennektar (Del Hoyo et al. 1999, Stiles 1995, Abrahamczyk & Kessler 2010, Pyke 1980, Spence et al. 2021). Sie sind die bei weitem spezialisiertesten Nektarfresser unter den Vögeln und die einzigen Vögel, bei denen der Nektar den größten Teil der Energiezufuhr ausmacht. Kolibris weisen zahlreiche und weitreichende Anpassungen an die Nektarspeisung auf, darunter lange Schnäbel und Zungen, die schnell Flüssigkeiten aufnehmen (Berns & Adams 2012, Temeles et al. 2010, Leimberger et al. 2022, Rico-Guevara et al. 2019, Betts et al. 2015).
Ihre Zungen haben Rillen und Röhren, die über ihre gesamte Länge verlaufen, um den Nektarverbrauch durch schnelles Hinein- und Herauspumpen des Nektars zu erleichtern. Während man bisher annahm, dass der Nektar durch Kapillarwirkung in diese Röhren gelangt, zeigten Hochgeschwindigkeitsaufnahmen, dass der Nektar durch die rasche Bewegung der gegabelten Zunge, einer Pumpe ähnlich, in den Rillen eingeschlossen wird, ohne dass Kapillarwirkung im Spiel ist (Rico-Guevara et al. 2015, Rico-Guevara & Rubega 2011, Kim et al. 2012, Abb. 20 & 21).
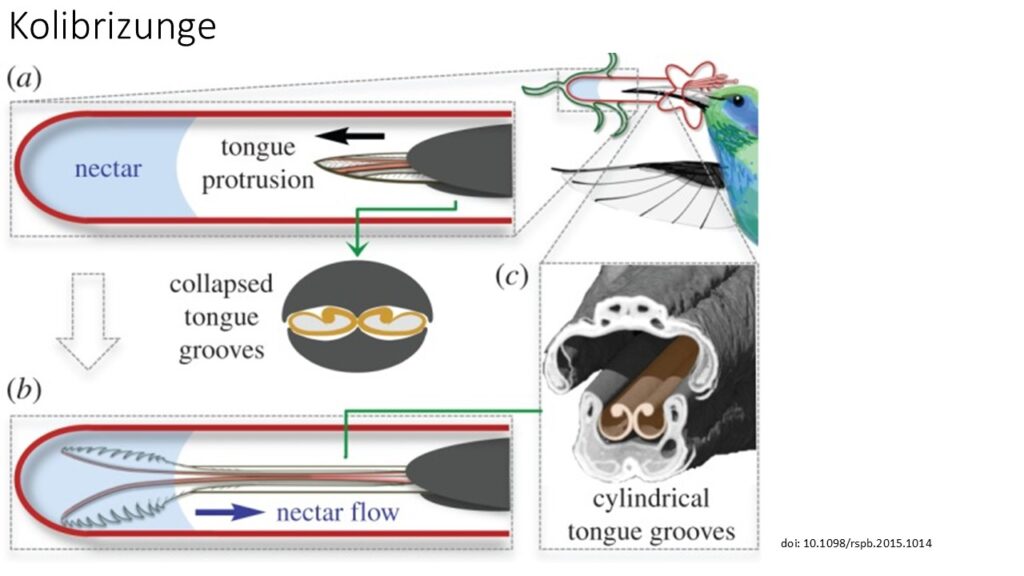
Abb. 20: Die Zunge des Kolibris füllt sich mit Nektar, auch wenn nur die Spitze eingetaucht ist. (a) Kolibris können von Blüten trinken, deren Blütenkronen länger sind als ihre Schnäbel, indem sie ihre gegabelten, längs gerillten Zungen ausfahren, um den Nektar zu erreichen. Beim Herausstrecken wird die Zunge beim Durchgang durch die Schnabelspitze zusammengedrückt, wodurch die Rillen zusammengedrückt werden (Querschnitt). (b) Beim Erreichen des Nektars rollen sich die lamellengesäumten Zungenspitzen auf und spreizen sich, aber einige der gerillten Zungenabschnitte kommen nie mit dem Nektarpool in Kontakt. Damit sich die Rillen mit Nektar füllen können, müssen sie in ihre unkomprimierte, zylindrische Form zurückkehren. (c) Koronaler Ausschnitt aus einem µCT-Scan, der die Architektur von Schnabel und Zunge zeigt.
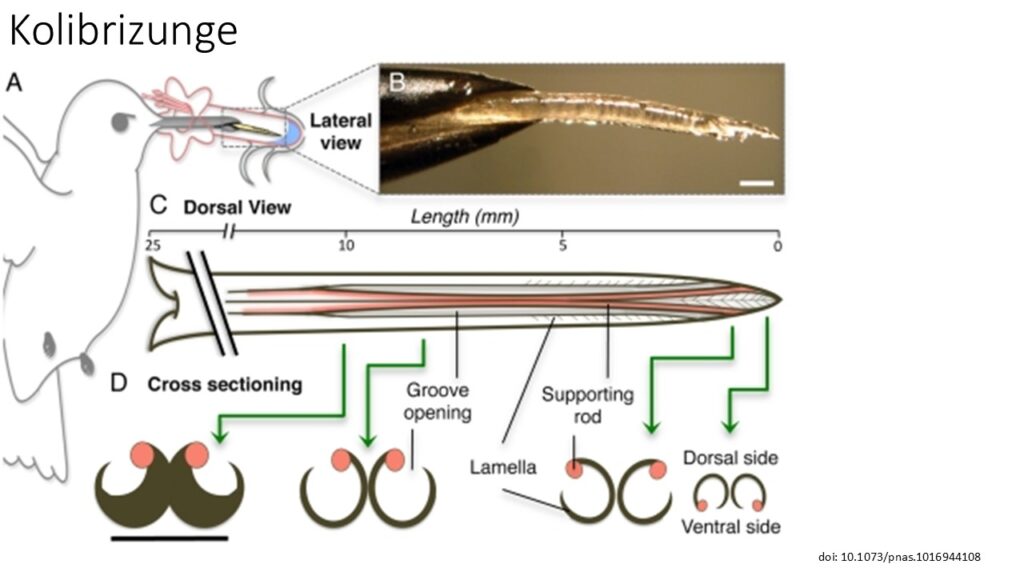
Abb. 21: Kolibri Zungen. (A) Nektarfresser benutzen ihre Zunge (gelb) als primäres Werkzeug zum Sammeln von Nahrung. (B) Seitliche Aufnahme eines post mortem Rubinkehlkolibri (Archilochus colubris), dessen Zungenspitze aus der Schnabelspitze herausragt. (C) Dorsalansicht der Zungenmorphologie eines Kolibris (ungefähre Maße für A. colubris), die die Länge der gesamten Zunge, die Rillen an den offenen Seiten und den fransigen (lamellaren) Bereich der Spitze (distal etwa 6 mm) zeigt. Der Zungengrund befindet sich links, die Zungenspitze rechts. (D) Der Querschnitt zeigt die strukturelle Anordnung entlang des distalen Bereichs der Zunge; grüne Pfeile kennzeichnen die Lage der Querschnitte. Schwarze Linien zeigen die gleichen Strukturen in der Dorsal- und der Querschnittsansicht. Man beachte die Veränderung der Position der Stützstäbe von der Basis der Rillen zur Zungenspitze. Unbeschriftete Skalenbalken, 0,5 mm.
Ihr Darm ist in der Lage, innerhalb von Minuten über 99 % der Glukose aus dem Nektar zu extrahieren, was auf die hohe Dichte an Glukosetransportern zurückzuführen ist (die höchste, die bei Wirbeltieren bekannt ist, Del Hoyo et al. 1999). Da Kolibris zu den wichtigsten Wirbeltierbestäubern gehören, haben sie sich in komplexer Weise mit blühenden Pflanzen entwickelt. Mehr als 7000 durch Kolibris bestäubte Pflanzenarten in 404 Gattungen und 68 Familien sind bekannt. Vieler dieser Arten haben sich so entwickelt, ausschließlich von Kolibris bestäubt zu werden und verwehren sogar Insekten den Zugang (Abrahamczyk & Kessler 2010, Leimberger et al. 2022, Del Hoyo et al. 1999, Stiles 1995, Brusatte et al. 2015).
Dabei spezialisieren sich einzelne Pflanzenarten auf bestimmte Kolibriarten, welche dann verschiedene Schnabelformen haben. Blüten, die hauptsächlich von Vögeln bestäubt werden, bezeichnet man als ornithophil. Diese Koevolution impliziert, dass morphologische Merkmale von Kolibris, wie Schnabellänge, Schnabelkrümmung und Körpermasse, mit morphologischen Merkmalen von Pflanzen, wie Länge, Krümmung und Volumen der Blumenkrone, korrelieren. Beim Schwertschnabelkolibri (Ensifera ensifera) z. B. ist der Schnabel fast so lang wie der ganze übrige Körper, der 10 cm misst. Die Gattung der Engelstrompeten (Brugmansia) wird z. B. von ihnen bestäubt. Der Kurzschnabelkolibri (Ramphomicron microrhynchum) hat nur eine Schnabellänge von 5 mm. Die Schnäbel der Adlerschnabel-Kolibris (Eutoxeres) sind stark nach unten gebogen, bei den Avosettkolibris (Avocettula recurvirostris) sind die Schnäbel an der Spitze nach oben gebogen. Jede Schnabel-Art ist auf einen anderen Blütentyp abgestimmt, sodass jede Gruppe von gleichschnabeligen Kolibris ihre eigene ökologische Nische besetzt (Abb. 22). Der Zwergwuchs der Bienenelfe entstand wahrscheinlich in Konkurrenz zu den größeren Kolibriarten, um bevorzugt andere Blüten zu bestäuben, die für die größeren Arten mit langem Schnabel uninteressant waren (Abrahamczyk & Renner 2015, Abrahamczyk & Kessler 2010, Abrahamczyk et al. 2014, 2015, 2017, Stiles 1981, Maglianesi et al. 2014, Dalsgaard et al. 2009, Junker et al. 2012, Chmel et al. 2021).

Abb. 22: Schnabelformen der Kolibris
Früher ging man von einer engen Wechselbeziehung zwischen Pflanzen und Kolibris aus, d. h., dass einige Pflanzenarten enge Wechselbeziehungen mit bestimmten Kolibris haben. Heute weiß man, dass diese Wechselbeziehungen nicht so eng sind und viele Pflanzenarten sich von verschiedenen Kolibriarten bestäuben lassen und Kolibris nicht besonders wählerisch bei der Wahl der Blüten sind. Die Fütterungseffizienz wird jedoch optimiert, wenn die Vögel sich von Blüten ernähren, die besser an ihre Schnabelmorphologie angepasst sind (Del Hoyo et al. 1999, Stiles 1995, Abrahamczyk & Kessler 2010, Spence et al. 2021).
Auch wenn die Wechselbeziehungen zwischen Kolibris und Blüten nicht zwingend obligatorisch sind, haben eine Reihe an Pflanzen eine Vorliebe entwickelt, bevorzugt von Kolibris bestäubt zu werden. Blüten, die für Kolibris attraktiv sind, sind oft farbenfroh (besonders rot), öffnen sich tagsüber und produzieren Nektar mit einem hohen Saccharosegehalt, die Blüten sind oft länglich und röhrenförmig und sind in der Regel duftlos. Diese Blütenmorphologie steht im Gegensatz zu den typischen von Insekten bestäubten Blüten, die oft blau oder violett sind und weniger Nektar liefern. Die von Kolibris bestäubten Blüten unterscheiden sich auch von denen der Fledermauspflanzen, die meist weiß sind und starke Geruchssignale aussenden. Da Kolibris zu einem anhaltenden Schwebeflug fähig sind, weisen viele von Kolibris bestäubte Pflanzen der Neuen Welt eine besonders charakteristische Blütenmorphologie auf, die sie von den vogelbestäubten Pflanzen der Alten Welt unterscheidet. Zu diesen Merkmalen gehören tiefe, hängende Blüten, die keine Sitzstangen bieten, auf denen ein Vogel sitzen kann. Viele dieser Anpassungen schrecken Insekten ab (Del Hoyo et al. 1999, Rodriguez-Girones & Santamaria 2004, Altschuster 2003, Nunes et al. 2018, Coutinho et al. 2016, Queiroz et al. 2015, Abb. 23 und 24). Erstaunlicherweise gibt es in der Alten Welt auch heute noch einige wenige Pflanzen mit diesen Merkmalen. Dies ist darauf zurückzuführen, wie wir sehen werden, dass fossil Kolibris auch außerhalb Amerikas anzutreffen sind und nach ihrem Aussterben die Bestäubung von Insekten oder anderen Vögeln mit kurzzeitigen Schwebefähigkeiten übernommen worden sein könnte (Mayr 2004a, 2009).

Abb. 23: Vogelbestäubte Blüten
Abb. 24: Insektenbestäubte Blüten
Eine Studie zeigte, dass drei kalifornische Arten sich von 62 Pflanzenfamilien ernähren. Ein Kolibri muss täglich ein- bis zweitausend Blüten besuchen, um seinen Energiebedarf zu decken (Del Hoyo et al. 1999, Spence et al. 2021, Toledo & Moreira 2008).
Kolibris sind in der Lage Süßes zu schmecken, ein Merkmal, dass nach ihrer Trennung von den insektenfressenden Seglern entstand. Obwohl der einzige bekannte Süßrezeptor, T1R2 genannt, bei Vögeln fehlt, haben Kolibris einen anderen Rezeptor, T1R1-T1-R3, für die Fähigkeit Süßes zu schmecken, adaptiert. Diese geschmackliche Anpassung ermöglichte es den Kolibris, süßen Nektar als Energiequelle zu erkennen und zu nutzen, was ihre Verbreitung in geografischen Regionen mit nektarhaltigen Blüten erleichterte (Baldwin et al. 2014, Li 2009).
Obwohl Nektar eine hochwertige Energiequelle ist, weist er einen Mangel an vielen Makro- und Mikronährstoffen auf (Del Hoyo et al. 1999, Stiles 1995, Brice & Grau 1991). Studien zeigen aber, dass Nektar eine ausreichende Menge an Vitaminen und Mineralen liefert (Caroll & Moore 1993). Obwohl der Eiweißbedarf von Kolibris mit 1,5 % der Nahrung recht gering zu sein scheint, ist Nektar immer noch eine unzureichende Quelle (Brice & Grau 1991); Kolibris ergänzen daher ihre Nahrung durch den Verzehr von Wirbellosen, meist Insekten und Spinnen (Del Hoyo et al. 1999, Brice & Grau 1991, Yanega & Rubega 2004). Man geht davon aus, dass der Insektenverzehr kalorienmäßig nicht wichtig ist; dennoch wird der regelmäßige Verzehr von Arthropoden als entscheidend für das Gedeihen der Vögel angesehen (Brice & Grau 1991, Chavez-Ramirez & McAlister 1992).
Bei einigen Arten wurde sogar festgestellt, dass sie sich über längere Zeiträume hinweg weitgehend oder vollständig von Insekten ernähren, insbesondere wenn Nektarquellen knapp sind, und bei einigen Arten möglicherweise sogar mit saisonaler Regelmäßigkeit in Gebieten mit einer Regenzeit (Kuban & Neill 1980, Montgomerie & Redsell 1980, Chavez-Ramirez & McAlister 1992, Toledo & Moreira 2008).
Fliegen und Sinnesleistungen
Kolibris verfügen auch über einen ausgeklügelten Schwebeflug, eine Notwendigkeit, um schnell viele Blüten besuchen zu können, ohne sich niederzulassen.
In zwei Studien mit Zimt- und Annakolibris (Selasphorus rufus und Calypte anna) im Windkanal mit Hochgeschwindigkeits-Videokameras wurde der Auftrieb beim Auf- und Abschlag des Vogels untersucht (Warrick et al. 2005, Sapir & Dudley 2012, Abb. 25). Die Vögel erzeugten 75 % ihres Gewichts beim Abschlag und 25 % beim Aufschlag, wobei die Flügel eine „Achterbewegung“ machten (Tobalske et al. 2007). Viele frühere Studien waren davon ausgegangen, dass der Auftrieb während der beiden Phasen des Flügelschlagzyklus gleichmäßig erzeugt wird, wie es bei Insekten ähnlicher Größe der Fall ist (Warrick et al. 2005, Ravi et al. 2015).
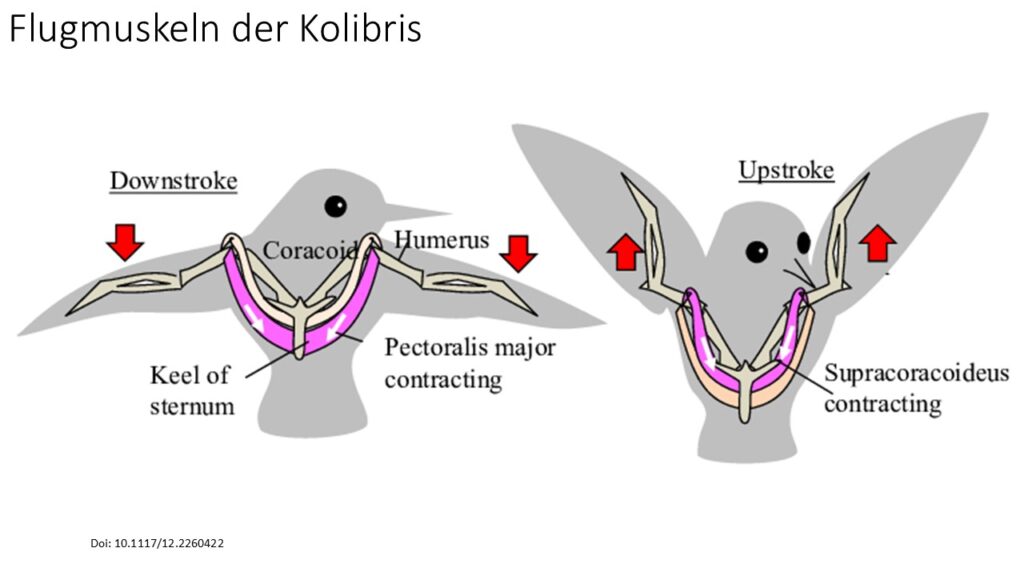
Untersuchungen der Muskulatur zeigen, dass die Muskelbelastung beim großen Brustmuskel (Pectoralis major) die geringste ist, die bei einem fliegenden Vogel jemals festgestellt wurde und der Kleine Brustmuskel (Musculus supracoracoideus) proportional größer ist, als bei anderen Vogelarten (Tobalske et al. 2010, Abb. 26). Weiterhin fehlt ihnen die für viele Vögel typische Alula. Die Flügel des Riesenkolibris schlagen nur 12 Mal pro Sekunde (Fernandez et al. 2011), während die Flügel typischer Kolibris bis zu 80 – 100 Mal pro Sekunde schlagen (Feinsinger et al. 1979, Wilcox & Clark 2022, Clark 2011, Ravi et al. 2015, Agrawal et al. 2022, Maeda et al. 2017, Lau et al. 2017).
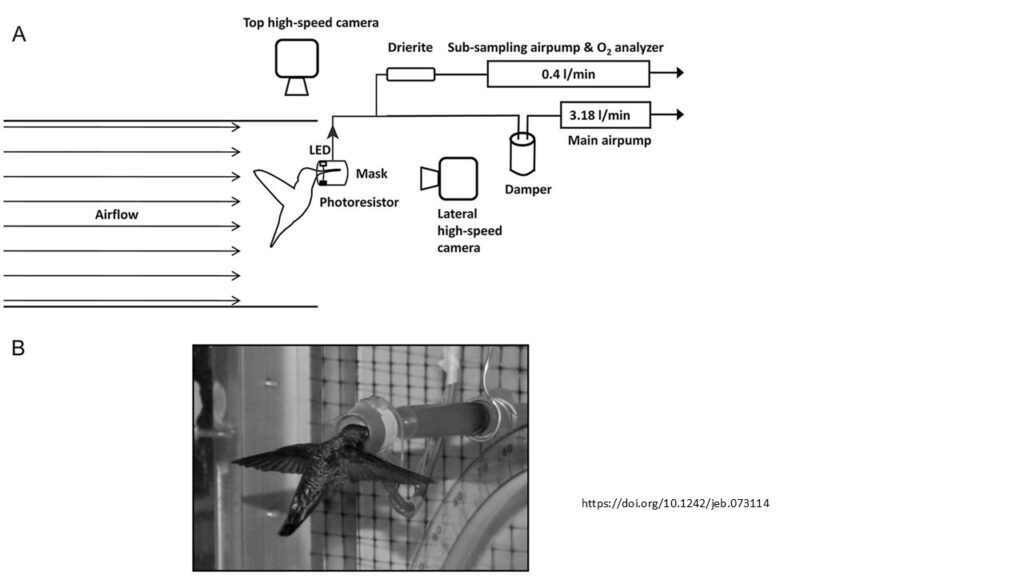
Abb. 25: (A) Allgemeiner Aufbau des Windkanals, in dem Annakolibris mithilfe von Respirometrie und Hochgeschwindigkeitsvideografie bei Vorwärts-, Rückwärts- und Stillstandsflügen untersucht wurden. (B) Foto eines Annakolibri während der Fütterung durch die Respirometriemask
Abb. 26: Brustmuskeln der Kolibris (Schema)
Ihre besondere Flugfähigkeit ermöglicht, dass die Tiere mit ihren Flügeln oder Schwanzfedern Töne erzeugen können. Dieses Summen, jenem des Insektenflugs ähnlich, gibt den Tieren den englischen Namen „Humming Bird“ (Hightower et al. 2021, Ingersoll & Lentink 2018, Clark & Feo 2008, 2010, Clark 2009, 2011, 2014, Clark et al. 2013).
Die Augen der Tiere sind verhältnismäßig groß, haben eine große Hornhaut (Cornea) und eine außergewöhnliche Dichte an retinalen Ganglienzellen, die für die visuelle Verarbeitung verantwortlich sind. Die große Hornhaut dient dazu, die Lichtwahrnehmung des Auges zu erhöhen, wenn die Pupille maximal geweitet ist (Ocampo et al. 2018, Lisney et al. 2015, Abb. 27). Morphologische Untersuchungen des Kolibri-Gehirns haben gezeigt, dass eine Region namens Nucleus lentiformis mesencephali, die für die Verfeinerung der dynamischen visuellen Verarbeitung während des Schnellflugs verantwortlich ist, besonders reich an Neuronen ist (Iwaniuk & Wylie 2007, Gaede et al. 2017). Kolibris haben einen vierten Zapfentypen (Menschen haben nur drei), der ultraviolettes Licht erkennt und die Unterscheidung nicht-spektraler Farben ermöglicht, was möglicherweise eine Rolle bei der Blütenidentität, der Balz, der Revierverteidigung und dem Ausweichen vor Räubern spielt (Stoddard et al. 2020).
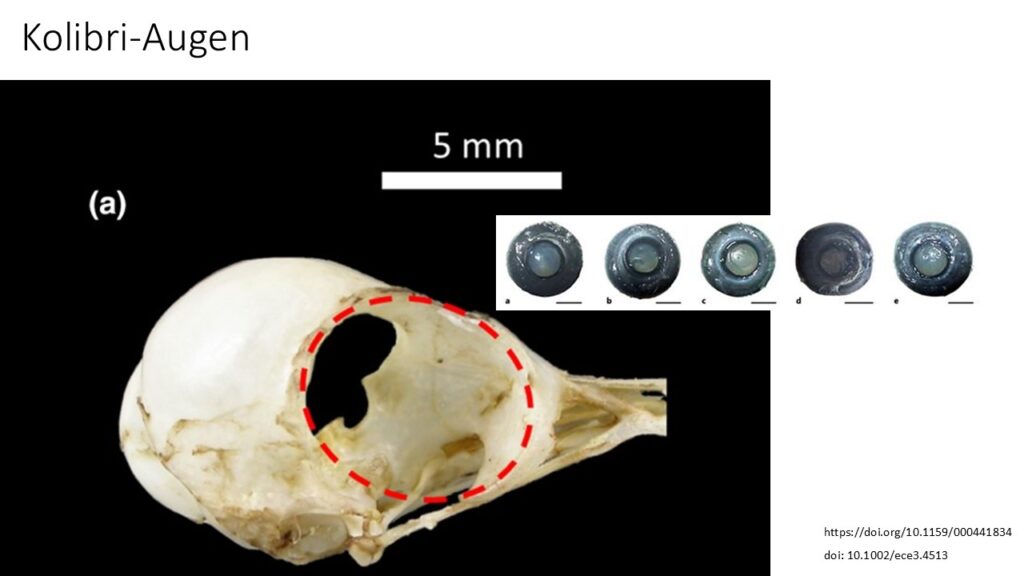
Abb. 27: Kolibriaugen.
Kolibris reagieren sehr empfindlich auf Reize in ihrem Gesichtsfeld und selbst auf minimale Bewegungen in jede Richtung, indem sie sich mitten im Flug neu orientieren (Gaede et al. 2017, Goller & Altschuler 2014). Ihre visuelle Empfindlichkeit ermöglicht es ihnen, in komplexen und dynamischen natürlichen Umgebungen präzise an Ort und Stelle zu schweben.
Stoffwechsel
Kolibris haben den höchsten Stoffwechsel aller Wirbeltiere – eine Notwendigkeit, um den schnellen Flügelschlag zu unterstützen. Während des Flugs ist der Sauerstoffverbrauch pro Gramm Muskelgewebe bei Kolibris etwa zehnmal höher als bei menschlichen Spitzensportlern. Kolibris erreichen diese außergewöhnliche Kapazität für den Sauerstoffverbrauch durch eine außergewöhnliche Dichte von Kapillaren und Mitochondrien in ihren Flugmuskeln (Hargrove 2005, Suarez 1992, Altschuler & Dudley 2002, Suarez et al. 1991).
Sie sind in der Lage den aufgenommenen Zucker schnell zu verwerten und ihre Flugmuskulatur hat eine hohe Kapazität Kohlenhydrate und Fettsäuren zu oxidieren, und zwar mit der höchsten Rate unter allen Wirbeltieren. Kolibris können neu aufgenommenen Zucker innerhalb von 30-45 Minuten nach dem Verzehr für den Schwebeflug verwenden. Die schnelle Oxidation des Zuckers zur ATP-Synthese wird u. a. durch den evolutionären Verlust eines Schlüsselgens, des Gens für das Enzym Fructose-Bisphosphatase 2 (FBP2) ermöglicht, der zeitgleich mit dem Beginn des Schwebefluges der Kolibris, der nach fossilen Belegen auf etwa 35 Millionen Jahre geschätzt wird, korreliert. Ohne dieses Gen werden die Glykolyse und die mitochondriale Atmung in den Flugmuskeln verstärkt, wodurch die Kolibris Zucker effizienter zur Energiegewinnung verstoffwechseln können (Welch & Chen 2014, Welch & Suaret 2007, Suare & Welch 2017, Suarez et al. 1990, Chen & Welch 2014, Osipova et al. 2023).
Um die schnellen Flügelschläge aufrechtzuerhalten, verbrauchen Kolibris das menschliche Äquivalent von 150.000 Kalorien pro Tag (Barlett 2018). Die Herzfrequenz von Kolibris kann bis zu 1.260 Schläge pro Minute erreichen, die Atemfrequenz liegt bei bis zu 250 Atemzügen pro Minute in Ruhe (Suarez 1992, Lasiewski 1964).
Die hohe Stoffwechselrate von Kolibris erzeugt eine erhöhte Körperwärme, die spezielle Mechanismen der Thermoregulation zur Wärmeableitung erfordert. Kolibris leiten Wärme teilweise durch Verdunstung über die ausgeatmete Luft und über Körperstrukturen mit dünner oder keiner Federbedeckung ab, wie etwa um die Augen, die Schultern, unter den Flügeln und an den Füßen. Auch der durch die Flügelschläge erzeugte Luftstrom kann zur Abkühlung beitragen. In kalten Klimazonen ziehen Kolibris ihre Füße in das Brustgefieder ein, um die Haut nicht zu exponieren und die Wärmeableitung zu minimieren (Powers et al. 2017, Evangelista et al. 2010, Udvardy 1983).
Die hohe Stoffwechselrate der Kolibris erfordern weiterhin eine spezielle Anpassung der Nierenfunktion. Während eines Tages mit Nektarverzehr und einer entsprechend hohen Wasseraufnahme, die sich auf das Fünffache des Körpergewichts pro Tag belaufen kann, verarbeiten Kolibri-Nieren Wasser in Mengen, die proportional zum Wasserverbrauch sind, wodurch eine Überwässerung vermieden wird. Während kurzer Perioden des Wasserentzugs, wie z. B. während des nächtlichen Schlafs, sinkt die Filtrationsrate jedoch auf Null, wodurch das Körperwasser erhalten bleibt (Suarez & Gass 2002, Bakken & Sabat 2006, Bakken et al. 2004).
Die Nieren von Kolibris besitzen auch die einzigartige Fähigkeit, den Elektrolytgehalt nach dem Verzehr von Nektar mit hohem oder niedrigem Mineralgehalt zu regulieren, was darauf hindeutet, dass die Nieren hochspezialisiert sein müssen, um den Schwankungen der Mineralqualität des Nektars gerecht zu werden. Morphologische Studien an den Nieren von Annakolibris ergaben eine hohe Kapillardichte in unmittelbarer Nähe der Nephrone, was eine präzise Regulierung von Wasser und Elektrolyten ermöglicht (Bakken & Sabat 2006, Lotz & Martinez 2004, Beuchat et al. 1999).
Bei Kolibris, die in großen Höhen leben, fanden Forscher heraus, dass das Hämoglobin eine erhöhte Sauerstoffbindungsaffinität aufweist, und dass dieser adaptive Effekt wahrscheinlich auf evolutionäre Mutationen innerhalb des Hämoglobinmoleküls zurückzuführen ist (Projecto-Garcia et al. 2013, Lim et al. 2019).
Torpor
Der Stoffwechsel von Kolibris kann sich nachts oder zu jeder anderen Zeit verlangsamen, wenn keine Nahrung zur Verfügung steht; die Vögel begeben sich in einen Kälteschlaf (bekannt als Torpor), um zu verhindern, dass ihre Energiereserven auf ein kritisches Niveau sinken (Shankar et al. 2021, Abb. 28). In einer Studie an Breitschwanzkolibris wurde festgestellt, dass das Körpergewicht während des Torpors linear um 0,04 g pro Stunde abnimmt (Bakken et al. 2004). Bei einem karibischen Kolibri sank die Körpertemperatur während des nächtlichen Kälteschlafs von 40 auf 18 °C, wobei sich die Herz- und Atemfrequenz dramatisch verlangsamte (Hainsworth & Wolf 1970, siehe auch Hiebert 1992). Beim Schwarzbauch-Glanzschwänzchen (Metallura phoebe), der in den Anden auf etwa 3.800m Höhe lebt, sinkt beim Kälteschlaf die Körpertemperatur auf 3,3 Grad – den niedrigsten Wert bei allen Vögeln (Wolf et al. 2020). Während kalter Nächte in der Höhe befanden sich Kolibris je nach Art 2-13 Stunden lang im Torpor, wobei die Abkühlung mit einer Geschwindigkeit von 0,6 °C pro Minute und die Wiederaufwärmung mit 1-1,5 °C pro Minute erfolgte.
Nutzung und Dauer des Torpor sind bei den verschiedenen Kolibriarten unterschiedlich und hängen davon ab, ob ein dominanter Vogel sein Territorium verteidigt, während nicht territoriale, untergeordnete Vögel längere Torpor-Perioden haben (Powers et al. 2003). Bei einem Kolibri mit einem höheren Fettanteil ist die Wahrscheinlichkeit geringer, dass er in einen Torpor-Zustand eintritt, als bei einem mit weniger Fett, da der Vogel die Energie aus seinen Fettreserven nutzen kann. Der Torpor bei Kolibris scheint nicht von der nächtlichen Temperatur abhängig zu sein, da er in einem weiten Temperaturbereich auftritt (Shankar et al. 2020).
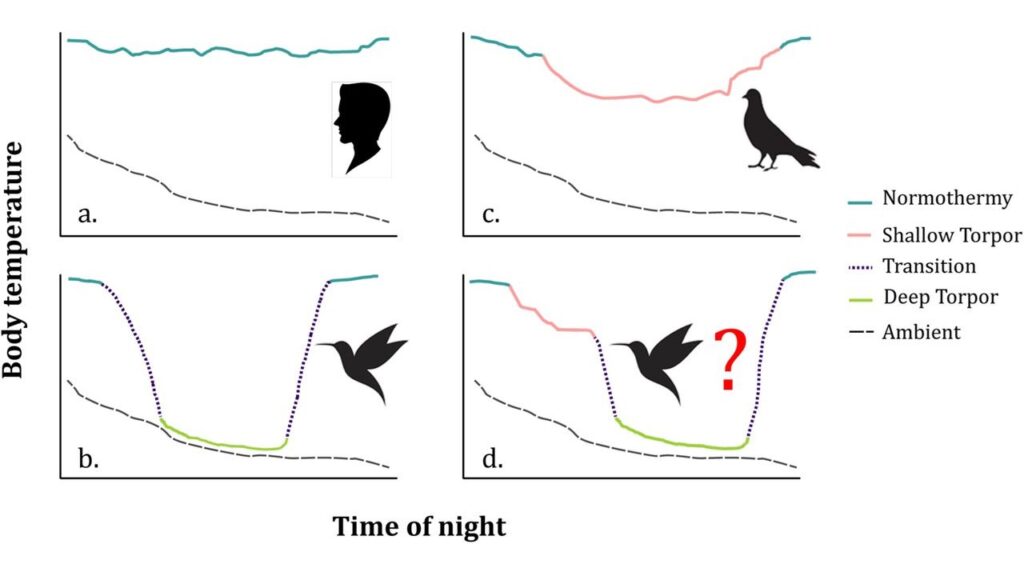
Abb. 28: Eine schematische Darstellung der Körpertemperatur (farbige Linien) im Verhältnis zur Umgebungstemperatur (schwarz gestrichelte Linie) bei Nacht, im Schlaf, in flacher Kältestarre und in tiefer Kältestarre. a. Ein normothermisches Individuum mit minimalen zirkadianen Absenkungen der nächtlichen Körpertemperatur (z. B. Menschen). b. Ein Individuum beginnt die Nacht normothermisch und dann in einen tiefen Torpor übergeht, bei dem die Körpertemperatur mit der Umgebungstemperatur sinkt und der Unterschied zwischen minimaler Körpertemperatur und Umgebungstemperatur minimiert wird (z. B. Kolibris). c. Ein Individuum beginnt die Nacht normotherm und geht dann in einen „flachen“ Torpor über, möglicherweise weil die Art eine sehr hohe minimale Körpertemperatur von nur 4–5 °C unter dem normothermen Niveau liegt (z. B. bei einigen Taubenarten). d. Ein Individuum nutzt eine Kombination aus Normothermie, flachem und tiefem Torpor und reguliert seine Körpertemperatur zeitweise über seine minimale torpide Körpertemperatur hinaus.
Studien zum Kolibri-Stoffwechsel befassen sich auch mit der Frage, wie ein wandernder Rubinkehlkolibri (Archilochus colubris) 800 km des Golfs von Mexiko auf einem Nonstop-Flug überqueren kann. [Wie andere Langstreckenzugvögel speichert dieser Kolibri Fett als Treibstoffreserve, wodurch er sein Gewicht um bis zu 100 % erhöht, um dann den Stoffwechsel für den Flug über offenes Wasser zu aktivieren (Hagrove 2005).
Beim Annakolibri (Calypte anna), dessen Verbreitung bis nach Alaska reicht, kommen weitere Spezialisierungen hinzu. Bei kalten Temperaturen legen sie z. B. allmählich an Gewicht zu, da sie Zucker in Fett umwandeln können (Beuchat et al. 1979, Powers 1991).
Für Organismen mit einem so schnellen Stoffwechsel haben Kolibris eine ungewöhnlich lange Lebensspanne. Obwohl viele von ihnen im ersten Lebensjahr sterben, vor allem in der gefährdeten Zeit zwischen dem Schlüpfen und dem Ausfliegen, können diejenigen, die überleben, gelegentlich ein Jahrzehnt oder länger leben. Bei den bekannteren nordamerikanischen Arten beträgt die typische Lebensspanne wahrscheinlich 3 bis 5 Jahre.[1] Zum Vergleich: Die kleineren Spitzmäuse, die zu den kleinsten Säugetieren gehören, leben selten länger als 2 Jahre (Churchfield 1990). Die längste in freier Wildbahn nachgewiesene Lebensdauer bezieht sich auf ein Weibchen eines Breitschwanzkolibris (Selasphorus platycercus), das als Erwachsener im Alter von mindestens einem Jahr beringt und 11 Jahre später wieder eingefangen wurde, also mindestens 12 Jahre alt war.
Evolution und Fossilbericht der Kolibris
Kolibris spalteten sich von anderen Mitgliedern der Apodiformes vor etwa 42 Millionen Jahren ab. Im Jahr 2013 wurde in Wyoming ein 50 Millionen Jahre altes Vogelfossil ausgegraben, das sich als Vorläufer von Kolibris und Seglern herausstellte, bevor sich die beiden Gruppen voneinander trennten (Ksepka et al. 2013). Heute sind Kolibris auf den amerikanischen Doppelkontinent beschränkt, doch dürfte ihr Ursprung außerhalb liegen.
Im Jahr 2004 wurde eine 30 Mio. Jahre alte Kolibriart beschrieben, welches in Deutschland, südlich von Heidelberg, ausgegraben wurde. Die Art wurde Eurotrochilus inexpectatus („unerwarteter europäischer Kolibri“) getauft (Mayr 2004a, 2005, 2007, Bochenski & Bochenski 2008, Louchart et al. 2008, Abb. 29).
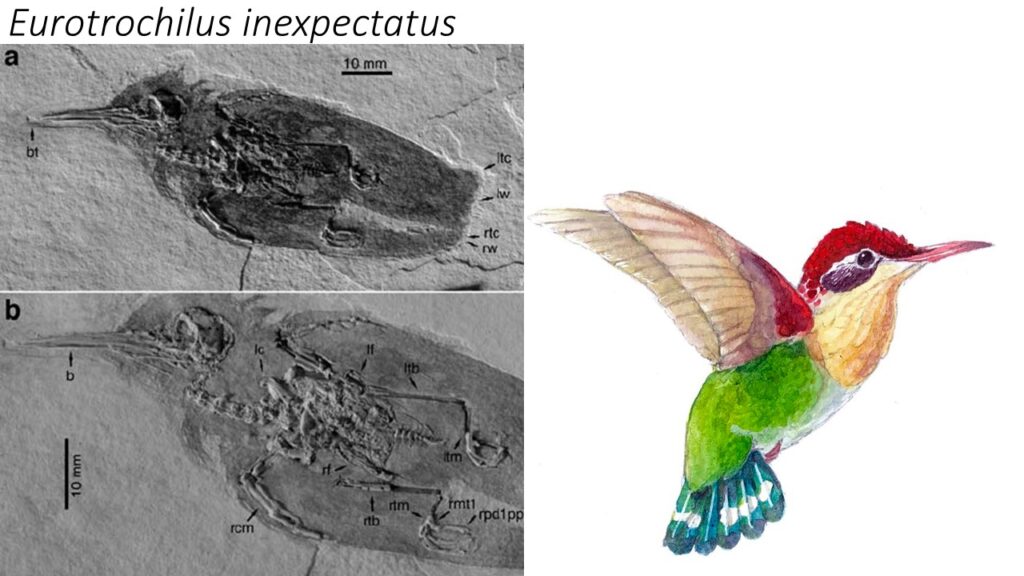
Abb. 29: Eurotrochilus inexpectatus
In der Grube Messel und im Kaukasus wurden Fossilien von Vögeln gefunden, die weder eindeutig den Kolibris noch einer verwandten, ausgestorbenen Familie, den Jungornithidae (Gattungen Jungornis, Parargornis, Argornis), zuzuordnen sind. Sie stammen aus der Zeit vor 35 bis 40 Millionen Jahren, was darauf hindeutet, dass die Trennung zwischen diesen beiden Linien tatsächlich um diese Zeit stattfand. In den Gebieten, in denen diese frühen Fossilien gefunden wurden, herrschte zu dieser Zeit ein ähnliches Klima wie in der nördlichen Karibik oder im südlichsten China (Karhu 1988, 1992, 1999, Mourer-Chauviré & Sigé 2006, Mayr 2003a, Abb. 30).

Abb. 30: Jungornithidae
Phylogenetische Stammbäume belegen, dass die modernen Kolibris ihren Ursprung in Südamerika haben, wobei der letzte gemeinsame Vorfahre vor etwa 22 Mio. Jahren lebte (McGuire et al. 2014). Die Ergebnisse deuten weiterhin darauf hin, dass die Hauptausbreitung der südamerikanischen Kolibris vor etwa 12 bis 13 Millionen Jahren, während der Hebung der nördlichen Anden stattfand (Bleiweiss et al. 1999).
Ein großes Rätsel in der Evolution der Kolibris ist, was in dem Zeitraum zwischen ursprünglichen Gattungen aus der alten Welt wie Eurotrochilus und den modernen Kolibris Amerikas geschah. Die erstaunlichen morphologischen Anpassungen, die Verkleinerung, die Ausbreitung nach Amerika und das Aussterben in Eurasien fallen allesamt in diese Zeitspanne.
Die Fähigkeit Nektar als Nahrungsquelle zu nutzen hat sich in der Evolution der Vögel mehrmals unabhängig voneinander entwickelt. In Afrika, Asien und Australien sind einige Papageien, aber vor allem die Nektarvögel und Honigfresser darauf spezialisiert Blütennektar zu trinken. Besonders die Nektarvögel sehen den Kolibris erstaunlich ähnlich – ihnen fehlen aber die besonderen Anpassungen der Kolibris, wie die außergewöhnlichen Flugeigenschaften (Abb. 31).

Abb. 31: Nektarvögel
Es schwierig, einen nektarfressenden Vogel nur anhand von Skelettresten zu identifizieren, es sei denn, seine phylogenetische Verwandtschaft ist gut eingegrenzt. In einigen wenigen Fällen liefern die Fossilien jedoch Hinweise auf eine nektarfressende Ernährung der fossilen Vögel. Der älteste Hinweis auf Nektarfresser in einem fossilen Vogel stammt von einem Exemplar von Pumiliornis aus dem frühen Eozän von Messel, in dem große Mengen von Pollen als Mageninhalt erhalten sind (Mayr & Wilde 2014). Pumiliornis wurde kürzlich als Vertreter einer zygodaktylen Stammgruppe der Sperlingsartigen (Passeriformes) vermutet (Mayr 2015b) und ist eindeutig mit keiner der heute lebenden nektarfressenden Taxa eng verwandt (Abb. 32).

Abb. 32: Pumiliornis
Vielfalt der Kolibris
Die modernen Kolibris lassen sich in 9 Hauptkladen unterteilen: Florisugainae, Phaethornithinae, Polytminae, Lesbiini, Heliantheini, Patagoninae, Trochilini, Lampornithini und Mellisugini (McGuire et al. 2007, 2008, 2014, Remsen et al. 2015, Bleiweiss et al. 1997, Winkler et al. 2015, Abb. 33).
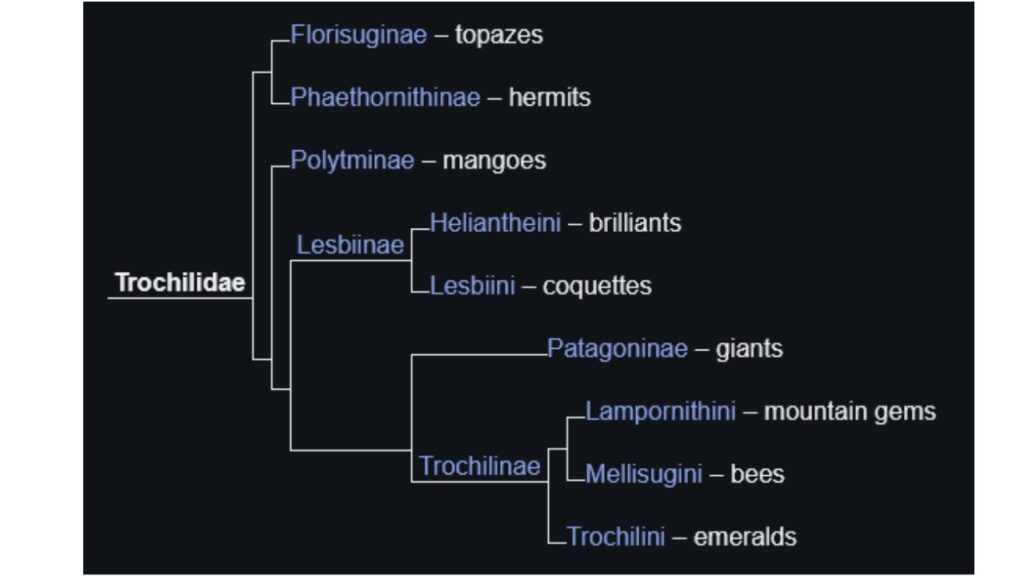
Abb. 33: Kladogramm der Kolibris
Die Florisuginae haben zwei Gattungen mit je zwei Arten in Südamerika (Topaza, Florisuga). Hier sind die zwei Arten der Topas-Kolibris (Topaza) besonders zu erwähnen, da sie sich häufiger von Insekten zu ernähren scheinen als andere Kolibriarten (Abb. 34).
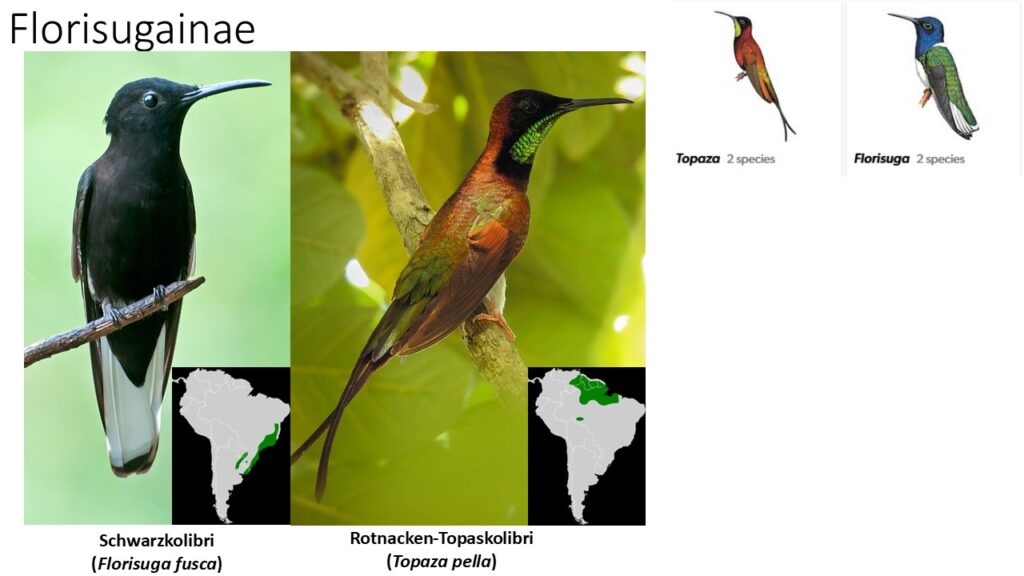
Abb. 34: Florisuginae
Die Klade der Phaethornithinae werden auch als Eremiten bezeichnet, die früher als eine eigene Unterfamilie den anderen Kolibris (Trochilinae) gegenübergestellt wurde. Während die Eremiten sich tatsächlich als monophyletische Gruppe herausgestellt haben, stehen sie mitten im Stammbaum der restlichen Kolibris. Die etwa 40 Arten (in sechs Gattungen: Anopetia, Eutoxeres, Glaucis, Phaethornis, Ramphodon, Threnetes) kommen von Mexiko bis Bolivien und Südbrasilien vor und unterscheiden sich von den anderen Kolibris vor allem durch ihre Färbung, die vor allem aus bräunlichen, rötlichen oder grauen Tönen besteht, die durch Pigmentfarben gebildet werden. Die oft glitzernden und recht bunten Färbungen der anderen Kolibriarten werden dagegen vor allem durch Strukturfarben hervorgerufen (Abb. 35).
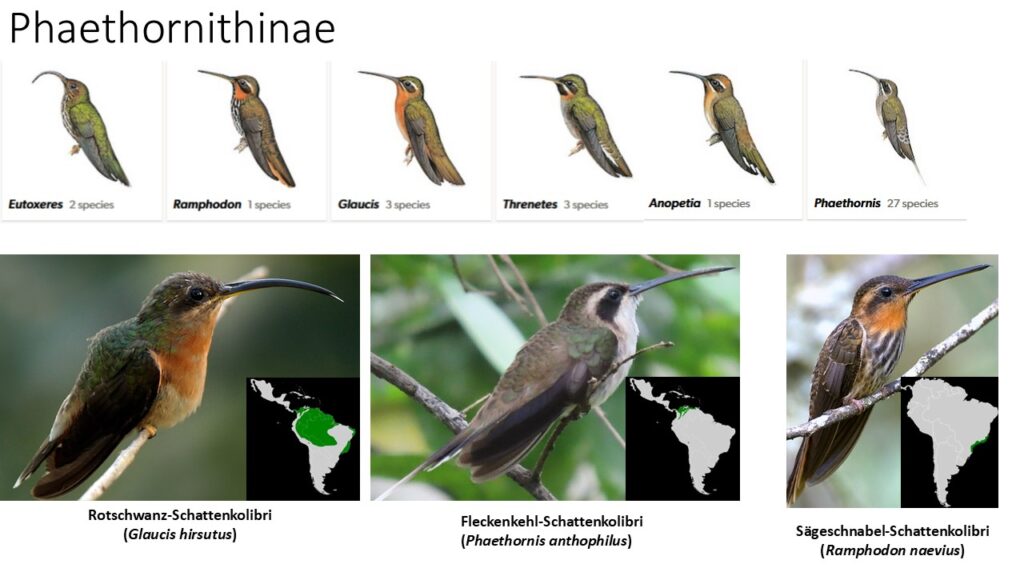
Abb. 35: Phaethornithinae
Die Polytminae haben 12 Gattungen mit ca. 30 Arten in Mittel- und Südamerika (Androdon, Anthracothorax, Augastes, Avocettula, Chrysolampis, Colibri, Doryfera, Eulampis, Heliactin, Heliothryx, Polytmus, Schistes). Sie werden auch als Mangokolibris bezeichnet, benannt nach ihrer größten Gattung (Anthracothorax). Eine weitere Gattung dieser Klade sind die Veilchen-Kolibris (Colibri). Viele Arten haben Zacken an der Schnabelscheide, welches beim Zahnschnabelkolibri (Androdon aequatorialis) besonders auffällt (Abb. 36).

Abb. 36: Polytminae
Zu den Lesbiini gehören 18 Gattungen mit knapp 70 Arten (Adelomyia, Aglaiocercus, Chalcostigma, Discosura, Heliangelus, Lesbia, Lophornis, Metallura, Opisthoprora, Oreonympha, Oreotrochilus, Oxypogon, Phlogophilus, Polyonymus, Ramphomicron, Sappho, Sephanoides, Taphrolesbia, Abb. 37). Größere Gattungen sind die Glanzschwänzchen (Chalcostigma und Metallura), Fadenelfen (Discosura), Sonnennymphen (Heliangelus) und Schopfkolibris (Lophornis). Letztere haben einen auffälligen Federschopf am Kopf. Alle Arten leben in Mittel- und Südamerika mit einem Schwerpunkt in den tropischen Anden. Eine der südlichsten Arten ist der Chile-Kolibri (Sephanoides sephanoides), der im Süden Chiles und Argentiniens, inklusive Feuerlands, vorkommt, gehört ebenfalls zu den Lesbiini.

Abb. 37: Lesbiini
Die Heliantheini haben 13 Gattungen mit über 50 Arten, die in Mittel- und Südamerika vorkommen (Aglaeactis, Boissonneaua, Coeligena, Ensifera, Eriocnemis, Haplophaedia, Heliodoxa, Lafresnaya, Loddigesia, Ocreatus, Pterophanes, Urochroa, Urosticte, Abb. 38). Auch hier kommen viele Arten in den tropischen Anden vor. Größere bzw. auffälligere Gattungen sind hier z. b. die Höschen-Kolibris (Eriocnemis). Ihr auffälligstes Merkmal sind dichte, weiße dunige Federbüschel an den Beinen, die den Eindruck von Wollhöschen erwecken. Weitere große Gattungen sind die Waldnymphen (Coeligena) mit geraden nadelartigen Schnäbeln, deren Länge sich bei den Geschlechtern unterscheiden können und die Brilliantkolibris (Heliodoxa) mit einem besonders schillernden Gefieder. Auch der Schwertschnabel-Kolibri (Ensifera ensifera) gehört in diese Gruppe.

Abb. 38: Heliantheini
Die Lesbiini und Heliantheini werden als Unterfamilie Lesbiinae zusammengefasst.
Die Patagoninae haben nur eine Gattung mit einer Art: dem Riesenkolibri, mit 22cm Körperlänge der größte Kolibri. Sein Verbreitungsgebiet sind die Anden. Man geht davon aus, dass die Art Patagona gigas vergleichsweise alt ist und größtenteils ein gescheitertes evolutionäres Experiment zur Vergrößerung von Kolibris darstellt, da sie sich nicht verzweigt und vermehrt hat (Abb. 19).
Die Klade der Trochilini hat 36 Gattungen mit über 114 Arten (Abeillia, Amazilia, Amazilis, Anthocephala, Basilinna, Campylopterus, Chalybura, Chionomesa, Chlorestes, Chlorostilbon, Chrysuronia, Cynanthus, Elliotomyia, Eupherusa, Eupetomena, Goldmania, Hylocharis, Klais, Leucippus, Leucochloris, Microchera, Orthorhyncus, Pampa, Phaeochroa, Phaeoptila, Polyerata, Ramosomyia, Riccordia, Saucerottia, Stephanoxis, Talaphorus, Taphrospilus, Thalurania, Thaumasius, Trochilus, Uranomitra, Abb. 39 und 40). Hierher gehören mehrere Gattungen, die als Amazilien (z. B. Amazilia, Amazilis, Chionomesa, Chrysuronia, Elliotomyia, Polyerata, Ramosomyia, Saucerottia, Uranomitra), Smaragdkolibris (z. B. Chlorostilbon, Cynanthus, Riccordia), Saphirkolibris (z. B. Basilinna, Hylocharis) und Degenflügel (z. B. Campylopterus, Pampa) bezeichnet werden. Sie kommen in Mittel- und Südamerika, sowie der Karibik vor. Auch hier gibt es viele Arten in den Anden, aber eine große Vielfalt findet sich auch in Mexiko, Mittelamerika, sowie im Amazonas-Regenwald. Einige Gattungen sind auch auf die Karibik beschränkt: Die Gattung Trochilus mit zwei Arten auf Jamaika, der Antillenhaubenkolibri (Orthorhyncus cristatus), der von Puerto Rico, über Barbados, Grenada, den Grenadinen und den kleinen Antillen vorkommt, sowie die Gattung Riccordia, die auf mehreren Karibik-Inseln vorkommt.

Abb. 39: Trochilini

Abb. 40: Trochilini
Die Klade der Lampornithini umfasst 7 Gattungen mit 18 Arten (Eugenes, Heliomaster, Hylonympha, Lampornis, Lamprolaima, Panterpe, Sternoclyta, Abb. 41), deren größte Gattungen Lampornis mit 8 und Heliomaster mit vier Arten sind. 4 Gattungen haben nur eine Art und die Gattung Eugenes, die Brilliant-Kolibris, haben zwei. Die meisten Arten kommen in Mexiko, Mittelamerika und dem Norden Südamerikas (Kolumbien und Venezuela) vor. Einige Arten der Gattung Heliomaster kommen auch bis nach Argentinien vor. Zwei Arten: der Violettkron-Brillantkolibri (Eugenes fulgens) und die Blaukehlnymphe (Lampornis clemenciae) kommen auch im Süden der USA vor.

Abb. 41: Lampornithini
Die Klade der Mellisugini haben 17 Gattungen mit 37 Arten (Archilochus, Calothorax, Calliphlox, Calypte, Chaetocercus, Doricha, Eulidia, Mellisuga, Microstilbon, Myrmia, Myrtis, Nesophlox, Philodice, Rhodopis, Selasphorus, Thaumastura, Tilmatura, Abb. 42). Hierzu gehören u. a. die Bienenelfe (Mellisuga helenae) und Zwergelfe (Mellisuga minima), die auf Kuba bzw. Jamaika und Hispaniola vorkommen und mit rund 2 Gramm die kleinsten Vögel der Welt sind. Weiterhin finden sich in dieser Klade jene Arten, die auch in den gemäßigten Zonen Nordamerikas vorkommen, wie der Schwarzkinnkolibri (Archilochus alexandri), Rubinkehlkolibri (Archilochus colubris), Sternelfe (Selasphorus calliope), Breitschwanzelfe (Selasphorus platycercus), Zimtkolibri (Selasphorus rufus), Grünrücken-Zimtelfe (Selasphorus sasin), Veilchenkopfelfe (Calypte costae) und Annakolibri (Calypte anna). Viele Gattungen, so auch die Gattung Chaetocercus, zu der u. a. die Hummelelfe (Chaetocercus bombus) gehört, haben ihren Verbreitungsschwerpunkt in den tropischen Anden. Die zwei Arten der Gattung Nesophlox findet man auf den Bahamas.

Abb. 42: Mellisugini
Die Trochilini, Lampornithini und Mellisugini werden als Unterfamilie Trochilinae zusammengefasst.

Abb. 43: Schwarzkinnkolibri (Archilochus alexandri), Rubinkehlkolibri (Archilochus colubris)

Abb. 44: Sternelfe (Selasphorus calliope), Breitschwanzelfe (Selasphorus platycercus)

Abb. 45: Zimtkolibri (Selasphorus rufus), Grünrücken-Zimtelfe (Selasphorus sasin)

Abb. 46: Veilchenkopfelfe (Calypte costae), Annakolibri (Calypte anna).
Literatur
Abrahamczyk, S.; Kessler, M. (2010): Hummingbird diversity, food niche characters, and assemblage composition along a latitudinal precipitation gradient in the Bolivian lowlands. Journal of Ornithology. 151 (3): 615–625.
Abrahamczyk, S.; Poretschkin, C., Renner, S. S. (2017): Evolutionary flexibility in five hummingbird/plant mutualistic systems: testing temporal and geographic matching. Journal of Biogeography. 44 (8): 1847–855.
Abrahamczyk, S.; Renner, S.S. (2015): The temporal build-up of hummingbird/plant mutualisms in North America and temperate South America. BMC Evolutionary Biology. 15 (1): 104.
Abrahamczyk, S.; Souto-Vilarós, D.; McGuire, J.A.; Renner, S.S. (2015): Diversity and clade ages of West Indian hummingbirds and the largest plant clades dependent on them: a 5–9 Myr young mutualistic system. Biological Journal of the Linnean Society. 114 (4): 848–859.
Abrahamczyk, S.; Souto-Vilaros, D.; Renner, S. S. (2014): Escape from extreme specialization: Passionflowers, bats and the sword-billed hummingbird. Proceedings of the Royal Society B: Biological Sciences. 281 (1795): 20140888.
Agrawal S., Tobalske B. W., Anwar Z., Luo H., Hedrick T. L., Cheng B. (2022): Musculoskeletal wing-actuation model of hummingbirds predicts diverse effects of primary flight muscles in hovering flightProc. R. Soc. B.28920222076
Altschuler, D. L. (2003): Flower color, hummingbird pollination, and habitat irradiance in four Neotropical forests. Biotropica. 35 (3): 344–355.
Altschuler, D.L.; Dudley, R. (2002): The ecological and evolutionary interface of hummingbird flight physiology. The Journal of Experimental Biology. 205 (Pt 16): 2325–336.
Bakken, B.H.; McWhorter, T.J.; Tsahar, E.; Martinez del Rio, C. (2004): Hummingbirds arrest their kidneys at night: diel variation in glomerular filtration rate in Selasphorus platycercus. The Journal of Experimental Biology. 207 (25): 4383–391.
Bakken, B.H.; Sabat, P. (2006): Gastrointestinal and renal responses to water intake in the green-backed firecrown (Sephanoides sephanoides), a South American hummingbird. AJP: Regulatory, Integrative and Comparative Physiology. 291 (3): R830–836.
Baldwin, Maude W.; Toda, Yasuka; Nakagita, Tomoya; O’Connell, Mary J.; Klasing, Kirk C.; Misaka, Takumi; Edwards, Scott V.; Liberles, Stephen D. (2014): Sensory biology. Evolution of sweet taste perception in hummingbirds by transformation of the ancestral umami receptor. Science. 345 (6199): 929–933.
Barlett, P. (2018): Fueling the hummingbird’s extreme biology. Johns Hopkins Medicine.
Berns, C. M.; Adams, D. C. (2012): Becoming Different But Staying Alike: Patterns of Sexual Size and Shape Dimorphism in Bills of Hummingbirds. Evolutionary Biology. 40 (2): 246–260.
Betts, M.G.; Hadley, A.S.; Kress, W.J. (2015): Pollinator recognition by a keystone tropical plant. Proceedings of the National Academy of Sciences of the United States of America. 112 (11): 3433–8.
Beuchat, C.A.; Chaplin, S.B.; Morton, M.L. (1979): Ambient temperature and the daily energetics of two species of hummingbirds, Calypte anna and Selasphorus rufus. Physiological Zoology. 52 (3): 280–295.
Beuchat, C.A.; Preest, M.R.; Braun, E.J. (1999): Glomerular and medullary architecture in the kidney of Anna’s Hummingbird. Journal of Morphology. 240 (2): 95–100.
Bleiweiss, R.; Kirsch, J.A.; Matheus, J.C. (1997): DNA hybridization evidence for the principal lineages of hummingbirds (Aves:Trochilidae). Molecular Biology and Evolution. 14 (3): 325–343.
Bleiweiss, R.; Kirsch, J. A. W.; Matheus, J. C. (1999): DNA-DNA hybridization evidence for subfamily structure among hummingbirds. Auk. 111 (1): 8–19.
Bochenski, Z.; Bochenski, Z. M. (2008): An Old World hummingbird from the Oligocene: a new fossil from Polish Carpathians. Journal of Ornithology. 149 (2): 211–216.
Boles ,WE (2001): A swiftlet (Apodidae: Collocaliini) from the Oligo-Miocene of Riversleigh, northwestern Queensland. Mem Assoc Austral Palaeontol 25:45–52
Brice, Ann T.; Grau, C. Richard (1991): Protein Requirements of Costa’s Hummingbirds Calypte costae. Physiological Zoology. 64 (2). University of Chicago Press: 611–626.
Brusatte, SL; O’Connor, JK; Jarvis, ED (2015): The origin and diversification of birds. Current Biology. 25 (19): R888–98.
Carroll, S. P.; Moore, L. (1993): Hummingbirds take their vitamins. Animal Behaviour. 46 (4). Elsevier BV: 817–820.
Chantler, P, Driessens, G. (2000): Swifts – A Guide to the Swifts and Tree Swifts of the World. Pica Press, Mountfield
Chavez-Ramirez, F.; McAlister, D. (1992): Arthropod Feeding by Two Dominican Hummingbird Species. The Wilson Bulletin. 104 (4). Wilson Ornithological Society: 743–747.
Chen, A., Field, D. J. (2020): Phylogenetic definitions for Caprimulgimorphae (Aves) and majorconstituent clades under the International Code of PhylogeneticNomenclature. Vertebrate Zoology 70(4):571-585
Chen, A., White, N. D., Benson, R. B. J., Braun, M. J., Field, D. J. (2019): Total-Evidence Framework Reveals Complex Morphological Evolution in Nightbirds (Strisores). Diversity. 11(9); 143.
Chen, C. C. W.; Welch, K. C. (2014): Hummingbirds can fuel expensive hovering flight completely with either exogenous glucose or fructose. Functional Ecology. 28 (3): 589–600.
Chiappe, L. M. (2009): Downsized dinosaurs: The evolutionary transition to modern birds. Evolution: Education and Outreach. 2 (2): 248–256.
Chmel, K., Ewome, F., Uceda Gómez, G., Klomberg, Y., Mertens, J., Tropek, R., Janeček, S. (2021): Bird pollination syndrome is the plant’s adaptation to ornithophily, but nectarivorous birds are not so selective. Oikos. 130. 10.1111/oik.08052.
Churchfield, S. (1990): The natural history of shrews. Cornell University Press.
Clark, C.J. (2009): Courtship dives of Anna’s hummingbird offer insights into flight performance limits. Proceedings of the Royal Society B: Biological Sciences. 276 (1670): 3047–052
Clark, C.J. (2011): Wing, tail, and vocal contributions to the complex acoustic signals of courting Calliope hummingbirds. Current Zool. 57 (2): 187–196.
Clark, C.J. (2014): Harmonic hopping, and both punctuated and gradual evolution of acoustic characters in Selasphorus hummingbird tail-feathers. PLOS ONE. 9 (4): e93829.
Clark, C.J.; Elias, D.O.; Prum, R.O. (2013): Hummingbird feather sounds are produced by aeroelastic flutter, not vortex-induced vibration. Journal of Experimental Biology. 216 (18): 3395–403.
Clark, C. J.; Feo, T.J. (2008): The Anna’s hummingbird chirps with its tail: A new mechanism of sonation in birds. Proceedings of the Royal Society B: Biological Sciences. 275 (1637): 955–962.
Clark, C. J.; Feo, T. J. (2010): Why do Calypte hummingbirds “sing” with both their tail and their syrinx? An apparent example of sexual sensory bias. The American Naturalist. 175 (1): 27–37.
Coutinho, L., Rech, A., Bergamo, P., Gonçalves-Esteves, V., Sazima, M. (2016): Heterospecific pollen deposition among plants sharing hummingbird pollinators in the Brazilian Atlantic Forest. Rodriguesia. 67. 335-345.
Dalsgaard, B.; Martín González, A. M.; Olesen, J. M.; et al. (2009): Plant-hummingbird interactions in the West Indies: Floral specialisation gradients associated with environment and hummingbird size. Oecologia. 159 (4): 757–766.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliot, A.; Sargatal, J., eds. (1999): Handbook of the Birds of the World, volume 5, Barn-owls to Hummingbirds, Lynx Edicions, Barcelona.
Dyke, G.J., Waterhouse, D.M., Kristoffersen, A.V. (2004): Three new fossil landbirds from the early Paleogene of Denmark. Bull. Geol. Soc. Denmark 51: 47–56.
Ericson, P. G. P., et al. (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters 22: 543–547.
Evangelista, D.; Fernández, M. J.; Berns, M. S.; Hoover, A.; Dudley, R. (2010): Hovering energetics and thermal balance in Anna’s hummingbirds (Calypte anna). Physiological and Biochemical Zoology. 83 (3): 406–413.
Feinsinger, P.; Colwell, R. K.; Terborgh, J.; Chaplin, S. B. (1979): Elevation and the Morphology, Flight Energetics, and Foraging Ecology of Tropical Hummingbirds. The American Naturalist. 113 (4): 481–497.
Fernández, M.J.; Dudley, R.; Bozinovic, F. (2011): Comparative energetics of the giant hummingbird (Patagona gigas). Physiological and Biochemical Zoology. 84 (3): 333–340.
Freile, J. (2009): Species lists of birds for South American countries and territories: Ecuador
Fullard, B. (1993): Echolocation in Free Flying Atiu Swiftlet (Aerodramus sawtelli). Biotropica. 25: 334–339
Gaede, A.H.; Goller, B.; Lam, J.P.; Wylie, D.R.; Altshuler, D.L. (2017): Neurons responsive to global visual motion have unique tuning properties in hummingbirds. Current Biology. 27 (2): 279–285.
Goller, B.; Altschuler, D.L. (2014): Hummingbirds control hovering flight by stabilizing visual motion. Proceedings of the National Academy of Sciences. 111 (51): 18375–380.
Hackett, S. J. et al. (2008): A phylogenomic study of birds reveals their evolutionary history. Science 320: 1763–1768.
Hainsworth, F.R.; Wolf, L.L. (1970): Regulation of oxygen consumption and body temperature during torpor in a hummingbird, Eulampis jugularis. Science. 168 (3929): 368–369.
Hargrove, J.L. (2005): Adipose energy stores, physical work, and the metabolic syndrome: Lessons from hummingbirds. Nutrition Journal. 4: 36.
Harrison, C.J.O. (1984): A revision of the fossil swifts (Vertebrata, Aves, suborder Apodi), with descriptions of three new genera and two new species. Meded. Werkgr. Tert. Kwart. Geol. 21: 157–177.
Hendry, L. (2023): Are birds the only surviving dinosaurs?. The Trustees of The Natural History Museum, London.
Hiebert, S.M. (1992): Time-dependent thresholds for torpor initiation in the rufous hummingbird (Selasphorus rufus). Journal of Comparative Physiology B. 162 (3): 249–255.
Hightower, B.J.; Wijnings, P. W.A.; Scholte, R.; et al. (2021): How oscillating aerodynamic forces explain the timbre of the hummingbird’s hum and other animals in flapping flight. eLife. 10: e63107.
Ingersoll, R.; Lentink, D. (2018): How the hummingbird wingbeat is tuned for efficient hovering. Journal of Experimental Biology. 221 (20).
Iwaniuk, A.N.; Wylie, D.R. (2007): Neural specialization for hovering in hummingbirds: hypertrophy of the pretectal nucleus Lentiformis mesencephali. Journal of Comparative Neurology. 500 (2): 211–221.
Jaramillo, A.; Barros, R. (2010): Species lists of birds for South American countries and territories: Chile
Jarvis, E. D.; et al. (2014): Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 346 (6215): 1320–1331
Junker, R. R.; Blüthgen, N.; Brehm, T.; Binkenstein, J.; Paulus, J.; Martin S., H., Stang, M. (2012): Specialization on traits as basis for the niche-breadth of flower visitors and as structuring mechanism of ecological networks. Functional Ecology. 27 (2): 329–341.
Karhu, A. (1988): A new family of swift-like birds from the Paleogene of Europe. Paleontol J 3:78–88. [in Russian]
Karhu, A. (1992): Morphological divergence within the order Apodiformes as revealed by the structure of the humerus. In: Campbell KE (ed) Papers in avian paleontology honoring Pierce Brodkorb. Nat Hist Mus Los Angeles Cty Sci Ser 36:379–384
Karhu, A. (1999): A new genus and species of the family Jungornithidae (Apodiformes) from the Late Eocene of the Northern Caucasus, with comments on the ancestry of hummingbirds. In: Olson SL (ed): Avian paleontology at the close of the 20th century: Proceedings of the 4th international meeting of the Society of Avian Paleontology and Evolution, Washington, D.C., 4-7 June 1996. Smithson Contrib Paleobiol 89:207–216
Kim, W.; Peaudecerf, F.; Baldwin, M.W.; Bush, J.W. (2012): The hummingbird’s tongue: A self-assembling capillary syphon. Proceedings of the Royal Society B: Biological Sciences. 279 (1749): 4990–996.
Ksepka, D. T.; Clarke, J. A.; Nesbitt, S. J.; Kulp, F. B.; Grande, L. (2013): Fossil evidence of wing shape in a stem relative of swifts and hummingbirds (Aves, Pan-Apodiformes). Proceedings of the Royal Society B: Biological Sciences. 280 (1761): 20130580. doi:10.1098/rspb.2013.0580.
Kuban, J. F.; Neill, R. L. (1980): Feeding Ecology of Hummingbirds in the Highlands of the Chisos Mountains, Texas. The Condor. 82 (2). Oxford University Press (OUP): 180.
Kuhl, H. et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38: 108–127.
Lasiewski, R. C. (1964): Body temperatures, heart and breathing rate, and evaporative water loss in hummingbirds. Physiological Zoology. 37 (2): 212–223.
Lau, G. K., Chin, Y. W., Lau, T.-G. (2017): Development of elastomeric flight muscles for flapping wing micro air vehicles. 1016320. 10.1117/12.2260422.
Leimberger, K.G.; Dalsgaard, B.; Tobias, J.A.; Wolf, C.; Betts, M.G. (2022): The evolution, ecology, and conservation of hummingbirds and their interactions with flowering plants. Biological Reviews of the Cambridge Philosophical Society. 97 (3): 923–959.
Li, X. (2009): T1R receptors mediate mammalian sweet and umami taste. American Journal of Clinical Nutrition. 90 (3): 733S–37S.
Lim, M. C.W.; Witt, C. C.; Graham, C. H.; Dávalos, L. M. (2019): Parallel molecular evolution in pathways, genes, and sites in high-elevation hummingbirds revealed by comparative transcriptomics. Genome Biology and Evolution. 11 (6): 1573–1585.
Lisney, T.J.; Wylie, D.R.; Kolominsky, J.; Iwaniuk, A.N. (2015): Eye morphology and retinal topography in hummingbirds (Trochilidae Aves). Brain, Behavior and Evolution. 86 (3–4): 176–190.
López-Segoviano, G; Arenas-Navarro, M; Vega, E; Arizmendi, M del Coro (2018): Hummingbird migration and flowering synchrony in the temperate forests of northwestern Mexico. PeerJ. 6: e5131.
Lotz, C.N.; Martínez Del Rio, C. (2004): The ability of rufous hummingbirds Selasphorus rufus to dilute and concentrate urine. Journal of Avian Biology. 35: 54–62.
Louchart, A., Tourment, N., Carrier, J., Roux, T., Mourer-Chauviré, C. (2008): Hummingbird with modern feathering: An exceptionally well-preserved Oligocene fossil from southern France. Die Naturwissenschaften. 95. 171-5. 10.1007/s00114-007-0309-0.
Maeda, M., Nakata, T., Kitamura, I., Tanaka, H., Liu, H. (2017): Quantifying the dynamic wing morphing of hovering hummingbird. Royal Society Open Science. 4. 170307. 10.1098/rsos.170307.
Maglianesi, M.A.; Blüthgen, N.; Böhning-Gaese, K., Schleuning, M. (2014): Morphological traits determine specialization and resource use in plant–hummingbird networks in the Neotropics. Ecology. 95 (12): 3325–334.
Mayr, G. (2003): A new Eocene swift-like bird with a peculiar feathering. Ibis. 145 (3): 382–391.
Mayr, G. (2003a): Phylogeny of eaerly Tertiary swifts and hummingbirds (Aves: Apodiformes), The Auk 120 1, 145-151
Mayr, G. (2004): Phylogeny of early Tertiary swifts and hummingbirds (Aves: Apodiformes). Auk, 120 (1): 145-151.
Mayr, G. (2004a): Old World fossil record of modern-type hummingbirds. Science 304, 861–864.
Mayr, G. (2005): Fossil hummingbirds of the Old World. Biologist. 52 (1): 12–16.
Mayr, G. (2007): New specimens of the early Oligocene Old World hummingbird Eurotrochilus inexpectatus. Journal of Ornithology. 148 (1): 105–111.
Mayr, G. (2009): Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G. (2010): Reappraisal of Eocypselus – a stem group representative of apodiform birds from the early Eocene of Northern Europe. Palaeobiodiversity and Palaeoenvironments, 90: 395-403.
Mayr, G. (2015a): Skeletal morphology of the middle Eocene swift Scaniacypselus and the evolutionary history of true swifts (Apodidae). J Ornithol. 156 (2): 441–450.
Mayr, G. (2015b): A reassessment of Eocene parrotlike fossils indicates a previously undetected radiation of zygodactyl stem group representatives of passerines (Passeriformes). Zoologica Scripta 44, 587–602.
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G.; Kitchener, A.C. (2024): New fossils of Eocypselus and Primapus from the British London Clay reveal a high taxonomic and ecological diversity of early Eocene swift-like apodiform birds. Ibis (advance online publication). doi:10.1111/ibi.13323
Mayr, G.; Peters, D.S. (1999): On the systematic position of the Middle Eocene swift Aegialornis szarskii Peters 1985 with description of a new swift-like bird from Messel (Aves, Apodiformes). Neues Jahrbuch für Geologie und Paläontologie – Monatshefte. 1999 (5): 312–320.
Mayr, G., Wilde, V. (2014): Eocene fossil is earliest evidence of flower-visiting by birds. Biology Letters 10, 20140223.
McGuire, J.A.; Witt, C.C.; Altshuler, D.L.; Remsen, J.V. (2007): Phylogenetic systematics and biogeography of hummingbirds: Bayesian and maximum likelihood analyses of partitioned data and selection of an appropriate partitioning strategy. Systematic Biology. 56 (5): 837–856.
McGuire, J.; Witt, C.; Remsen, J.V.; Corl, A.; Rabosky, D.; Altshuler, D.; Dudley, R. (2014): Molecular phylogenetics and the diversification of hummingbirds. Current Biology. 24 (8): 910–916.
McGuire, J. A.; Witt, C. C.; Remsen, J.V. Jr.; Dudley, R.; Altshuler, D. L. (2008): A higher-level taxonomy for hummingbirds. Journal of Ornithology. 150 (1): 155–165.
McKinney, A.M.; Caradonna, P.J.; Inouye, D.W.; Barr, B; Bertelsen, C.D.; Waser, N.M. (2012): Asynchronous changes in phenology of migrating broad-tailed hummingbirds and their early-season nectar resources. Ecology. 93 (9): 1987–993.
Montgomerie, R. D.; Redsell, C. A. (1980): A Nesting Hummingbird Feeding Solely on Arthropods. The Condor. 82 (4).
Mourer-Chauviré, C. (1978): La poche à phosphate de Ste. Néboule (Lot) et sa faune de vertébrés du Ludien Supérieur. 6—Oiseaux. Palaeovertebrata 8:217–229
Mourer-Chauviré, C. (1980): The Archaeotrogonidae from the Eocene and Oligocene deposits of “Phosphorites du Quercy”, France. In: Campbell KE (ed) Papers in avian paleontology honoring Hildegarde Howard. Nat Hist Mus Los Angeles Cty Contrib Sci 330:17–31
Mourer-Chauviré, C. (1988): Les Aegialornithidae (Aves: Apodiformes) des Phosphorites du Quercy. Comparaison avec la forme de Messel. Cour Forsch-Inst Senckenberg 107:369–381
Mourer-Chauviré, C., Sigé, B. (2006): Une nouvelle espèce de Jungornis (Aves, Apodiformes) et de nouvelles formes de Coraciiformes s.s. dans l’Éocène supérieur du Quercy. Strata, ser 1 13:151-159
Nunes, C., Briet, J., Galetto, L., Sazima, M., Amorim, F. (2018): Nectar ecology of the endemic epiphytic hummingbird-pollinated bromeliad Vriesea altodaserrae: secretion dynamics and pollinator visitation pattern. Acta Botanica Brasilica. 32. 479-486.
Ocampo, D.; Barrantes, G.; Uy, J. A. C. (2018): Morphological adaptations for relatively larger brains in hummingbird skulls. Ecology and Evolution. 8 (21): 10482–10488.
Osipova, E.; Barsacchi, R.; Brown, T.; et al. (2023): Loss of a gluconeogenic muscle enzyme contributed to adaptive metabolic traits in hummingbirds. Science. 379 (6628): 185–190.
Peters, DS (1985): Ein neuer Segler aus der Grube Messel und seine Bedeutung für den Status der Aegialornithidae (Aves: Apodiformes). Senckenb Lethaea 66:143–164
Peters, DS (1998): Erstnachweis eines Seglers aus dem Geiseltal (Aves: Apodiformes). Senckenb Lethaea 78:211–212
Powers, D. R. (1991): Diurnal variation in mass, metabolic rate, and respiratory quotient in Anna’s and Costa’s hummingbirds. Physiological Zoology. 64 (3): 850–870.
Powers, D.R.; Brown, A.R.; Van Hook, J.A. (2003): Influence of normal daytime fat deposition on laboratory measurements of torpor use in territorial versus nonterritorial hummingbirds. Physiological and Biochemical Zoology. 76 (3): 389–397.
Powers, D. R.; Langland, K. M.; Wethington, S. M.; Powers, S. D.; Graham, C. H.; Tobalske, B. W. (2017): Hovering in the heat: effects of environmental temperature on heat regulation in foraging hummingbirds. Royal Society Open Science. 4 (12): 171056.
Price, J.J., Johnson, K. P., Bush, S. E., Clayton, D. H. (2005): Phylogenetic relationships of the Papuan Swiftlet Aerodramus papuensis and implications for the evolution of avian echolocation, Ibis 147, 790-796
Price, J.J., Johnson, K. P., Clayton, D. H. (2004): The evolution of echolocation in swiftlets, J. Avian Biol. 35, 135-143.
Projecto-Garcia, J.; Natarajan, C.; Moriyama, H.; et al. (2013): Repeated elevational transitions in hemoglobin function during the evolution of Andean hummingbirds. Proceedings of the National Academy of Sciences of the United States of America. 110 (51): 20669–20674.
Prum, R. O. et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Pyke, G. H. (1980): The foraging behaviour of Australian honeyeaters: a review and some comparisons with hummingbirds. Austral Ecology. 5 (4). Wiley: 343–369.
Queiroz, J., Quirino, Z., Machado, I. (2015): Floral traits driving reproductive isolation of two co-flowering taxa that share vertebrate pollinators. AoB PLANTS. 7. 10.1093/aobpla/plv127.
Ravi, S.; Crall, J. D.; McNeilly, L.; Gagliardi, S. F.; Biewener, A. A.; Combes, S. A. (2015): Hummingbird flight stability and control in freestream turbulent winds. J Exp Biol. 218 (Pt 9): 1444–452
Remsen, J.V.J.; Stiles, F.G.; Mcguire, J.A. (2015): Classification of the Polytminae (Aves: Trochilidae). Zootaxa. 3957 (1): 143–150.
Rico-Guevara, A.; Fan, T.-H.; Rubega, M. A. (2015): Hummingbird tongues are elastic micropumps. Proceedings of the Royal Society B. 282 (1813): 20151014
Rico-Guevara, A.; Rubega, M.A. (2011): The hummingbird tongue is a fluid trap, not a capillary tube. Proceedings of the National Academy of Sciences. 108 (23): 9356–360.
Rico-Guevara, A.; Rubega, M.A.; Hurme, K.J.; Dudley, R. (2019): Shifting paradigms in the mechanics of nectar extraction and hummingbird bill morphology. Integrative Organismal Biology. 1 (1): oby006.
Rodríguez-Gironés, M.A., Santamaría, L. (2004): Why are so many bird flowers red?. PLOS Biology. 2 (10): e350.
Salaman, P.; Donegan, T.; Caro, D. (2009): Checklist to the Birds of Colombia 2009. Conservation Colombiana. Fundación ProAves.
Sapir, N.; Dudley, R. (2012): Backward flight in hummingbirds employs unique kinematic adjustments and entails low metabolic cost. Journal of Experimental Biology. 215 (20): 3603–611.
Shankar, A., Cisneros, I., Thompson, S., Graham, C., Powers, D. (2021): Facultative variation across a shallow to deep torpor spectrum in hummingbirds. 10.1101/2021.07.18.452827.
Shankar, A.; Schroeder, R. J.; Wethington, S. M.; Graham, C. H.; Powers, D. R. (2020): Hummingbird torpor in context: duration, more than temperature, is the key to nighttime energy savings. Journal of Avian Biology. 51 (5): jav.02305.
Spence, A R; Wilson R, Erin E; Tingley, M W (2021): DNA metabarcoding reveals broadly overlapping diets in three sympatric North American hummingbirds. Ornithology. 139 (1).
Stiles, G. (1981): Geographical aspects of bird flower coevolution, with particular reference to Central America. Annals of the Missouri Botanical Garden. 68 (2): 323–351.
Stiles, G. (1995): Behavioral, Ecological and Morphological Correlates of Foraging for Arthropods by the Hummingbirds of a Tropical Wet Forest. The Condor. 97 (4): 853–878.
Stiller, J. et al. (2024): Complexity of avian evolution revealed by family-level genomes. Nature 629, 851–860. https://doi.org/10.1038/s41586-024-07323-1
Stoddard, M.C.; Eyster, H.N.; Hogan, B.G.; et al. (2020): Wild hummingbirds discriminate nonspectral colors. Proceedings of the National Academy of Sciences. 117 (26): 15112–122.
Suarez, R.K. (1992): Hummingbird flight: Sustaining the highest mass-specific metabolic rates among vertebrates. Experientia. 48 (6): 565–570.
Suarez, R.K.; Gass, C.L. (2002): Hummingbirds foraging and the relation between bioenergetics and behavior. Comparative Biochemistry and Physiology. Part A. 133 (2): 335–343.
Suarez R.K.; Lighton J.R.; Brown G.S.; Mathieu-Costello O. (1991): Mitochondrial respiration in hummingbird flight muscles. Proceedings of the National Academy of Sciences of the United States of America. 88 (11): 4870–3.
Suarez, R.K.; Lighton, J.R.; Moyes, C.D.; et al. (1990): Fuel selection in rufous hummingbirds: ecological implications of metabolic biochemistry. Proceedings of the National Academy of Sciences of the United States of America. 87 (23): 9207–10.
Suarez, R.; Welch, K. (2017): Sugar metabolism in hummingbirds and nectar bats. Nutrients. 9 (7): 743.
Temeles, E.J.; Miller, J. S.; Rifkin, J. L. (2010): Evolution of sexual dimorphism in bill size and shape of hermit hummingbirds (Phaethornithinae): a role for ecological causation. Philosophical Transactions of the Royal Society of London B: Biological Sciences. 365 (1543): 1053–063.
Thomassen, H.A, den Tex, R.-J., de Bakker, M.A.G., Povel, G.D.E. (2005): Phylogenetic relationships amongst swifts and swiftlets: A multi locus approach, Mol. Phylogenet. Evol. 37, 264-277.
Thomassen, H.A, Wiersema, A.T., de Bakker, M.A.G., de Knijff, P., Hetebrij, E., Povel, G.D.E. (2003): A new phylogeny of swiftlets (Aves: Apodidae) based on cytochrome-b DNA, Mol. Phylogenet. Evol. 29, 86-93.
Tobalske, B.W.; Biewener, A.A.; Warrick, D.R.; Hedrick, T.L.; Powers, D.R. (2010): Effects of flight speed upon muscle activity in hummingbirds. Journal of Experimental Biology. 213 (14): 2515–523.
Tobalske, B. W.; Warrick, D. R.; Clark, C. J.; Powers, D. R.; Hedrick, T. L.; Hyder, G. A.; Biewener, A. A. (2007): Three-dimensional kinematics of hummingbird flight. J Exp Biol. 210 (13): 2368–382.
Toledo, MCB.; Moreira, DM. (2008): Analysis of the feeding habits of the swallow-tailed hummingbird, Eupetomena macroura (Gmelin, 1788), in an urban park in southeastern Brazil. Brazilian Journal of Biology. 68 (2). FapUNIFESP (SciELO): 419–426.
Udvardy, M. D.F. (1983): The role of the feet in behavioral thermoregulation of hummingbirds. Condor. 85 (3): 281–285.
von Blotzheim, UN, Bauer, KM (1994): Handbuch der Vögel Mitteleuropas. Band 9: Columbiformes – Piciformes. AULA-Verlag, Wiesbaden.
Warrick, D. R.; Tobalske, B. W.; Powers, D. R. (2005): Aerodynamics of the hovering hummingbird. Nature. 435 (7045): 1094–097.
Welch, K.C. Jr.; Chen, C.C. (2014): Sugar flux through the flight muscles of hovering vertebrate nectarivores: A review. Journal of Comparative Physiology B. 184 (8): 945–959.
Welch, K.C. Jr.; Suarez, R.K. (2007): Oxidation rate and turnover of ingested sugar in hovering Anna’s (Calypte anna) and rufous (Selasphorus rufus) hummingbirds. Journal of Experimental Biology. 210 (Pt 12): 2154–162.
Wilcox, S.; Clark, C. (2022): Sexual selection for flight performance in hummingbirds. Behavioral Ecology. 33 (6): 1093–1106.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2024a): Swifts (Apodidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.apodid1.02
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2024b): Treeswifts (Hemiprocnidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.hemipr1.02
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2024c): Hummingbirds (Trochilidae), version 2.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.trochi1.02
Wolf, B. O.; McKechnie, A. E.; Schmitt, C. .; Czenze, Z. J.; Johnson, A. B.; Witt, C. C. (2020): Extreme and variable torpor among high-elevation Andean hummingbird species. Biology Letters. 16 (9): 20200428.
Wu, S. et al. (2024): Genomes, fossils, and the concurrent rise of modern birds and flowering plants in the Late Cretaceous. Proceedings of the National Academy of Sciences. 121 (8).
Yanega, G. M.; Rubega, M. A. (2004): Feeding mechanisms: Hummingbird jaw bends to aid insect capture. Nature. 428 (6983): 615.
[1] https://web.archive.org/web/20170202002338/http://rpbo.org/hummingbirds.php