Der wohl historisch wichtigste Durchbruch in der Erforschung zur Entstehung des Lebens wurde 1953 durch Stanley Miller und Harold Urey erreicht (Miller 1953), indem sie aus einer Mischung aus Gasen wie Ammoniak, Methan, Stickstoff und CO2 Aminosäuren herstellen konnten. Damit war der Weg geebnet für die Erforschung zur Entstehung des Lebens. Natürlich haben Miller und Urey kein Leben erschaffen, konnten aber zeigen, dass die wichtigsten Baustoffe des Lebens – Aminosäuren – auf natürliche Wiese entstehen können. Doch wie sieht es mit den anderen Biomolekülen, also Nukleinsäuren, Kohlenhydraten und Lipiden aus? Können auch diese unter natürlichen Bedingungen entstanden sein? In diesem Beitrag gehen wir genau dieser Frage nach.
Text als pdf
Präbiotische Synthesen von Nukleinsäuren
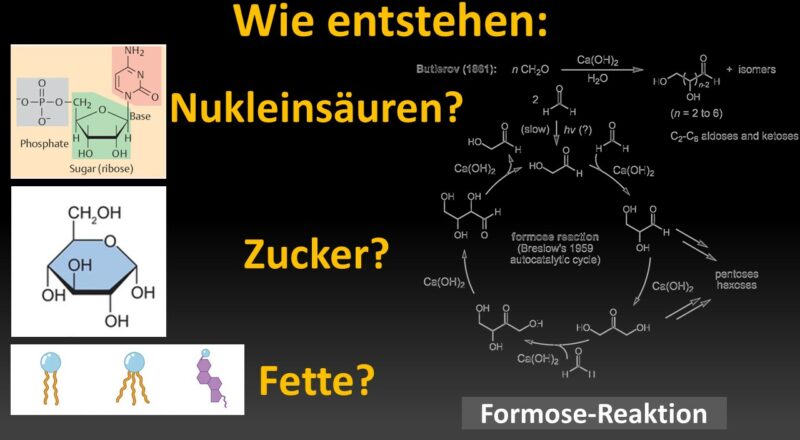
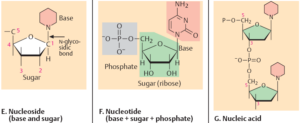
Ein Kennzeichen von Lebewesen ist das Vorhandensein von Nukleinsäuren, so in Form von DNS und RNS. Nukleinsäuren sind Polymere, deren Untereinheiten (Monomere) die Nukleotide sind. Nukleotide bestehen aus drei prinzipiellen Bausteinen: Phosphaten, Zucker, und einer Nukleinsäurebase. Es gibt vier verschiedene Basen in der DNA: Cytosin und Thymin, die zu den Pyrimidin-Basen gehören, sowie Guanin und Adenin, die zu den Purin-Basen gehören. Die RNA hat als Zucker die Ribose, die DNA Desoxyribose. Außerdem wird bei der RNA die Base Thymin durch die Base Uracil ersetzt (Abb. 1).
Abb. 1: Nukleinsäuren
Adenin kommt nicht nur in den Nukleinsäuren vor, sondern erfüllt auch, verbunden mit Ribose und drei Phosphatresten als ATP (Adenosintriphosphat, Abb. 2), Schlüsselfunktionen im Zellstoffwechsel aller Lebewesen. Adenin ist stabiler als die anderen Purinderviate und dürfte daher bei Selektionsprozessen bevorzugt in Biomoleküle eingebaut worden sein (Pullman, 1972). Die Summenformel für Adenin lautet: C5N5H5.
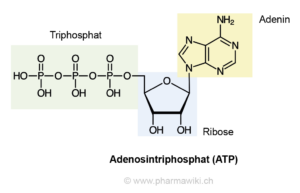
Abb. 2: Strukturformel des ATP
Dem katalanischen Biochemiker Joan Oro gelang schon wenige Jahre nach dem Miller-Urey-Experiment die Synthese des Adenins (Oro 1960). Oro erhitzte Ammoniumcyanid auf 343 K und konnte nach wenigen Tagen Adenin nachweisen. Den Reaktionsweg klärte Orò kurze Zeit später auf: Aus fünf Molekülen Blausäure (HCN) entsteht ein Molekül Adenin (Orò, 1961).
Höhere Ausbeuten konnten erzielt werden, wenn man Cyanidlösungen bei Temperaturen von etwa 243–263 K mehrere Monate stehen ließ (Sanchez et al. 1966a, Abb. 3). Viele Jahre später entdeckten andere Wissenschaftler, dass die Synthese von Adenin durch die Polymerisation von Cyanid durch Zusatz von Formaldehyd beschleunigt werden kann (Schwartz & Goverde 1982, sowie Voet & Schwartz 1983). Cyanide (CN–) sind die Salze der Blausäure (HCN). Bei Reaktionen in einer N2– und CH4-Atmosphäre mittels elektrischer Entladungen bildete sich mit relativ guter Ausbeute Cyanoacetylen, das sich mit Harnstoff zu verschiedenen Produkten umsetzt, darunter auch Cytosin (Sanchez et al. 1968, Abb. 4).
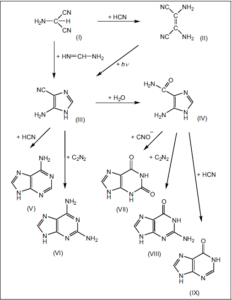
Abb. 3: Durch Variation der Adeninsynthese konnten weitere Purinderivate bei obigen Umsetzungen nachgewiesen werden. Es bedeuten:
I Aminomalonitril VI Diaminopurin
II HCN-Tetramer VII Xanthin
III Aminoimidazol-carbonitril VIII Guanin
IV 4-Aminoimidazol-5-carboxamid IX Hypoxanthin
V Adenin
Quelle: Sanchez et al. (1966)
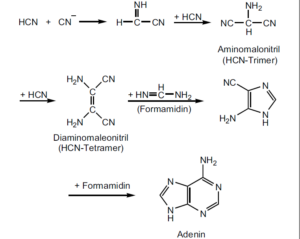
Abb. 4: Schematische Darstellung eines möglichen Syntheseweges, der vom HCN (mit Formamidin) zum Adenin führte. Quelle: Sanchez et al. (1968)
Die Synthese von Nukleinbasen weist aber einige Probleme auf. Entweder war die erforderliche Konzentration der Ausgangsstoffe unrealistisch hoch oder die Ausbeuten zu gering. Auch die Stabilität von Adenin ist niedrig und konnte daher nach Meinung einiger Forscher auf der Urerde kaum in nennenswerten Mengen zur Verfügung gestanden haben (vgl. Shapiro 1986).
Gleichwohl steht auch der präbiotischen Entstehung von Nukleinsäuren kein physikalisch-chemisches Prinzip im Weg. Nach einer kritischen Bewertung von Nelson et al. (2001) deutet sich an, dass die Annahmen über die mangelnde Stabilität des Adenins auf einer Fehlinterpretation von Daten beruhen. Außerdem hängt die Stabilität stark von den Randbedingungen ab: Während für Adenin in freier Lösung bei 20 °C eine Halbwertszeit von nur 80 Jahren angenommen wird, sind es bei 0 °C schon 4.000 Jahre.
Im Mai 2009 wurde schließlich ein präbiotischer Syntheseweg für Ribonukleotide entdeckt, der das Problem der geringen Stabilität und Ausbeute der RNA-Bausteine löst. So wurden RNA-Basen und Ribose-Zucker nicht etwa separat erzeugt und anschließend miteinander verknüpft; sie entstanden stattdessen simultan durch Reaktion präbiotisch plausibler Vorstufen wie Glykolaldehyd, Glyceraldehyd, Cyanamid, Cyanoacetylen und Phosphat ausgingen. (Powner et al. 2009).
Robertson & Miller (1995) gelang die Synthese von Cytosin und Uracil in sensationell hohen Ausbeuten. Ausgangspunkt für ihre Synthesen war Cyanoacetaldehyd und Harnstoff. Bei niedrigen Harnstoffkonzentrationen bilden sich keine nachweisbaren Cytosinkonzentrationen. Jedoch bei konzentrierten Harnstofflösungen entsteht Cytosin mit 30–50 % Ausbeute. Uracil konnte aus Cytosinlösungen durch Hydrolyse gewonnen werden. Dieser schöne Erfolg hat aber einen Haken, denn die für eine solche effektive Cytosinsynthese nötigen hohen Harnstoffkonzentrationen konnten unmöglich im freien Urozean vorhanden gewesen sein. Man muss also auch hier – ähnlich wie bei anderen Kondensationsreaktionen – die Existenz von Tümpeln
oder Lagunen voraussetzen, in denen durch Verdunstung des Wassers die notwendigen hohen Substanzkonzentrationen entstanden. Ein solches „Lagunen-Modell“ wurde vom selben Wissenschaftsteam 1996 mit ähnlich hohen Ausbeuten durchgeführt (Robertson et al. 1996, Abb. 5).
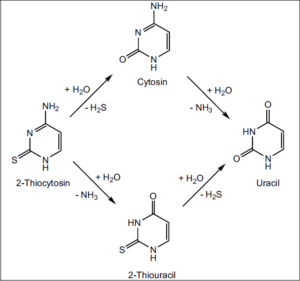
Abb. 5: Die Synthese von Cyanoacetaldehyd mit Thioharnstoff ergibt 2-Thiocytosin, das zu Cytosin bzw. Thiouracil (und weiter zu Uracil) umgewandelt werden kann. Quelle: Robertson et al. (1996)
Manche Experimentatoren gewannen Guanin durch thermale Polymerisation von Aminosäuren (Ponnamperuma et al. 1963), andere Adenin aus Methan, Ammoniak und Wasserdampf (Calvin et al. 1963), wieder andere Guanin, Uracil und Cytosin aus Kohlenmonoxid, Stickstoff und Wasserdampf im Hochtemperaturplasma (Miyakawa et al. 2000).
Mittlerweile konnte also die Bildung aller Nukleinsäurebasen nachgewiesen werden (Senanayake & Idriss 2006).
Eine Forschungsarbeit befasst sich mit der Chemie einer reduzierenden Atmosphäre mit Ammoniak, Kohlenmonoxid und Wasser und der Rolle von Formamid als Zwischenprodukt der Nukleinsäurebasenbildung im Miller-Urey-Experiment (Ferus et al. 2017).
Man konnte zeigen, dass Nukleinsäurebasen in diesen Experimenten synthetisiert wurden, was die Möglichkeit der Entstehung biologisch relevanter Moleküle in einer reduzierenden Atmosphäre stark unterstützt. Die rekonstruierten Synthesewege deuten darauf hin, dass freie Radikale und Formamid eine entscheidende Rolle spielen, was mit einer Reihe neuerer experimenteller und theoretischer Ergebnisse übereinstimmt.
Präbiotische Synthese von Kohlenhydraten
Allgemeiner Aufbau von Kohlenhydraten
Kohlenhydrate sind weitere wichtige Biomoleküle und hierzu zählen die verschiedenen Zucker, aber auch Stärke und Cellulose. Sie sind die zentrale Energiequelle, auf der fast alle Stoffwechselprodukte beruhen. Kohlenhydrate sind eine Verbindung von Kohlenstoff, Wasserstoff und Sauerstoff. Chemisch handelt es sich bei Kohlenhydraten um Oxidationsprodukte mehrwertiger Alkohole, also Alkohole, die mehr als eine OH-Gruppe als funktionelle Gruppe haben (unser Trinkalkohol Ethanol ist ein einwertiger Alkohol, weil er nur eine OH-Gruppe hat). Die einfachsten Kohlenhydrate bezeichnet man als Monosaccharide (=Einfachzucker), die die Bausteine für komplexere Kohlenhydrate sind.
Man unterschiedet hier zwischen Aldosen und Ketosen (Abb. 6). Aldosen haben eine Aldehyd-Bindung als funktionelle Gruppe, bestehend aus einer Doppelbindung von Kohlenstoff und Sauerstoff und zusätzlich hat dieses Kohlenstoffatom eine weitere Bindung mit einem Wasserstoff. Zu den Aldosen gehören z. B. Glucose, Ribose und Desoxyribose. Ketosen haben eine Ketogruppe als funktionelle Gruppe. Das ist eine Doppelbindung des Kohlenstoffs mit einem Sauerstoff. Ein bekanntes Beispiel hierfür ist die Fructose. Eine weitere Einteilung der Kohlenhydrate kann nach der Anzahl ihrer Kohlenstoffatome gemacht werden. Glucose hat sechs Kohlenstoffatome und ist damit eine Hexose, da es gleichzeitig eine Aldose ist, kann man auch von einer Aldohexose sprechen, Fructose als Ketose mit sechs Kohlenstoffatomen ist eine Ketohexose. Die Ribose hat nur 5 Kohlenstoffatome, ist damit eine Pentose. Als Aldose wäre sie demnach eine Aldopentose.
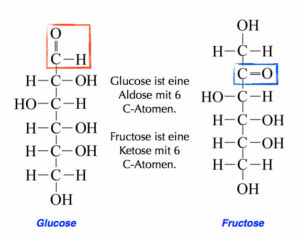
Abb. 6: Kohlenhydrate: Aldosen & Ketosen
Wie bei den meisten organischen Molekülen gibt es auch bei Kohlenhydraten sogenannte Isomere. Isomerie bedeutet, dass die Summenformel des Moleküls die gleiche ist, die Strukturformel jedoch eine andere. Das heißt im Grunde genommen nur, dass ein Molekül die gleiche Anzahl von Atomen haben kann, diese aber unterschiedlich angeordnet sein können. Nehmen wir als Beispiel die Aldohexosen, deren bekannteste Form die Glucose ist. Neben der Aldehydgruppe finden sich bei den Hexosen auch die OH-Gruppen (Alkoholgruppen). Je nachdem wo sich die OH-Gruppen im Molekül positionieren gibt es bei Glucose 8 Struktur-Isomere, die verschiedene Positionen der OH-Gruppen haben (Abb. 7). Jede dieser Strukturisomere hat noch eine Spiegelbild-Isomerie, eine sog. Chiralität. Mit der Chiralität werden wir uns ein anderes Mal näher befassen.
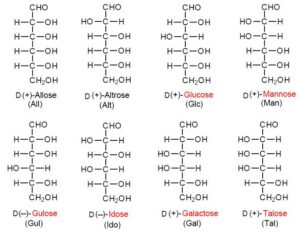
Abb. 7: Isomere der Hexoaldosen
Formose-Reaktion
Die erste Synthese von Kohlenhydraten gelang Alexander Butlerow (1828–1886, Butlerow 1861), Professor für Chemie an den Universitäten in Kasan und St. Petersburg im 19. Jh. Er erhielt bei der Umsetzung wässriger Formaldehyd-Lösungen unter alkalischen Bedingungen ein Gemisch von Zuckern. Man bezeichnet diese als Formose-Reaktion. Sie gilt als Schlüsselreaktion bei der Entstehung von Kohlenhydraten unter präbiotischen Bedingungen (Breslow 1959, Eschenmoser 2007, Abb. 8).
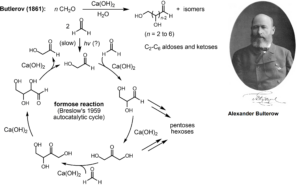
Abb. 8: Formose-Reaktion
Die „Formose-Reaktion“ ist relativ komplex und benötigt anorganische Katalysatoren, wie z.B. Calciumhydroxid (Ca(OH)2), Calciumcarbonat (CaCO3), aber auch Natriumcarbonat (Na2CO3), Kaliumkarbonat (K2CO3) und Magnesiumsulfat (MgSO4). Auch eine Reihe organischer Substanzen wie Thiazoliumsalze sind in der Lage die Formose-Reaktion zu katalysieren (eine umfassende Darstellung findet sich bei Delidovich et al. 2014, inklusive weiterführender Literatur; Abb. 9 & 10).
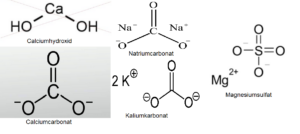
Abb. 9: Strukturformeln verschiedener anaorganischer Katalysatoren, die die Formose-Reaktion katalysieren.
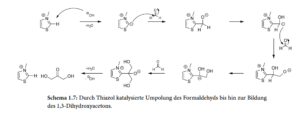
Abb. 10: Durch Thiazol katalysierte Umpolung des Formaldehyds bis hin zur Bildung des 1,3-Dihydroxyacetons.
Die Formose-Reaktion durchläuft eine Reihe von Zwischenprodukten, wie Glykolaldehyd, Glycerinaldehyd, verschiedene C4-Zucker, Pentosen und Hexosen (Abb. 11).
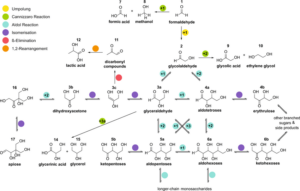
Abb. 11: Komplexität der Formose-Reaktion
In Wirklichkeit handelt es sich bei der Formose-Reaktion also nicht um eine einzige Reaktion, sondern um eine Reihe verschiedener Reaktionen der Umwandlung von Formaldehyd in wässriger Lösung in Gegenwart basischer Katalysatoren, der von zahlreichen Disproportionierungs- und Spaltungsreaktionen begleitet wird.
Des Weiteren sind bei der Formose-Reaktion auch organische Co-Katalysatoren notwendig. So stimulieren höhere und niedrigere Monosaccharide, Benzoin, Apfelsäure und andere die Umwandlung von Formaldehyd in Kohlenhydrate, während mehrwertige Alkohole, Aceton oder Polysaccharide keinen Einfluss auf die Dauer der Induktionsphase der Formose-Reaktion haben.
Es sollte erwähnt werden, dass die Formose-Reaktion formal gesehen auch ohne einen organischen Co-Katalysator erfolgreich durchgeführt werden kann, wenn sie durch Thiazoliumsalze katalysiert oder durch eine physikalische Einwirkung, z. B. UV-Bestrahlung, ausgelöst wird.
Die Formose-Reaktion ist zwar recht einfach zu realisieren, weist aber einige Probleme auf:
Die typische “zuckerhaltige Substanz”, die als “Formose” bezeichnet wird, besteht aus Dutzenden von geradkettigen und verzweigten Monosacchariden, mehrwertigen Alkoholen und Polyhydroxycarbonsäuren (Delidovich et al. 2014).
Die für die Nukleinsäuren benötigten zwei Zuckerspezies, Ribose und Desoxyribose, entstehen nur in Ausbeuten von etwa 1 % oder weniger. Es ist noch unklar, wie auf der Urerde diese beiden Zuckerarten von den anderen getrennt werden konnten. Des Weiteren ist Ribose durch Instabilität gekennzeichnet (vgl. Shapiro 1984, 1988, Larralde et al. 1995, 1996).
Der zeitliche Ablauf (Kinetik) und die Zusammensetzung der Produkte der Formose-Reaktion sind zudem äußerst empfindlich gegenüber den Versuchsbedingungen.
Schlecht optimierte Bedingungen können zu einer vernachlässigbaren Ausbeute an Monosacchariden führen. Um die Ausbeute an Kohlenhydraten zu erhöhen, wird die Formose-Reaktion traditionell in einer sauerstofffreien Atmosphäre durchgeführt, um die oxidative Zerstörung der Monosaccharide durch Sauerstoff in Gegenwart eines basischen Katalysators auszuschließen. Weiterhin ist die Formose-Reaktion auch abhängig von der Temperatur.
So konnten Weiss & John (1974) einen abrupten Anstieg des Formaldehydumsatzes von 8 auf 93 % durch die Erhöhung der Reaktortemperatur um 5 Grad zeigen.
Bei extrem hohen Temperaturen (>200 °C) dauert die vollständige Umwandlung von Formaldehyd weniger als eine Minute, und die Bildung von Zuckern findet sogar in einem leicht sauren Medium statt (Kopetzki & Antonietti 2011). Diese Besonderheiten sind offensichtlich ein Hinweis auf die bedeutenden Unterschiede im Gesamtmechanismus des Prozesses, wenn man von klassischen Bedingungen zu extremen hydrothermalen Bedingungen übergeht.
Der springende Punkt bei der Formose-Reaktion ist die erste C-C-Verknüpfung.
Formaldehyd kann nicht unkatalysiert mit sich selbst reagieren. In einer reinen, alkalischen Formalinlösung läuft normalerweise nur die Cannizzaro-Reaktion ab, die Methanol und Ameisensäure liefert (Abb. 12). Kohlenhydrate würden sich so nicht bilden. Es sind jedoch mehrere effiziente Ansätze zur Unterdrückung der Cannizzaro-Reaktion bekannt.
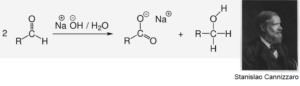
Abb. 12: Die Cannizzaro-Reaktion ist eine Namensreaktion aus der Organischen Chemie. Sie wurde nach ihrem Entdecker dem italienischen Chemiker Stanislao Cannizzaro benannt. Bei der Reaktion disproportionieren Aldehyde in Gegenwart von starken Basen wie konzentrierter Natronlauge. Als Oxidationsprodukt entsteht das Salz einer Carbonsäure, als Reduktionsprodukt der Alkohol.
Wird eine alkalische Formalinlösung mit einer kleinen Menge einer α-Hydroxycarbonylverbindung, wie zum Beispiel Glycolaldehyd angeimpft, schaukelt sich innerhalb kurzer Zeit ein autokatalytischer Prozess hoch, der die Reaktion in eine ganz andere Richtung lenkt. Durch eine Aldoladdition entsteht aus Glycolaldehyd Glycerinaldehyd, welcher über die Verschiebung der Carbonylgruppe in Dihydroxyaceton überführt wird. Diese Verschiebung der Carbonylgruppe ist ganz wesentlich für den weiteren Aufbau der Kohlenstoffkette, denn dadurch wird das Reaktivitätsmuster umgepolt und weitere Kettenverlängerung stattfinden können.
Die niederen Zucker Glycolaldehyd und Glycerinaldehyd können ihrerseits C5- oder C6-Zucker bilden, die die chemisch stabilsten Endprodukte der Formose-Reaktion sind.
Die Herausforderung der Formose-Reaktion besteht zum einen in ihrer Komplexität, der Vielfalt der Katalysatoren, Zwischenprodukte und Versuchsbedingungen, zum anderen in der unterschiedlichen Ausbeute und Stabilität der entstandenen Zuckermoleküle.
Doch seit den ersten Arbeiten von Alexander Butlerow haben Wissenschaftler viele Fortschritte zum Verständnis der Formose-Reaktion und der synthetischen Chemie der Kohlenhydrate erzieht (siehe hierzu Delidovich et al. 2014). Uns soll hier aber nur die Erkenntnisse in Bezug zu präbiotischen Fragestellungen interessieren.
Synthese von Kohlenhydraten unter präbiotischen Bedingungen
Die Formose-Reaktion oder zumindest einige ihrer Hauptstadien werden als plausible Möglichkeit für die Bildung biologisch wichtiger Zucker unter präbiotischen Bedingungen angesehen. Gleichzeitig ließ eine sehr komplizierte Zusammensetzung des Formoseprodukts berechtigte Zweifel an der Plausibilität der Annahme aufkommen, dass die Formose-Reaktion ein Vorläufer der ersten lebenswichtigen Monosaccharide (in erster Linie Ribose und Glucose) auf der präbiotischen Erde war (Lambert et al. 2004). Jüngste Entdeckungen über die Möglichkeit, einige Produkte der Formose-Reaktion auch unter stark alkalischen Bedingungen zu stabilisieren, bestärken jedoch die Plausibilität ihrer Rolle unter präbiotischen Bedingungen.
Setzt man bei präbiotischen Bedingungen als katalytisch wirksame Oberflächen Tone wie z. B. Kaolin ein, um aus Formaldehyd-Lösungen einfache Zucker zu gewinnen, konnte man den Zucker Ribose als Reaktionsprodukt finden (Gabel & Ponnamperuma 1967; Reid & Orgel, 1967).
Mit Hilfe der Massenspektrometrie haben Lambert et al. (2004) gezeigt, dass Monosaccharide, wenn sie in der Furanose-Konfiguration vorliegen, Komplexe mit Silikat-Ionen bilden (Abb. 13). Als Furanose bezeichnet man den Fünferring aus vier Kohlenstoff- und einem Sauerstoff-Atom in bestimmten Monosacchariden. Solch eine Verbindung kann auch die Ribose eingehen. Ein Komplex ist eine Struktur, bei der ein Zentralatom das in seiner Elektronenkonfiguration Lücken aufweist, von einem oder mehreren Molekülen oder Ionen (den Liganden) umgeben ist, die jeweils mindestens ein freies Elektronenpaar für die Bindung zur Verfügung stellen. Dabei umschließen die Liganden das Zentralatom. Solche Komplexe spielen in der Biologie durchaus eine sehr wichtige Rolle, denn Chlorophyll und das Hämoglobin enthalten ebenfalls solche Komplexverbindungen um ein Metallion. Lamberts Arbeitsgruppe konnte zeigen, dass Ribose in ihrer Furanose-Form einen signifikanten Anteil mit Silikatkomplexen bildet.
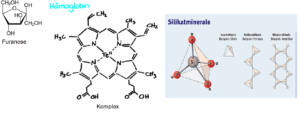
Abb. 13: Darstellung einer Furanose, eines Komplexes (Beispiel Hämoglobin) und Silikatmineralen
Quantenchemische Simulationen der Stabilität von Silikat-Komplexen ergaben dabei die höchste thermodynamische Stabilität des Komplexes, der zwei Ribose-Moleküle und ein Silikation enthält (Vazquez-Mayagoitia et al. 2011, Abb. 14). Formaldehyd und Monosaccharide mit zwei oder drei Kohlenstoffatomen sind nicht in der Lage, die stabilen Silikatkomplexe zu bilden, sondern werden in Gegenwart von Silikaten in einem stark alkalischen Medium zu Monosacchariden mit 4 bis 6 Kohlenstoffatomen umgewandelt. Die Reaktionsprodukte sind stabil und werden mindestens mehrere Stunden lang nicht abgebaut (Lambert et al. 2010).
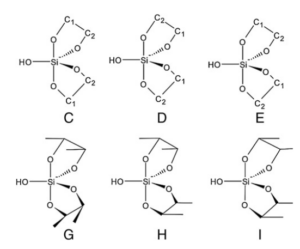
Abb. 14: Silikat-Komplexe
Eine Stabilisierung der Ribose bei der Formose-Bildung gelang durch die Zugabe von Magnesiumhydroxid (Mg(OH)2), welche den pH-Wert erniedrigten. Die Umsetzung der Reaktion verlief jedoch langsamer. Gibt man jedoch Blei-Ionen (Pb2+) als Katalysatoren hinzu, verlief die Reaktion wieder schneller (Zubay 1998). Hinweise auf dieses Schwermetall stammten von Wolfgang Langenbeck, die er in den 1950er Jahren publiziert hatte (Langenbeck 1954). Blei-Ionen kommen in einer Reihe von Mineralen vor, wie z. B. in Galenit (PbS), Cerussit (PbCO3), Stolzit (PbWO4) und Anglesit (PbSO4; Abb. 15).

Abb. 15: Galenit (PbS), Cerussit (PbCO3), Stolzit (PbWO4) und Anglesit (PbSO4)
Eine weitere Stabilität der Ribose ist durch Borat-Mineralien möglich (Benner 2004, Kim et al. 2011, Benner et al. 2012, Abb. 16). Borate sind Salze der Borsäuren H3BO3. Diese Salze sind dadurch gekennzeichnet, dass sie in ihrem Ionengitter als Anion das Borat-Ion BO33− bzw. eine kondensierte Form davon (z. B. B4O5(OH)42−, Tetraborat) enthalten.
Eine Forschergruppe führte die Ribosesynthese aus Glykolaldehyd und Glycerin-aldehyd mit verschiedenen Boratminerale wie Kernit (Na2[B4O6(OH)2] · 3 H2O), Ulexit (NaCa[B5O6(OH)6] · 5 H2O) und Colemanit (Ca[B3O(OH)3] · H2O1) durch und konnten auch nach zwei Monaten Ribose nachweisen, die durch die Bindung an Borsäure stabilisiert wurde (Ricardo et al. 2004). Es ist vorstellbar, dass die zuvor aufgeführten Boratminerale durch Verwitterungsprozesse Borsalze freisetzen konnten, die dann ihre Stabilisierungseffekte auf die Ribose ausübten.

Abb. 16: Boratminerale
Eine weitere Forschergruppe (Colón-Santos, Cooper & Cronin 2019, Abb. 17) zeigte, dass unter Beteiligung von Mineraloberflächen Ribose und Uracil unter viel einfacheren Bedingungen als ursprünglich angenommen entstehen können. Eine Formosereaktion wurde dabei in Gegenwart eines Minerals durchgeführt. Nach jedem Zyklus von 48 Stunden bei 50 °C wird ein Teil des Gesamtvolumens entnommen und das Fläschchen mit frischem Ausgangsmaterial aufgefüllt, um den nächsten Zyklus zu beginnen. Dabei nahm mit zunehmender Anzahl der Zyklen, die bei der Formose-Reaktion entstehenden Produkte ab, sodass sich bestimmte Reaktionsprodukte wie Ribose und Uracil anreichern konnten. Dies ist auf die verbesserte Selektivität der mineralischen Umgebung zurückzuführen.
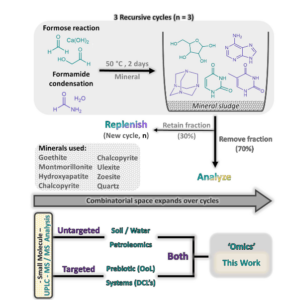
Abb. 17: Versuch von Colón-Santos, Cooper & Cronin (2019). Rekursive Zyklen: Eine Formosereaktion (grün) in Formamid/Wasser (violett) wird in Anwesenheit eines Minerals durchgeführt. Nach jedem Zyklus von 48 bis 50 °C wird ein Teil des Gesamtvolumens (70 %, von oben) entnommen und das Fläschchen mit frischem Ausgangsmaterial aufgefüllt, um den nächsten Zyklus zu beginnen. UPLC-MS/MS-Analyse: Eine ungezielte Analyse, gefolgt von einer gezielten Datenverarbeitung, wurde durchgeführt, um die resultierende Produktverteilung mit einem “Omics”-Ansatz zu untersuchen.
Durch UV-Bestrahlung von Formaldehydlösungen konnten in den 1960ern ebenfalls Ribose und andere Zucker nachgewiesen werden (Ponnamperuma & Mariner 1963). Die Möglichkeit der Initiierung der Formose-Reaktion durch UV-Strahlung wurde bereits in den ersten Studien von Baly (1924) aufgezeigt, der über die Bildung von Monosacchariden in 8 % Ausbeute in wässriger Formaldehyd-Lösung berichtete, die in Gegenwart von Calciumkarbonat-Katalysatoren bestrahlt wurde.
Dies ermöglichte z. B. die Synthese von Erythrulose (Abb. 11) und 3-Pentulose aus reinem Formaldehyd, obwohl die Ausbeute der Produkte nicht hoch war (Simonov et al. 2007, Delidovich et al. 2011).
Die kritische Phase dieses Syntheseverfahrens ist die Bildung von Glycolaldehyd aus zwei Molekülen Formaldehyd unter der Einwirkung von UV-Strahlung (Snytikova et al. 2006, Pestunova et al. 2005). Darüber hinaus nimmt Glycolaldehyd an der Aldol-Reaktion mit dem Hauptsubstrat Formaldehyd teil, um höhere Monosaccharide zu erzeugen.
Die UV-Bestrahlung von Formaldehydlösungen in Gegenwart von Natrium- und Kaliumcarbonaten führt zur überwiegenden Bildung von mehrwertigen Alkoholen mit nennenswerten Ausbeuten. Shigemasa et al. (1977) berichteten, dass in konzentrierten wässrigen Formaldehydlösungen während der “photochemischen Formosereaktion” die mehrwertigen Alkohole Pentaerythrit und 2-Hydroxymethylglycerin in einer Ausbeute von ca. 12 bzw. 5 Mol-% entstehen. Schwartz & de Graaf (1993) gewannen Pentaerythrit in einer Ausbeute von bis zu 28 % in Gegenwart von Kaliumkarbonat durch UV-Bestrahlung einer verdünnten Formaldehydlösung und anschließende Inkubation des Reaktionsgemisches im Dunkeln.
Generell ist die photochemische Umwandlung von Formaldehyd von großer Bedeutung für Studien zur abiotischen chemischen Evolution, die wahrscheinlich entweder im Weltraum oder unter den Bedingungen der präbiotischen Erde stattfand. Die nachgewiesene Möglichkeit, die Synthese komplexer biologisch relevanter organischer Verbindungen durch UV-Strahlung aus dem einfachsten Substrat zu initiieren, was im Weltraum leicht nachzuweisen ist (Hollis et al. 2000, 2004), erleichtert die Entwicklung von Szenarien für die präbiotische chemische Evolution.
Die wohl exotischste Studie über die Formose-Reaktion und ihre Beziehung zur präbiotischen Chemie wurde von Gardner et al. (2009, Abb. 18) durchgeführt. In dieser Arbeit wurde die Calciumhydroxid (Ca(OH)2)-katalysierte Synthese von Monosacchariden aus Formaldehyd in einem Phospholipid (1,2-di-O-phytanoyl-sn-glycero-3-O-phosphocolin) Vesikelreaktor mit einem Durchmesser von 160-200 nm eingeschlossen. Es wurde festgestellt, dass der Einschluss der Formose-Reaktion in das mikroskopische vesikuläre Reaktionskompartiment die Prozesskinetik und die Produkte erheblich abwandelt. Insbesondere produzierte die in den Vesikeln eingekapselte Formose-Reaktion Pentosen in einer 65 %igen Ausbeute, die viermal höher ist als die Menge der unter herkömmlichen Bedingungen gebildeten C5-Monosaccharide. Darüber hinaus stellt das von Gardner et al. beschriebene Formosesystem in den Vesikeln als lipidgebundener Protometabolismus, der komplexe Kohlenhydrate aus einem einfachen Ausgangsmaterial synthetisiert, ein faszinierendes Beispiel für eine künstliche Zelle dar.
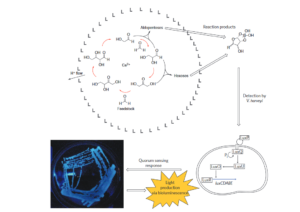
Abb. 18: Das Konzept der chemischen Zelle nach Gardner et al. (2009). Die Komponenten der autokatalytischen Formosereaktion sind in einem Lipidvesikel (L) eingekapselt (oben). Der erhöhte pH-Wert außerhalb des Vesikels löst die Produktion von Kohlenhydraten aus. Es bilden sich Kohlenhydrat-Borat-Komplexe (oben rechts), die durch das Medium diffundieren und mit dem Bakterium Vibrio harveyi interagieren (unten rechts). Die erfolgreiche Bindung an die LuxP/LuxQ-Signaltransduktionsproteine des Bakteriums V. harveyi führt zu einer Proteinphosphorylierungsreaktion und der anschließenden Expression des Gens luxCDABE (Pi, anorganisches Phosphat). Die produzierten Proteine führen zu einer nachweisbaren biolumineszenten Produktion (unten links, Foto einer Agarplatte von V. harveyi, die mit Formose stimuliert wurde). Auf diese Weise ermöglichen die Produkte des protozellulären Stoffwechsels einer chemischen Zelle eine Signalisierung an die Zellen eines natürlichen Organismus.
Präbiotische Synthese von Lipiden
Allgemeines über Lipide
Lipide sind chemisch heterogene Substanzen, die sich schlecht in Wasser (Hydrophobie), aber gut in unpolaren Lösungsmitteln (Lipophilie) lösen. In lebenden Organismen werden Lipide hauptsächlich als Strukturkomponente in Zellmembranen, als Energiespeicher oder als Signalmoleküle gebraucht.
Die meisten biologischen Lipide sind amphiphil, besitzen also einen hydrophoben Kohlenwasserstoff-Rest und eine polare hydrophile Kopfgruppe. Dies erlaubt ihnen, in polaren Lösungsmitteln wie Wasser je nach Beschaffenheit entweder Mizellen (kugelförmige Aggregate, die sich spontan zusammenlagern) oder Doppellipidschichten bilden – wobei immer der hydrophile Teil mit dem polaren Lösungsmittel interagiert. Aus diesen Doppellipidschichten sind alle Biomembranen aufgebaut, welche den Inhalt einer Zelle gegen die Umgebung abgrenzt und somit membranbildende Lipide zu einer der Grundvoraussetzungen allen Lebens macht (Abb. 19). Ein Beispiel hierfür sind die Phospholipide. Phospholipide haben eine Phosphatgruppe und bilden den Hauptbestandteil von Biomembranen.
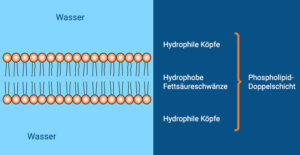
Abb. 19: Grundaufbau der Phospholipide und der Biomembranen
Eine andere Gruppe bekannter Lipide sind die Triglyceride, die die hauptsächlichen Bestandteile unserer Nahrung sind (Abb. 20). Triglyceride bestehen aus dem dreiwertigen Alkohol Gylcerin und drei Fettsäuren. Fettsäuren bestehen meist aus unverzweigten Kette aus Kohlenstoffatomen, an deren einem Ende sich eine Carboxylgruppe befindet.
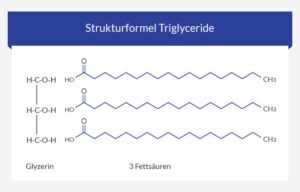
Abb. 20: Grundaufbau der Triglyceride
Unterschieden wird zwischen gesättigten Fettsäuren, in denen keine Doppelbindungen vorkommen, und ungesättigten Fettsäuren, die eine oder mehrere Doppelbindungen besitzen (Abb. 21). Die einfachste gesättigte Fettsäure ist die Buttersäure und enthält nur vier Kohlenstoffatome. Ein wichtiger Vertreter der ungesättigten Fettsäuren ist z. B. die Ölsäure. Je mehr Doppelbindungen Fettsäuren enthalten, desto niedriger liegt ihr Schmelzpunkt, sind also bei Raumtemperatur eher flüssig, z. B. bei Ölen.
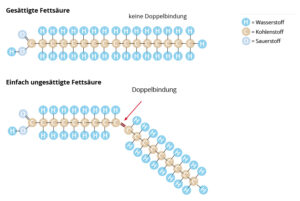
Abb. 21: Unterschiede zwischen gesättigten und ungesättigten Fettsäuren
Eine weitere Gruppe der Lipide sind die Wachse (Abb. 22), die anders als die Triglyceride anstelle des Glycerins andere Alkohole als Grundstruktur haben (z. B. Myricylalkohol).
Erwähnenswert sind als weitere Gruppe der Lipide die Isoprenoide (Abb. 23) zu denen z. B. Carotionoide und Steroide, wie das Cholesterin zählen.
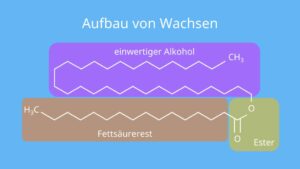
Abb. 22: Aufbau von Wachsen
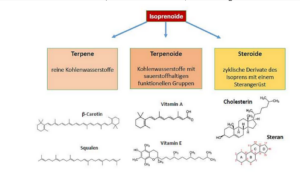
Abb. 23: Isoprenoide
Präbiotische Synthese von Lipiden
Lipide älter als die Entstehung des Lebens auf der Erde. Mehrere potenzielle präbiotische Reaktionen könnten zu lipidähnlichen amphiphilen Molekülen führen, z. B. zu langkettigen Kohlenwasserstoffen und ihren Derivaten, unter Verwendung von Energie aus Vulkanen und hydrothermalen Schloten, Photochemie oder pyrithaltiger Reduktion (Segre et al. 2001, Hargreaves et al. 1977).
Lipide mit amphiphilen Eigenschaften wurden schon in Meteroriten entdeckt und im Labor unter einer großen Bandbreite von Randbedingungen erhalten – etwa durch UV-Bestrahlung interstellarer Eispartikel oder durch hydrothermale Prozesse, mit denen die Bedingungen der Urerde nachgestellt wurden (Hanczyc et al. 2003).
Eine Arbeitsgruppe (Hazen & Deamer 2007) konnte zeigen, dass unter hydrothermalen Bedingungen aus Pyruvat Verbindungen entstehen, von denen einige amphiphilen Charakter haben und die Bildung von Vesikeln aus unpolaren Verbindungen fördern. Schon Follmann (1981) hat vielfältige Synthesemöglichkeiten von Membrangrundbausteinen referiert. So können z. B. Paraffine, aber auch ungesättigte Kohlenwasserstoffe sowie längerkettige Alkohole in Reaktionen vom Typ der Fischer-Tropsch-Synthese aus CO und H2 unter präbiotischen, hydrothermalen Bedingungen gebildet worden sein (vgl. u. a. Rushdi & Simoneit 2001, Holm & Charlou 2001, Klein & Pilpel 1973, Deamer 1985, Deamer & Pashley 1989, Mccollom et al. 1999 Dworkin et al. 2001, , Simoneit 2004, Meierhenrich et al. 2010, Hargreaves et al. 1977, Segre et al. 2001).
Die Fischer-Tropsch-Synthese (Abb. 24) ist ein großtechnisches Verfahren zur Herstellung von Kohlenwasserstoffen aus Synthesegas, einem Gemisch aus Kohlenstoffmonoxid und Wasserstoff. In Analogie zu den Fischer-Tropsch-Prozessen beginnt die Biosynthese einer Fettsäure aus natürlichen Kohlenstoffquellen wie CO2 (Abb. 25).
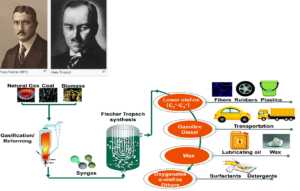
Abb. 24: Fischer-Tropsch-Synthese
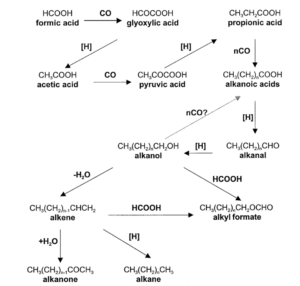
Abb. 25: Die möglichen Reaktionsschritte, die zur Bildung von Lipidverbindungen in Reaktionen vom Typ der Fischer-Tropsch-Synthese aus CO und H2 führen Rushdi & Simoneit (2001).
Phosphatreiche Seen könnten sich bevorzugt auf der präbiotischen Erde gebildet haben, da die Kohlensäureverwitterung in CO2-reichen Atmosphären und die mikrobielle Phosphatkonzentration fehlten (Toner & Catling 2019). Glyceraldehyd, Dihydroxyaceton und Glycerin sind zusammen mit ihren Phosphatderivaten die plausibelsten chemischen Vorläufer von Phospholipiden. Mehrere Studien haben Formamid oder Formaldehyd als zwei der einfachsten und plausibelsten Ausgangsstoffe für Glycerin und Phospholipide vorgeschlagen (Patel et al. 2015, Bizzarri et al. 2021). Eine breite Palette von plausiblen präbiotischen Bedingungen durch Kondensation von Acylketten, Glycerinrückgrat und anorganischen Phosphaten in Gegenwart von Kondensationsmitteln wie Cyanamid, Natriumdicyanamid oder Harnstoff ergibt Phospholipide (Fiore et al. 2022).
Glycerinphosphat wurde ebenfalls als Phospholipidvorläufer verwendet, und seine Bildung erfolgte unter ähnlichen Bedingungen nach chemischer Aktivierung, in Analogie zu biologischen Prozessen, die durch Coenzyme und ATP als Energiequellen angetrieben werden (Gözen, 2021).
Aus systemchemischer Sicht deuten diese wenigen Analogien darauf hin, dass sich die Eigenschaften von Phospholipiden unter abiotischen Bedingungen aus unbelebten Gemischen entwickelt haben (Dalai & Sahai, 2019; Gözen, 2021).
Zusammenfassung
Wie man es auch dreht und wendet, es bedarf keiner göttlichen Intervention, um die Grundbausteine des Lebens herzustellen.
Fast alle biologisch wichtigen Aminosäuren, Lipide, Nukleinbasen und Zucker konnten bis heute in den Ursuppenexperimenten der Folgegenerationen nachgewiesen werden, ja selbst die Bildung hoch komplexer, biologisch wichtiger Verbindungen wie Porphyrine wurde vermeldet (Hodgson 1968). Es scheint vollkommen gleich zu sein, auf welche Ausgangsstoffe man zurückgreift – Hauptsache ist, dass das Gemisch Kohlenstoff, Wasserstoff und Stickstoff enthält und eine Energiequelle vorhanden ist, die die chemischen Bindungen neu „ordnet“. Die Aussage, es bedürfe dazu eines speziellen „Know-hows“, muss als widerlegt gelten.
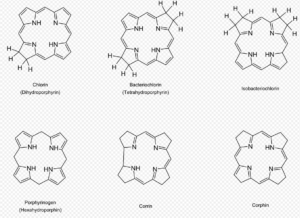
Abb. 26: Porphyrine
Dass ein weiter Bereich von Randbedingungen nach den Gesetzen der Physik und Chemie zur Entstehung der Grundbausteine des Lebens führt, ist ein wichtiger Mosaikstein im Rahmen der evolutionären Argumentation. Daher ist es eigentlich müßig, wenn heute immer noch betont wird, dass bestimmte Nukleinbase nur mit „sehr geringer Ausbeute“, jene Aminosäure „zu viel“ usw. nachgewiesen“ wurden. Das bisher nicht alle Fragen restlos beantwortet werden konnten liegt in der Natur der Sache: bis heute ist ja auch nur ein winziger Bruchteil der möglichen Reaktionswege erforscht worden!
Literatur
Baly, E. C. C. (1924): Photosynthesis. Ind. Eng. Chem. 16, 1016–1018
Benner, S. A. (2004): Understanding Nucleic Acids Using Synthetic Chemistry Acc. Chem. Res. 37, 784–797
Benner, A. et al. (2012): Asphalt, Water, and the Prebiotic Synthesis of Ribose, Ribonucleosides, and RNA Acc. Chem. Res. 2012, 45, 2025–2034.
Bizzarri, B. M. et al. (2021): Prebiotic organic chemistry of formamide and the origin of life in planetary conditions: what we know and what is the future. Int J Mol Sci 22:917.
Breslow, R. (1959): On the Mechanism of the Formose Reaction. Tetrahedron Letters, Bd. 1, Nr. 21: 22–26 (doi:10.1016/S0040-4039(01)99487-0).
Butlerow, A. (1861): Bildung einer zuckerartigen Substanz durch Synthese. In: Friedrich Wöhler, Justus Liebig, Hermann Kopp (Hrsg.): Justus Liebigs Annalen der Chemie. Band 120, Nr. 3. C. F. Winter’sche Verlagshandlung, Januar 1861, ISSN 1099-0690, S. 295–298, doi:10.1002/jlac.18611200308
Calvin, M., Ponnamperuma, C., Lemon, R.M. et al. (1963): Formation of adenine by electron irradiation of methane, ammonia and water. PNAS 49, 737–740.
Colon-Santos, S., Cooper, G, J. T., Cronin, L. (2019): Taming the Combinatorial Explosion of the Formose Reaction via Recursion within Mineral Environments. ChemSystemsChemVolume 1, Issue 3 https://chemistry-europe.onlinelibrary.wiley.com/doi/epdf/10.1002/syst.201900014
Dalai, P., Sahai, N. (2019): Mineral–lipid interactions in the origins of life. Trends Biochem Sci 44:331–341.
Deamer, D. W. (1985): Boundary structures are formed by organic components of the Murchison carbonaceous chondrite. Nature 317:792–794.
Deamer, D. W., Pashley, R.M. (1989): Amphiphilic components of the murchison carbonaceous chondrite: surface properties and membrane formation. Orig Life Evol Biosph 19:21–38.
Delidovich, I. V. et al. (2011): Photoinduced catalytic synthesis of biologically important metabolites from formaldehyde and ammonia under plausible “prebiotic” conditions . Adv. Space Res. 48, 441–449.
Delidovich, I. V. et al. (2014): Catalytic formation of monosaccharides: from the formose reaction towards selective synthesis. ChemSusChem, 7(7), 1833-1846. https://doi.org/10.1002/cssc.201400040
Dworkin, J. P. et al. (2001): Self-assembling amphiphilic molecules: synthesis in simulated interstellar/precometary ices. Proc Natl Acad Sci U S A 98:815–819.
Eschenmoser, A. (2007): The search for the chemistry of life’s origin. ITetrahedron 63: 12821–12844 (doi:10.1016/j.tet.2007.10.012).
Ferus, M. et al. (2017): Formation of nucleobases in a Miller–Urey reducing atmosphere. PNAS 114 (17) 4306-4311
Fiore, M. et al. (2022):Synthesis of Phospholipids Under Plausible Prebiotic Conditions and Analogies with Phospholipid Biochemistry for Origin of Life Studies. Astrobiology 22:5, 598-627
Follmann, H. (1981): Chemie und Biochemie der Evolution. Wie und Wo entstand das Leben? Heidelberg.
Gabel, N. W., Ponnamperuma, C. (1967): Model for origin of monosaccharides. Nature 216:453
Gardner, P. M. et al. (2009): Sugar synthesis in a protocellular model leads to a cell signalling response in bacteria Nat. Chem. 1, 377–383.
Gözen, I. (2021): Did solid surfaces enable the origin of life? Life 11:795.
Hanczyk M.M. et al. (2003): Experimental models of primitive cellular compartments: encapsulation, growth, and division. Science 302, 618–622.
Hargreaves, W.R., Mulvihill, S.J., Deamer, D.W. (1977): Synthesis of phospholipids and membranes in prebiotic conditions. Nature 266, 78–80
Hazen, R.M., Deamer, D.W. (2007): Hydrothermal reactions of pyruvic acid: synthesis, selection, and self-assembly of amphiphilic molecules. Origins o Life and Evolution of the Biosphere 37, 143–152.
Hodgson, G. W. et al. (1968): Prebiotic porphyrin genesis: porphyrins from electric discharge in methane, ammonia and water vapor. PNAS 59, 22–28.
Hollis, J. M. et al. (2000): Interstellar Glycolaldehyde: The First Sugar Astrophys. J. 540, L107–L110;
Hollis, J. M. et al. (2004): Green Bank Telescope Observations of Interstellar Glycolaldehyde: Low-Temperature Sugar Astrophys. J. 613, L45–L48.
Holm, N. G., Charlou, J. L. (2001): Initial indications of abiotic formation of hydro-carbons in the rainbow ultramafic hydrothermal system, mid-atlantic ridge. Earth and Planetary Science Letters 191, 1–8.
Kaiser, P.M. (2009) Die chemische Evolution: Hat es sie gegeben und wenn ja, wie sah sie aus? In: Neukamm, M. (Hrsg.) Evolution im Fadenkreuz des Kreationismus. Göttingen, 171-211. www.evolution-im-fadenkreuz.info/KapVII.pdf
Kim, H.-J. et al. (2011): Synthesis of Carbohydrates in Mineral-Guided Prebiotic Cycles J. Am. Chem. Soc. 133, 9457–9468
Klein, A. E., Pilpel, N. (1973): Oxidation of n-alkanes photosensitized by 1-naphthol. J Chem Soc Faraday Trans 1 69:1729.
Kopetzki, D., Antonietti, M. (2011): Hydrothermal formose reaction . New J. Chem. 35, 1787–1794.
Lambert, J. B. et al. (2004):Silicate Complexes of Sugars in Aqueous Solution J. Am. Chem. Soc. 126, 9611–9626.
Lambert, J. B. et al. (2010): The Silicate-Mediated FormoseReaction: Bottom-Up Synthesisof Sugar Silicates Science 2010, 327, 984–986.
Langenbeck, W. (1954): Neue Untersuchungen über die Formaldehydkondensation. Angew Chem 66:151
Larralde, R., Robertson M. P., Miller, S. L. (1995): Rates of decomposition of ribose and other sugars: implications for chemical evolution.. Proc Natl Acad Sci USA 92:8158
Larralde, R., Robertson M. P., Miller, S. L. (1996): Kinetics of the decomposition of ribose and other sugars: Implications for chemical evolution. Orig Life Evol Biosphere 26:355
Mccollom, T. M., Ritter, G., Simoneit, B. R. T. (1999): Lipid synthesis under hydrothermal conditions by Fischer-Tropsch-type reactions. Orig Life Evol Biosph 29:153–166.
Meierhenrich, U. J. et al. (2010): On the origin of primitive cells: from nutrient intake to elongation of encapsulated nucleotides. Angew Chem Int Ed Engl 49:3738–3750.
Miyakawa, S. et al. (2000): Abiotic synthesis of guanine with high-temperature plasma. Origin of Life and Evolution of the Biosphere 30, 557–566
Miller, S. L. (1953): A Production of Amino Acids Under Possible Primitive Earth Conditions. Science 117:528
Nelson, K.E., Robertson, M.P., Levy, M., Miller, S.L. (2001): Concentration by evaporation and the prebiotic synthesis of cytosine. Origins of Life and Evolution of the Biosphere 31, 221–229.
Oró, J. (1960): Synthesis of adenine from ammonium cyanide Biophys Biochem Res Commun 2:407
Oró, J. (1961): Mechanism of Synthesis of Adenine from Hydrogen Cyanide under Possible Primitive Earth Conditions. Nature volume 191, pages 1193–1194
Patel, B. H., et al. (2015): Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism. Nat Chem 7:301–307.
Pestunova,O. et al. (2005): Putative mechanism of the sugar formation on prebiotic Earth initiated by UV-radiation Adv. Space Res. 36, 214–219.
Ponnamperuma, C., Mariner, R. (1963): Formation of ribose and desoxyribose by ultraviolet irradiation of formaldehyde in water. Radiation Research 19, 183.
Ponnamperuma, C., Young, R.S., Munoz, E. (1963): The formation of guanine during the thermal polymerization of amino acids. Federation Proceedings 22, 479.
Powner, M.W., Gerland, B., Sutherland, J.D. (2009): Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions. Nature 459, 239–242.
Pullman, B. (1972): Electronic Factors in biochemical evolution. In: Ponnamperuna, C. (ed): Exobiology. North Holland Publishing Company, Amsterdam London,
Reid, C., Orgel, L. E. (1967): Model for origin of monosaccharides: synthesis of sugars in potentially prebiotic conditions. Nature 216:216
Ricardo, A., Carrigan, M. A., Olcott, A. N., Benner, S. A. (2004): Borate minerals stabilize ribose. Science 9; 303(5655):196. doi: 10.1126/science.1092464. PMID: 14716004.
Robertson, M. P., Miller, S. L. (1995): An efficient prebiotic synthesis of cytosine and uracil. Nature 375:772
Robertson, M. P., Levy, M., Miller, S. L. (1996): Prebiotic synthesis of diaminopyrimidine and thiocytosine. J Mol Evol 43:543
Rushdi, A. I., Simoneit, B. R. T. (2001): Lipid formation by aqueous Fischer-Tropsch-type synthesis over a temperature range of 100 to 400 °C. Origins of Life and Evolution of the Biosphere 31, 103–118.
Rushdi, A. I., Simoneit, B. R. T. (2006): Abiotic condensation synthesis of glyceride lipids and wax esters under simulated hydrothermal conditions. Orig Life Evol Biosph 36:93–108.
Sanchez, R. A., Ferris, J. P., Orgel, L. E. (1966): Conditions for Purine Synthesis: Did Prebiotic Synthesis Occur at Low Temperatures? Science 153:72
Sanchez, R. A., Ferris, J. P., Orgel, L. E. (1968): Studies in prebiotic synthesis. IV. Conversion of 4-aminoimidazole-5-carbonitrile derivatives to purines. J Mol Biol 38:121
Schwartz, A. W., de Graaf, R. M. (1993): The prebiotic synthesis of carbohydrates: A reassessment J. Mol. Evol. 36, 101–106.
Schwartz, A. W., Goverde, M. (1982): Acceleration of HCN oligomerization by formaldehyde and related compounds: Implications for prebiotic syntheses. J Mol Evol 18:351
Senanayake, S.D., Idriss, H. (2006): Photocatalysis and the origin of life: Synthesis of nucleoside bases from formamide on TiO2(001) single surfaces. PNAS 103, 1194–1198.
Segre, D., Ben-Eli, D., Deamer, D.W., Lancet, D. (2001): The lipid world. Orig. Life Evol. Biosph. 31, 119–145.
Simoneit, B. R. T. (2004): Prebiotic organic synthesis under hydrothermal conditions: an overview. Adv Space Res 33:88–94.
Simonov, A. N. et al. (2007): Possible prebiotic synthesis of monosaccharides from formaldehyde in presence of phosphates .Adv. Space Res. 40, 1634–1640.
Shapiro, R. (1986): Origins. Summi books, New York
Shapiro, R. (1984): The Improbability of Prebiotic Nucleic Acid Synthesis, Origins Life Evol. Biosphere 14, 565–70.
Shapiro, R. (1988): Prebiotic ribose synthesis: A critical analysis Orig Life Evol Biosphere 18:71
Shigemasa, Y. et al. (1977): Formose Reactions. II. The Photochemical Formose Reaction Bull. Chem. Soc. Jpn. 50, 222–226.
Snytnikova, O. A. et al. (2006): Study of the photoinduced formose reaction by flash and stationary photolysis . Mendeleev Commun. 16, 9–11.
Toner, J. D., Catling, D. C. (2019): Alkaline lake settings for concentrated prebiotic cyanide and the origin of life. Geochim Cosmochim Acta 260:124–132.
Vázquez-Mayagoitia, A. et al. (2011): On the Stabilization of Ribose by Silicate Minerals Astrobiology 11, 115–121.
Voet, A. B., Schwartz, A. W. (1983): Prebiotic adenine synthesis from HCN—Evidence for a newly discovered major pathway. Bioinorganic Chem 12:8
Weiss, A. H., John, T. (1974): Homogeneously catalyzed formaldehyde condensation to carbohydrates: III. Concentration instabilities, nature of the catalyst, and mechanisms. J. Catal. 32, 216–229.
Zubay, G. (1998): Prebiotic Synthesis of Nucleotides Orig Life Evol Biosphere 28:13