Im letzten Beitrag befassten wir uns mit den ersten wissenschaftlichen Vorstellungen zur Entstehung des Lebens. Gelehrte wie Wöhler konnten 1828 nachweisen, dass organische Moleküle wie Harnstoff synthetisch hergestellt werden können. Durch diese und andere Experimente konnten vitalistische Vorstellungen, also das belebte Materie irgendeine geheimnisvolle Lebenskraft habe, zunehmend widerlegt werden. Pasteur widerlegte den langen Streit um die Urzeugung. Er konnte durch sorgfältige Versuche zeigen, dass aus unbelebter Materie unter heutigen Bedingungen keine komplexen Lebensformen entstehen können. Die Betonung liegt aber auf den heutigen Bedingungen, in einer sauerstoffreichen Atmosphäre, und einem Planeten, auf dem schon Leben existiert. In unseren Beiträgen zur Entstehung des Universums und der Erde haben wir aber zeigen können, dass vor der Entstehung des Lebens andere Bedingungen herrschten (z. B. das Fehlen von atmosphärischem Sauerstoff). Diese anderen Bedingungen zu untersuchen und plausible Szenarien zur Entstehung des Lebens zu postulieren – damit befasst sich die Abiogenese. Weil der Fossilbericht aus dieser Zeit relativ spärlich ist – man fand Spuren von einzelligem Leben, welches auf ca. 3,5 – 3,8 Mrd. Jahren datiert wird – müssen wir einen experimentellen Ansatz wählen, bei dem wir die Beschränkungen nutzen, die uns durch unser Wissen über die Erdgeschichte und die Natur der organischen Chemie auferlegt werden, um mögliche Lösungen zu finden.
Damit Leben überhaupt existieren kann, müssen als erster Schritt die Grundbausteine entstehen, aus dem alle Lebewesen aufgebaut sind: Aminosäuren, Kohlenhydrate, Lipide und Nukleinsäuren. Ob das möglich ist und was bisher erreicht wurde, erfahrt ihr in diesem Beitrag am Beispiel der Aminosäuren.
Text als pdf
Aminosäuren – Bausteine des Lebens
Aminosäuren sind die Bausteine aus denen sich Proteine bilden. Proteine erfüllen eine wichtige Funktion bei Lebewesen. Faserproteine dienen der Struktur, Enzyme spalten Nährstoffe, Muskelproteine sorgen für die Bewegung, Antikörper dem Schutz usw. Die Unterschiede zwischen den Proteinen liegen an der Anordnung der Aminosäuren. 20 verschiedene Aminosäuren werden in unterschiedlicher Anzahl und Kombination für den Aufbau unserer Proteine verwendet. Insgesamt sind aber tatsächlich über 250 verschiedene Aminosäuren bekannt. Trotz ihrer Vielfalt haben alle Aminosäuren allgemeine Eigenschaften, die durch ihre funktionellen Gruppen beschrieben werden. Wie ist der Grundaufbau einer Aminosäure? Schauen wir uns dazu Abb. 1 an:
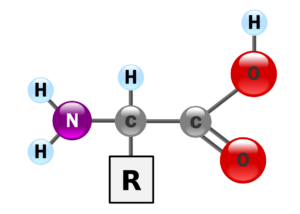
Abb. 1: Grundaufbau einer Aminosäure
Wir sehen in der Mitte ein Kohlenstoffatom (Abkürzung C), es ist das zentrale Kohlenstoffatom. An diesem befinden sich 4 Bindungsmöglichkeiten. Am oberen Ende ist eine Verbindung mit dem Wasserstoff. Auf der linken Seite findet sich die Aminogruppe, die aus einem Stickstoffatom und zwei Wasserstoffatomen besteht. Rechts befindet sich die Carboxylgruppe. Eine Carboxylgruppe ist ein Kohlenstoffatom, dass eine Doppelbindung mit einem Sauerstoff eingeht und eine weitere Verbindung mit einer Alkoholgruppe (Sauerstoff + Wasserstoff). Die Aminogruppe und die Carboxylgruppe sind die zwei funktionellen Gruppen einer jeden Aminosäure. Die vierte Bindung des zentralen Kohlenstoffatoms wird hier mit R abgekürzt. Sie steht für Rest bzw. Seitenkette. Diese ist bei verschiedenen Aminosäuren unterschiedlich aufgebaut. Die einfachste Aminosäure ist Glycin, bei der die Seitenkette ein weiteres Wasserstoffatom ist. Andere Aminosäuren sind komplexer aufgebaut, wie z. B. Phenylalanin oder Tryptophan. Die Zusammensetzung der Seitenkette bestimmt weitere Eigenschaften der einzelnen Aminosäuren, so z. B. ob sie eher hydrophob, sauer, basisch oder neutral reagieren (Abb.2). Ist es möglich, dass solch eine komplexe und vielfältige Stoffgruppe auf natürliche Wiese entstehen konnte?
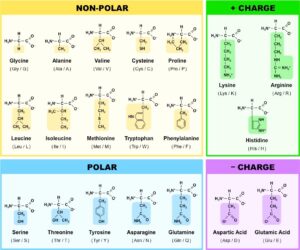
Abb. 2: die 20 Aminosäuren
Millers Ursuppen-Experiment
Schon Darwin spekulierte, dass in einem “warmen kleinen Teich” (gewöhnlich als “Ursuppe” bezeichnet) mit der richtigen Kombination chemischer Verbindungen und den richtigen Energiequellen Proteine entstehen könnten. Doch die organische Chemie steckte damals noch in den Kinderschuhen, so dass man dieser Vermutung kaum nachgehen konnte.
In den 1920er Jahren entdeckten der sowjetische Biochemiker A. I. Oparin und der britische Genetiker J. B. S. Haldane unabhängig voneinander, dass die Erde mit einer Atmosphäre aus Stickstoff, CO2, Ammoniak (NH3) und Methan (CH4) die ideale Ursuppe für die Herstellung einfacher organischen Verbindungen war.
Der wichtigste Durchbruch gelang 1953, als ein junger Doktorand an der Universität von Chicago namens Stanley Miller von seinem Berater, dem Chemienobelpreisträger Harold Urey, von Oparins Hypothese erfuhr. Sie beschlossen, ein Experiment nach den Vorschlägen von Oparin und Haldane durchzuführen, um herauszufinden, ob eine solche Ursuppe grundlegende biochemische Stoffe erzeugen könnte. Miller baute eine einfache Apparatur aus versiegelten Röhren, die eine kontinuierliche Schleife bildeten, wobei die gesamte Luft durch ein Vakuum entfernt wurde. Eine Atmosphäre, die reich an CO2, Stickstoff, Methan, Ammoniak und Wasser (aber nicht an freiem Sauerstoff) war, wurde in die evakuierten Röhren gegeben. Unter dem mit Wasser gefüllten Kolben brachte Miller eine Wärmequelle an, um den Dampf zirkulieren zu lassen, und in einem anderen Kolben verwendete er Elektroden, die Funken erzeugten, um einen Blitz als Energiequelle zu simulieren. Unterhalb der Blitz-Kammer brachte ein Kondensator die Gase wieder in den flüssigen Zustand, von wo aus sie zurück in den mit Wasser gefüllten Kolben zirkulierten (Abb. 3).
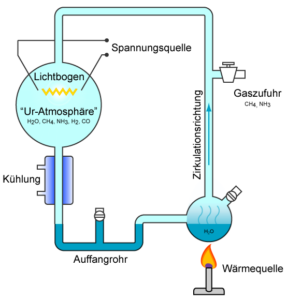
Abb. 3: Miller Experiment
Dieses Experiment führte zu den erstaunlichsten Ergebnissen. Innerhalb weniger Tage färbte sich der mit Wasser gefüllte Kolben mit neuen Chemikalien braun, und innerhalb einer Woche entstand ein organisch angereicherter Schleim. In diesem simulierten Urozean entstand eine Anzahl organischer Verbindungen, darunter einige von biochemischer Bedeutung. – Dieser Erfolg wurde in der wissenschaftlichen Zeitschrift „Science“ unter dem Titel „A Production of Amino Acids Under Possible Primitive Earth Conditions“ veröffentlicht (Miller 1953). Interessante „Hintergrundinformationen“ zur zuvor genannten Veröffentlichung erfährt der Leser bei Bada & Lazcano (2003), sowie bei Kaiser (2009) und Rauchfuß (2005).
Als Hauptsyntheseprodukte entstanden u. a. Ameisensäure, Glycin, Milchsäure und Alanin. Glycin und Alanin sind die am einfachsten gebauten Aminosäuren, die auch in unseren Proteinen vorkommen. In geringerer Ausbeute wurde auch die Aminosäure Glutaminsäure entdeckt. Andere organische Moleküle wie Blausäure (Cyanwasserstoff, HCN) und Formaldehyd (H2CO) entstanden ebenfalls (Abb. 4).
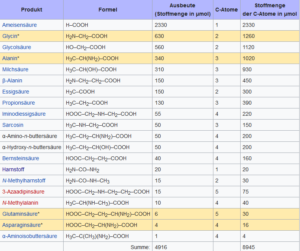
Abb. 4: Entstandene Produkte des Miller-Urey-Experiments
Bald nach Millers Publikation erhob sich die Frage nach dem möglichen Reaktionsmechanismus, der den Synthesen zugrunde lag. Kinetische Untersuchungen mit den reduzierenden Gasmischungen zeigten, dass im Laufe der Umsetzungen die Konzentration an Ammoniak fällt, wogegen sich die Blausäure (HCN)-Konzentration deutlich erhöht und dann nahezu konstant bleibt. Die Aminosäurekonzentration steigt etwa gleichmäßig mit der Reaktionsdauer, die Aldehydkonzentration bleibt konstant.
Glycin und die anderen Aminosäuren dürften über die seit 150 Jahren bekannte Streckersche Cyanhydrin-Synthese aus Aldehyd, Blausäure und Ammoniak mit nachfolgender Hydrolyse gebildet worden sein (Strecker 1850, 1854; Miller 1955; Abb. 5).
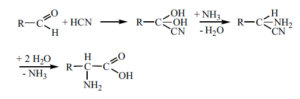
Abb. 5: Strecker-Synthese
„Mit einem bemerkenswerten Experiment brachte Miller die Forschung über die Ursprünge des Lebens in Schwung. Angetrieben von der Energie der Natur konnten aus einfachen Gasgemischen Moleküle von biologischer Relevanz und Komplexität entstehen.“ (Knoll 2003:74)
Mit diesen Experimenten gelang erstmals der Nachweis, dass die Frage nach dem Ursprung des Lebens ein wissenschaftliches Problem ist, das mit naturwissenschaftlichen Methoden bearbeitet und (möglicherweise) gelöst werden kann. Von diesem Zeitpunkt an begannen mehrere Institute in aller Welt mit präbiotischen, chemischen Experimenten. Die inzwischen berühmt gewordene Synthese-Apparatur war von Miller und auch anderen Arbeitsgruppen modifiziert und verbessert worden, um die Produktausbeuten zu steigern.
Dabei wurden nicht etwa exotische oder besonders kompliziert gebaute Ausgangsstoffe eingesetzt oder mehrstufige Synthesen mit dazwischen geschalteten Reinigungsschritten durchgeführt. Vielmehr wurden die Randbedingungen meist nach spezifisch irdischen Bedingungen ausgewählt: Als Ausgangsstoffe wurden meist einfache Atmosphärengase (N2, CO2, H2O) verwendet, Gase, die aus Vulkanen oder hydrothermalen Schloten austreten (wie CO, NH3, CH4, H2S) oder einfache Produkte, die aus der Reaktion dieser Gase hervorgehen, wie Formaldehyd, Harnstoff, Blausäure, Formamid oder Cyanoacetylen. Typisch irdischen Randbedingungen entsprechen ferner Beimengungen von Schwermetallen, Phosphorverbindungen, Ton, Sand und anderen Mineralien, die im Meer vorkommen, sowie UV-Strahlung, Radioaktivität, Hitze, elektrische Entladungen oder Hochtemperaturplasma, mit dem sich vulkanische Bedingungen simulieren lassen.
Interessanterweise meldeten fast alle Experimentatoren Erfolge, kaum einer zog eine Niete. Manche bedienten sich des Kohlenmonoxids anstelle des Methans, andere setzten CO2 und elementaren Stickstoff ein. Wieder andere verwendeten Methanol und Isooctan (Franck 1959) oder ließen radioaktive Strahlung auf verdünnte Blausäurelösungen einwirken (Sweeney et al. 1976).
Abelson (1956) führte Experimente mit Atmosphären von CO2, (CO), N2, (NH3), H2 und H2O durch und fand geringe Mengen einfach aufgebauter Aminosäuren. Bei Sauerstoffzusatz zu den Gasmischungen bildeten sich jedoch keine Aminosäuren.
In den 1970er Jahren wiederholte Miller mit Hilfe seiner Mitarbeiter das Experiment und konnte genauere Ergebnisse durch bessere analytische Methoden erzielen. In Rückstellproben aus den Miller-Urey-Experimenten fand man nicht weniger als 22 Aminosäuren, darunter die drei in Proteinen vorkommenden Aminosäuren Serin, Valin und Phenylalanin, außerdem wichtige Naturstoffe wie Harnstoff, Ornithin und 3-Hydroxyasparagin (Johnson et al. 2008). Diese Rückstellproben galten ursprünglich als fehlgeschlagenes Experiment, da nur geringe Konzentrationen an Aminosäuren produziert wurden und daher in Millers bahnbrechender Science-Studie von 1953 nicht erwähnt wurden. Aber Miller hatte keinen Zugang zur Hochleistungsflüssigkeitschromatographie, mit der Chemiker Proben mit einer früher undenkbaren Präzision aufschlüsseln und klassifizieren können. Als man die nicht berücksichtigten Proben erneut analysierte, fanden sie die eben erwähnten organischen Substanzen.
Falsche Zusammensetzung der Uratmosphäre?
Entwicklung der Atmosphäre
Eine entscheidende Frage war aber, ob Millers Annahme der Zusammensetzung der Uratmosphäre richtig war. Während seine experimentellen befunde niemand anzweifelte, gab es doch verschiedene Auffassungen über die chemische Zusammensetzung der Uratmosphäre, besonders im Hinblick für die Synthese der Aminosäuren wichtigen gase Ammoniak und Methan. Einig sind sich aber alle, dass die Atmosphäre frei von Sauerstoff war. Ich habe schon einen Beitrag zum Klima und der Atmosphäre der frühen Erde schon gemacht (Kubi 2022). Dennoch ist es sinnvoll das Wichtigste hier nochmal zu erwähnen, weil dies für die Bildung von Aminosäuren unter präbiotischen Bedingungen entscheidend ist.
Unsere heutige Atmosphäre besteht zu 78% aus Stickstoff und zu 21% aus Sauerstoff (Abb. 6). Man spricht aufgrund des hohen Gehalts an Sauerstoff von einer oxidierend wirkenden Atmosphäre, die über kurz oder lang Stahl zum Rosten bringt und organische Substanzen chemisch angreift. Doch sie ist auch stets eine lebensspendende Atmosphäre, ohne die gegenwärtig kein komplexeres Leben möglich wäre.
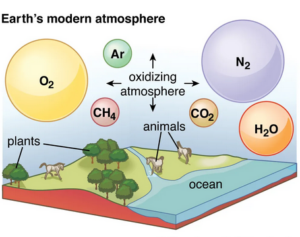
Abb. 6: Zusammensetzung der heutigen Atmosphäre
Der aggressive Sauerstoff verhindert aber jede spontane Neu-Entstehung von Leben und wirkt fast ebenso stark oxidierend wie elementares Chlor. Selbst niedrige Chlorkonzentrationen in der Atemluft führen zu schweren Lungen- und Hautverätzungen und nach kurzer Zeit zum Tode. Besonders die freien Radikale des Sauerstoffs, die bei der Zellatmung entstehen können, zeigen ein solch „aggressives“ Verhalten (Abb. 7). Freie Radikale sind Moleküle, die ein ungepaartes Elektron aufweisen und dadurch äußerst reaktionsfreudig sind. Aufgrund des ungepaarten Elektrons zeigen freie Radikale eine starke Tendenz dazu, ein weiteres Elektron von einem potenziellen Reaktionspartner zu „stehlen“, um eine höhere chemische Stabilität zu erreichen. Zurück bleibt häufig wiederum ein Molekül, das nun seinerseits zu einem freien Radikal geworden ist. Der Vorgang kann sich wiederholen und möglicherweise wird sogar eine Kettenreaktion in Gang gesetzt. Solche Reaktionskaskaden können Stoffwechselvorgänge empfindlich stören. Nur einem ausgeklügelten Enzymsystem im Stoffwechsel eines jeden Lebewesens ist es zu verdanken, dass wir nicht binnen kurzer Zeit durch Luftsauerstoff getötet werden.
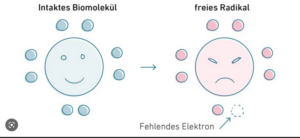
Abb. 7: freies Radikal
Die Zusammensetzung der Atmosphäre der jungen Erde war jedoch eine andere als die heutige. Erst vor gut 350 Millionen Jahren war ein chemisches Gleichgewicht erreicht, das bis heute recht stabil geblieben ist – von kleinen Schwankungen abgesehen, z. B. war die Sauerstoffkonzentration mit über 30% im Karbon höher als heute und auch der CO2-Gehalt der Atmosphäre schwankte, war aber stets in geringen Konzentrationen. Diese Zusammensetzung wissen wir anhand von Gaseinschlüssen in uralten Gesteinsschichten.
Im Gegensatz zu einer oxidierenden Atmosphäre, steht eine reduzierende Atmosphäre. Dies ist ein Zustand in dem die Oxidation durch Entfernung von Sauerstoff und anderen oxidierenden Gasen verhindert wird und der aktiv reduzierende Gase wie Wasserstoff, Kohlenmonoxid und Gase wie Schwefelwasserstoff, Ammoniak und Methan enthalten kann.
Miller und Urey gingen genau von solch einer Atmosphärenzusammensetzung aus. Da Wasserstoff das am häufigsten im Universum vorkommende Element darstellt, nahmen Urey und Miller an, dass bei der Bildung der Erde aus solarer Materie viele Verbindungen in ihrer wasserstoffreichen Form, d. h. reduziert, vorkamen (Miller & Urey 1959, Urey 1959).
Bereits 1966 wurden die Annahmen hinter Millers Ursuppenexperiment von dem amerikanischen Chemiker Philip H. Abelson in Frage gestellt (Abelson 1966). Er legte dar, dass die erste Atmosphäre nicht aus reduzierenden Gasen bestanden haben konnte. Zum einen verflüchtigt sich Wasserstoff schnell in den Weltraum. Andererseits werden Methan und Ammoniak durch Sonneneinstrahlung rasch photochemisch zersetzt und mit Spaltprodukten des Wassers zu den “neutralen Gasen” CO2 und Stickstoff (N2) nebst geringen Mengen von Kohlenmonoxid (CO) oxidiert. Auch die beiden Nachbarplaneten der Erde, Venus und Mars haben sehr hohe Konzentrationen an CO2; zwischen 93-98% Vol.%.
Die hohe Temperatur der frühen Erde bewirkte, dass sich die damals bereits vorhandene Uratmosphäre weitestgehend in den Weltraum verflüchtigte und dabei der Anteil an Wasserstoff, Stickstoff, CO2, Methan, Ammoniak und Edelgasen um mindestens den Faktor 1000 abnahm.
Vor etwa 4,4 Milliarden Jahren hatte sich die Erde soweit abgekühlt, dass sich flüssiges Wasser auf ihr halten konnte. Dies wissen wir aufgrund von ebenso alten Zirkonkristallen in den Jack Hills in Westaustralien, die nicht nur das älteste Krustenmaterial auf der Erde darstellen, sondern die Untersuchung der Sauerstoffisotope belegt zudem das Vorhandensein einer Hydrosphäre und damit Wasser (Valley et al. 2015). Nach der Abkühlung der Erdoberfläche setzte zudem eine Fragmentierung ein, die zu dem typischen Aufbau des Erdinnern führte. Zeitgleich bildeten sich das Weltmeer und die Atmosphäre aus.
Die geringeren Temperaturen und damit Teilchengeschwindigkeiten der Gase verringerten die Diffusion weiterer Gase ins All. Der in der Folgezeit auftretende Vulkanismus führte zu starken Ausgasungen und schuf damit die erste Atmosphäre. Dabei hatte die Gravitationsdifferenzierung der Erde, insbesondere die Bildung eines Eisen-Nickel-Kerns, dramatische Auswirkungen auf die Zusammensetzung dieser Ausgasungen. Die reduzierten Metalle sanken in die Tiefe ab und bildeten den Erdkern. Dabei erhöhte sich der oxidative Charakter der Atmosphäre; Methan und Ammoniak wurden oxidiert. Daher ist nach den neuesten Erkenntnissen anzunehmen, dass die erste Atmosphäre nicht, wie zunächst angenommen, aus Methan und Ammoniak, sondern – nebst Spuren von Methan und Ammoniak – im Wesentlichen aus Wasser, CO2, Stickstoff und Kohlenmonoxid bestand. Heute geht man von dem Gedanken aus, dass die erste Atmosphäre etwa dieselbe Zusammensetzung gehabt hatte, wie die heute noch von Vulkanen ausgestoßenen Gase, so dass ungefähr folgende Zusammensetzung als wahrscheinlich gilt:
80% Wasser und Stickstoff, 10% CO2, 7 % Schwefelwasserstoff, 0,5% Kohlenmonoxid, 0,5% Wasserstoff, sowie Spuren an Methan und Ammoniak. Die Atmosphäre war schwach reduzierend (Abb. 8).
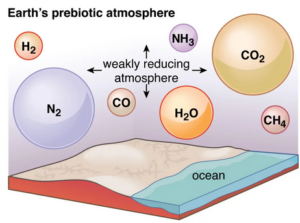
Abb. 8: frühe Atmosphäre
Die Kondensation des Wassers führte zu einer relativen Anreicherung der übrigen Gase. Durch den Einfluss der Sonne, die immer stärker zu strahlen begann, wurden die reduzierenden Gase der ersten Atmosphäre auf den sonnennahen Planeten (Venus und der Erde) in zunehmendem Maße wieder chemisch gespalten. Die verbliebenen Elemente verbanden sich, chemischen Regeln folgend, zu CO2 und Stickstoff. Das CO2 löste sich teils im Meer unter Bildung gewaltiger Carbonatsedimente und wurde teils infolge veränderter vulkanischer Aktivitäten durch ausgasenden Stickstoff und Wasserdampf verdrängt. Es bildete sich daher eine Lufthülle, die im Wesentlichen aus Stickstoff mit Beimengungen von Wasser, CO2 und Argon bestand. Vor etwa 3,4 Milliarden Jahren hatte sich diese sogenannte zweite Atmosphäre vollständig ausgebildet, die nun weder reduzierend, noch oxidierend war. Durch den Löseprozess des Kohlendioxids im Meer verringerte sich überdies auch der Treibhauseffekt, so dass sich die noch immer recht warme Erdatmosphäre weiter abkühlen konnte.
Die Untersuchungen alter Sedimentgesteine deuten darauf hin, dass die Atmosphäre der sehr jungen Erde reich an CO2 und N2 gewesen sein musste (Trail et al. 2011). Auch hier spielen Zirkone eine wichtige Rolle, die zu den ältesten Mineralien gehören, die sich auf der Erde bilden konnten. Zirkone sind Bestandteil von Granit und anderen plutonischen Gesteinen und bilden extrem stabile Kristalle aus Zirkoniumsilicat (Abb. 9), die in abkühlendem Magma auskristallisieren. In das Kristallgitter werden häufig andere Schwermetalle wie Uran, Hafnium und Cer eingebaut, die einerseits sehr präzise radiochemische Datierungen erlauben, andererseits auch Rückschlüsse über den Oxidationsstatus der Magmaschmelzen auf der Urerde gestatten, in der die Zirkone auskristallisierten. Da das Element Cer in zwei verschiedenen Oxidationsstufen vorkommt, könnte das Verhältnis beider Formen etwas über die reduzierenden Bedingungen aussagen, und damit möglicherweise auch etwas über die Zusammensetzung der frühen Atmosphäre. So wäre unter reduzierenden Bedingungen überwiegend die dreiwertige Form (CerIII) zu erwarten. Man findet jedoch Verhältnisse, die Oxidationsbedingungen nahelegen, die weitgehend den heutigen Bedingungen entsprechen. Daraus könnte man schließen, dass die Uratmosphäre überwiegend aus H2O, CO2, N2 und SO2 bestand (vgl. Neukamm 2012).

Abb. 9: Zirkon
An dieser Stelle erlauben wir uns mal einen gewaltigen Sprung: Denn durch die Entstehung des Lebens wandelte sich die Atmosphäre schließlich ein drittes Mal. Aufgrund der Entwicklung der oxygenen Photosynthese durch Cyanobakterien vor etwa 3,5 Milliarden Jahren, wurde nach und nach das CO2 bis auf einen kleinen Rest beseitigt, denn sie “veratmeten” das CO2 unter Bildung von Sauerstoff. Dieser Sauerstoff reicherte sich zunächst im Meerwasser an. Vor etwa 2,5 Milliarden Jahren entstanden somit riesige Eisenoxidablagerungen auf dem Meeresboden. Vor etwa 2 Milliarden Jahren war fast das gesamte Eisen im Meer als Oxid ausgefällt und der Sauerstoff begann in die Atmosphäre auszugasen. Im Laufe der Evolution passten sich die Lebewesen nach und nach an die immer mehr oxidierend wirkende Atmosphäre an, und aerobe Einzeller begannen gar, den Sauerstoff zur effizienten “Nahrungsveratmung” zu nutzen. Mit zunehmender Konzentration des Sauerstoffs in der Atmosphäre wurde dieser vermehrt durch die nach wie vor hohe UV-Einstrahlung der Sonne in atomaren Sauerstoff gespalten. Dieser “aktive” Sauerstoff verband sich mit molekularem, “normalem” Luftsauerstoff zu dreiatomigem Ozon. In rund 15-30 km Höhe bildete sich die stratosphärische Ozonschicht aus, welche für die Evolution des Lebens von entscheidender Bedeutung war (Abb. 10).
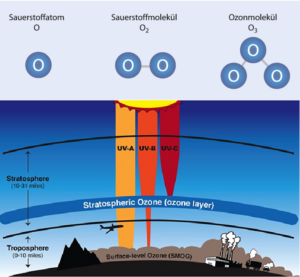
Abb. 10: Ozon & Ozonschicht
Hier sei noch Folgendes erwähnt: Urey hatte angenommen, dass die UV-Strahlung zu einer photolytischen Spaltung des Wasserdampfes geführt habe. Der dabei entstandene Wasserstoff verflüchtigte sich aufgrund seiner geringen Dichte ins Weltall, der Sauerstoff blieb zurück und bildete bereits viel früher eine schwache Ozonschicht aus.
Zwei Wissenschaftler der Universität Texas, Berkner & Marshall (1965), begannen diesen Effekt mithilfe von Computern zu simulieren und fanden heraus, dass sich aufgrund dieses Effekts eine Gleichgewichtskonzentration etwa 0,1% des heutigen Gehalts an Sauerstoff in der Atmosphäre befunden haben musste. Die aus der Spurenkonzentration des Sauerstoffs resultierende Ozonschicht absorbierte UV-Strahlung im Wellenlängenbereich zwischen 260 und 280 Nanometer besonders wirkungsvoll. In diesem Bereich sind Aminosäuren besonders empfindlich gegen UV-Strahlung und werden leicht zersetzt. Die Absorption dieser UV-Strahlung ermöglicht also die Existenz von chemischen Verbindungen wie Aminosäuren und anderen Urstoffen, die zur Bildung von Leben von äußerster Relevanz gewesen waren! Dem Entdecker zu ehren wurde dieses Phänomen künftig als Urey-Effekt benannt.
Experimente mit schwach reduzierten und neutralen Gasen
Millers Experimente gingen von einer falschen Zusammensetzung der Uratmosphäre aus, seine experimentellen Befunde wurden jedoch niemals angezweifelt.
Kreationisten neigen dazu diese Befunde so zu missinterpretierten, dass für die Entstehung des Lebens keine geeigneten Atmosphären-Bedingungen geherrscht haben. Ironischerweise ist hier hervorzuheben, dass Junge-Erde-Kreationisten diese Befunde dafür verwenden, um zu zeigen, dass die Entstehung des Lebens unmöglich sei, ignorieren aber gleichzeitig die Tatsache, dass die Datierung der ältesten Zirkone ein hohes Alter der Erde bekräftigen. Offensichtlich gehen Kreationisten nach folgendem Prinzip: “Nutze die Ergebnisse der Wissenschaft immer dann, wenn du sie brauchen kannst, verwerfe sie aber, wenn sie mit Deiner rigoristischen Bibelauslegung unvereinbar sind”. Dabei vergessen Kreationisten auch zu gerne, dass die Forschung schon längst nicht mehr von Miller Annahmen der Zusammensetzung der Uratmosphäre ausgeht, da nach geochemischem Wissensstand eher eine neutrale Atmosphäre anzunehmen ist (Plankensteiner et al. 2004). Und sie übergehen stillschweigend, dass die Wissenschaft auch nicht auf die Annahme einer reduzierenden Erdatmosphäre angewiesen ist, um die Entstehung der Bausteine des Lebens zu erklären!
Neue Versuchsreihen, mehr als zwei Jahrzehnte nach Millers ersten Ansätzen, mit schwach reduzierenden oder neutralen Gasmischungen wurden geplant und durchgeführt (Schlesinger & Miller, 1983). Verschiedene Gasmischungen mit unterschiedlichen Anteilen aus CH4, H2, N2, NH3, CO2 und CO führten zu unterschiedlichen Aminosäureausbeuten, die von 0,05% bis 4,7% reichten (vgl. Rauchfuß 2005).
Die Ausbeute an Aminosäuren war zwar unter Verwendung „neutraler“ Gase wie CO2 und Stickstoff wesentlich geringer als unter Verwendung von Methan und Ammoniak (Schlesinger & Miller, 1983). Durch Zugabe von reduzierenden Reagenzien wie zweiwertigem Eisen (Fe2+), das nach heutigem Kenntnisstand in den nahezu sauerstofffreien Ozeanen der Urerde reichlich vorhanden war, lässt sich die Ausbeute um ein Viel-Hundertfaches steigern (Cleaves et al. 2008).
Selbst wenn die gesamte Uratmosphäre eine nicht reduzierende Zusammensetzung aufwies, können lokal präbiotische Synthesen unter reduzierenden Bedingungen effektiv abgelaufen sein (Johnson et al. 2008). Reduzierte Gase und elektrische Entladungen treten etwa bei Vulkaneruptionen auf. Ein entsprechendes Szenario bietet die “Eisen-Schwefel-Welt” in der Tiefsee. Die Gase, die den hydrothermalen Quellen (den bis heute existierenden “Schwarzen Rauchern” in der Tiefsee) entsteigen, sind im Gegensatz zur Uratmosphäre schwach bis stark reduzierend, denn es können neben CO2, Stickstoff (N2), Schwefeldioxid (SO2) und Wasser (H2O) in wechselnden Gewichtsanteilen Gase wie Schwefelwasserstoff, Methan, Ammoniak und Wasserstoff vorkommen. Zudem wird durch Reaktion von Stickstoff und Schwefelwasserstoff in einer wässrigen Suspension von Eisensulfid Wasserstoff und Ammoniak zur Verfügung gestellt, das zu den in den Miller-Synthesen nachgewiesenen Reaktionsprodukten reagieren kann (Weigand et al. 2003). Es herrscht also weitgehend Konsens darüber, dass das Leben nicht global, sondern in bestimmten Nischen der Urerde entstanden ist, die passende Bedingungen für deren Entstehung boten.
Weitere Arbeiten zeigen, dass die Aminosäure-Ausbeute (vor allem an
Glycin) in einer CO–N2–H2O-Atmosphäre, die mit hochenergetischen Partikeln (Kobayaski et al. 1998) bestrahlt wurde, bedeutend höher liegt als beim gleichen Ansatz mit Funkenentladungen. Man kann also annehmen, dass die kosmische Strahlung eine wichtige Energiequelle für präbiotische Synthesen auf der Erde darstellte. Aus dem Chemischen Institut der Universität Oldenburg berichtete eine Forschergruppe (Strasdeit et al. 2001) über die Synthese von Zink- und Calciumkomplexen mit den Aminosäuren Valin und Isovalin. Sie nehmen an, dass diese auf der mineralreichen Urerde eine gewisse Bedeutung erlangt haben konnten.
Über die Simulation der Bildung von Glycin und Alanin in einer neutralen Gasmischung aus CO2, N2 und Wasserdampf berichten Plankensteiner et al. (2004). Dem System führte man Energie über elektrische Funkenentladungen zu. Das Reaktionsgefäß war zur Hälfte mit Wasser von 353 K gefüllt. Die Wolfram-Kathode befand sich über, die Kupfer-Anode unter der Wasseroberfläche. Die Zufuhr von CO2 und N2 erfolgte kontinuierlich. Es wurde kein (auch nur schwach) reduzierendes Agens zugesetzt.
Die Aminosäureausbeute nach zwei Wochen Reaktionsdauer war zwar
nicht überragend, aber eindeutig.
Aber Aminosäuren mussten nicht nur in der Gasphase entstanden sein. John Orò, einer der Pioniere der präbiotischen Chemie, führte Aminosäure-Synthesen in flüssiger Phase durch (Oro 1960). Er setzte Blausäure, Ammoniak und Wasser bei 343 K um. Die Arbeiten wurden von Löwe et al. (1963) bestätigt und weitergeführt, aber erst zehn Jahre später erneut von Jim Ferris aufgenommen und intensiv bearbeitet (Ferris et al. 1973, 1974). Bei allen diesen Simulationsversuchen entstehen die einfach aufgebauten Aminosäuren – wie zu erwarten – immer am häufigsten, also Glycin, Alanin und in geringen Mengen Asparaginsäure und alpha-Aminobuttersäure. Die Ausbeuten liegen meist bei etwa 1% für Glycin, die anderen Aminosäuren weit darunter.
Einen ganz anderen Weg wählten Morowitz et al. (1995). Ihnen gelang die Synthese von Glutaminsäure aus alpha-Ketoglutarat, Ammoniak und Ameisensäure in wässrigem Medium ohne die Mithilfe von Enzymen. Die als Reduktionsmittel eingesetzte Ameisensäure entsteht übrigens als ein Hauptprodukt beim Miller-Urey-Experiment.
Zusammenfassung
Die Synthese von Aminosäuren unter präbiotischen Bedingungen ist machbar und wird durch eine Reihe an Experimenten, die verschiedene präbiotische Bedingungen simulieren, bestätigt. Auch wenn die Uratmosphäre nicht (stark) reduzierend war, so bieten doch bestimmte Bereiche auf der Erde sehr wohl reduzierenden Charakter. Daher ist es eigentlich müßig, wenn heute immer noch versucht wird, die Grundannahmen, die Millers historischem Experiment zugrunde lagen, zu erschüttern. Ausschlaggebend für die evolutionäre Argumentation ist nur, dass ein weiter Bereich von (irdischen und kosmischen) Randbedingungen nach den Gesetzen der Physik und Chemie zur Entstehung der Grundbausteine des Lebens führt. Die Entstehung von Biomolekülen unter plausiblen Bedingungen ist möglich. Doch die Synthese von Biomolekülen reduziert sich ja keineswegs auf die Bildung von Aminosäuren. Zu den Biomolekülen zählen bekanntlich auch Kohlenhydrate, Fette und Nukleinsäuren. Mit ihrer Bildung werden wir uns im nächsten Beitrag auseinandersetzen.
Literatur
Abelson, P. H. (1956): Amino Acids Formed in Primitive Atmospheres. Science 124:935
Abelson, P. H. (1966): Chemical Events on the Primitive Earth. PNAS 55, 1365.
Bada, J. L., Lazcano, A. (2003): Prebiotic Soup–Revisiting the Miller Experiment. Science 300:745
Berkner, L. V., Marshall, L. C. (1965): On the Origin and Rise of Oxygen Concentration in the Earth’s Atmosphere. Journal of Atmospheric Sciences, 22(3), 225-261. https://ui.adsabs.harvard.edu/abs/1965JAtS…22..225B/abstract
Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. (2008): A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Origins of Life and Evolution of the Biosphere 38, 105–115.
Ferris, J. P., Donner, D. B., Lobo, A. P. (1973): Possible role of hydrogen cyanide in chemical evolution: Investigation of the proposed direct synthesis of peptides from hydrogen cyanide. J Mol Biol 74:499
Ferris, J. P., Wos, J. D., Nooner, D. W., Oró, J. (1974): Chemical evolution XXI. The amino acids released on hydrolysis f HCN oligomers. J. Mol. Evol. 3: 225–231.
Franck, B. (1959): Synthese von Aminosäuregemischen aus Methanol und alipha-tischen Kohlenwasserstoffen. Chemische Berichte 93, 446–454.
Johnson, A.P., Cleaves, H.J., Dworkin, J.P. et al. (2008): The miller volcanic spark discharge experiment. Science 322, 404.
Kaiser, P.M. (2009) Die chemische Evolution: Hat es sie gegeben und wenn ja, wie sah sie aus? In: Neukamm, M. (Hrsg.) Evolution im Fadenkreuz des Kreationismus. Göttingen, 171-211. www.evolution-im-fadenkreuz.info/KapVII.pdf
Knoll, A. H. (2003): Life on a Young Planet: The First Three Billion Years of Evolution on Earth. Princeton, N.J.: Princeton University Press.
Kobayashi, K., Kaneko, T., Saito, T. et al. (1998): Amino Acid Formation in Gas Mixtures by High Energy Particle Irradiation. Orig Life Evol Biosph 28: 155–165. https://doi.org/10.1023/A:1006561217063
Kubi, M. (2022): Klima und Atmosphäre der jungen Erde https://internet-evoluzzer.de/klima-und-atmosphaere-der-jungen-erde/
Löwe, C. J., Rees, M. W., Markham, R. M. (1963): Synthesis of Complex Organic Compounds from Simple Precursors: Formation of Amino-Acids, Amino-Acid Polymers, Fatty Acids and Purines from Ammonium Cyanide. Nature 199:219
Miller, S. L. (1953): A Production of Amino Acids Under Possible Primitive Earth Conditions. Science 117:528
Miller, S. L. (1955): Production of Some Organic Compounds under Possible Primitive Earth Conditions. J Amer Chem Soc 77:2351
Miller S. L., Urey H. C. (1959): Organic Compound Synthesis on the Primitive Earth: Several questions about the origin of life have been answered, but much remains to be studied. Science 130:245
Morowitz, H., Peterson, E., Chang, S. (1995): The synthesis of glutamic acid in the absence of enzymes: Implications for biogenesis. Origins Life Evol Biosphere 25, 395–399. https://doi.org/10.1007/BF01581777
Neukamm, M. (2012): Die frühe Erdatmosphäre: ungeeignete Bedingungen für die Entstehung des Lebens? Das MILLER-UREY-Experiment – und was der Kreationismus verschweigt https://www.ag-evolutionsbiologie.net/html/2012/miller-urey-experiment.html
Oró, J. (1960): Synthesis of adenine from ammonium cyanide Biophys Biochem Res Commun 2:407
Plankensteiner K., Reiner H., Schranz B., Rode M. B. (2004): Simulation einer präbiotischen Bildung von Aminosäuren in einer neutralen Atmosphäre durch elektrische Funkenentladungen. Angewandte Chemie 116, 1922-1924.
Rauchfuß, H. (2005): Chemische Evolution und der Ursprung des Lebens. Springer, Heidelberg
Schlesinger, G., Miller, S. L. (1983): Prebiotic synthesis in atmospheres containing CH4, CO and CO2. I. Amino acids. Journal of Molecular Evolution 19, 376–382.
Strasdeit H., Büsching I., Behrends S., Saak W., Barklage W. (2001): Syntheses and Properties of Zinc and Calcium Complexes of Valinate and Isovalinate: Metalα-Amino Acidates as Possible Constituents of the Early Earth’s Chemical Inventory. Chemistry: a European Journal. 7: 1133-1142.
Strecker, A. (1850): Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper. Liebigs Ann Chem 75:27
Strecker, A. (1854): Ueber einen neuen aus Aldehyd – Ammoniak und Blausäure entstehenden Körper. Liebigs Ann Chem 91:349
Sweeney, M.A., Toste, A.P., Ponnamperuma, C. (1976): Formation of amino acids by cobalt-60 irradiation of hydrogen cyanide solutions. Origins of Life 7, 187–189.
Trail, D., Watson, E.B., Tailby, N.D. (2011): The oxidation state of Hadean magmas and implications for early earth’s atmosphere. Nature 480, 79-82.
Urey H. C. (1959) In: Flügge S. (Hrsg.) Handbuch der Physik. Springer, Berlin Heidelberg New York, S. 363
Valley, J., Reinhard, D., Cavosie, A., Ushikubo, T., Lawrence, F., Larson, D., Kelly, T., Snoeyenbos, D., Strickland, A. (2015): Presidential Address. Nano-and micro-geochronology in Hadean and Archean zircons by atom-probe tomography and SIMS: New tools for old minerals. American Mineralogist. 100. 10.2138/am-2015-5134.
Weigand, W. et al. (2003) Possible prebiotic formation of ammonia from dinitrogen on iron sulfide surface. Angewandte Chemie 115, 1579.



