Die Vielfalt der Vögel ist gewaltig und deren allergrößte Gruppe stellen die Neoaves dar, die außer den Palaeognathae sowie den Gänse- und Hühnervögeln alle modernen Vögel ausmachen. Die Neoaves können in zehn Großgruppen zusammengefasst werden, von denen wir in den letzten beiden Episoden vier kennengelernt haben: Opisthocomiformes, Eurypygimorphae, Gruiformes und Charadriiformes. Diese Episode stellt zwei weitere kleinere Gruppen vor, bei denen die Verwandtschaftsverhältnisse teilweise für große Überraschungen sorgten: die Mirandornithes und die Otidimorphae.
Text als pdf
Mirandornithes
Synapomorphien der Mirandornithes
Unter den phylogenetischen Verwandtschaftsverhältnissen innerhalb der Neoaves sorgte die Klade der Mirandornithes für eine der größten Überraschungen (Abb. 1). In diese Gruppe fallen zwei Familien, deren nähere Verwandtschaft nicht offensichtlich ist: die Flamingos (Phoenicopteridae) und Lappentaucher (Podicipedidae). In ihrem Erscheinungsbild unterschieden sich die beiden Vogelgruppen wie Tag und Nacht. Tatsächlich wurden die Lappentaucher früher mit den Seetauchern in die Ordnung der Taucher zusammengefasst. Mittlerweile hat sich bestätigt, dass das Erscheinungsbild beider Familien durch konvergente Evolution entstanden ist. Die Seetaucher gehören in die Klade der Aequornithes, einer großen Gruppe von Wasservögeln, zu denen u. a. die Pinguine, Albatrosse und Sturmvögel zählen. Die verwandtschaftliche Einordnung der Flamingos erwies sich als schwieriger.
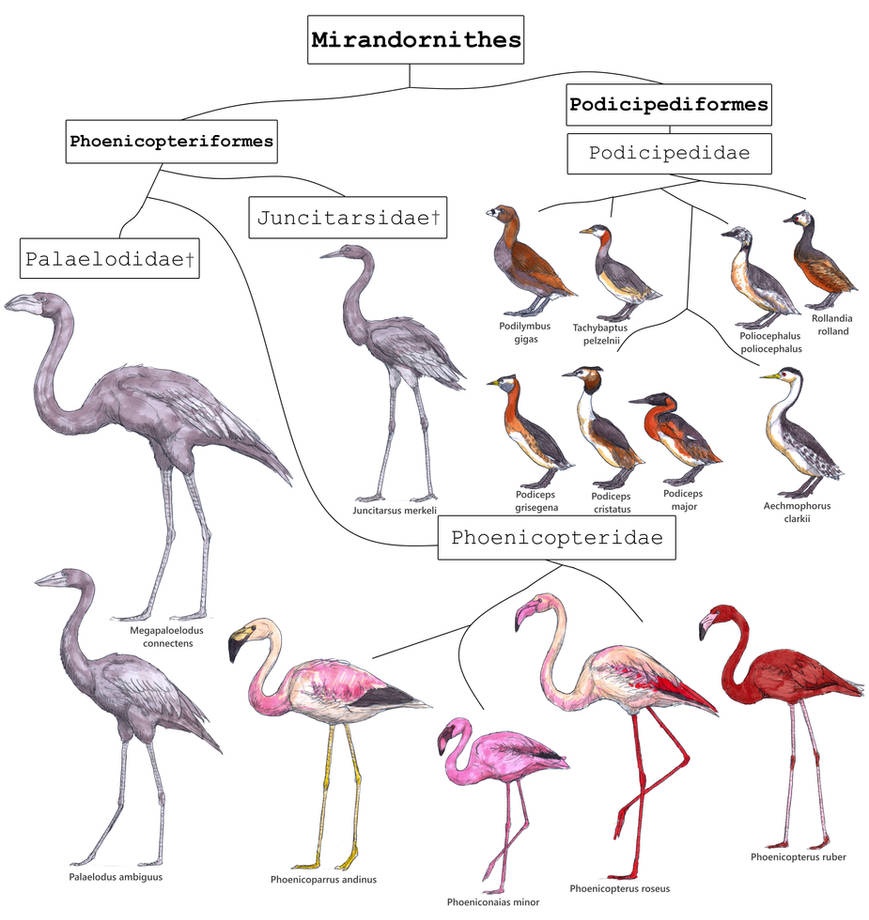
Abb. 1: Mirandornithes
Es war früher üblich, Flamingos den Schreitvögeln, wozu u. a. die Störche gehören, zuzuordnen. Nicht nur das äußere Erscheinungsbild, sondern auch anatomische Details stimmen überein: die Struktur der Dunen junger Flamingos sowie die Beschaffenheit des Beckens und der Rippen weisen starke Parallelen zu den Störchen auf. In der Mitte des 20. Jahrhunderts wurde es gebräuchlicher, Flamingos in die Nähe der Gänsevögel zu stellen. Wie bei diesen sind die Jungen Nestflüchter, die Zehen mit Schwimmhäuten verbunden, und die Federlinge (auf Vögeln parasitierende Kieferläuse) beider Taxa sind eng miteinander verwandt. Eine dritte Hypothese wurde in den 1980ern aufgestellt: Aufgrund von Fossilfunden und mancher ethologischer Parallelen kam man zu dem Schluss, die Flamingos seien mit Austernfischern und Säbelschnäblern verwandt und somit den Regenpfeiferartigen zuzuordnen (Peters 1987, Feduccia 1976). DNA-Hybridisierungen in den 1980ern platzierten die Flamingos zunächst wieder dort, wo sie ganz am Anfang standen: in der Nähe der Schreitvögel, von denen sie sich vor 48 Millionen Jahren getrennt hätten (Sibley & Ahlquist 1983).
Neueste morphologische und genetische Untersuchungen stützen jedoch eine Verwandtschaft mit den Lappentauchern (Sangster 2005, Jarvis et al. 2012, Kuhl et al. 2021, Tuinen et al. 2001, Chub 2004, Mayr 2004, Fain & Houde 2004, Ericson et al. 2006, Hackett et al. 2008, Prum et al. 2015, Reddy et al. 2017, Suh 2016, Braun & Kimball 2021, Houde et al. 2019; Wu et al. 2024, Stiller et al. 2024, Mirarab et al. 2024). Die von beiden Taxa gebildete Klade erhielt den Namen Mirandornithes, was übersetzt „wundervolle Vögel“ bedeutet (Sangster 2005).
Es gibt mindestens 12 verschiedene morphologische Synapomorphien dieser Gruppe (Mayr 2004, Sangster 2005), die teilweise sehr detailreich sind. So sind die Eier der Flamingos und Lappentaucher mit einer kalkhaltigen Schicht aus amorphem Kalziumphosphat bedeckt und die Flügel haben 12 Primärfedern. Weiterhin sind mindestens der vierte bis siebte Halswirbel stark verlängert und der Oberarmknochen hat eine deutlich ovale Vertiefung an der Ansatzstelle des Musculus scapulohumeralis cranialis, einem Muskel des Schultergürtels (Abb. 2). Außerdem sind vier Brustwirbel zu einem sog. Notarium verschmolzen und die linke Arteria carotis, die Halsschlagader, ist reduziert oder fehlend. Diese und weitere Details in den Merkmalen belegen wie feindgliedrig die Untersuchung von Synapomorphien sein muss, um mögliche Konvergenzen auszuschließen.
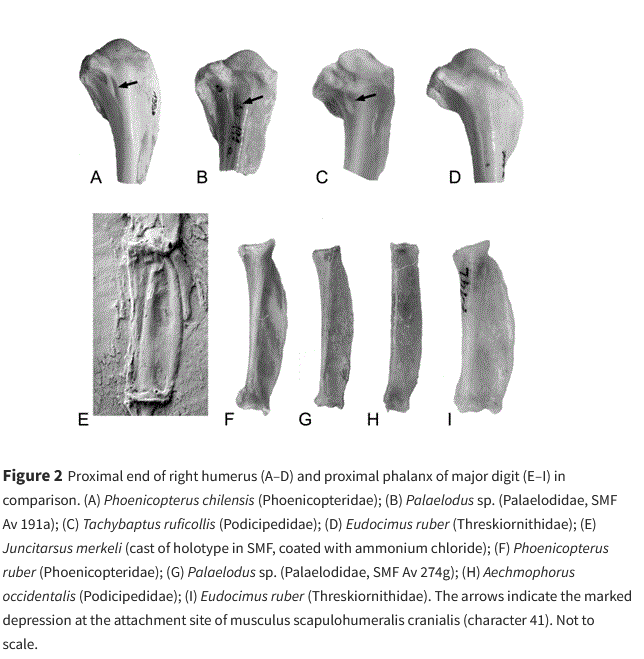
Abb. 2: Synapomorphien der Mirandornithes. Proximales Ende des rechten Humerus (A–D) und proximale Phalanx der Hauptfinger (E–I) im Vergleich. (A) Phoenicopterus chilensis (Phoenicopteridae); (B) Palaelodus sp. (Palaelodidae, SMF Av 191a); (C) Tachybaptus ruficollis (Podicipedidae); (D) Eudocimus ruber (Threskiornithidae); (E) Juncitarsus merkeli (Abguss des Holotyps in SMF, mit Ammoniumchlorid beschichtet); (F) Phoenicopterus ruber (Phoenicopteridae); (G) Palaelodus sp. (Palaelodidae, SMF Av 274g); (H) Aechmophorus occidentalis (Podicipedidae); (I) Eudocimus ruber (Threskiornithidae). Die Pfeile zeigen die markierte Vertiefung an der Ansatzstelle des Musculus scapulohumeralis cranialis.
Fossile Mirandornithes
Ein fossiles Taxon, das für den Ursprung der Mirandornithes von Bedeutung sein könnte, ist Juncitarsus (Juncitarsidae, Abb. 3 und 4), dessen zwei beschriebene Arten in Eozän-Lokalitäten in Wyoming und Deutschland gefunden wurden (Olson & Feduccia 1980, Peters 1987, Mayr 2004, 2009, 2014a, 2016). Juncitarsus war etwa zwei Drittel so groß wie die kleinste heutige Flamingoart. Das Taxon zeichnet sich durch stark verlängerte Hintergliedmaßen aus, die proportional sogar länger sind als die der heutigen Flamingos, aber ansonsten unterscheidet es sich von den Flamingos und Lappentauchern durch einige plesiomorphe Merkmale. Zu diesen Unterschieden gehört das Fehlen einer weitgehenden Verschmelzung der Brustwirbel, eine verhältnismäßig längere Hinterzehe und das Fehlen von nagelartigen Fußklauen (Mayr 2004, 2014). Anders als bei Lappentauchern und Flamingos, hat der lange und gerade Schnabel von Juncitarsus darüber hinaus sehr lange Nasenlöcher. Wie Flamingos besetzte Juncitarsus wahrscheinlich eine ökologische Nische als Watvogel, aber die unterschiedliche Morphologie des Schnabels und die Erhaltung von Gastrolithen in einem Exemplar belegen, dass er sich in seinen Lebensgewohnheiten von Flamingos unterscheidet (Mayr 2014).

Abb. 3: Fossil und Rekonstruktion von Juncitarsus.
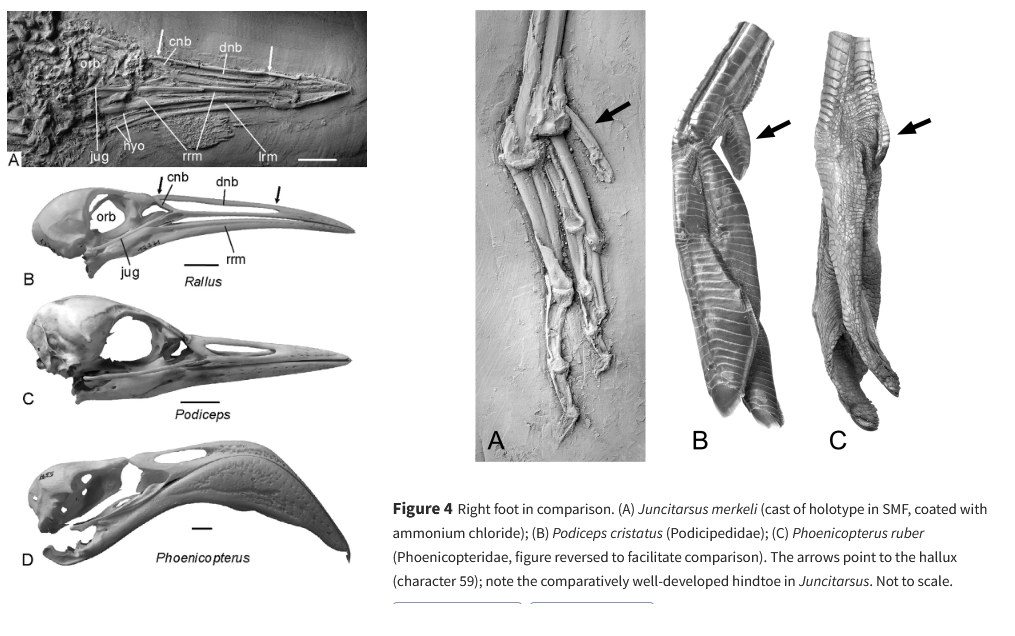
Abb. 4: linke Seite: Schädel von Junictarsus (A) im Vergleich zu einer Ralle (B), einem Rothalstaucher (C) und einem Rosaflamingo (D). rechte Seite: Rechter Fuß im Vergleich. (A) Juncitarsus; (B) Haubentaucher; (C) Rosaflamingo. Die Pfeile zeigen auf den Hallux; man beachte die vergleichsweise gut entwickelte Hinterzehe bei Juncitarsus.
Eine weitere Gruppe, die zwischen Lappentauchern und Flamingos vermittelt sind die Palaelodidae, die spezialisierte Schwimmvögel waren und noch nicht den hochspezialisierten Filtrierapparat der Flamingos entwickelt hatten (Torres & van Tuinen 2016, Abb. 5). Die Morphologie dieser eigentümlichen Stammgruppe der Flamingoartigen deutet darauf hin, dass der unmittelbare Vorfahre der Flamingos und Lappentaucher ein Schwimmvogel war. Die frühesten Nachweise der Palaelodidae sind fragmentarische Fossilien aus dem frühen Oligozän Ägyptens (Rasmussen et al. 1987) und ein großes, aber schlecht repräsentiertes Taxon aus dem frühen Oligozän Belgiens (Adelalopus; Mayr & Smith 2002, Mayr 2009). Spätestens im frühen Miozän hatten die Palaelodidae eine nahezu globale Verbreitung erreicht, und sie sind in europäischen Fundorten sehr zahlreich vertreten (Mlíkovský 2002). Überreste der Gattung Palaelodus, dem bekanntesten Taxon der Palaelodidae, sind auch aus dem Oligozän und Miozän von Brasilien, Australien, Neuseeland und der Mongolei bekannt (Alvarenga 1990; Baird & Vickers-Rich 1998; Worthy et al. 2010; Zelenkov 2013).
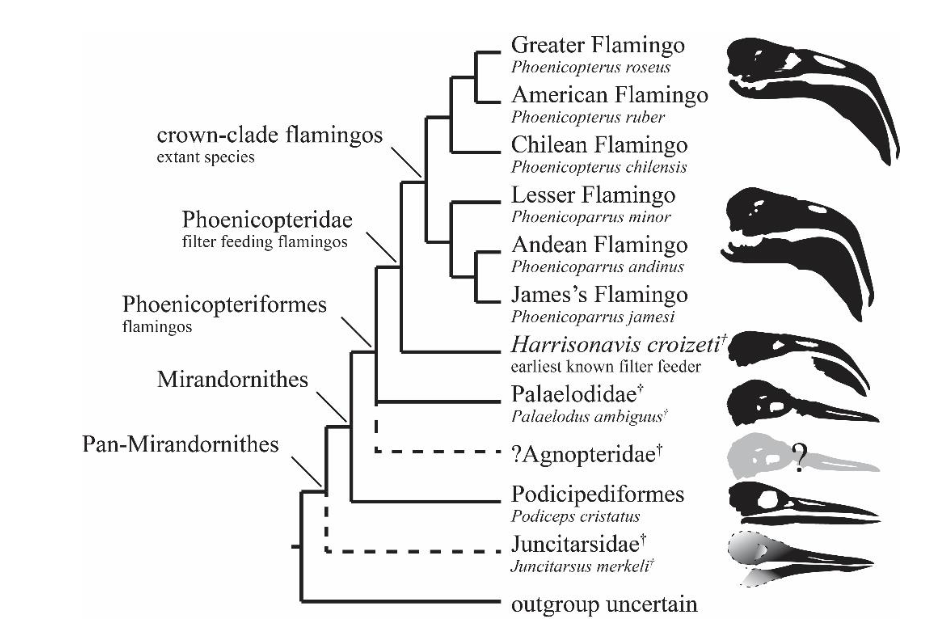
Abb. 5: Kladogramm der Mirandornithes und ihrer Stammgruppen mit dem Schwerpunkt der Evolution des Filterapparates der Flamingos
Insgesamt ist die Skelettmorphologie von Palaelodus derjenigen der Flamingoartigen recht ähnlich, aber die Beine sind nicht so stark verlängert. Der Tarsometatarsus der heutigen Flamingos übertrifft den Oberarmknochen in seiner Länge bei weitem, während er bei Palaelodus viel kürzer ist (Abb. 6). Die Form dieses Knochens sowie weitere Merkmale sprechen für die Annahme, dass diese Gattung aquatisch lebte und die Hinterbeine für die Fortbewegung im Wasser nutzte (Mayr 2015). Der Schnabel von Palaelodus weicht vom hochspezialisierten Schnabel der Flamingos ab: er ist kurz und gerade, mit einer abgerundeten Spitze und langen Nasenlöchern und ähnelt damit dem Schnabel eines Kranichs, mit dem er ursprünglich verwechselt wurde (Cheneval & Escuillié 1992, Torres & van Tuinen 2016, Abb. 5). Auch fehlten Palaelodus die Lamellen im Schnabel, die moderne Flamingos zum Filtrieren der Nahrung nutzen (Mayr 2015). Der Schädel weist Vertiefungen für Salzdrüsen auf, und viele der Sedimente, in denen Palaelodidenreste gefunden wurden, wurden in salinen oder brackigen Paläoumgebungen abgelagert.
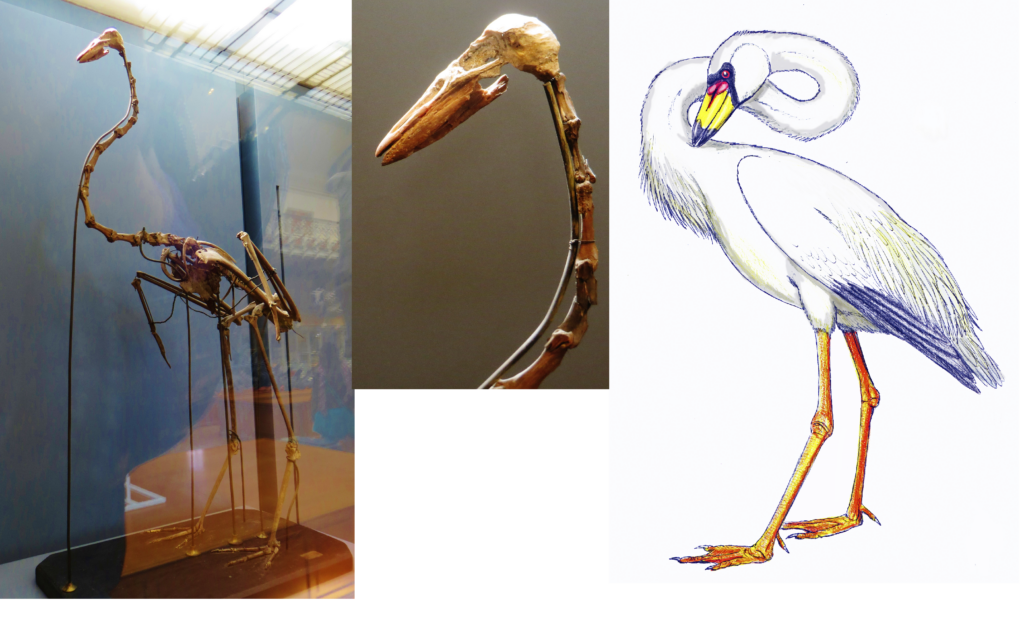
Abb. 6: Skelett und Rekonstruktion von Palaelodus.
Eine weitere Gattung ist Megapaloelodus, der sich in einigen Merkmalen von Palaelodus unterscheidet, wie z. B. der geringeren Anzahl von Brustwirbeln (Mayr 2014, Abb. 7), und kam im Miozän von Namibia, Argentinien und im frühen Miozän bis Pliozän von Nordamerika vor (Mourer-Chauviré 2008; Noriega & Agnolín 2008; Agnolín 2009). Die letzten europäischen Nachweise der Palaelodidae stammen aus dem mittleren Miozän von Deutschland (Mlíkovský 2002), aber in Australien existierte Palaelodus bis ins Pleistozän (Baird & Vickers-Rich 1998).

Abb. 7: Megapaloelodus
Flamingos (Phoenicopteridae)
Heute gibt es sechs Arten von Flamingos, die in Mittel- und Südamerika, Afrika, Südeuropa sowie in einigen Regionen Asiens, vor allem im Iran und Indien leben. Vier Arten leben auf dem amerikanischen Doppelkontinent, zwei in Europa, Asien und Afrika (Winkler et al. 2020a, del Hoyo 2020, del Hoyo et al. 1996, Torres et al. 2014, Jenkin 1957, Abb. 8).

Abb. 8: Flamingos
Flamingos ernähren sich je nach Art von Kleinkrebsen, Mückenlarven, Weichtieren, Ringelwürmern und Cyanobakterien. Ein Kennzeichen der Flamingos ist der nach unten geknickte Seihschnabel, mit dem sie – mit der Oberseite nach unten – Plankton aus dem Wasser oder Schlamm filtrieren (Abb. 9). Die Schnabelränder sind mit feinen Lamellen besetzt, zusammen mit der Zunge bilden sie einen Filterapparat, der eine ähnliche Funktion wie die Barten der Bartenwale erfüllt. Zur Aufnahme von Plankton wird der Schnabel seitlich durch das Wasser geschwenkt und dabei nur halb geöffnet gehalten. Die Zunge fährt beständig vor und zurück, um Wasser in den Schnabel und wieder hinaus zu befördern. Dabei gerät Wasser mit Nahrungspartikeln in den Innenraum des Schnabels (Jenkin 1957). In einer Studie wurde der tägliche Nahrungsbedarf von Kubaflamingos (Phoenicopterus ruber) in Venezuela ermittelt. Diese nehmen täglich 270 Gramm Nahrung zu sich, was 50.000 Insektenlarven entspricht. Eine Gruppe von 1500 Flamingos verzehrt demnach täglich das Äquivalent von 75 Millionen Larven (Casler & Este 2000). Ein Zwergflamingo (Phoeniconaias minor) nimmt im Nakurusee täglich 60 Gramm Cyanobakterien zu sich. Da sich dort regelmäßig Kolonien von einer Million Tieren versammeln, bedeutet dies eine tägliche Ausbeute von 60 Tonnen Cyanobakterien (del Hoyo et al. 2020).
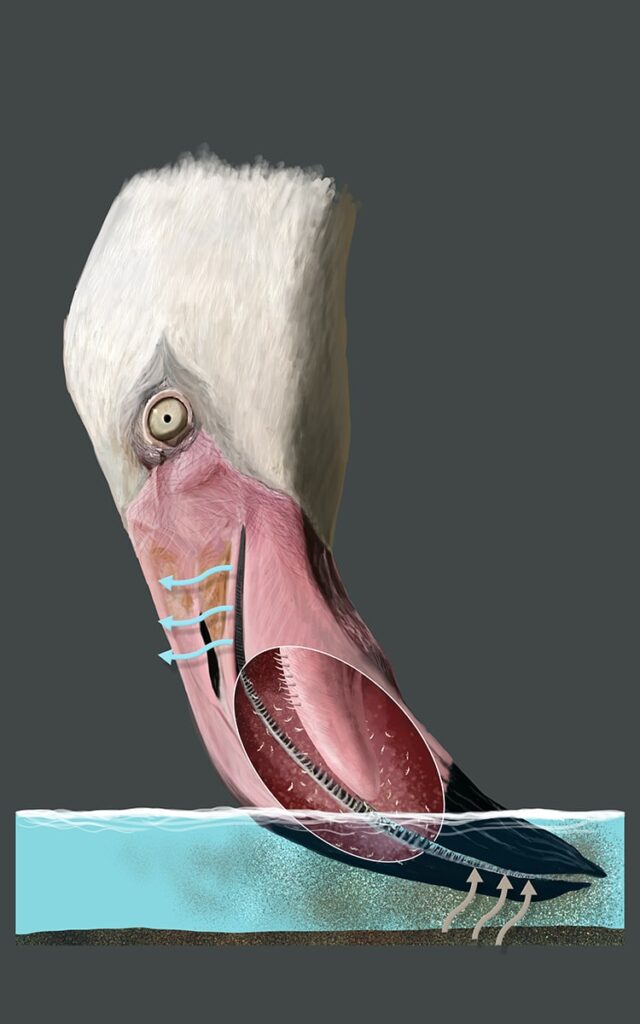
Abb. 9: Flamingoschnabel
Die kleinen Flamingoarten (Zwerg-, Anden- und Jamesflamingo; Phoeniconaias minor, Phoenicoparrus andinus, Phoenicoparrus jamesi) haben einen im Querschnitt dreieckigen Oberschnabel, der lückenlos auf den Unterschnabel passt (Jenkin 1957, Abb. 10). Ihr Schnabel hat äußere Lamellen, die das Passieren zu großer Bestandteile verhindern. Die inneren Lamellen liegen hingegen waagerecht und erfüllen im Moment des Hereinströmens noch keine Funktion. Erst wenn das Wasser hinausgepresst wird, richten sich die inneren Lamellen auf und hindern die Nahrungsbestandteile daran, nach außen zu gelangen. Gaumen und Zunge sind mit kleinen, nach hinten weisenden Stacheln besetzt, die für den Transport der Partikel in Richtung des Verdauungstrakts sorgen.
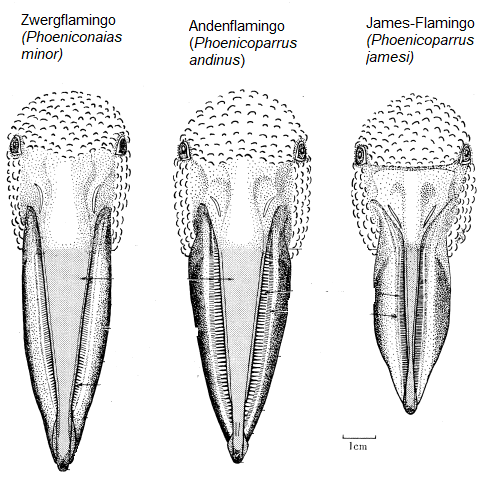
Abb. 10: Schnabel der kleinen Flamingoarten
Die großen Flamingoarten (Kuba-, Rosa- und Chileflamingo) haben einen ovalen Oberschnabel, der nicht genau auf den Unterschnabel passt, sondern eine etwa 6 mm große Lücke für die Zunge lässt. Äußere Lamellen wie bei den kleineren Flamingos gibt es nicht. Daher sind sie eher auf das Filtrieren größerer Nahrungspartikel angepasst (Jenkin 1957, Abb. 11). Die unterschiedlichen Anpassungen haben zur Folge, dass z. B. Rosa- und Zwergflamingos nebeneinander nach Nahrung filtern können, ohne sich gegenseitig Konkurrenz zu machen.
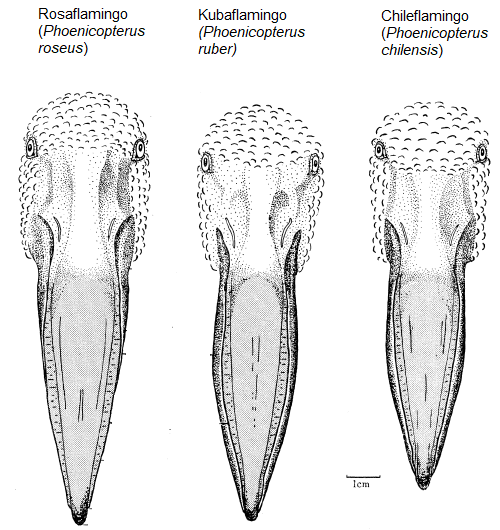
Abb. 11: Schnabel der großen Flamingoarten
Vor allem für die großen Arten gilt, dass es einen Zusammenhang zwischen dem Fehlen von Fischen und der Anwesenheit von Flamingos gibt. Fische sind für Flamingos Nahrungskonkurrenten; wo Fische zahlreich sind, fehlen Flamingos. Bei den kleineren Flamingo-Arten spielt diese Wechselwirkung eine geringere Rolle, da sie vor allem von Kieselalgen und Cyanobakterien leben. Extrem sind auch die Höhen, in denen Flamingos vorkommen können. In den Anden brüten Flamingos noch in Höhen von 3500 bis 4700 m. Besonders bekannt sind die großen Kolonien der Zwergflamingos und Rosa-Flamingos in den Salzseen des ostafrikanischen Grabenbruchs. Einige Zwergflamingokolonien können mehrere Millionen Tiere umfassen.
Die Rosafärbung des Gefieders ist auf die Aufnahme von Carotinoiden mit der Nahrung zurückzuführen. Diese sind vor allem in planktonischen Algen enthalten. Der Flamingo-Organismus kann diese Carotinoide mit Hilfe von Enzymen in der Leber umwandeln; dabei entstehen mehrere Pigmente, vor allem Canthaxanthin, das in Haut und Federn ausgewachsener Flamingos eingelagert wird. Jungvögel haben ein graues Gefieder mit keinen oder wenigen rosa Pigmenten (Hill et al. 1994, Abb. 12).

Abb. 12: Flamingos mit Küken am Natronsee.
Auffällig ist, dass Flamingos auf einem Bein stehen können. Während Flamingos für den Stand auf zwei Beinen Muskelkraft benötigen, können sie mit nur minimaler Anstrengung auf einem Bein balancieren. Wenn das eine Bein angehoben wird, verschiebt sich der Körperschwerpunkt über das andere Bein. Ein zusätzlicher „Arretiermechanismus“ sorgt für die nötige Stabilität, sodass das Balancieren auf einem Bein selbst im Schlaf möglich ist (Chang & Ting 2017).
Flamingos sind sehr gesellige Tiere, die oft in Kolonien brüten. Sie brüten nur in Gebieten, wo sie ungestört von Raubtieren sind. Solche Stellen finden sich nicht notwendigerweise an Gewässern, die den Flamingos auch ausreichend Nahrung bieten. Dementsprechend können Flamingos weite Strecken zwischen Brutgebiet und Nahrungsquelle zurücklegen. Flamingos sind opportunistische Brüter und Brüten dann, wenn die Bedingungen vor Ort es zulassen. Meist ist dies nach längeren, heftigen Regenfällen der Fall (Johnson & Cezilly 2007). Es ist daher notwendig, dass Flamingos sehr schnell synchron zueinander in Brutstimmung kommen. Vor dem Brüten teilen sich die Flamingokolonien in Brutgruppen von 15 bis 50 Vögeln auf. Sowohl die Männchen als auch die Weibchen in diesen Gruppen führen synchronisierte rituelle Darbietungen auf. Die Mitglieder einer Gruppe stehen zusammen und zeigen sich gegenseitig, indem sie ihre Hälse nach oben strecken, dann Rufe ausstoßen, während sie mit dem Kopf wedeln, und dann mit den Flügeln schlagen. Die Darbietungen scheinen nicht auf ein Individuum gerichtet zu sein, sondern treten zufällig auf (Johnson & Cezilli 2007, Studer-Thiersch 2000).
Die ersten Fossilien, die eindeutig der Kronengruppe der Flamingos zugeordnet werden können stammen aus dem Oligozän. Mehrere fossile Gattungen sind bekannt, wie Agnopterus, Elornis und Harrisonavis (Mayr 2005, 2009; Zelenkov 2013, Torres et al. 2015, Abb. 13). Letztere ist den modernen Flamingos schon recht ähnlich, jedoch ist ihr Schnabel noch nicht so gebogen. Weitere Gattungen sind Leakeyornis aus dem Miozän Kenias (Rich & Walker 1983, Mayr 2014b) und eine Reihe an Gattungen aus Australien wie Phoeniconotius als auch Fossilien, die den modernen Flamingogattungen zugeschrieben werden. Das Vorkommen fossiler Flamingos in Australien ist insofern interessant, als dass es keine wildlebenden Flamingos auf diesem Kontinent mehr gibt. Zurückgeführt wird das Verschwinden der Flamingos in Australien auf das zunehmend trockenere Klima seit dem Pleistozän (Miller 1963, Rich et al. 1987).

Abb. 13: Harrisonavis
Lappentaucher (Podicipediformes, Podicipedidae)
Die Lappentaucher sind eine Familie von Wasservögeln, die, wie ihr Name vermuten lässt, in der Lage sind zu tauchen. Als Anpassung an das Tauchen sind ihre Knochen weniger hohl als bei anderen Vögeln. Die kräftigen Beine sind weit hinten am Körper positioniert. Sie besorgen den Antrieb beim Schwimmen und Tauchen und dienen als Ruder. Die Zehen sind nicht wie bei vielen anderen Wasservögeln mit Schwimmhäuten verbunden, sondern tragen breite Schwimmlappen. Wird der Fuß im Wasser vorwärts gezogen, falten sich diese zusammen, so dass kaum Widerstand entsteht. Beim Zurückführen öffnen sie sich und drücken den Körper gegen das Wasser nach vorne. Die Tauchtiefe beträgt durchschnittlich 1 bis 4m (Winkler et al. 2020b, Fjeldsa 2004, Bochenski 1994, del Hoyo 2020, Ksepa et al. 2013, Frank & Neu 1929, Abb. 14 und 15).
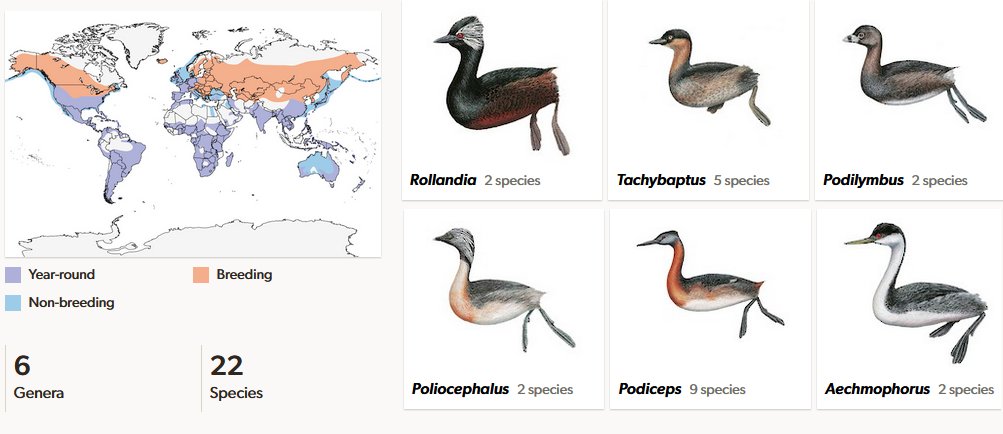
Abb. 14: Lappentaucher

Abb. 15: Füße der Lappentaucher
Die 23 Arten kommen fast weltweit vor, wobei drei Arten kürzlich ausgestorben sind: der Delacour-Zwergtaucher (Tachybaptus rufolavatus) aus Madagaskar, der Atitlántaucher (Podilymbus gigas) aus Guatemala und der Andentaucher (Podiceps andinus) aus Kolumbien (Abb. 16). Zentrum der Artenvielfalt der Lappentaucher ist Südamerika. Die bekanntesten Arten, die auch in Europa vorkommen sind Haubentaucher (Podiceps cristatus, Abb. 17) und Zwergtaucher (Tachybaptus ruficollis, Abb. 18). Lappentaucher sind eine sehr alte Vogelgruppe. Fossil sind sie seit dem Miozän durch die Gattungen Miobaptus und Thiornis belegt (Abb. 19). Im Pliozän gab es neben der fossilen Gattung Pliolymbus auch bereits Vertreter der Haubentaucher-Gattung Podiceps, und aus dem Pleistozän gibt es Funde von Arten zweier weiterer rezenter Gattungen, Podilymbus und Aechmophorus (Storer 1976, 2000, Olson 1995, Cracraft 1973, Murray 1967, Alvarez 1977, Jehl 1967, Svec 1982a,b, Zelenkov 2015).

Abb. 16: die ausgestorbenen Lappentaucherarten

Abb. 17: Haubentaucher

Abb. 18: Zwergtaucher
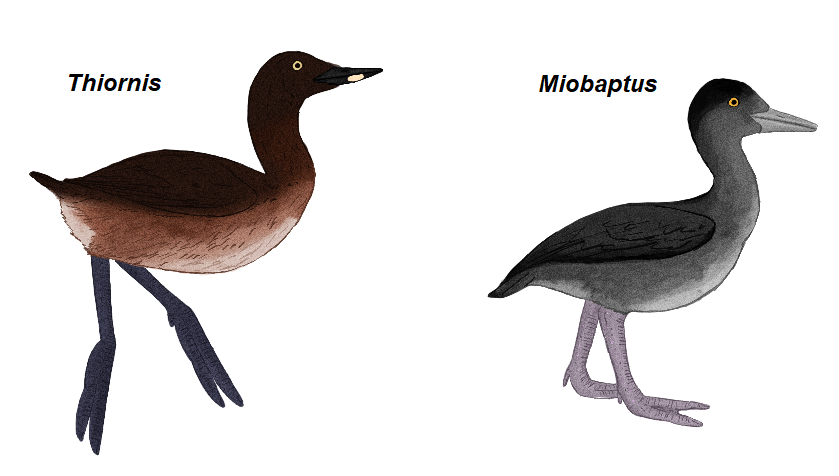
Abb. 19: Thiornis und Miobaptus
Otidimorphae
Die Otidimorphae umfassen drei Ordnungen mit jeweils einer Familie: die Trappen (Otidiformes; Otididae), Turakos (Musophagiformes; Musophagidae) und Kuckucke (Cuculiformes; Cuculidae), wobei noch nicht ganz klar, welche der drei Familien untereinander näher verwandt sind (Sangster et al. 2022, Jarvis et al. 2014, Ericson et al. 2006, Hackett et al. 2008).
Trappen (Otididae)
Die Trappen (Otididae) sind eine Familie mittelgroßer bis sehr großer, bodenlebender, aber flugfähiger Vögel. Von den 27 Arten leben 16 in Afrika, die anderen kommen in Europa, Asien und Australien vor (Winkler et al. 2020c, del Hoyo et al. 1996, Pitra et al. 2002, Abb. 20). In den gemäßigten Regionen sind sie Zugvögel. Der Rumpf ist kräftig, Hals und Beine sind lang, der Schwanz und der Schnabel recht kurz. Die größten Arten stehen 1 m hoch und erreichen ein Gewicht von 10 kg und mehr. Die Riesentrappe (Ardeotis kori, Abb. 21) kann sogar bis zu 19 Kg wiegen und gehört zu den schwersten flugfähigen Vögeln der Welt. Die Weibchen sind bei den großen Arten erheblich leichter und kleiner; sie erreichen nur zwei Drittel der Höhe und ein Drittel des Gewichts eines durchschnittlichen Männchens. Bei kleineren Arten gibt es dagegen keine nennenswerten Größenunterschiede. Das Gefieder ist überwiegend wenig auffällig braun oder grau mit weißen und schwarzen Zeichnungen. Die Männchen haben in der Regel hellere Gefiederfarben und oft Schmuckfedern an Scheitel, Nacken, Wangen, Kehle oder Hals. Bei den Hähnen einer Reihe von Arten ist der Hals während der Fortpflanzungszeit verdickt oder wird zumindest bei der Balz durch Aufpumpen eines Teils der Speiseröhre oder zusätzlich noch eines Kehlsacks vergrößert. Die Tiere haben nur drei Zehen mit unten ausgehöhlten, breiten Krallen, die Hinterzehe fehlt. Das bewirkt, dass Trappen auf Bäumen keinen Halt fänden und ausschließlich am Boden leben. Als tagaktive Allesfresser nehmen sie Blätter, Früchte und wirbellose Tiere zu sich. Die Mehrzahl der Arten hat ein polygynes Fortpflanzungssystem: Ein Männchen paart sich mit mehreren Weibchen und hilft nicht bei Brut und Jungenaufzucht. Ausnahme von dieser Regel sind die kleinen afrikanischen Trappen der Gattung Eupodotis, die saisonal monogam sind und bei denen ein Paar gemeinsam die Jungenaufzucht übernimmt.
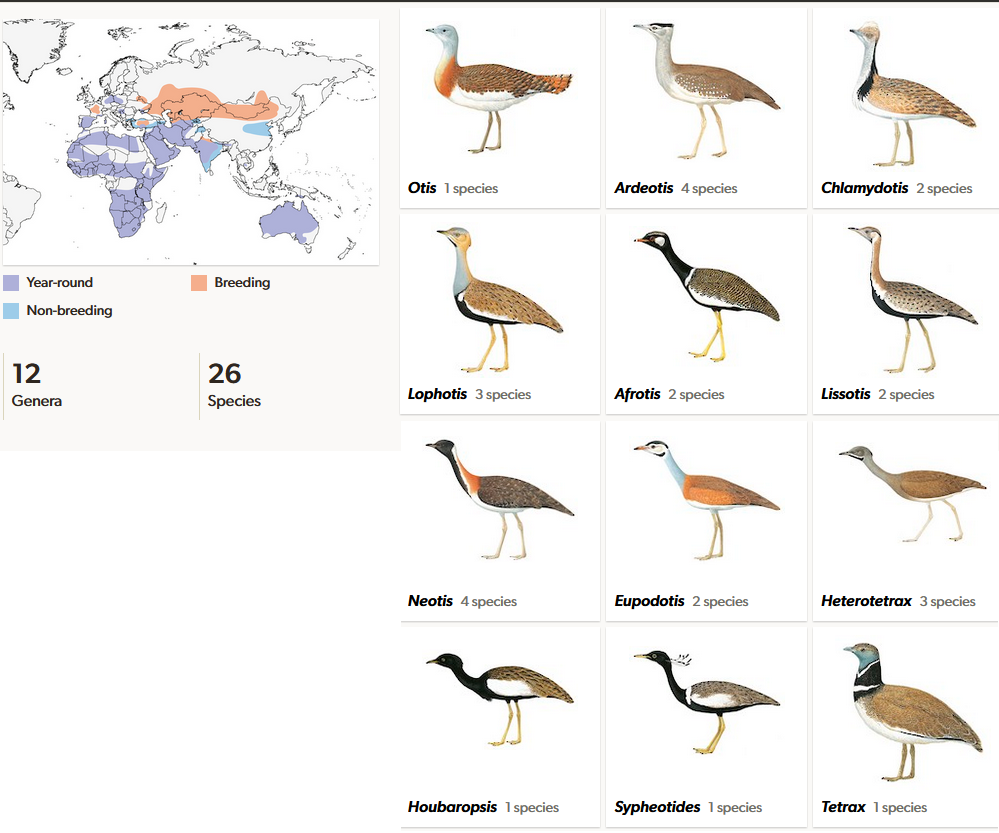
Abb. 20: Trappen

Abb. 21: Riesentrappe
Trappen sind fossil schlecht überliefert, die frühesten fragmentarischen Funde stammen aus dem Miozän. Das schlecht erhaltene Skelett von „Otis affinis“ aus dem mittleren Miozän von Deutschland, das oft als eine der frühesten Trappen angesehen wird (Lambrecht 1933, Mlíkovský 2002), wurde falsch identifiziert und stellt wahrscheinlich einen Ibis dar (im Gegensatz zu modernen Trappen hat dieses Fossil eine gut ausgebildete Hinterzehe, die bei heutigen Trappen fehlt). Aus dem Pliozän sind mehrere Fossilfunde aus Nordafrika und Eurasien bekannt. Das späte Auftreten von Trappen im Fossilbericht deutet entweder darauf hin, dass die typischen Trappenmerkmale sich erst sehr spät entwickelt haben und Fossilien daher nicht als Trappen identifiziert werden können oder ihr Ursprung liegt in einer Region mit schlechter fossiler Überlieferung (Mayr 2016).
Turakos (Musophagidae)
Turakos (Musophagidae) kommen in fünf Gattungen mit 23 Arten ausschließlich in Afrika vor (Winkler et al. 2020d, del Hoyo 2020, del Hoyo et al. 1997, Perktas et al. 2020, Veron & Winney 2000; Abb. 22). Die meisten Arten zeichnen sich durch ein farbenprächtiges Gefieder aus und bewohnen hauptsächlich die Regen- und Trockenwälder des Kontinents. Lediglich die Gattung der Lärmvögel (Crinifer) hat ein bräunliches oder gräuliches Gefieder und sie bewohnen eher die trockenen Regionen Afrikas. Viele Arten kommen auch nur in einem beschränkten Verbreitungsgebiet vor: der Ruwenzori-Turako (Gallirex johnstoni) kommt nur in den Bergwäldern des westlichen Riftgebirges vor, Weißohrturako (Menelikornis leucotis) und Ruspoliturako (Menelikornis ruspolii) in den Bergwäldern und im Hochland von Äthiopien, der Bannermanturako (Tauraco bannermani) in den Bergwäldern Kameruns, der Seidenturako (Tauraco hartlaubi) in den Bergwäldern Kenias und Tansanias, der Fischerturako (Tauraco fischeri) in den Küstenwäldern Ostafrikas und der Federhelmturako (Tauraco corythaix) in den Küstenwäldern Südafrikas (Abb. 23 und 24). Die größte Art ist der Riesenturako (Corythaeola cristata) mit 70 bis 75 cm und ist weit in den Regenwäldern Afrikas verbreitet (Abb. 25). Turakos besitzen im Verhältnis zum Körper kurze, abgerundete Flügel, die deutlich kürzer als die Schwanzfedern sind. Der relativ lange Schwanz ist am Ende abgerundet und teilt sich in zehn steifschaftige Steuerfedern ein. Ihre Schnäbel sind kurz und kräftig. Außergewöhnlich ist das Vorhandensein der zwei Farbstoffe Turacin und Turacoverdin (Church 1869, Blumberg & Peisach 1965, Keilin & McCosker 1961, Dyck 1992). Beide Farbstoffe wurden nach den Turakos benannt, da sie bisher nirgendwo im Tierreich vorgefunden wurden. Der rote kupferhaltige Farbstoff Turacin verleiht den Schwungfedern und bei manchen Arten den Federhauben ihre rote bis dunkelrote Farbe. Die grüne Befiederung kommt von dem grünen Farbstoff Turacoverdin. Andere Farben, wie zum Beispiel Blau, kommen durch Vermischung der Farbstoffe zustande. Turakos ernähren sich überwiegend von Beeren und Früchten, aber auch von Insekten.
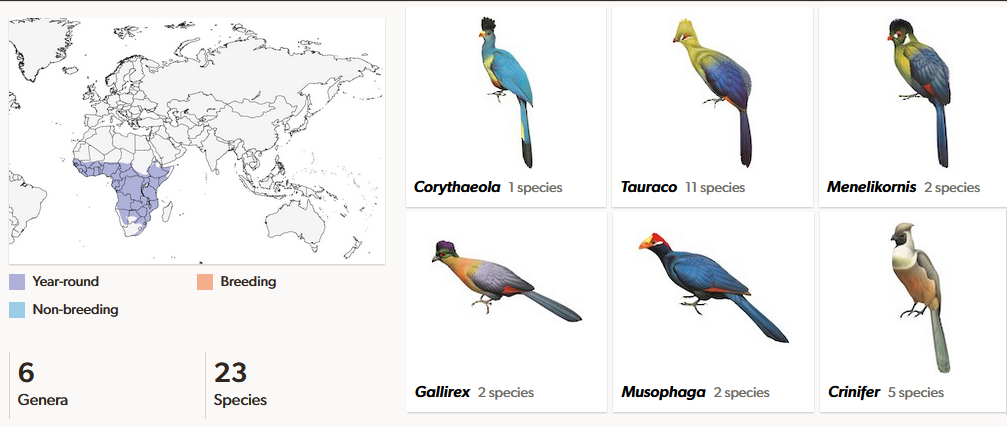
Abb. 22: Turakos
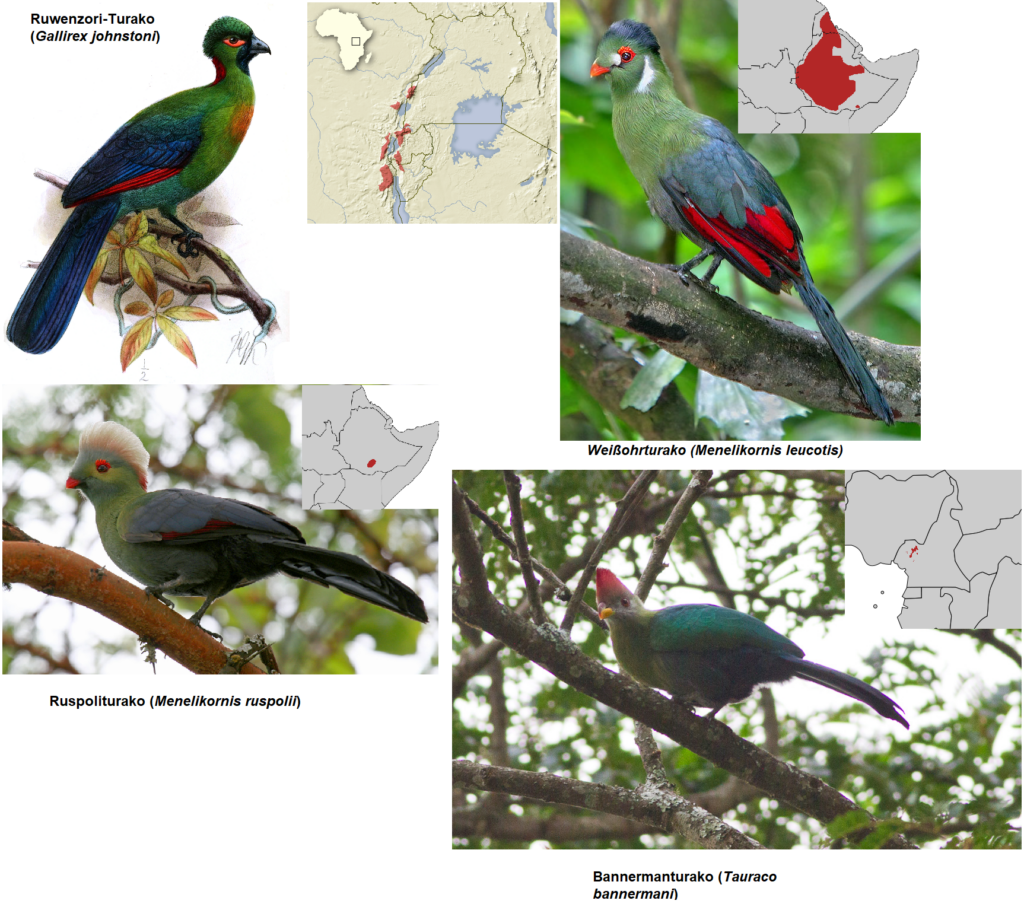
Abb. 23: Turakos

Abb. 24: Turakos

Abb. 25: Riesenturako
Der Fossilbericht zeigt, dass Turakos wesentlich weiterverbreitet waren. So sind einige fossile Funde aus dem Oligozäns Europas dokumentiert, die möglicherweise zu den Turakos gehören. Das Klima während dieser Zeit war in Europa dem des heutigen tropischen Afrikas ähnlich; die Wüste Sahara war noch nicht vorhanden und die Entfernung über das Mittelmeer war nicht viel größer als heute. Daher ist anzunehmen, dass es eine Ausbreitung der Turakos nach Süden gab. Die Gattung Veflintornis ist aus dem Miozän Frankreichs bekannt (Mlikovski 2002, Mayr 2016). Aus dem Eozän Wyomings ist die Art Foro panarium bekannt (Abb. 26). Ursprünglich in eine eigene Familie gestellt (Olson 1992), gilt sie nach einer Analyse von 2018 als basaler Turako (Field & Hsiang 2018). Eine Besonderheit dieser Gattung ist, dass die Proportion ihrer Beinknochen darauf schließen lässt, dass Turakos ursprünglich Bodenbewohner waren. Dies geht einher mit einer Untersuchung, dass die Neornithes, also die modernen Vögel, die das Massenaussterben am Ende der Kreidezeit überlebt haben, ursprünglich Bodenbewohner waren. Als nach dem Massenaussterben die Wälder sich wieder ausbreiten konnten, hatten sich viele Vogellinien zu Baumbewohnern entwickelt (Field et al. 2018).

Abb. 26: Foro panarium
Kuckucke
Die dritte Ordnung der Otidimorphae sind die Kuckucke mit einer Familie. Mit etwa 140 Arten kommen sie fast weltweit vor (del Hoyo 2020, del Hoyo et al. 1997, Winkler et al. 2020e, Abb. 27 und 28). Der Verbreitungsschwerpunkt ist Asien, Afrika und Südamerika. In Westeuropa kommen lediglich der Kuckuck und der Häherkuckuck (Clamator glandarius) vor. Der bevorzugte Lebensraum von Kuckucken sind Wälder und Buschlandschaften. Die meisten Kuckucke sind Baumbewohner. Einige wenige Arten wie die aus der Unterfamilie der Erdkuckucke (Neomorphinae) aus Nord- und Südamerika, zu denen unter anderem der Rennkuckuck – auch bekannt als Roadrunner (Geococcyx velox), gehört, sind Bodenbewohner. Auch die südostasiatischen Laufkuckucke (Carpococcyx) halten sich bevorzugt am Boden auf. Die meisten Kuckucksarten sind schlicht grau, braun oder olivfarben gefärbt. Die Farben bilden meist ein grobes Muster von Streifen und Flecken. Einige Arten zeigen auch ein metallisch glänzendes Schwarz wie die südamerikanischen Anis (Crotophaga). Bunte, leuchtende Farben sind nur selten ausgeprägt, finden sich aber beispielsweise bei den Eigentlichen Goldkuckucken (Chrysococcyx). Die Kuckucke lassen sich in fünf Unterfamilien einteilen (Sorenson & Payne 2005, vgl. Abb. 27 – 29).
Die Madenkuckucke (Crotophaginae) haben zwei Gattungen mit vier Arten aus Süd- und Mittelamerika. Die Gattung Crotophaga hat drei Arten und der Guirakuckuck (Guira guira) wird in eine eigene Gattung gestellt. Die Neomorphinae, die Erdkuckucke, haben ebenfalls ihren Schwerpunkt in Mittel- und Südamerika, aber einige, wie der Rennkuckuck (Geococcyx velox) kommen in den USA vor. Zu den Erdkuckucken gehören fünf Gattungen (Dromococcyx, Geococcyx, Morococcyx, Neomorphus und Tapera) mit 11 Arten. Alle Arten dieser Unterfamilie bewegen sich meist am Boden fort, lange Flüge werden vermieden. Die dritte Unterfamilie sind die Centropodinae zu denen eine Gattung, die Spornkuckucke (Centropus) gehören. Fast 30 Arten sind beschrieben worden und kommen in Afrika, dem tropischen Asien, Neuguinea, den Salomonen und Australien vor. Schwerpunkt der Artenvielfalt liegt in Indonesien, Philippinen und Neuguinea, aber auch im tropischen Afrika finden sich etwa ein halbes Dutzend Arten. Im Gegensatz zu vielen anderen Kuckucken sind sie keine Brutparasiten, was auch für die meisten amerikanischen Kuckucksarten gilt. Dennoch haben Spornkuckucke eine Besonderheit in ihrem Brutverhalten. Bei allen Vertretern der Gattung sind die Geschlechterrollen (in unterschiedlichem Maße) vertauscht, sodass das kleinere Männchen den Großteil der elterlichen Fürsorge übernimmt (Maurer 2008, Andersson 1995). Die Couinae sind die dritte Unterfamilie der Kuckucke. Hierher gehören zwei Gattungen: die Laufkuckucke (Carpococcyx) mit drei Arten aus Südostasien, die, den amerikanischen Erdkuckucken ähnlich, hauptsächlich Bodenbewohner sind. Die Seidenkuckucke (Coua) kommen mit 10 Arten nur in Madagaskar vor. Auch sie sind hauptsächlich bodenbewohnend und keine Brutparasiten.

Abb. 27: Kuckucke 1, Unterfamilien Crotophaginae, Neomorphinae, Centropodinae und Couinae.
Die größte Unterfamilie sind die Cuculinae (Abb. 28 und 29), die die restlichen Kuckucke ausmachen. Diese Unterfamilie lässt sich in drei weitere Linien bzw. Gattungsgruppen aufspalten. An der Basis der Cuculinae steht der Bubukuckuck (Rhinortha chlorophaea) aus Südostasien. Zur Gattungsgruppe der Phaenicophaeini gehören 10 Gattungen. 5 Gattungen mit 11 Arten (Taccocua, Zanclostomus, Phaenicophaeus, Dasylophus, Rhamphococcyx) kommen nur im tropischen Asien und drei Gattungen mit 18 Arten (Coccycua, Piaya, Coccyzus) schwerpunktmäßig in Mittel- und Südamerika, mit einigen Arten auch in Nordamerika. Die Gattung der Erzkuckucke (Ceuthmochares) hat zwei Arten aus Afrika und die Schopfkuckucke (Clamator) haben vier Arten, die in Asien und Afrika leben. Mit dem Häherkuckuck (Clamator glandarius) haben wir auch eine Art, die in Europa lebt.
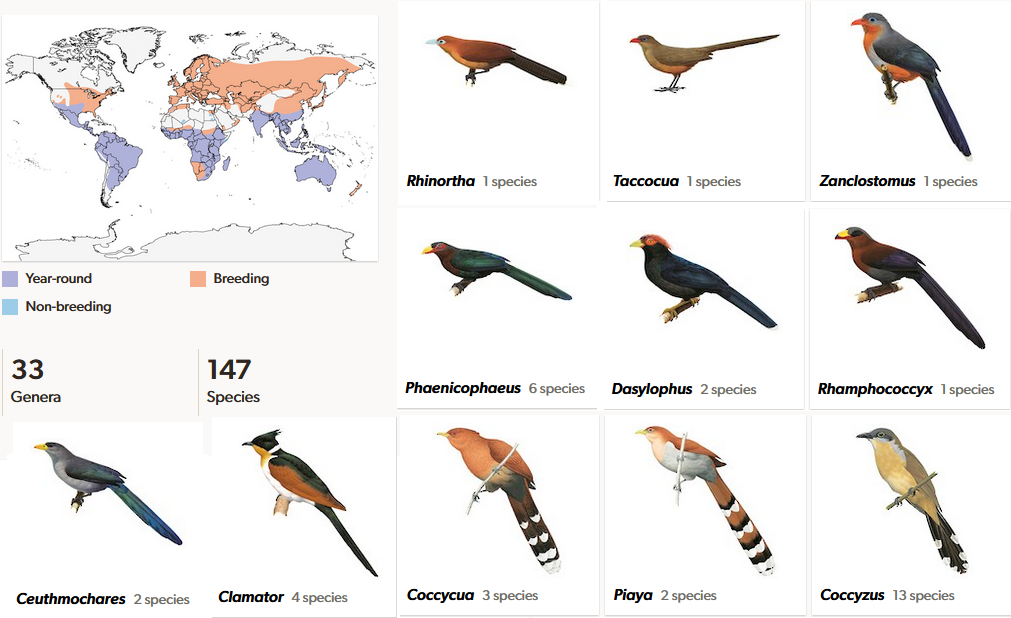
Abb. 28: Cuculinae (Rhinortha chlorophaea und Phaenicophaeini)
Die Gattungsgruppe der Cuculini hat 11 Gattungen. Vier Gattungen haben jeweils nur eine Art: der Dickschnabelkuckuck (Pachycoccyx audeberti) aus Afrika, der Schwarzkappenkuckuck (Microdynamis parva) aus Neuguinea, der Fratzenkuckuck (Scythrops novaehollandiae) aus Australien, Neuguinea und Ozeanien und der Langschwanzkoel (Urodynamis taitensis) aus Neuseeland. Die Gattung Eudynamys kommt mit drei Arten in Asien und Australien und die Eigentlichen Goldkuckucke (Chrysococcyx) mit 13 Arten in Afrika, Südostasien, Australien und Ozeanien vor. Einige ordnen die australischen und pazifischen Goldkuckucke in eine eigene Gattung (Chalcites) ein. Die Gattung Cacomantis hat 9 bis 11 Arten, die in Asien und Australien vorkommen, wobei einige Autoren den Blasskuckuck (Heteroscenes pallidus) und den Weißscheitelkoel (Caliechthrus leucolophus) in eine eigene monotypische Gattung stellen. Die Gattung Surniculus hat vier Arten aus Asien und die Gattung Cercococcyx hat drei oder vier Arten in den afrikanischen Regenwäldern. Hierococcyx umfasst acht asiatische Arten und in die Gattung Cuculus gehören 11 Arten, die etwa gleich verteilt in Afrika und Asien vorkommen. Zu dieser Gattung gehört auch der eigentliche Kuckuck (Cuculus canorus), der in Europa vorkommt, aber auch in weiten Teilen des gemäßigten Asiens lebt und in den Tropen Afrikas und Asiens überwintert. Mit dem St.-Helena-Kuckuck (Nannococcyx psix) hat man eine Art, die wohl im 18. Jahrhundert ausstarb, von dem aber nur einzelne Knochenfragmente gefunden wurden.

Abb. 29: Cuculinae (Cuculini).
Der Fossilbericht der Kuckucke ist schlecht überliefert. Der älteste mutmaßliche Kuckuck ist Chambicuculus aus dem Eozän von Tunesien (Mourer-Chauviré et al. 2013, 2016). Dieser Vogel ist jedoch nur von fragmentarischen Resten bekannt, und obwohl diese sehr kuckucksähnlich sind, sind weitere Knochen wünschenswert, um seine Verwandtschaft festzustellen. Dasselbe gilt für weitere Gattungen aus dem Eozän Kanadas und Colorados: Neococcyx und Eocuculus (Mayr 2009).
Aus dem Miozän Nordamerikas stammen Cursoricoccyx und Thomasococcyx (Olson 1985, Steadman 2008). Auch hier bestehen diese Funde nur aus einigen wenigen Knochenfragmenten, und da selbst die Fossilienfunde von Kuckucken aus dem späten Känozoikum dürftig sind, bleibt die Evolutionsgeschichte dieser Vögel weitgehend unbekannt.
Evolution des Brutparasitismus
Eine Besonderheit vieler Kuckucke ist ihr Brutparasitismus (Abb. 30). Brutparasitismus ist bei 59 Arten beschrieben worden, wobei nur drei Arten (Fasan- Pfauen- und Streifenkuckuck) in Südamerika vorkommen. Die restlichen brutparasitierenden Arten leben in Afrika, Asien und Europa (del Hoyo et al. 1997).
Diese Arten sind obligate Brutparasiten, was bedeutet, dass sie sich nur auf diese Weise fortpflanzen und auch zu der Metapher „Kuckucksei“ führte. Das bekannteste Beispiel ist der europäische Kuckuck (Abb. 30). Neben den oben genannten Arten gibt es aber auch Arten, die keinen obligaten Brutparasitismus betreiben, d. h. sie legen ihre Eier in die Nester von Mitgliedern ihrer eigenen Art und ziehen ihre eigenen Jungen auf. Die Schalen der Eier von Kuckuckseiern, die Brutparasiten sind, sind in der Regel dicker und stärker als die ihrer Wirte, was das Ei schützt, wenn ein Wirtselternteil versucht, es zu beschädigen, und es widerstandsfähig gegen Risse macht, wenn es in ein Wirtsnest fällt (Antonov et al. 2008).

Abb. 30: Ein Küken des Kuckucks (Cuculus canorus) wird von einem Teichrohrsänger (Acrocephalus scirpaceus) gefüttert.
Für die brutschmarotzenden Arten innerhalb der Unterfamilie der Altweltkuckucke gilt, dass sie als Wirtsvögel meist solche wählen, die kleiner sind als sie selbst. Meist handelt es sich um insektenfressende Arten geringer Größe wie beispielsweise Timalien oder Würger. Der Indische Koel (Eudynamys scolopaceus) und der Fratzenkuckuck (Scythrops novaehollandiae) sind aber Brutschmarotzer von Krähen in gleicher Größe. Der afrikanische Häherkuckuck (Clamator glandarius) parasitiert mit Elster (Pica pica), Aaskrähe (Corvus corone) und Schildrabe (Corvus albus) sogar Arten, die deutlich größer sind als er (Davies 2000, 2015).
Bei den meisten Arten legt das Weibchen nur ein Ei pro Wirtsnest und der frisch geschlüpfte Jüngling, der meist größer ist und schneller wächst als die Küken der Wirte, entfernt wahrscheinlich instinktiv aus dem Nest die Eier oder die anderen Jungvögel und wird dann alleine von den Wirtsvögeln hochgezogen.
Kuckuckseier haben in der Regel eine kürzere Inkubationszeit und so schlüpft das Küken früher als die Küken der Wirte. Ein Grund dafür, dass das Kuckucksei früher schlüpft, ist, dass das Kuckucksweibchen das Ei, nachdem es vollständig geformt ist, vor der Eiablage noch weitere 24 Stunden in seinem Eileiter hält (Davies 2015), was bedeutet, dass das Ei bereits 24 Stunden intern bebrütet wurde.
Da obligate Brutparasiten ihren Wirt erfolgreich austricksen müssen, um sich fortzupflanzen, haben sie Anpassungen in verschiedenen Phasen der Fortpflanzung entwickelt. Der Parasitismus ist für den Wirt mit hohen Kosten verbunden, was zu einer starken Selektion auf den Wirt führt, um parasitäre Eier zu erkennen und abzuweisen. Die Anpassungen und Gegenanpassungen zwischen Wirten und Parasiten haben zu einem „Wettrüsten“ in der Koevolution geführt. Das bedeutet, dass eine der beteiligten Arten, wenn sie aufhört, sich anzupassen, das Rennen gegen die andere Art verliert, was zu einer geringeren Fitness der verlierenden Art führt (Spottiswoode & Stevens 2012).
Kuckucke haben verschiedene Strategien, um ihre Eier in Wirtsnester zu bringen. Kuckucksweibchen legen ihre Eier heimlich und schnell, aber in einigen Fällen wurde nachgewiesen, dass die Männchen die erwachsenen Wirtsvögel von ihren Nestern weglocken, damit die Weibchen ihre Eier in das Nest legen können (Davies 2011). Einige Wirtsarten versuchen möglicherweise direkt zu verhindern, dass Kuckucke überhaupt Eier in ihrem Nest ablegen – es ist bekannt, dass Vögel, deren Nester einem hohen Risiko der Kuckuckskontamination ausgesetzt sind, Kuckucke „mobben“, um sie aus dem Gebiet zu vertreiben (Wheatcroft 2009).
Viele Kuckucksweibchen legen Eier, die den Eiern ihres gewählten Wirts sehr ähnlich sind. Einige Vögel sind in der Lage, Kuckuckseier von ihren eigenen zu unterscheiden, was dazu führt, dass die Eier, die den Eiern des Wirts am wenigsten ähneln, aus dem Nest geworfen werden. Parasitäre Kuckucke, die den höchsten Grad an Ei-Mimikry aufweisen, sind diejenigen, deren Wirte ein hohes Maß an Ei-Abstoßungsverhalten zeigen (Stoddard & Stevens 2011). Einige Wirte zeigen kein Ei-Abstoßungsverhalten und die Kuckuckseier sehen den Wirtseiern sehr unähnlich. In einer Studie über den europäischen Kuckuck wurde auch gezeigt, dass die Weibchen ihre Eier in das Nest eines Wirts legen, der Eier hat, die seinen eigenen ähnlichsehen (Aviles et al. 2006). Andere Kuckucksarten legen “kryptische” Eier, die dunkel gefärbt sind, während die Eier ihrer Wirte hell sind (Davies 2011). Dies ist ein Trick, um das Ei vor dem Wirt zu verstecken, und wird bei Kuckucken gezeigt, die Wirte mit dunklen, gewölbten Nestern parasitieren (Abb. 31).

Abb. 31: Mimetische, nicht-mimetische und kryptische Kuckuckseier. (a) Die Wirtsrasse des Kuckucks (Cuculus canorus), die auf Rohrsänger (Acrocephalus scirpaceus) spezialisiert ist, legt ein mimetisches Ei (Kuckucksei rechts, mit drei Rohrsängereiern), während (b) die Wirtsart, die auf Heckenbraunellen (Prunella modularis) spezialisiert ist, ein nicht-mimetisches Ei legt (Kuckucksei mit vier Heckenbraunelleiern). (c) Der Jakobinerkuckuck (Clamator jacobinus) legt ein nicht-mimetisches weißes Ei in das Nest des Kapbülbüls (Pycnonotus capensis). (d) Der Glanzbronzekuckuck (Chalcites lucidus) legt ein dunkles, kryptisches Ei in das dunkle, gewölbte Nest seines Wirts, des Gelbbürzel-Dornschnabels (Acanthiza chrysorrhoa), der blasse Eier hat.
Es gibt zwei Haupthypothesen zu den kognitiven Mechanismen, die dem Wirt die Unterscheidung von Eiern ermöglichen. Die eine Hypothese besagt, dass ein Wirt die Eier in seinem Gelege mit einer (erlernten oder angeborenen) Vorlage vergleicht, um zu erkennen, ob es sich um Parasiteneier handelt. Das Einprägen einer Vorlage für ein Parasitenei ist jedoch kostspielig und unvollkommen und wahrscheinlich nicht mit jedem Ei des Wirts identisch. Die andere ist die Diskordanzhypothese, die besagt, dass ein Wirt die Eier in einem Gelege vergleicht und die unpassenden identifiziert, wenn jedoch die Mehrheit der Eier in einem Gelege aus parasitären Eiern besteht, lehnt der Wirt seine eigenen Eier schließlich ab. Neuere Studien haben ergeben, dass wahrscheinlich beide Mechanismen zur Unterscheidung von Parasiteneiern durch den Wirt beitragen, da der eine die Einschränkungen des anderen ausgleicht (Rothstein 1975, Feeney et al. 2014).
Aber, wie konnte es grundsätzlich zur Entstehung des Brutparasitismus kommen? Bei einigen Tieren ist die Aufzucht von Jungtieren mit einem großen Aufwand verbunden, so auch bei Vögeln. Dazu gehört das Bauen von Nestern, das Ausbrüten von Eiern und das Füttern von Küken. Aus diesem Grund kann es manchmal besser sein, sich die Mühe zu sparen und stattdessen zu betrügen, wenn ein Organismus einen anderen manipuliert, um seine Jungen aufzuziehen, als wären es seine eigenen. Es gibt im Wesentlichen zwei Haupttheorien, wie sich solch ein Brutparasitismus entwickeln konnte (Krüger 2017). Eine Theorie besagt, dass sich der Brutparasitismus zwischen verschiedenen Arten aus dem Brutparasitismus innerhalb derselben Art entwickelt hat.
Dies könnte bei Vögeln geschehen sein, die in Kolonien nisteten, in denen die Individuen ihre Eier entweder versehentlich oder nach dem Verlust ihrer eigenen Eier in andere Nester legten. Schätzungen zufolge verbraucht ein parasitärer Kuckuck nur halb so viel Energie wie ein elterlicher Kuckuck, um den gleichen Fortpflanzungserfolg zu erzielen. Aus diesem Grund wurde diese Strategie wahrscheinlich ausgewählt, sodass Weibchen möglicherweise nach weiteren Nestern, wie denen anderer Arten, gesucht haben. Diese Theorie ist jedoch unwahrscheinlich, da es keine enge Korrelation des Parasitismus zwischen und innerhalb von Arten gibt. Stattdessen haben Analysen von Arten, die eng mit diesen Kuckucken verwandt sind, ergeben, dass sich der Brutparasitismus ohne den Zwischenschritt des Parasitismus bei Artgenossen entwickelt hat.
Eine Studie besagt, dass sich der Brutparasitismus als Folge von Veränderungen in der Ökologie entwickelt hat (Krüger & Davies 2002). Die Autoren der Studie vermuten, dass eine anfängliche Ausdehnung des Lebensraums zu mehr Vogelwanderungen führte. Dadurch vergrößerte sich das Brutgebiet und es wurden neue Nahrungsquellen verfügbar. Diese ökologischen Veränderungen hätten eine Verringerung des Energieaufwands für die Fortpflanzung erforderlich gemacht und könnten die Entwicklung des Brutparasitismus begünstigt haben. Nachdem sich diese hinterlistige Strategie entwickelt hatte, führte sie auch zu interessanten Anpassungen wie der besprochenen Eimimikry (Krüger 2007).
Doch trotz dieser Anpassungen überleben nicht alle Jungparasiten. Manchmal durchschauen die Wirte den Trick, und dies kann ein evolutionäres Wettrüsten auslösen. Je täuschender die Parasiten sind, desto besser können die Wirte ihr Nest verteidigen. Eine Studie ergab, dass viele Vögel in Nordamerika fremde Eier des brutparasitierenden Kuhstärlings zu fast 100 Prozent abwehren können, indem sie sie entweder zerstören oder das Nest komplett verlassen (Soler 2016). Es wurde jedoch auch festgestellt, dass viele andere Arten in derselben Region sie überhaupt nicht ablehnen, mit Raten nahe null Prozent. Warum versuchen einige Vögel also nicht, Parasiten abzuwehren? Um ein parasitäres Ei erfolgreich zu beseitigen, müssen die Wirte in der Lage sein, ihre eigenen Eier von den fremden zu unterscheiden, und die Kosten, die entstehen, wenn dies nicht gelingt, sind enorm.
Manchmal verwechseln sie eines ihrer eigenen Eier mit einem Parasiten und stoßen es aus oder beschädigen versehentlich ihre Eier, während sie versuchen, die Parasiten zu vernichten. Diese Kosten wirken sich natürlich auf die Fitness aus, da das resultierende Gelege kleiner sein wird. Wirte können sogar ihre Nester verlassen, wenn sie glauben, dass sie parasitiert wurden, was bedeutet, dass all ihre Bemühungen umsonst waren. Bei einer geringen Parasitenrate sind die Kosten dieser Fehler viel höher als die Kosten einer tatsächlichen Parasitierung. Das bedeutet, dass die Annahme eines Eindringlings-Eies die bessere Strategie für sie sein kann.
Es gibt noch einen weiteren Grund, warum einige parasitäre Eier akzeptiert werden. Der Braunkopf-Kuhstärling (Molothrus ater, Abb. 32) ist für seine Wirte ein wahrer Albtraum. Wenn das Kuhstärling-Ei aus dem Nest entfernt wird, kehrt das Elterntier zurück und zerstört das gesamte Gelege des Wirts. Dies wurde in einer Studie aus dem Jahr 2007 nachgewiesen (Hoover & Robinson 2007). Als die Autoren die Eier des Kuhstärlings aus den Nestern der Zitronenwaldsänger (Protonotaria citrea) entfernten, wurden 56 Prozent dieser Nester, die die Eier ablehnten, von den Brutparasiten zerstört.

Abb. 32: der brutparasitierende Braunkopf-Kuhstärling (Molothrus ater)
Und als die Wirte, die die Eier ablehnten, ihre Nester wieder aufbauten, wurden 85 Prozent von ihnen erneut zerstört. Tatsächlich brachten die Nester der Wirte, die die Eier ablehnten, 60 Prozent weniger Nachkommen hervor als die Nester der Wirte, die die Eier akzeptierten. Diese mafiöse Taktik kann eine Bestrafung sein oder ein Versuch, sie zur Produktion eines neuen Geleges zu zwingen (vgl. auch Abou Chakra et al. 2014, 2016). In jedem Fall ist es für die Wirtsvögel sinnvoll, den Eindringling zu akzeptieren, um das Leben ihres eigenen Nachwuchses nicht zu gefährden.
Die Evolution des Brutparasitismus ist eine Geschichte voller Überwachungstäuschung und Aggression. Solange es parasitäre Vögel und Wirte gibt, die sich täuschen lassen, kann diese Geschichte als nie endender Eierkrieg weitergehen.
Die nächste Episode widmet sich zwei weiteren Großgruppen der Neoaves: den Columbiformes und den Strisores. Zu diesen Gruppen gehören u. a. die Tauben und die Kolibris.
Literatur
Abou Chakra, M., Hilbe, C., Traulsen, A. (2014): Plastic behaviors in hosts promote the emergence of retaliatory parasites. Sci Rep 4, 4251
Abou Chakra, M., Hilbe, C., Traulsen, A. (2016): Coevolutionary interactions between farmers and mafia induce host acceptance of avian brood parasitesR. Soc. Open Sci.3160036
Agnolin, F.L. (2009): Una nueva especie del género Megapaloelodus (Aves: Phoenicopteridae: Palaelodinae) del Mioceno Superior del noroeste de Argentina. Revista del Museo Argentino de Ciencias Naturales. 11 (1): 23–32.
Alvarenga, H.M.F. (1990): Flamingos Fósseis da Bacia de Taubaté, Estado de São Paulo, Brasil: Descrição de Nova Espécie. Anais da Academia Brasileira de Ciências. 62 (4): 335–345.
Alvarez, R. (1977): A Pleistocene Avifauna from Jalisco, Mexico. Contributions from the Museum of Paleontology. 24 (19). University of Michigan: 205–220.
Andersson, M. (1995): Evolution of reversed sex roles, sexual size dimorphism, and mating system in coucals (Centropodidae, Aves). Biol. J. Linn. Soc. 54 (2): 173–181.
Antonov, A.; Stokke, B. G.; Moksnes, A.; Roeskaft, E. (2008): Does the cuckoo benefit from laying unusually strong eggs?. Animal Behaviour. 76 (6): 1893–900.
Avilés JM, Stokke BG, Moksnes A, Røskaft E, Asmul M, Møller AP (2006): Rapid increase in cuckoo egg matching in a recently parasitized reed warbler population. Journal of Evolutionary Biology. 19 (6): 1901–10.
Baird, RF; Vickers-Rich, P (1998): Palaelodus (Aves: Palaelodidae) from the Middle to Late Cainozoic of Australia. Alcheringa. 22 (2): 135–151.
Blumberg, W.E.; Peisach, J. (1965): An Electron Spin Resonance Study of Copper Uroporphyrin III and Other Touraco Feather Components. Journal of Biological Chemistry. 240 (2): 870–876.
Bochenski, Z. (1994).: The comparative osteology of grebes (Aves: Podicipediformes) and its systematic implications. Acta Zoologica Cracoviensia. 37 (1): 191–346.
Braun, E. L.; Kimball, R. T. (2021): Data types and the phylogeny of Neoaves. Birds. 2 (1): 1–22.
Casler; C. L., Este, E. E. (2000): Caribbean Flamingos Feeding at a New Solar Saltworks in Western Venezuela. Waterbirds: The International Journal of Waterbird Biology 23, S. 95–102.
Chang, Y.-H., Ting, L. H. (2017): Mechanical evidence that flamingos can support their body on one leg with little active muscular force. Biology Letters. Royal Society Publishing
Cheneval, J.; Escuillié, F. (1992): New data concerning Palaelodus ambiguus (Aves: Phoenicopteriformes: Palaelodidae): ecological and evolutionary interpretations. In: Campbell KE Jr. (ed.). Papers in Avian Paleontology honoring Pierce Brodkorb. Vol. 36. Nat Hist Mus Los Angeles County Science Series. pp. 208–224.
Chubb, A.L. (2004): New nuclear evidence for the oldest divergence among neognath birds: The phylogenetic utility of ZENK (i). Molecular Phylogenetics and Evolution. 30 (1): 140–151.
Church, A. H. (1869): Researches on Turacin, an Animal Pigment Containing Copper. Philosophical Transactions of the Royal Society of London. 159: 627–636.
Cracraft, J. (1973): Systematics and evolution of the Gruiformes (class Aves). 3, Phylogeny of the suborder Grues. Bulletin of the American Museum of Natural History. 15 (1): 1–127.
Davies, N. B. (2000): Cuckoos, Cowbirds and Other Cheats. T & AD Poyser, London.
Davies, N.B. (2011): Cuckoo adaptations: trickery and tuning. Journal of Zoology. 284: 1–14.
Davies, N. B. (2015): Cuckoo: Cheating by Nature. Bloomsbury.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Boesman, P. F. D.; Garcia, E.; Kirwan, G. M. (2020): Del Hoyo, J.; Elliott, A.; Sargatal, J.; Christie, D.; De Juana, E. (eds.). “Lesser Flamingo (Phoeniconaias minor)”. www.hbw.com. doi:10.2173/bow.lesfla1.01. S2CID 226397475
Del Hoyo, J.; Elliott, A.; Sargatal, J., eds. (1996): Handbook of the Birds of the World. Vol. 3: Hoatzin to Auks. Lynx Edicions.
del Hoyo, J.; Elliott, A.; Sargatal, J. (1997). Handbook of the Birds of the World. Vol. 4: Sandgrouse to Cuckoos.
Dyck, J. (1992): Reflectance spectra of plumage areas colored by green feather pigments. The Auk. 109 (2): 293–301.
Ericson, J.I.; et al. (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters. 2 (4): 543–547.
Fain, M.G., Houde, P. (2004): Parallel radiations in the primary clades of birds. Evolution. 58 (11): 2558–2573.
Feduccia, A. (1976): Osteological evidence for shorebird affinities of the flamingos. The Auk 93(3), S. 587–601
Feeney, W. E.; Welbergen, J. A.; Langmore, N. E. (2014): Advances in the Study of Coevolution Between Avian Brood Parasites and Their Hosts. Annual Review of Ecology, Evolution, and Systematics. 45 (1): 227–246.
Field DJ, Bercovici A, Berv JS, Dunn R, Fastovsky DE, Lyson TR, et al. (2018): Early evolution of modern birds structured by global Forest collapse at the end-cretaceous mass extinction. Curr Biol. 28(11):1825–1831.e1822.
Field, D.J., Hsiang, A.Y. (2018): A North American stem turaco, and the complex biogeographic history of modern birds. BMC Evol Biol 18, 102
Fjeldså, J. (2004): The Grebes. Oxford: Oxford University Press.
Frank, H.R.; Neu, W. (1929): Die Schwimmbewegungen der Tauchvögel (Podiceps). Zeitschrift für vergleichende Physiologie 10 (3): 410–418
Hackett, S.J.; et al. (2008): A phylogenomic study of birds reveals their evolutionary history. Science. 320 (5884): 1763–1768.
Hill, G. E.; Montgomerie, R.; Inouye, C. Y.; Dale, J. (1994): Influence of Dietary Carotenoids on Plasma and Plumage Colour in the House Finch: Intra- and Intersexual Variation. Functional Ecology. 8 (3): 343–350.
Hoover, J. P., Robinson, S. K. (2007): Retaliatory mafia behavior by a parasitic cowbird favors host acceptance of parasitic eggs. Proc Natl Acad Sci U S A 104:4479–4483.
Houde, P. et al. (2019): Phylogenetic Signal of Indels and the Neoavian Radiation. Diversity. 11 (7): 108.
Jarvis, E. D.; et al. (2014): Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 346 (6215): 1320–1331
Jehl, J. R. (1967): Pleistocene Birds from Fossil Lake, Oregon. The Condor. 69 (1): 24–27.
Jenkin, P. M. (1957): The filter-feeding and food of flamingoes (Pheonicopteri). Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 240 (674): 401–493.
Johnson, A., Cézilly, F. (2007): The Greater Flamingo. T & AD Poyser, London.
Keilin, J.; McCosker, P.J. (1961): Reactions between uroporphyrin and copper and their biological significance. Biochimica et Biophysica Acta. 52 (3): 424–435.
Krüger, O. (2007): Cuckoos, cowbirds and hosts: adaptations, trade-offs and constraints. Phil Trans R Soc B 362:1873–1886.
Krüger, O. (2017): Evolution of avian brood parasitism and phylogenetic history of brood parasites. In: Avian brood parasitism. Springer, Cham; S. 43–59.
Krüger, O., Davies, N. B. (2002): The evolution of cuckoo parasitism: a comparative analysis. Proc Biol Sci 269:375–381.
Ksepka, D. T.; Balanoff, A. M.; Bell, M. A.; Houseman, M. D. (2013): Fossil grebes from the Truckee Formation (Miocene) of Nevada and a new phylogenetic analysis of Podicipediformes (Aves). Smithsonian Contributions to Paleobiology. 56 (5): 1149–1169.
Kuhl, H. et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38: 108–127.
Lambrecht, K. (1933): Handbuch der Palaeornithologie. Berlin: Gebrüder Borntraeger
Maurer, G. (2008): Who Cares? Males Provide Most Parental Care in a Monogamous Nesting Cuckoo. Ethology. 114 (6): 540–547. doi:10.1111/j.1439-0310.2008.01498.x.
Mayr, G. (2004): Morphological evidence for sister group relationship between flamingos (Aves: Phoenicopteridae) and grebes (Podicipedidae). Zoological Journal of the Linnean Society. 140 (2): 157–169.
Mayr, G. (2005): The Paleogene fossil record of birds in Europe. Biological Reviews. 80 (4): 515–542.
Mayr, G. (2009): Paleogene Fossil Birds. Springer-Verlag Berlin Heidelberg.
Mayr, G. (2014a): The Eocene Juncitarsus – its phylogenetic position and significance for the evolution and higher-level affinities of flamingos and grebes. Comptes Rendus Palevol. 13(1):9-18.
Mayr, G. (2014b): On the Middle Miocene avifauna of Maboko Island, Kenya. Geobios. 47 (3): 133–146.
Mayr, G. (2015): Cranial and vertebral morphology of the straight-billed Miocene phoenicopteriform bird Palaelodus and its evolutionary significance. Zoologischer Anzeiger – A Journal of Comparative Zoology. 254: 18–26.
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G.; Smith, R. (2002): Avian remains from the lowermost Oligocene of Hoogbutsel (Belgium). Bulletin de l’Institut Royal des Sciences Naturelles de Belgique, Sciences de la Terre. 72: 139–150.
Miller, A.H. (1963): The fossil flamingos of Australia. The Condor. 65 (4): 289–299.
Mirarab S. et al. (2024): A region of suppressed recombination misleads neoavian phylogenomics. Proc Natl Acad Sci U S A.;121(15):e2319506121.
Mlíkovský, J. (2002): Cenozoic Birds of the World. Part 1: Europe. Praha: Ninox Press.
Mourer-Chauviré, C. (2008): Birds (Aves) from the Early Miocene of the Northern Sperrgebiet, Namibia. Mem. Geol. Surv. Namibia. 20: 147–167.
Mourer-Chauviré C., Essid E. M., Khayati Ammar H., Marivaux L., Marzougui W., Temani R., Vianey-Liaud M., Tabuce R. (2016): New remains of the very small cuckoo, Chambicuculus pusillus (Aves, Cuculiformes, Cuculidae) from the late Early/early Middle Eocene of Djebel Chambi, Tunisia. Palaeovertebrata 40 (1)-e2. doi: 10.18563/pv.40.1.e2
Mourer-Chauviré, C., Tabuce, R., El Mabrouk, E., Marivaux, L., Khayati, H., Vianey-Liaud, M., Ben Haj Ali, M. (2013): A new taxon of stem group Galliformes and the earliest record for stem group Cuculidae from the Eocene of Djebel Chambi, Tunisia. In: U.B. Göhlich & A. Kroh (eds.), Paleornithological Research 2013 – Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution. Vienna: Natural History Museum Vienna, pp. 1–15.
Murray, B. G. (1967): Grebes from the Late Pliocene of North America. The Condor. 69 (3): 277–288.
Noriega, J.I.; Agnolin, F. (2008): El registro paleontológico de las Aves del Mesopotamiense (Formación Ituzaingó; Mioceno tardío-Plioceno) de la provincia de Entre Ríos, Argentina. Insugeo. 17 (2): 271–290.
Olson, S. L. (1985): The fossil record of birds. In: Farner DS, King JR, Parkes KC (eds) Avian biology, vol 8. Academic Press, New York, pp 79–238
Olson, S. L. (1992): A new family of primitive landbirds from the early Eocene Green River Formation of Wyoming. Natural History Museum of Los Angeles County Science Series. 36: 127–136.
Olson, S. L. (1995): Thiornis sociata Navas, a nearly complete Miocene grebe (Aves: Podicipedidae). Courier Forschungsinstitut Senckenberg. 181: 131–140.
Olson, S. L.; Feduccia, A. (1980): Relationship and evolution of flamingos (Aves: Phoenicopteridae). Smithsonian Contributions to Zoology. 316: 1–73.
Peters, D. S. (1987): Juncitarsus merkeli n. sp. stützt die Ableitung der Flamingos von den Regenpfeifervögeln (Aves: Charadriiformes: Phoenicopteridae). Courier Forschungsinstitut Senckenberg 97, S. 141–155
Perktaş, U.; Groth, J. G.; Barrowclough, G. F. (2020): Phylogeography, Species Limits, Phylogeny, and Classification of the Turacos (Aves: Musophagidae) Based on Mitochondrial and Nuclear DNA Sequences. American Museum Novitates (3949): 1–61.
Pitra, C.; Lieckfeldt, D.; Frahnert, S.; Fickel, J. (2002): Phylogenetic relationships and ancestral areas of the bustards (Gruiformes: Otididae), inferred from mitochondrial DNA and nuclear intron sequences. Molecular Phylogenetics and Evolution.
Prum, R. O. et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Rasmussen, D.T.; Olson, S.L.; Simons, E.L. (1987): Fossil birds from the Oligocene Jebel Qatrani formation Fayum Province, Egypt. Smithsonian Contributions to Paleobiology. 62 (62): 1–20.
Reddy, S. et al. (2017): Why Do Phylogenomic Data Sets Yield Conflicting Trees? Data Type Influences the Avian Tree of Life more than Taxon Sampling. Systematic Biology. 66 (5): 857–879.
Rich, P.V.; van Tets, G.F.; Rich, T.H.V.; McEvey, A.R. (1987): The Pliocene and Quaternary Flamingos of Australia. Memoirs of the Queensland Museum. 25 (1): 207–225.
Rich, P. V.; Walker, C.A. (1983): A New Genus of Miocene Flamingo from East Africa. Ostrich. 54 (2): 95–104.
Rothstein, S. I. (1975): Mechanisms of avian egg-recognition: Do birds know their own eggs?. Animal Behaviour. 23 (Part 2): 268–278.
Sangster, G. (2005): A name for the flamingo-grebe clade. Ibis. 147 (3): 612–615.
Sangster, G.; Braun, E.L.; Johansson, U.S.; Kimball, R.T.; Mayr, G.; Suh, A. (2022): Phylogenetic definitions for 25 higher-level clade names of birds. Avian Research. 13: 100027.
Sibley, C. G., Ahlquist, J. E. (1983): Phylogeny and classification of birds based on the data of DNA-DNA-hybridization. In: Current Ornithology 1, S. 245–292
Soler M. (2016): Brood parasite-host coevolution in america versus europe: egg rejection in large-sized host species. Ardeola 63:35–48.
Sorenson, M.D.; Payne, R.B. (2005): A molecular genetic analysis of cuckoo phylogeny. In Payne, R.B. (ed.). The Cuckoos. Oxford: Oxford University Press. pp. 68–94.
Spottiswoode, C.N.; Stevens, M. (2012): Host-parasite arms races and rapid changes in bird egg appearance. The American Naturalist. 179 (5): 633–648.
Steadman, D.W. (2008): Doves (Columbidae) and cuckoos (Cuculidae) from the early Miocene of Florida. Bulletin of the Florida Museum of Natural History 48, 1–16.
Stiller, J. et al. (2024): Complexity of avian evolution revealed by family-level genomes. Nature 629, 851–860. https://doi.org/10.1038/s41586-024-07323-1
Stoddard MC, Stevens M (2011): Avian vision and the evolution of egg color mimicry in the common cuckoo. Evolution; International Journal of Organic Evolution. 65 (7): 2004–13.
Storer, R. W. (1976): The Pleistocene Pied-billed Grebes (Aves: Podicipedidae). Smithsonian Contributions to Paleobiology. 27: 147–288.
Storer, R. W. (2000): The systematic position of the Miocene grebe Thiornis sociata Navás. Annales de Paléontologie. 86 (2): 129–139.
Studer-Thiersch, A. (2000): What 19 Years of Observation on Captive Great Flamingos Suggests about Adaptations to Breeding under Irregular Conditions. Waterbirds: The International Journal of Waterbird Biology. 23 (Special Publication I: Conservation Biology of Flamingos): 150–159.
Suh, A. (2016): The phylogenomic forest of bird trees contains a hard polytomy at the root of Neoaves. Zoologica Scripta. 45: 50–62.
Švec, P. (1982a): Two new species of diving birds from the Lower Miocene of Czechoslovakia. Časopis pro mineralogii a geologii. 27: 243–260.
Švec, P. (1982b): Further finds of grebe Miobaptus walteri in the Miocene of Bohemia. Časopis pro mineralogii a geologii. 29 (2): 167–170.
Torres, C. R.; De Pietri, V. L.; Louchart, A.; Van Tuinen, M. (2015): New cranial material of the earliest filter feeding flamingo Harrisonavis croizeti (Aves, Phoenicopteridae) informs the evolution of the highly specialized filter feeding apparatus. Organisms Diversity & Evolution. 15 (3): 609–618.
Torres, C. R; Ogawa, L. M; Gillingham, M. AF; Ferrari, B.; van Tuinen, M. (2014): A multi-locus inference of the evolutionary diversification of extant flamingos (Phoenicopteridae). BMC Evolutionary Biology. 14 (36): 36.
Torres, C.R., van Tuinen, M. (2016): The evolution of flamingos. In: Anderson, M. (Hrsg): Flamingos, Behavior, Biology and Relationships with Humans, Kapitel 2, S. 29-54. Nova Science Publishers
Tuinen, V.; Butvill, M.; Kirsch, D.B.; Hedges, S.B. (2001): Convergence and divergence in the evolution of aquatic birds. Proc. R. Soc. B. 268 (1474): 1345–1350.
Veron, G., Winney, B. J. (2000): Phylogenetic relationships within the turacos (Musophagidae). Ibis 142, 446-456.
Wheatcroft, D. (2009): Co-evolution: A Behavioral ‘Spam Filter’ to Prevent Nest Parasitism. Current Biology. 19 (4): R170–R171.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a). Flamingos (Phoenicopteridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.phoeni1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b). Grebes (Podicipedidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c). Bustards (Otididae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.otidid1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d). Turacos (Musophagidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.musoph1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020e). Cuckoos (Cuculidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.cuculi1.01
Worthy, T.H.; Tennyson, A.J.D.; Archer, M.; Scofield, R.P. (2010): First record of Palaelodus (Aves: Phoenicopteriformes) from New Zealand. Records of the Australian Museum. 62 (1): 77–88.
Wu, S. et al. (2024): Genomes, fossils, and the concurrent rise of modern birds and flowering plants in the Late Cretaceous. Proceedings of the National Academy of Sciences. 121 (8).
Zelenkov, N. V. (2013): Cenozoic phoenicopteriform birds from Central Asia. Paleontological Journal. 47 (11): 1323–1330.
Zelenkov, N. V. (2015): A Primitive Grebe (Aves, Podicipedidae) from the Miocene of Eastern Siberia (Lake Baikal, Olkhon Island). Paleontological Journal. 49 (5): 521–529.



