Text als pdf
Neoaves
Die verwandtschaftlichen Beziehungen der modernen Vögel gelten als eine der größten Herausforderungen der Phylogenetik. Bei der enormen Artenfülle, sollte das nicht verwundern. Zum einen zeigt sich, besonders bei den Singvögeln, dass viele traditionell anerkannte Vogelfamilien tatsächlich paraphyletisch sind und in mehrere Familien aufgeteilt wurden. Zum anderen sind die phylogenetischen Verwandtschaftsbeziehungen zwischen den einzelnen Vogelordnungen nicht ganz klar. Ansätze zur Phylogenie der Neornithes wurden erstmals in den 1970er Jahren verwendet (Cracraft 1972). 1990 kam es mittels DNA-DNA-Hybridisierung zu einer ersten großen Phylogenie der Vögel, bei der über 1100 Arten untersucht wurden (Sibley & Ahlquist 1990). Seit den späten 1990er Jahren wurden in phylogenetischen Studien sowohl molekulare als auch morphologische Daten verwendet, um die Verwandtschaft der Neornithes zu analysieren (z. B. Mayr & Clarke 2003; Mayr et al. 2003; Cracraft et al. 2004; Ericson et al. 2006; Livezey & Zusi 2007; Hackett et al. 2008). Diese Studien stimmen in mehreren Bereichen überein, so in der Einteilung zwischen Palaeognathae und Neognathae. Die Neognathae teilen sich wieder in die Galloanserae, welche die Gänse- und Entenvögel ausmachen, sowie die Neoaves, den Rest der Vögel. Die Palaeognathae und Galloanserae lernten wir in den letzten beiden Episoden kennen. Die Beziehungen innerhalb der Neoaves sind hingegen komplizierter. Verschiedene Publikationen sind in den letzten Jahren erschienen, welche die verwandtschaftlichen Beziehungen der Neoaves untersuchten (Jarvis et al. 2014, Prum et al. 2015, Reddy et al. 2017, Suh 2016, Braun & Kimball 2021, Kuhl et al. 2021, Houde et al. 2019; Wu et al. 2024, Stiller et al. 2024, Gatesy & Springer 2022, Mirarab et al. 2024; einige Phylogenien werden in Abb. 1-5 gezeigt). All diese Studien kommen zu verschiedenen Ergebnissen, besonders an der Basis der Neoaves, also welche Gruppen sich als früheste abspalteten, und welche der Großgruppen näher miteinander verwandt sind, während andere Studien (Suh 2016, Braun & Kimball 2021) andeuten, dass die verwandtschaftlichen Verhältnisse zwischen den einzelnen Großgruppen der Neoaves nicht geklärt sind (Abb. 4).
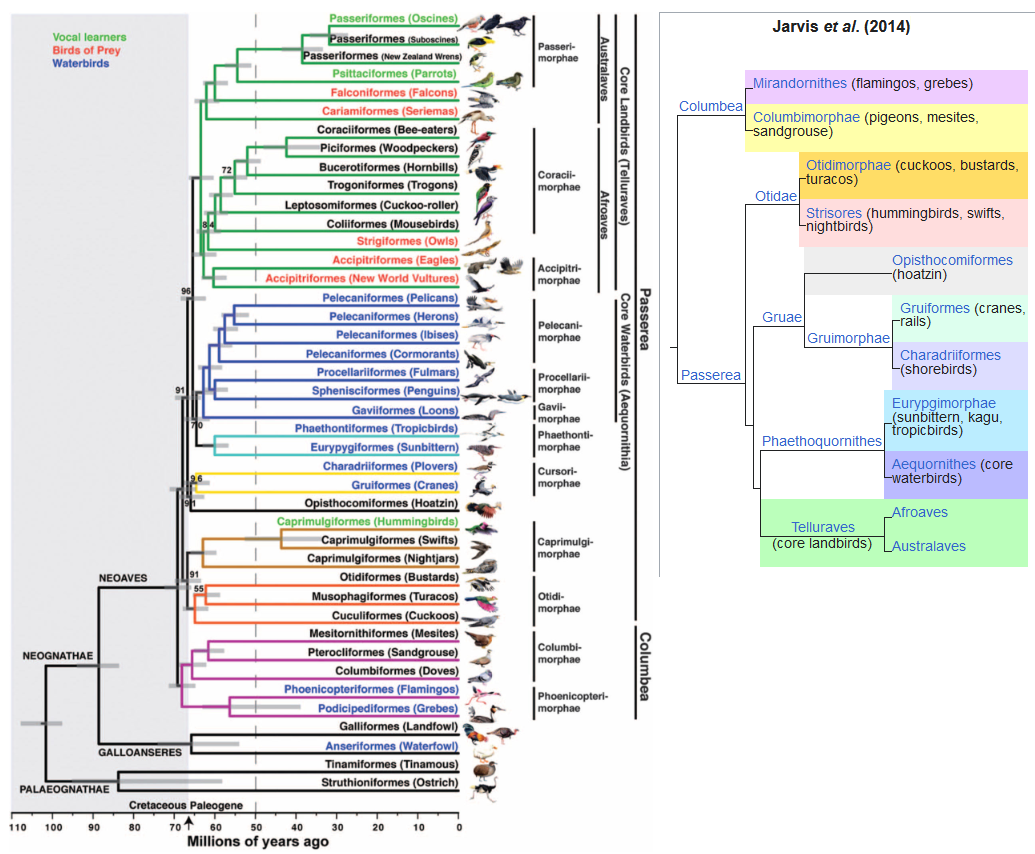
Abb. 1: Phylogenie der modernen Vögel nach Jarvis et al. 2014 (mit vereinfachter Darstellung der Neoaves auf der rechten Seite).
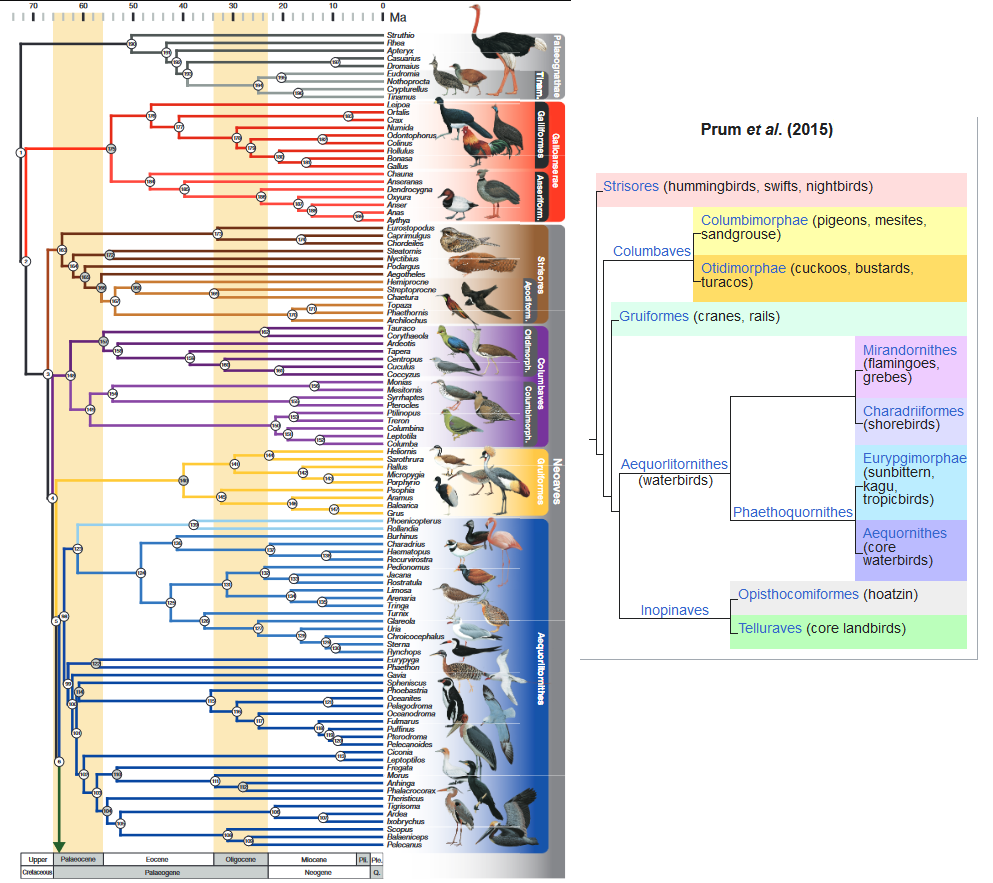
Abb. 2: Phylogenie der modernen Vögel nach Prum et al. 2015 (mit vereinfachter Darstellung der Neoaves auf der rechten Seite).
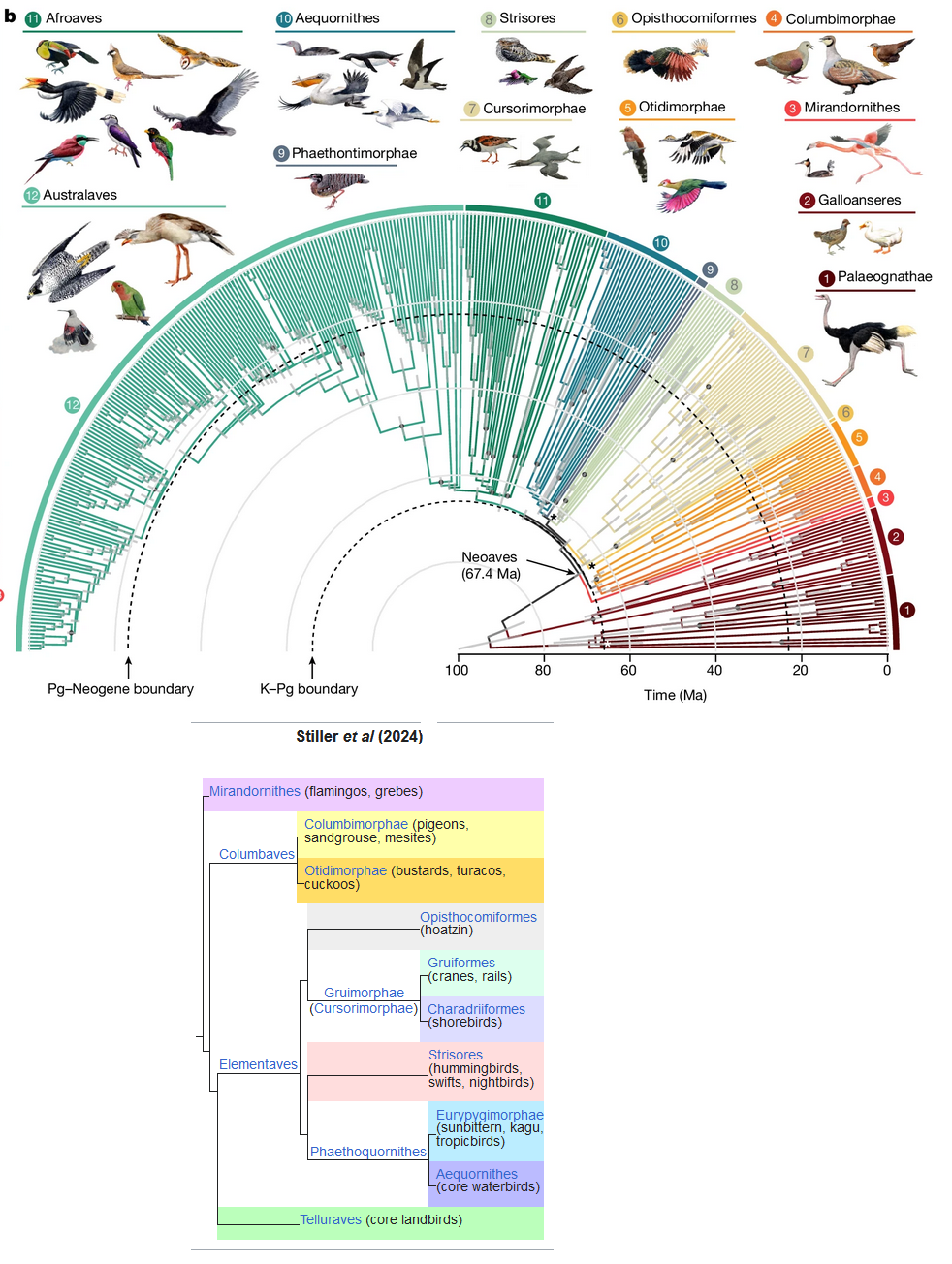
Abb. 3: Phylogenie der modernen Vögel nach Stiller et al. 2024 (mit vereinfachter Darstellung der Neoaves auf der unteren Seite).
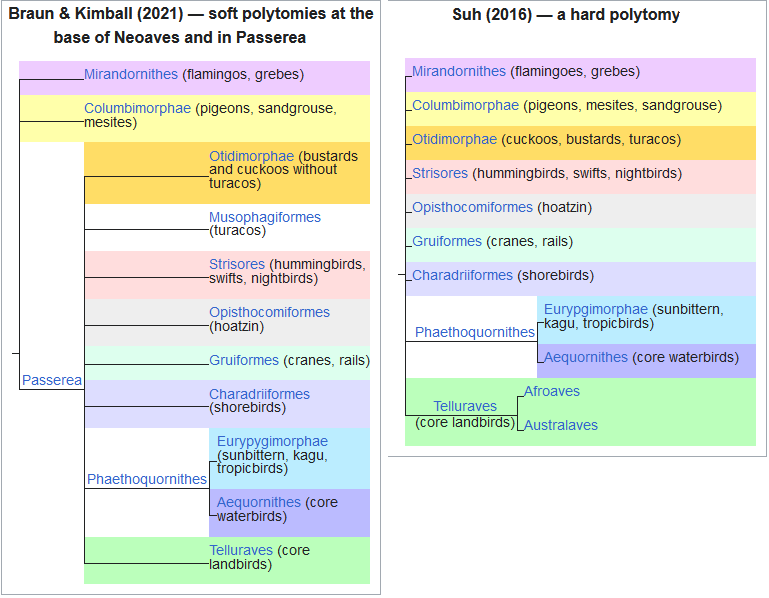
Abb. 4: Phylogenie der modernen Vögel nach Braun & Kimball (2021) und Suh (2016), die andeuten, dass die verwandtschaftlichen Verhältnisse zwischen den einzelnen Großgruppen der Neoaves nicht geklärt sind.
Trotz der Unstimmigkeiten sind sich diese Studien über eine Reihe übergeordneter Gruppen einig. Es handelt sich um insgesamt 10 Großgruppen innerhalb der Neoaves (vgl. Reddy et al. 2017, Abb. 5):
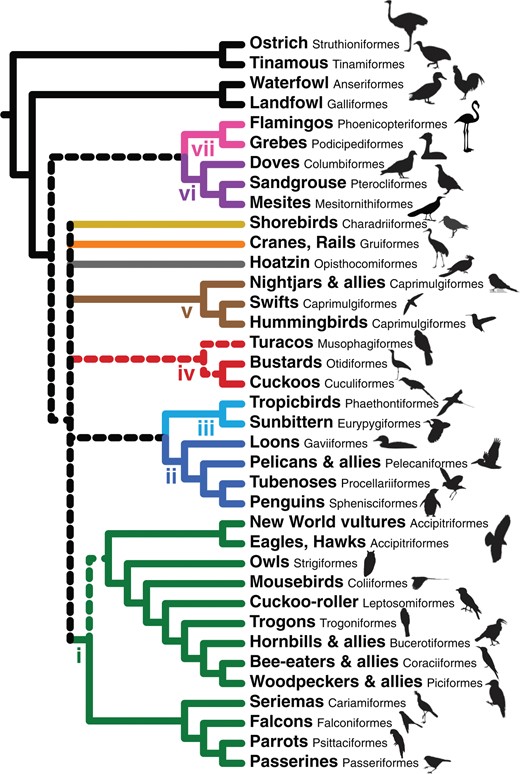
Abb. 5: Die zehn Großgruppen der Neoaves nach Reddy et al. (2017) im Stammbaum der modernen Vögel sind farblich unterlegt. Sieben Großgruppen werden als die „magnificent seven) bezeichnet und sind mit römischen Ziffern markiert: i) Telluraves, ii) Aequornithes, iii) Eurypygimorphae, iv) Otidimorphae, v) Strisores, vi) Columbimorphae, vii) Mirandornithes. Die meisten Studien stimmen in Bezug auf die Beziehungen innerhalb dieser sieben Gruppen weitgehend überein (eine Ausnahme hier würden die Turakos sein, die bei einigen Studien nicht zu den Otidimorphae gezählt werden). Die drei anderen Ordnungen sind die Opisthocomiformes, Charadriiformes und Gruiformes.
- Telluraves: das sind die Landvögel und sie machen die größte Gruppe aus. Hier finden sich u. a. die Greifvögel, Falken, Papageien, Spechte, Nashornvögel und sie verschiedenen Gruppen der Singvögel.
- Aequornithes: hier finden sich verschiedene Wasservögel: Albatrosse, Pinguine, Pelikane, Kormorane, Störche, Ibisse und Reiher.
- Eurypygimorphae: hierbei handelt es sich um eine kleine Gruppe, die aus den südamerikanischen Sonnenrallen, dem Kagu aus Neukaledonien und den Tropikvögeln, einer kleinen Familie, welche tropische Meeresküsten bewohnen, bestehen. Die meisten Studien sehen sie als Schwestergruppe der Aequornithes.
- Otidimorphae: hierzu gehören die Turakos, Trappen und Kuckucke, wobei einige Studien die Kuckucke (Kuhl et al. 2021) oder die Turakos (Braun & Kimball 2021) nicht in diese Gruppe einordnen.
- Strisores: hierzu zählen die Nachtschwalben, Mauersegler, Kolibris und ihre Verwandten
- Columbimorphae: hierzu zählen die Tauben, Flughühner und die madagassischen Stelzenrallen.
- Mirandornithes: zu dieser kleinen Klade gehören die Flamingos und die Lappentaucher.
- Opisthocomiformes, welche nur den Hoatzin als einzigen Vertreter haben.
- Gruiformes, welche die Kraniche und Rallen vereinen.
- Charadriiformes, hierzu zählen die verschiedenen Watvögel, Möwen und Alke.
Wir werden uns nach diesen Gruppen orientieren und einen Überblick über ihre biologische Vielfalt und deren Evolutionsgeschichte geben. In dieser Episode lernen wir drei etwas kleinere Gruppen kennen: die Opisthocomiformes, die Eurypygimorphae und die Gruiformes.
Opisthocomiformes
Der Hoatzin (Opisthocomus hoazin, Abb. 6) gehört wohl zu den herausragendsten lebenden Vögeln des tropischen Südamerikas. Er kommt vor allem in der Ufervegetation des Amazonas- und Orinoko-Beckens vor und erinnert äußerlich an einige hühnerartige Vögel. Hoatzins sind obligate Blattfresser (Winkler et al. 2020a, Del Hoyo et al. 1996, Del Hoyo 2020).

Abb. 6: Hoatzin
Die Nahrung besteht zu 82 % aus grünen Blättern, zu 10 % aus Blüten und 8 % aus Früchten. Es handelt sich um eine nährstoffarme und oft toxische Nahrung. Mit Hilfe seiner Bakterienflora verdaut der Hoatzin die Nahrung in besonderer Effizienz. Die Bakterien sorgen hier auch für den Abbau der in den Nahrungspflanzen enthaltenen Gifte. Die Verdauungszeit beträgt insgesamt 24 bis 48 Stunden, was erheblich länger als bei jedem anderen Vogel. Die Verdauung des Hoatzins findet nicht im Magen statt, sondern im Kropf und in der unteren Speiseröhre. Dieser Bereich ist so voluminös, dass er den Magen um ein Fünfzigfaches an Größe übertrifft (Abb. 7). Dieser Platzbedarf führte zu einer Verkleinerung des Brustbeinkiels und einer Verlagerung der Brustmuskeln nach caudal (in Richtung Schwanz). Diese anatomischen Besonderheiten machen den Hoatzin zu einem schlechten Flieger. Die Beine sind zwar kräftig und voll entwickelt, wird aber zur Fortbewegung kaum benutzt. Meistens kriechen und schieben sie sich auf eine unbeholfen wirkende Weise, die für Vögel sehr ungewöhnlich ist, durch das Geäst vorwärts. Der Name Stinkvogel, wie der Hoatzin auch genannt wird, bezieht sich auf den Geruch, der dem Vogel nachgesagt wird (Grajal et al. 1989, Grajal 1995, Del Hoyo et al. 1996, Godoy-Vitorino et al. 2008, 2011, Wright et al. 2009).
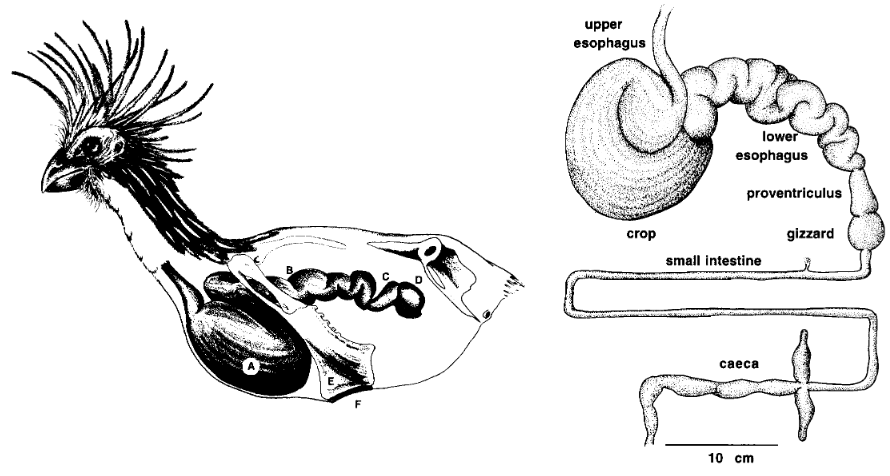
Abb. 7: Verdauungssystem des Hoatzins. Links: Schematische Darstellung des Verdauungssystems eines erwachsenen Hoatzins von links aus gesehen, mit (A) Kropf, (B) hinterer Speiseröhre, (C) Proventriculus und (D) Muskelmagen. Das vordere Brustbein ist stark reduziert, um Platz für die großen Gärkammern zu schaffen, was zu einer drastischen Verringerung der Fläche führt, die für die Befestigung der Flugmuskeln an der (E) Carina sternalis zur Verfügung steht; (F) “Ruhekissen” am Ende des Brustbeins, das beim Sitzen mit vollem Kropf verwendet wird. Rechts: Die einzigartige Form und Funktion des Verdauungstrakts der Hoatzin ähnelt mehr dem von Säugetieren mit Vormagengärung als bei allen bekannten Vögeln. Der Inhalt des vergrößerten muskulösen Kropfes und der unteren Speiseröhre wiegt bis zu 17,7 % der Gesamtmasse des erwachsenen Tieres. Die Innenauskleidung des Kropfes weist tiefe Rillen auf, die die Absorptionsfläche vergrößern. Darüber hinaus verzögert die stark sackartige Speiseröhre die Passage von Partikeln in den unteren Darm wirksam. Die paarigen Zäkum sind möglicherweise wichtige Orte für die mikrobielle Vitaminproduktion sowie für das Recycling und die Absorption von Stickstoff, Ionen und Wasser.
Eine weitere Besonderheit zeigen die Jungvögel: Sie haben sichtbare Krallen an den Flügeln. Diese Krallen sind die Enden des zweiten und dritten Fingers und ragen als kleine gerundete Haken aus den Flügeln heraus. Wenn Gefahr droht, verlassen Hoatzin-Küken das Nest und springen ins Wasser. Die Jungen sind schwimm- und tauchfähig. Anschließend erklettern sie wieder den Baum ihrer Eltern, wobei ihnen die Krallen an den Flügeln behilflich sind (Parker 1891, Thomas 1996, Abb. 8).

Abb. 8: Zeichnung eines jungen Hoatzins im Daunenkleid; sichtbar sind die Krallen an den Flügeln.
Die Verwandtschaft des Hoatzins ist viel diskutiert worden und es gibt keinen Konsens. Obwohl die afrikanischen Turakos (Musophagiformes) einige Ähnlichkeiten im Skelett aufweisen (Hughes & Baker 1999), ist eine Verwandtschaft zwischen beiden Anhand molekularer Daten nicht bestätigt (Sorenson et al. 2003). Die meisten molekularen Datensätze stellen die Hoatzins in die Verwandtschaft der Kraniche (Gruiformes) (Ericson et al. 2006; Hackett et al. 2008; Jarvis et al. 2014), andere sehen sie als Schwestergruppe der Telluraves (Prum et al. 2015) oder Strisores (Kuhl et al. 2021). Bislang wurden keine morphologischen Beweise zur Unterstützung einer dieser neuen molekularen Phylogenien vorgelegt.
In der Zwischenzeit sind einige Fossilien aus der Hoatzin-Verwandtschaft entdeckt worden, von denen einige unerwartete Einblicke in die Evolutionsgeschichte dieser Vögel gewähren. Zu den neuen Fossilien gehört der früheste südamerikanische Nachweis: Hoazinavis aus dem Oligo-Miozän des südöstlichen Brasiliens, der in einem Gebiet gefunden wurde, in dem Hoatzine heute ebenfalls nicht vorkommen (Mayr 2016, Mayr et al. 2011, Abb. 9). Hoazinavis ist kleiner als der heutige Hoatzin, aber die bekannten Knochen sind ansonsten sehr ähnlich und deuten darauf hin, dass südamerikanische Hoatzine in den letzten 22-24 Millionen Jahren nur wenige morphologische Veränderungen erfahren haben. Dass Hoatzine auch außerhalb der Neuen Welt eine lange Evolutionsgeschichte hatten, zeigen Fossilien von Protoazin aus dem späten Eozän von Frankreich (Mayr & De Pietri 2014). Ein weiterer fossiler Hoatzin mit einer ebenso unerwarteten geografischen Verbreitung ist Namibiavis aus dem frühen Miozän Namibias, der durch Oberarmknochen und Rabenbeinen mehrerer Individuen vertreten ist (Abb. 9). Diese Knochen ähneln denen des etwa gleichaltrigen südamerikanischen Hoazinavis, unterscheiden sich aber in einigen plesiomorphen Merkmalen, die darauf hindeuten, dass Namibiavis das Schwestertaxon einer Klade ist, die Hoazinavis und den heutigen Hoatzin umfasst (Mayr et al. 2011, Mourer-Chauvire 2003). Ein Tarsometatarsus, der jenen heutiger Hoatzine ähnlich ist, wurde in Kenia entdeckt und dessen Morphologie zeigt, dass die frühen Opisthocomifomes Afrikas Baumbewohner waren (Mayr 2014).

Abb. 9: Hoazinavis und Namibiavis
Die Oberarmknochen von Hoazinavis und Namibiavis ähneln denen des heutigen Hoatzins, insbesondere was die Form des niedrigen deltopectoralen Kammes betrifft (Abb. 10). Dies deutet darauf hin, dass diese frühen Hoatzine, wie ihre heutigen Verwandten, nur begrenzt fliegen konnten. Da die Morphologie de Oberarmknochens des heutigen Hoatzins funktionell mit seinem großen Kropf korreliert, könnte die Stammgruppe Opisthocomiformes ebenfalls bereits einen spezialisierten Verdauungstrakt besessen und eine ähnliche Ernährung, die überwiegend aus Blättern besteht, besessen haben (Mayr et al. 2011).
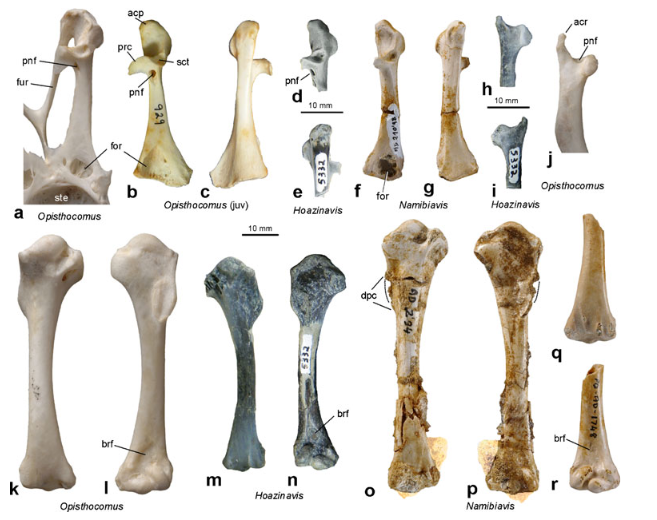
Abb. 10: Knochen von Hoazinavis lacustris gen. et sp. nov. und Namibiavis senutae im Vergleich zu Opisthocomus hoazin. a-c Rechte Coracoidea von adultem (a) und juvenilem (b, c) O. hoazin. d, e Rechtes omales Ende des Coracoides von Hoazinavis lacustris (Holotyp, MHNT-VT 5332) in dorsaler (d) und ventraler (e) Ansicht. f, g Rechtes Coracoid von N. senutae (Holotyp, GSMME AD 210′98) in dorsaler (f) und ventraler (g) Ansicht. h, i Rechtes kraniales Ende der Scapula von Hoazinavis lacustris (Holotyp, MHNT-VT 5332) in lateraler (h) und medialer (i) Ansicht. j Rechtes kraniales Ende des Schulterblattes von O. hoazin. k, l Linker Humerus von O. hoazin in kaudaler (k) und kranialer (l) Ansicht. m, n Rechter Humerus von Hoazinavis lacustris (Holotyp, MHNT-VT 5332) in kaudaler (m) und kranialer (n) Ansicht. o, p Linker Humerus von N. senutae (GSMME AD 2′94) in kaudaler (o) und kranialer (p) Ansicht; die gestrichelten Linien zeigen den rekonstruierten Verlauf des Deltopectoralkamms, die am distalen Ende anhaftende Matrix wurde digital eingefärbt und aufgehellt. q, r Distaler rechter Humerus von N. senutae (GSMME PQ AD 1748) in kaudaler (q) und kranialer (r) Ansicht. Gleicher Maßstab für alle Knochen außer d, e, h und i. Scapula und Coracoid von Hoazinavis wurden mit Ammoniumchlorid beschichtet. Abkürzungen: acp acrocoracoid process, acr acromion, brf brachial fossa, dpc deltopectoral crest, foramen in sternal end of coracoid, fur furcula, pnf pneumatic foramen, prc procoracoid process, sct scapular cotyla, ste sternum.
Der Nachweis von Hoatzin-Fossilien auf beiden Seiten des Südatlantiks ist von besonderem biogeografischem Interesse, da die Trennung von Südamerika und Afrika bereits in der mittleren Kreidezeit, also vor etwa 100 Mio. Jahren, vollzogen wurde (Smith et al. 1994), und die Verbreitung der Opisthocomiformes der Stammgruppe daher eher das Ergebnis von Dispersion als Vikarianz ist. Vikarianz beschreibt die Trennung einer Population in zwei oder mehr durch Isolation – in dem Fall Kontinentaldrift. Dispersion bedeutet, dass eine Teilpopulation durch Ausbreitung neue Regionen besiedelt. Vögel haben weitaus bessere Ausbreitungsmöglichkeiten als flugunfähige Tiere, aber selbst kleine Gewässer stellen für so schlechte Flieger wie die Hoatzins unüberwindbare Verbreitungsbarrieren dar. Mit mehr als 1.000 Kilometern Luftlinie war die Mindestentfernung zwischen Südamerika und Afrika im frühesten Känozoikum zu groß für eine aktive Ausbreitung einer Stammgruppe von Hoatzins (Abb. 11). Daher wurde die Hypothese aufgestellt, dass die transatlantische Ausbreitung der Hoatzins möglicherweise durch Flöße auf schwimmenden Vegetationsinseln zurückzuführen ist, was auch für die Vorfahren der neotropischen Nagetiere und Primaten zutrifft (Mayr et al. 2011). Geeignetes Treibgut wird in die von der Mündung großer Flüsse in die Ozeane geschwemmt und kann große Dimensionen erreichen. Da Hoatzine Uferbewohner sind, sind sie geeignete Kandidaten für solch eine Art der Ausbreitung. Weil eine Reise nach Westen auf einer schwimmenden Vegetationsinsel aufgrund der damaligen Strömungen begünstigt wurde, gilt die Ausbreitung von Stamm-Opisthocomiformes von Afrika nach Südamerika als sehr wahrscheinlich (Mayr et al. 2011).
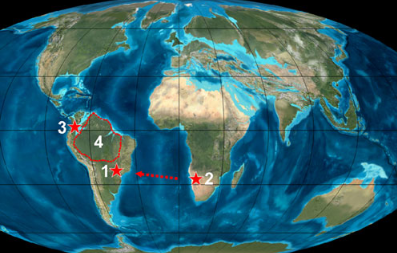
Abb. 11: Paläokarte der Kontinente im frühen Oligozän (35 Mio. Jahre). Sternchen kennzeichnen Fundorte von Hoazinavis lacustris gen. et sp. nov. (1), Namibiavis senutae (2) und Hoazinoides magdalenae (3). Das Verbreitungsgebiet von Opisthocomus hoazin (4) ist durch die gestrichelten Linien gekennzeichnet. Der Pfeil zeigt die vermutete Ausbreitungsrichtung der Hoazinoiden an.
Eurypygimorphae
Die Eurypygimorphae sind eine kleine Gruppe, welche drei Familien umfassen: die Tropikvögel, die Sonnenrallen und die Kagus (Mayr et al. 2023, Jarvis et al. 2014, Tamaki et al. 2013, Kennedy & Spencer 2004, Mikhailov 1995, Ericson et al. 2006, Hackett et al. 2008, Prum et al. 2015). Ihre verwandtschaftlichen Verhältnisse wurden erst durch Genomanalysen ermittelt. Früher wurden diese Familien in andere Ordnungen gestellt: die Tropikvögel in die Pelikanverwandtschaft, Sonnenrallen und Kagus wurden hingegen zu den Kranichvögeln gezählt.
Tropikvögel (Phaethontidae)
Tropikvögel (Phaethontidae) umfassen drei sehr eng miteinander verwandte Arten, die als Seevögel tropische Ozeane bewohnen (del Hoyo 2020, Winkler et al 2020b, Abb. 12). Die Vögel sind schlank und größtenteils weiß, Kopf und Flügel sind schwarz gezeichnet. Sie erinnern entfernt an Möwen oder Seeschwalben, sind aber mit diesen nicht näher verwandt. Auffallend sind die zwei mittleren Schwanzfedern, die manchmal mehr als körperlang sind. Bei zwei der drei Arten sind diese Federn weiß, beim Rotschwanz-Tropikvogel leuchtend rot. Sie spielen bei der Balz eine Rolle, vielleicht auch als Hilfen zum Halten des Gleichgewichts im Flug.

Abb. 12: Tropikvögel
Die Beine sind kurz und setzen weit hinten am Körper an. Da die Füße auch noch sehr klein sind, bewegen sich Tropikvögel an Land sehr unbeholfen. Dabei schieben sie ihren Bauch über den Grund und können nur kurze Strecken zurücklegen. Der Schnabel ist groß, schlank und spitz; er ist leuchtend rot oder gelb gefärbt. Zwischen ihren Zehen befinden sich Schwimmhäute. Sie ernähren sich als Stoßtaucher von Fischen und anderen Meerestieren. Der Rotschwanz-Tropikvogel (Phaethon rubricauda) ist über dem Indischen und Pazifischen Ozean zu finden, die anderen beiden Arten (P. lepturus und P. aethereus) sogar über allen drei Ozeanen. Bevorzugt wird eine Wassertemperatur zwischen 24 und 30 °C. Die Tiere brüten auf tropischen Inseln, wo sie kleine Kolonien mit wenig sozialer Interaktion bilden. Der Brut geht ein spektakulärer Balzflug voraus. Hierzu sammeln sich zunächst mehrere Tropikvögel einer Kolonie und fliegen laut rufend in der Nähe der Brutplätze auf und ab. Wenn sich ein Paar gefunden hat, löst es sich von den anderen. Die Partner steigen gemeinsam in große Höhe auf, um synchron bis zu einige hundert Meter abwärts zu gleiten. Dabei fliegt typischerweise ein Partner direkt über dem anderen und senkt die Flügel, während der untere seine Flügel hebt. So berühren sich die Flügelspitzen nahezu. Außerdem werden oft die verlängerten Schwanzfedern abwärts gebogen, sodass sie den Partner berühren, oder sie werden hin und her geschwenkt. Die Partner tauschen bei den Sinkflügen oft die Rollen. In der Regel legen sie nur ein Ei, die aber sehr variabel sein können: es gibt weiße, graue, braune oder rote Eier, manche einfarbig, andere gepunktet oder gefleckt (Ismar et al. 2011, Nunes et al. 2013, 2017, Orta et al. 2017, 2018, Marchant & Higgins 1990, Boland et al. 2004, Abb. 13).

Abb. 13: oben links: Rotschwanztropikvogel mit Jungvogel, oben rechts: balzende Rotschwanztropikvögel. Unten links: am Boden befindlicher Weißschwanztropikvogel, unten rechts. Ei eines Rotschnabel-Tropikvogels.
Tropikvögel sind eine sehr alte Vogelfamilie. Die Gattungen Lithoptila und Prophaethon tauchten bereits im Paläozän und Eozän auf, allerdings wurde gelegentlich bezweifelt, dass es sich hierbei wirklich um echte Tropikvögel handelte; zumindest ist es üblich geworden, die Gattung in einer eigenen Familie Prophaethontidae abzutrennen (Mlikovsky 1996, Bourdon et al. 2005, 2008, Mayr 2009, 2015g, 2016, Andrews 1899). Der älteste zweifelsfreie Tropikvogel stammt aus dem Miozän Australiens und gehört der ausgestorbenen Gattung Heliadornis an. Diese Gattung wurde auch in Europa gefunden, war also offenbar sehr weit verbreitet (Olson 1985b; Olson & Walker 1997, Mayr 2015).
Kagus (Rhynochetidae) und Sonnenrallen (Eurypygidae)
Kagus (Rhynochetidae)
Kagus (Rhynochetidae) und Sonnenrallen (Eurypygidae), beide Familien jeweils durch eine Art vertreten, werden als Eurypygiformes zusammengefasst (Ericson et al. 2006, Oliveira et al. 2015, Fain & Houde 2004). Der Kagu (Rhynochetos jubatus) ist ein etwa entengroßer, flugunfähiger Vogel, der auf der Insel Neukaledonien endemisch ist (del Hoyo 2020, del Hoyo et al. 1996, Winkler et al. 2020c, Theuerkauf et al. 2009, 2017, 2021, Salas & Letocart 1997 Abb. 14). In der Gestalt entfernt taubenähnlich, aber mit einem im Vergleich zu Tauben viel längeren Schnabel und langen Beinen ausgestattet, wurde er ursprünglich in der Ordnung der Kranichvögel zugeordnet, was durch molekularbiologische Untersuchungen jedoch nicht unterstützt wird. Ein Schwestergruppenverhältnis zwischen Sonnenralle und Kagu wurde inzwischen auch in weiteren Studien bestätigt (Fain & Houde 2004, Hackett et al. 2008, Ericson et al. 2006). Einige Merkmale sind im gesamten Vogelreich einmalig. Dazu gehören die äußeren Klappen über den Nasenlöchern und die ungewöhnliche Zusammensetzung des Blutes, das viel weniger Erythrozyten mit einem extrem viel höheren Hämoglobinanteil pro Erythrozyt enthält als das Blut aller anderen darauf analysierten Vögel (del Hoyo et al. 1996). Kagus sind reine Fleischfresser und ernähren sich von Eidechsen, Würmern, Schnecken, Insekten, Spinnen und Tausendfüßern. Bemerkenswert ist, dass er auch solche Tausendfüßer nicht verschmäht, die für andere Vögel wegen ihrer giftigen Absonderungen ungenießbar sind. Zur Nahrungssuche durchwühlt der Kagu mit dem Schnabel das Laub und das Erdreich.

Abb. 14: Kagu
Während der Kagu die einzige lebende Art seiner Familie ist, wurde eine größere Art, der Tiefland-Kagu (Rhynochetos orarius), aus subfossilen Überresten aus dem späten Holozän beschrieben (Balouet & Olson 1989). Da die Fundorte von R. orarius alle im Tiefland liegen und dort keine Fossilien von R. jubatus gefunden wurden, vermuteten die Wissenschaftler, die die Fossilien beschrieben, dass es sich um Hochland- bzw. Tieflandarten handelt. R. orarius ist eine von vielen Arten, die in Neukaledonien nach der Ankunft des Menschen ausgestorben sind (del Hoyo et al. 1996) Die Gültigkeit der Art wird von einigen Autoren in Frage gestellt (Theuerkauf & Gula 2018), von anderen jedoch akzeptiert (Balouet & Olson 1989, Steadman 2006).
Sonnenrallen Eurypygidae
Die Sonnenralle (Eurypyga helias) ist eine Vogelart aus den Tropen Lateinamerikas (del Hoyo 2020, del Hoyo et al. 1996, Winkler et al. 2020d, Abb. 15). Trotz ihres Namens ist sie mit den Rallen nicht näher verwandt. Auch die Sonnenralle wurde ursprünglich in die Ordnung der Kranichvögel gestellt. Eine Besonderheit stellen die Flügel dar: Wenn die Flügel geöffnet werden, wird auf den Schwungfedern ein auffälliges Fleckenmuster sichtbar, das aus jederseits zwei großen rostbraunen, hinten schwarz gesäumten Flecken auf gelblich-brauner Grundfarbe besteht. Dies erinnert ein wenig an die Augenflecken mancher Schmetterlinge und dient möglicherweise ähnlich wie bei diesen der Abschreckung von Feinden.
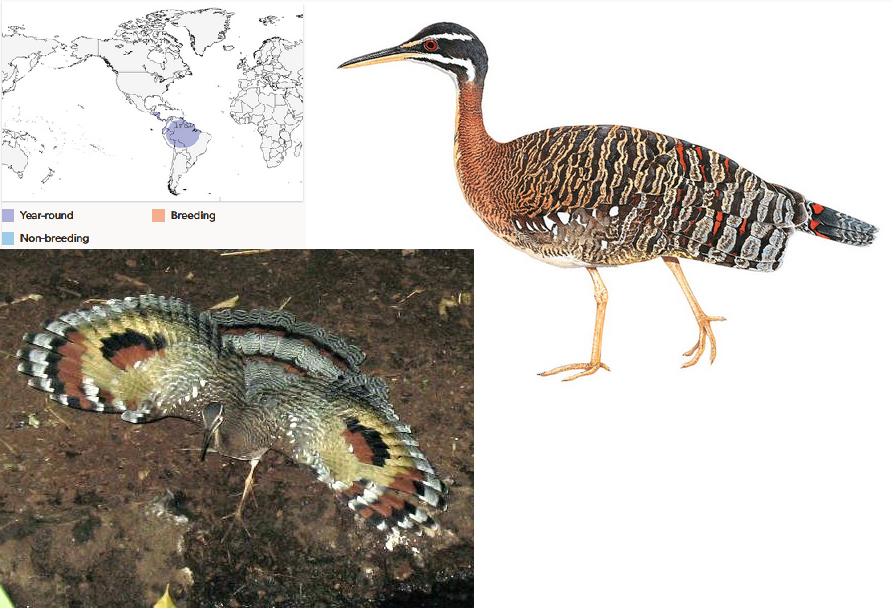
Abb. 15: Sonnenralle
Gruiformes – Kraniche und Rallen
Zu den Kranichvögeln wurden ursprünglich etwa 20 Vogelfamilien gerechnet, von denen die meisten jedoch in andere Ordnungen gestellt wurden, so auch die vorgestellten Kagus und Sonnenrallen. Heute werden folgende Familien in die Gruiformes gestellt (Abb. 16): Kraniche (Gruidae), Rallenkraniche (Aramidae), Trompetervögel (Psophiidae), die zu den Kranichverwandten (Gruoidea) gehören sowie die Rallen (Rallidae), Binsenrallen (Heliornithidae) und die Besenschwanzrallen (Sarothruridae), die zu den Rallenverwandten (Ralluoidea) zählen. Des Weiteren gibt es noch einige ausgestorbene Familien, die Messelrallen (Messelornithidae) und die Aptornithidae.

Abb. 16: Gruiformes
Messelrallen (Messelornithidae) und Aptornithidae
Messelrallen (Messelornithidae)
Die Messelrallen (Messelornithidae) sind eine ausgestorbene Familie rallenartiger Vögel, die vom Paläozän bis zum unteren Oligozän in Europa und Nordamerika vorkam. Mehrere Gattungen wurden beschrieben, von denen Messelornis aus der Grube Messel die bekannteste ist. Tatsächlich ist Messelornis das bei weitem häufigste Vogeltaxon in der früh-eozänen Fossilfundstelle Messel in Deutschland, wo Hunderte von Skeletten gefunden wurden; Messelornis ist auch in der früh-eozänen nordamerikanischen Green River Formation recht häufig (Mourer-Chavire 1995, Mayr 2004, 2009, 2016, Morlo 2004, Hesse 1990; Abb. 17). Bei ihrer Erstbeschreibung wurde angenommen, dass die Messelrallen nah mit dem neukaledonischen Kagu (Rhynochetos jubatus) und der südamerikanischen Sonnenralle (Eurypyga helias) verwandt sind (Livecey 1998). Heute geht man eher davon aus, dass sie die Schwestergruppe einer gemeinsamen Klade von Binsenrallen (Heliornithidae) und Rallen (Rallidae) sind (Mayr 2019, Boast et al. 2019).

Abb. 17: Messelornis
Aptornithidae
Die Aptornithidae, dessen einzige bekannte Gattung Aptornis ist, war ein flugunfähiger Vogel aus Neuseeland (Hamilton 1891, Worthy et al. 2011, Livezey 1994, Tennyson & Martinson 2006, Fain & Houde 2004). Insgesamt sind drei Arten beschrieben worden, die wahrscheinlich im 13. Jahrhundert durch Überjagung ausstarben. Ihre nächsten Verwandten innerhalb der Kranichvögel sind nach neuesten Untersuchungen die afrikanischen Besenschwanzrallen (Boast et al. 2019). Auch sie wurden ursprünglich in die Nähe der Kagus gestellt, die morphologischen Ähnlichkeiten sind aber eine Folge konvergenter Evolution.

Abb. 18: Aptornis
Kraniche (Gruidae)
Kraniche (Gruidae) sind heute mit 15 Arten fast weltweit verbreitet, sie fehlen in Südamerika und der Antarktis (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020e, Ellis et al. 1996, Krajewski et al. 2010, Abb. 19). Schwerpunkt der Vielfalt liegt in Asien und Afrika. Bevorzugter Lebensraum der Kraniche sind offene Landschaften wie die Tundra oder die Savanne. Viele Arten sind ans Wasser gebunden und kommen daher hauptsächlich in sumpfigen Habitaten vor. Kraniche sind große bis sehr große Vögel, die mit ihrem langen Hals und ihren langen Beinen äußerlich an Störche und Reiher erinnern. Mit einer Körperlänge zwischen 90 und 150 cm gehören sie zu den größten Vögeln überhaupt. Der Saruskranich (Antigone antigone) steht aufrecht vom Boden zur Scheitelspitze 176 cm hoch, höher als jeder andere flugfähige Vogel. Bekannt sind auch die Kronenkraniche, die mit zwei Arten auf dem afrikanischen Kontinent vorkommen. Den Kronenkranichen (Balearica) fehlt der Resonanzraum, der bei den echten Kranichen, zu denen alle anderen Kranicharten gehören durch die vergrößerte und gewundene Luftröhre gebildet wird. Weitere bekannte Kranicharten sind Mandschurenkranich (Grus japonensis), Paradieskranich (Anthropoides paradisea), der Graue Kranich (Grus grus), Nonnenkranich (Leucogeranus leucogeranus), Schreikranich (Grus americana) und der Kanadakranich (Antigone canadensis). Während einige Kranicharten in wärmeren Klimazonen Standvögel sind, sind solche in kälteren Klimazonen Zugvögel, die lange Strecken von mehreren tausend Kilometern überwinden müssen. Der Schneekranich (Leucogeranus leucogeranus) zieht aus dem äußersten Norden Sibiriens nach Iran, Indien und Südchina; manche Populationen des Kanadakranichs ziehen aus den arktischen Regionen Kanadas und Alaskas bis nach Florida und Mexiko. Kraniche ziehen in einer V-Formation in Höhen von etwa 2000 m, ausnahmsweise sogar 10.000 m. An einem Tag werden typischerweise 300 km, manchmal sogar 800 km zurückgelegt.
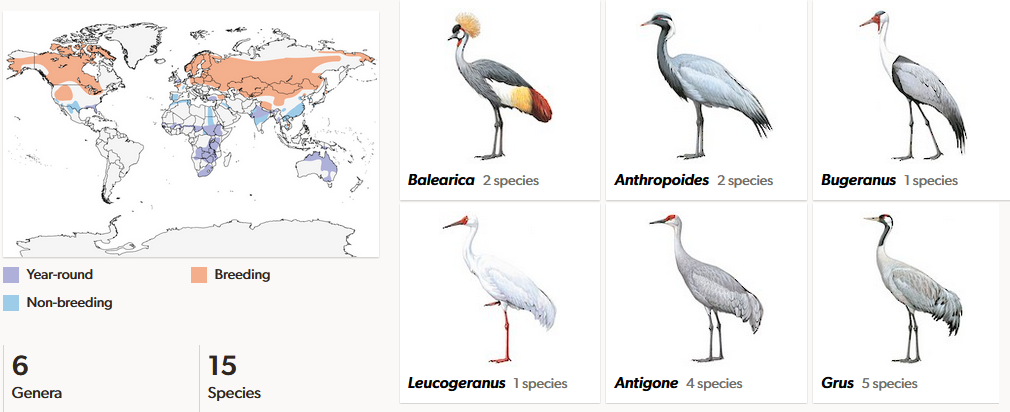
Abb. 19: Kraniche
Rallenkraniche (Aramidae)
Der Rallenkranich (Aramus guarauna) ist eine in den tropischen und subtropischen Bereichen Amerikas lebende Vogelart und einziges Mitglied seiner Familie Aramidae (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020f, Abb. 20). Der langbeinige Vogel frisst als Nahrungsspezialist vor allem Apfelschnecken. Sein Name rührt von seinem rallenähnlichen Verhalten und der sowohl Kranichen als auch Rallen ähnlichen Anatomie.
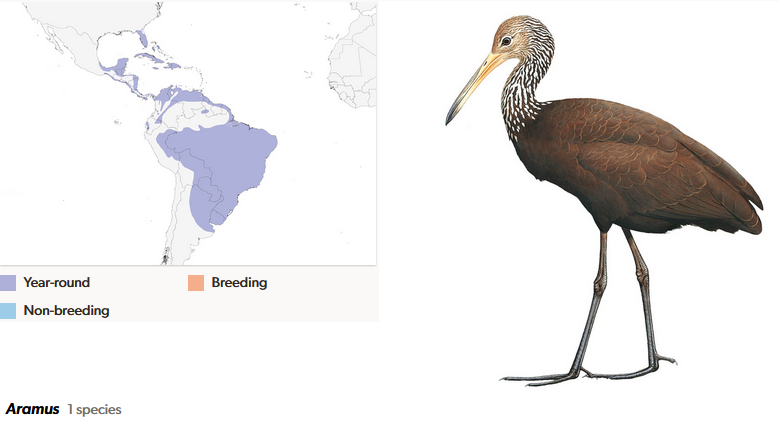
Abb. 20: Rallenkranich
Trompetervögel (Psophiidae)
Die Trompetervögel kommen mit drei Arten ebenfalls nur in Südamerika vor; einige unterscheiden sogar sechs Arten (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020g, Seddon et al. 2002, Sherman 1995, Sherman & Eason 1995, Oppenheimer & Silveira 2009, Ribas et al. 2011; Abb. 21). Als sehr ruffreudige Vögel verfügen Trompetervögel über eine ganze Reihe verschiedener Lautäußerungen. Der namensgebende Ruf der Trompetervögel klingt weniger wie eine Trompete, sondern ist eine Reihe grunzender, schnell hintereinander ausgestoßener, abgehackt klingender Laute. Die Vögel ernähren sind hauptsächlich von Früchten und sind eher Bodenbewohner mit kräftigen Beinen. Die drei Arten bewohnen verschiedene Regionen des Amazonasregenwaldes und ihre Verbreitungsgebiete überlappen sich nicht. Die Aufspaltung in drei Arten erfolgte vermutlich im Pleistozän, nachdem Populationen durch Änderungen von Flussläufen und regionales, klimatisch bedingtes Zurückweichen des Regenwaldes voneinander getrennt wurden.
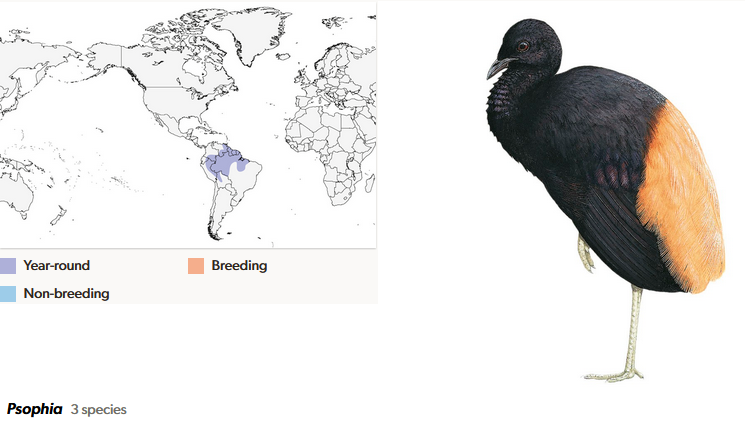
Abb. 21: Trompetervögel
Fossile Kraniche
Es gibt verschiedene Taxa aus dem frühen Paläogen, die vermutlich mit den Kranichen verwandt sind. Die phylogenetisch wahrscheinlich basalsten unter ihnen sind die Parvigruidae, zu denen Parvigrus (Abb. 22) und Rupelrallus aus dem frühen Oligozän Europas gehören (Mayr 2005, 2009, 2013, 2016). Parvigruidae sind mittelgroße Vögel mit rallenartigen Gliedmaßen und relativ kürzeren Beinen als die heutigen Kranichverwandten. Zu den Merkmalen, die sie mit den heutigen Gruoidea teilen, gehören ein stark verlängertes und schmales Brustbein sowie verknöcherte Sehnen entlang der Hintergliedmaßen, aber einige plesiomorphe Merkmale weisen auf eine Position außerhalb der Kronengruppe Gruppe Gruoidea hin (Mayr 2013b). Von den Rallenkranichen und Trompetervögeln sind kaum und nur fragmentarische Fossilien bekannt, deren phylogenetische Einordnung nicht sicher ist (Mayr 2009, 2016, Wetmore 1940, Rasmussen et al. 1997). Der Fossilbericht der Kraniche ist deutlich besser repräsentiert.
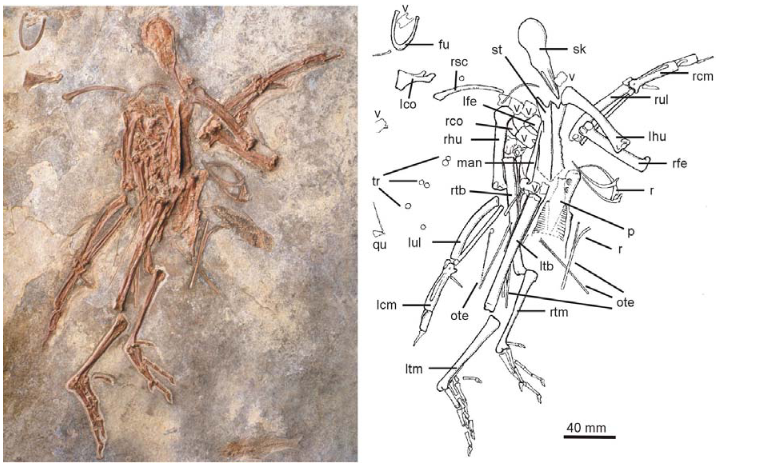
Abb. 22: Parvigrus
Die frühesten fragmentarischen Fossilien, genauer aus dem mittleren und späten Eozän Italiens und Englands, werden dem Taxon Palaeogrus zugeordnet (Mayr 2009, 2016). Die frühesten gut repräsentierten fossilen Kraniche stammen aus dem frühen und mittleren Miozän von Frankreich und Deutschland (Göhlich 2003). Diese Fossilien wurden ebenfalls zu Palaeogrus gezählt, sind aber wahrscheinlich näher mit der Kronengruppe der Kraniche verwandt als mit den Fossilien aus dem Eozän. Ein weiterer Kranich aus dem frühen Miozän von Deutschland, der nur von einem Oberarmknochen bekannt ist, wurde zu den Kronenkranichen gestellt (Mayr 2016). Die Ähnlichkeiten zwischen diesem frühen miozänen Kranich und der heute lebenden Kronenkranichen können durchaus plesiomorph sein, und eine endgültige Beurteilung der Verwandtschaft hängt von der Entdeckung von weiterem Material ab. Weitere Fossilien, die in die Verwandtschaft der Kronenkraniche zugeordnet werden, stammen aus dem Eozän und Miozän von Nordamerika (Probalearica, Aramornis; Olson 1985a). Eine ausgestorbene Art der Kronenkraniche, die durch vollständige Skelette gut vertreten ist, wurde aus dem späten Miozän von Nebraska beschrieben (Feduccia & Voorhies 1992). Kronenkraniche waren also früher wesentlich weiterverbreitet und dürften die ältesten Vertreter der Kraniche sein, da die anderen Kranichgattungen jüngeren Ursprungs sind und selbst Fossilien aus dem Pleistozän der Mittelmeerinsel Menorca einem sind als basale Vertreter der Klade identifiziert worden (Camusia; Seguí 2002). Außerhalb Europas und Nordamerikas, ist der Fossilnachweis von Kranichen sehr spärlich. Es gibt fragmentarische Funde in Usbekistan und Ägypten (Mayr & Zvonok 2011, Rasmussen et al. 1987).
Rallen (Rallidae)
Rallen (Rallidae) sind eine recht artenreiche Gruppe mit 155 Arten (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020h, Abb. 23). Davon sind aber mindestens 22 Arten seit dem Jahr 1500 ausgestorben. Einige bekannte Arten kommen auch in unseren Gewässern vor: das Blässhuhn (Fulica atra, Abb. 24) und das Teichhuhn (Gallinula chloropus; Abb. 24).
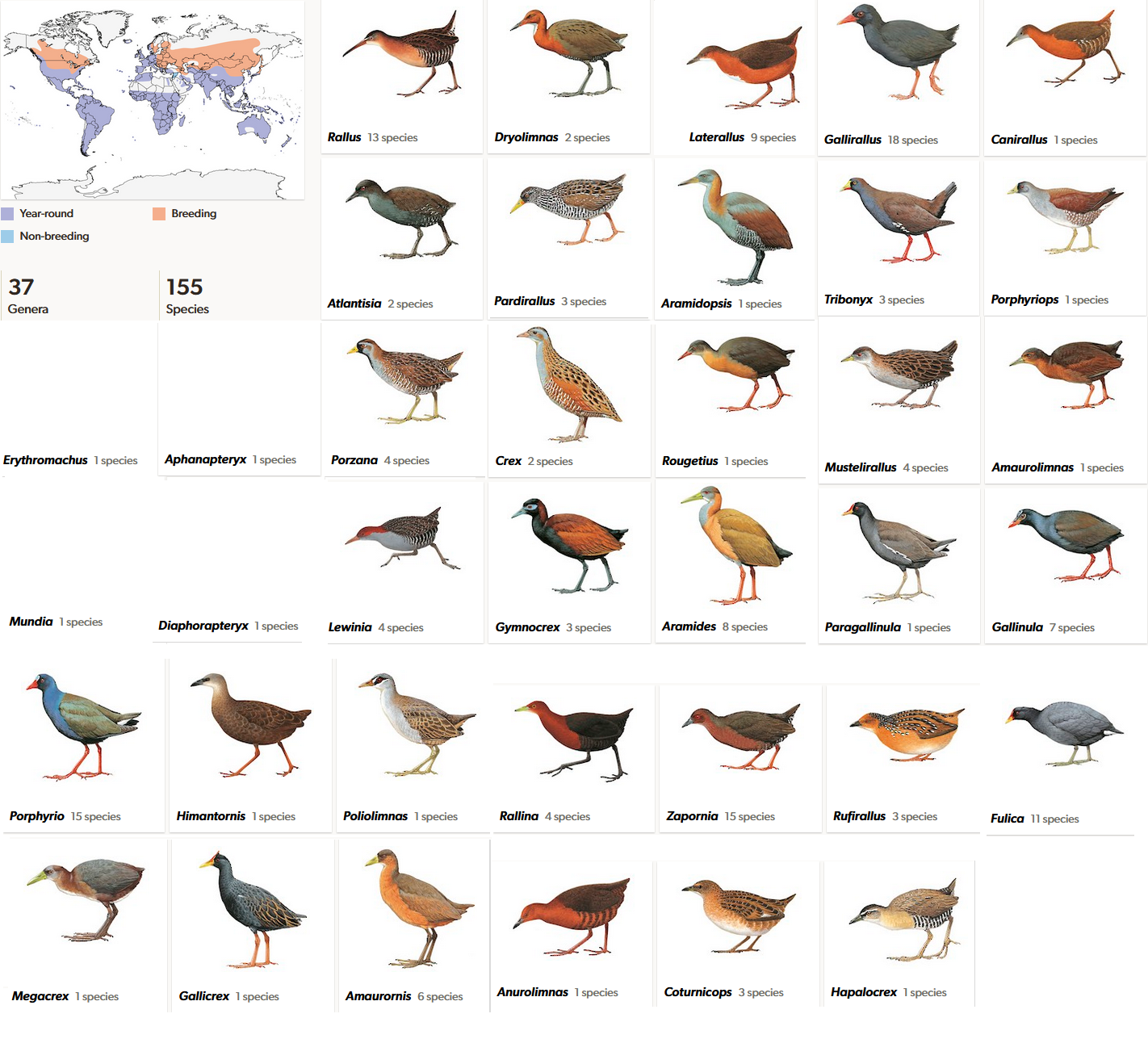
Abb. 23: Rallen

Abb. 24: Teichhuhn und Blässhuhn
Rallen sind kleine bis mittelgroße Bodenvögel, der Körper der Vögel ist schmal und wirkt zusammengedrückt. Die Wirbelsäule ist sehr beweglich, wodurch im Zusammenspiel mit den langen Zehen ihre Lebensweise als Schlüpfer in sehr dichter Vegetation auf oft wenig tragfähigem Untergrund ermöglicht wird. Die Größe liegt zwischen 12 cm und 63 cm, das Gewicht zwischen 20 g und 3 kg. Die kleinste Art ist die amerikanische Schieferralle (Laterallus jamaicensis, Abb. 25), die größte die neuseeländische Takahē (Porphyrio hochstetteri, Abb. 25) Die Schnabelformen sind in Anbetracht der unterschiedlichen Ernährungsgewohnheiten sehr variabel. Arten, die sich vorwiegend carnivor ernähren, haben meist relativ lange, spitze und schmale Schnäbel, die im letzten Drittel leicht nach unten gebogen sind; die Schnäbel sich bevorzugt omnivor oder vegetarisch ernährender Arten sind kürzer und kräftiger und zuweilen auch auffallend hoch. Die Nasenöffnungen vieler Rallen haben Klappen, die sich beim Eintauchen des Schnabels ins Wasser oder in das Substrat reflektorisch schließen. Die gut ausgebildeten Schleimzellen der Riechhöhle sowie das große Riechhirn deuten auf ein gut entwickeltes Geruchsvermögen der Rallen hin.

Abb. 25: Schieferralle und Takahe
Ungewöhnlich viele Rallenarten sind auf ozeanischen Inseln endemisch und haben dort ihre Flugfähigkeit verloren. Flugunfähig sind über 30 Arten, die allesamt Inselendemiten sind (Kirchman 2012), einige sind jedoch ausgestorben. Bei diesen ist die Flugmuskulatur im Laufe der Evolution verkümmert, da die Flugfähigkeit wegen der Abwesenheit von Prädatoren nicht mehr genutzt wurde. Erwähnenswert ist die Atlantisralle (Laterallus rogersi, Abb. 26), der kleinste flugunfähige Vogel der Welt; sie hat eine Körperlänge von 13 bis 15 cm.

Abb. 26: Atlantisralle
Viele Inselrallen sind flugunfähig, da sie auf kleinen Inseln ohne Raubsäugetiere keine Notwendigkeit haben, zu fliegen oder große Entfernungen zurückzulegen (Sayol et al. 2020, Palombo & Moncunill-Sole 2023, Nudds et al. 2010, Trewick 1997, Livezey 2003, Slikas et al. 2002, Kirchman 2012, Diamond 1991; Abb. 27). Der Flug ist sehr anstrengend, da die Kiel- und Flugmuskulatur bis zu 40 % des Vogelgewichts ausmacht. Durch die Reduzierung der Flugmuskulatur und die damit verbundene Verringerung des Stoffwechselbedarfs sinkt der Energieaufwand der flugunfähigen Ralle. Aus diesem Grund erleichtert die Fluglosigkeit das Überleben und die Besiedlung einer Insel, auf der die Ressourcen möglicherweise begrenzt sind (McNab 1994, 2002, McNab & Ellis 2006, Nudds & Davidson 2010, McCall et al. 1998).
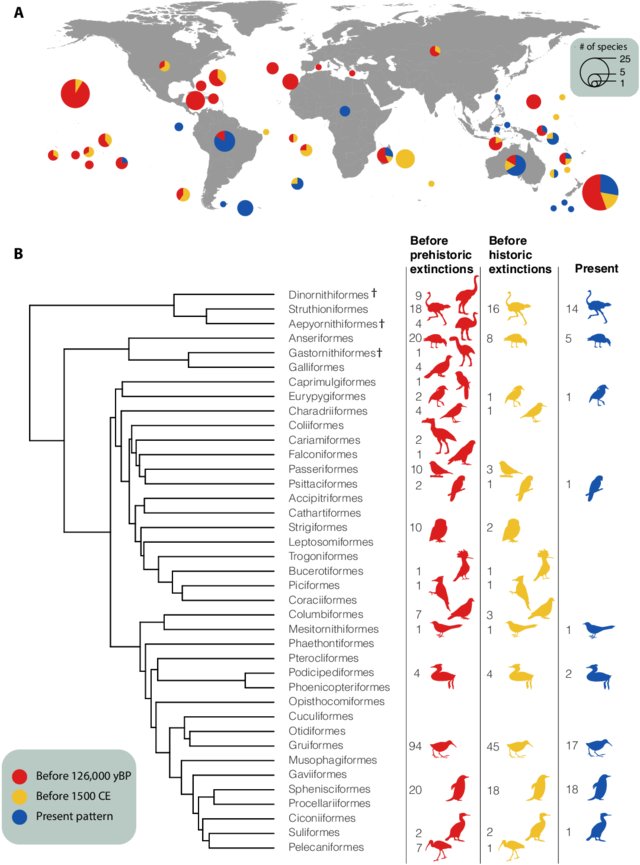
Abb. 27: Geografische und phylogenetische Verteilung der flugunfähigen Vögel im Laufe der Zeit. (A) Die globale Verteilung der flugunfähigen Arten wird durch die Lage der Kreise dargestellt, wobei die Fläche des Kreises die Gesamtvielfalt der bekannten flugunfähigen Arten pro Inselgruppe und Kontinent darstellt. Der Anteil dieser Vielfalt, der heute noch existiert, ist in blau dargestellt, der Anteil, der das historische Aussterben (d. h. nach 1500 n. Chr.) repräsentiert, in gelb, und der Anteil, der das prähistorische Aussterben (d. h. Spätpleistozän und Holozän bis 1500 n. Chr.) repräsentiert, in rot. (B) Die phylogenetische Verteilung der Fluglosigkeit zeigt einen Rückgang der Zahl der Ordnungen mit flugunfähigen Arten. Die Anzahl der lebenden flugunfähigen Arten für jede Ordnung ist für jeden Zeitabschnitt angegeben. Die Original-Silhouetten sind bei phylopic.org unter einer Public-Domain-Lizenz hinterlegt. Völlig ausgestorbene Ordnungen sind mit † gekennzeichnet. yBP, Jahre vor der Gegenwart.
Dies ermöglicht auch die Entwicklung mehrerer Größen flugunfähiger Rallen auf ein und derselben Insel, da sich die Vögel diversifizieren, um Nischen zu besetzen (Livezey 2003, Trewick 1997). Neben der Energieeinsparung beeinflussen auch bestimmte morphologische Merkmale die Evolution der Rallen. Rallen haben von vornherein relativ kleine Flugmuskeln und Flügel (Kirchman 2012). Dies trägt in Verbindung mit ihrer terrestrischen Lebensweise und ihrer verhaltensbedingten Flugunfähigkeit wesentlich dazu bei, dass die Rallen ihre Flugfähigkeit bemerkenswert schnell verloren haben (Livezey 2003). Die Laysan-Ralle (Zapornia palmeri) brauchte nur 125 000 Jahre, um die Flugfähigkeit zu verlieren (Slikas et al. 2002, Abb. 28).

Abb. 28: die mittlerweile ausgestorbene Laysan-Ralle.
Fragmentarische fossile Überlieferungen gibt es bereits aus dem Eozän, diese lassen sich aber nicht zweifelsfrei den Rallen zuordnen. Sicher gelingt dies erst ab dem Oligozän. Belgirallus oligocaenus aus dem frühen Oligozän ist das älteste bekannte sicher den Rallen zuzuordnende Fossil (Mayr 2006, Mayr & Smith 2001; Abb. 29). Aus dem Pliozän und Pleistozän sind bereits viele Vertreter der rezenten Gattungen bekannt. Eine andere fossile Rallengattung ist Rhenanorallus aus dem Oligozän Deutschlands (Mayr 2010) und Paraortygometra aus dem Oligozän Frankreichs und Thailands (Cheneval et al. 1991; De Pietri & Mayr 2014). In Afrika und Neuseeland gibt es einige fragmentarische Überreste von Rallen (Rasmussen et al. 1987, Worthy et al. 2007).

Abb. 29: Belgirallus
Binsenrallen (Heliornithidae)
Die Binsenrallen (Heliornithidae), auch Binsenhühner genannt, sind eine pantropisch verbreitete Familie und besteht aus drei Gattungen mit je einer Art. Die Zwergbinsenralle (Heliornis fulica) lebt in Südamerika, die Afrikanische Binsenralle (Podica senegalensis) in Afrika und die Maskenbinsenralle (Heliopais personatus) in Südostasien (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020i, Fain et al. 2007, Abb. 30). Der Körperbau der drei Arten ist stark an eine vorwiegend aquatische Lebensweise angepasst. Binsenrallen weisen einen langen Hals und einen schlanken, stromlinienförmigen Körper auf, der Schnabel erreicht etwa Kopflänge, ist nur unmerklich nach unten gebogen und endet in einer Spitze. Die Zehen tragen anders als bei vielen anderen Wasservögeln keine Schwimmhäute, sondern Schwimmlappen und sind mit scharfen Krallen versehen. Die Afrikanische Binsenralle (Podica senegalensis) weist eine weitere Besonderheit auf: Sie besitzt eine Kralle am Flügel, die am ersten Finger ansetzt und 12 bis 18 mm Länge erreicht. Diese Kralle erleichtert das Klettern im Geäst.

Abb. 30: Binsenrallen
Fossile Überlieferungen von Binsenrallen bestehen nur aus zwei Oberarmknochenfragmenten. Eines davon stammt aus dem mittleren Miozän von North Carolina, USA, und ist nicht von der südamerikanischen Zwergbinsenralle zu unterscheiden. Da diese Vogelfamilie ozeanische Barrieren nicht überqueren, deutet das Fossil darauf hin, dass sie sich nach der Bildung der mittelamerikanischen Ladbrücke nach Südamerika ausgebreitet haben (Olson 2003). Ein weiterer Oberarmknochen wurde aus dem späten Miozän des Tschad beschrieben (Louchart et al. 2005b). Dieses Fossil ähnelt mehr der asiatischen Maskenbinsenralle als der afrikanischen, aber ob diese Ähnlichkeit tatsächlich auf eine engere Verwandtschaft mit der asiatischen Art hinweist (Louchart et al. 2005a) muss noch untersucht werden.
Besenschwanzrallen (Sarothruridae)
Die Besenschwanzrallen (Sarothruridae) haben 15 Arten in drei Gattungen mit einer recht ungewöhnlichen Verbreitung (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020j, Garcia et al. 2014, Kirchman et al. 2021, Livezey 1998, Goodman et al. 2011; Abb. 31). Eine Gattung mit zwei Arten bewohnt Madagaskar (Mentocrex), eine mit neun Arten den afrikanischen Kontinent (Sarothrura) und eine dritte mit 4 Arten kommt auf Neuguinea vor (Rollicula). Ursprünglich wurden diese Gattungen in die Familie der Rallen gestellt, molekulare Untersuchungen ergaben aber eine nähere Verwandtschaft mit den Binsenrallen. Möglicherweise sind die vorhin ausgestorbenen Aptornithidae aus Neuseeland mit den Besenschwanzrallen ebenfalls näher verwandt (Boast et al. 2019).

Abb. 31: Besenschwanzrallen
Fürs erste sollen wir es dabei belassen. Wir haben noch einiges vor, denn bisher haben wir nur einen Bruchteil der Vogelwelt kennengelernt. In der nächsten Episode werden wir die nächste Gruppe vorstellen: die Charadriiformes, zu denen verschiedene Watvögel, aber auch die Möwen gehören.
Literatur
Balouet, J. C.; Olson, S. L. (1989): Fossil birds from Late Quaternary deposits in New Caledonia. Smithsonian Contributions to Zoology. 469 (469): 28–32. doi:10.5479/si.00810282.469.
Boast, A. P. et al. (2019): Mitochondrial genomes from New Zealand’s extinct adzebills (Aves: Aptornithidae: Aptornis) support a sister-taxon relationship with the Afro-Madagascan Sarothruridae. Diversity. 11 (2): 1–24.
Boland, C. R. J.; Double, M. C.; Baker, G. B. (2004): Assortative mating by tail streamer length in red-tailed tropicbirds Phaethon rubricauda breeding in the Coral Sea. Ibis. 146 (4): 687–690.
Bourdon, E., Bouya, B., Iarochène, M. (2005): Earliest African neornithine bird: A new species of Prophaethontidae (Aves) from the Paleocene of Morocco. Journal of Vertebrate Paleontology 25, 157–170.
Bourdon, E., Mourer-Chauviré, C., Amaghzaz, M., Bouya, B. (2008): New specimens of Lithoptila abdounensis (Aves, Prophaethontidae) from the Lower Paleogene of Morocco. Journal of Vertebrate Paleontology 28, 751–761.
Braun, E. L.; Kimball, R. T. (2021): Data types and the phylogeny of Neoaves. Birds. 2 (1): 1–22.
Chas, A. W. (1899): On the Remains of a new Bird from the London Clay of Sheppey. Proceedings of the Zoological Society of London. 67 (3): 776–785.
Cheneval, J., Ginsburg, L., Mourer-Chauviré, C., Ratanasthien, B. (1991): The Miocene avifauna of the Li Mae Long locality, Thailand: Systematics and paleoecology. Journal of Southeast Asian Earth Sciences 6, 117–126.
Cracraft, J. (1972): The relationships of the higher taxa of birds: problems in phylogenetic reasoning. Condor 74: 379–392.
Cracraft, J., et al. (2004): Phylogenetic relationships among modern birds (Neornithes): towards an avian tree of life. In J. Cracraft and M. Donoghue (eds.), Assembling the Tree of Life, 468– 489. Oxford: Oxford University Press.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliott, A.; Sargatal, J., eds. (1996): Handbook of the Birds of the World. Vol. 3: Hoatzin to Auks. Lynx Edicions.
De Pietri, V.L., Mayr, G. (2014): Reappraisal of early Miocene rails (Aves, Rallidae) from central France: Diversity and character evolution. Journal of Zoological Systematics and Evolutionary Research 52, 312–322.
Diamond, J. (1991): A New Species of Rail from the Solomon Islands and Convergent Evolution of Insular Flightlessness. The Auk. 108 (3): 461–470.
Ellis, D. H., Gee, G. F., Mirande, C. M. (1996; Hrsg.): Cranes: Their Biology, Husbandry, and Conversation, Hancock House Publishers, Blaine.
Ericson, P. G. P., et al. (2006): Diversification of Neoaves: integration of molecular sequence data and fossils. Biology Letters 22: 543–547.
Fain, M. G.; Houde, P. (2004): Parallel Radiations in the Primary Clades of Birds. Evolution. 58 (11): 2558–73.
Fain, M. G., Krajewskib, C., Houde, P. (2007): Phylogeny of “core Gruiformes” (Aves: Grues) and resolution of the Limpkin–Sungrebe problem. Molecular Phylogenetics and Evolution 43 (2), 515–529.
Feduccia, A., Voorhies, M.R. (1992): Crowned cranes (Gruidae: Balearica) in the Miocene of Nebraska. Natural History Museum of Los Angeles County, Science Series 36, 239–248.
García-R, J.C.; Gibb, G.C.; Trewick, S.A. (2014): Deep global evolutionary radiation in birds: Diversification and trait evolution in the cosmopolitan bird family Rallidae. Molecular Phylogenetics and Evolution. 81: 96–108
Godoy-Vitorino, F. et al. (2008): Bacterial Community in the Crop of the Hoatzin, a Neotropical Folivorous Flying Bird. Applied and Environmental Microbiology. 74 (19): 5905–5912.
Godoy-Vitorino, F. et al. (2011): Comparative analyses of foregut and hindgut bacterial communities in hoatzins and cows. The ISME Journal. 6 (3): 531–541.
Göhlich, U.B. (2003): A new crane (Aves: Gruidae) from the Miocene of Germany. Journal of Vertebrate Paleontology 23, 387–393.
Goodman, S.M., Raherilalao, M. J., Block, N. L. (2011): Patterns of morphological and genetic variation in the Mentocrex kioloides complex (Aves: Gruiformes: Rallidae) from Madagascar, with the description of a new species, Zootaxa 2776, 49-60.
Grajal, A. (1995): Structure and Function of the Digestive Tract of the Hoatzin (Opisthocomus hoazin): A Folivorous Bird with Foregut Fermentation. The Auk. 112 (1): 20–28. doi:10.2307/4088763
Grajal, A.; Strahl, S. D.; Parra, R.; Dominguez, M. G.; Neher, A. (1989): Foregut fermentation in the Hoatzin, a Neotropical leaf-eating bird. Science. 245 (4923): 1236–1238.
Hackett, S. J. et al. (2008): A phylogenomic study of birds reveals their evolutionary history. Science 320: 1763–1768.
Hamilton, A. (1891): On the Genus Aptornis, with more Especial Reference to Aptornis defossor, Owen. Transactions and Proceedings of the Royal Society of New Zealand 1868-1961 Vol. 24
Hesse, A. (1990): Die Beschreibung der Messelornithidae (Aves: Gruiformes: Rhynocheti) aus dem Alttertiär Europas und Nordamerikas. Courier Forschungsinstitut Senckenberg 128, 1–176.
Houde, P. et al. (2019): Phylogenetic Signal of Indels and the Neoavian Radiation. Diversity. 11 (7): 108.
Hughes, J. M., Baker, A. J. (1999): Phylogenetic relationships of the enigmatic hoatzin (Opisthocomus hoazin) resolved using mitochondrial and nuclear gene sequences. In: Molecular Biology and Evolution 16 (9), 1300–1307
Ismar, S. et al. (2011): Visual sensitivity, coloration and morphology of red-tailed tropicbirds Phaethon rubricauda breeding on the Kermadec Islands. New Zealand Journal of Zoology. 38. 29-42.
Jarvis, E. D.; et al. (2014): Whole-genome analyses resolve early branches in the tree of life of modern birds. Science. 346 (6215): 1320–1331
Kennedy, M.; Spencer, H. G. (2004): Phylogenies of the frigatebirds (Fregatidae) and tropicbirds (Phaethonidae), two divergent groups of the traditional order Pelecaniformes, inferred from mitochondrial DNA sequences. Molecular Phylogenetics and Evolution. 31 (1): 31–38.
Kirchman, J. J. (2012): Speciation of flightless rails on islands: A DNA-based phylogeny of the typical rails of the Pacific. The Auk. 129 (1): 56–69.
Kirchman, J.J. et al. (2021): Phylogeny based on ultra-conserved elements clarifies the evolution of rails and allies (Ralloidea) and is the basis for a revised classification, Ornith. 138,
Krajewski, C.; Sipiorski, J.T.; Anderson, F.E. (2010): Mitochondrial genome sequences and the phylogeny of cranes (Gruiformes: Gruidae). Auk. 127 (2): 440–452.
Kuhl, H. et al. (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life. Molecular Biology and Evolution. 38: 108–127.
Livezey B. C. (1994): The carpometacarpus of Apterornis. Notornis. 41 (1): 51–60.
Livezey, B.C. (1998): A phylogenetic analysis of the Gruiformes (Aves) based on morphological characters, with an emphasis on the rails (Rallidae), Phil. Trons. R. Soc. Lond. B 353, 2077-2151.
Livezey, B. (2003): Evolution of Flightlessness in Rails (Gruiformes: Rallidae): Phylogenetic, Ecomorphological, and Ontogenetic Perspectives. Ornithological Monographs No. 53.
Livezey, B. C., Zusi, R. L. (2007): Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy. II. Analysis and discussion. Zoological Journal of the Linnean Society 149: 1–95.
Louchart, A. et al. (2005a): A new swan (Aves: Anatidae) in Africa, from the latest Miocene of Chad and Libya. Journal of Vertebrate Paleontology 25, 384–392.
Louchart, A. et al. (2005b) A finfoot from the Late Miocene of Toros Menalla (Chad, Africa): Palaeobiogeographical and palaeoecological implications. Palaeogeography, Palaeoclimatology, Palaeoecology 222, 1–9.
Marchant, S.; Higgins, P.G., eds. (1990). Phaethon rubricauda Red-tailed Tropicbird. Handbook of Australian, New Zealand & Antarctic Birds. Volume 1: Ratites to ducks; Part B, Australian pelican to ducks. Melbourne, Victoria: Oxford University Press. pp. 935–44
Mayr, G. (2004): Phylogenetic relationships of the early Tertiary Messel rails (Aves, Messelornithidae). Senckenbergiana Lethaea. 84 (1–2): 317–322.
Mayr, G. (2005): A chicken-sized crane precursor from the early Oligocene of France. Naturwissenschaften. 92 (8): 389–393.
Mayr, G. (2006): A rail (aves, rallidae) from the early oligocene of Germany. Ardea 94 (1).
Mayr, G. (2009). Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G. (2010): Mousebirds (Coliiformes), parrots (Psittaciformes), and other small birds from the late Oligocene/early Miocene of the Mainz Basin, Germany. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 258, 129–144.
Mayr, G. (2013): Parvigruidae (Aves, core-Gruiformes) from the early Oligocene of Belgium. Palaeobiodiversity and Palaeoenvironments 93, 77–89.
Mayr, G. (2014): A hoatzin fossil from the middle Miocene of Kenya documents the past occurrence of modern-type Opisthocomiformes in Africa. The Auk 131, 55–60.
Mayr, G. (2015): New remains of the Eocene Prophaethon and the early evolution of tropicbirds (Phaethontiformes). The Ibis 157, 54–67.
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G. (2019): Hypotarsus morphology of the Ralloidea supports a clade comprising Sarothrura and Mentocrex to the exclusion of Canirallus. Acta Ornithologica. 54 (1): 51–58.
Mayr, G., Alvarenga, H.M.F., Mourer-Chauviré,C. (2011): Out of Africa: Fossils shed light on the origin of the hoatzin, an iconic Neotropic bird. Naturwissenschaften 98, 961–966.
Mayr, G., Clarke, J. (2003): The deep divergences of neornithine birds: a phylogenetic analysis of morphological characters. Cladistics 19: 527–553.
Mayr, G., De Pietri, V. L. (2014): Earliest and first Northern Hemispheric hoatzin fossils substantiate Old World origin of a “Neotropic endemic”. Naturwissenschaften. 101 (2): 143–148.
Mayr, G.; De Pietri, V. L.; Love, L.; Mannering, A.; Crouch, E.; Reid, C.; Scofield, R. P. (2023): Partial skeleton from the Paleocene of New Zealand illuminates the early evolutionary history of the Phaethontiformes (tropicbirds). Alcheringa: An Australasian Journal of Palaeontology. 47 (3): 315–326.
Mayr, G., Manegold, A., Johansson, U. S. (2003): Monophyletic groups within “higher land birds” – comparison of morphological and molecular data. Journal of Zoological and Systematic Evolutionary Research 41: 233–248.
Mayr, G., Smith, R. (2001): Ducks, rails, and limicoline waders (Aves: Anseriformes, Gruiformes, Charadriiformes) from the lowermost Oligocene of Belgium. Geobios 34, 547–561.
Mayr, G., Zvonok, E. (2011): Middle Eocene Pelagornithidae and Gaviiformes (Aves) from the Ukrainian Paratethys. Palaeontology 54, 1347–1359.
McCall, R. A.; Nee, S.; Harvey, P. H. (1998): The role of wing length in the evolution of avian flightlessness. Evolutionary Ecology. 12 (5): 569–580.
McNab, B.K. (1994): Energy conservation and the evolution of flightlessness in birds. Am. Nat. 144 (4): 628–642.
McNab, B.K. (2002): Minimizing energy expenditure facilitates vertebrate persistence on oceanic islands. Ecology Letters. 5 (5): 693–704.
McNab, B.K.; Ellis, H.I. (2006): Flightless rails endemic to islands have lower energy expenditures and clutch sizes than flighted rails on islands and continents. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 145 (3): 295–311.
Mikhailov, K. E. (1995): Eggshell structure in the shoebill and pelecaniform birds: comparison with hamerkop, herons, ibises and storks. Canadian Journal of Zoology. 73 (9): 1754–70.
Mirarab S. et al. (2024): A region of suppressed recombination misleads neoavian phylogenomics. Proc Natl Acad Sci U S A.;121(15):e2319506121.
Mlíkovský, J. (1996): A new tropicbird (Aves: Phaethontidae) from the late Miocene of Austria. Annalen des Naturhistorischen Museums in Wien. 98A: 151–54.
Morlo, M. (2004): Diet of Messelornis (Aves: Gruiformes), an Eocene bird from Germany. Courier Forschungsinstitut Senckenberg. 252: 29–33.
Mourer-Chauviré C. (1995): The Messelornithidae (Aves: Gruiformes) from the Paleogene of France. Courier Forschungsinstitut Senckenberg. 181: 95–105.
Mourer-Chauviré, C. (2003): Birds (Aves) from the Middle Miocene of Arrisdrift (Namibia). Preliminary study with description of two new genera: Amanuensis (Accipitriformes, Sagittariidae) and Namibiavis (Gruiformes, Idiornithidae). Geological Survey of Namibia, Memoir. 19: 103–113.
Nudds, R. L.; Davidson, J. S. (2010): A shortening of the manus precedes the attenuation of other wing-bone elements in the evolution of flightlessness in birds. Acta Zoologica. 91: 115–122.
Nunes, G. T. et al. (2013): Sex determination and sexual size dimorphism in the red-billed tropicbird (Phaethon aethereus) and white-tailed tropicbird (P. lepturus). Waterbirds. 36 (3): 348–52.
Nunes, G. T. et al. (2017): Conservation genetics of threatened red-billed tropicbirds and white-tailed tropicbirds in the southwestern Atlantic Ocean. The Condor. 119 (2): 251–260.
Oliveira, E. H. C. et al. (2015): Cytotaxonomy of Eurypyga helias (Gruiformes, Eurypygidae): First Karyotypic Description and Phylogenetic Proximity with Rynochetidae. PLOS ONE. 10 (12): e0143982.
Olson, S.L. (1985a): The fossil record of birds. In: D.S. Farner, J.R. King, & K.C. Parkes (eds.), Avian Biology, vol. 8. New York: Academic Press, 79–238.
Olson, S.L. (1985b): A new genus of tropicbird (Pelecaniformes: Phaethontidae) from the Middle Miocene Calvert Formation of Maryland. Proceedings of the Biological Society of Washington 98, 851–855.
Olson, S.L. (2003): First fossil record of a finfoot (Aves: Heliornithidae) and its biogeographical significance. Proceedings of the Biological Society of Washington 116, 732–736.
Olson, S.L., Walker, C.A. (1997): A trans-Atlantic record of the fossil tropicbird Heliadornis ashbyi (Aves: Phaethontidae) from the Miocene of Belgium. Proceedings of the Biological Society of Washington 110, 624–628.
Oppenheimer, M.; Silveira, L.F. (2009): A taxonomic review of the Dark-winged Trumpeter Psophia viridis (Aves: Gruiformes: Psophiidae). Papéis Avulsos de Zoologia, Universidade de São Paulo. 49 (41): 547–555.
Orta, J. et al. (2017): Red-billed Tropicbird (Phaethon aethereus). In: del Hoyo, et al. (eds.). Handbook of the Birds of the World Alive. Barcelona, Spain: Lynx Edicions.
Orta, J. et al. (2018). Red-tailed Tropicbird (Phaethon rubricauda). IN. del Hoyo, et a. (eds.). Handbook of the Birds of the World Alive. Barcelona, Spain: Lynx Edicions.
Palombo, M. R.; Moncunill-Solé, B. (2023): Dwarfing and gigantism in quaternary vertebrates. Reference Module in Earth Systems and Environmental Sciences.
Parker, W. K. (1891): On the Morphology of a Reptilian Bird, Opisthocomus hoazin. Transactions of the Zoological Society of London. 13 (2): 43–89.
Prum, R. O. et al. (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing. Nature. 526 (7574): 569–573.
Rasmussen, D.T., et al. (1987): Fossil birds from the Oligocene Jebel Qatrani Formation, Fayum Province, Egypt. Smithsonian Contributions to Paleobiology 62, 1–20.
Rasmussen, T. et al. (1997): Vertebrate paleontology in the neotropics – the Miocene fauna of La Venta, Colombia. Birds. Smithsonian Institution Press.
Reddy, S. et al. (2017): Why Do Phylogenomic Data Sets Yield Conflicting Trees? Data Type Influences the Avian Tree of Life more than Taxon Sampling. Systematic Biology. 66 (5): 857–879.
Ribas, C.C. et al. (2011): A palaeobiogeographic model for biotic diversification within Amazonia over the past three million years. Proceedings of the Royal Society B: Biological Sciences. 279 (1729), 681–689.
Salas, M.; Letocart, Y. (1997): Spatial Organisation and Breeding of Kagu Rhynochetos jubatus in Rivière Bleue Park, New Caledonia. Emu. 97 (2): 97–107.
Sayol, F.; Steinbauer, M. J.; Blackburn, T. M.; Antonelli, A.; Faurby, S. (2020): Anthropogenic extinctions conceal widespread evolution of flightlessness in birds. Science Advances. 6 (49).
Seddon, N., Tobias, J. A., Alvarez, A. (2002): Vocal communication in the pale-winged trumpeter (Psophia leucoptera): repertoire, context and functional reference. Behaviour 139 (10), 1331–1359.
Seguí, B. (2002): A new genus of crane (Aves: Gruiformes) from the Late Tertiary of the Balearic Islands, Western Mediterranean. The Ibis 144, 411–422.
Sherman, P. T. (1995): Breeding Biology of White-Winged Trumpeters (Psophia leucoptera) in Peru. The Auk 112 (2) 285–295.
Sherman, P. T., Eason, P. K. (1995): Dominance status, mating strategies and copulation success in cooperatively polyandrous white-winged trumpeters, Psophia leucoptera. Animal Behaviour 49 (3), 725–736.
Sibley, C. G., Ahlquist, J. A. (1990): Phylogeny and Classification of Birds. New Haven, Conn.: Yale University Press.
Slikas, B.; Olson, S. L.; Fleischer, R.C. (2002): Rapid, independent evolution of flightlessness in four species of Pacific Island rails (Rallidae): an analysis based on mitochondrial sequence data. J. Avian Biol. 33 (1): 5–14.
Steadman, D. (2006): Extinction and Biogeography in Tropical Pacific Birds. Chicago: University of Chicago Press. ISBN 978-0-226-77142-7.
Stiller, J. et al. (2024): Complexity of avian evolution revealed by family-level genomes. Nature 629, 851–860. https://doi.org/10.1038/s41586-024-07323-1
Smith, A.G., Smith, D.G., Funnell, B.M. (1994): Atlas of Mesozoic and Cenozoic Coastlines. Cambridge: Cambridge University Press.
Sorenson M. D. et al. (2003): More taxa, more characters: the Hoatzin problem is still unresolved. Molecular Biology and Evolution 20 (9), 1484–1499
Suh, A. (2016): The phylogenomic forest of bird trees contains a hard polytomy at the root of Neoaves. Zoologica Scripta. 45: 50–62.
Tamaki, Y. et al. (2013): Parsimony and Model-Based Analyses of Indels in Avian Nuclear Genes Reveal Congruent and Incongruent Phylogenetic Signals. Biology. 2 (1): 419–444.
Tennyson, A., Martinson, P. (2006): Extinct birds of New Zealand, Te Papa Press.
Theuerkauf, J. et al. (2009): Group Territoriality as a form of Cooperative Breeding in the Flightless Kagu (Rhynochetos jubatus) of New Caledonia. Auk. 126 (2): 371–375.
Theuerkauf, J. et al. (2017): Elevated concentrations of naturally occurring heavy metals inversely correlate with reproductive output and body mass of the Kagu Rhynochetos jubatus. Ibis. 159 (3): 580–587
Theuerkauf, J. et al. (2021): Some like it odd: Long-term research reveals unusual behaviour in the flightless Kagu of New Caledonia. Austral Ecology. 46 (1): 151–154.
Theuerkauf, J., Gula, R. (2018): Indirect evidence for body size reduction in a flightless island bird after human colonisation. Journal of Ornithology, 159(3), 823–826.
Trewick, S. A. (1997): Flightlessness and phylogeny amongst endemic rails (Aves:Rallidae) of the New Zealand region. Philosophical Transactions of the Royal Society B: Biological Sciences. 352 (1352): 429–446.
Wetmore, A. (1940): Fossil Bird Remains from Tertiary Deposits in the United States. Journal of Morphology. 66 (1): 25–37.
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020a): Hoatzin (Opisthocomidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA.
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020b): Tropicbirds (Phaethontidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.phaeth1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020c): Kagu (Rhynochetidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.rhynoc1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020d): Sunbittern (Eurypygidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.eurypy1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020e): Cranes (Gruidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.gruida1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020f): Limpkin (Aramidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.aramid1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020g): Trumpeters (Psophiidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.psophi1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020h): Rails, Gallinules, and Coots (Rallidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.rallid1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020i): Finfoots (Heliornithidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.helior1.01
Winkler, D. W., Billerman, S. M., I. J. Lovette, I. J. (2020j): Flufftails (Sarothruridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.saroth1.01
Worthy, T.H., et al. (2007): Miocene waterfowl and other birds from central Otago, New Zealand. Journal of Systematic Palaeontology 5, 1–39.
Worthy, T. H. et al. (2011): Fossils reveal an early Miocene presence of the aberrant gruiformes: Aptornithidae in New Zealand. Journal of Ornithology 152 (3), 669–680
Wright, A.-D. G.; Northwood, K. S.; Obispo, N. E. (2009): Rumen-like methanogens identified from the crop of the folivorous South American bird, the hoatzin (Opisthocomus hoazin). The ISME Journal. 3 (10): 1120–1126.
Wu, S. et al. (2024): Genomes, fossils, and the concurrent rise of modern birds and flowering plants in the Late Cretaceous. Proceedings of the National Academy of Sciences. 121 (8).



