Text als pdf
Die Neornithes, also die modernen Vögel, sind eine außerordentlich artenreiche Gruppe:
Laut dem Buch „All the Birds of the World“ von Joseph del Hoyo, welches 2020 veröffentlich wurde, gibt es 11.524 Vogelarten auf der Welt, eingeteilt werden diese in 36 Ordnungen und 244 Familien, wobei die Ordnung der Passeriformes (Singvögel) 138 Familien und rund 6.500 Arten ausmacht (del Hoyo 2020). Andere Werke zur Vogelkunde (Ornithologie) geben etwas andere Artenzahlen und Zahlen für die Ordnungen und Familien an, doch dürfte dies ein guter Richtwert sein. Wenn man bedenkt, dass Vögel hoch-spezialisierte Dinosaurier sind, ist diese Vielfalt erstaunlich.
In den kommenden Episoden werden wir die verschiedenen Vogelgruppen und ihre Vielfalt, inklusive der Evolutionsgeschichte, näher kennenlernen. Tatsächlich gehören die verwandtschaftlichen Beziehungen der modernen Vögel zu den größten Herausforderungen der Phylogenetik, was bei der Artenfülle nicht verwundert. Aber grob lassen sich die Neornithes in zwei Hauptkladen einteilen: die Palaeognathae und die Neognathae, welche die früheste phylogenetische Aufspaltung der modernen Vögel ausmacht (Abb. 1). Palaeognathae kann man als Urkiefervögel, die Neognathae als Neukiefervögel bezeichnen. Die Neognathae lassen sich dann weiter in die Galloanserae und die Neoaves aufspalten. Deren Phylogenie wird in der nächsten Episode behandelt.
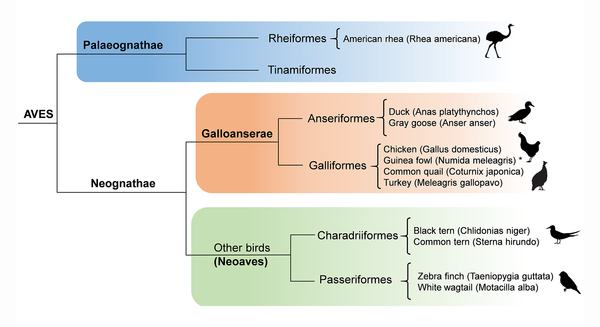
Abb. 1: Stammbaum der Neornithes bzw. Aves.
Palaeognathae
Urkiefer-Vögel weisen eine Reihe von plesiomorphen Schädel- und Postkranialmerkmalen auf, die sie von allen anderen heute lebenden Vögeln unterscheiden. Unterschieden werden sie von den Neukiefervögeln (Neognathae) hauptsächlich durch eine andere Gaumenstruktur. Der palaeognathe Gaumen hat seitlich abstehende, verlängerte Basipterygoid-Fortsätze, die das Flügelbein (Pterygoid) erreichen. Das Pflugscharbein oder der Vomer ist lang und reicht nach hinten, um das Flügelbein zu stützen. Bei den Neukiefervögeln sind die Basipterygoid-Fortsätze klein oder nicht vorhanden und der Vomer reduziert und kurz. Zusätzlich zu der namensgebenden primitiven Gaumenmorphologie sind die kaudalen Enden des Darmbeins und des Sitzbeins des Beckens bei den meisten Arten nicht miteinander verbunden und dem Tibiotarsus fehlt häufig eine supratendinale Brücke (Storch & Welsch 1997, Bergmann 2004, Gussekloo et al. 2017, Widrig & Field 2022).
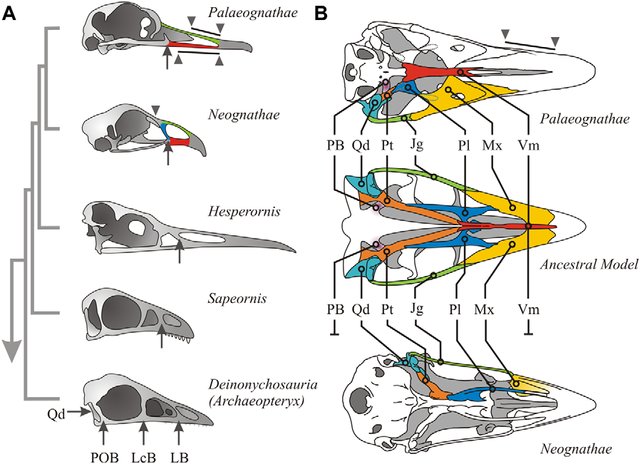
Abb. 2: Die Palaeognathae unterscheiden sich von den Neognathae u. a. durch die Morphologie der ventralen Schädelteile (a) Eine vereinfachte Phylogenie der Vögel (basierend auf Xu et al. 2011), die die fortschreitende Reduzierung der seitlichen Schädelteile zeigt. An der Basis des Vogelstammbaums sind vier Spangen vorhanden: das Quadrate (Qd), der Postorbitalbogen (POB), das Tränenbein (LcB) und der seitliche Bogen des oberen Schnabels (LB). Die Pfeile in den abgeleiteten Exemplaren zeigen den seitlichen Bogen an. Der Schnabel von Vögeln besteht aus einem einzigen medialen Dorsalstab (grün) und seitlich symmetrischen ventralen (rot) und lateralen Stäben (blau). Bei den Neognathae sind Quadrate und Seitenleiste intakt, während bei den Palaeognathae nur das Quadrat intakt ist. Dreiecke und Linien zeigen flexible Zonen im oberen Schnabel an. Die meisten Neognathae haben ein einzelnes nasal-frontales Scharnier an der Schädelbasis; Palaeognathae haben lange flexible Zonen entlang des oberen Schnabels. (b) Die allgemeinen Unterschiede zwischen den Schädeln von Palaeognathae (Rhea americana) und Neognathae (Gallus gallus) im Vergleich zu einem allgemeinen Modell des Vorfahrenstatus (basierend auf Archeopteryx; Elzanowski 2001). Palaeognathae haben kleine und dicke Pterygoide (Pt, orange, gestrichelte Linien zeigen die dorsale Verlängerung des Knochens an), kurze und breite Palatine (Pl, hellblau, gestrichelte Linien zeigen die dorsale Verlängerung des Knochens an), dicke kurze Jugale (Jg, grün), breite dünne Maxillen (Mx, gelb), ein gut entwickeltes Vomer (Vm, rot) und eine Verlängerung der Schädelbasis (proc. basipterygoidei, PB, lila). Die Quadrate (Qd) sind in Türkis dargestellt. Quelle: Gussekloo et al. (2017)
Mit Ausnahme der flugfähigen süd- und mittelamerikanischen Steißhühner (Tinamiformes) sind alle heute lebenden palaeognathen Vögel flugunfähig. Zu diesen “Laufvögeln” gehören die neuseeländischen Kiwis (Apterygiformes), die südamerikanischen Nandus (Rheiformes), die afrikanischen Strauße (Struthioniformes), die Kasuare und Emus (Casuariiformes) aus der australischen Region, sowie die kürzlich ausgestorbenen madagassischen Elefantenvögel (Aepyornithiformes) und die Moas (Dinornithiformes) aus Neuseeland (Abb. 3). Allen gemeinsam ist auch ihre Verbreitung auf den Erdteilen, die früher Gondwana bildeten.

Abb. 3: Moderne und kürzlich ausgestorbene Palaeognathae mit ihren jeweiligen Eigrößen. Lithornis, ein alter fliegender Palaeognathenvogel, ist abgebildet und hat eine unbekannte Eigröße. Bildnachweis: Hyunjoo Shin / CC BY 4.0.
Die phylogenetische Verwandtschaft der Palaeognathae
Einige Studien, die sich auf Morphologie, Immunologie und DNA-Sequenzierung stützen, belegen, dass die Urkiefervögel monophyletisch sind (Haddrath & Baker 2001, Roff 1994).
Die lange Zeit vorherrschende Meinung zur Evolution der Urkiefervögel war, dass sie einen gemeinsamen flugunfähigen Vorfahren haben, der in Gondwana lebte und dessen Nachkommen durch die Kontinentaldrift voneinander isoliert wurden, wodurch sie an ihre heutigen Standorte gelangten und die heutigen Arten bildeten (Cracraft 1974, Abb. 4). Wenn dies zuträfe, so sind dann die australischen Emus und Kasuare mit den Kiwis aus Neuseeland enger verwandt als mit den anderen Laufvögeln.
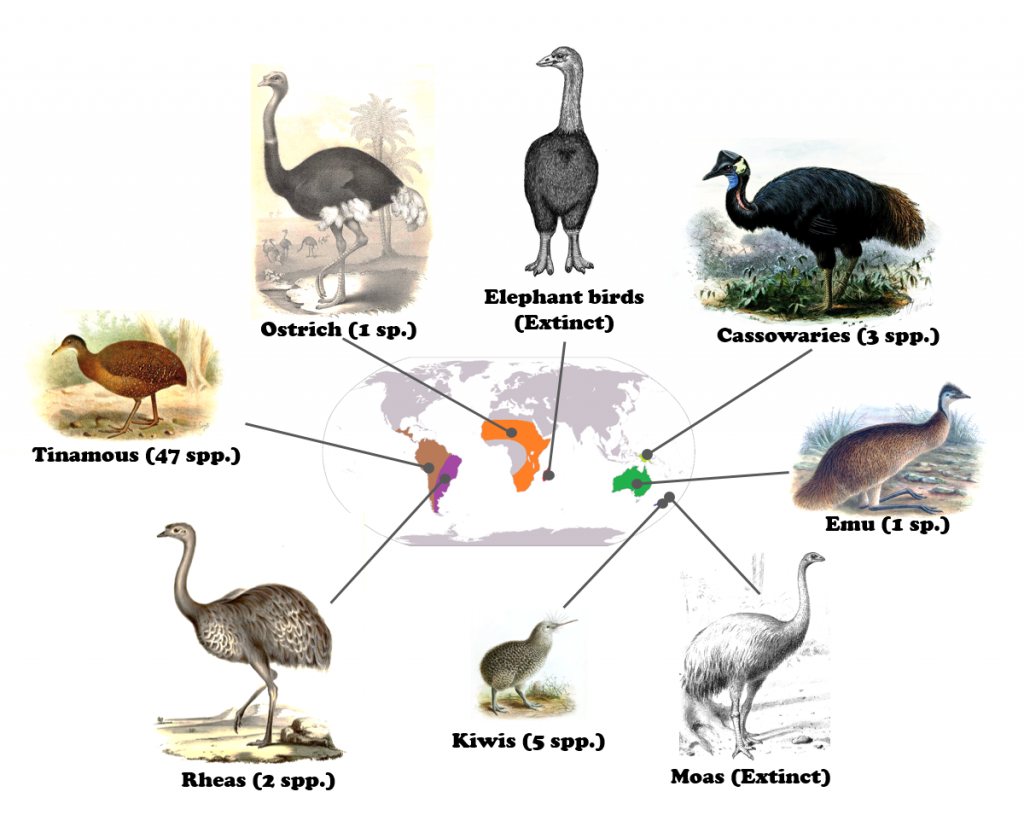
Abb. 4 Verbreitung der Palaeognathae in den südlichen Kontinenten, die einstmals Gondwana bildeten.
Neuere Analysen der genetischen Variation zwischen den Laufvögeln bestätigen dieses einfache Bild jedoch nicht (Abb. 5). Eine 2008 durchgeführte genetische Studie zeigt, dass sich die Strauße zuerst verzweigen, gefolgt von Nandus und Steißhühnern, und dann spalten sich die Kiwis von Emus und Kasuaren ab (Harshman et al. 2008). In neueren Studien wurde gezeigt, dass die neuseeländischen Moas und die südamerikanischen Steißhühner Schwestergruppen sind (Philips et a. 2010, Allentoft & Rawlence 2012, Baker et al. 2014) und dass die Elefantenvögel Madagaskars am engsten mit dem neuseeländischen Kiwi verwandt sind (Mitchell et al. 2014). Zusätzliche Unterstützung für die letztgenannte Verwandtschaft wurde durch morphologische Analysen gewonnen (Mitchell et al. 2014). Die Belege deuten darauf hin, dass sich die Flugunfähigkeit der Laufvögel mindestens sechs Mal unabhängig voneinander entwickelte. Im Jahr 2014 stellte eine mitochondriale DNA-Phylogenie, die auch fossile Mitglieder umfasst, Strauße auf den basalen Zweig, gefolgt von Nandus, dann eine Gruppe von Moas und Steißhühnern, gefolgt von den letzten beiden Zweigen: die Klade der Emus und Kasuare und die Klade der Elefantenvögel und Kiwis (Mitchell et al. 2014).
Vor allem die Beziehung zwischen den Elefantenvögeln Madagaskars und Kiwis in Neuseeland scheint eine Ausbreitung über die Ozeane durch den Flug zu erfordern (Mitchell et al. 2014), ebenso wie die Besiedlung Neuseelands durch den Moa und möglicherweise die Rückausbreitung von Steißhühnern nach Südamerika (Philips et al. 2010). Die Phylogenie als Ganzes deutet nicht nur auf mehrere unabhängige Ursprünge der Fluglosigkeit hin, sondern auch auf Gigantismus (mindestens fünfmal; Mitchell et al. 2014).
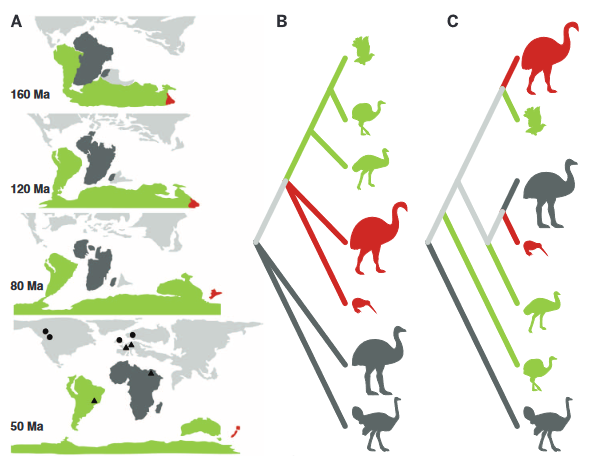
Abb. 5: Widerspruch zwischen der abgeleiteten Palaeognathae-Phylogenie und der durch die kontinentale Vikarianz vorhergesagten Topologie. (A) Relative Position der Kontinente während der späten Kreidezeit und des Tertiärs. Die kontinentalen Landmassen sind in der Reihenfolge ihrer Abtrennung von der übrigen gondwanischen Landmasse eingefärbt: Afrika und Madagaskar zuerst (dunkelgrau; 100 bis 130 Ma), gefolgt von Neuseeland (rot; 60 bis 80 Ma), und schließlich Australien, Antarktis und Südamerika (grün; 30 bis 50 Ma). Palaeognathae-Fossilien aus dem späten Paläozän und Eozän sind durch Kreise (flugfähige Taxa) und Dreiecke (flugunfähige Taxa) dargestellt. (B) Voraussichtliche Phylogenie der Laufvögel nach einem Modell, bei dem die Artbildung ausschließlich durch kontinentale Vikarianz bestimmt wird, bei dem die Taxa der einzelnen Kontinente näher miteinander verwandt sind. (C) Phylogenie der Palaeognathae, wie sie in den neusten Studien abgeleitet sind.
Der Fossilbericht der Palaeognathae
Da es in der späten Kreidezeit unbestreitbar Neognathae gab, muss es zu dieser Zeit auch Palaeognathae gegeben haben. Bestätigte mesozoische Palaeognathae wurden noch nicht gemeldet (obwohl einige Kandidaten vorgeschlagen wurden), und die ältesten eindeutigen Mitglieder der Gruppe stammen aus dem Paläozän. Auch wenn heute die Palaeognathae eine Verbreitung in den südlichen Kontinenten aufweisen, deutet der Fossilbeleg auf einen Ursprung auf der Nordhalbkugel hin (siehe Abb. 5).
Eine Gruppe prähistorischer Palaeognathae sind die Lithornithiformes aus dem späten Paläozän und Eozän Nordamerikas und Europas. Die bekannteste Art ist Lithornis vulturinus aus England, welcher schon 1840 beschrieben wurde (Owen 1840; Abb. 6).

Abb. 6: Lebendrekonstruktion von Lithornis.
Zur Gattung Lithornis gehören insgesamt sechs Arten, weitere Gattungen sind Pseudocrypturus, Paracathartes, Fissuravis und Calciavis mit je einer Art (Houde 1988; Mayr 2007, 2009; Stidham et al. 2014, Parris & Hope 2002, Nesbitt & Clarke 2016, Harrison 1979, Abb. 7 – 10). Lithornithiformes sind mittelgroße Vögel, deren Gliedmaßen denen der Steißhühner (Tinamiformes) ähnlich sind. Mit diesen teilen sie auch ein gut entwickeltes Brustbeinkiel und getrennte Coracoidea (Rabenbein) und Scapulae (Schulterblatt), d. h. das Fehlen eines Scapulocoracoids, das bei allen flugunfähigen Palaeognathae vorkommt. Die Morphologie der Flügel- und Brustgürtelknochen deutet darauf hin, dass die Lithornithiformes zum Dauerflug fähig waren und ihre Flugleistung war wahrscheinlich viel besser als die der Steißhühner. Der Schnabel hat Anpassungen zum Beutefang an Uferzonen und die Hinterzehe ist länger als bei allen modernen Palaeognathae mit langen, gebogenen Krallen, die darauf hindeuten, dass diese Vogelgruppe sich an Ästen festhalten konnte (Houde 1988).

Abb. 7: Pseudocrypturus

Abb. 8: Paracathartes

Abb. 9: Fissuravis

Abb. 10: Calciavis
Die phylogenetische Verwandtschaft dieser Gruppe ist nicht ganz geklärt und Analysen legen verschiedene Zuordnungen innerhalb der Palaeognathae oder gar als Schwestergruppe zu allen Neornithes vor (Houde 1988; Livezey & Zusi 2007; Worthy & Scofield 2012). Eindeutig abgeleitete Ähnlichkeiten werden nur mit den Kiwis (Apterygiformes) geteilt, wobei eine enge Verwandtschaft mit diesen aufgrund der geographischen Distanzen als unwahrscheinlich betrachtet wird und die Ähnlichkeiten eher auf Konvergenzen beruhen (Houde 1988; Zelenitsky et al. 2011).
Im Paläozän und frühen Eozän war Europa von anderen Kontinenten isoliert und frei von größeren fleischfressenden Säugetieren, die später aus Asien bzw. Nordamerika einwanderten (van Valkenburgh 1999). Diese geografischen und biotischen Bedingungen ermöglichten die Evolution einer überraschend großen Zahl flugunfähiger Vögel (Mayr 2009), darunter einige “laufvogelähnliche” Palaeognathae aus der Familie der Remiornithidae und Palaeotididae.
Während von Remiornis (Abb. 11) nur wenige Fragmente aus dem späten Paläozän gefunden wurden, was seine genaue Zuordnung innerhalb der Palaeognathae erschwert (Lemoine 1881; Martin 1992; Mayr 2009; Buffetaut & Angst 2014), gibt es von Palaeotis (Abb. 12) mehrere Skelette, vor allem in Deutschland (Lambrecht 1928; Houde & Haubold 1987; Peters 1988; Mayr 2015). Palaeotis ist etwas kleiner als Remiornis und hat einen länglicheren Tarsometatarsus (Mayr 2009). Der langbeinige und flugunfähige Palaeotis war knapp 1m hoch und hat einen schmaleren Schnabel als alle heute lebenden Laufvögel mit Ausnahme von Kasuaren und Kiwis. Sein Oberarmknochen war recht lang, die Flügelknochen jedoch stark reduziert, ihm fehlt ein Brustbeinkiel und Schulterblatt und Coracoid sind zu einem Scapulocoracoid verschmolzen. Mit diesen und einigen anderen Merkmalen, wie einem schmalen Becken und dem Fehlen einer Hinterzehe, weist Palaeotis eine “laufvogelartige” Morphologie auf und unterscheidet sich von den zeitgenössischen lithornithiformen Arten. Im Gegenzug zu den anderen modernen schnell laufenden Palaeognathae wie Straußen und Nandus bewohnte Palaeotis bewaldete Gebiete.
Bislang wurden keine abgeleiteten Merkmale identifiziert, die eine eindeutige Zuordnung von Palaeotis zu einer der existierenden palaeognathe Taxa erlauben. Insgesamt ähnelt sein Skelett am ehesten mit dem der heutigen Strauße (Struthioniformes) und Nandus (Rheiformes), weiterhin bestehen Ähnlichkeiten mit Diogenornis, einem mutmaßlichen Stammgruppenvertreter der Nandus aus dem Paläozän Brasiliens (Houde & Haubold 1987; Peters 1988, Mayr 2009, 2015).

Abb. 11: Remiornis

Abb. 12: Palaeotis
Strauße
Die wohl bekanntesten Laufvögel sind die Strauße (Winkler et al. 2020a, del Hoyo 2020, Abb. 13), die heute in zwei Arten in Afrikas Savannen leben, die bekannteste und am weitesten verbreitete Art ist der Afrikanische Strauß (Struthio camelus). Der Somalistrauß (Struthio molybdophanes) kommt im Horn von Afrika vor. Beide Arten seit etwa 3,6 bis 4,1 Millionen Jahren genetisch voneinander getrennt, wobei der Ostafrikanische Graben und die unterschiedliche Nutzung ökologischer Nischen als Barrieren gedient haben könnten (Freitag & Robinson 1993). Vom Afrikanischen Strauß unterscheiden sie sich dadurch, dass die unbefiederten Körperteile – Kopf, Hals und Beine – blaugrau statt rosa sind.

Abb. 13: links: Somali-Strauß, recht Afrikanischer Strauß.
Strauße sind die größten und schwersten lebenden Vogel sowie die einzige lebende Gruppe mit nur zwei Zehen. Diese spezialisierte Morphologie ist eine Anpassung an ihre schnelle Fortbewegung mit Geschwindigkeiten von bis zu 70 Kilometern pro Stunde (Schaller et al. 2011). Wie bei anderen flugunfähigen Vögeln, z. B. Nandus, sind die Flügel der Strauße vergleichsweise lang und werden bei schnellen Zickzackläufen als stabilisierende “Luftruder” eingesetzt (Schaller 2008). Bei flugunfähigen Vögeln, die keine schnellen Läufer sind, sind die Flügel dagegen meist stark reduziert.
Die frühesten afrikanischen “Laufvogel”-ähnlichen Fossilien stammen aus dem späten Eozän Ägyptens und gehören zu Eremopezus (Eremopezidae; Rasmussen et al. 1987, 2001, Abb. 14). Dieses Taxon ist nur von Beinknochen bekannt, deren Abmessungen eindeutig auf einen flugunfähigen Vogel hinweisen, Details der Beinanatomie weisen ihn als Palaeognathae aus. Die Gesamtmorphologie der Knochen unterscheidet sich jedoch deutlich von derjenigen der heutigen Strauße.

Abb. 14: Eremopezus
Strauße gibt es heute nur in Afrika, doch waren sie seit dem Miozän auch in Asien und Europa verbreitet. Dabei zeigt sich, dass die frühen Miozänen Arten kleiner waren als moderne Strauße, während die Arten im Pliozän und Pleistozän etwa genauso groß oder gar noch größer waren.
Die frühesten gesicherten Skelettreste von Straußen gehören zu Struthio coppensi aus dem frühen Miozän (20 mya) von Namibia (Mourer-Chauviré et al. 1996; Mourer-Chauviré 2008, Abb. 15). Diese Art ist viel kleiner als das heute lebende S. camelus und weist noch ein Überbleibsel im Fußgelenk für die zweite Zehe auf. Ansonsten ähnelt die Morphologie der bekannten Knochen derjenigen der heutigen Strauße, was darauf hindeutet, dass sich die Strauße weit vor dem frühen Miozän von ihrem Schwestertaxon unterschieden haben. Die nächstältesten afrikanischen Belege für Strauße stammen aus dem mittleren Miozän (14 mya) von Kenia und stammen von einer größeren Art (Leonard et al. 2006), was auf eine Größenzunahme der Strauße zwischen dem frühen und dem mittleren Miozän schließen lässt. Straußenknochen aus dem Pliozän Südafrikas und Marokkos wurden dem großen und massiven Struthio asiaticus zugeordnet, der sogar den heutigen Strauß an Größe übertraf (Mourer-Chauviré & Geraads 2008; Manegold et al. 2013, Abb. 16).

Abb. 15: Struthio coppensi

Abb. 16: Struthio asiaticus
In Afrika sind aber besonders viele Fossilien von Straußen-Eiern bekannt, die sich von jenen moderner Strauße unterscheiden und auf eine wesentlich höhere Diversität hindeuten (Sauer 1969, Mourer-Chauviré et al. 1996; Harrison & Msuya 2005; Bibi et al. 2006).
In Europa scheinen Strauße auf den südöstlichen Teil des Kontinents beschränkt gewesen zu sein, wo sie vom späten Miozän bis zum Ende des Pliozäns überlebten. In Asien sind verschiedene Straußenarten aus China, der Mongolei, Russland und Indien. Bekannte Arten aus Eurasien sind Struthio linxiaensis (mittlerweile als Orientornis linxiaensis bezeichnet, Abb. 17) aus China, S. wimani aus China und der Mongolei, S. asiaticus (Abb. 16) aus Indien, China und Nordafrika, Struthio brachydactylus aus Osteuropa, Pachystruthio dmanisensis aus dem Kaukasus (Abb. 18) und Palaeostruthio karatheodoris aus Südosteuropa (Mlíkovský 1996, Boev & Spassov 2009; Hou et al. 2005; Wang 2008; Wang et al. 2011). Welche der verschiedenen fossilen Arten dem heutigen Strauß am nächsten steht, ist nicht bekannt. Warum Strauße außerhalb Afrikas ausstarben, bleibt ebenfalls unbekannt, aber die klimatische Abkühlung der nördlichen Kontinente während der pleistozänen Eiszeiten könnte eine Rolle gespielt haben.

Abb. 17: Orientornis linxiaensis

Abb. 18: Pachystruthio dmanisensis
Nandus
Heute gibt es drei Nandu-Arten in Südamerika (del Hoyo 2020, Winkler et al. 2020b unterscheiden nur zwei Arten; Abb. 19): der Große Nandu (Rhea americana), der Darwin-Nandu (Rhea pennata) und der Puna-Nandu (Rhea tarapacensis).
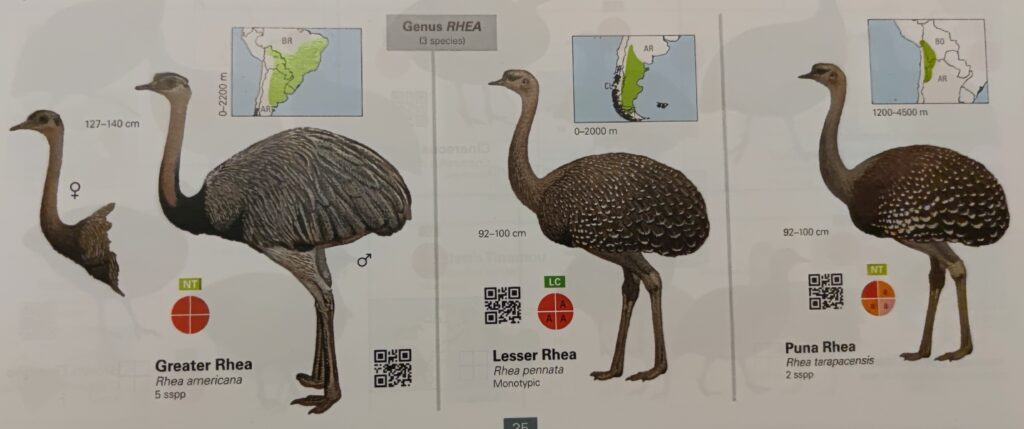
Abb. 19: Nandus
Die Fossilien zeigen, dass große, flugunfähige palaeognathe Vögel eine lange Evolutionsgeschichte in Südamerika haben. Die frühesten Fossilien, die Nandus zugeordnet werden, sind Phalangen aus dem mittleren Paläozän Argentiniens (Tambussi 1995). Wesentlich besser vertreten ist Diogenornis aus dem späten Paläozän Brasiliens, von dem verschiedene postkraniale Knochen und die Spitze der Praemaxilla entdeckt wurden (Alvarenga 1983). Dieser flugunfähige Vogel erreichte etwa zwei Drittel der Größe des heutigen Großen Nandus (Rhea americana), von dem er sich unter anderem durch einen schmaleren, kasuarähnlichen Schnabel unterscheidet. Die Flügelknochen von Diogenornis sind außerdem weniger reduziert als die der heutigen Nandus. Die Verwandtschaft von Diogenornis mit den Nandus ist nicht eindeutig geklärt, aber aus biogeografischen Gründen und wegen der allgemeinen Ähnlichkeit der Tiere sehr wahrscheinlich. Weitere Nandu-ähnliche Gattungen, alle aus Argentinien, sind Opisthodactylus aus dem frühen und Pterocnemia aus dem späten Miozän, sowie Hinasuri aus dem Pliozän (Noriega & Agnolín 2008, Tambussi 1995, Abb. 21).

Abb. 20: Diogenornis
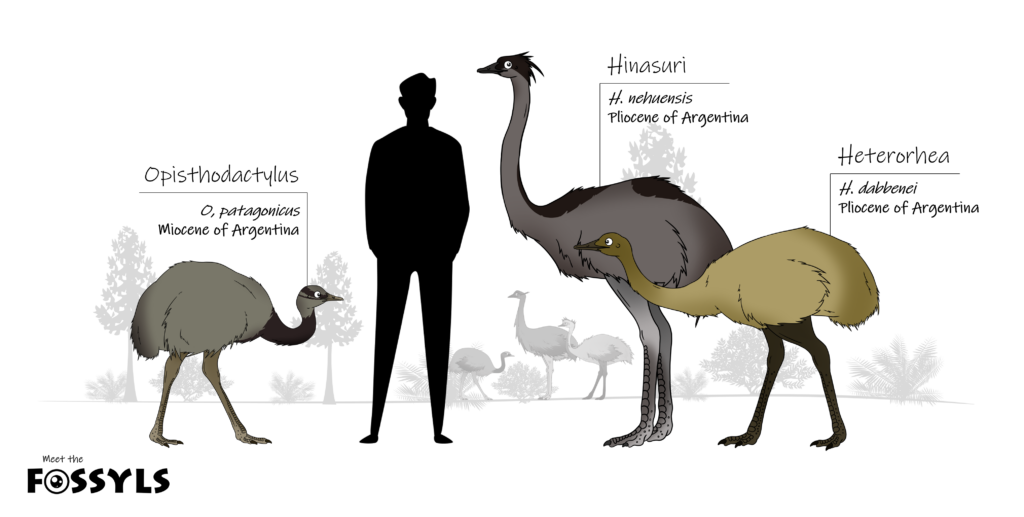
Abb. 21: einige fossile Nandu-Verwandte
Steißhühner (Tinamus)
In Südamerika koexistieren die Nandus mit den Steißhühnern, den einzigen flugfähigen Palaeognathae, die es noch gibt. Gegenwärtig werden 46-48 Arten in 9 Gattungen zu den Steißhühnern gerechnet, die die Regenwälder, Bergregionen und Grasländer Süd- und Mittelamerikas bewohnen (Abb. 22). Steißhühner sind nicht in der Lage, Langstreckenflüge durchzuführen. Sie sind aber in der Lage einen schwerfälligen Flug mit schnellen Flügelschlägen zu absolvieren, ähnlich wie bei Hühnervögeln, was zu einer konvergenten Evolution ähnlicher Flügel-, Brustgürtel- und Brustbeinmorphologien führte. Die fossilen Überlieferungen von Steißhühnern stammen aus dem frühen bis mittleren Miozän von Argentinien, bestehen aber hauptsächlich aus fragmentarischen Knochen und liefern wenig spezifische Informationen über die Evolutionsgeschichte dieser Vögel (Almeida et al. 2022, Beretelli & Porzecanski 2004, Bertelli & Chiappe 2005, Bertelli et al. 2014, del Hoyo 2020, Winkler et al. 2020c).

Abb. 22: die neun Gattungen der Steißhühner, die hier 46 Arten umfassen, einige Literaturquellen sprechen von bis zu 48 Arten. Vor allem die Gattung Crypturellus mit ihren 21-23 beschriebenen Arten bereitet hier Probleme. Viele der Arten sind voneinander kaum zu unterscheiden, während andere sehr variantenreich vorkommen. Eine noch ausstehende genaue Untersuchung der Arten könnte dazu führen, dass die Artenzahl noch nach unten oder auch nach oben korrigiert werden muss.
Moas
Die vielfältigsten Laufvögel sind die Moas in Neuseeland (Abb. 23). Es werden zwei Moa-Kladen anerkannt, die Emeidae und die Dinornithidae, aber die Zahl der als gültig angesehenen Arten (etwa neun bis 14) ist im Fluss, da molekulare Arbeiten zusätzliche Abstammungslinien innerhalb einiger morphologisch definierter Arten aufgedeckt und einen ausgeprägten sexuellen Dimorphismus in der Gruppe festgestellt haben. Einige riesige “Arten” (wie Dinornis giganteus) haben sich als die Weibchen viel kleinerer Arten (wie D. stuthoides) herausgestellt (Bunce et al. 2003; Huynen et al. 2003). Bei diesen Arten waren die Weibchen etwa 280 % so schwer und 150 % so groß wie die größten Männchen. Die Schnabelform, der Inhalt des Magens und die Koprolithen zeigen, dass einige Arten Zweige und andere faserige Pflanzenteile bevorzugten, während andere Blätter und Früchte bevorzugten (Worthy & Holdaway 2002). Einige Moa-Arten gehörten zu den größten Vögeln, die jemals gelebt haben, und die Höhe des größten, Dinornis maximus, wurde auf mehr als 3 Meter geschätzt (Abb. 24).
Moas sind wohl die flugunfähigsten aller Vögel, denn ihnen fehlen die Flügel vollständig und sogar das Schulterblatt am Schulterdach. Pachyornis und Euryapterx haben bemerkenswert kurze, kräftige Beine. Wachstumslinien in den Knochen deuten darauf hin, dass sie viel langsamer heranwuchsen als andere Vögel und fast ein Jahrzehnt brauchten, um die Skelettreife zu erreichen (Turvey et al. 2005). Längliche, geschlungene Luftröhren deuten darauf hin, dass einige Arten laute Rufe erzeugen konnten. Abgesehen von einigen miozänen Eierschalenfragmenten (Tennyson et al. 2010) gibt es keine fossilen Funde von Moas aus dem Präpleistozän. Die jüngsten Knochen wurden auf das auf das späte 13. Jahrhundert datiert, und es wird angenommen, dass die Moas weniger als 100 Jahre nach der der Ankunft der ersten polynesischen Siedler auf Neuseeland ausstarben (Holdaway & Jacomb 2000). Phylogenetisch sind die Moas eher mit den Steißhühnern verwandt, während die ebenfalls auf Neuseeland vorkommenden Kiwis mit den Elefantenvögeln Madagaskars verwandt sind (Mitchell et al. 2014).
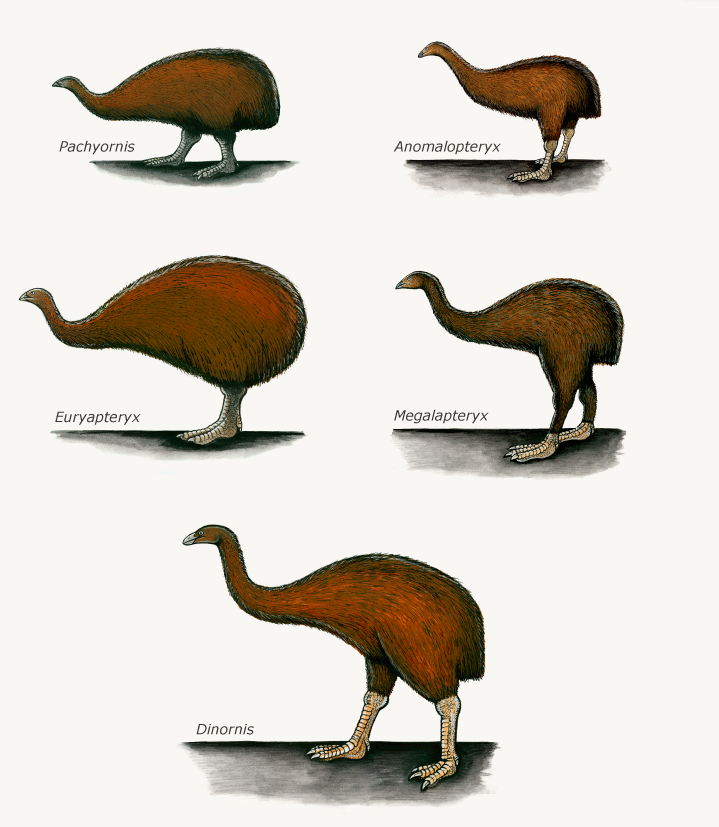
Abb. 23: verschiedene Moa-Gattungen. Es gab eine Vielzahl von physischen Merkmalen bei Moas. Oben links: Die Mitglieder der Gattung Pachyornis waren schwere Vögel mit einem scharfen Schnabel. Oben rechts: Der kleine Buschmoa (Anomalopteryx didiformis) war klein und schlank und hatte einen kräftigen Schnabel. Mitte rechts: Der Hochlandmoa (Megalapteryx didinus) war schlank und athletisch, mit langen Zehen und einem langen Schnabel. Dies waren wahrscheinlich Anpassungen an seine Umgebung in den Bergen. Mitte links: Die Familie der Stumpfschnabelmoa, zu der die Gattungen Emeus und Euryapteryx gehören, war sehr gedrungen und hatte kurze Beine. Unten: Die Riesenmoa der Gattung Dinornis waren groß und relativ schlank, mit einem breiten, abgeflachten Kopf.

Abb. 24: Ein Größenvergleich zwischen drei Moa-Arten. Arten von oben nach unten: Südinsel-Riesenmoa (Dinornis robustus), Östlicher Moa (Emeus crassus) und Kleiner Buschmoa (Anomalopteryx didiformis).
Kiwis
Es werden fünf verschiedene Kiwi-Arten unterschieden (Burbidge et al. 2003, del Hoyo 2020, Winkler et al. 2020d, Abb. 25): Zwergkiwi oder Kleiner Fleckenkiwi (Apteryx owenii), Haastkiwi oder Großer Fleckenkiwi (Apteryx haastii), Nördlicher Streifenkiwi (Apteryx mantelli), Rowi oder Okarito-Streifenkiwi (Apteryx rowi), Tokoeka oder Südlicher Streifenkiwi (Apteryx australis).

Abb. 25: die fünf Kiwi-Arten
Kiwis weisen einige plesiomorphe Merkmale auf, die sie von allen anderen Vögeln unterscheiden, wie zum Beispiel zwei funktionsfähige Eierstöcke (Kinsky 1971) und eine nur teilweise umgekehrte Hinterzehe. Diese primitiven Merkmale sind jedoch wahrscheinlich das Ergebnis einer Pädomorphose. Leider ist die frühe Evolutionsgeschichte der Kiwis genauso wenig bekannt wie die der Moas. Die einzigen Fossilien aus der Zeit vor dem Pleistozän sind ein Quadratum, also ein Teil des hinteren Schädelknochens und ein unvollständiger Oberschenkelknochen von Proapteryx aus dem frühen oder mittleren Miozän Neuseelands (Abb. 26). Proapteryx war kleiner als die heute lebenden Kiwis und wenn dieses Fossil tatsächlich eine Stammgruppe der Kiwis repräsentiert, unterstützt es nicht die Hypothese einer Verkleinerung der Kiwis (Worthy et al. 2013). Aufgrund seiner geringen Größe und Knochenproportionen wurde die Hypothese aufgestellt, dass Proapteryx flugfähig war, in diesem Fall hätte der Vorfahre der Kiwis Neuseeland per Flug erreicht (Worthy et al. 2013). Die Fossilien von Proapteryx sind jedoch zu lückenhaft für fundierte Schlussfolgerungen über die Verwandtschaft und Lebensweise dieses Taxons. Die Evolutionsgeschichte der Kiwis bleibt daher weitgehend im Dunkeln, inklusive der Ursprünge ihrer Nachtaktivität.

Abb. 26: Proapteryx
Elefantenvögel
Madagaskar hatte seine eigenen Riesenvögel: die Elefantenvögel (Aepyornithiformes), deren ältesten Fossilien im Jahr 1851 beschrieben wurden. Es gibt zwei Gattungen: Aepyornis und Mullerornis, die mehrere Arten umfassten, die aber einer taxonomischen Überarbeitung bedürfen (Abb. 27). Die größte Art, Aeptyornis maximus, war 2,7 m hoch und wog bis zu 300 kg und er legte die größten Eier im gesamten Tierreich (Abb. 28). Anders als die schnellfüßigen Strauße, hatten Elefantenvögel kräftige Knochen und waren eher langsam (Worthy & Holdaway 2002, Balanoff & Rowe 2007, Goodman & Jungers 2014). Wie die neuseeländischen Moas waren auch die Elefantenvögel Pflanzenfresser und offenbar haben einige Pflanzen auf Madagaskar auch Verteidigungsstrukturen gegen Elefantenvogelfraß entwickelt (Bond & Silander 2007, Clarke et al. 2006), jedoch ist über die Lebensweise der Elefantenvögel praktisch nichts bekannt.
Höchst unerwartet, und wie bereits ausführlich beschrieben, wiesen Analysen mitochondrialer Genomsequenzen auf eine Schwestergruppenbeziehung zwischen Elefantenvögeln und Kiwis hin (Mitchell et al. 2014). Beide Taxa unterscheiden sich in zahlreichen Aspekten ihres Skeletts, aber sie teilen eine ähnliche abgeleitete Morphologie des Brustbeins, das kraniokaudal sehr kurz ist und eine ausgeprägte Konkavität an seinem kranialen Rand aufweist. Diese Merkmale hängen jedoch eindeutig mit der Flugunfähigkeit zusammen und müssen sich daher konvergent entwickelt haben, denn Madagaskar hatte sich bereits im mittleren bis frühen Spätjura, etwa 155-160 Mio. Jahren, vom mesozoischen Superkontinent Gondwana abgespalten und es keine Ausbreitungswege für einen flugunfähigen Vorfahren der Elefantenvögel oder Kiwis gab (z. B. Smith et al. 1994).
Das genaue Aussterbedatum der Elefantenvögel ist unbekannt. Die jüngsten Radiokarbondaten stammen von Knochen aus dem 8. Jahrhundert, aber ein Überleben bis ins 13. Jahrhundert gilt als wahrscheinlich (Goodman & Jungers 2014). Selbst zu diesem früheren Zeitpunkt waren Menschen bereits auf Madagaskar präsent, aber ob sie am Aussterben beteiligt waren, oder ob natürliche Ursachen wie die zunehmende Veränderungen in der Vegetation eine Rolle spielten, bleibt unbekannt (Goodman & Jungers 2014).
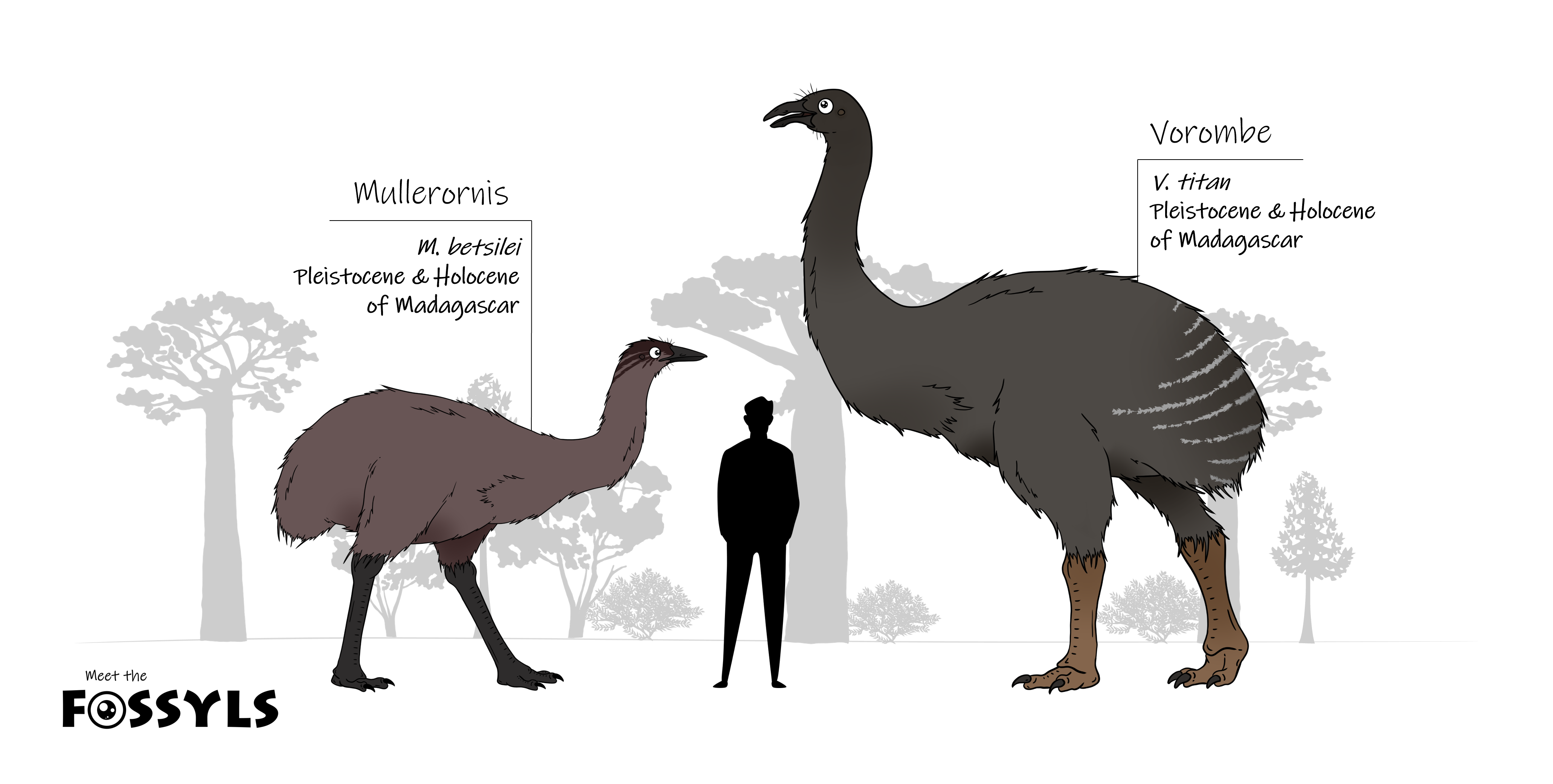
Abb. 27: Die Elefantenvögel Madagaskars. Aepyornis wird manchmal unter der Gattung Vorombe aufgeführt.

Abb. 28: Vergleich von Vogeleiern, von links nach rechts: Kolibri, Huhn, Kasuar, Strauß, Elefantenvogel
Kasuare und Emus
In Australien und Neuguinea kommen die Emus und Kasuare vor. Kasuare umfassen drei Arten: Bennettkasuar (Casuarius bennetti), Helmkasuar (C. casuarius) und Rothalskasuar, (C. unappendiculatus), die alle in Neuguinea und der Helmkasuar zusätzlich auf der Cape-York-Halbinsel in Nordaustralien vorkommen (del Hoyo 2020, Winkler et al. 2020e; Abb. 29). Kasuare zeichnen sich im Vergleich zu anderen Laufvögeln durch verschiedene Eigenheiten aus. Dazu gehören leuchtend gefärbte Kehllappen, eine besonders lange, stachelige zweite Zehenkralle, lange, steife Federkiele an den Flügeln und ein knöcherner, mit Keratin ummantelter Helm. Der Helm kann als Laubabweiser dienen, wenn der Vogel durch dichtes Gebüsch läuft, als visuelles Signal für Alter und/oder Geschlecht, als Grabwerkzeug und – besonders bemerkenswert – als Mikrofon, mit dem der Vogel Infraschallgeräusche wahrnehmen kann (Mack & Jones 2003).
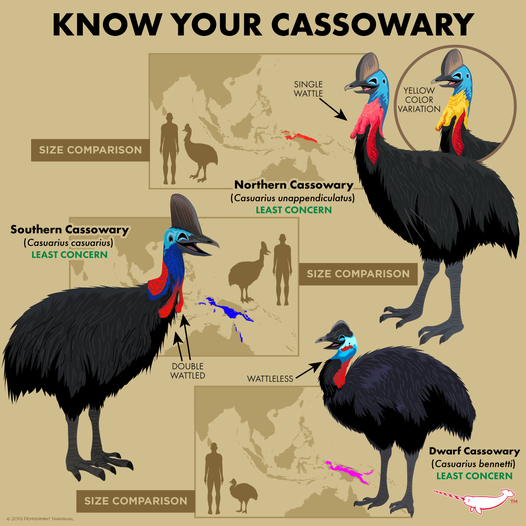
Abb. 29: die drei Kasuararten
Emus (Dromaius novaehollandiae) haben nur eine Art und bewohnen fast den gesamten australischen Kontinent (del Hoyo 2020, Winkler et al. 2020e, Abb. 30). Im späten Oligozän bis mittleren Miozän (24-15 Mio. Jahre) gibt es zwei Arten der Gattung Emuarius, die als Stammgruppe der Emus angehören (Abb. 31). Wie beim heutigen Emu hat der Schnabel von Emuarius eine abgerundete Spitze, während der Schnabel der Kasuare schmaler und spitzer ist. Die Augen von Emuarius, sind jedoch verhältnismäßig kleiner als die des Emus, und der schlankere Oberschenkel deutet darauf hin, dass Emuarius weniger für schnelles Laufen spezialisiert war als moderne Emus (Boles 1997, Worthy et al. 2014). Die einzige andere Fossilnachweis von Emus aus der Zeit vor dem Quartär ist eine ausgestorbene Art aus dem Pliozän, die Dromaius zugeordnet wurde, aber kleiner war als die heute lebende Art (Yates & Worthy 2019, Miller 1963). Zwei kleine Emu-Arten, die zu Beginn des 19. Jahrhunderts ausgestorben sind, kamen auch auf King Island (D. ater, Abb. 32) und Kangaroo Island (D. baudinianus, Abb. 33) vor der Küste Südaustraliens vor (Parker 1984, Hume et al. 2018).

Abb. 30: Emu
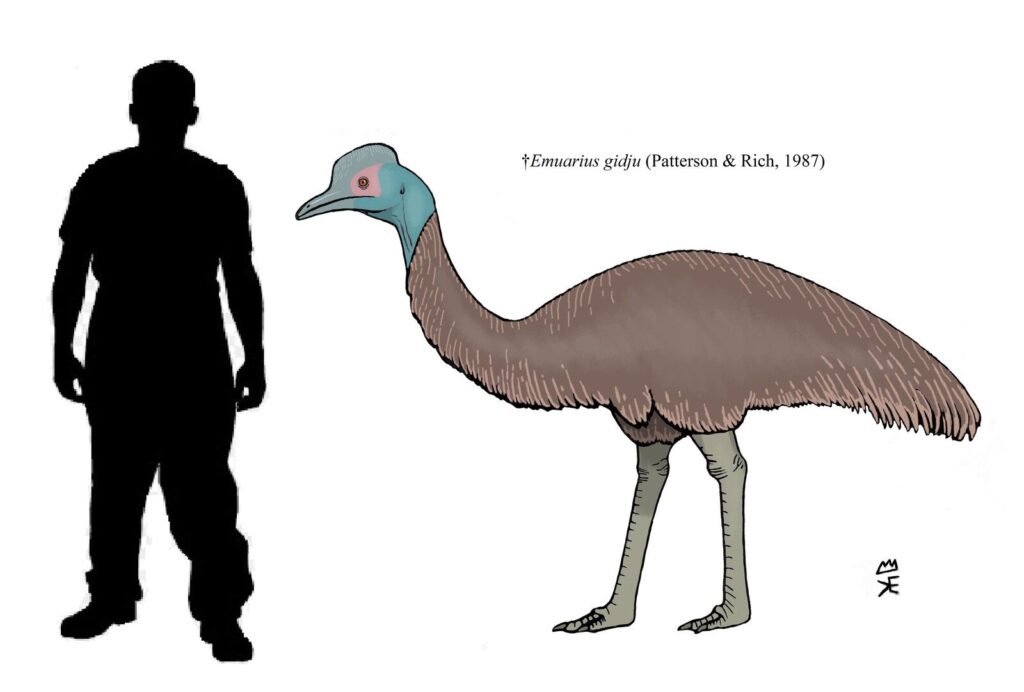
Abb. 31: Emuarius

Abb. 32: Dromaius ater

Abb. 33: Dromaius baudinianus
Im Vergleich zu den Neukiefervögeln sind die Urkiefervögel sehr arm an Arten. Gleichzeitig zählen zu ihnen aber die ikonischsten Vogelarten: zum einen die größten Vögel, die wir kennen und mit dem Kiwi sicherlich auch einen der untypischsten Vögel. Die Neukiefervögel machen aber die allergrößte Vielfalt der modernen Vogelwelt aus und die nächsten Episoden werden die wichtigsten Gruppen und ihre Evolutionsgeschichte nachzeichnen.
Literatur
Allentoft, M. E., Rawlence, N. J. (2012): Moa’s Ark or volant ghosts of Gondwana? Insights from nineteen years of ancient DNA research on the extinct moa (Aves: Dinornithiformes) of New Zealand. Annals of Anatomy – Anatomischer Anzeiger. 194 (1): 36–51.
Almeida, F. C., Porzecanski, A. L., Cracraft, J. L., Bertelli, S. (2022): The evolution of tinamous (Palaeognathae: Tinamidae) in light of molecular and combined analyses., S. 106-124 in Zoological Journal of the Linnean Society 195 (1), S. 116, DOI: 10.1093/zoolinnean/zlab080
Alvarenga, H.M.F. (1983) Uma ave ratitae do Paleoceno Brasileiro: Bacia calcária de Itaboraí, Estado do Rio de Janeiro, Brasil. Boletim do Museu Nacional, Geologia 41, 1–8.
Baker, A. J., Haddrath, O., McPherson, J. D., Cloutier, A. (2014): Genomic Support for a Moa-Tinamou Clade and Adaptive Morphological Convergence in Flightless Ratites. Molecular Biology and Evolution. 31 (7): 1686–1696.
Balanoff, A.M., Rowe, T. (2007): Osteological description of an embryonic skeleton of the extinct elephant bird, Aepyornis (Palaeognathae: Ratitae). Journal of Vertebrate Paleontology 27 (Supplement), 1–53
Bergmann, H.-H. (2004): Aves, Vögel. In: Wilfried Westheide, Reinhard Rieger: Spezielle Zoologie. Teil 2: Wirbel und Schädeltiere. 1. Auflage. Spektrum Akademischer Verlag, Heidelberg/Berlin
Bertelli, S., Chiappe, L. M. (2005): Earliest tinamous (Aves: Palaeognathae) from the Miocene of Argentina and their phylogenetic position. Contributions in Science. 502: 1–20.
Bertelli, S., Chiappe, L.M., Mayr, G. (2014): Phylogenetic interrelationships of living and extinct Tinamidae, volant palaeognathous birds from the New World. Zoological Journal of the Linnean Society 172, 145–184.
Bertelli, S., Porzecanski, A. J. (2004): Tinamou (Tinamidae) systematics: a preliminary combined analysis of morphology and molecules. Ornitologia Neotropical 15 (Supp.):1–8
Bibi, F., Shabel, A.B., Kraatz, B.P., & Stidham, T.A. (2006): New fossil ratite (Aves: Palaeognathae) eggshell discoveries from the Late Miocene Baynunah Formation of the United Arab Emirates, Arabian Peninsula. Palaeontologia Electronica 9.1.2A, 1–13.
Boev, Z., Spassov, N. (2009): First record of ostriches (Aves, Struthioniformes, Struthionidae) from the late Miocene of Bulgaria with taxonomic and zoogeographic discussion. Geodiversitas 31, 493–507.
Boles, W.E. (1997): Hindlimb proportions and locomotion of Emuarius gidju (Patterson & Rich, 1987) (Aves: Casuariidae). Memoirs of the Queensland Museum 41, 235–240.
Bond, W.J., Silander, J.A. (2007): Springs and wire plants: Anachronistic defences against Madagascar’s extinct elephant birds. Proceedings of the Royal Society B: Biological Sciences 274, 1985–1992.
Buffetaut, E., Angst, D. (2013): New evidence of a giant bird from the Late Cretaceous of France. Geological Magazine 150, 173–176.
Bunce, M., Worthy, T.H., Ford, T., Hoppitt, W., Willerslev, E., Drummond, A., Cooper, A. (2003): Extreme reversed sexual size dimorphism in the extinct New Zealand moa Dinornis. Nature 425, 172–175.
Burbidge, M., Colbourne, R., Robertson, H., Baker, A. (2003): Molecular and other biological evidence supports the recognition of at least three species of brown kiwi. Conservation Genetics. 4. 10.1023/A:1023386506067.
Clarke, S.J., Miller, G.H., Fogel, M.L., Chivas, A.R., Murray-Wallace, C.V. (2006): The amino acid and stable isotope biogeochemistry of elephant bird (Aepyornis) eggshells from southern Madagascar. Quaternary Science Reviews 25, 2343–2356.
Cracraft, J. (1974): Phylogeny and evolution of ratite birds. Ibis. 116 (4): 494–521.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Elzanowski, A. (2001): A novel reconstruction of the skull of Archaeopteryx. Neth. J. Zool. 51:207–215
Freitag, S., Robinson, T. J. (1993): Phylogeographic patterns in mitochondrial DNA of the Ostrich (Struthio camelus). The Auk. 110(3): 614–622
Goodman, S.M., Jungers, W.L. (2014): Extinct Madagascar: Picturing the Island’s Past. Chicago, IL: University of Chicago Press.
Gussekloo, S., Berthaume, M., Pulaski, D., Westbroek, I., Waarsing, J., Heinen, R., Grosse, I., Dumont, E. (2017): Functional and evolutionary consequences of cranial fenestration in birds. Evolution. 71. 10.1111/evo.13210.
Haddrath, O., Baker, A. J. (2001): Complete mitochondrial DNA genome sequences of extinct birds: ratite phylogenetics and the vicariance biogeography hypothesis. Proceedings of the Royal Society. Biological Sciences. 268 (1470): 939–945.
Harrison, C. J. O. (1979): A new cathartid vulture from the lower Eocene of Wyoming. Tertiary Research Special Papers. 5: 29–39.
Harrison, T., Msuya, C.P. (2005): Fossil struthionid eggshells from Laetoli, Tanzania: Taxonomic and biostratigraphic significance. Journal of African Earth Sciences 41, 303–315.
Harshman, J., Braun, E. L., Braun, M. J., Huddleston, C. J., Bowie, R. C. K., Chojnowski, J. L., Hackett, S. J., Han, K.-L., Kimball, R. T., Marks, B. D., Miglia, K. J., Moore, W. S., Reddy, S., Sheldon, F. H., Steadman, D. W., Steppan, S. J., Witt, C. C., Yuri, T. (2008): Phylogenomic evidence for multiple losses of flight in ratite birds. Proceedings of the National Academy of Sciences. 105 (36): 13462–13467.
Holdaway, R.N., Jacomb, C. (2000): Rapid extinction of the moas (Aves: Dinornithiformes): Model, test, and implications. Science 287, 2250–2254.
Hou, L., Zhou, Z., Zhang, F., Wang, Z. (2005): A Miocene ostrich fossil from Gansu Province, northwest China. Chinese Science Bulletin 50, 1808–1810.
Houde, P. (1988): Paleognathous birds from the early Tertiary of the Northern Hemisphere. Publications of the Nuttall Ornithological Club 22, 1–148.
Houde, P., Haubold, H. (1987): Palaeotis weigelti restudied: A small Middle Eocene ostrich (Aves: Struthioniformes).
Hume, J., Steel, L., Middleton, G., Medlock, K. (2018): In search of the dwarf emu: A palaeontological survey of King and Flinders Islands, Bass Strait, Australia. Contribuciones Científicas del Museo Argentino de Ciencias Naturales. 7: 81–98.
Huynen, L., Millar, C. D., Scofield, R. P., Lambert, D. M. (2003): Nuclear DNA sequences detect species limits in ancient moa. Nature 425: 175–178
Kinsky, F.C. (1971): The consistent presence of paired ovaries in the Kiwi (Apteryx) with some discussion of this condition in other birds. Journal für Ornithologie 112, 334–357.
Lambrecht, K. (1928): Palaeotis weigelti n. g. sp., eine fossil trappe aus der mitteleozanen Braunkohle des Geiseltales. Jahrbuch hallesch. Verband., Halle, n.s., 7:11.
Lemoine, V. (1881): Recherches sur les oiseaux fossiles des terrains tertiaires inférieurs des environs de Reims, deuxième partie. Matot-Braine, Reims, pp 75 – 170
Leonard, L., Dyke, G.J., Walker, C.A. (2006): New specimens of a fossil ostrich from the Miocene of Kenya. Journal of African Earth Sciences 45, 391–394.
Livezey, B.C., Zusi, R.L. (2007): Higher-order phylogeny of modern birds (Theropoda, Aves: Neornithes) based on comparative anatomy: II. Analysis and discussion. Zoological Journal of the Linnean Society 149, 1–94.
Mack, A. L., Jones, J. (2003): Low-frequency vocalizations by cassowaries (Casuarius spp.). Auk 120: 1062–1068.
Manegold, A., Louchart, A., Carrier, J., Elzanowski, A. (2013): The Early Plioceneavifauna of Langebaanweg (South Africa): Areview and update. In: U.B. Göhlich & A. Kroh(eds.), Paleornithological Research2013 – Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution. Vienna: Natural History Museum Vienna, pp. 135–152.
Martin, L.D. (1992): The status of the Late Paleocene birds Gastornis and Remiornis. Natural History Museum of Los Angeles County, Science Series 36, 97–108.
Mayr, G. (2007): The birds from the Paleocene fissure filling of Walbeck (Germany). Journal of Vertebrate Paleontology 27, 394–408.
Mayr, G. (2009): Paleogene Fossil Birds.Heidelberg: Springer.
Mayr, G. (2015): The middle Eocene European “ratite” Palaeotis (Aves, Palaeognathae) restudied once more. Paläontologische Zeitschrift 89, 503–514.
Miller, A.H. (1963): Fossil ratite birds of the late Tertiary of South Australia. Records of the South Australian Museum. 14: 413–420.
Mitchell, K. J., Llamas, B., Soubrier, J., Rawlence, N. J., Worthy, T. H., Wood, J., Lee, M. S. Y., Cooper, A. (2014): Ancient DNA reveals elephant birds and kiwi are sister taxa and clarifies ratite bird evolution. Science. 344 (6186): 898–900.
Mlíkovský, J. (1996, ed.): Tertiary Avian Localities of Europe. Acta Universitatis Carolinae, Geologica 39, 1–852.
Mourer-Chauviré, C. (2008): Birds (Aves) from the Early Miocene of the Northern Sperrgebiet, Namibia. Memoir of the Geological Survey of Namibia 20, 147–167.
Mourer-Chauviré, C., Geraads, D. (2008): The Struthionidae and Pelagornithidae (Aves: Struthioniformes, Odontopterygiformes) from the Late Pliocene of Ahl al Oughlam, Morocco. Oryctos 7, 169–194.
Mourer-Chauviré, C., Senut, B., Pickford, M., Mein, P. (1996): Le plus ancien représentant du genre Struthio (Aves, Struthionidae), Struthio coppensi n. sp., du Miocène inférieur de Namibie. Comptes rendus de l’Académie des Sciences Paris, série IIa 322, 325–332.
Nesbitt, S. J., Clarke, J. A. (2016): The anatomy and taxonomy of the exquisitely preserved Green River Formation (early Eocene) lithornithids (Aves) and the relationships of Lithornithidae. Bulletin of the American Museum of Natural History 406
Noriega, J.I., Agnolín, F.L. (2008): El registro paleontológico de las Aves del “Mesopotamiense” (Formación Ituzaingó, Mioceno tardío-Plioceno) de la provincia de Entre Ríos, Argentina. INSUGEO, Miscelánea 17, 271–290.
Owen, R. (1840): Description of the remains of a mammal, a bird, and a serpent from the London Clay. Proceedings of the Geological Society of London, 3, 162-166.
Parker, S. A. (1984): The extinct Kangaroo Island emu, a hitherto unrecognised species. Bull. Brit. Ornithol. Club 104: 19–22.
Parris, D.C., Hope, S. (2002): New interpretations of the birds from the Navesink and Hornerstown Formations, New Jersey, USA (Aves: Neornithes). In: Z.-H. Zhou & F.-Z. Zhang (eds.), Proceedings of the 5th Symposium of the Society of Avian Paleontology and Evolution, 1–4 June 2000. Beijing: Science Press, pp. 113–124.
Peters, D.S. (1988): Ein vollständiges Exemplar von Palaeotis weigelti (Aves, Palaeognathae). Courier Forschungsinstitut Senckenberg 107, 223–233.
Phillips MJ, Gibb GC, Crimp EA, Penny D (2010): Tinamous and moa flock together: mitochondrial genome sequence analysis reveals independent losses of flight among ratites. Systematic Biology. 59 (1): 90–107
Rasmussen, D.T., Olson, S.L., Simons, E.L. (1987): Fossil birds from the Oligocene Jebel Qatrani Formation, Fayum Province, Egypt. Smithsonian Contributions to Paleobiology 62, 1–20.
Rasmussen, D.T., Simons, E.L., Hertel, F., Judd, A. (2001): Hindlimb of a giant terrestrial bird from the Upper Eocene, Fayum, Egypt. Palaeontology 44, 325–337.
Roff, D. A. (1994): The evolution of flightlessness: Is history important? Evolutionary Ecology. 8 (6): 639–657.
Sauer, E.G.F. (1969): Evidence and evolutionary interpretation of Psammornis. Bonner zoologische Beiträge 20, 290–310.
Schaller, N.U. (2008): Structural attributes contributing to locomotor performance in the ostrich. Unpublished PhD thesis, Ruperto-Carola University, Heidelberg.
Schaller, N.U., D’Août, K., Villa, R., Herkner, B., Aerts, P. (2011): Toe function and dynamic pressure distribution in ostrich locomotion. Journal of Experimental Biology 214:, 1123–1130.
Smith, A.G., Smith, D.G., Funnell, B.M. (1994): Atlas of Mesozoic and Cenozoic Coastlines. Cambridge: Cambridge University Press.
Stidham, T.A., Lofgren, D., Farke, A.A., Paik, M., Choi, R. (2014): A lithornithid (Aves: Palaeognathae) from the Paleocene (Tiffanian) of southern California. PaleoBios 31, 1–7.
Storch, V., Welsch, U. (1997): Systematische Zoologie, Fischerverlag
Tambussi, C.P. (1995): The fossil Rheiformes from Argentina. Courier Forschungsinstitut Senckenberg 181, 121–129.
Tennyson, A.J.D., Worthy, T.H., Jones, C.M., Scofield, R.P., Hand, S.J. (2010): Moa’s ark: Miocene fossils reveal the great antiquity of moa (Aves: Dinornithiformes) in Zealandia. Records of the Australian Museum 62, 105–114.
Turvey, S. T., Green, O. R., Holdaway, R. N. (2005): Cortical growth marks reveal extended juvenile development in New Zealand moa. Nature 435: 940–943
van Valkenburgh, B. (1999): Major patterns in the history of carnivorous mammals. Annual Review of Earth and Planetary Sciences 27, 463–493.
Wang, S. (2008): Re-examination of taxonomic assignment of “Struthio linxiaensis Hou et al., 2005.” Acta Palaeontologica Sinica 47, 362–368.
Wang, S., Hu, Y., Wang, L. (2011): New ratite eggshell material from the Miocene of Inner Mongolia, China. Chinese Birds 2, 18–26.
Widrig, K., Field, D. J. (2022): The Evolution and Fossil Record of Palaeognathous Birds (Neornithes: Palaeognathae) Diversity 14, no. 2: 105.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a): Ostriches (Struthionidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b): Rheas (Rheidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.rheida1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c): Tinamous (Tinamidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.tinami1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d). Kiwis (Apterygidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.aptery1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020e). Cassowaries and Emu (Casuariidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.casuar1.01
Worthy, T.H., Hand, S.J., Archer, M. (2014): Phylogenetic relationships of the Australian Oligo-Miocene ratite Emuarius gidju Casuariidae. Integrative Zoology 9, 148–166.
Worthy, T. H., Holdaway, R. N. (2002): The Lost World of the Moa. Bloomington: Indiana University Press.
Worthy, T.H., Scofield, R.P. (2012): Twenty-first century advances in knowledge of the biology of moa (Aves: Dinornithiformes): A new morphological analysis and moa diagnoses revised. New Zealand Journal of Zoology 39, 87–153.
Worthy, T.H., Worthy, J.P., Tennyson, A.J.D., Salisbury, S.W., Hand S.J., Scofield, R.P. (2013): Miocene fossils show that kiwi (Apteryx, Apterygidae) are probably not phyletic dwarves. In: U.B. Göhlich & A. Kroh (eds.), Paleornithological Research 2013 – Proceedings of the 8th International Meeting of the Society of Avian Paleontology and Evolution. Vienna: Natural History Museum Vienna, pp. 63–80.
Xu, X., You, H., Du, K., Han, F. (2011): An Archaeopteryx-like theropodfrom China and the origin of Avialae. Nature 475:465–470.
Yates, A. M., Worthy, T. H. (2019): A diminutive species of emu (Casuariidae: Dromaiinae) from the late Miocene of the Northern Territory, Australia. Journal of Vertebrate Paleontology. e1665057.
Zelenitsky, D.K., Therrien, F., Ridgely, R.C., McGee, A.R., Witmer, L.M. (2011): Evolution of olfaction in non-avian theropod dinosaurs and birds. Proceedings of the Royal Society B: Biological Sciences 278, 3625–3634.



