Mitose und Zellzyklus
Wir wissen nun wie unsere DNA vermehrt wird über einen Prozess, der sich Replikation nennt. Hier werden wir uns mit der Vermehrung von Zellen befassen.
Grundsätzlich: Alle Zellen stammen von Zellen ab. Die Zellteilung ist bei allen Lebewesen Grundvoraussetzung für die Reproduktion (Fortpflanzung) und bei vielzelligen Organismen zudem für Wachstum, Regeneration und Reparatur. Für eine jede Zellteilung sind vier Ereignisse erforderlich:
- Das Reproduktionssignal. Ein intrazelluläres oder extrazelluläres Signal löst die Zellteilung aus.
- Die Replikation der DNA. Das genetische Material der Zelle muss dupliziert werden, damit jede der beiden neuen Zellen über einen vollständigen und identischen Satz von Genen verfügt. Diesen Schritt haben wir bereits kennengelernt und werden ihn hier nicht weiter vertiefen. Schaut dazu nochmal den Beitrag zur Replikation der DNA an.
- Die Segregation der replizierten DNA. Die replizierte DNA muss auf die beiden neuen Zellen gleichmäßig verteilt werden.
- Die Cytokinese. Die Enzyme und Organellen der neuen Zellen müssen nachproduziert und der Plasmamembran muss neues Material hinzugefügt werden (auch der Zellwand bei Lebewesen, die eine solche besitzen), damit sich die beiden Zellen voneinander trennen können.
Zellzyklus und Reproduktionssignale
Wie weiß eine Zelle, dass sie sich teilen muss?
Bei den Prokaryoten wirken häufig äußere Signale wie ein Wechsel von Umweltbedingungen oder die Konzentration von Nährstoffen als Auslöser für die Zellteilung. Das Bakterium Escherichia coli teilt sich bei ausreichender Versorgung mit Kohlenhydraten und Mineralstoffen alle 20 min.
Anders als Prokaryoten teilen sich eukaryotische Zellen nicht ständig, sobald die Bedingungen in ihrer Umgebung günstig sind. Bei vielzelligen Eukaryoten sind die meisten Zellen sehr spezialisiert und teilen sich tatsächlich nur selten. In einem eukaryotischen Organismus hängen die Signale für die Zellteilung nicht mit der Umgebung einer einzelnen Zelle zusammen, sondern mit den Bedürfnissen und Anforderungen des gesamten Lebewesens.
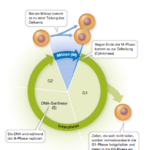
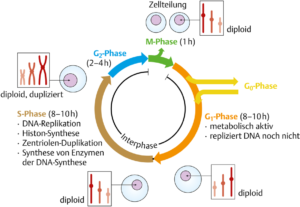
Die Zellteilung bei Eukaryoten wird durch den Zellzyklus reguliert. Der Zellzyklus lässt sich untergliedern in Mitose/Cytokinese und Interphase. Während der Interphase ist der Zellkern im Lichtmikroskop sichtbar und es finden die charakteristischen Zellfunktionen statt wie die DNA-Replikation. Diese Phase der Zelle beginnt, wenn die Cytokinese abgeschlossen ist, und endet mit dem Beginn der Mitose (M). Die Dauer des Zellzyklus ist bei den einzelnen Zelltypen sehr unterschiedlich. In der frühen Embryonalphase kann der Zellzyklus nur 30 min umfassen, während sich schnell teilende Zellen bei einem erwachsenen Menschen für einen vollständigen Zellzyklus etwa 24 h benötigen. Allgemein gilt, dass sich die Zellen die meiste Zeit in der Interphase befinden.
Der Zellzyklus lässt sich einteilen in eine G1-Phase, S-Phase, G2-Phase und M-Phase.
Während der G1-Phase besteht jedes Chromosom aus einem einzigen, nichtreplizierten DNA-Molekül, das an Histone gebundenen ist. Für die unterschiedliche Dauer des Zellzyklus bei den einzelnen Zelltypen ist vor allem die Dauer der G1-Phase verantwortlich. Im Übergang von der G1-Phase zur S-Phase wird die Zelle darauf festgelegt, die DNA zu replizieren und anschließend die Mitose durchzuführen.
Während der S-Phase (Synthesephase) kommt es zur Replikation der DNA. Jedes Chromosom wird verdoppelt, es besteht also aus zwei Schwesterchromatiden, die bis zur Mitose miteinander verbunden bleiben.
Während der G2-Phase bereitet sich die Zelle auf die Mitose vor – etwa indem sie die Proteinkomponenten synthetisiert, die im Verlauf der Mitose gebraucht werden.
Manche in der G1-Phase befindliche Zellen treten in einen inaktiven Ruhezustand des Zellzyklus ein, die G0-Phase. Solche Zellen können oft unter bestimmten äußeren Bedingungen wieder in die G1Phase und damit in den Zellzyklus wechseln, etwa aufgrund eines extrazellulären Signals.
Bei einem Zellzyklus von 24 h dauern diese untergeordneten Phasen normalerweise 11 h (G1-Phase), 8 h (S-Phase) und 4 h (G2-Phase), wobei die noch fehlende 1 h auf die Mitose/Cytokinese (M-Phase) entfällt (Abb. 1).
Abb. 1: Zellzyklus
Spezifische Signale lösen die Ereignisse des Zellzyklus aus. Das Voranschreiten des Zellzyklus beruht auf den Aktivitäten der cyclinabhängigen Kinasen (Cdks). Das sind Enzyme, die die Übertragung einer Phosphatgruppe von ATP auf ein Zielprotein katalysieren. Diese Phosphatgruppenübertragung bezeichnet man als Phosphorylierung. Das ändert die räumliche Struktur und damit die Aktivität des Proteins. Durch Katalyse der Phosphorylierung bestimmter Zielproteine spielen die Cdks an verschiedenen Stellen im Zellzyklus eine wichtige Rolle. Z. B.: Eine Arbeitsgruppe um James Maller untersuchte unreife Eier des Krallenfroschs Xenopus laevis und versuchte herauszufinden, wie sie zur Teilung und schließlich zur Bildung reifer Eier stimuliert werden. Man stellte fest, dass bei Einführen eines Proteins aus heranreifenden Eiern in unreife Eizellen diese zur Teilung angeregt wurden. Das Protein wurde als Reifungsfaktor (maturation promoting factor) bezeichnet. Gleichzeitig untersuchte Leland Hartwell mit seiner Gruppe den Zellzyklus der Bierhefe Saccharomyces cerevisiae. Dabei entdeckte er einen Stamm, der beim G1-S-Übergang angehalten wurde, da ihm eine Cdk fehlte.
Es stellte sich heraus, dass diese Cdk der Hefe und der Reifungsfaktor des Krallenfroschs ähnliche Eigenschaften besitzen. Weitere Untersuchungen bestätigten dann, dass das Protein der Froscheier tatsächlich eine Cdk ist. Man fand bald darauf bei vielen anderen Organismen, so auch beim Menschen, ähnliche Cdks, die den G1-S-Übergang regulieren.
Diese Kontrollstelle bezeichnet man heute als Restriktionspunkt (R-Punkt). Inzwischen sind weitere Cdks bekannt, die andere Abschnitte des Zellzyklus regulieren.
Cdks sind erst dann als Proteinkinasen enzymatisch aktiv, wenn sie an einen anderen Typ von Protein gebunden sind – an einen Aktivator mit der Bezeichnung Cyclin. Cyclin wurde von Tim Hunt bei Seeigeleiern entdeckt; danach konnte er zeigen, dass es auch bei Froscheiern wirkt. Die Bindung von Cyclin an die Cdk aktiviert die Cdk, indem es deren Konformation verändert, sodass das aktive Zentrum für die Substrate zugänglich wird. Der Cyclin/Cdk-Komplex, der den Übergang von der G1- zur S-Phase kontrolliert, ist nicht der einzige derartige Komplex, der bei der Regulation des eukaryotischen Zellzyklus eine Rolle spielt. Es gibt unterschiedliche Cyclin/Cdk-Komplexe, die aus unterschiedlichen Cyclinen und Cdks bestehen und in verschiedenen Zyklusphasen aktiv sind.
Als Beispiel dient der Cyclin/Cdk-Komplex, der den G1-S-Übergang kontrolliert. Der Cyclin/Cdk-Komplex katalysiert die Phosphorylierung des Retinoblastomproteins (RB). In vielen Zellen fungiert RB oder ein RB-ähnliches Protein als Inhibitor des Zellzyklus am R-Punkt. Um in die S-Phase einzutreten, muss eine Zelle die RB-Blockade umgehen. Hier liegt nun die Funktion des G1-S-Cyclin/Cdk-Komplexes. Der Komplex katalysiert das Anhängen einer Phosphatgruppe an RB. Dadurch verändert sich die dreidimensionale Struktur von RB, und es wird infolgedessen inaktiviert. Sobald die Wirkung von RB aufgehoben ist, kann der Zellzyklus voranschreiten (Abb. 2).
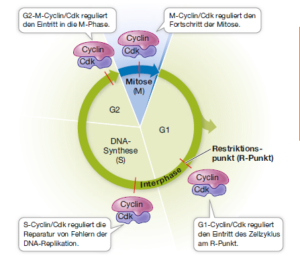
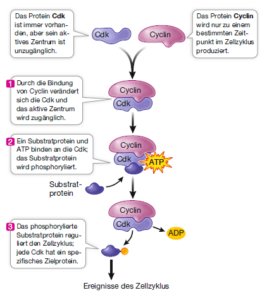
Abb. 2: Cdk und Zellzyklus
Die verschiedenen Cyclin/Cdk-Komplexe fungieren als Kontrollpunkte des Zellzyklus in Form von Signalwegen, die den Fortschritt des Zellzyklus regulieren. Ist beispielsweise eine Zelle durch Strahlung oder Gift grundlegend geschädigt, kann sie daran gehindert werden, den Zellzyklus abzuschließen.
Als Beispiel soll hier der G1-Kontrollpunkt (R) dienen. Wird die DNA während der G1-Phase geschädigt, führt ein Signalweg zur Produktion des Proteins p21. Das p21-Protein bindet an die G1-S-Cdk, sodass sie Cyclin nicht mehr binden kann. Dadurch bleibt die Cdk inaktiv und der Zellzyklus hält an, während die DNA repariert wird.
Wenn der Signalweg für DNA-Schädigung nicht mehr aktiv ist, wird p21 abgebaut, sodass die Funktion des Cyclin/Cdk-Komplexes zum Tragen kommt und sich der Zellzyklus fortsetzt. Wenn die DNA-Schädigung gravierend ist und nicht repariert werden kann, durchläuft die Zelle den programmierten Zelltod (die Apoptose). Solche Kontrollen verhindern, dass sich geschädigte Zellen vermehren und einem Organismus schaden können.
Die Cyclin/Cdk-Komplexe geben der Zelle die Möglichkeit, den Fortschritt des Zellzyklus intern zu regulieren. Der Zellzyklus wird jedoch auch durch äußere Signale beeinflusst. Nicht alle Zellen in einem Organismus durchlaufen den Zellzyklus gleich schnell. Manche Zellen verlassen ihn und treten in die G0-Phase ein, oder sie durchlaufen ihn nur sehr langsam und teilen sich entsprechend selten. Wenn sich solche Zellen teilen sollen, müssen sie durch externe chemische Signale stimuliert werden, die man als Wachstumsfaktoren bezeichnet. Z. B. wenn wir uns schneiden und bluten sammeln sich spezialisierte Zellfragmente, die Blutplättchen (Thrombocyten), an der Wunde und setzen die Blutgerinnung in Gang. Die Thrombocyten produzieren das Protein PDGF (plateletderived growth factor), das zu den angrenzenden Zellen in der Haut diffundiert und sie zur Zellteilung und Wundheilung anregt. Wachstumsfaktoren binden an spezifische Rezeptoren auf ihren Zielzellen und aktivieren Signaltransduktionswege, an deren Ende die Synthese von Cyclin steht, wodurch die Cdks und der Zellzyklus aktiviert werden.
G2-Phase und Mitose
Während der S-Phase wird die DNA bzw. Chromosomen verdoppelt, es entstehen die Schwesterchromatiden. Diese werden während der G2-Phase über den größten Teil ihrer Länge von einem Proteinkomplex zusammengehalten, den man als Cohesin bezeichnet. Am Ende der G2-Phase und zu Beginn der Mitose umhüllen die sogenannten Kondensine, eine andere Gruppe von Proteinen, die DNA-Moleküle, wodurch diese durch Faltung kompakter werden. Außerdem wird in der G2-Phase der Beginn der Bildung des de Spindelapparat initiiert. Dieser gehört zum Cytoskelett und trennt die Schwesterchromatiden bei der Mitose voneinander.
Die Mitose findet in verschiedenen Schritten statt (Abb. 3).
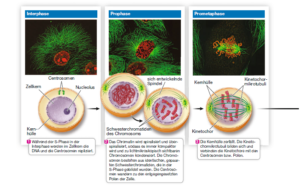
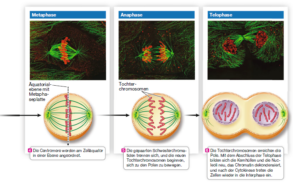
Abb. 3: Mitose
- Interphase: G1 (Wachstum; am Ende liegt der Restriktionspunkt), S (DNA-Replikation), G2 (Bildung des Spindelapparats beginnt)
- Prophase: Kondensation der DNA der Chromosomen, die lichtmikroskopisch sichtbar werden; Zusammenbau des Spindelapparates aus den Centrosomen
- Prometaphase: Zellkernhülle löst sich auf; Chromosomen heften sich an die Spindel
- Metaphase: Anordnung der Chromosomen zu einer Äquatorialplatte (Metaphasenplatte)
- Anaphase: Trennung der Chromatiden; Wanderung zu den Polen der Zelle
- Telophase: Dekondensieren der Tochterchromosomen; Bildung der neuen Kernhüllen
- Cytokinese
Nach ihrer Trennung bezeichnet man die Schwesterchromatiden auch als Tochterchromosomen. Zur besseren Unterscheidung spricht man bis zur Trennung auch von Zwei-Chromatid-Chromosomen und nach der Trennung von Ein-Chromatid-Chromosomen.
Spindelapparat
Der Spindelapparat ist eine dynamische Struktur aus Mikrotubuli, die die Schwesterchromatiden bei der Mitose voneinander wegbewegt. Die Mikrotubuli sind die größten Bestandteile des Cytoskeletts (Abb. 4). Sie sind zwischen 15 und 25 nm groß. Zusammengesetzt sind die Mikrotubuli aus dem runden Protein namens Tubulin. Ihr Aufbau ist durch eine Basisstruktur, das Protofilament, gegeben.
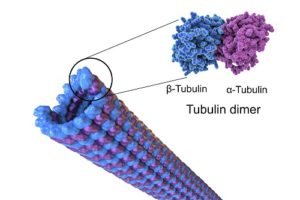
Abb. 4: Mikrotubuli
Die Protofilamente sind dabei aus den sogenannten alpha-Tubulinen an einem Ende und beta-Tubulinen am anderen Ende aufgebaut. Das sind kugelförmige Proteine aus ca. 450 Aminosäuren. Ein Mikrotubulus besteht aus ungefähr 13 dieser Protofilamente. Die Protofilamente sind dabei durch das sogenannte Kopf-Schwanz-Prinzip aufgebaut. Das bedeutet, dass ein alpha-Tubulin (Kopf) immer mit einem beta-Tubulin verbunden ist.
Diese Art der Verknüpfung tritt in sehr vielen Verbindungen auf. Analog dazu existieren auch Kopf-Kopf-Verknüpfungen und Schwanz-Schwanz-Verknüpfungen.
Über das alpha-Tubulin sind die Mikrotubuli an das sogenannte Mikrotubulus-Organisationszentrum (MTOC) gebunden. Dies ist quasi der Startpunkt des Wachstums, also der Verknüpfung der Mikrotubuli. Die Mikrotubuli sind zu einem Großteil für den Stofftransport innerhalb des Zytoskeletts verantwortlich, mit dem wir uns später befassen werden. Seine zweite Aufgabe, die Ausbildung des Spindelapparates, wird hier besprochen.
Bevor sich der Spindelapparat bilden kann, wird seine Orientierung durch das Centrosom (Zentralkörperchen) festgelegt. Dies ist ein membranloses Organell im Cytoplasma in der Nähe des Zellkerns. Bei den Tieren enthält das Centrosom ein Paar von Centriolen, die jeweils die Form eines kurzen Zylinders besitzen, der aus neun Dreiergruppen von Mikrotubuli besteht. Während der S-Phase verdoppelt sich das Centrosom, und zu Beginn der Prophase trennen sich die beiden Centrosomen voneinander und wandern zu den entgegengesetzten Enden der Kernhülle. Sie bestimmen so die beiden Zellpole, auf die sich die Chromatiden während der Anaphase zu bewegen. Die Zellen von Pflanzen und Pilzen besitzen keine Centriolen, sondern bilden ein Mikrotubuliorganisationszentrum (MTOC) an jedem Zellpol, das die gleiche Funktion erfüllt. Die Positionen der beiden Centrosomen legen die Ebene fest, an der sich eine tierische Zelle teilt. Dadurch bestimmen sie die räumliche Beziehung zwischen den beiden neuen Zellen.
Während der Prophase wird der entsprechende Spindelapparat aufgebaut. In diesem Stadium verschwindet der größte Teil des Cohesins, das seit der S-Phase die beiden DNA-Moleküle zusammengehalten hat.
Der Spindelapparat wird aus drei Mikrotubulus-Arten aufgebaut. Das sind die Polar-, Astral- und Kinetochor-Mikrotubuli (Abb. 5).
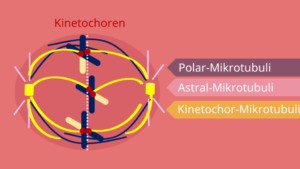
Abb. 5: Spindelapparat
Die polaren Mikrotubuli sind von Zellpol zu Zellpol aufgespannt. Sie können somit über die Äquatorialebene des Spindelapparates hinausreichen.
Die astralen Mikrotubuli stellen die Verbindung zum Cytoskelett her. Sie sind dabei sternförmig um die Zellpole angeordnet.
Die Kinetochor-Mikrotubuli sind wahrscheinlich die wichtigsten der drei Arten. Sie sind maßgeblich an der Trennung der Chromosomen beteiligt. Sie werden in der Prophase der Mitose gebildet. In der darauffolgenden Prometaphase binden sie an die sogenannten Kinetochoren der Chromosomen. Diese sind kleine Proteinstrukturen, die am Centromer der Chromosomen sitzen. Sie sind dabei eine Art Bindungsstelle für einen Kinetochor-Mikrotubulus. Nachdem an den Kinetochor angedockt wurde, werden die Chromosomen auseinandergezogen.
Cytokinese
Nach der Mitose, also nach Bildung der beiden Tochterkerne, teilt sich das Cytoplasma der Zelle im Rahmen der Cytokinese. Bei diesem Vorgang bestehen zwischen Tier- und Pflanzenzellen zwei grundlegende Unterschiede. Bei Tierzellen beginnt die Cytokinese mit einer Einschnürung der Plasmamembran, als ob sich zwischen den beiden Zellkernen ein unsichtbarer Gummiring bildet und zusammenzieht. Er wird von Actinfilamenten und dem assoziierten Motorprotein Myosin an der cytoplasmatischen Oberfläche der Plasmamembran gebildet. Actinfilamente sind Bestandteile des Cytoskeletts. Motorproteine sind intrazelluläre Transportproteine, die unter Energieverbrauch Moleküle in der Zelle transportieren können und mit dem Cytoskelett verbunden sind.
Diese beiden Proteine interagieren und bewirkten dadurch eine Kontraktion, sodass durch die Einschnürung schließlich zwei Zellen entstehen. Actinfilamente bilden sich sehr schnell aus Actinmonomeren, die bereits in der Interphase als Bausteine des Cytoskeletts vorhanden sind.
Das Cytoplasma von Pflanzenzellen teilt sich auf andere Weise, da Pflanzen feste Zellwände besitzen. In Pflanzenzellen treten während des Abbaus der Spindel nach der Mitose entlang der Zellteilungsebene, etwa in der Mitte zwischen den beiden Tochterkernen, vom Golgi-Apparat abgeschnürte Membranvesikel auf. Die Vesikel werden durch das Motorprotein Kinesin entlang von Mikrotubuli (ebenso Bestandteil des Cytoskeletts) bewegt und verschmelzen mit ihresgleichen zur Bildung der beiden trennenden Plasmamembranen. Gleichzeitig bildet sich aus ihren Inhaltsstoffen eine Zellplatte, das Anfangsstadium der neuen trennenden Zellwand.
Nach der Cytokinese enthält jede Tochterzelle alle Bestandteile einer vollständigen Zelle. Durch die Mitose wird die exakte Verteilung der Chromatiden sichergestellt. Im Gegensatz dazu werden Organellen wie Ribosomen, Mitochondrien und Chloroplasten nicht unbedingt gleichmäßig zwischen den Tochterzellen aufgeteilt, es müssen nur in jeder Zelle genügend davon vorhanden sein. Dementsprechend gibt es für die Organellen keinen so präzisen und offensichtlichen Verteilungsmechanismus wie für die Mitose. Umso erstaunlicher ist, dass die Verteilung der Organellen durchweg funktioniert, und es ist weitgehend unverstanden, wie sie gesteuert wird.