Zellkommunikation
Alle Zellen verarbeiten ihre Informationen aus ihrer Umwelt. Ein Signal kann aus der Umgebung des Organismus stammen, wie etwa der Geruch einer weiblichen Motte, die bei Dunkelheit einen Paarungspartner anlockt. Ein Signal kann aber auch von innerhalb des Organismus kommen, wie bei Zellen der Leber, wo von Zellen anderer Organe gebildete Signalmoleküle die Aufnahme oder die Freisetzung von Glucose steuern. Natürlich bedeutet das reine Vorhandensein eines Signals noch nicht, dass eine Zelle darauf reagiert. Damit eine Zelle auf ein Signal reagieren kann, benötigt sie ein spezifisches Rezeptorprotein, welches das Signal aufnimmt; außerdem ist ein Signalübertragungsweg (Signaltransduktionsweg) nötig, damit die aufgenommene Information zelluläre Prozesse auch beeinflussen kann. Ein Signaltransduktionsweg ist eine Abfolge von molekularen Vorgängen und chemischen Reaktionen, die zu einer Reaktion bzw. einer Antwort der Zelle auf ein Signal führen. Signaltransduktionswege variieren im Detail sehr stark, ihre Grundstruktur ist ihnen jedoch gemeinsam: Ein solcher Weg beginnt mit einem Signal und dessen spezifischem Rezeptor und mündet in eine Reaktion. Signalmoleküle lassen sich in drei Typen einteilen (Abb. 1):
- Autokrine Signalmoleküle wirken auf diejenigen Zellen, die sie herstellen. Beispielsweise wachsen viele Tumoren so schnell, weil sie die entsprechenden Signalmoleküle selbst produzieren und so ihre eigenen Zellteilungen stimulieren.
- Parakrine Signalmoleküle diffundieren zu Zellen in der Nähe, die sie beeinflussen. Ein Beispiel hierfür tritt im Zuge der Entzündungsreaktion bei einer Verletzung der Haut auf. Signalmoleküle aus den Hautzellen erreichen bestimmte Blutzellen in der Nähe, die dann den Heilungsprozess unterstützen.
- Endokrine Signalmoleküle gelangen bei Tieren mit dem Blutkreislauf zu weit entfernten Zellen, die sie beeinflussen. Hierzu zählen z. B. Hormone.
Daneben gibt es noch juxtakrine Signalmoleküle. Sie bleiben in der Plasmamembran der produzierenden Zelle verankert und beeinflussen ausschließlich Zellen, die mit der signalproduzierenden Zelle in direktem Kontakt stehen. Diese Art der Signalübertragung ist insbesondere während der Entwicklung häufig anzutreffen, wenn die Zellen Gruppen bilden und sich spezialisieren.
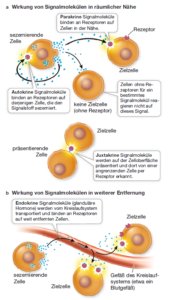
Abb. 1: Formen der Zellkommunikation
Liganden
Damit die Information durch ein Signal auf eine Zielzelle übertragen werden kann, muss diese das Signal empfangen und darauf reagieren können. Das ist die Aufgabe des Rezeptors (Abb. 2). In einem vielzelligen Lebewesen können alle Zellen sämtlichen chemischen Signalen ausgesetzt sein, aber die meisten von ihnen sind nicht in der Lage, auf diese Signale zu reagieren. Nur Zellen mit dem erforderlichen Rezeptor können eine Reaktion zeigen. Diese Spezifität der Bindung stellt sicher, dass nur diejenigen Zellen, die einen spezifischen Rezeptor synthetisieren (exprimieren), auf ein bestimmtes Signal reagieren.
An dieser Reaktion kann ein Enzym beteiligt sein, das eine biochemische Reaktion katalysiert, oder auch Transkriptionsfaktoren, die die Expression von bestimmten Genen an- und abschalten können.
Rezeptoren, die ein Signalmolekül erkennen, haben eine spezifische Bindungsstelle für dieses Molekül. Diese Signalmoleküle werden auch Ligand genannt (Abb. 2). Die Bindung eines Liganden führt zu einer Veränderung der dreidimensionalen Struktur des Rezeptorproteins, und diese Konformationsänderung löst eine zelluläre Reaktion aus. Der Ligand trägt zu dieser Reaktion nicht weiter bei. Tatsächlich wird der Ligand normalerweise nicht verändert. Seine Funktion besteht ausschließlich darin, „an die Tür zu klopfen“. Die Empfindlichkeit einer Zelle für ein Signalmolekül wird zum Teil von der Affinität des Rezeptors für den Liganden bestimmt. also der Wahrscheinlichkeit, mit der der Rezeptor den Liganden bei einer gegebenen Konzentration bindet. Diese Bindung ist reversibel, d. h. das Signalmolekül bleibt nicht dauerhaft an den Liganden gebunden. Würde das passieren, dann würde der Rezeptor ständig stimuliert und zelluläre Reaktionen auslösen.
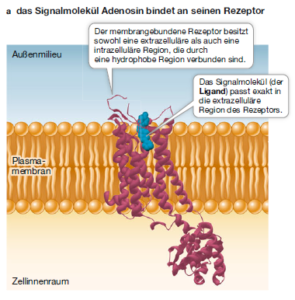
Abb. 2: Rezeptor und Ligand
Bindet der Ligand an das Rezeptormolekül, kommt es bei letzterem zu einer Konformationsänderung. Durch die Konformationsänderung wird zum Beispiel eine zuvor im Inneren des Rezeptors verborgene Gruppe von Aminosäuren so exponiert, dass deren Seitenketten an einer biochemischen Reaktion teilnehmen können. Diese Reaktion kann die Bindung eines weiteren Moleküls sein, zum Beispiel eines anderen Proteins oder auch eines Enzymsubstrats.
Anstelle des normalen Liganden können auch andere Substanzen, die dem Liganden stark ähneln, an den Rezeptor binden. Agonisten sind chemische Verbindungen, die wie der Ligand die Signalübertragung durch den Rezeptor auslösen. Im Gegensatz dazu binden Antagonisten, auch als Inhibitoren bezeichnet, an den Rezeptor, „fixieren“ seine Raumstruktur und hindern den natürlichen Liganden an einer Bindung; sie lösen jedoch keine Signalübertragung aus. Agonisten und Antagonisten können natürlicher Herkunft sein oder sie werden gezielt im Labor entwickelt.
Viele Substanzen, die das menschliche Verhalten beeinflussen, binden an spezifische Rezeptoren im Gehirn und verhindern so die Bindung des eigentlichen Liganden des jeweiligen Rezeptors. Ein Beispiel dafür ist das Koffein, das wahrscheinlich weltweit am häufigsten konsumierte Aufputschmittel. Im Gehirn fungiert das Nucleosid Adenosin als natürlicher Ligand, der an einen Rezeptor auf Nervenzellen bindet. Dadurch wird ein Signaltransduktionsweg ausgelöst, der die Gehirnaktivität reduziert, insbesondere das Gefühl aktiver Wachheit. Da Koffein eine ähnliche Molekülstruktur besitzt wie Adenosin, bindet es ebenfalls an den Adenosinrezeptor (Abb. 3). Im Falle einer Bindung wird der Signaltransduktionsweg jedoch nicht aktiviert. Stattdessen wird der Rezeptor blockiert und die Bindung von Adenosin verhindert. Die Nervenzellen bleiben weiterhin aktiv und der Wachzustand bleibt fühlbar bestehen.
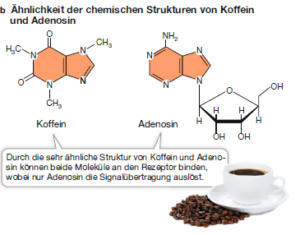
Abb. 3: Koffein als Ligand
Rezeptoren
Die im Körper aktiven Signalmoleküle sind sehr vielfältig. Einige Liganden sind hydrophob (unpolar) und können durch Membranen diffundieren, andere können dieses nicht. Physikalische Reize wie Licht unterscheiden sich in ihrer Fähigkeit, in Zellen oder Gewebe einzudringen. Entsprechend kann man Rezeptoren nach ihrer Lokalisation in der Zelle klassifizieren (Abb. 3); diese hängt stark von der Art seines Liganden bzw. Reizes ab:
- Membranrezeptoren: Große oder polare Liganden können die Lipiddoppelschicht nicht passieren. Insulin zum Beispiel ist ein Proteohormon, das nicht durch die Plasmamembran diffundieren kann. Stattdessen bindet das Molekül an einen Transmembranrezeptor mit einer extrazellulären Bindungsdomäne.
- intrazelluläre Rezeptoren: Kleine oder unpolare Liganden können durch die unpolare Phospholipiddoppelschicht der Plasmamembran diffundieren und so in die Zelle gelangen. Das Steroidhormon Östrogen beispielsweise ist lipidlöslich und kann daher durch die Plasmamembran diffundieren. Es bindet an einen intrazellulären Rezeptor. Licht bestimmter Wellenlängen kann relativ ungehindert in die Zellen eines Blattes vordringen, sodass zahlreiche Lichtrezeptoren von Pflanzen ebenfalls intrazellulär lokalisiert sind.
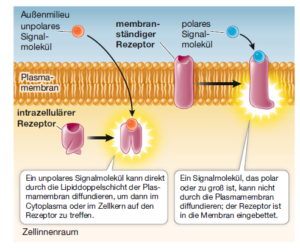
Abb. 3: Membranrezeptoren und intrazelluläre Rezeptoren
Bei komplexen Eukaryoten wie den Wirbeltieren oder Landpflanzen kennt man drei genau untersuchte Gruppen von Plasmamembranrezeptoren, die man entsprechend ihrer Funktionen unterteilt hat:
Ligandengesteuerte und andere Ionenkanäle (Abb. 4): Wie wir erfahren haben, enthält die Plasmamembran vieler Zelltypen ligandengesteuerte Ionenkanäle, die Ionen wie Na+, K+, Ca2+ oder Cl– in die Zelle hinein oder aus ihr heraus diffundieren lassen. Der Öffnungsmechanismus besteht in der Veränderung der dreidimensionalen Struktur des Kanalproteins nach der Wechselwirkung mit dem Liganden. Ein ligandengesteuerter Ionenkanal reagiert also auf einen spezifischen chemischen Signalstoff. Bei anderen Ionenkanälen kann dieses Signal ein sensorischer Reiz wie Licht oder Schall sein, und bei spannungsgesteuerten Ionenkanälen ist es die Veränderung der elektrischen Spannung über der Membran. Der Acetylcholinrezeptor, der bei Wirbeltieren in der Plasmamembran der Skelettmuskelzellen vorkommt, ist ein Beispiel für einen ligandengesteuerten Ionenkanal. Dabei handelt es sich um einen Natriumkanal, der den Liganden Acetylcholin bindet. Acetylcholin ist ein sogenannter Neurotransmitter – ein Signalmolekül, das von Nervenzellen freigesetzt wird. Wenn zwei Moleküle Acetylcholin an den Rezeptor binden, öffnet er den Kanal für etwa eine Tausendstelsekunde. Diese Zeit genügt, damit Na+, das außerhalb der Zelle viel höher konzentriert ist als innen, in die Zelle strömen kann. Die treibende Kraft ist sowohl der Konzentrationsgradient als auch die elektrische Potenzialdifferenz (elektrischer Gradient). Die Veränderung der Na+-Konzentration führt über ein Muskelaktionspotenzial schließlich zur Kontraktion des Muskels.
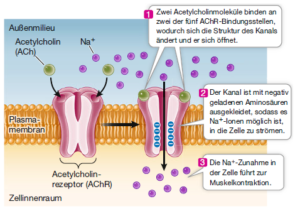
Abb. 4: Ionenkanäle
Enzymgekoppelte Rezeptoren, insbesondere Proteinkinaserezeptoren (Abb. 5). Bestimmte eukaryotische Rezeptorproteine sind mit einem Enzym gekoppelt. Die wichtigste Gruppe solcher Enzyme sind die Proteinkinasen; die damit gekoppelten Rezeptoren heißen entsprechend Proteinkinase-Rezeptoren. Proteinkinasen katalysieren die eigene Phosphorylierung (Addition von Phosphat) oder die Phosphorylierung anderer Proteine, was die Proteinstruktur und damit die Proteinfunktion verändert. Die Phosphorylierung von Proteinen hat in der Biologie eine herausragende Bedeutung. Beim Menschen codieren z. B. 500 Gene für Proteinkinasen. Proteinkinasen wirken also an unzähligen Stellen in unserem Körper und beeinflussen damit auf die eine oder andere Weise unsere sämtlichen Lebensäußerungen. Der Insulinrezeptor ist ein Beispiel für einen Proteinkinaserezeptor. Insulin ist ein Proteohormon, das in der Bauchspeicheldrüse produziert wird. Der zugehörige Rezeptor besteht aus jeweils zwei Kopien zweier verschiedener Proteinuntereinheiten, alpha und beta. Wenn Insulin an den Rezeptor bindet, wird dieser aktiviert und kann sich selbst und bestimmte Proteine im Cytoplasma phosphorylieren, die man treffend als Substrate der Insulinreaktion bezeichnet. Diese Proteine setzen dann zahlreiche zelluläre Reaktionen in Gang, beispielsweise das Einfügen von Glucosetransportern in die Plasmamembran.
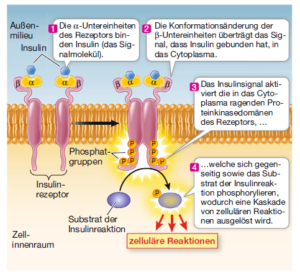
Abb. 5: Enzymgekoppelte Rezeptoren
G-Protein-gekoppelte Rezeptoren (Abb. 6). Diese Rezeptoren sind an der Verarbeitung eines breiten Spektrums an Signalen beteiligt, darunter Licht, das auf die Netzhaut von Wirbeltieren trifft (Photorezeptoren), und Duftstoffe (Geruchsrezeptoren). Außerdem spielen sie bei der Regulation von Stimmungen und Verhalten (wie das Paarungsverhalten von Säugetieren) eine Rolle. So zählen die Rezeptoren der Hormone Oxytocin und ADH, die das Paarungsverhalten der Wühlmäuse steuern zu den G-Protein-gekoppelten Rezeptoren. Die sieben Transmembranhelices dieser Rezeptoren durchqueren die Phospholipiddoppelschicht und sind über kurze Schleifen miteinander verbunden, die sich dadurch abwechselnd außerhalb oder innerhalb der Zelle befinden. Die Bindung eines Liganden an die extrazelluläre Region des Rezeptors verändert die Struktur der cytoplasmatischen Region, sodass dort eine Stelle zugänglich wird, an die ein mobiles Membranprotein, ein G-Protein, binden kann. Das G-Protein taucht teilweise in die Lipiddoppelschicht ein. Viele G-Proteine bestehen aus drei Proteinuntereinheiten und können drei verschiedene Moleküle binden: den Rezeptor, ein GDP bzw. GTP (Guanosindiphosphat bzw. -triphosphat) und an ein Effektorprotein. Wenn das G-Protein an ein aktiviertes Rezeptorprotein bindet, tritt GTP an die Stelle von GDP. Normalerweise wird gleichzeitig an der extrazellulären Seite des Rezeptors der Ligand freigesetzt. Die Bindung von GTP verursacht eine Konformationsänderung des G-Proteins. Die Untereinheit mit dem gebundenen GTP trennt sich von dem übrigen G-Protein und diffundiert in der Ebene der Phospholipiddoppelschicht, bis sie auf ein Effektorprotein trifft, an das sie binden kann. Die Bindung der G-Protein-Untereinheit mit dem gekoppelten GTP aktiviert den Effektor – der zum Beispiel ein Enzym oder ein Ionenkanal sein kann – und führt so zu Veränderungen der Zellfunktion. Nach der Bindung und Aktivierung des Effektorproteins löst sich die G-Protein-Untereinheit und kann weitere Effektorproteinmoleküle aktivieren, bis die intrinsische GTPase-Aktivität der Untereinheit das GTP zu GDP hydrolysiert und so inaktiviert. Die G-Protein-Untereinheit kann nun wieder an die beiden anderen G-Protein-Untereinheiten binden. Sobald sich die drei Untereinheiten zusammengefügt haben, kann das G-Protein erneut an einen aktivierten Rezeptor binden. Nach der Bindung tauscht der aktivierte Rezeptor das GDP auf dem G-Protein gegen GTP aus und der ganze Zyklus beginnt von vorne.

Abb. 6: G-Protein gekoppelter Rezeptor
Intrazelluläre Rezeptoren (Abb. 7) sind in der Zelle lokalisiert und dienen dem Erkennen von physikalischen Reizen wie Licht (z. B. einige Photorezeptoren bei Pflanzen) oder von Signalmolekülen, die durch die Plasmamembran diffundieren können (z. B. Steroidhormone bei Tieren). Bei zahlreichen intrazellulären Rezeptoren handelt es sich um Transkriptionsfaktoren, von denen wiederum einige bis zu ihrer Aktivierung im Cytoplasma lokalisiert sind. Nach Bindung ihres Liganden diffundieren diese Transkriptionsfaktoren durch die Kernporen in den Zellkern, wo sie an die DNA binden und die Expression von bestimmten Genen modulieren. Ein typisches Beispiel dafür ist der Rezeptor des Steroidhormons Cortisol. Der Rezeptor ist normalerweise an ein Chaperonprotein gebunden, das die Diffusion des Rezeptors in den Zellkern verhindert. Durch die Bindung eines Hormons verändert der Rezeptor seine Struktur, sodass er sich vom Chaperon löst. Dies ermöglicht es dem Rezeptor, in den Zellkern zu diffundieren, wo er die Transkription der DNA beeinflusst. Eine andere Gruppe von intrazellulären Rezeptoren ist stets im Zellkern lokalisiert, sodass ihre Liganden bis dorthin gelangen müssen, bevor sie an den Rezeptor binden können.
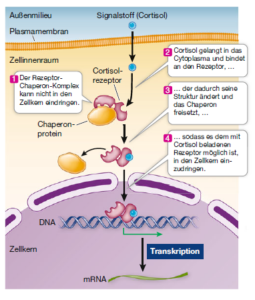
Abb. 7: Intrazellulärer Rezeptor
Signalkaskaden und sekundäre Botenstoffe
Es gibt verschiedene Arten von Signalen und Rezeptoren und wie zu erwarten ist, variieren auch die Wege, auf denen die Signale übertragen werden, wie auch die ausgelösten zellulären Reaktionen. Einige Signaltransduktionswege sind verhältnismäßig einfach und direkt, andere hingegen umfassen zahlreiche Schritte. Daran können Enzyme und auch Transkriptionsfaktoren beteiligt sein. Außerdem können weitere Moleküle, die man als sekundäre Botenstoffe (second messenger) nennt, durch das Cytoplasma diffundieren und Zwischenschritte im Signalübertragungsweg vermitteln. In vielen Fällen kann ein Signal eine Kaskade von Ereignissen auslösen, bei denen Proteine mit anderen Proteinen in Wechselwirkung treten, die wiederum mit weiteren Proteinen interagieren, bis die letztendlichen Reaktionen ablaufen. Über solch eine auf Proteinen basierende Signaltransduktionskaskade kann ein ursprüngliches Signal in der Zelle sowohl verstärkt als auch verteilt werden, um so in der Zielzelle verschiedene Reaktionen hervorzurufen. Wir haben uns z. B. die G-Protein-gekoppelten Rezeptoren angeschaut, bei dem ein G-Protein solch eine Signaltransduktionskaskade auslöst (Abb. 6). G-Proteine fungieren als eine Art Schalter, die sich im „An“- oder auch im „Aus“-Zustand befinden können. Stehen sie auf „Aus“, dann ist GDP an das G-Protein gebunden, im „An“-Zustand ist das Protein mit GTP beladen. Eines der bekannten G-Proteine heißt Ras, welches eine Reihe von Ereignissen in Gang setzt, bei denen eine Proteinkinase die nächste aktiviert und so weiter (Abb. 8).
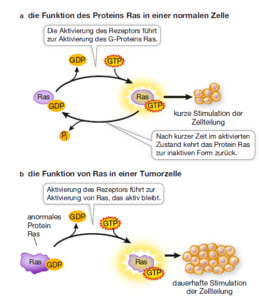
Abb. 8: Das G-Protein Ras
Einen solchen Vorgang bezeichnet man als Proteinkinasekaskade (Abb. 9). Derartige Kaskaden sind zentraler Bestandteil der Regulation zahlreicher zellulärer Aktivitäten.
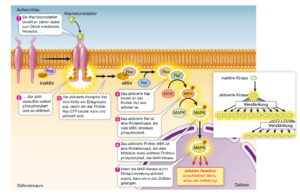
Abb. 9: Eine Proteinkinasekaskade. Bei einer Proteinkinasekaskade wird eine Reihe von Proteinen nacheinander aktiviert.
Proteinkinasekaskaden sind aus vier Gründen nützliche Signalüberträger:
- Bei jedem Schritt der Kaskade erfolgt eine Verstärkung des Signals, da jedes neu aktivierte Proteinkinasemolekül ein Enzym ist, das die Phosphorylierung von zahlreichen Zielproteinmolekülen katalysieren kann.
- Die Information, dass ein bestimmtes Signal an der Plasmamembran angekommen ist, wird in den Zellkern übertragen, wo häufig die Expression zahlreicher Gene moduliert wird.
- Die Vielzahl der Schritte gewährleistet eine Spezifität des Vorgangs.
- Unterschiedliche Zielproteine in den einzelnen Schritten der Kaskade erlauben eine Variation der Reaktion.
In vielen Fällen existiert ein kleines Molekül, das zwischen den aktivierten Rezeptor und den Beginn der eigentlichen Kaskade geschaltet ist. Ein solches Molekül wurde entdeckt, als man die Aktivierung des Leberenzyms Glykogen-Phosphorylase durch das Hormon Adrenalin untersuchte. Dieses Hormon wird freigesetzt, wenn sich ein Tier in einer Stresssituation befindet und schnell Energie für die Kampf-oder-Flucht-Reaktion verfügbar sein muss. Die Glykogen-Phosphorylase katalysiert den Abbau von Glykogen, das in Leberzellen gespeichert ist, sodass die entstehenden Glucosemoleküle in das Blut freigesetzt werden können. Das Enzym kommt im Cytoplasma der Leberzellen vor, ist jedoch inaktiv, wenn kein Adrenalin vorhanden ist.
Wie sich herausstellte, kann das Adrenalin die Glykogen-Phosphorylase auch in Leberzellextrakten aktivieren, aber nur dann, wenn der gesamte Zellinhalt inklusive Fragmenten der Plasmamembran vorhanden ist. Unter diesen Bedingungen war Adrenalin an die Fragmente der Plasmamembranen gebunden (wo der Adrenalinrezeptor lokalisiert ist), aber die aktivierte Phosphorylase befand sich frei in der Lösung. Die Zugabe von Adrenalin zum Cytoplasma mit der inaktiven Phosphorylase führte nicht zu einer Aktivierung des Enzyms. Daraus konnte abgeleitet werden, dass das Signal von Adrenalin über einen Die Wissenschaftler sekundären Botenstoff (second messenger) übertragen wird. Dieser sekundäre Botenstoff ist das zyklisches AMP (cAMP). Es wird von dem Enzym Adenylat-Cyclase aus ATP gebildet. Die Adenylat-Cyclase wird vom G-Protein-gekoppelten Adrenalinrezeptor aktiviert (Abb. 10).
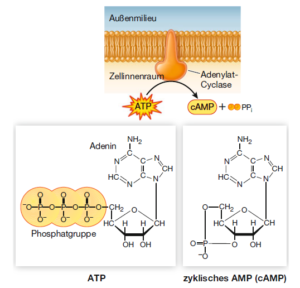
Abb. 10: Die Bildung von zyklischem AMP. Die Bildung von cAMP aus ATP wird von der Adenylat-Cyclase katalysiert, die durch G-Proteine aktiviert wird.
Im Gegensatz zur hohen Spezifität der Rezeptorbindung erlauben es sekundäre Botenstoffe wie cAMP der Zelle, auf ein einzelnes Ereignis an der Plasmamembran mit einer Vielzahl an zellulären Ereignissen innerhalb der Zelle zu reagieren. Sekundäre Botenstoffe dienen also dazu, das Signal rasch zu verstärken und zu verbreiten. So führt beispielsweise die Bindung eines einzigen Adrenalinmoleküls zur Produktion von zahlreichen Molekülen cAMP, die dann ebenso viele Kopien des Zielenzyms aktivieren, indem sie nichtkovalent an diese binden.
Im Fall von Adrenalin und der Leberzelle ist die Glykogen-Phosphorylase zudem nur eines von mehreren Enzymen, die aktiviert werden.
Sekundäre Botenstoffe sind häufig an der Vernetzung von Signalwegen, dem Crosstalk, beteiligt. Die Aktivierung des Adrenalinrezeptors ist nicht der einzige für eine Zelle gangbare Weg, um cAMP herzustellen; es gibt zahlreiche Ziele für cAMP in der Zelle, die gleichzeitig Komponenten anderer Signalwege darstellen.
Auch einige Lipide sind als sekundäre Botenstoffe bekannt. Bei der Bildung bestimmter sekundärer Botenstoffe werden gewisse Phospholipide durch Enzyme, die man als Phospholipasen bezeichnet, durch hydrolytische Spaltung in ihre Bestandteile zerlegt.
Die am besten untersuchten Beispiele für von Lipiden abgeleitete sekundäre Botenstoffe hängen mit der Hydrolyse des Phospholipids Phosphat-Idylinositol-4,5-bisphosphat (PIP2) zusammen. Wie alle Phospholipide hat PIP2 einen hydrophoben Teil, der in die Plasmamembran eingebettet ist: zwei an Glycerol gebundene Fettsäureschwänze, zusammen als Diacylglycerol (DAG) bezeichnet. Der hydrophile Anteil von PIP2, der in das Cytoplasma hineinragt, ist Inositoltrisphosphat (IP3).
Wie bei cAMP sind die Rezeptoren, die zu diesem System der sekundären Botenstoffe gehören, häufig mit G-Proteinen gekoppelt. Eine G-Protein-Untereinheit wird durch den Rezeptor aktiviert, diffundiert dann innerhalb der Plasmamembran und aktiviert die Phospholipase C, ein Enzym, das sich in der Membran befindet. Dieses Enzym spaltet IP3 von PIP2 ab, sodass in der Lipiddoppelschicht Diacylglycerol (DAG) entsteht: Sowohl IP3 als auch DAG sind sekundäre Botenstoffe. Sie gehören zu unterschiedlichen Signalübertragungswegen, die einander unterstützen und beide die Proteinkinase C (PKC) aktivieren.
Auch Calciumionen können als sekundäre Botenstoffe dienen. Sie kommen in den meisten Zellen nur in geringen Mengen vor. Außerhalb der Zellen und innerhalb des endoplasmatischen Reticulums ist die Ca2+-Konzentration oftmals viel höher. Ca2+ -Pumpen in der Plasmamembran und der ER-Membran halten die Konzentrationsunterschiede unter ATP-Verbrauch aufrecht, indem sie Ca2+ aus dem Cytosol befördern. Anders als cAMP und die von Lipiden abgeleiteten sekundären Botenstoffe kann die Zelle Ca2+ nicht herstellen, sondern muss diese Ionen aus der Umgebung aufnehmen. Der Ca2+ -Spiegel im Cytoplasma und in Organellen wird durch das Öffnen und Schließen von Ca2+ -Ionenkanälen und die Aktivität der membranständigen Ca2+– Pumpen reguliert.
Zahlreiche Signalstoffe können Calciumkanäle öffnen, beispielsweise IP3. Das Eindringen des Spermienzellkerns in eine Eizelle ist ein sehr wichtiges Signal, das zum Öffnen zahlreicher Calciumkanäle führt. Dadurch kommt es zu beträchtlichen Veränderungen, die das nun befruchtete Ei auf die anstehenden Zellteilungen vorbereiten. Unabhängig davon, welches Signal zum Öffnen der Calciumkanäle geführt hat, das Ergebnis ist eine deutliche Zunahme der Ca2C-Konzentration im Zellplasma, die innerhalb eines Sekundenbruchteils um das Hundertfache ansteigen kann. Diese Zunahme aktiviert die Proteinkinase C.


