Das Problem mit der Ursuppe
Die letzten Beiträge befassten sich mit der Herstellung von Biomolekülen unter präbiotischen Bedingungen. Wir konnten zeigen, dass nahezu alle organischen Moleküle unter natürlichen Bedingungen entstehen können. Doch das ist nur der erste Schritt auf dem langen Weg zur ersten Zelle. Tatsächlich reicht es definitiv nicht aus, einige Moleküle miteinander reagieren zu lassen, um lebende Systeme zu erschaffen. Leben ist tatsächlich mehr als „nur Chemie“ (Branscomb & Russel 2018a,b).
Text als pdf
Worin liegt der Unterschied zwischen der Chemie des Lebens und der nicht-lebender Systeme?
Liegt z. B. eine chemische Reaktion vom Typ A + B↔C +D vor, stellt sich nach einer gewissen Zeit ein Gleichgewicht zwischen den Ausgangsstoffen A und B und den Endprodukten C und D ein (Abb. 1).
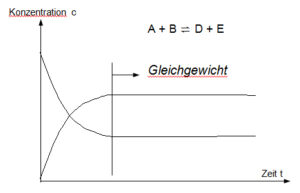
Abb. 1: Zeitlicher Verlauf der Geschwindigkeiten von Hin- und Rückreaktion bei der Einstellung des chemischen Gleichgewichts
Lebende Systeme hingegen zeichnen sich durch ein thermodynamisches Ungleichgewicht aus. Lebende Systeme existieren nur im ständigen Austausch von Stoffen und Energie mit ihrer Umwelt, anders wäre die Aufrechterhaltung der inneren Ordnung nicht möglich. Jedes Lebewesen ist daher in ein Ökosystem einbezogen, welchem es Stoffe und Energie entnehmen kann. Lebende Systeme befinden sich daher nicht im thermodynamischen Gleichgewicht, sondern in einen dynamischen Fließgleichgewicht (Abb. 2). Trotz des ständigen Material- und Energieaustausches mit der Umgebung bleiben die inneren Systemeigenschaften relativ konstant (Homöostase), was durch komplizierte Rückkopplungsmechanismen erreicht wird. Leben ist nur möglich als Eigenschaft sehr komplexer Systeme. Lebende Systeme zeichnen sich durch eine sehr inhomogene, insbesondere räumlich und zeitlich aperiodische Struktur aus. Sie haben eine innere Ordnung (stoffliche Ungleichverteilung), welche über längere Zeiträume relativ unabhängig von der Umgebung existiert.
Die molekularen Umwandlungen des Lebens müssen eine Anforderung an chemische Spezifität erfüllen. Dazu gehören z. B. die Kontrolle über die Auswahl der Reaktanten und die Kontrolle darüber, welche Produkte entstehen; Anforderungen, die die Chemie nicht-lebender Systeme in keiner Wiese erfüllen kann. Des Weiteren unterliegen die meisten Molekülumwandlungen einer strengen quantitativen Kontrolle als Reaktion auf sich ändernde Bedürfnisse und Bedingungen, die weitgehend auf andere, im Allgemeinen kleine Signalmoleküle reagiert, die keine direkte chemische Rolle bei der Umwandlung spielen. Ein lebendes System muss also dynamisch und steuerbar sein.
Jedes lebende System befindet sich also in einem physikalischen Zustand, der extrem weit vom Gleichgewicht entfernt ist, einem Zustand, den es selbst herstellen und aufrechterhalten muss. Dies wiederum setzt voraus, dass es alle seine molekularen Transformationen – zwangsläufig solche, die Ungleichgewichte umwandeln und damit schaffen – mit Hilfe von fallspezifischen mechanochemischen makromolekularen Maschinen durchführt. Hierzu gehören z. B. Protonenpumpen wie die ATP-Synthase. Diese inhärente Abhängigkeit des Lebens von makromolekularen Maschinen, die Ungleichgewichte umwandeln, ist auch eine zwingende Voraussetzung für die Entstehung des Lebens (Lane 2010).

Abb. 2: in lebenden Systemen herrscht ein Fließgleichgewicht. Unter Fließgleichgewicht versteht man einen stationären Zustand, bei dem kontinuierlich Substanzen (Edukte) in ein System einströmen und Reaktionsprodukte herausgeschleust werden. Durch ständigen Stoffaustausch mit der Umwelt wird verhindert, dass sich ein Gleichgewicht der Reaktionen einstellt. Durch ständigen Stoffaustausch mit der Umwelt wird verhindert, dass sich ein chemisches Gleichgewicht der einzelnen Reaktionen einstellt. Die Gleichgewichte der verschiedenen Teilreaktionen werden angestrebt, aber nie erreicht. Dadurch ist das Reaktionssystem zu dauernder Arbeitsleistung fähig. Das von der lebenden Zelle aufrechterhaltene Ungleichgewicht wird als Fließgleichgewicht bezeichnet.
Das ist genau das Problem mit der Ursuppe: sie ist thermodynamisch gesehen im Gleichgewicht. Nichts in der Suppe will wirklich reagieren. Es gibt kein Ungleichgewicht, keine treibende Kraft, die das Leben den unsagbar steilen energetischen Hang hinaufjagen könnte, an dessen Ende die Bildung wirklich komplexer Polymere steht.
Die frühen Ansätze in der Abiogenese-Forschung – von Darwins „warmen kleinen Teich“ (Darwin 1871), über die Vermutungen von Oparin (1953), Haldane (1929) und Bernal (1951) über eine Ursuppe, hin zum Experiment von Urey und Miller (Miller 1953), bis hin zu einem Großteil der heutigen Arbeiten über den Ursprung – und nicht die Entstehung – von Leben wurde allgemein angenommen, dass die richtige “Suppe” von Molekülen irgendeiner Form von “Energie” ausgesetzt werden muss, um “abiogen” Leben zu erzeugen (Bada & Lazcano 2003, Bonfio et al. 2017, Burcar et al. 2016, Deamer 2009, Hud et al. 2013, Izgu et al. 2016, Kobayashi et al. 2017, Mulkidjanian et al. 2012, Pascal et al. 2013, Ritson & Sutherland 2013, Ruiz-Mirazo et al. 2014, Saladino et al. 2009, Van Kranendonk et al. 2017, Zhu et al. 2012).
Mehr oder weniger implizit und zunehmend explizit wird das Erfordernis der Energiezufuhr als Ausdruck der Notwendigkeit gesehen, das System in einen Zustand des thermodynamischen Ungleichgewichts zu versetzen, um die erforderlichen Reaktionen, wie Polymerisationen, anzutreiben und ablaufen zu lassen (Sutherland 2014, Deamer 2009, Ross & Deamer 2016). Und mehr oder weniger explizit wird gewöhnlich angenommen, dass die vollständige Entstehung von Leben – zum Beispiel einer RNA-Welt – dann von selbst beginnen würde.
Es erinnert ein wenig an Mary Shelleys „Frankenstein“. In Shelleys Erzählung erweckt Victor Frankenstein die Kreatur, bestehend aus Leichenteilen, mittels Elektrizität zum Leben.
Es reicht offensichtlich nicht aus, eine Ursuppe mit Energie zu versorgen, und voila, das Leben entsteht. Dass man unter den unvermeidlichen Myriaden von organischen Produkten solcher Experimente und Prozesse einige “Bausteine des Lebens” finden kann zu finden, ist hierbei völlig irrelevant und irreführend.
Die Vorstellungen von der energetisierten Suppe sind nicht nur deshalb unhaltbar, weil sie falsch sind, was die “Energie” angeht und wie diese physikalische Größe in die Prozesse einfließt, die das Leben antreiben (Branscomb et al. 2017); sie sind auch insofern falsch, als dass sie auf grundlegenden Missverständnissen darüber beruhen, was für eine Art von Phänomen “Leben” ist – vor allem auf der Annahme, dass es in irgendeinem allgemein gültigen Sinne als “Chemie in einem Behälter” betrachtet werden kann, selbst wenn diese Chemie auf irgendeine Weise von außen “energetisiert” oder ständig neu versorgt werden muss (Dyson 2004).
Gegen diese – salopp formuliert – „Frankenstein-These“ in der Abiogenese-Forschung gibt es einige stichhaltige Gegenargumente (Kurland 2010, Lane et al. 2010, Maden 1995, Shapiro 2000).
Aber schon Oparin hat in einem Buch über die Entstehung des Lebens bemerkt, dass, ein Gemisch, welches alle Enzyme und anderen Stoffe hat, die in einer lebenden Zelle vorhanden sind, lebensunfähig ist, da es an einer bestimmten physikalisch-chemische Organisation fehlt (Oparin 1953). Ebenso erkannte John D. Bernal, dass es nicht genüge die Bildung solcher Moleküle zu erklären. Erforderlich ist eine physikalisch-chemische Erklärung für die Entstehung dieser Moleküle, die auf das Vorhandensein geeigneter Quellen und Senken für freie Energie schließen lässt (Bernal 1951).
Außerdem hat Oparin im Gegensatz zu der elektrisch angezapften Leiche in Dr. Frankensteins Labor nicht behauptet, dass solche Extrakte, wenn sie der richtigen “Energiezufuhr” ausgesetzt würden, “lebendig” würden. In der Tat hätte jede derartige Energiezufuhr einen solchen Extrakt unweigerlich in genau die falsche chemische Richtung bewegt. Auch hätten die Extrakte nicht die kleinsten zögerlichen Schritte in Richtung Leben unternommen.
Wenn also die Ursuppenexperimente zwar die Entstehung von Biomolekülen, nicht jedoch die Entstehung des Lebens erklären können und das Leben eine komplexere Chemie hat, bedeutet das, dass hinter der Entstehung des Lebens doch eine höhere Macht tätig war? Hat der Vitalismus doch recht und wir können uns die Abiogenese-Forschung sparen? Keineswegs. Der Motor für die Entstehung des Lebens stammt nicht aus der Ursuppe und auch nicht aus dem Weltraum, sondern woanders.
Schwarze Raucher
Der erste Schlüssel sind die untermeerischen hydrothermalen Quellen, die sog. Schwarzen Raucher, die in mehreren tausend Metern Tiefe auf dem Meeresboden liegen (vgl. Van Dover 2000, Karl 1995, Müller & Hoffmann-Wieck 2020, Abb. 3).
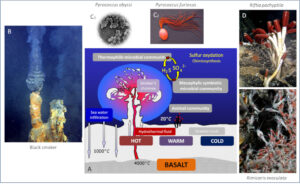
Abb. 3: Schwarze Raucher und ihr Ökosystem. (A) Schematische Darstellung einer ozeanischen hydrothermalen Quelle (schwarze Raucher). (B) Schwarzer Raucher. (C-E) Einige mit Schwarzen Rauchern assoziierte Arten: C1 und C2, zwei Arten hyperthermophiler sulfatoxidierender Mikroorganismen Pyrococcus abyssi und Pyrococcus furiosus; D, Riesenwürmer Riftia pachyptila; E, Garnele Rimicaris exoculata.
Im Jahr 1977 fuhren Wissenschaftler mit kleinen U-Booten über die mittelozeanischen Rücken am Meeresboden, wo sich der Meeresboden ausbreitet und neue ozeanische Kruste gebildet wird. Zu ihrem Erstaunen entdeckten sie Stellen, an denen die vulkanische Hitze das Meerwasser überhitzte und unterseeische heiße Quellen hervorbrachte. Schwankende Schwarze Schornsteine, manche so hoch wie Häuser, pumpen schwarze Rauchschwaden in das darüberliegende Meer. Der Rauch ist jedoch kein richtiger Rauch. Es handelt sich um kochende metallische Sulfide, die ins Meerwasser eindringen und aus der heißen Magmakammer darunter hervorquellen. Sie sind sauer wie Essig und erreichen unter dem großen Druck der Meerestiefen Temperaturen von 400°C, bevor sie sich in das kalte Meerwasser ergießen. Die höchsten Wassertemperaturen, die an Schwarzen Rauchern gemessen wurden, erreichten die beiden Schlote Two Boats und Sister Peaks auf dem Mittelatlantischen Rücken in 3000 Metern Tiefe, welche bei einem Wasserdruck von 298 bar bis zu 464 °C heißes Wasser schwadenweise ausstoßen. Sicher bekannt sind derzeit 224 aktive und ca. 90 inaktive Hydrothermalquellen (Abb. 4).
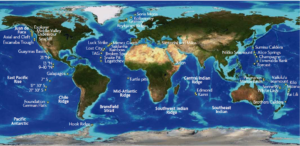
Abb. 4: Globale Verteilung der bekannten hydrothermalen Schlote.
Die Schornsteine selbst werden von Schwefelmineralien wie Eisenpyrit, Kalziumsulfat, Blei- und Zinksulfat aufgebaut, die sich aus den schwarzen Rauch abscheiden und über weite Bereiche in dicken Ablagerungen ansammeln. Manche Schornsteine wachsen rasch, bis zu 30 cm am Tag und können Höhen von bis zu 60 m erreichen, bevor sie in sich zusammenfallen. Diese bizarre Welt erinnert an eine Vision der Hölle, vollgestopft mit Schwefel und dem faulen Gestank von Schwefelwasserstoff, der aus den Schwarzen Rauchern rausströmte.
Während ihre Existenz nicht überraschte, war die Fülle des Lebens, die in diesen dunklen Tiefen herrschte wie ein Schock. Die Hölle erweist sich als Paradies für eine Reihe bizarrer Lebewesen.
In dieser heißen, dunklen Umgebung lebt eine dichte Population sulfidreduzierender Bakterien, die Schwefelwasserstoff (H2S) aufnehmen und verstoffwechseln, indem sie ihn anstelle von Wasser als Wasserstoffquelle nutzen.
Von dieser Bakterienpopulation ernährt sich eine riesige Gemeinschaft bizarrer Tiere, die man noch nie zuvor gesehen hatte, darunter gigantische Muscheln, riesige bis zu 3m lange Röhrenwürmer, seltsame Krebse und einige Tiere, die der Wissenschaft völlig neu waren. Die Populationsdichten an Tiefseeschloten sind mit denen des Regenwaldes oder den Korallenriffen vergleichbar. Der Unterschied besteht darin, dass das Leben hier nicht von der Sonne, sondern durch die Exhalationen der Schlote gespeist wird. Das Leben an den schwarzen Rauchern erträgt diese höllischen Bedingungen nicht nur, es kann ohne sie nicht existieren. Es geschieht durch sie, aber wie?
Die Antwort liegt in der Ungleichheit. Während Meerwasser zum Magma unter den Schwarzen Rauchern durchsickert, wird sie stark erhitzt und mit Mineralen und Gasen angereichert, insbesondere mit Schwefelwasserstoff. Schwefelbakterien können den Wasserstoff aus dieser Verbindung lösen, ihn mit CO2 verbinden und so organisches Material bilden. Diese Reaktion ist die Grundlage des Lebens an den Schloten. Sie erlaubt es Bakterien zu gedeihen, ohne dass dazu Sonnenlicht nötig wäre. Jedoch kostet die Umwandlung von CO2 in organisches Material Energie und um diese zu gewinnen, brauchen die Schwefelbakterien Sauerstoff. Durch diese Reaktion zwischen Schwefelwasserstoff und Sauerstoff wird die Energie frei, die die Welt an den Schloten zum Leben erweckt. Sie ist mit der Reaktion von Wasserstoff und Sauerstoff vergleichbar, die unser Leben in Gang hält. Es entsteht Wasser, wie zuvor, aber auch elementarer Schwefel, der den Schwefelbakterien ihren Namen gab. Die Bakterien nutzen also nicht die Wärme der Schlote, sondern nur den Schwefelwasserstoff. Dieses Gas ist von Natur aus nicht sehr energiereich. Erst durch die Reaktion mit Sauerstoff wird Energie frei. Diese Reaktion ist wiederrum auf die Kontaktzone zwischen Schlot und Meerwasser angewiesen, auf die Gegenüberstellung zweier Welten in einem dynamischen Ungleichgewicht. Nur die Bakterien, die in direkter Nachbarschaft der Schlote leben und von beiden Welten gleichzeitig zehren, sind in der Lage, diese Reaktionen ablaufen zu lassen. Die Tiere, die an den Schloten leben, weiden entweder die Bakterien ab, wie die Garnelen, oder züchten Bakterien in ihrem Inneren.
Diese erstaunliche chemosynthetische Gemeinschaft unterscheidet sich völlig von den auf Pflanzen basierenden photosynthetischen Ökologien anderswo auf der Erde. Der wichtigste Hinweis darauf ist, dass sie von den ursprünglichsten Lebensformen bewohnt wird, die auf der Erde bekannt sind, den sulfidreduzierenden Archaebakterien. Für viele Wissenschaftler deutet dies darauf hin, dass die einfachsten Lebensformen nicht an der Oberfläche in Darwins „warmem kleinen Teich“ entstanden sind, sondern in einer heißen Quelle in der Tiefsee, wo sie geschützt gewesen wären, wenn Einschläge die flachen Ozeane verdampft hätten.
Hier sind vor allem die Theorien von Günter Wächtershäuser hervorzuheben, der die Bedeutung von Pyritkristallen für die Polymerisation von Biomolekülen erkannt hat. Pyritkristalle haben eine positive Ladung auf der Oberfläche, die die negativ geladenen Enden vieler organischer Moleküle anziehen könnte. Sobald sie angezogen, aufgereiht und dicht aneinander gepackt sind, können sich die organischen Moleküle leicht zu komplexen Polymeren verbinden. Sobald sie miteinander verbunden sind, können sie sich vom Pyrit-Muster lösen und als freie Biomoleküle schwimmen. Seine Theorie ist auch als Oberflächenmetabolismus bekannt (Wächtershäuser 1988a; 1988b; 1990; 1992; 1994; 2000, 2006, 2007, Huber & Wächtershäuser 1997, Huber et al. 2012 ). Als Grundlage der Erzeugung wichtiger chemischer Verbindungen dient Schwefelwasserstoff (H2S), der neben Kohlenmonoxid, Methan, Stickstoff und CO2 beständig aus heißen Schloten der Tiefsee ausgast. Dieser reagiert mit Eisenmonosulfid (Mackinawit, FeS) zu Pyrit. Bei dieser Reaktion wird Wasserstoff (H2) gebildet und Energie frei, die zur Erzeugung von so wichtigen Grundstoffen wie Blausäure oder Ammoniak genutzt werden kann (Dörr et al. 2003, Abb. 5). Auf der Pyritoberfläche gebunden könnten daraus wiederum Aminosäuren und diverse Zucker entstanden sein, die in der Lage sind, lange Polymere zu erzeugen, aus denen sich stufenweise Isoprenoide, Hüllmembranen und einfache Stoffwechselprozesse gebildet haben könnten.

Abb. 5: Eisen-Schwefel-Welt nach Wächtershäuser
Diese Eisen-Schwefel-Welt als Ursprung des Lebens wird auch gestützt durch die Tatsache, dass noch heute viele Enzyme Übergangsmetall-Schwefel-Komplexe enthalten, insbesondere zur Katalyse anaerober (und damit stammesgeschichtlich meist sehr alter) Reaktionen (Follmann 2004, Russel & Martin 2004; Abb.6).
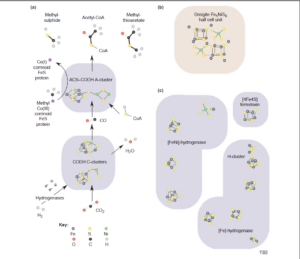
Abb. 6 Strukturelle Ähnlichkeit zwischen (Fe,Ni)S-Zentren in Enzymen und in Mineralien.
(a) Darstellung der Kohlenmonoxid-Dehydrogenase (CODH) und Acetyl-Coenzym-A (CoA)-Synthetase (ACS) Reaktion, basierend auf den bei Dobbeck et al. (2001), Doukov et al. (2002), Svetlitchnyi et al. (2004), Ragsdale & Kumar (1996), Lindahl (2002) und Darnault et al. (2003) zusammengefassten Strukturdaten. Der genaue Reaktionsmechanismus für ACS ist nicht geklärt: Es wurden unterschiedliche Vorschläge unterbreitet, und es wurde auch über Unterschiede hinsichtlich des Vorhandenseins von Kupfer, Zink und Nickel an der aktiven Stelle des A-Clusters berichtet; Nickel wurde an der aktiven Stelle des aktiven Enzyms gefunden. Es sind nur ausgewählte Metallsulfidzentren von CODH und ACS dargestellt; die Proteinstruktur ist schattiert dargestellt. Die Strukturen von Methylsulfid, das durch FeS-Katalyse aus H2S und CO2 synthetisiert wurde (Heinen & Lauwers 1996), und Methylthioacetat (Acetylmethylsulfid), das durch NiS- und FeS-Katalyse aus CO und Methylsulfid synthetisiert wurde (Huber & Wächtershäuser 1997), sind zum Vergleich oben dargestellt. Ein Reaktionsmechanismus für die letztgenannte mineralkatalysierte Synthese wurde vorgeschlagen (Huber & Wächtershäuser 1997).
(b) Struktur der Fe42.5+S4-“Cuban”-Einheit in einer Halbzelle des metastabilen Minerals Greigit (SNiS)(Fe4S4)(SFeS); siehe Ref. (Russel & Hall 1997) für weitere strukturelle Details und Vergleiche.
(c) Die Fe4S4-“Thiocuban”-Einheiten in anderen Proteinen, die für den Acetyl-CoA-Weg relevante Reaktionen katalysieren, nämlich ein Ferredoxin (Russel & Hall 2002), eine [FeNi]-Hydrogenase (Volbeda & Fontecilla-Camps 2003) und eine reine Eisen-[Fe]-Hydrogenase (Nicolet et al. 1997), deren aktives Zentrum als “H-Cluster” bezeichnet wird. Abbildung nach Russel & Martin (2004).
Die Schlote lösen umgehend viele Probleme, die man mit der Ursuppe hatte, besonders das der Thermodynamik. In dem aufsteigenden schwarzen Rauch herrschte kein Gleichgewicht, wodurch chemische Reaktionen ablaufen konnten. Doch auch in dieser Tiefe, frei von Sonnenlicht, sind die heutigen Schwarzen Rauche doch vom Sonnenlicht indirekt abhängig und zwar von der Photosynthese. Die Tiere, die hier leben, sind auf symbiotische Beziehungen mit Bakterien angewiesen, die das Schwefelwasserstoffgas oxidieren, das aus den Rauchern austritt. Dies ist die Hauptquelle des Ungleichgewichts: Schwefelwasserstoff (H2S) ist ein reduziertes Gas, das mit Sauerstoff reagiert und dabei Energie freisetzt, welche in Form des ATP gespeichert wird. Sauerstoff ist jedoch ein Nebenprodukt der Photosynthese und war auf der frühen Erde, vor der Entwicklung der Photosynthese, nicht vorhanden. Die erstaunliche Eruption von Leben in der Nähe dieser Black-Smoker-Schlote ist also vollständig, wenn auch indirekt, von der Sonne abhängig. Und das bedeutet, dass diese Schlote vor 4 Milliarden Jahren noch ganz anders ausgesehen haben müssen. Die Reaktion zwischen Schwefelwasserstoff und Sauerstoff kann demzufolge nicht die treibende Kraft gewesen sein.
Nimmt man den Sauerstoff weg, was bleibt dann übrig? Nun, schwarze Raucher entstehen durch die direkte Wechselwirkung von Meerwasser mit Magma an vulkanisch aktiven Orten. Das Wasser sickert durch den Meeresboden zu den Magmakammern in der Tiefe, wo es sofort auf Hunderte von Grad erhitzt und mit gelösten Metallen und Sulfiden angereichert wird, wodurch das Wasser stark sauer wird. Wenn das überhitzte Wasser mit explosiver Kraft wieder in den Ozean aufsteigt, kühlt es abrupt ab. Winzige Partikel von Eisensulfiden wie Pyrit fallen sofort aus. Das meiste davon wäre auch vor 4 Milliarden Jahren so gewesen (Pinti 2005), aber nichts von dieser vulkanischen Aktivität ist für das Leben verfügbar. Nur die chemischen Gradienten spielen eine Rolle, und genau da liegt der Haken. Der chemische Schub, den der Sauerstoff liefert, hätte gefehlt. Der Versuch, Schwefelwasserstoff mit CO2 zu organischen Stoffen reagieren zu lassen, ist viel schwieriger, insbesondere bei hohen Temperaturen.
Wächtershäuser schlug eine Methode zur Reduktion von CO2 zu organischen Molekülen an der Oberfläche des Minerals Eisenpyrit vor, die er als “Pyrits Pulling” bezeichnete. Im weiteren Sinne sprach Wächtershäuser von einer “Eisen-Schwefel-Welt”, in der Eisen-Schwefel-Mineralien (FeS) die Bildung organischer Moleküle katalysierten. Solche Minerale bestehen typischerweise aus sich wiederholenden Gittern aus Eisen (Fe2+) und Sulfid (S2).
Kleine Mineralcluster aus Eisen und Sulfid, die so genannten FeS-Cluster, bilden auch heute noch das Herzstück vieler Enzyme, einschließlich derer, die an der Atmung beteiligt sind (Dobbek 2008, Beinert 2000, Camprubi et al. 2017, Cody 2004, Russel et al. 2008, Abb. 6). Ihre Struktur ist im Wesentlichen identisch mit der Gitterstruktur von FeS-Mineralen wie Mackinawit und Greigit, was die Vorstellung untermauert, dass diese Minerale die ersten Schritte des Lebens katalysiert haben könnten. Doch obwohl FeS-Minerale gute Katalysatoren sind, zeigten Wächtershäusers eigene Experimente, dass das „Pyrit Pulling“, wie er es sich ursprünglich vorstellte, nicht funktioniert.
Da die Energie, die bei der Bildung von Eisenpyrit frei wird, nicht ausreicht, um CO2 in organisches Material umzuwandeln, kam Wächtershäuser auf die Idee, Kohlenmonoxid (CO) als reaktionsfreudiges Zwischenprodukt zu verwenden (Huber & Wächtershäuser 1997,1998). Dieses Gas wurde tatsächlich auch in den sauren Schloten entdeckt. Er überlegte sich weitere träge, organische Reaktionen mit unterschiedlichen Eisen-Schwefelmineralen, die außergewöhnliche Katalysekräfte zu haben schienen. Darüber hinaus gelang es Wächtershäuser und Kollegen viele dieser theoretischen Reaktionen im Labor nachzuweisen.
Die heikelste Schwachstelle an Wächtershäusers Modell ist das Konzentrationsproblem. CO wird zwar in den Schloten schwarzer Raucher gefunden, aber seine Konzentration ist verschwindend gering – es ist viel zu wenig, um eine ernsthafte organische Chemie zu betreiben. (Die CO-Konzentration ist 1.000-1.000.000-mal niedriger als die von CO2.) Es gibt noch weitere gravierende Probleme. Die Schwarzen Raucher sind übermäßig heiß; die Schlotflüssigkeiten treten mit 250-400°C aus, werden aber durch den extremen Druck am Meeresboden am Sieden gehindert. Bei diesen Temperaturen ist die stabilste Kohlenstoffverbindung CO2. Das bedeutet, dass eine organische Synthese nicht stattfinden kann; im Gegenteil, jede organische Verbindung, die sich bildet, sollte schnell wieder zu CO2 abgebaut werden. Die Vorstellung, dass die organische Chemie durch die Oberfläche von Mineralien katalysiert wird, ist ebenfalls problematisch. Entweder bleiben die organischen Stoffe an der Oberfläche gebunden, dann verklumpt alles, oder sie dissoziieren, dann werden sie mit ungebührlicher Eile in den Ozean gespült. Andere Probleme betreffen das saure Milieu der schwarzen Raucher. Wächtershäusers Reaktionen liefen jedoch unter basischen Bedingungen ab. Schwarze Raucher sind auch sehr instabil, sie wachsen und kollabieren im Laufe von höchstens ein paar Jahrzehnten. Das ist nicht viel Zeit, um Leben zu “erfinden”. Obwohl die Schwarzen Raucher sicherlich einige der Probleme der Ursuppe lösen, sind diese vulkanischen Systeme zu extrem und instabil, um die sanfte Kohlenstoffchemie zu nähren, die für den Ursprung des Lebens erforderlich ist (vgl. Lane 2017).
Was sie jedoch taten, und das war unabdingbar, war die Aufladung der frühen Ozeane mit katalytischen Metallen wie Eisen (Fe2+) und Nickel (Ni2+) aus dem Magma.
Weiße Raucher
Der Nutznießer all dieser im Ozean gelösten Metalle war eine andere Art von Schloten, die als alkalische hydrothermale Schlote, oder auch als Weiße Raucher, bekannt sind (Abb. 7). Diese lösen alle Probleme der Schwarzen Raucher. Weiße Raucher sind nicht vulkanisch und haben nicht die Dramatik der Schwarzen Raucher. Ihre Bedeutung für den Ursprung des Lebens wurde erstmals von dem revolutionären Geochemiker Mike Russell in einem kurzen Brief an Nature im Jahr 1988 aufgezeigt (Russel et al. 1988) und in einer Reihe von theoretischen Arbeiten in den 1990er Jahren weiterentwickelt (Russel et al. 1994, 1997, 1998, Russel 2003, 2011, vgl. auch Baross & Hoffmann 1985, Cody 2004, Herschy 2014, Herschy et al. 2014, Lane et al. 2010, Martin et al., 2008, 2014, Martin & Russel 2003, 2007, Martin 2012, Nitschke & Russel 2009, Russel et al. 2003, 2013, Shock 1992, Shock & Canovas 2010, Shock et al. 1998, Camprubi et al. 2017, Lane 2017, Branscomb & Russel 2018a,b).

Abb. 7: Unter dem Meeresboden reagieren eisenhaltige Krustenmaterialien wie Olivin und Pyroxen mit Wasser in einem Prozess, der Serpentinisierung genannt wird. Bei dieser Reaktion entsteht ein grünes Mineral namens Serpentin zusammen mit Wasserstoffgas und Methan, wobei auch Wärme freigesetzt wird. Alkalisches Grundwasser, das durch das zerklüftete Gestein zirkuliert, nimmt die Wärme und die Gase zusammen mit Metallionen auf und strömt unter Druck an die Oberfläche. An den Stellen, an denen es aus dem Meeresboden austritt, bewirken die Chemie- und Temperaturkontraste, dass sich Mineralien in rauchigen Schwaden und mineralisierten Schloten ablagern.
Weiße Raucher entstehen nicht durch die Wechselwirkung von Wasser mit Magma, sondern durch einen viel sanfteren Prozess – eine chemische Reaktion zwischen festem Gestein und Wasser. Gesteine aus dem Erdmantel, die reich an Mineralien wie Olivin sind, reagieren mit Wasser und bilden das hydratisierte Mineral Serpentinit, ein Prozess, der als Serpentinisierung bezeichnet wird (Russel et al. 2010, Sleep et al. 2004, 2011, Schulte 2006, Bach et al. 2006, Abb. 8). Die Abfallprodukte dieser Reaktion sind der Schlüssel zum Ursprung des Lebens. Olivin ist reich an Eisen und Magnesium. Das Eisen wird durch Wasser zu Eisenoxid oxidiert. Die Reaktion ist exotherm (setzt Wärme frei) und erzeugt eine große Menge Wasserstoffgas, das in warmen alkalischen Flüssigkeiten, die Magnesiumhydroxide enthalten, gelöst wird. Da Olivin im Erdmantel häufig vorkommt, findet diese Reaktion hauptsächlich auf dem Meeresboden in der Nähe der tektonischen Spreizungszentren statt, wo frisches Mantelgestein dem Ozeanwasser ausgesetzt ist. Mantelgestein wird nur selten direkt freigelegt – das Wasser sickert unter dem Meeresboden durch, manchmal bis in mehrere Kilometer Tiefe, wo es mit Olivin reagiert. Die dabei entstehenden warmen, alkalischen, wasserstoffreichen Flüssigkeiten haben einen größeren Auftrieb als das absteigende kalte Meerwasser und steigen wieder zum Meeresboden auf. Dort kühlen sie ab und reagieren mit im Meer gelösten Salzen, die sich in großen Schloten auf dem Meeresboden ablagern.

Abb. 8: Serpentinisierung
Diese Quellen unterscheiden sich also in nahezu jedem Detail von den Schwarzen Rauchern. Sie sind nicht sauer, sondern neigen zu einem stark basischen Milieu. Ihre Temperatur ist warm oder heiß, liegt jedoch erheblich unter den jenen der Schwarzen Raucher. Weiterhin tendieren sie dazu komplexe Strukturen zu bilden, durchsiebt von winzigen Blasen und Kammern, die sich an ihnen abscheiden, während die warmen, basischen, hydrothermalen Fluide in das darüberliegende kalte Meerwasser einströmen. Und genau diese komplexen Strukturen machen die Weißen Raucher, neben ihrer für chemische Reaktionen günstigen Bedingungen, für die Entstehung des Lebens so interessant.
Neben Mike Russel war ein weiterer Ideengeber für die Bedeutung der Weißen Raucher William F. Martin, ein amerikanischer Botaniker und Mikrobiologe. Erbrachte seine mikrobiologische Perspektive ein. Russell und Martin vertreten wie Wächtershäuser die Ansicht, bei der Entstehung des Lebens einfache autotrophe Reaktionen, wie die Reaktion einfacher Moleküle wie H2 und CO2, eine wichtige Rolle spielen. Autotrophe Stoffwechselreaktionen sind jene, die organische Moleküle aus einfachen anorganischen Vorläufern synthetisieren (Martin et al., 2008, 2014, Martin & Russel 2003, 2007, Martin 2012).
Des Weiteren betonen auch alle die Bedeutung von Eisen-Schwefel (FeS) Mineralien als frühe Katalysatoren. Die Tatsache, dass Russell, Martin und Wächtershäuser alle von hydrothermalen Schloten, FeS-Mineralen und autotrophen Ursprung sprechen, führt dazu, dass ihre Ideen leicht vermischt werden. In Wirklichkeit unterscheiden sich die Theorien von Russel und Martin von jenen von Wächtershäuser wie Tag und Nacht (oder weiß und schwarz).
Weil die weißen Raucher nicht vulkanischen Ursprungs sind, das Meerwasser mit den Gesteinen chemische Reaktionen eingeht und sich in den Gesteinen poröse Strukturen ausbilden, halten Russel und Martin die Weißen Raucher für die Entstehung des Lebens für geeigneter.
Diese basischen Schlote sind anhand weniger Fossilien nachgewiesen, so u. a. bei Tynagh in Irland, die etwa 350 Mio. Jahre alt sind. Als man Dünnschliffe dieser basischen Gesteine aus der Umgebung dieser fossilen Quellen unter dem Elektronenmikroskop untersuchte, konnte man sehen, dass diese Kammern ähnlich groß waren wie organische Zellen und labyrinthartig miteinander vernetzt waren (Banks 1985, für weitere Fossilfunde von schwarzen und weißen Rauchern siehe Georgieva et al. 2021). Russel nahm an, dass sich ähnliche mineralische Zellen bilden können, wenn sich Fluide basischer Quellen mit saurem Meerwasser vermischen, was er auch erfolgreich im Labor nachweisen konnte, indem er durch die Mischung von Basen und Säuren poröse Gesteinsstrukturen erzeugte. In einem Nature-Beitrag von 1988 bemerkte Russel, dass die basischen Bedingungen an den Schloten diese zu einem perfekten Brutplatz für Leben gemacht hätten (Russel et al. 1988). Die Kammern stellten eine natürliche Form von konzentrierten organischen Molekülen dar, während ihre Wände, die aus Eisen-Schwefel-Mineralen wie Malackwit bestehen, den mineralischen Zellen die katalytische Eigenschaft verliehen, die Wächtershäuser vorausgesagt hatte. In einer Veröffentlichung von 1994 schreiben Russel et al. Folgendes:
„Das Leben ging aus wachsenden Ansammlungen von Eisensulfidblasen hervor, die mit einer basischen und stark reduzierten, hydrothermalen Lösung gefüllt waren. Diese Blasen wurden vor vier Milliarden Jahren an sulfidischen untermeerischen, heißen Quellen, die sich in einiger Entfernung von den ozeanischen Spreizungsprozessen befinden, hydrostatisch gebildet.“ (Russel et al. 1994)
Zur Jahrtausendwende stießen Wissenschaftler an Bord des Tauchboots Atlantis genau auf solch einen Schlottyp. Sie fanden ihn etwa 15 km vom mittelatlantischen Rücken entfernt, auf einem untermeerischen Massiv, das ebenfalls den Namen Atlantis erhielt. Dieses alkalische Hydrothermalfeld trägt den Namen Lost City und stimmt bemerkenswerterweise mit fast allen Vorhersagen von Russell überein (Kelley et al. 2001, 2005, 2007, Früh-Green et al. 2003, Boetius 2005, Abb. 9).

Abb. 9: Mächtige Karbonat-Strukturen in der Lost City
In den Poren dieser Schlote herrscht rege bakterielle Betriebsamkeit, das chemische Ungleichgewicht wird hier voll und ganz ausgenutzt. Das Leben beruht auf der Reaktion von Wasserstoff mit CO2. Reiner Wasserstoff, der als Gas aus dem Untergrund aufsteigt, ist ein seltenes Geschenk auf unserem Planeten. Daher ist das Leben dazu gezwungen geheime Vorräte auszukundschaften, in denen die Atome in einer festen molekularen Verbindung mit anderen Atomen stehen, wie dies bei Wasser oder Schwefelwasserstoff ist. Den Wasserstoff von solchen Molekülen abzuspalten und an CO2 zu binden kostet Energie, die bei der Photosynthese von der Sonne geliefert wird. In den Schloten wird die Energie dagegen durch die Ausnutzung des chemischen Ungleichgewichtes gewonnen. Nur im Falle des Wasserstoffgases läuft die Reaktion spontan ab, wenn auch mühevoll und langsam. Aus thermodynamischer Sicht ist diese Reaktion jedoch ein kostenloses Mittagessen. Anders ausgedrückt, bringt die Reaktion auf direktem Wege organische Moleküle hervor und lässt dabei sofort eine beträchtliche Menge an Energie frei, die im Prinzip dazu genutzt werden kann, andere organische Reaktionen anzutreiben.
Der Bau der porösen Kammern der Schlote macht eine Anreicherung und Bau von Polymeren plausibel. Außerdem waren die Meere damals mit gelöstem Eisen angereichert und die mikroskopisch kleinen Kammern müssen katalytische Wände gehabt haben, die aus Eisen-Schwefel-Mineralien bestanden, wie die fossilen Schlote in Tynagh.
Wie genau solche Reaktionen abgelaufen sind und welche Bedeutung diese für die Bildung der ersten Zellen hatten, werden wir im nächsten Beitrag kennenlernen
Literatur
Bach, W. et al. (2006): Unraveling the sequence of serpentinization reactions: petrography, mineral chemistry, and petrophysics of serpentinites from MAR 15ºN (ODP Leg 209, Site 1274). Geophys. Res. Lett. 33, L13306.
Bada, J. L., Lazcano, A. (2003): Prebiotic Soup–Revisiting the Miller Experiment Science 300:745.
Banks, D. A (1985): fossil hydrothermal worm assemblage from the Tynagh lead–zinc deposit in Ireland. Nature 313, 128–131. https://doi.org/10.1038/313128a0
Baross JA, Hoffman SE (1985): Submarine hydrothermal vents and associated gradient environments as sites for the origin and evolution of life. Origins Life Evolution of the Biosphere 15: 327–45.
Beinert, H. (2000): Iron-sulfur proteins: ancient structures, still full of surprises. JBIC 5, 2–15 (2000). https://doi.org/10.1007/s007750050002
Bernal, J. D. (1951): The Physical Basis of Life. Routledge and Kegan Paul, London.
Boetius, A. (2005): Lost City Life. Science. 7 (5714): 1420–1422, doi:10.1126/science.1109849
Bonfio C, Valer L, Scintilla S, Shah S, Evans DJ, Jin L, Szostak JW, Sasselov DD, Sutherland JD, Mansy SS. (2017): UV-light-driven prebiotic synthesis of iron-sulfur clusters. Nat Chem. 9(12):1229-1234. doi: 10.1038/nchem.2817. Epub 2017 Jul 10. PMID: 29168482; PMCID: PMC5808832.
Branscomb, E., Biancalani, T., Goldenfeld, N., Russell, M. J. (2017): Escapement mechanisms and the conversion of disequilibria; the engines of creation Phys. Rep. 677:1.
Branscomb E., Russell M. J. (2018a) Frankenstein or a Submarine Alkaline Vent: Who Is Responsible for Abiogenesis?: Part 1: What is life-that it might create itself? Bioessays. 40(7):e1700179. doi: 10.1002/bies.201700179. Epub 2018 Jun 5. PMID: 29870581.
Branscomb E, Russell MJ. (2018b): Frankenstein or a Submarine Alkaline Vent: Who is Responsible for Abiogenesis?: Part 2: As life is now, so it must have been in the beginning. Bioessays. 40(8):e1700182. doi: 10.1002/bies.201700182. Epub 2018 Jul 4. PMID: 29974482.
Burcar, B., Pasek, M., Gull, M., Cafferty, B.J., et al. (2016): Darwin’s Warm Little Pond: A One-Pot Reaction for Prebiotic Phosphorylation and the Mobilization of Phosphate from Minerals in a Urea-Based Solvent. Angew. Chem. Int. Ed. 2016, 55, 13249.
Camprubi, E., Jordan, S.F., Vasiliadou, R., Lane, N. (2017): Iron catalysis at the origin of life. IUBMB Life, 69: 373-381. https://doi.org/10.1002/iub.1632
Cody G. (2004): Transition metal sulfides and the origins of metabolism. Annual Review Earth and Planetary Sciences 32: 569–99.
Darnault, C. et al. (2003): Ni-Zn-[Fe4-S4] and Ni-Ni-[Fe4-S4] clusters in closed and open a-subunits of acetyl-CoA synthase/carbon monoxide dehydrogenase. Nat. Struct. Biol. 10, 271–279
Darwin, C. (1871): Brief an J. D. Hooker https://www.darwinproject.ac.uk/letter/DCP-LETT-7471.xml
Deamer, D. (2009): First Life and Next Life Synthetic biology is a new field, but it’s targeting an old question: How did life begin? Technol. Rev. 112, 66.
Dobbek, H. (2008): Wie biologische Fe-S-Zentren CO2 aktivieren. In: Nachrichten aus der Chemie. Band 56, Nr. 7–8:734–737, doi:10.1002/nadc.200857949.
Dobbeck, H. et al. (2001): Crystal structure of a carbon monoxide dehydrogenase reveals a [Ni-4Fe-5S] cluster. Science 293, 1281–1285
Dörr, M., Käßbohrer, J., Grunert, R. et al. (2003): Eine mögliche präbiotische Bildung von Ammoniak aus molekularem Stickstoff auf Eisensulfidoberflächen. Angewandte Chemie 115, 1579–1581.
Doukov, T.I. et al. (2002): A Ni-Fe-Cu center in a bifunctional carbon monoxide dehydrogenase/acetyl-CoA synthase. Science 298, 567–572
Dyson, F. (2004): Origins of Life. Cambridge University Press, Cambridge
Follmann, H. (2004): Desoxyribonucleotides: the unusual chemistry and biochemistry of DANN precursors. Chemical Society Reviews 33, 225–233.
Fruh-Green, G. L. (2003): 30,000 Years of Hydrothermal Activity at the Lost City Vent Field. Science, 301(5632), 495–498.
Georgieva, MN, Little, CTS orcid.org/0000-0002-1917-4460, Maslennikov, VV et al. (2021): The history of life at hydrothermal vents. Earth-Science Reviews, 217. 103602. ISSN 0012-8252
Haldane, J. B. S. (1929): Origin of Life. Rationalist Ann 1929, 3, 148.
Heinen, W. Lauwers, A.M. (1996): Organic sulfur compounds resulting from the interaction of iron sulfide, hydrogen sulfide and carbon dioxide in an anaerobic aqueous environment. Orig. Life Evol. Biosph. 26, 131–150
Herschy B. (2014): Nature ’s electrochemical flow reactors: Alkaline hydrothermal vents and the origins of life. Biochemist 36: 4–8.
Herschy B, Whicher A, Camprubi E, Watson C, Dartnell L, Ward J, Evans JRG, Lane N. (2014): An origin-of-life reactor to simulate alkaline hydrothermal vents. Journal of Molecular Evolution 79: 213–27.
Huber, C., Kraus, F., Hanzlik, M., Eisenreich, W., Wächtershäuser, G. (2012): Elements of Metabolic Evolution. Chemistry – A European Journal, advanced online publication: 13 Jan 2012 – DOI: 10.1002/chem.201102914
Huber, C., Wächtershäuser, G. (1997): Activated acetic acid by carbon fixation on (Fe,Ni)S under primordial conditions. Science 276:245–247
Huber, C., Wächtershäuser G. (1998): Peptides by activation of amino acids with CO on (Ni, Fe)S surfaces: implications for the origin of life. Science 281: 670-72
Hud NV, Cafferty BJ, Krishnamurthy R, Williams LD. (2013): The origin of RNA and “my grandfather’s axe”. Chem Biol. 20(4):466-74. doi: 10.1016/j.chembiol.2013.03.012. PMID: 23601635.
Izgu, E. C., Björkbom, A., Kamat, N. P. et al. (2016): N-Carboxyanhydride-Mediated Fatty Acylation of Amino Acids and Peptides for Functionalization of Protocell Membranes J. Am. Chem. Soc. 138, 16669.
Karl, D. M. (1995): Microbiology of deep-sea hydrothermal vents. CRC Press, Boca Raton
Kelley, D. S. Früh-Green, G. L., Karson, J. A., Ludwig, K. A. (2007): The Lost City Hydrothermal Field Revisited. Oceanography. Band 20, Nr. 4, 2007, S. 90–99, doi:10.5670/oceanog.2007.09
Kelley DS, Karson JA, Blackman DK, et al. (2001): An off-axis hydrothermal vent field near the Mid-Atlantic Ridge at 30 degrees N. Nature 412: 145–49.
Kelley DS, Karson JA, Früh-Green GL, et al. A serpentinite-hosted submarine ecosystem: the Lost City Hydrothermal Field. Science 307: 1428–34 (2005).
Kobayashi K, Geppert WD, Carrasco N, Holm NG, Mousis O, Palumbo ME, Waite JH, Watanabe N, Ziurys LM. (2017): Laboratory Studies of Methane and Its Relationship to Prebiotic Chemistry. Astrobiology. 17(8):786-812. doi: 10.1089/ast.2016.1492. Epub 2017 Jul 20. PMID: 28727932.
Kurland, C. G. (2010): The RNA dreamtime BioEssays 2010, 32, 866.
Lane, N. (2010): Why Are Cells Powered by Proton Gradients? Nature Education 3(9):18
Lane, N. (2017): Der Funke des Lebens Energie und Evolution. Konrad Theis Verlag
Lane N, Allen JF, Martin W. (2010): How did LUCA make a living? Chemiosmosis in the origin of life. Bioessays. 32(4):271-80. doi: 10.1002/bies.200900131. PMID: 20108228.
Lindahl, P.A. (2002): The Ni-containing carbon monoxide dehydrogenase family: Light at the end of the tunnel? Biochemistry 41, 2097–2105
Maden, B. E. H. (1995): No soup for starters? Autotrophy and the origins of metabolism. Trends Biochem. Sci. 20:337.
Martin WF (2012): Hydrogen, metals, bifurcating electrons, and proton gradients: The early evolution of biological energy conservation. FEBS Letters 586: 485–93.
Martin W, Baross J, Kelley D, Russell MJ. (2008): Hydrothermal vents and the origin of life. Nature Reviews Microbiology 6: 805–14 (2008).
Martin, W., Russell, M. J. (2003): On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells. In: Philosophical Transactions of the Royal Society. Biological Sciences. 358 (1429):59–85, PMID 12594918, PMC 1693102
Martin W, Russell MJ. (2007): On the origin of biochemistry at an alkaline hydrothermal vent. Philosophical Transactions Royal Society B 367: 1887–1925.
Martin W, Sousa FL, Lane N. (2014): Energy at life’s origin. Science 344: 1092–93.
Miller, S. L. (1953): A Production of Amino Acids Under Possible Primitive Earth Conditions. Science 117:528
Mulkidjanian AY, Bychkov AY, Dibrova DV, Galperin MY, Koonin EV. (2012): Origin of first cells at terrestrial, anoxic geothermal fields. Proc Natl Acad Sci U S A. 109(14):E821-30. doi: 10.1073/pnas.1117774109. Epub 2012 Feb 13. PMID: 22331915; PMCID: PMC3325685.
Müller, T., Hoffmann-Wieck, G. (Hrsg., 2020): Tiefsee Vielfalt in der Dunkelheit. Senckenberg
Nicolet, Y. et al. (2000) A novel FeS cluster in Fe-only hydrogenases. Trends Biochem. Sci. 25, 138–143
Nitschke W, Russell MJ. (2009): Hydrothermal focusing of chemical and chemiosmotic energy, supported by delivery of catalytic Fe, Ni, Mo, Co, S and Se forced life to emerge. Journal of Molecular Evolution 69: 481–96.
Oparin, A. I., Morgulis, S. (1953): The Origin of Life, 2nd ed., Dover, New York 1953.
Pascal R, Pross A, Sutherland JD. (2013): Towards an evolutionary theory of the origin of life based on kinetics and thermodynamics. Open Biol. 3(11):130156. doi: 10.1098/rsob.130156.
Pinti D. (2005): The origin and evolution of the oceans. Lectures Astrobiology 1: 83–112.
Ragsdale, S.W., Kumar, M. (1996): Nickel containing carbon monoxide dehydrogenase/acetyl-CoA synthase. Chem. Rev. 96, 2515–2539
Ritson, D. J., Sutherland, J. D. (2013): Synthesis of Aldehydic Ribonucleotide and Amino Acid Precursors by Photoredox Chemistry Angew. Chem. Int. Ed. 52:5845.
Ross, D. S., Deamer, D. (2016): Dry/Wet Cycling and the Thermodynamics and Kinetics of Prebiotic Polymer Synthesis Life 6:1.
Ruiz-Mirazo,K., Briones, C., de la Escosura, A. (2014): Prebiotic Systems Chemistry: New Perspectives for the Origins of Life Chem. Rev. 114, n285.
Russell, M. J. (2003): On the importance of being alkaline, Science, 302, 580–581.
Russell M (2011): Origins: Abiogenesis and the Search for Life. Cosmology Science Publishers, Cambridge MA (2011).
Russell MJ, Allen JF, Milner-White EJ. (2008): Inorganic complexes enabled the onset of life and oxygenic photosynthesis. In Allen JF, Gantt E, Golbeck JH, Osmond B (Hrsg.): Energy from the Sun: 14th International Congress on Photosynthesis. Springer, Heidelberg.
Russell, M. J., Daia, D. E., and Hall, A. J. (1998): The emergence of life from FeS bubbles at alkaline hot springs in an acid ocean, in Thermophiles: The Keys to Molecular Evolution and the Origin of Life, edited by: Wiegel, J., and Adams, M. W. W., Taylor and Francis, Washington, 77–126.
Russell MJ, Daniel RM, Hall AJ, Sherringham J. (1994): A hydrothermally precipitated catalytic iron sulphide membrane as a first step toward life. Journal of Molecular Evolution 39: 231–43.
Russell, M.J., Hall, A.J. (1997): The emergence of life from iron monosulphide bubbles at a submarine hydrothermal redox and pH front. J. Geol. Soc. (London) 154, 377–402
Russell, M.J., Hall, A.J. (2002): From geochemistry to biochemistry: chemiosmotic coupling and transition element clusters in the onset of life and photosynthesis. Geochem. News 113, 6–12
Russell MJ, Hall AJ, Cairns-Smith AG, Braterman PS. (1988): Submarine hot springs and the origin of life. Nature 336: 117.
Russell MJ, Hall AJ, Martin W. (2010): Serpentinization as a source of energy at the origin of life. Geobiology 8: 355–71.
Russell, M. J., Hall, A. J., Mellersh, A. R. (2003): On the dissipation of thermal and chemical energies on the early Earth: The onsets of hydrothermal convection, chemiosmosis, genetically regulated metabolism and oxygenic photosynthesis, in Natural and Laboratory-Simulated Thermal Geochemical Processes, edited by: Ikan, R., Dordrecht, Kluwer Academic Publishers, 325–388,
Russell MJ, Nitschke W, Branscomb E. (2013): The inevitable journey to being. Philosophical Transactions Royal Society B 368: 20120254.
Saladino R, Crestini C, Ciciriello F, Pino S, Costanzo G, Di Mauro E. (2009): From formamide to RNA: the roles of formamide and water in the evolution of chemical information. Res Microbiol. 160(7):441-8. doi: 10.1016/j.resmic.2009.06.001. Epub 2009 Jun 25. PMID: 19559789.
Schulte, M., Blake, D., Hoehler, T. & McCollom, T. M. (2006): Serpentinization and its implications for life on the early Earth and Mars. Astrobiology 6, 364–376.
Shapiro R. (2000): A replicator was not involved in the origin of life. IUBMB Life. 49(3):173-6. doi: 10.1080/713803621. PMID: 10868906.
Shock, E. L. (1992): Chemical environments of submarine hydrothermal systems, Origins of Life and Evolution of the Biosphere, 22:67–107.
Shock E, Canovas P. (2010): The potential for abiotic organic synthesis and biosynthesis at seafloor hydrothermal systems. Geofluids 10: 161–92.
Shock, E. L., McCollom, T., Schulte, M. D. (1998): The emergence of metabolism from within hydrothermal systems, in Thermophiles: The Keys to Molecular Evolution and the Origin of Life, edited by: Wiegel, J. and Adams, M. W. W., Taylor and Francis, Washington, 59–76.
Sleep NH, Bird DK, Pope EC. (2011): Serpentinite and the dawn of life. Philosophical Transactions Royal Society B 366: 2857–69.
Sleep, N. H., Meibom, A., Fridriksson, T., Coleman, R. G., Bird, D. K. (2004): H2-rich fluids from serpentinization: geochemical and biotic implications. Proc. Natl Acad. Sci. USA 101, 12818–12823.
Sutherland, J. (2017): Opinion: Studies on the origin of life — the end of the beginning. Nat Rev Chem 1, 0012 https://doi.org/10.1038/s41570-016-0012
Svetlitchnyi, V. et al. (2004): A functional Ni-Ni-[4Fe4S] cluster in the monomeric acetyl-CoA synthase from Carboxydothermus hydrogenoformans. Proc. Natl. Acad. Sci. U. S. A. 101, 446–451
Van Dover, C. L. (2000): The ecology of deep-sea hydrothermal vents. Princeton Univ. Press, Princeton
Van Kranendonk MJ, Deamer DW, Djokic T. (2017): Life Springs. Sci Am. 317(2):28-35. doi: 10.1038/scientificamerican0817-28. PMID: 29565926
Volbeda, A., Fontecilla-Camps, J.C. (2003) The active site and catalytic mechanism of NiFe hydrogenases. Dalton Trans. 1, 4030–4038
Wächtershäuser, G. (1988a): Before enzymes and templates: theory of surface metabolism. Microbiological Reviews 52, 452–484.
Wächtershäuser, G. (1988b): Pyrite formation, the first energy source for life: a hypothesis. Systematic and Applied Microbiology 10, 207–210.
Wächtershäuser, G. (1990): Evolution of the first metabolic cycles. PNAS 87, 200–204.
Wächtershäuser, G. (1992): Ground works for an evolutionary biochemistry: the iron-sulfur world. Progress in Biophysics and Molecular Biology 58, 85–201.
Wächtershäuser, G. (1994): Life in a ligand sphere, PNAS 91, 4283–4287.
Wächtershäuser, G. (2000): Origin of life. Life as we don’t know it. Science 289, 1307–1308.
Wächtershäuser G. (2006): From volcanic origins of chemoautotrophic life to Bacteria, Archaea and Eukarya. Philosophical Transactions Royal Society B 361: 1787–1806 (2006).
Wächtershäuser, G. (2007): On the chemistry and evolution of the pioneer organism. Chem. Biodivers. 4: 584–602
Zhu, T. F., Adamala, K., Zhang, N., Szostak, J. W. (2012): Photochemically driven redox chemistry induces protocell membrane pearling and division Proc. Natl. Acad. Sci. 109:9828.



