Text als pdf
Einleitung
Die Neoaves bilden die allergrößte Klade innerhalb der Vögel, die sich in 10 Untergruppen gliedern lassen. Drei dieser Untergruppen – die Opisthocomiformes, die Eurypygimorphae und die Gruiformes haben wir in der letzten Episode besprochen. In dieser Episode widmen wir uns nur einer Gruppe: den Charadriiformes – den Regenpfeiferartigen. Diese sind nicht unbedingt die artenreichste Gruppe, doch sie umfassen viele Familien und einige für uns recht bekannte Wasservögel.
Bei den Charadriiformes werden drei phylogenetische Gruppen unterschieden (Ericson et al. 2003, Paton et al. 2003, Bridge et al. 2005, Paton & Baker 2006, Fain & Houde 2007, Baker et al. 2007, 2012, Gibson & Baker 2012, Dos Remedios et al. 2015, Prum et al. 2015, Kuhl et al. 2021, Thomas et al. 2004, Cerny & Natale 2022; Abb. 1):
- Die Lari: hierzu zählen die Alke (Alcidae), Möwen (Laridae und Sternidae, letztere hier als Unterfamilie der Laridae), Raubmöwen (Stercorariidae), Brachschwalbenartige (Glareolidae), Reiherläufer (Dromadidae) und Laufhühnchen (Turnicidae).
- Die Scolopaci. Hierzu zählen die Familien der Schnepfenvögel (Scolopacidae), Blatthühnchen (Jacanidae), Goldschnepfen (Rostratulidae), Steppenläufer (Pedionomidae) und Höhenläufer (Thinocoridae).
- Die Charadrii. Hierzu gehören die Familien der Regenpfeifer (Charadriidae), Säbelschnäbler (Recurvirostridae), Austernfischer (Haematopodidae), Ibisschnäbel (Ibidorhynchidae), Krokodilwächter (Pluvianidae), Triele (Burhinidae), Scheidenschnäbel (Chionididae) und Magellanregenpfeier (Pluvianellidae).
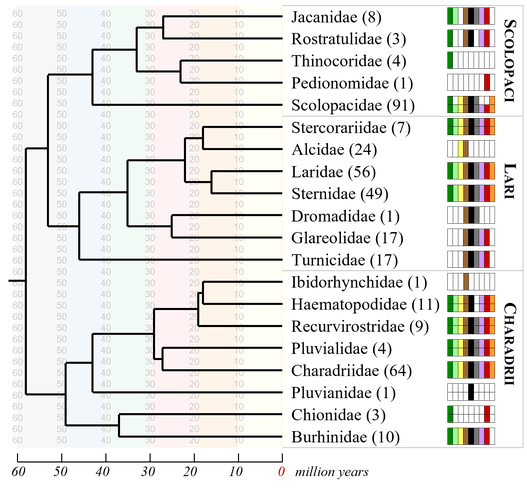
Abb. 1: Stammbaum der Charadriiformes; in Klammern stehen die Artenzahlen, die aber nach anderen Quellen abweichen können. Die Farbmarkierungen geben Ausunft über die geographische Verbreitung der Familien: dunkelgrün: Südamerika, hellgrün: Mittelamerika und Karibik (ohne Mexiko), gelb: Nordamerika (inklusive Mexiko), braun: Europa und Asien, schwarz: Afrika, grau: Madagaskar, pink: Wallacea und Philippinen, rot: Australien, Neuguinea Ozeanien, orange: Neu Seeland https://www.bird-phylogeny.de/superorders/charadriiformes/
Die Charadrii und Scolopaci wurden früher als Watvögel zusammengefasst. Insgesamt haben wir also 19 Familien, die gerade aber mal 391 Arten ausmachen. Hiervon sind die Regenpfeifer mit 69, Schnepfenvögel 98 und Möwen 103 Arten die artenreichsten. Die restlichen 121 Arten werden auf die anderen 16 Familien aufgeteilt, von denen besonders unter den Scolopaci und Charadrii die Familien eine bis 10 Arten aufweisen. Viele leben in Wassernähe an Meeresküsten, Seen, Flüssen und in Sümpfen, aber auch in trockenen Regionen wie Halbwüsten, Steppen und Hochgebirgen. Fast alle Arten sind Zugvögel.
Synapomorphien der Charadriiformes
Trotz ihres vielfältigen Aussehens haben sie einige charakteristische Merkmale gemeinsam. Bei allen Arten sind das Gaumendach und der Stimmapparat nahezu gleich, das Brustbein trägt keine nach innen weisenden Knochenfortsätze; außerdem gibt es Ähnlichkeiten im Aufbau des Fußes, vor allem bei den Sehnen. Die Federn am Rumpf besitzen einen Afterschaft. Die Bürzeldrüse ist durch einen langen Federschopf gekennzeichnet. Besonders wichtig sind die großen Nasendrüsen, die bei den am Meer lebenden Arten der Ausscheidung von überschüssigem Salz dienen. Sehr ausgeprägt sind sie bei den Scheidenschnäbeln. Während die drei Vorderzehen normal gebaut sind, setzt die Hinterzehe weiter oben am Fuß an, ist gewöhnlich kurz und berührt oft nicht den Boden; bei einigen Gruppen fehlt diese vierte Zehe, so bei Säbelschnäblern und Stelzenläufern, einigen Regenpfeifern, Alkenvögeln und der Dreizehenmöwe. Die meisten Arten der Unterordnungen Charadrii und Scolopaci besitzen freie Zehen, einige haben Schwimmhäute. Bei Möwen, Alkenvögeln und Raubmöwen befinden sich zwischen den Zehen vollständig entwickelte Schwimmhäute. Da der Großteil der Regenpfeiferartigen Zugvögel oder zumindest gelegentliche Langstreckenflieger sind, besitzen sie meist lange, dünne Flügel, die spitz zulaufen. Ausnahmen sind die Kiebitze mit ihren zur Spitze verbreiterten und die Alken mit stark verkürzten Flügeln als Anpassung an das Leben als Taucher auf offenem Meer (Niethammer et al. 1969, Jahn 1982).
Die Regenpfeiferartigen sind eine uralte Gruppe und sind fossil auch aus der späten Kreidezeit bekannt, wenn auch nur durch fragmentarische Fossilien (Baker et al. 2007). Vollständigere Überreste von unbestrittenen Regenpfeierartigen sind ab dem mittleren Paläogen bekannt. Die heutigen Ordnungen entstanden an der Grenze zwischen Eozän und Oligozän, vor etwa 35-30 Millionen Jahren (siehe Abb. 1).
Eines der Taxa, das dem Vorfahren der Regenpfeiferartigen nahestehen könnte, ist Scandiavis aus dem frühen Eozän Dänemarks, das von einem gut erhaltenen Teilskelett bekannt ist (Bertelli et al. 2013) und einige, aber nicht alle Merkmale, der Kronengruppe aufweist (Abb. 2).
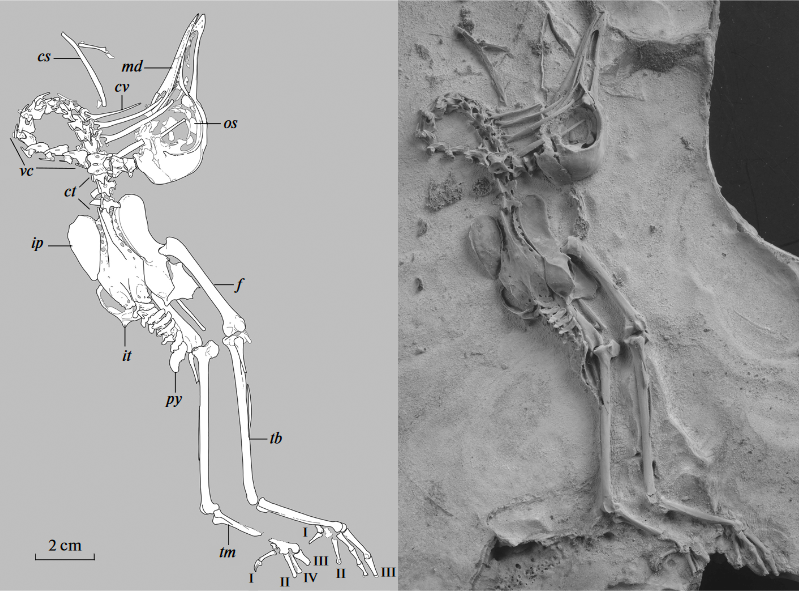
Abb. 2: Scandiavis mikkelseni
Charadrii
Regenpfeifer (Charadriidae)
Die größte Familie innerhalb der Charadrii sind die Regenpfeifer (Charadriidae), die auch namensgebend für diese Klade und für die Charadriiformes insgesamt sind (del Hoyo et a. 1996, del Hoyo 2020, Winkler et al. 2015, Winkler et al. 2020a, Abb. 3). Die Mitglieder der weltweit verbreiteten Familie sind kleine bis mittelgroße Watvögel, deren Beine meist relativ kurz oder sind. Charakteristisch für alle Regenpfeifer sind die relativ großen Augen, deren Iris bei vielen Arten leuchtend gefärbt ist (Abb. 4). Eine hohe Zahl von Sehstäbchen auf der Netzhaut ermöglicht Regenpfeifern das Sehen auch unter schwachen Lichtbedingungen. Der Kopf erscheint rundlich und sitzt auf einem recht kurzen Hals. Die Vögel tragen den Hals oft eingezogen, weshalb der Körper vieler Arten insgesamt kugelig erscheint. Der Schnabel ist gerade, in der Regel relativ kurz und hat eine stumpfe Spitze. Die größten Gattungen der Regenpfeifer sind Vanellus, auch bekannt als Kiebitze und Charadrius und Anargynchus, die eigentlichen Regenpfeifer. Des Weiteren gibt es sieben weitere Gattungen (Oreopholus, Haploxypterus, Erythrogonys, Peltohyas, Phegornis, Zonibyx, Eudromias) mit nur einer Art und die Kiebitzregenpfeifer (Pluvialis) mit vier Arten. Obwohl die Familie der Regenpfeifer ziemlich artenreich ist, ist ihr Fossilbestand sehr schlecht und nur fragmentarisch.
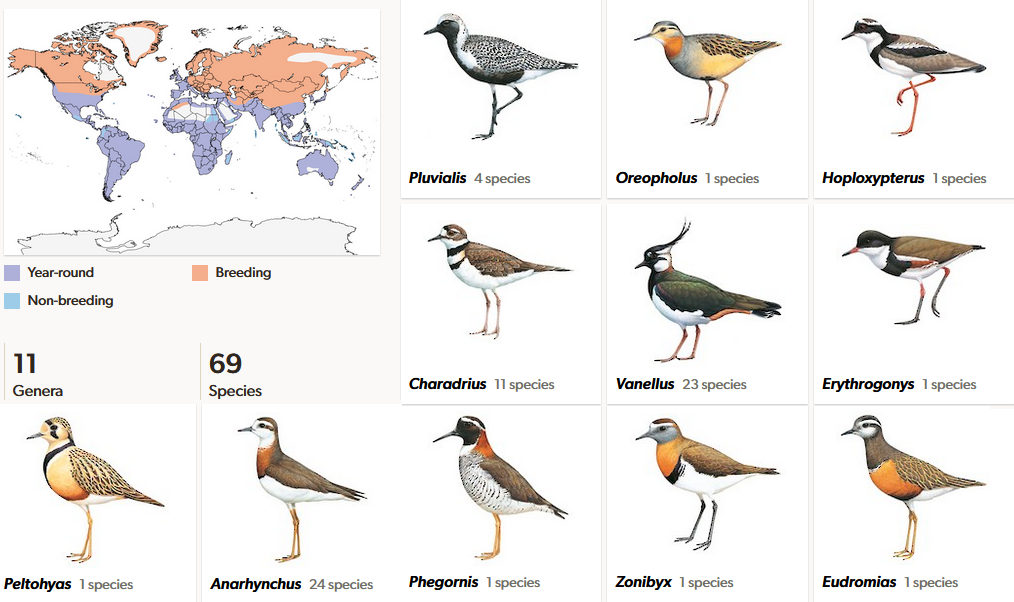
Abb. 3: Regenpfeifer

Abb. 4: Rotlappenkiebitz (Vanellus indicus)
Säbelschnäbler (Recurvirostridae)
Die Familie der Säbelschnäbler (Recurvirostridae) ist mit drei Gattungen und neun oder zehn Arten in fast allen tropischen und gemäßigten Zonen der Welt verbreitet (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al 2015, 2020b, Abb. 5). Gekennzeichnet sind sie durch einen langen Hals, lange Beine und einen langen, schlanken Schnabel. Dieser ist je nach Gattung entweder gerade geformt oder deutlich nach oben gekrümmt. Als stammesgeschichtlich sehr alte Familie sind Säbelschnäbler seit dem frühen Eozän belegt. Fossile Gattungen dieser Epoche sind Coltonia (Nordamerika), Kashinia (Großbritannien) und Fluviatilavis (Portugal, Harrison 2008; Abb. 6).
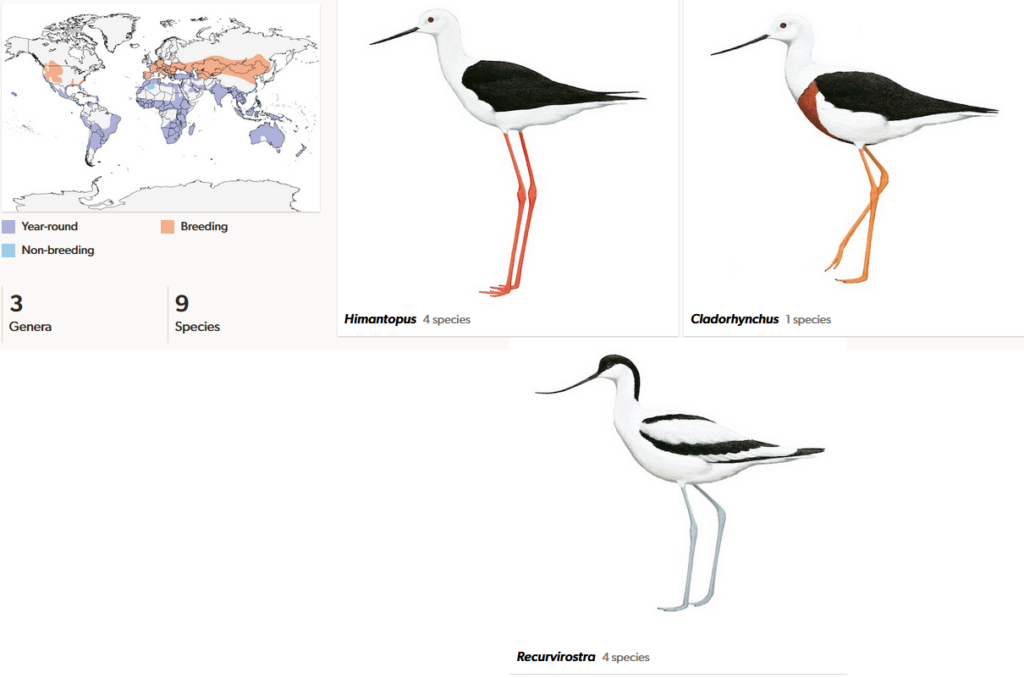
Abb. 5: Säbelschnäbler

Abb. 6: Fluviatilavis
Austernfischer (Haematopodidae)
Austernfischer (Haematopodidae) kommen mit 12 Arten in einer Gattung an fast allen Küstengebieten der Welt vor (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al 2020c; Abb. 7). Drei Arten (Braunmantel-, Feuerland- und Südamerikanischer Austernfischer; Haematopus palliatus, H. leucopodus, H. ater) besiedeln die Küsten Südamerikas; der Klippen-Austernfischer (H. bachmani) ist an der Pazifik- und der Braunmantel-Austernfischer (H. palliatus) an beiden Küsten Nordamerikas heimisch. An Afrikas Küsten leben der seltene Schwarze Austernfischer (H. moquini) im Süden des Kontinents und der Eurasische Austernfischer (H. ostralegus) im Nordwinter. Die Brutgebiete des Eurasischen Austernfischers (H. ostralegus) liegen in den gemäßigten Regionen Eurasiens. In Australien kommen der Australische und der Ruß-Austernfischer (H. longirostris und H. fuliginosus), in Neuseeland der Neuseeländische und der Südinsel-Austernfischer (H. unicolor und H. finschi) vor. Der Chatham-Austernfischer (H. chathamensis) ist nur auf den Chatham-Inseln südlich von Neuseeland anzutreffen. Der früher auf den östlichen Kanaren brütende Kanaren-Austernfischer (H. meadewaldoi) gilt seit 1994 laut IUCN als ausgestorben. Austernfischer haben mittellange, kräftige Beine mit drei Zehen, mit denen sie schnell rennen können. Je nach Art sind die Austernfischer entweder schwarz-weiß oder gänzlich schwarz gefärbt. Ihre Nahrung bilden vor allem Weichtiere und Ringelwürmer.
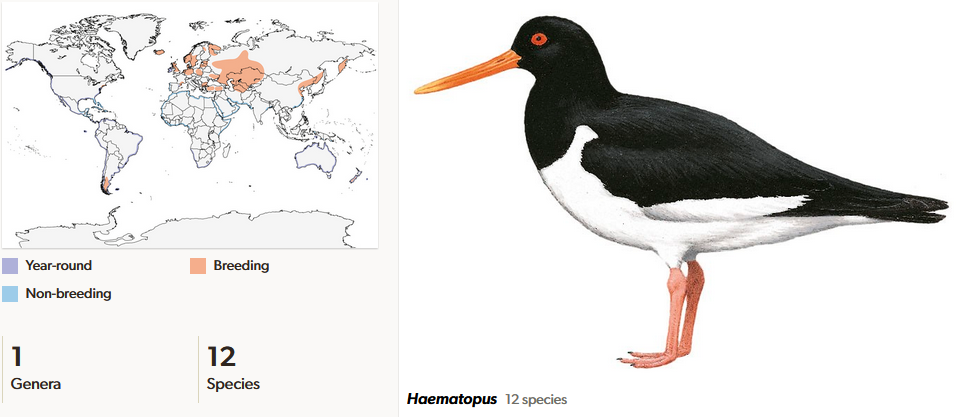
Abb. 7: Austernfischer
Ibisschnäbel (Ibidorhynchidae)
Der Ibisschnabel (Ibidorhyncha struthersii) ist die einzige Art seiner Familie und kommt nur an den Gebirgsbächen Zentralasiens vor (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020d, Abb. 8). Er lebt hauptsächlich von den Larven von Eintags- und Steinfliegen. Der bis zu 320 g schwere Vogel hat als auffälligstes Merkmal einen stark gekrümmten Schnabel, der an Ibisse erinnert und nach dem der Vogel seinen Namen hat.
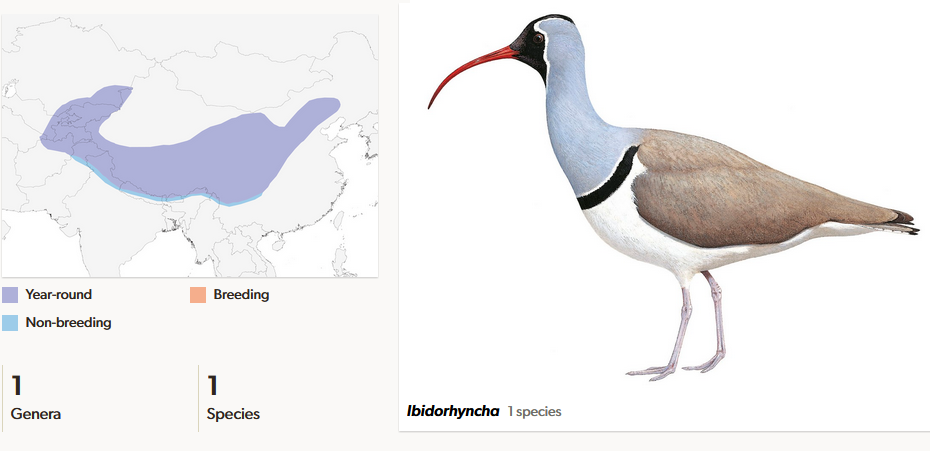
Abb. 8: Ibisschnäbel
Krokodilwächter (Pluvianidae)
Ein besonderer Vertreter der Charadrii ist der in Afrika lebende Krokodilwächter (Pluvianus aegyptius). Seine Färbung macht ihn unverwechselbar: Die Körperoberseite ist blass blaugrau, die Körperunterseite gelblichweiß mit einem scharf abgesetzten schwarzen Brustband. Der Scheitel sowie die Wangengegend sind schwarz (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020e; Abb. 9). Seinen Namen verdankt dieser Vogel, weil ihm die Eigenschaft zugeschrieben wird in den Mäulern von Krokodilen nach Nahrung zu suchen. Sie würden die Krokodile von Parasiten und Nahrungsresten befreien, deshalb ließen die Krokodile sie auch gewähren. Somit hätten die Vögel eine gesicherte Nahrungsquelle und die Krokodile eine gute Zahn- und Zahnfleischpflege. Diese Eigenschaft, die schon von Herodot im 5. Jh. vor Christus beschrieben wurde, gilt jedoch nicht als gesichert. Es gibt keine gesicherten Beobachtungen von diesem Verhalten, weshalb es von einigen Ornithologen als Legende bezeichnet wird (Maclean & Kirwan 2020).
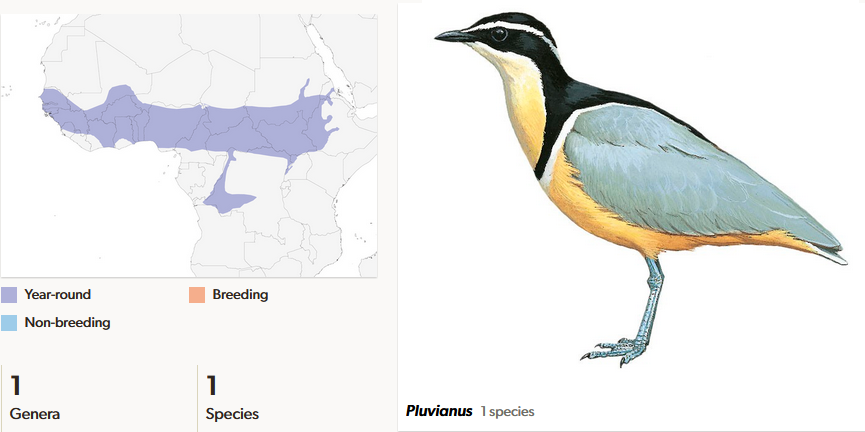
Abb. 9: Krokodilwächter
Triele (Burhinidae)
Die Triele (Burhinidae) sind eine unscheinbar wirkende Familie mit zehn Arten, die vorwiegend in Afrika, Europa, Asien und Australien, aber auch auf dem südamerikanischen Kontinent vorkommen (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020f, Abb. 10). Das Gefieder ist bei den meisten Arten sandfarben und mit braunen oder schwarzen Flecken oder Streifen überzogen. Auffälligstes Merkmal dieser Familie sind die gelben Beine, die durch ein deutlich verdicktes Intertarsalgelenk gekennzeichnet. Charakteristisch sind weiterhin die großen Augen mit meist gelber Iris. Die ältesten bisher bekannten Fossilien von Trielen stammen aus dem späten Oligozän Europas und Australiens (De Pietri & Scofield 2014).

Abb. 10: Triele
Scheidenschnäbel (Chionidae)
Die Familie der Scheidenschnäbel (Chionidae) hat zwei Arten: den Schwarzgesicht-Scheidenschnäbel (Chionis minor) und den Weißschnabel-Scheidenschnäbel (C. alba). Das Brutgebiet der Familie liegt ausschließlich in der Antarktis und Subantarktis, im Südwinter zieht der Weißschnabel-Scheidenschnabel nördlich bis Patagonien, während der Schwarzgesicht-Scheidenschnabel ganzjährig im Brutgebiet verweilt. Die komplett weiß gefiederten, etwa hühnergroßen und kompakt gebauten Scheidenschnäbel sind die einzigen Vögel im antarktischen Lebensraum, die ausschließlich an Land leben. Sie sind Kleptoparasiten, d. h. sie stehlen die Nahrung anderer Vogelarten (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020g, Abb. 11).

Abb. 11: Scheidenschnäbel
Magellanregenpfeifer (Pluvianellidae)
Der 20 Zentimeter große Magellanregenpfeifer (Pluvianellus socialis) ist die einzige Art seiner Familie und kommt nur im südlichen Südamerika vor. Molekulargenetische Untersuchungen haben gezeigt, dass die Art eng mit den Scheidenschnäbeln verwandt ist (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020h, Livezey 2010; Abb. 12).

Abb. 12: Magellanregenpfeifer
Scolopaci
Blatthühnchen (Jacanidae)
Eine auffällige Familie der Scolopaci die Blatthühnchen (Jacanidae). Die acht heute lebenden Arten dieses Taxons sind pantropisch verbreitet und gehören zu den morphologisch abweichendsten Regenpfeiferartigen. Sie zeichnen sich durch extrem lange Zehen aus, die es ihnen ermöglichen, sich auf schwimmender Süßwasservegetation fortzubewegen und dort nach Nahrung zu suchen (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020i, Abb. 13). Im Zusammenhang mit diesen Lebensgewohnheiten weisen sie eine charakteristische Tarsometatarsus-Morphologie auf, die eine zuverlässige Identifizierung fossiler Überreste ermöglicht. Der auch im Deutschen manchmal verwendete Name Jacana entstammt einer brasilianischen Indianersprache. Wegen ihrer äußeren Ähnlichkeit zu den Rallen wurden Blatthühnchen früher gelegentlich den Kranichvögeln zugeordnet. Zu den Hühnervögeln gibt es trotz des Namens keinerlei Verwandtschaft.

Abb. 13: Blatthühnchen
Heute steht die Zugehörigkeit der Blatthühnchen zu den Regenpfeiferartigen fest. Innerhalb dieser Gruppe wurde schon früh eine enge Verwandtschaft mit den Goldschnepfen (Rostratulidae) angenommen, wegen Gemeinsamkeiten im Skelettbau und der beiden gemeinen Anzahl von zehn Handschwingen (alle anderen Regenpfeiferartigen haben elf Handschwingen). In DNA-Analysen wurde ein Schwestergruppenverhältnis zwischen Blatthühnchen und Goldschnepfen bestätigt (Ericson et al. 2003, Whittingham et al. 2000). Die frühesten Blatthühnchen-Fossilien gehören zu Nupharanassa und Janipes aus dem späten Eozän und frühen Oligozän von Ägypten (Rasmussen et al. 1987, Abb. 14). Diese Taxa sind bemerkenswert, weil einige ihrer Arten viel größer sind als die heutigen Blatthühnchen. Sehr große Arten gab es noch im mittleren Miozän Afrikas, wo eine riesige Art in fossilem Material in Kenia identifiziert wurde (Mayr 2014). Diese Art ist doppelt so groß wie der heutige afrikanische Blaustirn-Blatthühnchen (Actophilornis africanus) und koexistierte mit kleineren Arten von der Größe der heutigen Arten. Warum es heute keine ähnlich großen Jacanidae gibt, ist noch nicht geklärt, und dies gilt auch für die Identität der Pflanzen, die das Gewicht dieser Vögel hätten tragen können. Die meisten heute lebenden Blatthühnchen leben in der Alten Welt, genauer in Afrika, inklusive Madagaskar, Asien und Australien. Die beiden Arten, die im tropischen Amerika vorkommen gehören zur Gattung Jacana. Die frühesten Fossilien der Neuen Welt wurden ebenfalls dieser Gattung zugeordnet und stammt aus dem Pliozän von Florida (Olson 1976), was auf eine vergleichsweise späte Ausbreitung in Amerika hinweist. Dabei sind sie mit dem asiatischen Phasanblatthühnchen (Hydrophasianus) näher verwandt als mit den afrikanischen Arten (Ericson et al. 2003, Whittingham et al. 2000).

Abb. 14: Während des späten Eozäns und frühen Oligozäns war die Umgebung der Jebel Qatrani-Formation in Faiyum, Ägypten, so üppig, wie man es sich nur vorstellen kann, mit tropischen Wäldern und einem riesigen System von Feuchtgebieten, Seen und Flüssen, die mit dem warmen Tethysmeer verbunden waren. Wie nicht anders zu erwarten, wimmelte es an einem solchen Ort von Vögeln. Die Vögel, die hier lebten, ahnten nicht, dass 30 Millionen Jahre später die Wüste Sahara all dieses Grün begraben würde. 1: Goliathia: Einer der frühesten bekannten Verwandten des Schuhschnabels. 2: Nycticorax: Ein frühes Mitglied der modernen Gattung der Nachtreiher. Er hat keinen Namen, kann aber aufgrund der Form seiner Gliedmaßen der Gattung zugeordnet werden. 3. Xenerodiops: Ein frühes Mitglied der Storchenfamilie mit einem kurzen, gebogenen Schnabel. 4. Nuphranassa: Ein Mitglied der modernen Blatthühnchen, aber viel größer als alle lebenden Arten, etwa so groß wie ein Huhn. 5. Janipes: Ein weiterer großes Blatthühnchen. Nicht so groß wie Nuphranassa, aber immer noch größer als jedes moderne Blatthühnchen. 6. Palaeoephippiorhynchus: Ein früher Storch, der aus dieser Zeit gut bekannt ist. Er ähnelt dem Sattelstorch und dem Schwarzhalsstorch, war aber deutlich kleiner. 7. Eremopezus: Ein sehr wenig bekannter flugunfähiger Palaeognathe, von dem nur einige fragmentarische Gliedmaßenknochen bekannt sind. Wahrscheinlich ist er mit dem modernen Strauß verwandt.
Goldschnepfen (Rostratulidae)
Die Goldschnepfen (Rostratulidae) sind mit drei Arten in zwei Gattungen vertreten, die voneinander im Aussehen und vor allem in der Lebensweise sehr verschieden sind (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020j, Abb. 15). Sie ähneln den Schnepfen, sind aber nicht enger mit ihnen, sondern wie erwähnt mit den Blatthühnchen verwandt. Die Ähnlichkeit zu den Schnepfen beruht auf konvergente Evolution. Die Bunt-Goldschnepfe (Rostratula benghalensis) ist in weiten Teilen Afrikas und Asiens verbreitet, die Schmuck-Goldschnepfe (Rostratula australis) lebt in Australien. Beide Arten gehören zur Gattung Rostratula. Die Weißflecken-Goldschnepfe (Nycticryphes semicollaris), welche in eine eigene Gattung (Nycticryphes) gestellt wird, kommt in Südamerika vor. Die Weißflecken-Goldschnepfe weist basale Schwimmhäute auf, die Bunt-Goldschnepfe nicht. Eine Besonderheit der Bunt-Goldschnepfe ist der umgekehrte Sexualdimorphismus: Die Weibchen sind größer, schwerer und leuchtender als die Männchen (Abb. 16). Außerdem herrscht Polyandrie vor: ein Weibchen paart sich mit mehreren Männchen. Bei der südamerikanischen Weißflecken-Goldschnepfe gibt es hingegen überhaupt keinen äußerlich sichtbaren Geschlechtsdimorphismus und die Tiere leben monogam. Die Goldschnepfen sind fossil aus dem Miozän Tschechiens (Rostratula pulia, Mlíkovský 2002) und Pliozäns Südafrikas (Rostratula minator; Olson & Eller 1989) bekannt.
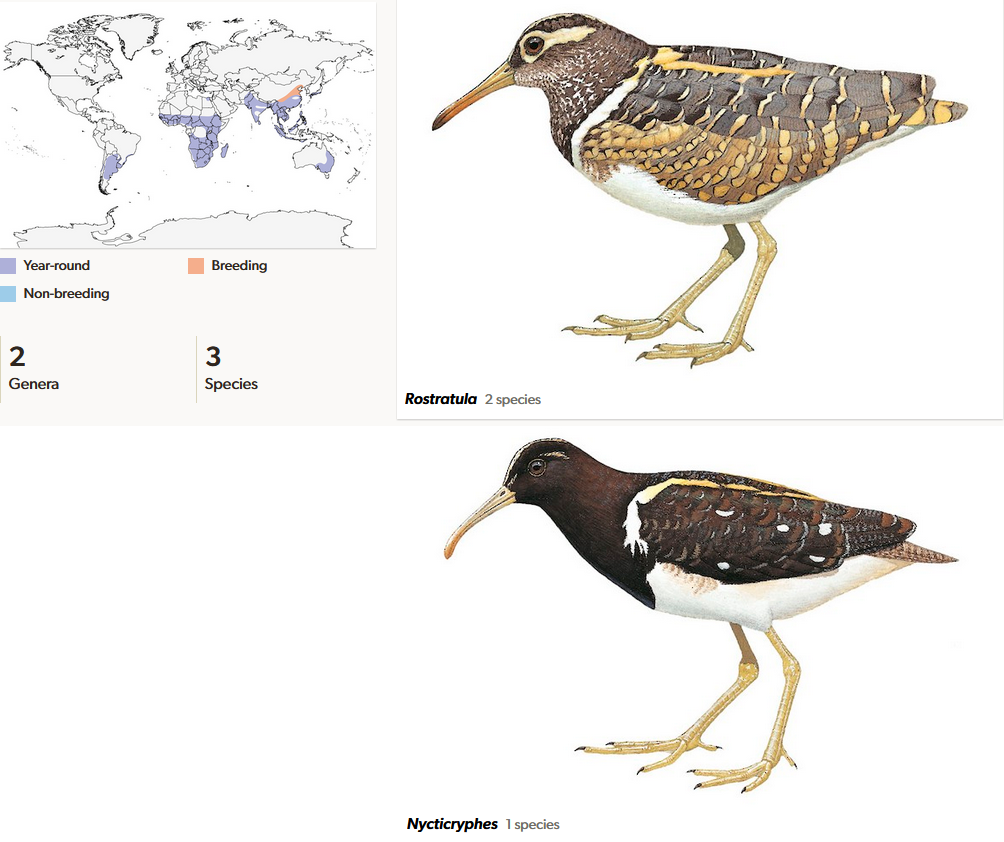
Abb. 15: Goldschnepfen

Abb. 16: umgekehrter Sexualdimorphismus bei der Bunt-Goldschnepfe
Höhenläufer (Thinocoridae)
Die südamerikanischen Höhenläufer (Thinocoridae) umfassen vier Arten und bewohnen die Anden von Kolumbien bis Feuerland (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020k, Abb. 17). Sie bevorzugen höhere Gebiete der Gebirgskette, häufig über 5000 Meter. Sie bleiben immer an der Schneegrenze und wandern mit dieser mit. Der Zwerghöhenläufer (Thinocorus rumicivorus) kommt auch in den Wüsten und Steppen der Westküste (Atacamawüste) vor. Höhenläufer haben sich auf pflanzliche Nahrung spezialisiert. Ihre Erscheinung erinnert an Wachteln mit einem kleinen Kopf und kurzem Hals. Sie sind fossil aus dem Miozäns Argentiniens bekannt (Agnolín et al. 2016).
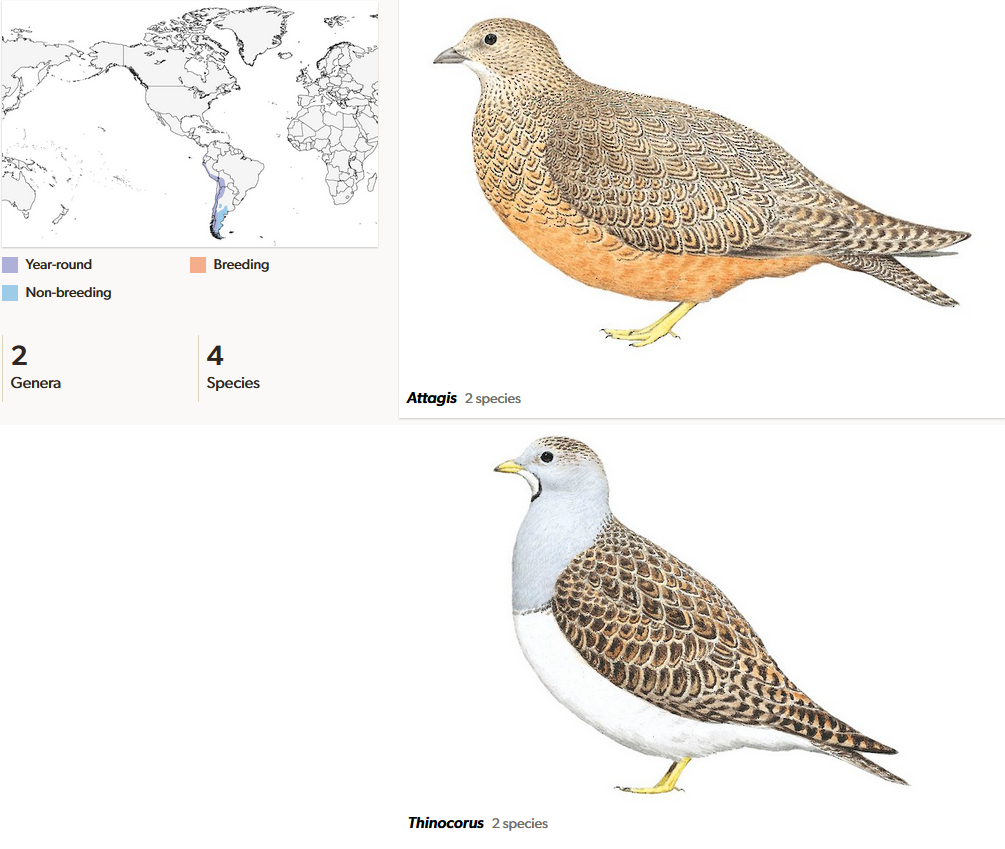
Abb. 17: Höhenläufer
Steppenläufer (Pedionomidae)
Die australischen Steppenläufer (Pedionomidae; del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020l, Abb. 18), heute mit nur einer Art vertreten (Pedionomus torquatus), sind auch aus dem Oligozän Australiens bekannt und bewohnten eher bewaldete Gebiete, während die moderne Art offene Landschaften bevorzugt (De Pietri et al. 2015). Höhenläufer und Steppenläufer, obwohl geographisch voneinander weit entfernt, bilden Schwestergruppen und eine ausgestorbene Gattung aus dem Miozän wurde in Neuseeland entdeckt (De Pietri et al. 2016).
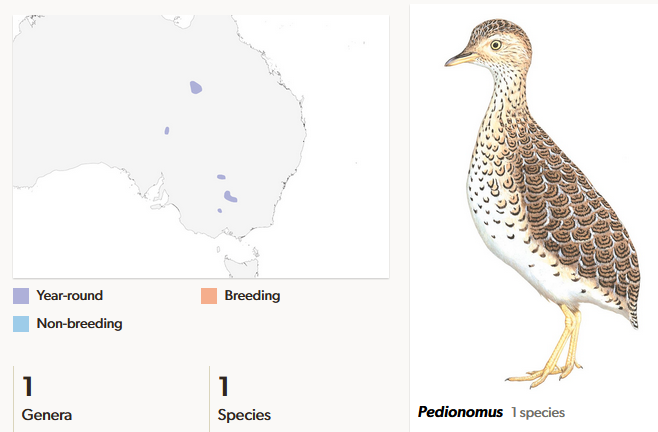
Abb. 18: Steppenläufer
Schnepfenvögel (Scolopacidae)
Die artenreichste Familie der Scolopaci sind die Schnepfenvögel (Scolopacidae). Sie enthält neben der Gattung der Eigentlichen Schnepfen (Scolopax) auch die Strandläufer (Calidris), Brachvögel (Numenius), Bekassinen (Gallinago) und die Wasserläufer (Tringa) sowie weitere Gattungen (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2020m, Abb. 19). Die Familie ist vor allem auf der Nordhalbkugel verbreitet. Sie kommen aber auch in den Tropen vor und es finden sich auf einigen Inseln endemische, also nur dort vorkommende Arten. Schnepfenvögel sind eine sehr vielgestaltige Gruppe. Einige Arten sind Standvögel, doch die meisten sind Zugvögel. Der Schnepfentyp (z. B. Scolopax, Gallinago) ist gekennzeichnet durch lange Beine und einen sehr langen Schnabel. Beim Brachvogeltyp (z. B. Numenius) ist der Schnabel zudem kräftig abwärts gebogen. Daneben gibt es den Wasserläufertyp (z. B. Tringa) mit mittellangem Schnabel und langen Beinen, den Strandläufertyp (z. B. Calidris) mit kürzeren Beinen und mittellangem Schnabel, sowie den kurzschnäbligen Steinwälzertyp (z. B. Arenaria). Abweichend sind dann noch die Wassertreter (z. B. Phalaropus), die eher entenartig schwimmend leben und kurze Beine und mittellange Schnäbel haben. Fast alle Schnepfenvögel (mit Ausnahme der Steinwälzer, Gattung Arenaria, und des Gischtläufers, Calidris virgata) haben an der Schnabelspitze einen geschwollenen mit Hornplatten versehenen Bereich, deren Ränder reich mit Rezeptorzellen zum Ertasten von Beute besetzt sind (Estrella & Masero 2007). Vor allem die Schnepfen und Strandläufer nutzen diese Vorrichtung, um in weichen Sand- und Schlickböden nach Nahrung zu suchen. Schnepfenvögel hatten ihre Diversifizierung im Oligozän, es gibt aber basale Vertreter schon im Miozän, die für diese Familie die typischen langen Schnäbel hatten.
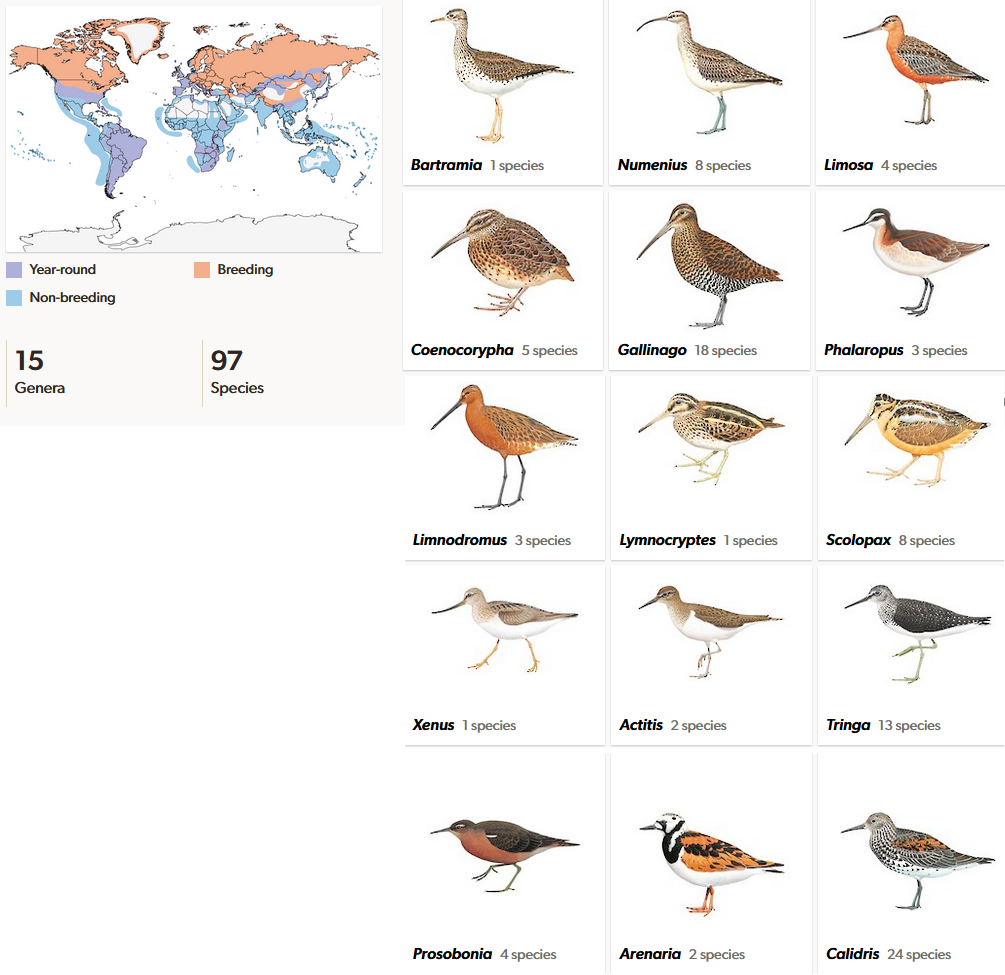
Abb. 19: Schnepfenvögel
Paarungssystem der Scolopaci
Watvögel zeichnen sich zudem durch eine Vielfalt der Brutfürsorge aus und sind somit interessante Modellorganismen für die Evolution der Brutpflege bei Vögeln (Thomas et al. 2007). Die Vorfahren der Vögel hatten höchstwahrscheinlich ein weibliches elterliches Fürsorgesystem (Tullberg et al. 2002). Der Vorfahre der Watvögel hatte höchstwahrscheinlich ein Brutpflegesystem, bei dem sich beide Elterntiere um die Brutpflege kümmerten. Insbesondere in der Familie der Schnepfenvögel kommt eine große Vielfalt der Brutpflege vor (Abb. 20). Die meisten Arten bilden monogame Paare. Doch die Kampfläufer-Männchen (Calidris pugnax) kümmern sich nach der Paarung nicht mehr um die Brut. Es gibt weitere Beispiele, wie zum Beispiel die Doppelschnepfe (Gallinago media), bei der mehrere Männchen involviert sind und am Ende keine Paarbildung stattfindet. Bei den Wassertretern (Phalaropus) dagegen gibt es einen Rollentausch; hier brüten die Männchen, während die Weibchen den Nistplatz verteidigen. Ursprünglich dürfte das Brutpflegesystem bei Schnepfenvögeln allein von den Männchen durchgeführt worden sein. Diese Übergänge könnten aus mehreren Gründen stattgefunden haben. Die Brutdichte korreliert mit der männlichen elterlichen Fürsorge. Männliche Pflegesysteme bei Vögeln haben nachweislich eine sehr geringe Brutdichte, während weibliche Pflegesysteme bei Vögeln eine hohe Brutdichte aufweisen (Thomas et al. 2007, Owens 2002). Bestimmte Raten der männlichen und weiblichen Sterblichkeit, der männlichen und weiblichen Eireifungsrate und der Eitodrate wurden ebenfalls mit bestimmten Systemen in Verbindung gebracht (Klug et al. 2013). Es wurde auch gezeigt, dass die Umkehrung der Geschlechterrolle durch das männlich geprägte Geschlechterverhältnis bei Erwachsenen motiviert ist (Liker et al. 2013). Der Grund für diese Vielfalt bei Watvögeln im Vergleich zu anderen Vögeln muss noch erforscht werden.
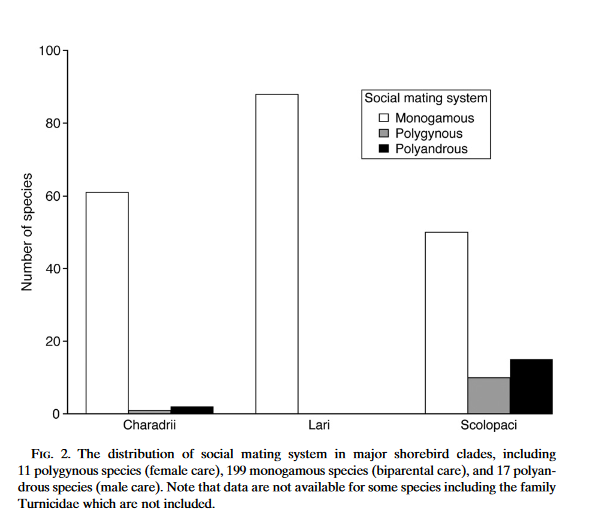
Abb. 20: Die Verteilung des sozialen Paarungssystems bei den Charadriiformes, einschließlich 11 polygyner Arten (weibliche Pflege), 199 monogamer Arten (biparentale Pflege) und 17 polyandrer Arten (männliche Pflege). Es ist zu beachten, dass für einige Arten, darunter die Familie der Laufhühnchen (Turnicidae), keine Daten vorliegen und diese nicht berücksichtigt wurden.
Lari
Möwen, Seeschwalben und Scherenschnäbel (Laridae)
Die wohl auffälligsten und bekanntesten Regenpfeiferartigen gehören zur Gruppe der Lari, vornehmlich die Möwen und Alke. Die Möwenverwandten (Laridae) sind eine weltweit verbreitete See- und Wasservogelfamilie. Sie kommen über allen Weltmeeren und auf allen Kontinenten mit Ausnahme der Antarktis vor und fehlen an Land nur in ariden Gebieten ohne Gewässer in der Nähe und über den Ozeanen nur in Regionen, die zu weit von einer größeren nächstgelegenen Landmasse oder Inseln entfernt sind. In diese Familie gehören neben den Möwen auch die Seeschwalben und Scherenschnäbel (Gattung Rynchops), die ursprünglich als eigene Familie angesehen wurden (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2015, 2020n, Abb. 21).

Abb. 21: Möwen
Möwen sind mittelgroße bis große Vögel. Sie besitzen relativ lange und schmale, spitze Flügel und kräftige, schlanke Schnäbel mit leicht nach unten gekrümmtem Oberschnabel. Die drei nach vorn gerichteten Zehen sind durch Schwimmhäute verbunden, eine vierte, sehr kurze, Zehe zeigt nach hinten oder fehlt bei einigen Arten. Möwen sind ziemlich lautstarke Vögel, was häufig noch durch ihr geselliges Auftreten verstärkt wird. Möwen sind fast weltweit verbreitet, am artenreichsten in den gemäßigten und kalten Klimazonen beider Erdhalbkugeln. In vielen tropischen Regionen fehlen Brutvorkommen, so im Amazonasbecken in Südamerika, im Kongobecken in Zentralafrika, in Indien, Südostasien und Neuguinea. Einige nördlich brütende Arten kommen allerdings zum Überwintern an die Küsten. Im Vergleich zu den nah verwandten Möwen sind die Seeschwalben im Allgemeinen kleiner, schmaler mit gegabeltem Schwanz und wirken gedrungener. Außerdem sind die Seeschwalben ausgesprochene Zugvögel, die in den Tropen oder sogar wie die Küstenseeschwalbe (Sterna paradisaea) in der Antarktis überwintern. Scherenschnäbel (Rynchops) kommen mit drei Arten ausschließlich in den Tropen Amerikas, Afrikas und Asiens vor. Als eine Besonderheit unter den Vögeln haben Scherenschnäbel schlitzförmige Pupillen. Eine weitere Besonderheit ist der seitlich abgeflachte Unterschnabel bei den erwachsenen Tieren, der deutlich länger als der Oberschnabel ist.
Einige Möwen und einige Seeschwalben, z. B. die Küstenseeschwalbe (Sterna paradisaea) und die Antipodenseeschwalbe (Sterna vittata) kommen auch an den Küsten der Arktis und Antarktis vor. Mit Ausnahme der nachtaktiven Gabelschwanzmöwe (Creagrus furcatus) sind alle Arten der Möwenverwandten tagaktiv. Möwen ernähren sich von Fisch, Krebstieren und anderen Wirbellosen, kleinen Säugern und kleinen Vögeln, Eiern und Jungvögeln. Die meisten Arten der Möwenverwandten nisten in Gruppen oder kolonial in größeren Verbänden. Sie bevorzugen dabei Gebiete, in denen es keine Beutegreifer gibt, vor allem Inseln. Die meisten Arten nisten auf dem Erdboden, einige auch auf Vorsprüngen an Felsklippen an den Küsten, auf Bäumen oder auf treibenden Flößen aus pflanzlichem Material.
Möwen sind fossil seit dem späten Oligozän bekannt und gehören zur Gattung Laricola (De Pietri et al. 2011). Feducciavis aus dem mittleren Miozän von Virginia (USA) ist der früheste Vertreter der Noddiseeschwalben (Gattung Anous; Olson 2011; Abb. 22). Mutmaßliche Möwen aus dem frühen bis mittleren Miozän Neuseelands und dem mittleren Miozän Nordamerikas (Olson & Rasmussen 2001, Worthy et al. 2007) beruhen auf sehr fragmentarischen Überresten, und sogar eine angebliche Möwe aus dem späten Miozän von Nebraska (Gaviota; Miller & Sibley 1941), die nur durch einen distalen Humerus vertreten ist, unterscheidet sich deutlich von den modernen Möwen. In einigen pliozänen Lokalitäten sind dagegen Möwen reichlich vertreten (Olson & Rasmussen 2001). Der Fossilnachweis deutet daher auf einen vergleichsweise jungen Ursprung dieser charakteristischen Vögel heutiger Küstengebiete hin, was auch durch kalibrierte molekularen Daten gestützt wird (Jetz et al. 2012, Mayr 2011).

Abb. 22: Laricola und Feducciavis
Raubmöwen (Stercorariidae)
Die Familie der Raubmöwen (Stercorariidae) sind vor allem in den polaren Regionen beheimatet. Sie sind in der Gestalt möwenartig, haben aber kräftigere Schnäbel, dessen Spitze gekrümmt ist. Die stämmigen Beine enden in Füßen mit voll entwickelten Schwimmhäuten und scharfen Krallen. n der Regel sind die großen Raubmöwen einfarbig braun gefärbt, die kleinen dunkelgrau mit helleren Brust- und Kopfpartien. Ausgeprägt ist aber bei fast allen Arten der Polymorphismus, das heißt innerhalb einer Art gibt es dunkle und helle Morphen. Raubmöwen sind Opportunisten mit einem sehr breiten Nahrungsspektrum. Am bekanntesten sind sie wohl für den Kleptoparasitismus, aber sie betätigen sich auch als Fischjäger, Eierdiebe, Aas- und Pflanzenfresser und erbeuten junge wie ausgewachsene Vögel (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2015, 2020o, Cohen et al. 1997, Chu et al. 2009; Abb. 23).

Abb. 23: Skuas
Insgesamt gibt es 7 Arten, vier auf der Nordhalbkugel, 3 auf der Südhalbkugel. Oft werden erhebliche Strecken zurückgelegt, vier der sieben Arten überwintern auf der jeweils anderen Halbkugel. Unter Raubmöwen treffen wir zwei bemerkenswerte Rekorde der Vogelwelt an: Die Antarktikskua (Stercorarius maccormicki) brütet dichter am Südpol als jedes andere Wirbeltier. Der gleichen Art gehört der Vogel mit der weitesten nachgewiesenen Zugstrecke an: beringt auf der Antarktischen Halbinsel, wurde derselbe Vogel später in Grönland nördlich des Polarkreises wiedergefunden.
Alkenvögel (Alcidae)
Alkenvögel (Alcidae) kommen ausschließlich auf der Nordhalbkugel vor. Es handelt sich um drossel- bis entengroße Meerestauchvögel mit weit hinten am Körper angesetzten Beinen, so dass sie an Land eine mehr oder weniger aufrechte Körperhaltung zeigen (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2015, 2020p, Friesen et al. 1996, Moum et al. 2002, Thomas et al. 2004, Strauch 1985; Abb. 24).

Abb. 24: Alkenvögel
Ihr Erscheinungsbild ähnelt dem der Pinguine, die fast ausschließlich auf der Südhalbkugel vorkommen. Die Angehörigen beider Familien sind schwarzweiß und stehen aufrecht. Beide haben ein kurzes und eng anliegendes Gefieder und bei beiden Familien sind die Flügel für die Fortbewegung unter Wasser umgebildet. Anders als Pinguine haben die meisten Alkenvögel ihre Flugfähigkeit behalten. Die einzige flugunfähige Art aus dieser Familie, der Riesenalk, der so groß wurde wie eine Gans, ist im 19. Jahrhundert ausgestorben. Die Ähnlichkeit mit den Pinguinen beruht allerdings ausschließlich auf konvergenter Evolution. Die beiden Familien sind nicht sehr nahe miteinander verwandt.[1] der wohl auffälligste und bekannteste Vertreter dieser Familie, die insgesamt 25 Arten hat, ist der Papageitaucher (Fratercula arctica). Die Art brütet in Erdhöhlen an und auf Klippen im Nordatlantik sowie im westlichen Nordpolarmeer. Nach den genetischen Daten zu urteilen, scheinen ihre nächsten lebenden Verwandten die Raubmöwen zu sein, wobei sich diese beiden Linien vor etwa 30 Millionen Jahren getrennt haben (Friesen et al. 1996, Moum et al. 2002, Thomas et al. 2004).
Die frühesten eindeutigen Fossilien der Alkenvögel stammen aus dem späten Eozän (Smith 2011). Die Gattung Miocepphus aus dem Miozän vor 15 Mio. Jahren ist die früheste, die aus guten Exemplaren bekannt ist. Zwei sehr fragmentarische Fossilien werden häufig den Alcidae zugeordnet, obwohl dies möglicherweise nicht korrekt ist: Hydrotherikornis (spätes Eozän) und Petralca (spätes Oligozän; Mayr 2009, 2016, Mlikovsky 1987, Göhlich & Mayr 2018; Abb. 25). Die meisten der heute lebenden Gattungen sind seit dem späten Miozän oder frühen Pliozän bekannt. Die flugunfähige Unterfamilie Mancallinae, die anscheinend auf die Pazifikküste des südlichen Nordamerikas beschränkt war und im frühen Pleistozän ausstarb, wird nach einigen Definitionen manchmal zur Familie der Alcidae gerechnet. Eine Art, Miomancalla howardae, ist die größte Charadriiformes aller Zeiten (Smith 2011, 2015, Abb. 26).

Abb. 25: Holotyp von Petralca, der möglicherweise kein Alkenvogel ist.
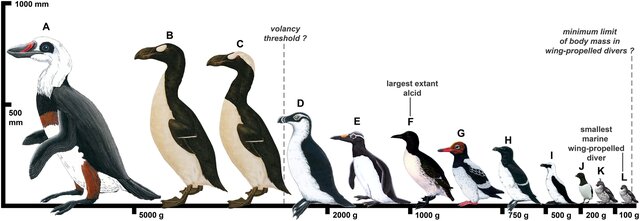
Abb. 26: Ausgewählte Arten, die die Bandbreite der Körpergrößen der Pan-Alcidae zeigen (skaliert auf der Grundlage von Körpermassenschätzungen): †Miomancalla howardae (A); Riesenalk (†Pinguinus impennis) (B); †Pinguinus alfrednewtoni (C); †Alca stewarti (D); †Mancalla vegrandis (E); Trottellumme (Uria aalge) (F); †Miocepphus blowi (G); Tordalk (Alca torda) (H); †Alca minor (I); Krabbentaucher (Alle alle) (J); †Aethia storeri (K); Zwergalk (Aethia pusilla) (L).
Heute kommt die größte Vielfalt der Alkenvögel im Nordpazifik vor, mit 19 Arten, von denen 16 endemisch sind, während im Nordatlantik insgesamt nur sechs Arten (mit nur vier endemischen Arten) vorkommen. Die Artenarmut im Atlantik wird auf das Aussterben vieler Arten im Atlantik zurückgeführt, da diese fossil nachweislich artenreicher in dieser Region waren. Die meisten und ältesten Funde stammen jedoch aus dem Pazifik. Entsprechend gehen die meisten Ornithologen davon aus, dass die Alkenvögel im Pazifik entstanden sind und sich von dort aus ausbreiteten (Konyukhov 2002).
Laufhühnchen (Turnicidae)
Die Laufhühnchen oder Kampfwachteln (Turnicidae), welche in Afrika, Asien und Australien vorkommen, ähneln äußerlich den Wachteln, gehören aber tatsächlich zu den Lari (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2015, 2020q; Abb. 27). Den Lebensraum bilden offene Habitate wie Savannen und Halbwüsten. Es sind kleine, bodenbewohnende Vögel mit einer Länge von 10 bis 23 cm und einem Gewicht von 20 bis 130 g. Sie sind plump gebaut, haben kräftige Füße, einen kurzen Schwanz und einen kurzen Schnabel. Das Gefieder ist in unauffälligen Farben gehalten. Braun- und Grautöne herrschen vor, oft mit einer schwarzen Strichelung oder Marmorierung. Die Weibchen sind in der Regel größer und es gibt deutliche Unterschiede in der Anatomie. Beim Weibchen sind Luftröhre und Speiseröhre deutlich vergrößert. Die verbreiterte Luftröhre dient zum Erzeugen weittragender Laute, dabei wird die Speiseröhre als Resonanzkörper genutzt. Diese Laute werden mit geschlossenem Schnabel ausgestoßen und erschallen je nach Art als taubenartiges Gurren, dumpfes Dröhnen oder rinderartiges Muhen. Sie sind auf weite Entfernungen hörbar, aber schwer zu orten. Männchen haben keine derartig gestalteten Organe und sind nicht fähig, diese Laute auszustoßen. Kennzeichnend für viele, aber nicht alle, Arten der Laufhühnchen ist auch eine eigentümliche Fortbewegungsweise. Dabei halten die Vögel zwischendurch inne und bewegen den Körper immer wieder vor und zurück, bevor sie den Fuß einen weiteren Schritt vorsetzen. Diese zögernde Fortbewegung erinnert am ehesten an Chamäleons.

Abb. 27: Laufhühnchen
Der früheste bekannte Vertreter der Laufhühnchen ist Turnipax oechslerorum aus dem Oligozän Deutschlands (Abb. 28). Diese Art wurde erst 2007 nach dem Fund eines postkranialen (= vollständig ohne Schädel) Skeletts den Laufhühnchen zugeordnet. Das Skelett vermittelt in den Merkmalen zwischen Regenpfeiferartigen und modernen Laufhühnchen (Mayr & Knopf 2007). Von dieser Art abgesehen sind keine fossilen Laufhühnchen bekannt, die älter als das Pleistozän sind.
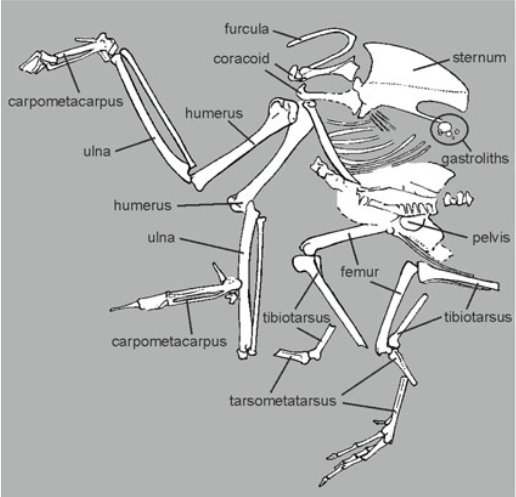
Abb. 28: Skelett von Turnipax oechslerorum
Reiherläufer (Dromadidae)
Der Reiherläufer (Dromas ardeola) ist ein in Kolonien brütender Vogel der Küsten des Indischen Ozeans. Seine taxonomische Einordnung ist nicht ganz sicher: während der hier in die Verwandtschaft der Lari gestellt wird, stellen ihn manche Autoren zu den Charadrii, vor allem der Triele. Dies liegt an der ähnlichen Schnabelform mit dem des Krabbentriels (Esacus recurvirostris), was aber auf konvergente Evolution zurückzuführen ist (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2015, 2020r, Pereia & Baker 2010; Abb. 29).
Abb. 29: Reiherläufer
Brachschwalbenartige (Glareolidae)
Die Brachschwalbenartigen (Glareolidae), welche zwei Unterfamilien haben (Bachschwalben, Glareolinae mit den Gattungen Glareola und Stiltia und Rennvögel, Cursoriinae mit den Gattungen Cursorius und Rhinoptilus; von einigen Autoren wird der Doppelband-Rennvogel, Rhinoptilus africanus in eine eigene Gattung Smutsornis gestellt) sind insofern ungewöhnlich, als dass sie mit den Rennvögeln auch Vertreter haben, die die ariden Gebiete Afrikas und Asiens bewohnen. Sieben der neun Arten der Rennvögel bewohnen Afrika (eine von diesen zusätzlich Westasien), die anderen zwei leben auf dem indischen Subkontinent. Typischer Lebensraum sind aride Regionen wie Wüste, Halbwüste und Savanne. Sie sind vorwiegend nachtaktiv. Die zweite Unterfamilie ist die Brachschwalben, die acht Arten in zwei Gattungen aufweist. Die meisten Brachschwalben bewohnen die feuchtgebiete Europas, Asiens, Afrikas und Australiens. Die sieben typischen Brachschwalben werden in die Gattung Glareola gestellt. Die deutlich abweichende australische Stelzenbrachschwalbe (Stiltia isabella), die gestaltlich zwischen Brachschwalben und den Rennvögeln vermittelt, repräsentiert eine eigene Gattung Stiltia (del Hoyo et al. 1996, del Hoyo 2020, Winkler et al. 2015, 2020s; Abb. 30). Fossil sind Brachschwalben seit dem Miozän bekannt. Sowohl die rezente Gattung Glareola als auch die ausgestorbene Gattung Mioglareola waren in dieser Zeit in Europa beheimatet. Vermutet wird allerdings ein afrikanischer Ursprung der Gruppe. Die Rotflügelbrachschwalbe (Glareola pratincola) war noch während des Pleistozäns in Mitteleuropa verbreitet (Mlikovsky 2002, Mayr & Smith 2001).
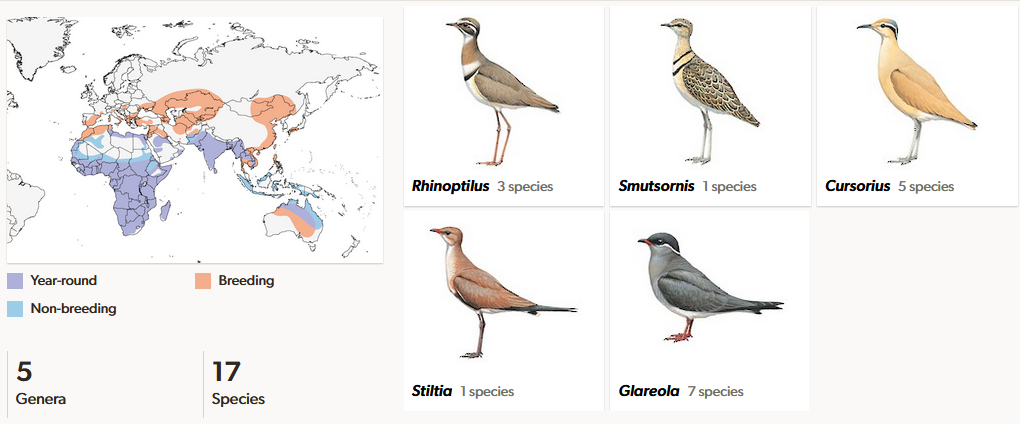
Abb. 30: Brachschwalben
Literatur
Agnolín, F.L., Tomassini, R.L., Contreras, V.H. (2016): Oldest record of Thinocoridae (Aves, Charadriiformes) from South America. Annales de Paléontologie 102, 1–6.
Baker AJ, Pereira SL, Paton TA (2007): Phylogenetic relationships and divergence times of Charadriiformes genera: multiple evidence for the Cretaceous origin of at least 14 clades of shorebirds, Biol. Lett. 3, 205-209.
Baker AJ, Yatsenko Y, Tavares ES (2012): Eight independent nuclear genes support monophyly of the Plovers: the role of mutational variance in gene trees, Mol. Phylogenet. Evol. 65, 631-641.
Bertelli, S.; Lindow, B. E. K.; Dyke, G. J.; Mayr, G. (2013): Another charadriiform-like bird from the lower Eocene of Denmark. Paleontological Journal. 47 (11). Pleiades Publishing Ltd: 1282–1301.
Bridge ES, Jones AW, Baker AJ (2005): A phylogenetic framework for the terns (Sternini) inferred from mtDNA sequences: implications for taxonomy and plumage evolution, Mol. Phylogenet. Evol. 35, 459-469.
Černý, D., Rossy, N. (2022): Comprehensive taxon sampling and vetted fossils help clarify the time tree of shorebirds (Aves, Charadriiformes). Molecular Phylogenetics and Evolution 177
Chu, P. C., Eisenschenk, S. K., Zhu, S.-T. (2009): Skeletal morphology and the phylogeny of skuas (Aves: Charadriiformes, Stercorariidae). In: Zoological Journal of the Linnean Society 157 (3): 612–621
Cohen, Baker, Belchschmidt, Dittmann, Furness, Gerwin, Helbig, de Korte, Marshall, Palma, Peter, Ramli, Siebold, Willcox, Wilson and Zink (1997): Enigmatic phylogeny of skuas. Proc. Biol. Sci. 264 (1379): 181–190.
Del Hoyo, J. (2020): All the Birds of the World. Lynx Nature Books
Del Hoyo, J.; Elliott, A.; Sargatal, J., eds. (1996): Handbook of the Birds of the World. Vol. 3: Hoatzin to Auks. Lynx Edicions.
De Pietri, V.L., Costeur, L., Güntert, M., Mayr, G. (2011): A revision of the Lari (Aves: Charadriiformes) from the early Miocene of Saint-Gérand-le-Puy (Allier, France). Journal of Vertebrate Paleontology 31, 812–828.
De Pietri, V.L., Camens, A.B., Worthy, T.H. (2015): A Plains-wanderer (Pedionomidae) that did not wander plains: A new species from the Oligocene of South Australia. The Ibis 157, 68–74.
De Pietri, V. L., Scofield; R. P. (2014): The earliest European record of a Stone-curlew (Charadriiformes, Burhinidae) from the late Oligocene of France. In: Journal of Ornithology. 155 (2): 421–426.
De Pietri, V.L., Scofield, R.P., Tennyson, A.J., Hand, S.J., Worthy, T.H. (2016): Wading a lost southern connection: Miocene fossils from New Zealand reveal a new lineage of shorebirds (Charadriiformes) linking Gondwanan avifaunas. Journal of Systematic Palaeontology 14, 603–616.
Dos Remedios N, Küpper C, Lee PLM, Burke T, Szekely T (2015): North or South? Phylogenetic and biogeographic origins of a globally distributed avian clade, Mol. Phylogenet. Evol. 89, 151-159.
Ericson PGP, Envall I, Irestedt M, Norman JA (2003): Inter-familial relationships of the shorebirds (Aves: Charadriiformes) based on nuclear DNA sequence data, BMC Evol. Biol. 3, 16.
Estrella, S.; Masero, J. A. (2007): The use of distal rhynchokinesis by birds feeding in water. Journal of Experimental Biology. 210 (21): 3757–3762.
Fain MG, Houde P (2007): Multilocus perspectives on the monophyly and phylogeny of the order Charadriiformes, BMC Evol. Biol. 7, 35.
Friesen, V.L.; Baker, A.J. & Piatt, J.F. (1996): Phylogenetic Relationships Within the Alcidae (Charadriiformes: Aves) Inferred from Total Molecular Evidence. Molecular Biology and Evolution 13 (2): 359–367.
Gibson R, Baker A (2012): Multiple gene sequences resolve phylogenetic relationships in the shorebird suborder Scolopaci (Aves: Charadriiformes), Mol. Phylogenet. Evol. 64, 66-72.
Göhlich, U. B., Mayr, G. (2018): The alleged early Miocene Auk Petralca austriaca is a Loon (Aves, Gaviiformes): restudy of a controversial fossil bird. Historical Biology: An International Journal of Paleobiology 30 (8): 1076–1083
Harrison, C. J. O. (2008): A new wader, Recurvirostridae (Charadriiformes), from the early Eocene of Portugal. Ciências da Terra 7: 9 – 16.
Jahn, T. (1982): Brehms neue Tierenzyklopädie. Herder, Freiburg im Breisgau, Prisma, Gütersloh.
Jetz, W., Thomas, G.H., Joy, J.B., Hartmann, K., Mooers, A.O. (2012): The global diversity of birds in space and time. Nature 491, 444–448.
Klug, H., Bonsall, M. B., Alonzo, S. H. (2013): Sex differences in life history drive evolutionary transitions among maternal, paternal, and bi‐parental care. Ecology and Evolution. 3: 792–806.
Konyukhov, N.B. (2002): Possible Ways of Spreading and Evolution of Alcids. Biology Bulletin of the Russian Academy of Sciences (russisch). 29 (5): 447–454.
Kuhl H, Frankl-Vilches C, Bakker A, Mayr G, Nikolaus G, Boerno ST, Klages S, Timmermann B, Gahr M (2021): An unbiased molecular approach using 3’UTRs resolves the avian family-level tree of life, Mol. Biol. Evol. 38, 108-127.
Liker, A., Freckleton, R. P., Székely, T. (2013): The evolution of sex roles in birds is related to adult sex ratio. Nature Communications. 4: 1587.
Livezey; B. C. (2010): Phylogenetics of modern shorebirds (Charadriiformes) based on phenotypic evidence: analysis and discussion. In: Zoological Journal of the Linnean Society 160 (3): 567–618.
Maclean, G.L., Kirwan; G. M. (2020): Egyptian Plover (Pluvianus aegyptius), version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.egyplo1.01
Mayr, G. (2009): Paleogene Fossil Birds. Heidelberg: Springer
Mayr, G. (2011): The phylogeny of charadriiform birds (shorebirds and allies) – reassessing the conflict between morphology and molecules. Zoological Journal of the Linnean Society. 161 (4): 916–934.
Mayr, G. (2014): On the middle Miocene avifauna of Maboko Island, Kenya. Geobios 47, 133–146.
Mayr, G. (2016): Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. TOPA Topics in Paleobiology.
Mayr, G., Knopf, C. W. (2007): A stem lineage representative of buttonquails from the Lower Oligocene of Germany – fossil evidence for a charadriiform origin of the Turnicidae. Ibis 149 (4): 774–782
Mayr, G., Smith, R. (2001): Ducks, rails, and limicoline waders (Aves: Anseriformes, Gruiformes, Charadriiformes) from the lowermost Oligocene of Belgium. Geobios 34, 547–561.
Miller, A.H., Sibley, C.G. (1941): A Miocene gull from Nebraska. The Auk 58, 563–566.
Mlikovsky, J. (1987): Eine Neue Alkenart (Aves: Alcidae) aus dem Ober-Oligozän Österreichs. Annalen des Naturhistorischen Museums in Wien. Ser. A. 88: 131–147.
Mlikovsky, J. (2002): Cenozoic Birds of the World. Part 1, Europe. Ninox, Prag.
Moum, T.; Arnason, U., Árnason, E. (2002): Mitochondrial DNA Sequence Evolution and Phylogeny of the Atlantic Alcidae, Including the Extinct Great Auk (Pinguinus impennis). Molecular Biology and Evolution. 19 (9): 1434–1439.
Niethammer, G. et al. (1969): Die Wat- und Möwenvögel – Regenpfeiferartige – Möwenartige und Alken. In: Bernhard Grzimek (Hrsg.): Grzimeks Tierleben. Enzyklopädie des Tierreiches. Band 8: Vögel 2 (hrsg. von Bernhard Grzimek, Wilhelm Meise, Günther Niethammer, Joachim Steinbacher). Kindler Verlag, Zürich 1969, S. 138–235.
Olson, S. L. (1976): A jacana from the Pliocene of Florida (Aves: Jacanidae). Proceedings of the Biological Society of Washington. 89: 259–264.
Olson, S.L. (2011): A new genus and species of unusual tern (Aves: Laridae: Anoinae) from the Middle Miocene Calvert Formation of Virginia. Proceedings of the Biological Society of Washington 124, 270–279.
Olson, S. L., Eller, K. (1989): A new species of painted snipe (Charadriiformes: Rostratulidae) from the early Pliocene at Langebaanweg, southwestern Cape Province, South Africa. Ostrich 60, 118–121
Olson, S.L., Rasmussen, P.C. (2001): Miocene and Pliocene birds from the Lee Creek Mine, North Carolina. Smithsonian Contributions to Paleobiology 90, 233–365.
Owens, I.P. (2002): Male–only care and classical polyandry in birds: phylogeny, ecology and sex differences in remating opportunities. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 357: 283–293.
Paton TA, Baker AJ, Groth JG, Barrowclough GF (2003): RAG-1 sequences resolve phylogenetic relationships within Charadriiform birds, Mol. Phylogenet. Evol. 29, 268-278.
Paton TA, Baker AJ (2006): Sequences from 14 genes provide a well-supported phylogeny of Charadriiform birds congruent with the nuclear RAG-1 tree, Mol. Phylogenet. Evol. 39, 657-667.
Pereira, S. L., Baker, A. J. (2010): The enigmatic monotypic crab plover Dromas ardeola is closely related to pratincoles and coursers (Aves, Charadriiformes, Glareolidae). Genetics and Molecular Biology 33 (3), 583–586.
Prum RO, Berv JS, Dornburg A, Field DJ, Townsend JP, Lemmon EM, Lemmon AR (2015): A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing, Nature 526, 569-573.
Rasmussen, D.T.; Olson, Storrs L.; Simons, Elwyn L. (1987): Fossil Birds from the Oligocene Jebel Qatrani Formation, Fayum Province, Egypt. Washington, D.C.: Smithsonian Institution. pp. 7–8.
Smith, N.A. (2011): Taxonomic revision and phylogenetic analysis of the flightless Mancallinae (Aves, Pan-Alcidae). ZooKeys (91): 1–116.
Smith, N. A. (2015): Evolution of body mass in the Pan-Alcidae (Aves, Charadriiformes): the effects of combining neontological and paleontological data. Paleobiology 42 (1): 8–26.
Strauch J.G. Jr. (1985): The phylogeny of the Alcidae. The Auk 102 (3): 520–539.
Thomas, G. H.; Székely, T.; Reynolds, J. D. (2007): Sexual Conflict and the Evolution of Breeding Systems in Shorebirds. Advances in the Study of Behavior 37, 279–342.
Thomas, G. H., Wills, M. A., Szekely, T. (2004): A supertree approach to shorebird phylogeny. BMC Evolutionary Biology. London 4: 28 ISSN 1471-2148
Tullberg, B. S., Ah–King, M., Temrin, H. (2002): Phylogenetic reconstruction of parental–care systems in the ancestors of birds. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 357: 251–257.
Whittingham, L. A., Sheldon, F. H., Emlen, S. T. (2000): Molecular phylogeny of jacanas and its implications for morphologic and biogeographic evolution. The Auk 2000, 117(1): 22–32.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2015): Bird Families of the World: A Guide to the Spectacular Diversity of Birds. Lynx Edicions, Barcelona.
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020a): Plovers and Lapwings (Charadriidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.charad1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020b): Stilts and Avocets (Recurvirostridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.recurv1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020c): Oystercatchers (Haematopodidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.haemat1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020d): Ibisbill (Ibidorhynchidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.ibidor1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020e): Egyptian Plover (Pluvianidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.pluvia1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020f): Thick-knees (Burhinidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.burhin2.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020g): Sheathbills (Chionidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.chioni1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020h): Magellanic Plover (Pluvianellidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.pluvia2.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020i): Jacanas (Jacanidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.jacani1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020j): Painted-Snipes (Rostratulidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.rostra1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020k): Seedsnipes (Thinocoridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.thinoc1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020l): Plains-wanderer (Pedionomidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.pedion1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020m): Sandpipers and Allies (Scolopacidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.scolop2.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020n): Gulls, Terns, and Skimmers (Laridae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.larida1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020o): Skuas and Jaegers (Stercorariidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.sterco1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020p): Auks, Murres, and Puffins (Alcidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.alcida1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020q): Buttonquail (Turnicidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.turnic1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020r): Crab-Plover (Dromadidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.dromad1.01
Winkler, D. W., Billerman, S. M., Lovette, I. J. (2020s): Pratincoles and Coursers (Glareolidae), version 1.0. In Birds of the World (S. M. Billerman, B. K. Keeney, P. G. Rodewald, and T. S. Schulenberg, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.glareo1.01
Worthy, T.H., Tennyson, A.J.D., Jones, C., McNamara, J.A., Douglas, B.J. (2007): Miocene waterfowl and other birds from central Otago, New Zealand. Journal of Systematic Palaeontology 5, 1–39.