Ok beginnen wir mit einem etwas kontroversen Thema. Dass Donald Trump sicherlich nicht zu den intelligent designten Exemplaren von Gottes Schöpfung gehört leuchtet mir ein. Aber manchmal habe ich das Gefühl, dass seine Gegner auch nicht immer zu den hellsten Sternen im Nachthimmel gehören. Und dies zeigt sich um eine Diskussion, nachdem seine Regierung ein Dekret erlassen hat, nachdem das Geschlecht eines Menschen zum Zeitpunkt der Zeugung gilt. Nachdem dieses Dekret erlassen wurde, häuften sich auf Social Media, vor allem auf Twitter (jetzt X) und TikTok, dass wir doch alle wüssten, dass alle menschlichen Embryonen zu Beginn weiblich seien.
Tatsächlich habe ich vorerst gar nicht viel davon mitbekommen, nicht zuletzt, weil ich Twitter kaum benutze und mit TikTok gar nichts anfangen kann. Aber ich wurde durch einen Kanal, den ich auf Youtube abonniert habe darauf aufmerksam gemacht, nämlich dem Kanal von @gen.au.gen.ommen[1], einer Genetikerin, die einige sehr interessante Vorträge hält und in meinem Video, in ich mich mit den Sichtweisen von Heinz Jürgen Voß zur Vielgeschlechtlichkeit auseinandergesetzt habe auch zu Wort kommt. Ihr Kanal ist in der Videobeschreibung verlinkt.
Schon mal Vorweg: die Behauptung, dass menschliche Embryonen oder Wirbeltierembryonen allgemein, als weiblich beginnen ist schlicht und einfach falsch. Ich werde gleich erklären warum. Aber dieser Mythos hält sich lange und hielt auch Einzug in einigen sehr populären Filmen und sogar einigen Biologielehrbüchern.
In dem Film „Jurassic Park“ aus dem Jahr 1993 erklärt der Wissenschaftler Henry Wu der Gruppe, die sich um einen Baby-Velociraptor schart, das gerade aus seinem Ei schlüpft, dass alle Wirbeltierembryonen zunächst weiblich sind und dass ein zusätzliches Hormon, das im richtigen Entwicklungsstadium verabreicht wird, sie in Männchen verwandelt. Um alle Dinosaurier im Jurassic Park zu Weibchen zu machen, sagt er, wird ihnen einfach dieses zusätzliche Hormon vorenthalten. Aber Filme können ja alles Mögliche behaupten, wie sieht es mit Biologie-Lehrbüchern aus.
Hierfür möchte ich folgendes Twitter Video einer Userin namens unlearn16 verweisen:
https://x.com/unlearn16tweet/status/1882187873715474585
Also diese Dame zitiert ein Biologie-Lehrbuch und behauptet großspurig und überheblich, keine falschen Schlüsse ziehen zu wollen. Aber welches Biologie-Lehrbuch zitiert sie da? Den Laien wird es wahrscheinlich nichts sagen, aber ich habe es eindeutig als den Campbell erkannt. Ich lasse hierzu @gen.au.gen.ommen zu Wort kommen:
Was ich hierzu ergänzen würde: Dem Film Jurassic Park kann man verzeihen diese Information zu verbreiten: der Film stammt aus dem Jahr 1993 und ist damit unwesentlich älter als die Ausgabe des Campbell. Aber im Jahr 2025 ein veraltetes Lehrbuch zu zitieren von dem in diesem Jahr die 12. Auflage erscheinen wird, ist schon echt peinlich, vor allem für eine Influencerin, die sich „Bildung“ auf die Fahnen geschrieben hat – und was sagt das über den Zustand dieser Bibliothek aus in der sie herumgeistert. Gibt es dort nichts Aktuelleres?
Aber warum ist die Aussage, dass menschliche Embryonen zu Beginn weiblich seien, falsch.
Als junge Embryonen beginnen Wirbeltiere undifferenziert (Wolpert et al. 2019). Embryonen haben beide Anlagen, die primitiven Genitalgänge, für beide Geschlechter angelegt, die als Müllersche und Wolffsche Gänge bekannt sind (Rey et al. 2020, Abb. 1). Die Müllerschen Gänge werden zum weiblichen Genitalsystem. Die Wolffschen Gänge werden zum männlichen Genitalsystem. Während der Geschlechtsentwicklung wird ein Gang eliminiert, während der andere differenziert wird, sodass beide Geschlechter am Ende nur einen Satz Genitalgänge haben. Allgemein wird davon gesprochen, dass die Embryonalanlagen bipotent sind (Capel et al. 2006, Rey et al. 2020). Aber hier ist Vorsicht geboten: undifferenziert bedeutet, dass man, betrachtet man sich nur das Zellgewebe, einen Embryo in diesem Stadium nicht als männlich oder weiblich definieren kann, da die Organe noch nicht ausgereift sind. Das ist in der Embryologie nichts Ungewöhnliches. Ein jedes Organ beginnt in einem Embryo aus undifferenziertem Gewebe. Es gibt sogar ein Embryonalstadium, dass sogenannte phylotypische Stadium, bei dem sich Wirbeltierembryonen grundsätzlich sehr stark ähneln (Wagner 2019). Trotz dieser Ähnlichkeit der Embryonen unterschiedlicher Wirbeltiere in diesem Stadium kann sich ein Forellenembryo nicht in ein Hühnerembryo verwandeln oder Waranembryo in einen Menschenembryo. Einfach aus dem Grund, weil die genetische Ausstattung den Entwicklungsweg salopp formuliert, vorherbestimmt. Genauso verhält es sich mit dem Begriff bipotent. Ein Menschenembryo hat nicht von Beginn an das Potential nach gut dünken männlich oder weiblich zu werden, denn das ist bei uns genetisch festgelegt. Bei Säugetieren wird dies durch die bei der Empfängnis vererbten Geschlechtschromosomen (XX oder XY) und die darin enthaltenen Gene bestimmt. Abgesehen von genetischen Störungen führt XX zu Eierstöcken. XY führt zu Hoden. Grundsätzlich: es sind noch nicht einmal die Chromosomen, sondern die darin und auch in anderen Chromosomen enthaltenen Gene, Geschlecht determinieren. Kurzgesagt: nicht die Chromosomen, sondern die Gene und Genexpression bestimmen das Geschlecht. Geschlecht ist bei Säugetieren genetisch festgelegt und die Entwicklung daher schon in die Wege geleitet, bevor sich das Gewebe überhaupt differenziert oder gar bildet.
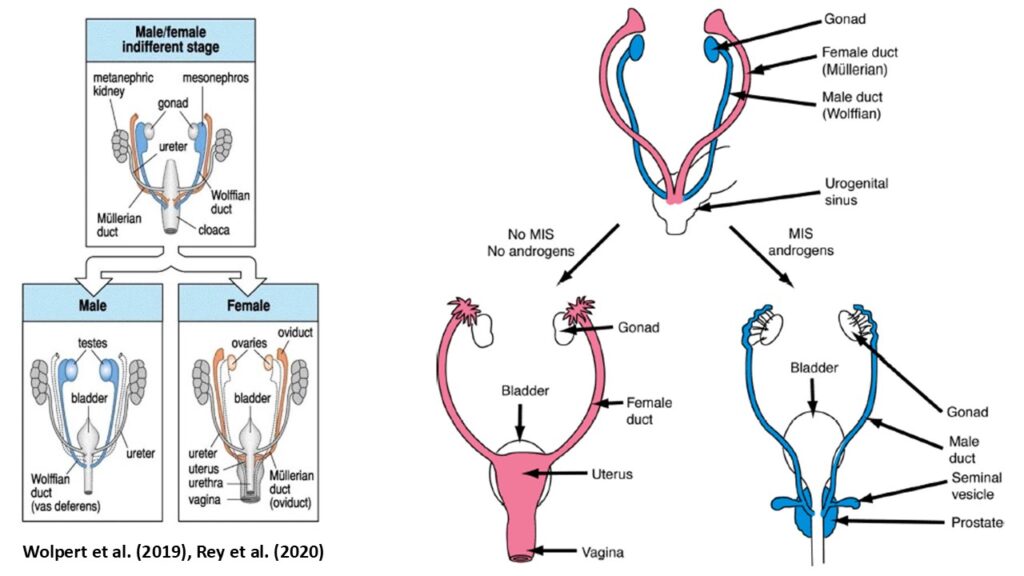
Abb. 1: Wolfsche und Müllersche Gänge
In den letzten Jahren hat sich gezeigt, dass die Geschlechtschromosomen schon bald nach der Befruchtung – lange vor dem Auftreten von Keimdrüsen oder Sexualhormonen – die Geschlechtsdifferenzierung vorantreiben, und dies wirkt sich auf alle Gewebe im Körper aus, einschließlich Knochen, Muskeln, Blut, Herz, Lunge, Leber, Gehirn usw. (Deegan & Engel 2019; Lowe, et al. 2015; Heydari et al., 2022). Außerdem: die verschiedenen Prozesse, bei der sich das Geschlecht entwickelt (nicht zu verwechseln mit der Definition des Geschlechts) sind auch nicht willkürlich und frei kombinierbar, sondern stehen in einem kohärenten Gesamtverband. Bezogen auf Säugetiere: Das Vorhandensein des SRY-Gens (meist am Y-Chromosom lokalisiert) schaltet im Embryonalstadium Entwicklungsvorgänge ein, die eine bestimmte Menge an Androgenen produzieren, die zur Bildung der Hoden führen, die Spermien produzieren etc. (Sekido & Lovell-Badge 2008, 2009). Diese Eigenschaften sind also nicht voneinander zu trennen: Eierstöcke produzieren keine Spermien und bei Aktivität des SRY-Gens entwickeln sich keine Eierstöcke etc.
Daher kann die Behauptung, dass „alle Embryonen als weiblich beginnen“, nur dann wahr sein, wenn undifferenzierte Gonaden und undifferenzierte Genitalien gleichbedeutend mit weiblich sind. Weiblich zu sein, erfordert jedoch einen bestimmten Entwicklungsweg: Die Gonaden differenzieren sich zu Eierstöcken, und die Müllerschen Gänge differenzieren sich bei Säugetieren zu Eileitern, Gebärmutter und Vagina. Weibliche Entwicklung bedeutet nicht undifferenziert. Damit wir alle auf körperlicher Ebene als weiblich beginnen, müssten wir zuerst Eierstöcke und weibliche Genitalien entwickeln. Um dann ein Mann zu werden, würden sich die Eierstöcke in Hoden verwandeln. Und die weiblichen Genitalien würden sich in männliche verwandeln. Aber das passiert nicht.
Der Mythos, dass Embryonen weiblich beginnen ist aber sogar noch älter als Jurassic Park und gehen auf den französischen Endokrinologen Alfred Jost Mitte des 20. Jh. zurück. Er entfernte Kaninchenembryonen die Keimdrüsen, bevor die Geschlechtsdifferenzierung einsetzte und entdeckte, dass die Embryonen ohne Keimdrüsen, unabhängig davon, ob sie XX- oder XY-Chromosomen hatten aus den Müllerschen Gängen Eileiter, Gebärmutter und Vagina entwickelten. Anschließend transplantierte er einem XX-Embryo Hoden und stellte fest, dass der Fötus die männlichen Genitalien und keine weiblichen Genitalien entwickelte. Aus seinen Experimenten an Kaninchen schloss Jost, dass die Entwicklung der weiblichen Genitalien ein Standardprozess sei, während die Entwicklung der männlichen Genitalien ein additiver Prozess sei, der durch die von den Hoden produzierten Sexualhormone ausgelöst werde (Jost 1947, 1970, 1972, Zhao & Yao 2019; DiNapoli & Capel 2008, Abb. 2). Hier verwandelten sich Josts Beobachtungen in einen verworrenen Mythos. Was ursprünglich die korrekte Behauptung war, dass sich die weiblichen Genitalien ohne jegliche Gonade entwickeln, wurde zur falschen Behauptung, dass wir alle als Frauen beginnen oder dass das Weibliche ein passiver Weg ist.
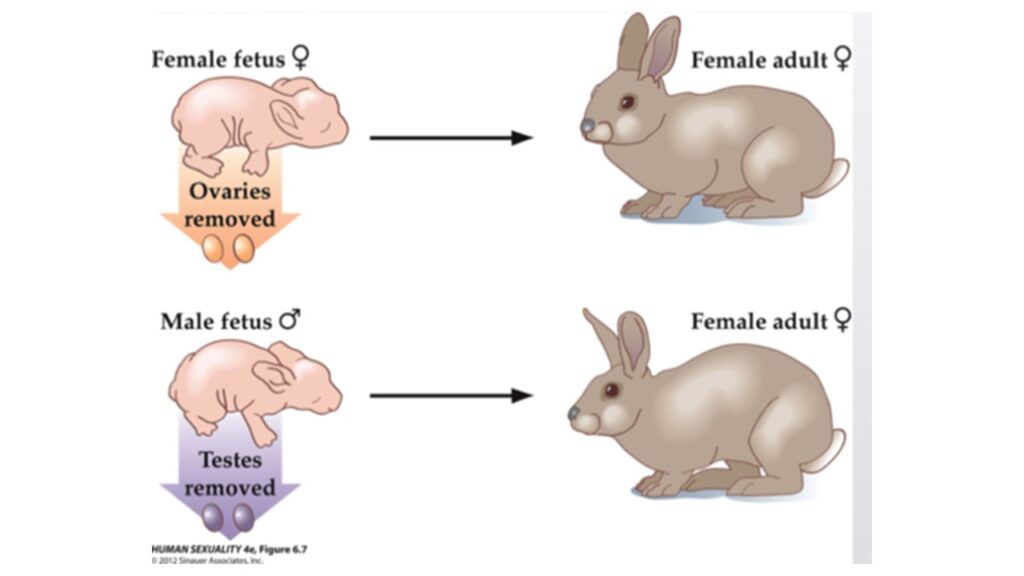
Abb. 2: Experimente von Alfred Jost
Seitdem haben genetische Studien jedoch zwei fehlende Teile aus Josts Experimenten entdeckt. Der erste fehlende Teil wurde in der Entwicklung der Gonaden gefunden, dem wichtigsten Schritt der Geschlechtsentwicklung. Viele Studien haben gezeigt, dass die Entwicklung der Eierstöcke, wie auch die Entwicklung der Hoden, ein aktiver genetischer Prozess ist (Biason-Lauber 2012).
Zum Beispiel führt bei XY-Embryonen der Verlust von Genen für die Hodenentwicklung in der Regel zu undifferenziertem Gonadengewebe, das als Streifengonaden bezeichnet wird, und nicht zu Eierstöcken. Ebenso kann bei XX-Embryonen der Verlust von essentiellen X-chromosomalen Genen für Eierstöcke zu Streifengonaden führen. Schließlich kann bei XX-Embryonen der Verlust der Gene WNT4 und FOXL2 zur Entwicklung von Hoden anstelle von Eierstöcken führen. Diese beiden Gene sind für die Hochregulierung des Eierstockentwicklung und die Unterdrückung der Hodenentwicklung von entscheidender Bedeutung (Biason-Lauber 2012, Ottolenghi et al. 2007; Kim et al. 2006; Eggers & Sinclair 2012, Uhlenhaut et al. 2009, Rey et al. 2020, Abb. 3). Diese beiden Gene finden sich übrigens nicht in den Geschlechtschromosomen. Aus diesen Erkenntnissen schlossen Genetiker, dass die Initiierung der Eierstockentwicklung eindeutig die aktive Regulierung vieler Gene beinhaltet und nicht einfach ein passiver Entwicklungsprozess ist (DiNapoli & Capel 2008).
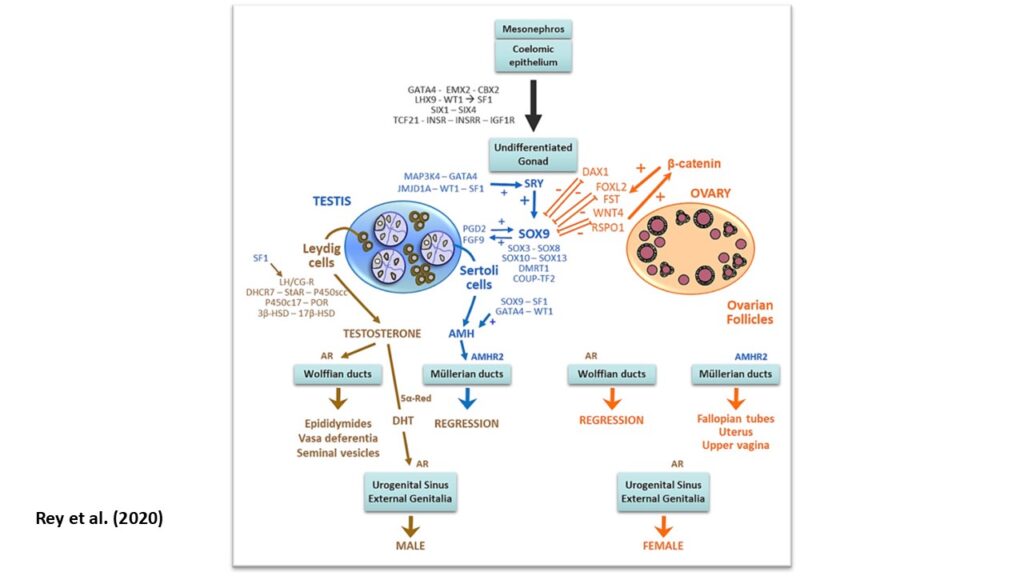
Abb. 3: Komplexität der Geschlechtsentwicklung
Das zweite fehlende Teil wurde in den Genitalien, bzw. den Müllerschen und Wolffschen Gänge, gefunden. Studien an Mäusen und Menschen haben gezeigt, dass für die korrekte Differenzierung der Müllerschen Gänge WNT- und HOX-Gennetzwerke erforderlich sind, nicht nur das Fehlen männlicher Sexualhormone. Ohne diese genetischen Netzwerke konnten weibliche Föten keine vollständigen Müllerschen Gänge entwickeln (Mullen & Behringer 2015; Prunskaite-Hyyryläinen et al. 2016; Wilson & Bordoni 2023). Nachdem die Genetik hinter der Bildung der Müllerschen Gänge entdeckt worden war, verlagerte sich der Fokus auf die Genetik der Wolffschen Gänge. Eine Studie an Mäusen aus dem Jahr 2017 ergab, dass die Wolffsche Gänge bei Weibchen, von denen man annimmt, dass sie bei Testosteronmangel eliminiert werden, tatsächlich eine aktive Unterdrückung durch das Gen COUP transcription factor 2 (COUP-TFII) benötigt. Daher behalten Weibchen, denen dieses Signal fehlt, die Wolffschen Gänge bei und entwickeln sie trotz Testosteronmangels weiter (Zhao et al. 2017).
Diese bahnbrechende Forschung lieferte wichtige Erkenntnisse, die in Josts Experimenten fehlten, und stellte das stark vereinfachte Modell in Frage. Wie sich herausstellte, benötigen beide Geschlechter aktive genetische Netzwerke, um die Gonaden und Genitalien vollständig zu entwickeln, wobei ein Pfad hochreguliert und der andere unterdrückt wird (Warr & Greenfield 2012).
Trotz all dieser Belege halten sich die Mythen hartnäckig. Da die Schlussfolgerungen von Josts Experimenten übertrieben wurden, glauben viele Menschen heute fälschlicherweise, dass wir alle als weiblich beginnen, dass Frauen unterentwickelte Männer sind und dass der einzige Unterschied zwischen den Geschlechtern der Testosteronspiegel ist. Dies hat weitreichende Auswirkungen.
Erstens trübt der Mythos, dass wir alle als weiblich beginnen, den Biologieunterricht und sorgt für Verwirrung und Unwissenheit. Diese Verwirrung und Unwissenheit erleben wir jetzt.
Zweitens könnte die falsche Annahme, dass Frauen unterentwickelte Männer sind, schädliche Geschlechterstereotypen verstärken – dass weibliche Eigenschaften weniger entwickelt oder zweitrangig sind. Dies kann die Sichtweise der Gesellschaft auf die Fähigkeiten, Rollen und Rechte von Frauen beeinträchtigen.
Schließlich ignoriert die Annahme, dass Testosteron der einzige Unterschied zwischen Mann und Frau ist, die unterschiedliche Genetik zwischen den Geschlechtern und die daraus resultierenden Unterschiede in der Genexpression. Forscher haben über 6500 Gene gefunden, die sich bei Männern und Frauen unterschiedlich ausprägen (Gershoni et al. 2017). Das Ignorieren dieser Genetik könnte Hypothesen verzerren und die Forschung darüber, wie sich Geschlechtsunterschiede bei Krankheiten manifestieren, in die falsche Richtung lenken. Dies könnte sich negativ auf die Wirksamkeit geschlechtsspezifischer Therapien und die Entwicklung von Arzneimittelbehandlungen auswirken.
Entgegen der Behauptung der Wissenschaftler in Jurassic Park und entgegen des Schwachsinns auf social media sind wir nicht alle von Beginn an weiblich. Die Entwicklung als Frau ist ebenso wie die Entwicklung als Mann ein spezifischer Differenzierungspfad mit allen wichtigen Unterschieden, die sich aus diesem spezialisierten Weg ergeben.
Literatur
Biason-Lauber, A. (2012). WNT4, RSPO1, and FOXL2 in sex development. Seminars in Reproductive Medicine, 30(5).
Capel, B., & Kim, Y. (2006). Balancing the Bipotential Gonad between Alternative Organ Fates: A New Perspective on an Old Problem. Developmental Dynamics, 235 (9), 2292-2300.
Deegan, D.F. Engel, N. (2019). Sexual Dimorphism in the Age of Genomics: How, When, Where. Front. Cell Dev. Biol., 06 September 2019. https://doi.org/10.3389/fcell.2019.00186
DiNapoli, L., Capel, B. (2008). SRY and the standoff in sex determination. Molecular Endocrinology, 22(1).
Eggers, S., Sinclair, A. (2012). Mammalian sex determination—insights from humans and mice. Chromosome Res, 20:215-238.
Gershoni, M., et al. (2017). The landscape of sex-differential transcriptome and its consequent action in human adults. BMC Biology, 15(7).
Heydari, R. Jangravi, Z. Maleknia, S. Seresht-Ahmadi, M. Bahari, Z. Salekdeh, G.H. Meyfour, A. (2022). Y chromosome is moving out of sex determination shadow. Cell Biosci. 2022 Jan 4;12(1):4. doi: 10.1186/s13578-021-00741-y. PMID: 34983649; PMCID: PMC8724748. https://cellandbioscience.biomedcentral.com/articles/10.1186/s13578-021-00741-y
Jost, A. (1972). A New Look at the Mechanisms Controlling Sex Differentiation in Mammals. Johns Hopkins Medical Journal, 130 (1), 38-53.
Jost, A. (1970). Hormonal Factors in the Sex Differentiation of the Mammalian Foetus. Philosophical Transactions of the Royal Society of London, 259, 119-130.
Jost, A. (1947). Recherches sur la Différenciation Sexuelle de l’Embryon de Lapin. Archives d’Anatomie Microscopique et de Morphologie Expérimentale, 36, 271–315.
Kim, Y., Kobayashi, A., Sekido, R., et al. (2006). FGF9 and WNT4 act as antagonistic signals to regulate mammalian sex determination. PLoS Biology, 4(6).
Lowe, R. Gemma, C. Rakyan, V. K. & Holland, M. L. (2015). Sexually dimorphic gene expression emerges with embryonic genome activation and is dynamic throughout development. BMC genomics, 16(1), 295. https://doi.org/10.1186/s12864-015-1506-4
Mullen, R., Behringer, R. (2015). Molecular genetics of Mullerian duct formation, regression, and differentiation. Sex Dev, 8(5), 281-296.
Ottolenghi, C., Pelosi, E., Tran. J., et al. (2007). Loss of WNT4 and FOXL2 leads to female-to-male sex reversal extending to germ cells. Human Molecular Genetics, 16(23), 2795-2804.
Prunskaite-Hyyryläinen, R., Skovorodkin, I., Xu, Q., et al. (2016). WNT4 coordinates directional cell migration and extension of the Müllerian duct essential for ontogenesis of the female reproductive tract. Human Molecular Genetics, 25(6).
Rey, R., Josso, N., Racine, C. (2020). Sexual differentiation. In: Endotext. South Dartmouth, MDText, Inc.
Sekido, R., & Lovell-Badge, R. (2009). Sex Determination and SRY: Down to a Wink and a Nudge? Trends in Genetics, 25 (1), 19-29.
Sekido, R., & Lovell-Badge, R. (2008). Sex Determination Involves Synergistic Action of SRY and SF1 on a Specific Sox9 Enhancer. Nature, 453, 930-934.
Uhlenhaut, N., Jakob, S., Anlag, K., Eisenberger, T., Sekido, R., Kress, J., Treier, A., Klugmann, C., Klasen, C., Holter, N., Riethmacher, D., Schütz, G., Cooney, A., Lovell-Badge, R., & Treier, M. (2009). Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2 Ablation. Cell, 139 (6), 1130-1142.
Wagner, P. (2019): Homolgy, Genes, and Evolutionary Innovation. Princeton University Press; Reprint Edition
Warr, N., Greenfield, A. (2012). The molecular and cellular basis of gonadal sex reversal in mice and humans. WIREs Dev Bio, 1.
Wilson, D., Bordoni, B. (2023). Embryology, Mullerian ducts (paramesonephric ducts). In: StatPearls [Internet]. Treasure Island (FL): Stat Pearls Publishing.
Wolpert, L., Tickle, C., & Martinez Arias, A. (2019). Principles of Development (6th ed.). Oxford University Press.
Zhao, F., Franco, H., Rodriguez, K., et al. (2017). Elimination of the male reproductive tract in the female embryo is actively promoted by COUP-TFII. Science, 357(6352), 717-720.
Zhao, F., Yao, H. (2019). A tale of two tracts: history, current advances, and future directions of research on sexual differentiation of reproductive tracts. Biology of Reproduction, 101(3).