Eine Welt ohne Photosynthese
Text als pdf
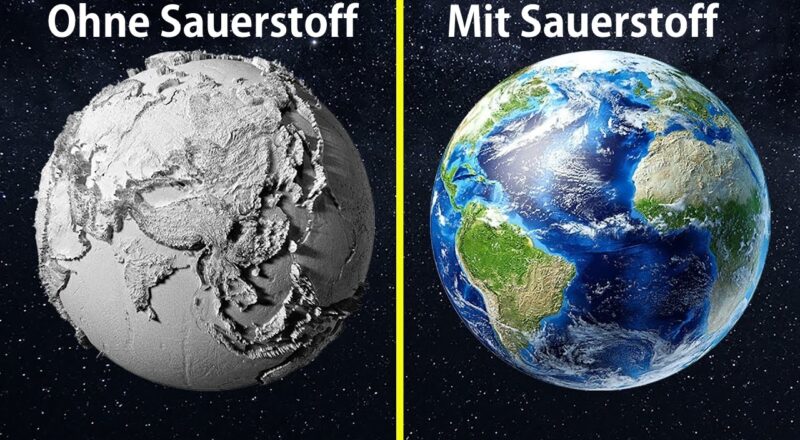
Wie sähe eine Welt ohne Photosynthese aus (Grundlagenliteratur zur Photosynthese, siehe Munk 2008, 2018, Nelson & Cox 2010, Campbell et al. 2016, Kadereit et al. 2021, Madigan et al. 2020, Weiler et al. 2008, Alberts et al. 2024, Savada et al. 2019)? Die Welt wäre erstmal nicht grün. Unser smaragdfarbener Planet spiegelt die Pracht der Pflanzen und Algen wider, und letztlich ihre grünen Pigmente, die das Licht für die Photosynthese absorbieren. An erster Stelle unter den Pigmenten steht das Chlorophyll, der einen Lichtstrahl auffängt und ihn in ein Quantum chemischer Energie umwandelt, das das Leben von Pflanzen und Tieren antreibt.
Die Welt wäre wahrscheinlich auch nicht blau, denn das Azurblau des Himmels und das Meeresblau der Ozeane sind auf einen klaren Himmel und klare Gewässer angewiesen, die durch die reinigende Kraft des Sauerstoffs von Dunst und Staub befreit werden (Abb. 1). Und ohne Photosynthese gäbe es keinen freien Sauerstoff.
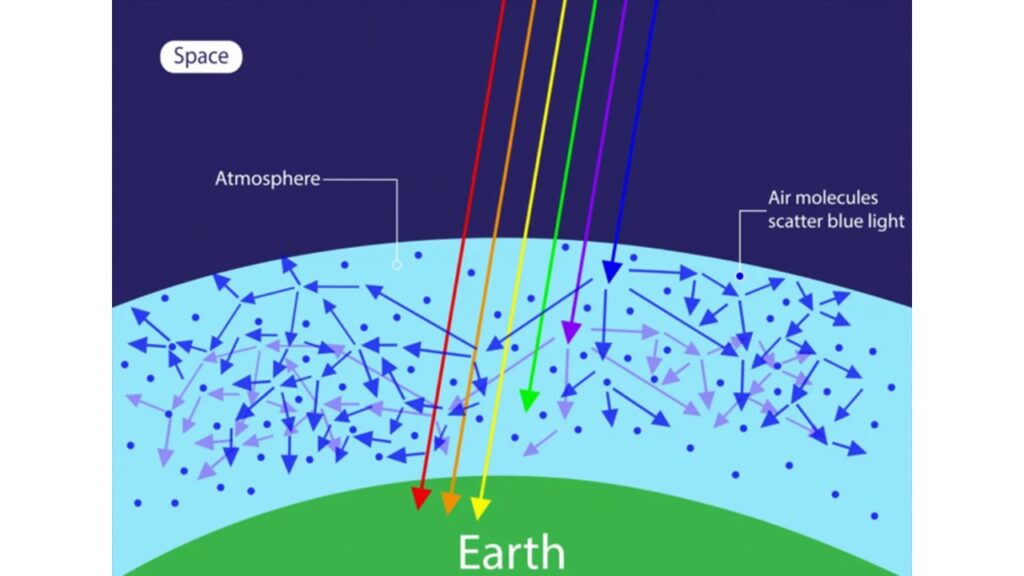
Abb. 1: Zusammenhang zwischen blauem Himmel und dem Sauerstoff in der Atmosphäre
In der Tat gäbe es auch keine Ozeane. Ohne Sauerstoff gibt es kein Ozon, und ohne Ozon gibt es kaum etwas, das die sengende Intensität der ultravioletten Strahlen abschwächt. Diese UV-Strahlen spalten Wasser in Sauerstoff und Wasserstoff auf. Der Sauerstoff wird langsam gebildet und reichert sich nicht in der Luft an; stattdessen reagiert er mit dem Eisen in den Felsen und färbt sie rostrot. Und Wasserstoff, das leichteste aller Gase, entzieht sich der Schwerkraft und entgleitet ins All. Der Prozess ist zwar langsam, aber auch unaufhaltsam: Die Ozeane bluten ins All aus. Ultraviolette Strahlung hat der Venus und wohl auch dem Mars ihre Ozeane gekostet.
Wir brauchen also nicht viel Phantasie, um uns eine Welt ohne Photosynthese vorzustellen: Sie würde dem Mars sehr ähnlichsehen, ein roter, staubiger Ort ohne Ozeane und ohne offensichtliche Anzeichen von Leben. Natürlich gibt es Leben ohne Photosynthese, und viele Astrobiologen suchen es auf dem Mars. Aber selbst wenn sich ein paar Bakterien unter der Oberfläche verstecken oder in einer Eiskappe begraben sind, ist der Planet selbst tot. Er befindet sich in einem nahezu perfekten Gleichgewicht, ein sicheres Zeichen für Trägheit. Sauerstoff ist der Schlüssel zum Leben auf dem Planeten.
Sauerstoff ist nicht mehr als ein Abfallprodukt der Photosynthese, sondern das Molekül, das die Welt ausmacht. Er wird durch die Photosynthese so schnell freigesetzt, dass er schließlich die Kapazität eines Planeten übersteigt, ihn zu verschlucken. Am Ende werden der gesamte Staub und das Eisen in den Gesteinen, der Schwefel in den Meeren und das Methan in der Luft, alles, was oxidiert werden kann, oxidiert, und freier Sauerstoff strömt in die Luft und die Ozeane. Dort angekommen, stoppt der Sauerstoff den Verlust von Wasser auf dem Planeten. Wasserstoff, der aus dem Wasser freigesetzt wird, stößt unweigerlich auf weiteren Sauerstoff, bevor er seinen Weg ins Weltall findet. Er reagiert schnell und bildet wieder Wasser, das nun vom Himmel regnet und den Verlust der Ozeane stoppt. Und wenn sich der Sauerstoff in der Luft anreichert, bildet sich ein Ozonschild, der die sengende Intensität der ultravioletten Strahlen abschwächt und die Welt zu einem bewohnbaren Ort macht.
Sauerstoff rettet nicht nur das Leben auf einem Planeten: Er verleiht allem Leben Energie und macht es groß. Viele Bakterienarten kommen auch ohne Sauerstoff aus: Sie verfügen über eine beispiellose Fähigkeit in der Elektrochemie, sie sind in der Lage, praktisch alle Moleküle miteinander zu verbinden, um ein wenig Energie zu gewinnen. Aber die Gesamtenergie, die aus der Gärung oder aus der Reaktion zweier Moleküle wie Methan und Sulfat gewonnen werden kann, ist vernachlässigbar im Vergleich zur Leistung der Sauerstoffatmung – der buchstäblichen Verbrennung der Nahrung mit Sauerstoff, wobei diese vollständig zu Kohlendioxid und Wasserdampf oxidiert wird. Nichts anderes kann die Energie liefern, die für den Bedarf des vielzelligen Lebens erforderlich ist. Die meisten mehrzelligen Lebewesen sind zumindest für einen Teil ihres Lebenszyklus auf Sauerstoff angewiesen. Eine Welt ohne freien Sauerstoff ist also mikroskopisch klein, zumindest auf der Ebene der einzelnen Organismen. Sauerstoff trägt auch auf andere Weise zur Größe bei. Denkt an eine Nahrungskette (Abb. 2). Große Raubtiere fressen die Pflanzenfresser, die Pflanzenfresser die Pflanzen. Dazu kommen Aasfresser usw. Fünf oder sechs Stufen in einem Nahrungsnetz sind keine Seltenheit. Auf jeder Stufe wird Energie verschwendet, denn keine Form der Atmung ist jemals zu 100 Prozent effizient. Die Sauerstoffatmung hat einen Wirkungsgrad von etwa 40 %, während die meisten anderen Formen der Atmung (z. B. mit Eisen oder Schwefel anstelle von Sauerstoff) einen Wirkungsgrad von weniger als 10 % haben. Das bedeutet, dass die verfügbare Energie ohne Sauerstoff in nur zwei Stufen auf 1 % des ursprünglichen Inputs schrumpft, während mit Sauerstoff sechs Stufen erforderlich sind, um den gleichen Punkt zu erreichen. Das wiederum bedeutet, dass lange Nahrungsketten nur mit Sauerstoffatmung möglich sind. Die Ökonomie der Nahrungskette bedeutet, dass Raubtiere in einer sauerstoffreichen Welt operieren können, aber Raubtiere als Lebensstil lohnen sich ohne Sauerstoff einfach nicht. Raubtiere werden natürlich immer größer, was zu einem Wettrüsten zwischen Raubtier und Beute führt. Schalen bekämpfen Zähne, Tarnung täuscht das Auge, und die Größe schüchtert Jäger und Gejagte ein. Sauerstoff macht also große Organismen nicht nur möglich, sondern auch wahrscheinlich.
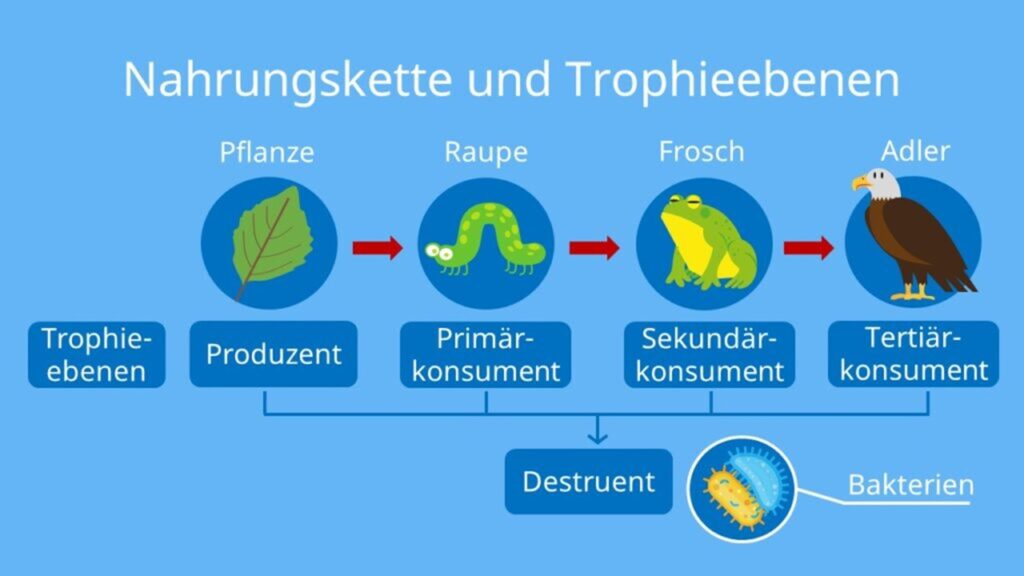
Abb. 2: Die Anwesenheit von Sauerstoff ermöglicht komplexere Nahrungsketten
Er hilft auch, sie zu bauen. Das Protein, das Tieren ihre Zugfestigkeit verleiht, ist Kollagen (Grundlagenliteratur zu Kollagen und dem Gewebesystem bei Tieren, siehe Hickmann 2008, Munk 2010, Wehner & Gehring 2018, sowie die Zoologie-Teile bei Campbell et al. 2016, Savada et al. 2016, Abb. 3). Es ist das Hauptprotein aller Bindegewebe, ob verkalkt in Knochen, Zähnen und Schalen oder “nackt” in Bändern, Sehnen, Knorpeln und Haut. Kollagen macht bei Säugetieren bemerkenswerte 25 % des gesamten Körperproteins aus. Kollagen besteht aus einigen ungewöhnlichen Bausteinen, die freien Sauerstoff benötigen, um Vernetzungen zwischen benachbarten Proteinfasern zu bilden, was der Gesamtstruktur eine hohe Zugfestigkeit verleiht. Der Bedarf an freiem Sauerstoff bedeutet, dass sich große Tiere, die mit Schalen oder Skeletten geschützt sind, nur entwickeln konnten, wenn der Sauerstoffgehalt der Atmosphäre hoch genug war, um die Kollagenproduktion zu unterstützen – ein Faktor, der zum abrupten Auftauchen großer Tiere im Fossilbericht zu Beginn der kambrischen Periode vor etwa 550 Millionen Jahren beigetragen haben könnte, kurz nach einem starken globalen Anstieg des atmosphärischen Sauerstoffs.
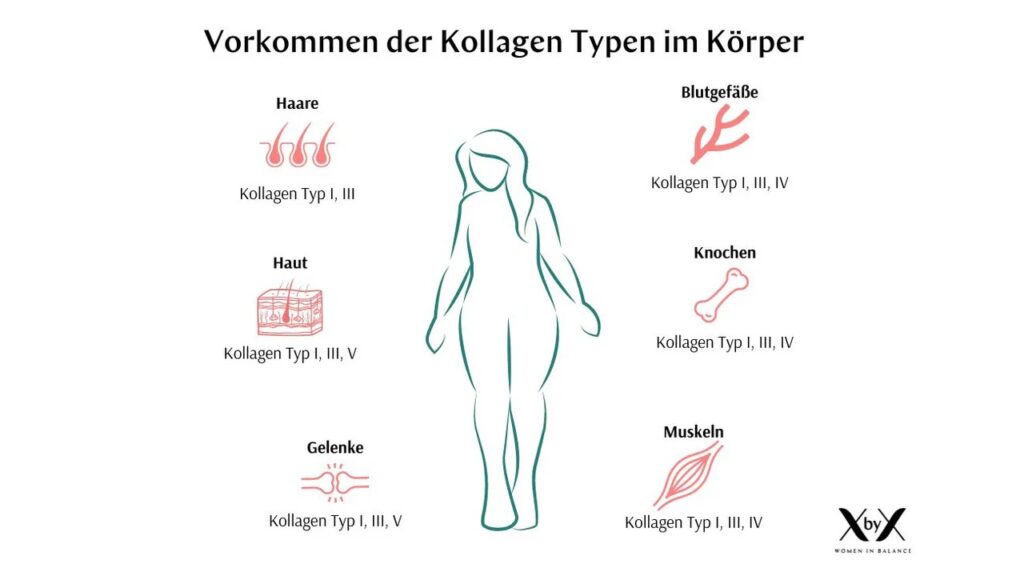
Abb. 3: Kollagen
Auch Pflanzen brauchen Sauerstoff, um ihre strukturelle Stütze zu bilden, und zwar in Form des immens starken Polymers Lignin, das dem Holz seine flexible Stärke verleiht (Abb. 4). Lignin entsteht auf chemisch zufällige Weise, indem freier Sauerstoff zur Bildung starker Vernetzungen zwischen den Ketten verwendet wird. Diese lassen sich nur sehr schwer abbauen, weshalb Holz so stark ist und es so lange dauert, bis es verrottet (siehe über den Grundaufbau der Pflanzengewebe die entsprechenden Kapitel in Kadereit et al. 2021).
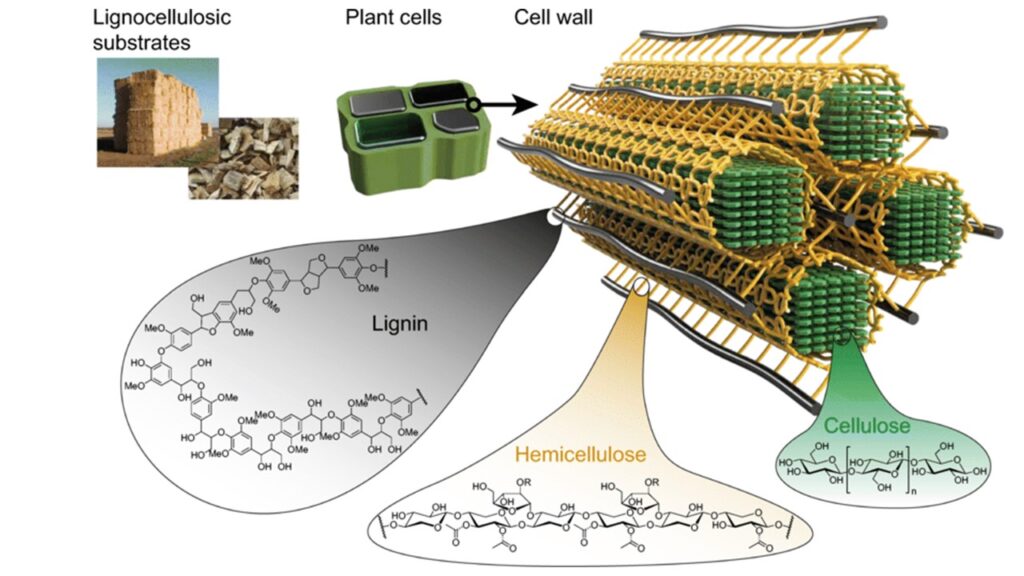
Abb. 4: Lignin
Ohne Sauerstoff gäbe es also keine großen Tiere oder Pflanzen, keine komplexen Nahrungsketten, keinen blauen Himmel, vielleicht keine Ozeane, wahrscheinlich nichts als Staub und Bakterien. Sauerstoff ist zweifelsohne der wertvollste Abfall, den man sich vorstellen kann. Doch er ist nicht nur ein Abfallprodukt, sondern auch ein unwahrscheinliches.
Heterotrophie und Autotrophie
Lebewesen verbrauchen Energie. Ein Großteil der Biologie besteht aus der Untersuchung des Stoffwechsels, also wie Lebewesen die Energie gewinnen und diese für ihr Wachstum und Fortpflanzung nutzen.
Dabei gibt es zwei Wege den Stoffwechsel zu betreiben, die man als Autotrophie und Heterotrophie bezeichnet (die Grundlagen der Stoffwechselbiologie können für ein vertieftes Studium, wie im vorherigen Kapitel ebenfalls in den Standardlehrbüchern entnommen werden, siehe Munk 2008, 2010, 2018, Nelson & Cox 2010, Campbell et al. 2016, Kadereit et al. 2021, Madigan et al. 2020, Weiler et al. 2008, Alberts et al. 2024, Savada et al. 2019, Hickmann 2008 Wehner & Gehring 2018).
Wenn für den Metabolismus vorhandene organische Substanzen umgesetzt werden, spricht man von Heterotrophie. Voraussetzung dafür ist, dass bereits ausreichend organisches Material gebildet wurde. Generell wird hier zwischen aerober und anaerober Heterotrophie unterschieden, also ob freier Sauerstoff an der Reaktion beteiligt ist oder nicht.
Die aerobe Heterotrophie braucht freien Sauerstoff für den oxidativen Stoffwechsel. Viele Bakterien und alle Eukaryota und damit auch alle Tiere und Pflanzen nutzen diesen Stoffwechselweg. Generell wird hier auch von der Zellatmung gesprochen. Bei der anaeroben Heterotrophie, auch anaerobe Atmung genannt, nutzen viele Eubakterien in Abwesenheit von freiem Sauerstoff andere Verbindungen zur Oxidation, die dabei reduziert werden. So gibt es die Nitrat-, Eisen- und Sulfatatmung, bei dem diese Elemente, statt des Sauerstoffs die Elektronen aufnehmen. All diese heterotrophen Stoffwechselreaktionen sind relativ komplex und dürften später in der Evolution entstanden sein.
Die einfachste Form der Heterotrophie dürfte die Gärung sein. Bei der Gärung wird eine organische Verbindung in ein reduziertes und ein oxidiertes Bruchstück gespalten und dabei Energie erzeugt. Anders als bei der aeroben oder anerorben Heterotrophie wird kein externer Elektronenakzeptor wie Sauerstoff (O2) oder Nitrat (NO3−) genutzt. Bekannte Formen der Gärung sind die alkoholische und Milchsäuregärung. Die Gärung galt lange als mögliche „Ernährung aus der Ursuppe“. Es ist allerdings umstritten, ob die Konzentration der organischen Substanzen im Ozean ausreichend hoch für solche Reaktionen war.
Bei der Autotrophie (Primärproduktion) werden anorganische Ausgangsstoffe für den Metabolismus verwendet. Zur Autotrophie gehört die Chemolithoautotrophie, bei der es ebenfalls eine anoxische und eine oxische Variante gibt. Die anoxische Chemolithoautotrophie nutzt anorganische Ausgangsstoffe für einfache Reaktionen. Hierzu gehören vor allem die Schwefelreduktion (S + H2 → H2S) und die Methanogenese (CO2 + 4H2 → CH4 + 2H2O). Diese Stoffwechsel sind vermutlich sehr ursprünglich, möglicherweise stehen sie am Beginn der Entwicklung.
Die oxische Chemolithoautotrophie benötigt ausreichend freien Sauerstoff, durch den Methan (Methanotrophie: CH4 + 2O2 → 2H2O + CO2 + E) oder Schwefelwasserstoff (Sulfidoxidation: H2S + O2 → 2H2O + S2 + E) oxidiert werden. Ähnliche Reaktionen gibt es auch mit Amonium (NH4+), Nitrit (NO2–), Schwefel und Wasserstoff, die vermutlich alle wegen des benötigten Sauerstoffs erst deutlich später in der Erdgeschichte aufgetreten sind.
Zur Autotrophie gehört natürlich auch die Photosynthese. Und auch hier gibt es eine oxische und anoxische Variante (Abb.5). Das ist insofern bemerkenswert, weil wir vorhin und auch später noch die Bedeutung des Sauerstoffs für die Erdgeschichte und das Leben angerissen haben. Doch die oxygene Photosynthese ist eine recht späte Entwicklung der Evolution, genauso wie die aerobe Zellatmung, die wir betreiben. Dennoch sind diese beiden Stoffwechselwege die heute dominierenden im Stammbaum des Lebens.
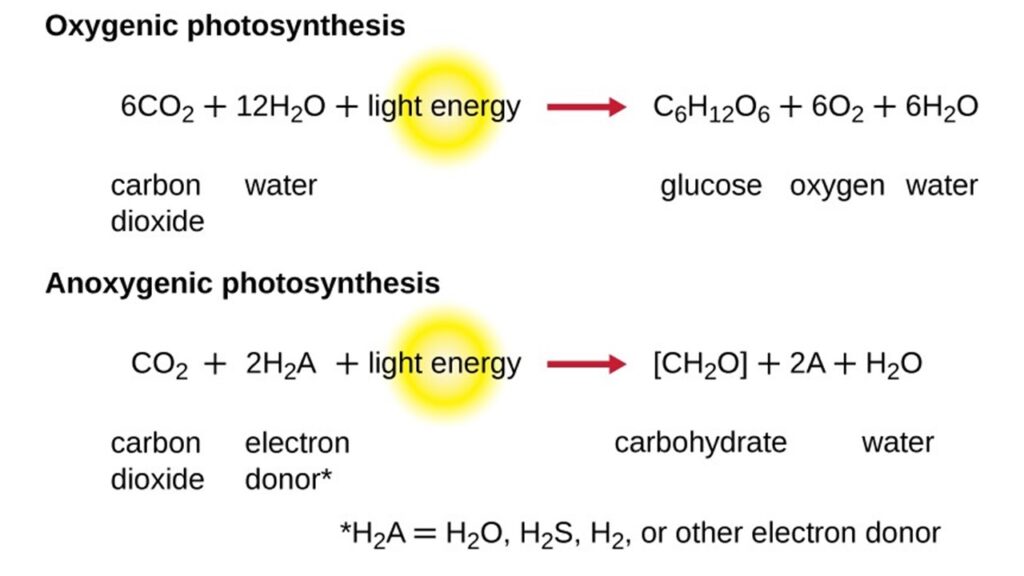
Abb. 5: oxische und anoxische Photosynthese
Die anoxische Photosynthese wird übrigens überwiegend von grünen Schwefelbakterien (Chlorobiaceen) und Purpurbakterien betrieben (Bryant & Frigaard 2006, Bryant et al. 2007, Blankenship et al. 2007, Hamilton 2019, Xiong 2006, He et al. 2019, Zeng et al. 2014). Sie verwenden CO2 und Schwefelwasserstoff, um organische Moleküle aufzubauen, dabei entsteht statt des „Abfallprodukts“ Sauerstoff elementarer Schwefel (CO2 + 2 H2S + Licht → CH2O + H2O + 2S). Wenn uns diese Rohstoffe unglaubwürdig erscheinen, liegt das nur daran, dass wir uns so sehr an unsere sauerstoffreiche Welt – das Produkt der oxischen Photosynthese – gewöhnt haben, dass wir uns nur schwer vorstellen können, wie die Bedingungen auf der frühen Erde waren, als sich die Photosynthese entwickelte.
Nach molekulargenetischen Untersuchungen sind Archaea die ursprünglichsten heute noch existierenden Organismen. Ihre Stoffwechselreaktionen sind einfach und meist obligatorisch anaerob. Schwefelreduktion, Methanogenese und diverse Fermentationsreaktionen sind vermutlich die ältesten Stoffwechselwege, die möglicherweise weiter als 4 Mrd. Jahre zurückgehen (Baldauf et al. 1996, Brown & Doolittle 1995, 1997, Camprubi et al. 2019, Doolittle 2000a, b, Hansmann & Martin 2000, Koonin 2003, Lane et al. 2010, Martin & Russel 2007, Martin & Sousa 2016, Martin et al. 2014, Russel & Martin 2004, Sousa et al. 2016, Woese 1998, 2000). Es ist aber zweifelhaft, ob dabei große Stoffmengen umgesetzt wurden. Vermutlich waren diese Stoffwechsel an hydrothermale Systeme gebunden. Auch die anoxische Photosynthese dürfte sehr alt sein, möglicherweise ebenfalls über 4 Mia. Jahre. Sie ist im ganzen von Licht beschienenen Oberflächenbereich der Ozeane möglich, was zu einem enormen Anstieg des Stoffumsatzes geführt haben dürfte. Erst in der Folgezeit konnten sich auch heterotrophe Stoffwechsel global ausbreiten. Wann die oxische Photosynthese einsetzte, ist unklar. Da es aber bereits vor 3,6 Mrd. Jahren gebänderte Eisenerze mit Fe3+-oxiden gab (Abb. 6), muss zu dieser Zeit, zumindest in lokalen Milieus bereits freier Sauerstoff in geringen Mengen verfügbar gewesen sein (Trandall 2002, 2005, Katsuta et al. 2012, Blockley 2004, Gole et al. 1981, Klein 2005). Die jüngste Entwicklungsstufe stellt die aerobe Heterotrophie dar.

Abb. 6: Banded Iron Formations (BIF)
Atmung und Photosynthese
Im Grunde genommen ist die aerobe Zellatmung die Umkehrung der oxischen Photosynthese (Abb. 7). Zur Einfachheit: Wenn nicht anders erwähnt werde ich bei der Photosynthese immer die oxische, sauerstoffproduzierende, Variante meinen. Wenn die anoxische angesprochen wird, wird dies extra erwähnt. Dasselbe trifft auf die Zellatmung (Heterotrophie) zu.
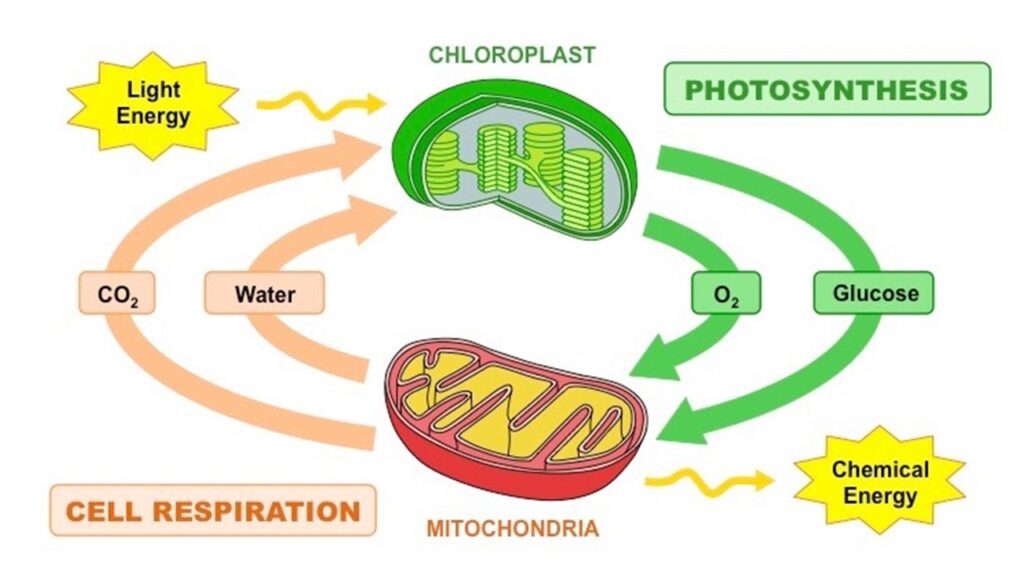
Abb. 7: Zusammenhang zwischen Atmung und Photosynthese
Photosynthese und Atmung sind gleichwertige und entgegengesetzte Prozesse. Kurz gesagt: Bei der Photosynthese werden aus zwei einfachen Molekülen, Kohlendioxid und Wasser, organische Moleküle hergestellt, wobei das Sonnenlicht die benötigte Energie liefert. Die Atmung bewirkt genau das Gegenteil. Wenn wir organische Moleküle verbrennen, setzen wir Kohlendioxid und Wasser wieder in die Luft frei, und die freigesetzte Energie treibt unser Leben an. Photosynthese und Atmung stehen sich nicht nur in den Details ihrer Chemie gegenüber, sondern auch in der Gesamtrechnung. Gäbe es keine Atmung – keine Tiere, Pilze und Bakterien, die pflanzliche Nahrung verbrennen -, wäre das gesamte Kohlendioxid schon längst aus der Atmosphäre gesaugt und in Biomasse umgewandelt worden. Dann würde alles mehr oder weniger zum Stillstand kommen, abgesehen von dem Rinnsal an Kohlendioxid, das durch langsamen Zerfall oder Vulkane freigesetzt wird. Was aber wirklich passiert, ist, dass die Atmung alle organischen Moleküle verbrennt, die von den Pflanzen eingelagert werden: In einem geologischen Zeitrahmen verschwinden die Pflanzen in einer Rauchwolke. Das hat eine tiefgreifende Konsequenz. Der gesamte Sauerstoff, der der Luft durch die Photosynthese zugeführt wird, wird durch die Atmung wieder entzogen. Es herrscht ein langfristiges, unveränderliches, nie endendes Gleichgewicht, das für jeden Planeten den Todesstoß bedeutet. Die einzige Möglichkeit für einen Planeten, eine Sauerstoffatmosphäre zu erhalten besteht darin, ein wenig Pflanzenmaterial intakt zu halten, das immun ist gegen die Elemente und gegen den Einfallsreichtum des Lebens, Wege zu finden, es zur Energiegewinnung abzubauen. Es muss begraben werden. Und so ist es auch. Konserviertes Pflanzenmaterial ist in Form von Kohle, Erdöl, Erdgas, Ruß, Holzkohle oder Staub in Gesteinen tief im Inneren der Erde vergraben. Nach Angaben des bahnbrechenden Geochemikers Robert Berner ist in der Erdkruste etwa 26.000 Mal mehr “toter” organischer Kohlenstoff eingeschlossen als in der gesamten lebenden Biosphäre. Jedes Kohlenstoffatom ist das Gegenstück zu einem Sauerstoffmolekül in der Luft. Für jedes Kohlenstoffatom, das wir ausgraben und als fossilen Brennstoff verbrennen, wird der Luft ein Sauerstoffmolekül entzogen und wieder in Kohlendioxid umgewandelt, mit schwerwiegenden Folgen für das Klima. Glücklicherweise werden wir durch die Verbrennung fossiler Brennstoffe niemals den Sauerstoffvorrat der Welt aufbrauchen, auch wenn wir das Klima schädigen: Der überwiegende Teil des organischen Kohlenstoffs ist als mikroskopisch kleiner Detritus in Gesteinen wie Schiefer vergraben und für die menschliche Industrie oder zumindest die Wirtschaftsindustrie unzugänglich. Bislang haben wir trotz unserer vergeblichen Bemühungen, alle bekannten Reserven an fossilen Brennstoffen zu verbrennen, den Sauerstoffgehalt der Luft nur um etwa 0,001 Prozent gesenkt (zum Kohlenstoffkreislauf siehe Royer et al. 2004, Berner 2001, 2003, 2004 Berner et al. 2003, Berner & Canfield 1989, Garrels et al. 1976, Walker 1986, Lenton & Watson 2000, Oschmann 2016).
Dieses riesige Reservoir an vergrabenem organischem Kohlenstoff bildet sich jedoch nicht kontinuierlich, sondern wurde im Laufe der geologischen Äonen in Schüben vergraben. In der Regel herrscht nahezu ein exaktes Gleichgewicht, bei dem die Atmung die Photosynthese ausgleicht. Aus diesem Grund blieb der Sauerstoffgehalt über viele Millionen Jahre hinweg bei etwa 21 %. In der tiefen geologischen Vergangenheit waren die Dinge jedoch in seltenen Fällen ganz anders. Das vielleicht eindrucksvollste Beispiel ist die Karbonzeit vor 300 Millionen Jahren, als Libellen von der Größe einer Möwe durch die Luft flatterten und meterlange Tausendfüßler durch das Unterholz krabbelten (siehe Dudley 1998, Abb. 8). Diese Giganten verdankten ihre Existenz der außergewöhnlichen Geschwindigkeit der Kohlenstoffeinlagerung im Karbon, dessen riesige Kohlevorkommen dieser Epoche ihren Namen gaben. Als der Kohlenstoff unter den Kohlesümpfen begraben wurde, stieg der Sauerstoffgehalt auf über 30 Prozent, was einigen Lebewesen die Möglichkeit gab, weit über ihre normale Größe hinauszuwachsen – insbesondere Tieren, die auf die passive Diffusion von Gasen durch Röhren oder über die Haut angewiesen sind, wie Insekten, und nicht auf die aktive Belüftung durch Lungen (Dudley 1998, Garwood & Edgecombe 2011, Garwood et al. 2009, Garwood & Mark 2010).

Abb. 8: Lebensbild aus dem Karbon
Was war der Grund für die beispiellose Geschwindigkeit der Kohlenstoffvergrabung im Karbon? Mit ziemlicher Sicherheit eine Reihe von zufälligen Faktoren. Die Ausrichtung der Kontinente, das feuchte Klima, die großen Überschwemmungsgebiete und – vielleicht am wichtigsten – die Entwicklung von Lignin, das große Bäume und robuste Pflanzen hervorbrachte, die in der Lage waren, große Gebiete der Landmasse zu besiedeln (Floudas et al. 2012). Lignin, das auch heute noch für Pilze und Bakterien schwer abbaubar ist, scheint schon bald nach seiner Entstehung eine unüberwindbare Herausforderung gewesen zu sein. Anstatt zur Energiegewinnung abgebaut zu werden, wurde es großflächig verschüttet, und sein Gegenspieler, der Sauerstoff, überschwemmte die Luft (zum Karbon siehe folgende Literatur: McGhee 2018, Oschmann 2016, 2018, Benton et al. 2020, Prothero 2021, Prothero & Dott 2004, Beerling 2007, Abb. 9).
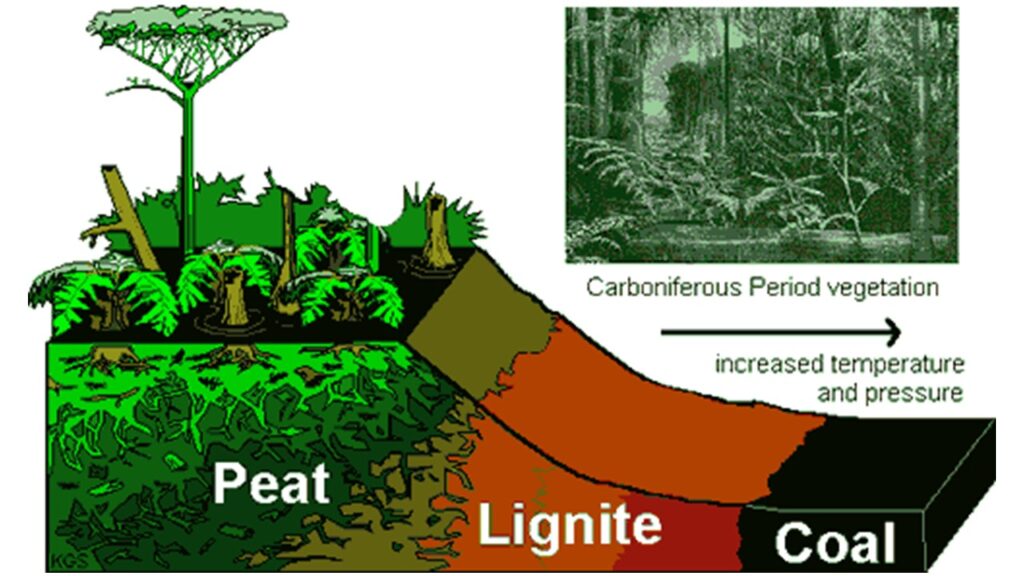
Abb. 9: Entstehung von Kohle
Geologische Zufälle trugen bei zwei weiteren Gelegenheiten dazu bei, den Sauerstoffgehalt in die Höhe zu treiben, beide vielleicht als Ergebnis globaler Vergletscherungen, die als “Schneeball-Erden” bezeichnet werden (Abb. 10). Der erste große Anstieg des Sauerstoffgehalts vor etwa 2,2 Milliarden Jahren folgte unmittelbar auf eine Periode geologischer Umwälzungen und globaler Vergletscherung zu dieser Zeit; und eine zweite Periode globaler Vergletscherung vor etwa 800 bis 600 Millionen Jahren scheint den Sauerstoffgehalt ebenfalls in die Höhe getrieben zu haben (Abb. 10). Diese katastrophalen globalen Ereignisse veränderten wahrscheinlich das Gleichgewicht zwischen Photosynthese und Atmung sowie zwischen Verschüttung und Erosion. Als die großen Gletscher schmolzen und die Regenfälle einsetzten, wurden Mineralien und Nährstoffe (Eisen, Nitrate und Phosphate), die das Eis von den Felsen gespült hatte, in die Ozeane gespült und lösten eine große Blüte von photosynthetischen Algen und Bakterien aus, die der heutigen durch Düngemittel verursachten Blüte ähnelte, aber weitaus größer war. Ein solcher Abfluss würde nicht nur eine Blüte auslösen, sondern sie auch tendenziell begraben: Der Staub, das schmutzige Eis und der Kies, die in die Ozeane gespült wurden, vermischten sich mit den blühenden Bakterien und setzten sich ab, wodurch Kohlenstoff in einem noch nie dagewesenen Ausmaß begraben wurde. Damit einher ging ein dauerhafter globaler Anstieg des Sauerstoffgehalts (Literatur zur Schneeballerde siehe: Oschmann 2016, Prothero 2021, Prothero & Dott 2004, Benton et al. 2020, Tziperman et al. 2011, Etienne et al. 2007, Micheels & Montenari 2008, Tang & Chen 2013, Evans et al. 1997, Kopp et al. 2005, Young et al. 2001, Schmidt & Williams 2003).
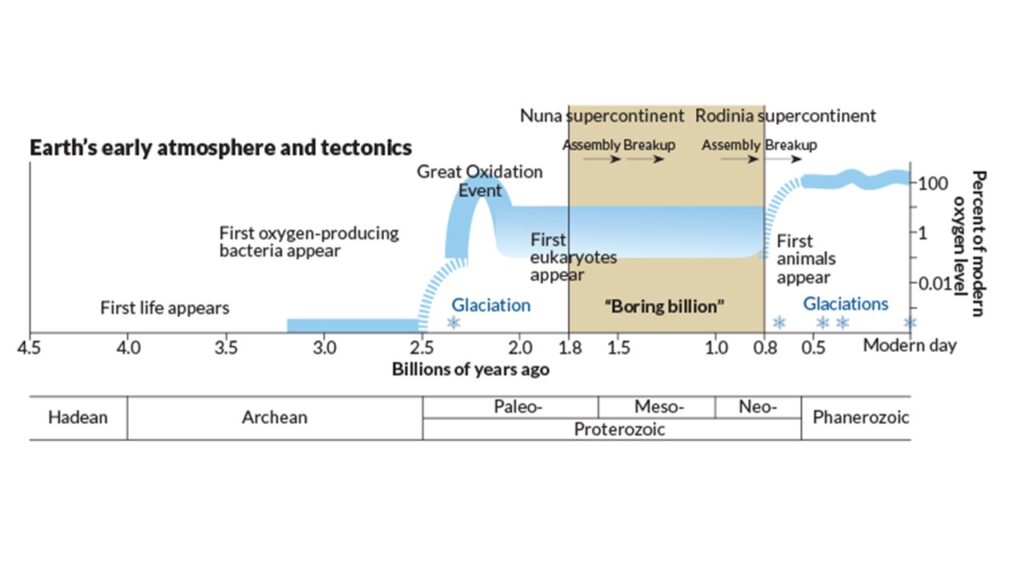
Abb. 10: Die Konzentration des Sauerstoffs in der Atmosphäre im Verlauf der Erdgeschichte
Die Sauerstoffanreicherung unseres Planeten hat also etwas Zufälliges an sich. Dieses Gefühl wird noch dadurch verstärkt, dass es über lange Zeiträume hinweg keine Veränderungen gab. Von vor zwei bis vor etwa einer Milliarden Jahren – ein Zeitraum, den Geologen als „langweilige Milliarde“ bezeichnen – scheint fast nichts Bemerkenswertes passiert zu sein (Abb. 10). Der Sauerstoffgehalt blieb während dieses Zeitraums konstant und niedrig, wie auch zu anderen Zeiten über Hunderte von Millionen Jahren hinweg (Zur langweiligen Milliarde siehe: Oschmann 2016, Prothero 2021, Prothero & Dott 2004, Benton et al. 2020, Mukherjee et al. 2018, Young 2013, Cawood & Hawkesworth 2014, Roberts 2013). Stillstand ist der Standard, während Episoden geologischer Unruhe dauerhafte Veränderungen bewirken. Solche geologischen Faktoren könnten auch auf anderen Planeten eine Rolle spielen, aber tektonische Bewegungen und aktiver Vulkanismus scheinen notwendig zu sein, um die zufälligen Konjugationen herbeizuführen, die für die Ansammlung von Sauerstoff erforderlich sind. Es ist nicht ausgeschlossen, dass sich die Photosynthese vor langer Zeit auch auf dem Mars entwickelt haben könnte, dass aber dieser kleine Planet mit seinem schrumpfenden vulkanischen Kern den geologischen Fluss nicht aufrechterhalten konnte, der für die Anhäufung von Sauerstoff erforderlich war, und dass er später im planetarischen Maßstab erlosch.
Es wurde erwähnt, dass komplexes Leben ohne Sauerstoff nicht möglich sei. Das ist insofern richtig. Das Paradoxe: wir haben gelernt, dass die oxische Photosynthese und damit auch die aerobe Zellatmung recht spät in der Evolutionsgeschichte auftauchten. Frühestes Leben existierte ohne Sauerstoff. Als sich die oxische Photosynthese entwickelte, trat der Sauerstoff in die Atmosphäre ein, zum Great Oxidation Event. Dieses führte tatsächlich zum ersten Massenaussterben in der Erdgeschichte – eines welches gerne ignoriert wird und nicht zu den fünf großen Massenaussterbeereignissen gezählt wird. Das Auftauchen eines reaktiven Moleküls wie O2 war für das bisherige Leben, das an anoxische Bedingungen gewöhnt war, giftig. Heute müssen diese Bakterien, die an sauerstoffarme Bedingungen angepasst sind, an sauerstoffarmen Orten wie den Böden von stehenden Seen und Meeresbecken leben. Vor 2,3 Mrd. Jahren beherrschten sie jedoch den Planeten. Erst als einige Bakterien die Fahrigkeit hatten den Sauerstoff als Elektronenakzeptor zu nutzen, um daraus harmloses Wasser zu bilden und diese Bakterien zu den Mitochondrien der eukaryotischen (und damit unserer) Zellen wurde, konnte sich das Leben die Sauerstoffkrise für sich gewinnbringend nutzen. Das ist vielleicht die größte Ironie der Geschichte: Sauerstoff, dieses Abfallprodukt der Photosynthese, welches unser Leben heute ermöglicht war gleichzeitig auch der erste Killer des Lebens (Literatur zum Great Oxidation Event siehe: Oschmann 2016, Prothero 2021, Prothero & Dott 2004, Benton et al. 2020, Buik 2001, 2008, Olson 2006, Holland 2006, Lyons et al. 2014, Gumsley et al. 2017, Wiechert 2002, Trendall 2002) .
Wie funktioniert die oxische Photosynthese
Bezüglich der Photosynthese gibt es oft zwei Fehlinterpretationen. Zum einen wird oft erwähnt, dass der freie Sauerstoff dem CO2 entzogen wird, zum anderen, dass das CO2 vom Licht aktiviert wird und der Kohlenstoff in Zucker umgewandelt wird. Beides trifft jedoch nicht zu.
Sonnenlicht aktiviert das Kohlendioxid nicht: Es kann genauso gut mitten in der Nacht aktiviert werden, und es wird in der Tat niemals durch Licht aktiviert, nicht einmal im hellsten Sonnenschein. Auch wird der Kohlenstoff nicht von seinem Sauerstoff getrennt. Der Sauerstoff bleibt hartnäckig an seinen Kohlenstoff gebunden. Der freie Sauerstoff stammt nicht vom CO2, sondern vom Wasser. Und das macht den entscheidenden Unterschied aus. Es ist der erste Schritt, um zu verstehen, wie sich die Photosynthese entwickelt hat (Abb. 11).
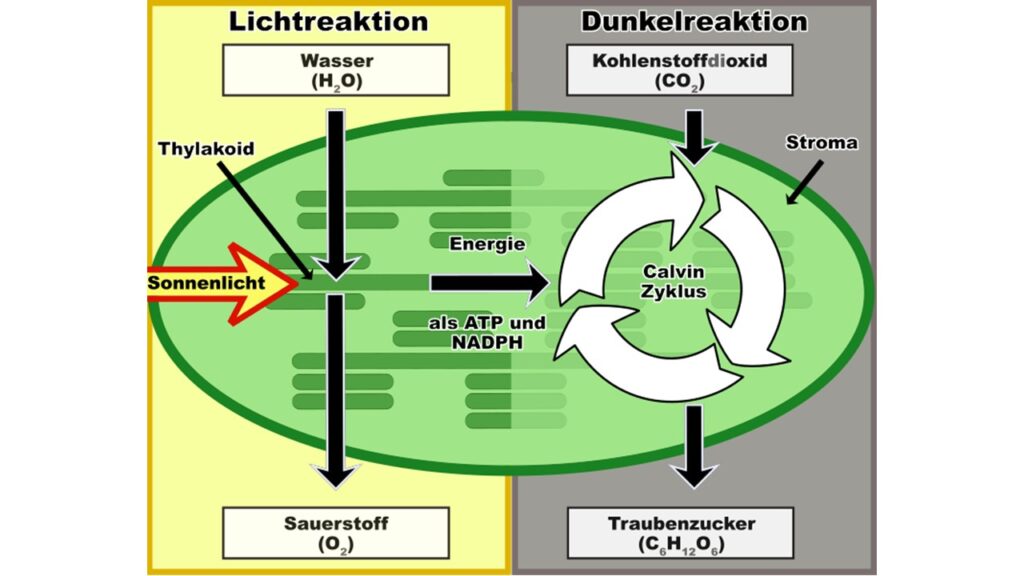
Abb. 11: Lichtreaktion und Dunkelreaktion
Die bei der Photosynthese verwendeten Sonnenenergiepakete spalten Wasser in Wasserstoff und Sauerstoff auf. Was die Photosynthese erreicht – und was wir bisher nicht geschafft haben – ist, einen Katalysator zu entwickeln, der den Wasserstoff mit minimalem Energieaufwand aus dem Wasser herauslösen kann, und zwar mit sanftem Sonnenlicht und nicht mit sengender ultravioletter oder kosmischer Strahlung. Bislang verbraucht der menschliche Erfindungsreichtum bei der Spaltung von Wasser mehr Energie, als durch die Spaltung gewonnen wird. Wenn es uns gelingt, die Photosynthese mit einem einfachen Katalysator nachzuahmen, der auf sanfte Weise Wasserstoffatome aus dem Wasser spaltet, dann haben wir die Energiekrise der Welt gelöst. Die Verbrennung dieses Wasserstoffs würde bequem den gesamten Energiebedarf der Welt decken und als einzigen Abfall Wasser regenerieren: keine Umweltverschmutzung, kein Kohlenstoff-Fußabdruck, keine globale Erwärmung. Doch das ist keine leichte Aufgabe, denn Wasser ist eine erstaunlich stabile Kombination von Atomen, wie die Ozeane beweisen; selbst die heftigsten Stürme, die an den Klippen zerschellen, zerlegen das Wasser nicht in seine einzelnen Atome. Wasser ist der am weitesten verbreitete und zugleich unerreichbarste Rohstoff auf unserem Planeten.
Vor dem gleichen Problem standen natürlich auch die entfernten Vorfahren der heutigen Cyanobakterien, der einzigen Lebensform auf unserem Planeten, die den Trick der Wasserspaltung für sich entdeckt hat. Das Seltsame ist, dass Cyanobakterien Wasser aus genau demselben Grund spalten, wie ihre bakteriellen Verwandten Schwefelwasserstoff spalten oder Eisen oxidieren: Sie wollen die Elektronen. Und auf den ersten Blick ist Wasser der letzte Ort, an dem sie diese finden. Die Photosynthese ist konzeptionell einfach: Es geht nur um Elektronen. Fügt man dem Kohlendioxid ein paar Elektronen hinzu, zusammen mit ein paar Protonen, um die Ladungen auszugleichen hat man den Zucker. Aber woher kommen die Elektronen? Mit ein wenig Energie von der Sonne können sie mehr oder weniger überall herkommen. Bei der bekannten “sauerstoffhaltigen” Form der Photosynthese stammen sie aus dem Wasser, aber eigentlich ist es viel einfacher, sie aus anderen Verbindungen zu gewinnen, die weniger stabil sind als Wasser. Wenn man dem Schwefelwasserstoff Elektronen entzieht, wird kein Sauerstoff an die Luft abgegeben, sondern elementarer Schwefel. Nimmt man sie aus dem in den Ozeanen gelösten Eisen (als Eisen(II)), erhält man rostrotes Eisen(III), das sich als neues Gestein ablagert – ein Prozess, der einst für die riesigen “gebänderten Eisenformationen” auf der ganzen Welt verantwortlich gewesen sein könnte und heute die größten verbleibenden Reserven an geringwertigem Eisenerz darstellt (Hamilton 2019, Xiong 2006, He et al. 2019, Zeng et al. 2014, Griffin et al. 2007, Blankenship et al. 2006).
Diese Formen der Photosynthese sind in der heutigen sauerstoffreichen Welt nur noch von untergeordneter Bedeutung, weil die Rohstoffe, Schwefelwasserstoff oder gelöstes Eisen, in sonnigen, gut durchlüfteten Gewässern nur selten zu finden sind. Aber als die Erde jung war, vor dem Aufkommen des freien Sauerstoffs, waren sie die bei weitem einfachste Elektronenquelle, und sie sättigten die Ozeane. Dies wirft ein Paradoxon auf, dessen Auflösung von grundlegender Bedeutung ist, um zu verstehen, wie sich die Photosynthese entwickelt hat. Warum sollte man von einer reichhaltigen und bequemen Elektronenquelle zu etwas weitaus Problematischerem wechseln, nämlich zu Wasser, dessen Abfallprodukt, der Sauerstoff, ein giftiges Gas war, das allen Bakterien, die es produzierten, schwere körperliche Schäden zufügen konnte?
Die Tatsache, dass Wasser mit der Kraft der Sonne und einem cleveren Katalysator weitaus häufiger vorkommt, ist nebensächlich, denn die Evolution ist nicht vorausschauend. Auch die Tatsache, dass die sauerstoffhaltige Photosynthese die Welt verändert hat, kümmert die Welt nicht im Geringsten. Welcher Umweltdruck oder welche Mutationen könnten also eine solche Veränderung bewirkt haben? Die einfache Antwort, die in vielen Lehrbüchern zu finden ist, lautet, dass die Rohstoffe ausgingen: Das Leben wandte sich dem Wasser zu, weil es keine einfachen Alternativen mehr gab. Aber diese Antwort kann nicht stimmen: Die geologischen Aufzeichnungen machen deutlich, dass sich die “sauerstoffhaltige” Photosynthese lange vorher – mehr als eine Milliarde Jahre vorher – entwickelt hat, als die Rohstoffe ausgingen. Das Leben wurde nicht in die Enge getrieben (Olson 2006, Buick 2001, 2008, Davis 2004, Hooper 2006, Holland 2006, Cardona 2018, Demoulin et al. 2024, Hohmann-Mariott et al. 2011).
Eine andere Antwort, die sich erst jetzt herauskristallisiert, liegt in der Maschinerie der Photosynthese selbst verborgen und ist viel schöner. Es ist eine Antwort, die Zufall und Notwendigkeit verbindet, eine Antwort, die das Licht der Einfachheit auf eine der verworrensten und kompliziertesten Abspaltungen der Welt wirft. Und das werden wir in der nächsten Episode ergründen.
Literatur
Alberts, B.; et al. (2024): Molekularbiologie der Zelle. New York: John Wiley & Sons.
Baldauf, S. L., Palmer, J. D., Doolittle, W. F. (1996): The root of the universal tree and the origin of eukaryotes based on elongation factor phylogeny. Proceedings of the National Academy of Sciences, USA 93:7749–7754
Beerling, D. (2007): The Emerald Planet: How Plants Changed Earth’s History. Oxford University Press.
Benton, M. et al. (2020): Cowen’s History of Life, Sixth Edition. Wiley Blackwell
Berner, R. A. (2001): Modeling atmospheric O2 over Phanerozoic time. Geochim. Cosmochim. Acta 65, 685–694.
Berner R. A. (2003): The long-term carbon cycle, fossil fuels and atmospheric composition. Nature 426(6964):323-6. doi: 10.1038/nature02131. PMID: 14628061.
Berner, R. A. (2004): The Phanerozoic Carbon Cycle (Oxford Univ. Press, Oxford)
Berner, R. A., Beerling, D. J., Dudley, R., Robinson, J. M., Wildman, R. A. (2003): Phanerozoic atmospheric oxygen. Annu. Rev. Earth Planet. Sci. 31, 105–134.
Berner, R. A., Canfield, D. E.(1989): A model for atmospheric oxygen over Phanerozoic time. Am. J. Sci. 289, 333–361.
Blankenship, R.E., Madigan, M.T., Bauer, C.E. (2006): Anoxygenic Photosynthetic Bacteria
Blankenship, R. E.; Sadekar, S.; Raymond, J. (2007): CHAPTER 3 – The Evolutionary Transition from Anoxygenic to Oxygenic Photosynthesis. In Falkowski, P. G.; Knoll, A. H. (eds.). Evolution of Primary Producers in the Sea. Academic Press. pp. 21–35.
Blockley, J.G. (2004): Precambrian iron-formation. In Eriksson, P.G.; Altermann, W.; Nelson, D.R.; Mueller, W.U.; Catuneanu, O. (eds.). Evolution of the Hydrosphere and Atmosphere. Developments in Precambrian Geology. Developments in Precambrian Geology. Vol. 12. pp. 359–511.
Brown, J. R., Doolittle, W. F. (1995): Root of the universal tree of life based on ancient aminoacyl-tRNA synthetase gene duplications. Proceedings of the National Academy of Sciences, USA 92: 2441–2445.
Brown, J. R., Doolittle, W. F. (1997): Archaea and the prokaryote-to-eukaryote transition. Microbiology and Molecular Biology Reviews 61: 456–502.
Bryant DA, Costas AM, Maresca JA, Chew AG, Klatt CG, Bateson MM, Tallon LJ, Hostetler J, Nelson WC, Heidelberg JF, Ward DM (2007): Candidatus Chloracidobacterium thermophilum: An Aerobic Phototrophic Acidobacterium. Science. 317 (5837): 523–6.
Bryant D. A.; Frigaard, N.-U. (2006): Prokaryotic photosynthesis and phototrophy illuminated. Trends in Microbiology. 14 (11): 488–496
Buick, R. (2001): Life in the Archean. In: Dereck Briggs, Peter R. Crowther: Paleobiology II. Wiley-Blackwell, Oxford
Buick R (2008): When did oxygenic photosynthesis evolve?. Philosophical Transactions of the Royal Society of London, Series B. 363 (1504): 2731–2743.
Campbell, N. A. et al. (2016): Biologie. München: Pearson.
Camprubí, E., de Leeuw, J.W., House, C.H. et al. (2019): The Emergence of Life. Space Sci Rev 215, 56 https://doi.org/10.1007/s11214-019-0624-8
Cardona T (2018): Early Archean origin of heterodimeric Photosystem I. Heliyon. 4 (3): e00548.
Cawood, P. A.; Hawkesworth, C. J. (2014): Earth’s middle age. Geology. 42 (6): 503–506.
Davis K (2004): Photosynthesis got a really early start. New Scientist.
Demoulin, C. F.; Lara, Y. J.; Lambion, A.; Javaux, E. J. (2024): Oldest thylakoids in fossil cells directly evidence oxygenic photosynthesis. Nature. 625 (7995): 529–534.
Doolittle, W. F. (2000a): Searching for the common ancestor. Research in Microbiology 151: 85–89.
Doolittle W. F. (2000b): Uprooting the tree of life. Sci Am. 282(2):90-5.
Dudley, R. (1998): Atmospheric Oxygen, Giant Paleozoic Insects and the Evolution of Aerial Locomotor Performance. The Journal of Experimental Biology. 201 (Pt 8): 1043–1050.
Etienne, J.L.; Allen, P.A.; Rieu, R. & Le Guerroué, E. (2007): Neoproterozoic glaciated basins: A critical review of the Snowball Earth hypothesis by comparison with Phanerozoic glaciations. In Michael Hambrey; Poul Christoffersen; Neil Glasser & Bryn Hubbard (eds.). Glacial Sedimentary Processes and Products. IAS Special Publication. Vol. 39. Malden, MA: IAS/Blackwell. pp. 343–399.
Evans, D. A. et al. (1997): Low-latitude glaciation in the Palaeoproterozoic era. Nature 386 (6622), 262–266, doi:10.1038/386262a0, bibcode:1997Natur.386..262E.
Floudas, D.; Binder, M.; Riley, R.; Barry, K.; Blanchette, R. A.; Henrissat, B.; Martinez, A. T.; et al. (2012): The Paleozoic Origin of Enzymatic Lignin Decomposition Reconstructed from 31 Fungal Genomes. Science. 336 (6089): 1715–1719.
Garrels, R. M., Lerman, A., Mackenzie, F. T. (1976): Controls of atmospheric O2 and CO2 — past, present, and future. Am. Sci. 64, 306–315.
Garwood, R. J.; Edgecombe, G. (2011): Early terrestrial animals, evolution and uncertainty. Evolution: Education and Outreach. 4 (3): 489–501. doi:10.1007/s12052-011-0357-y.
Garwood, R. J.; Dunlop, J. A.; Sutton, M. D. (2009): High-fidelity X-ray micro-tomography reconstruction of siderite-hosted Carboniferous arachnids. Biology Letters. 5 (6): 841–844. doi:10.1098/rsbl.2009.0464. PMC 2828000. PMID 19656861.
Garwood, R. J.; Sutton, M. D. (2010): X-ray micro-tomography of Carboniferous stem-Dictyoptera: New insights into early insects. Biology Letters. 6 (5): 699–702. doi:10.1098/rsbl.2010.0199. PMC 2936155. PMID 20392720.
Gole, M. J.; Klein, C. (1981): Banded Iron-Formations through Much of Precambrian Time. The Journal of Geology. 89 (2): 169–183.
Griffin, BM, Schott, J, Schink, B (2007): Nitrite, an electron donor for anoxygenic photosynthesis. Science 316(5833), 1870;
Gumsley, A. P.; Chamberlain, K. R.; Bleeker, W.; Söderlund, U.; De Kock, M. O.; Larsson, E. R.; Bekker, A. (2017): Timing and tempo of the Great Oxidation Event. Proceedings of the National Academy of Sciences of the United States of America. 114 (8): 1811–1816.
Hamilton TL (2019): The trouble with oxygen: The ecophysiology of extant phototrophs and implications for the evolution of oxygenic photosynthesis. Free Radical Biology & Medicine. 140: 233–249.
Hansmann S., Martin, W. (2000): Phylogeny of 33 ribosomal and six other proteins encoded in an ancient gene cluster that is conserved across prokaryotic genomes. Int. J. Syst. Evol. Microbiol. 50, 1655–1663.doi:10.1099/00207713-50-4-1655
He Z, Ferlez B, Kurashov V, Tank M, Golbeck JH, Bryant DA (2019): Reaction centers of the thermophilic microaerophile, Chloracidobacterium thermophilum (Acidobacteria) I: biochemical and biophysical characterization. Photosynthesis Research. 142 (1): 87–103.
Hickman, C. P. (2008): Zoologie. München: Pearson Deutschland GmbH.
Hohmann-Marriott, MF, Blankenship RE (2011): Evolution of photosynthesis. Annu Rev Plant Biol. Vol. 62, 2011, S. 515–548. PMID 21438681; doi:10.1146/annurev-arplant-042110-103811
Holland, H.D. (2006): The oxygenation of the atmosphere and oceans. Philosophical Transactions of the Royal Society: Biological Sciences. 361 (1470): 903–915.
Hooper R (2006): Revealing the dawn of photosynthesis. New Scientist.
Kadereit, J. W.; et al. (2021): Strasburger − Lehrbuch der Pflanzenwissenschaften. Berlin Heidelberg New York: Springer-Verlag, 38. Auflage.
Katsuta N, Shimizu I, Helmstaedt H, Takano M, Kawakami S, Kumazawa M (2012): Major element distribution in Archean banded iron formation (BIF): influence of metamorphic differentiation. Journal of Metamorphic Geology. 30 (5): 457–472.
Klein, C. (2005): Some Precambrian banded iron-formations (BIFs) from around the world: Their age, geologic setting, mineralogy, metamorphism, geochemistry, and origins. American Mineralogist. 90 (10): 1473–1499.
Koonin, E. V. (2003): Comparative genomics, minimal gene-sets, and the last universal common ancestor. Nature Reviews Microbiology 1: 127–136.
Kopp RE, Kirschvink JL, Hilburn IA, Nash CZ. (2005): The Paleoproterozoic snowball Earth: a climate disaster triggered by the evolution of oxygenic photosynthesis. Proc Natl Acad Sci U S A, 102(32):11131-6. doi: 10.1073/pnas.0504878102.
Lane, N., Allen, J. F., Martin, W. (2010): How did LUCA make a living? Chemiosmosis in the origin of life. BioEssays 32, 271–280
Lenton T. M., Watson, A. J. (2000): Redfield revisited 2: What regulates the oxygen content of the atmosphere? Glob. Biogeochem. Cycles 14, 249–268.
Lyons, T. W.; Reinhard, C. T.; Planavsky, N. J. (2014): The rise of oxygen in Earth’s early ocean and atmosphere. Nature. 506 (7488): 307–315.
Madigan, M. T.; et al. (2020): Brock Mikrobiologie. München: Pearson.
Martin W., Russell, M. (2007): On the origin of biochemistry at an alkaline hydrothermal vent. Philosophical Transactions of the Royal Society B 367: 1887–1925.
Martin, W., Sousa, F. L. (2016): Early microbial evolution: the age of anaerobes. Cold Spring Harb Perspect Biol. 8, A018127
Martin, W., Sousa, F.L., Lane, N. (2014): Energy at life’s origin. Science 344: 1092–93.
McGhee, G. R. Jr. (2018): Carboniferous Giants and Mass Extinction. The Late Paleozoic Ice Age World. Columbia University Press, New York.
Micheels, A.; Montenari, M. (2008): A snowball Earth versus a slushball Earth: Results from Neoproterozoic climate modeling sensitivity experiments. Geosphere. 4 (2): 401–10.
Mukherjee, I.; Large, R. R.; Corkrey, R.; Danyushevsky, L. V. (2018): The Boring Billion, a slingshot for Complex Life on Earth. Scientific Reports. 8 (4432): 4432.
Munk, K. (2008): Taschenlehrbuch Biologie: Botanik. Stuttgart: Georg Thieme Verlag.
Munk, K. (2010): Taschenlehrbuch Biologie: Zoologie. Stuttgart: Georg Thieme Verlag.
Munk, K. (2018): Taschenlehrbuch Biologie: Mikrobiologie. Stuttgart: Georg Thieme Verlag.
Nelson, D.; Cox, M. (2010): Lehninger Biochemie. Wiesbaden: Springer Berlin Heidelberg.
Olson JM (2006): Photosynthesis in the Archean era. Photosynthesis Research. 88 (2): 109–117.
Oschmann, W. (2016): Evolution der Erde. Utb
Ochmann, W. (2018): Leben der Vorzeit. Utb
Prothero, D. (2021): The Evolving Earth. Oxford University Press
Prothero, D., Dott, (2004): Evolution of the Earth, Seventh edition. McGrawHill
Roberts, N. M. W. (2013): The boring billion? – Lid tectonics, continental growth and environmental change associated with the Columbia supercontinent. Geoscience Frontiers. Thematic Section: Antarctica – A window to the far off land. 4 (6): 681–691.
Royer, D. L., et al. (2004): CO2 as a primary driver of Phanerozoic climate. GSA Today. Band 14, Nr. 3,
Russell, M., Martin, W. (2004): The rocky roots of the acetyl-CoA pathway. Trends in Biochemical Sciences 29: 358–63 (2004).
Sadava, D., et al. (2019): Purves Biologie. Berlin Heidelberg New York: Springer-Verlag.
Schmidt, PW, Williams, GE (2003): Paleomagnetism of the Lorrain Formation, Quebec, and Implications for the Latitudeof Huronian Glaciation. In: European Geophysical Society (Hrsg.): Geophysical Research Abstracts. Band 5, Nr. 08262
Sousa F. L. et al. (2013): Early bioenergetic evolution. Philosophical Transactions of the Royal Society B 368: 20130088.
Tang, H.; Chen, Y. (2013): Global glaciations and atmospheric change at ca. 2.3 Ga. Geoscience Frontiers. 4 (5): 583–596.
Trendall, A. F. (2002): The Significance of Iron-Formation in the Precambrian Stratigraphic Record. Precambrian Sedimentary Environments. pp. 33–66.
Trendall, A. F. (2005): Banded iron formations. Encyclopedia of Geology. Elsevier. pp. 37–42.
Tziperman, E.; Halevy, I.; Johnston, D. T.; Knoll, A. H.; Schrag, D. P. (2011): Biologically induced initiation of Neoproterozoic snowball-Earth events. Proceedings of the National Academy of Sciences. 108 (37): 15091–15096.
Walker J. C. G. (1986): Global geochemical cycles of atmospheric oxygen. Mar. Geol. 70, 159–174.
Wehner, R.; Gehring, W. J. (2013): Zoologie. Stuttgart: Georg Thieme Verlag.
Weiler, E. W. et al. (2008): Allgemeine und molekulare Botanik. Stuttgart: Thieme.
Wiechert, U. H. (2002): Earth’s Early Atmosphere. Science. 298 (5602): 2341–2342.
Woese, C. R. (1998): The universal ancestor. Proceedings of the National Academy of Sciences, USA 95: 6854–6859.
Woese, C. R. (2000): Interpreting the universal phylogenetic tree. Proceedings of the National Academy of Sciences, USA 97: 8392–8396.
Xiong J (2006): Photosynthesis: what color was its origin?. Genome Biology. 7 (12): 245.
Young, G. M. (2013): Precambrian supercontinents, glaciations, atmospheric oxygenation, metazoan evolution and an impact that may have changed the second half of Earth history. Geoscience Frontiers. 4 (3): 247–261.
Young, G. M; Long, D. G.F; Fedo, C. M; Nesbitt, H.W. (2001): Paleoproterozoic Huronian basin: product of a Wilson cycle punctuated by glaciations and a meteorite impact. Sedimentary Geology. 141–142: 233–254.
Zeng Y, Feng F, Medová H, Dean J, Koblížek M (2014): Functional type 2 photosynthetic reaction centers found in the rare bacterial phylum Gemmatimonadetes. Proceedings of the National Academy of Sciences of the United States of America. 111 (21): 7795–7800.