Wir wissen wie Zellen sich vermehren. Sie können aber auch sterben.
Zellen eines vielzelligen Lebewesens können auf zwei Weisen absterben. Die erste Art von Zelltod ist die Nekrose (unkontrollierter Zelltod); sie tritt auf, wenn Zellen oder Gewebe durch Gewalteinwirkung, Gift, Sauerstoffmangel oder Nährstoffmangel geschädigt werden. Nekrotische Zellen schwellen häufig an und platzen, sodass ihr Inhalt in den Extrazellularraum freigesetzt wird und eine Entzündung hervorrufen kann.
Die Apoptose (programmierter Zelltod) ist eine genetisch vorgegebene Abfolge von Ereignissen, die im Verlauf normaler Entwicklungsprozesse, aber auch in erwachsenen (adulten) Geweben stattfinden.
Durch den programmierten Zelltod werden Zellen beseitigt, die für den Organismus nicht vorteilhaft sind, weil sie entweder nicht mehr gebraucht werden oder weil Zellen, die zu lange Leben anfällig für Krebs sind. Der Ablauf der Apoptose ist bei vielen Lebewesen gleich. Die Zelle löst sich von ihren Nachbarn ab und ihr Chromatin wird von Enzymen abgebaut, die die DNA in Fragmente von etwa 180 Nucleotiden zerschneiden. Die Zelle bildet membranumhüllte Ausstülpungen („Blasen“) und löst sich in Zellfragmente auf. Eine Reihe verschiedener externer oder interner Signale kann den programmierten Zelltod auslösen (Abb. 1). Diese Signale sind beispielsweise Hormone, Wachstumsfaktoren, die Infektion mit einem Virus, bestimmte Toxine oder eine erhebliche Schädigung der DNA. Diese Signale aktivieren spezifische Rezeptoren, die wiederum Signalwege in Gang setzen, die zur Apoptose führen. Einige apoptotische Signalwege haben die Mitochondrien zum Ziel, etwa indem sie die Durchlässigkeit der mitochondrialen Membranen erhöhen. Die Zelle stirbt schnell ab, wenn die Mitochondrien die zelluläre Atmung nicht mehr ausführen können. Im Verlauf der Apoptose wird eine bestimmte Gruppe von Enzymen aktiviert, die man als Caspasen bezeichnet. Dabei handelt es sich um Proteasen, die in einer Kaskade von Ereignissen Zielmoleküle hydrolysieren. Die Zelle stirbt, wenn die Caspasen die Proteine der Kernhülle, des Cytoskeletts und der Plasmamembran hydrolysieren.
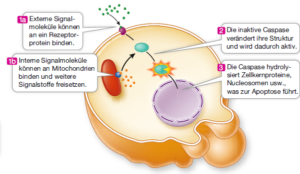
Abb. 1: Apoptose
Krebs
Durch die Mitose werden einem Lebewesen Zellen hinzugefügt, durch die Apoptose werden sie beseitigt. Unter normalen Bedingungen befinden sich diese Vorgänge im Gleichgewicht, sodass die Situation für den Organismus insgesamt von Vorteil ist. In anderen Situationen führt sie zu einem unkontrollierten Zellwachstum, geläufig auch als Krebs bezeichnet. Eine Krankheit, die den meisten ernste Sorgen bereitet und diese sind berechtigt. Einer von drei Bewohnern der USA bekommt während seines Lebens irgendeine Form von Krebs und zurzeit stirbt daran jeder Vierte. Mit 1,5 Mio. Neuerkrankungen und 0,5Mio. Todesfällen pro Jahr liegt Krebs in den USA als Todesursache auf Platz zwei hinter den Herz-Kreislauf-Erkrankungen. In Deutschland sind es rund 340.000 Neuerkrankungen und 210.000 Krebstote pro Jahr.
Krebszellen (bösartige Tumorzellen) unterscheiden sich von den normalen Zellen, aus denen sie hervorgehen, durch zwei Eigenschaften: Krebszellen verlieren die Kontrolle über die Zellteilung. Krebszellen können in andere Körperregionen wandern.
Die meisten Zellen im Körper teilen sich nur, wenn sie extrazelluläre Signale erhalten, beispielsweise Wachstumsfaktoren.
Krebszellen reagieren nicht auf diese Kontrollen und teilen sich stattdessen mehr oder weniger kontinuierlich. Schließlich bilden sie Tumoren (große Massen von Zellen). Tumoren können gutartig oder bösartig sein. Gutartige Tumoren ähneln dem Gewebe, aus dem sie stammen. Sie wachsen langsam und bleiben auf die Region beschränkt, in der sie sich entwickeln. Gutartige Tumoren sind kein Krebs, aber sie müssen entfernt werden, wenn sie so auf ein Organ übergreifen, dass sie seine Funktion beeinträchtigen.
Bösartige Tumoren sehen überhaupt nicht aus wie das ursprüngliche Gewebe. Bösartige Tumorzellen haben häufig irreguläre Strukturen, etwa Zellkerne von unterschiedlicher Größe und Form. Die zweite und besonders bedrohliche Eigenschaft von Krebszellen ist ihre Fähigkeit, in das umgebende Gewebe einzudringen und sich in andere Körperregionen auszubreiten, indem sie sich durch das Blut oder die Lymphe transportieren lassen. Haben sich bösartige Tumorzellen in irgendeiner weiter entfernten Körperregion angesiedelt, teilen sie sich und bilden so an dieser Stelle einen neuen Tumor, als Tochtergeschwulst oder Metastase bezeichnet. Diese Ausbreitung führt an verschiedenen Stellen des Körpers zu Organversagen und erschwert die Krebsbekämpfung in besonderer Weise.
Wir haben im Kapitel zur Mitose und Zellzyklus kennengelernt, dass bestimmte Signale das Wachstum und die Teilung von Zellen hemmen oder fördern. Wachstumshormone fördern die Zellteilung, andere Proteine wie das Retinoblastomprotein (RB) hemmen den Zellzyklus. Krebszellen reagieren auf diese Signale nicht. Hier sind zwei entsprechend wichtige Gengruppen wichtig: Onkogene und Tumorsupressorgene.
Onkogenproteine werden von Onkogenen exprimiert und sind positive Regulatoren von Krebszellen. Sie leiten sich von normalen positiven Regulatoren ab und sind entweder mutiert, sodass sie eine übermäßige Aktivität zeigen, oder sie kommen im Überschuss vor. So können sie Krebszellen dazu stimulieren, sich häufiger zu teilen. Die Zielstrukturen von Onkogenproteinen können Wachstumsfaktoren, deren Rezeptoren oder andere Komponenten eines Signaltransduktionswegs sein, der die Zellteilung stimuliert.
Ein Beispiel für ein Onkogenprotein ist ein Wachstumsfaktorrezeptor bei Brustkrebszellen. Normale Brustzellen enthalten relativ geringe Mengen des Wachstumsfaktorrezeptors HER2. Deshalb werden Brustepithelzellen normalerweise bei Vorhandensein dieses Wachstumsfaktors auch nicht dazu stimuliert, sich zu vermehren. Bei etwa 25% aller Fälle von Brustkrebs resultiert eine Mutation der DNA in einer erhöhten Produktion des HER2-Rezeptors. Das führt zu einer positiven Stimulation des Zellzyklus und zu einer schnellen Proliferation der Zellen mit der mutierten DNA.
Tumorsuppressorproteine werden von Tumorsuppressorgenen exprimiert und kommen sowohl in Krebszellen als auch in normalen Zellen vor. In normalen Zellen wirken sie als negative Regulatoren, in Krebszellen sind sie inaktiv.
Ein Beispiel ist das bereits erwähnte Retinoblastomprotein (RB), das in der G1-Phase als Restriktionspunkt wirkt. In einigen Krebszellen ist RB inaktiv, sodass der Zellzyklus ungebremst voranschreitet. Einige Virusproteine können Tumorsuppressorproteine inaktivieren. So infiziert beispielsweise das menschliche Papillomvirus Epithelzellen im Gebärmutterhals. Ein Genprodukt dieser Viren ist das Protein E7. Es bindet an das RB-Protein und verhindert dadurch, dass es den Zellzyklus hemmt. Ein weiterer wichtiger Tumorsuppressor ist p53, ein Transkriptionsfaktor, der bei Kontrollpunktsignalwegen des Zellzyklus und der Apoptose eine Rolle spielt. Die Bedeutung von p53 als Tumorsuppressor lässt sich dadurch veranschaulichen, dass bei über 50% aller Tumoren des Menschen das p53-codierende Gen mutiert ist.
Da es Onkogene und Tumorsuppressorgene gibt, ist mehr als ein mutiertes Protein erforderlich, damit der Zellzyklus von Krebszellen voranschreiten kann. An einem einzigen Tumor können mehrere mutierte Onkogene und Tumorsuppressorgene beteiligt sein. Bei der Maus gibt es beispielsweise zwei wichtige Onkogene: Myc, dessen Expression den Zellzyklus stimuliert und die Apoptose verhindert, und Ras, ein Signalprotein. In Experimenten ließ sich zeigen, dass beide Onkogene exprimiert werden müssen, damit der Zellzyklus in Mauszellen in Gang gesetzt wird, die dadurch zu Tumorzellen werden.
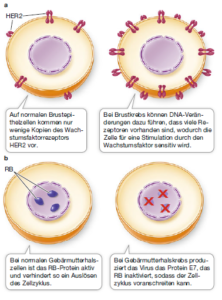
Abb. 2: Wirkung von Onkogenen (a) und Tumorsupressorgenen (b).
In normalen, nichtwachsenden Geweben ist die Zellteilungsrate gleich der Apoptoserate, sodass die Zellpopulation insgesamt nicht zunimmt. Bei Krebszellen ist die Regulation des Zellzyklus gestört, sodass sich die Zellteilungsrate erhöht.
Die immer noch erfolgreichste und am häufigsten angewendete Behandlungsmethode gegen Krebs ist ein chirurgischer Eingriff. Das physikalische Entfernen eines Tumors ist zwar effizient, oftmals ist es jedoch für einen Chirurgen schwierig, alle Tumorzellen zu beseitigen. (Ein Tumor von etwa 1 cm Größe enthält bereits 1Mrd. Zellen.) Tumoren sind im Allgemeinen von normalen Geweben umgeben. Darüber hinaus besteht die Möglichkeit, dass sich Zellen vom Tumor abgelöst und in andere Organe ausgebreitet haben. So ist es unwahrscheinlich, dass ein lokal begrenzter chirurgischer Eingriff eine dauerhafte Heilung bewirkt. Deshalb gibt es zusätzliche Verfahren, um Krebs zu heilen, und diese sind vor allem auf den Zellzyklus gerichtet. Das Ziel ist, bei den Tumorzellen die Zellteilungsrate zu erniedrigen oder die Apoptoserate zu erhöhen, sodass ihre Population abnimmt.
Ein Beispiel für einen Wirkstoff gegen Krebs, der sich gegen den Zellzyklus richtet, ist Fluoruracil, das die Synthese von Thymin blockiert, eine der vier Basen in der DNA. Der Wirkstoff Paclitaxel (im Handel z. B. unter dem Namen Taxol) behindert die Funktion der Mikrotubuli in der Mitosespindel.
Beide Wirkstoffe hemmen den Zellzyklus, und die Apoptose bewirkt, dass der Tumor schrumpft. Drastischere Auswirkungen zeigt die Strahlentherapie, bei der hochenergetische Strahlung auf den Tumor gerichtet wird. Dadurch kommt es zu erheblichen DNA-Schäden, und der Kontrollpunkt für die DNA-Reparatur wird überlastet. Das wiederum löst bei den betroffenen Zellen die Apoptose aus. Ein ähnliches Ziel verfolgt die Chemotherapie, bei der versucht wird, die Krebszellen gezielt zu vergiften.
Ein Hauptproblem bei diesen Behandlungsmethoden besteht darin, dass neben den Tumorzellen auch normale Zellen angegriffen werden. Diese Behandlungsmethoden sind insbesondere für solche Gewebe schädlich, die im Normalzustand eine hohe Zellvermehrungsrate haben, wie das Darmepithel, die Oberhaut (Epidermis) oder das Knochenmark (das laufend Blutzellen produziert).
Das vorherrschende Ziel in der Krebsforschung ist die Entwicklung von Behandlungsmethoden, die spezifisch nur Krebszellen angreifen. Ein vielversprechendes Beispiel ist Herceptin, das gegen den HER2-Wachstumsfaktorrezeptor gerichtet ist, der wiederum an der Oberfläche einiger Typen von Brustkrebszellen auf hohem Niveau exprimiert wird. Herceptin bindet spezifisch an den HER2-Rezeptor, stimuliert ihn jedoch nicht. Das verhindert ein Andocken des natürlichen Wachstumsfaktors, sodass die Zellteilung nicht angeregt wird. Da die Zellteilung blockiert ist und die Apoptoserate gleichbleibt, schrumpft der Tumor.
Einen ganz anderen und in den letzten Jahren zunehmend erfolgversprechenden Behandlungsansatz von Krebs verfolgt die Immuntherapie. Dabei wird versucht, das Immunsystem des Patienten zur Bekämpfung der Krebszellen anzuregen.


