Im letzten Beitrag haben wir festgestellt, dass die Weißen Raucher in der Tiefsee ideale Bedingungen für die Entstehung von Leben liefern können: ein hoher Kohlenstoff- und Energiefluss, der physikalisch über anorganische Katalysatoren geleitet wird und so eingeschränkt ist, dass sich hohe Konzentrationen an organischen Stoffen ansammeln können. Die hydrothermalen Fluide sind reich an gelöstem Wasserstoff und enthalten geringe Mengen anderer reduzierter Gase wie Methan, Ammoniak und Sulfid (Russel et al. 1988, 1994, 1998, 2003, 2013, Russel 2003, 2011, Russel & Hall 1997, 2002, Herschy 2014, Herschy et al. 2014, Lane et al. 2010, Lane 2017, Martin et al., 2008, 2014, Martin & Russel 2003, 2007, Martin 2012, Nitschke & Russel 2009, Branscomb & Russel 2018a,b). Lost City und andere bekannte alkalische Schlote (Kelley et al. 2001, 2005, 2007) sind mikroporös – es gibt keinen zentralen Schornstein, sondern das Gestein selbst ist wie ein mineralisierter Schwamm, mit dünnen Wänden, die miteinander verbundene Poren von Mikrometern bis Millimetern Größe voneinander trennen und insgesamt ein riesiges Labyrinth bilden, durch das die alkalischen hydrothermalen Fluide sickern (Abb. 1). Da diese Fluide nicht durch Magma überhitzt werden, begünstigen ihre Temperaturen nicht nur die Synthese organischer Moleküle, sondern auch langsamere Fließgeschwindigkeiten. Die Fluide werden nicht mit rasender Geschwindigkeit herausgepumpt, sondern schlängeln sich sanft über katalytische Oberflächen. Und diese Schlote bleiben Jahrtausende lang bestehen, im Fall von Lost City mindestens 100.000 Jahre.
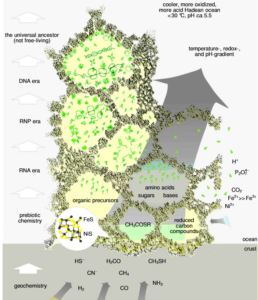
Abb. 1: Ein Modell für die Entstehung von Leben an einem Redox-, pH- und Temperaturgradienten an einem submarinen hydrothermalen Schlot. Siehe Russell & Hall (1997) und Russell et al. (2003) für Einzelheiten. Die Begriffe RNA-, RNP- und DNA-Ära (anstelle von “Welt”) werden verwendet, um zu betonen, dass keine Nukleinsäure-Evolution ohne eine unterstützende Geochemie, später Biogeochemie und schließlich Biochemie möglich ist, um einen stetigen Fluss angemessener Konzentrationen polymerisierbarer Vorläufer (z. B. Nukleotide) zu gewährleisten und und damit jede Art von Replikation zu unterstützen.
Doch bevor wir ins Detail gehen, welche Reaktionen genau zur Entstehung des Lebens führen konnten, müssen wir nochmal einige chemische Grundlagen verstehen, die uns im Laufe dieser und weiterer Episoden immer wieder begegnen werden.
Text als pdf
Was ist Stoffwechsel?
Leben wir u. a. dadurch gekennzeichnet, dass es über einen Stoffwechsel verfügt. Chemisch betrachtet sind Stoffwechselvorgänge chemische Reaktionen. Eine chemische Reaktion ist ein Vorgang, bei dem eine oder meist mehrere chemische Verbindungen in andere umgewandelt werden und Energie freigesetzt oder aufgenommen wird (Abb. 2, Vgl. auch Mortimer & Müller 2020, Kapitel 4.1).
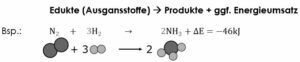
Abb. 2: Chemische Reaktion. Aus Stickstoff (N2) und Wasserstoffgas (H2) entsteht Ammoniak (NH3).
Zwei wichtige Begriffe hierbei sind Oxidation und Reduktion (Abb. 3, vgl. auch Mortimer & Müller 2020, Kapitel 15.3). Beide gehen immer mit einer Übertragung von Elektronen einher. Unter einer Reduktion versteht man die Aufnahme von Elektronen. Eine Oxidation ist eine Abgabe von Elektronen .
Die Verbindung die Elektronen aufnimmt, wird dann als Oxidationsmittel bezeichnet. Oxidationsmittel sind die Verbindungen, die durch Aufnahme von Elektronen eine Oxidation einer anderen Verbindung bewirken. Dabei werden sie selbst reduziert. Die Verbindung die Elektronen abgibt, ist dann das Reduktionsmittel. Reduktionsmittel sind Verbindungen, die durch Abgabe von Elektronen eine Reduktion einer anderen Verbindung bewirken. Dabei werden sie selbst oxidiert.
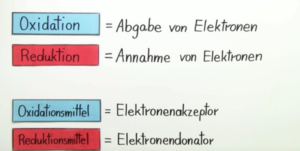
Abb. 3: Definition von Oxidation, Reduktion, Oxidations- und Reduktionsmittel
Sauerstoff ist z. B. ein Atom, welches Elektronen aufnimmt, wird also selbst reduziert und oxidiert andere Verbindungen. Es ist also ein Beispiel für ein Oxidationsmittel. Ein Oxidationsmittel fungiert daher als Elektronenakzeptor.
Wasserstoff gibt dagegen gerne seine Elektronen ab, wird also selbst oxidiert und reduziert andere Verbindungen. Es ist also ein Beispiel für ein Reduktionsmittel. Ein Reduktionsmittel fungiert daher als Elektronendonator (Abb. 4).

Abb. 4: Oxidation und Reduktion am Beispiel von Sauerstoff und Wasserstoff
Oxidation und Reduktion sind immer aneinandergekoppelt. Eine Oxidation kann nicht ablaufen, wenn die abgegebenen Elektronen nicht sofort in einer Reduktion aufgenommen werden können. Man kann zwar die beiden Prozesse räumlich voneinander trennen, jedoch müssen sie immer in Kontakt zueinanderstehen. Entsprechend spricht man von einer Redoxreaktion.
Dabei gibt es zwei Wege den Stoffwechsel zu betreiben, die man als Autotrophie und Heterotrophie bezeichnet (Abb. 5, Vgl. Oschmann 2016, S. 49-50).
Wenn für den Stoffwechsel vorhandene organische Substanzen umgesetzt werden, spricht man von Heterotrophie. Voraussetzung dafür ist, dass bereits ausreichend organisches Material gebildet wurde. Die Zellatmung, also wenn wir organische Moleküle wie Glucose verstoffwechseln ist ein berühmtes Beispiel für Heterotrophie.
Bei der Autotrophie werden anorganische Ausgangsstoffe für den Metabolismus verwendet. So gibt es die Chemolithoautotrophie, bei der anorganische Ausgangsstoffe, wie CO2 oder Schwefel für die Bildung organischer Moleküle verwendet werden. Das wohl berühmteste Beispiel für autotrophen Stoffwechsel ist die die Photosynthese, bei der Mittels Lichtenergie organische Moleküle aus CO2 gebildet werden können.
Nach diesem Muster – Abgabe und Aufnahme von Elektronen – laufen im Prinzip alle Reaktionen im Stoffwechsel ab.

Abb. 5: Unterschiede zwischen heterotrophen und autotrophen Stoffwechselwegen.
Aber nicht jede Reaktion läuft einfach so spontan ab. Einige Moleküle sind ziemlich Reaktionsträge. Denn jede chemische Reaktion ist nicht nur eine Stoffumwandlung, sondern auch eine Energieumwandlung. Je nachdem, ob Energie (in Form von Wärme) an die Umgebung abgegeben oder aufgenommen wird, teilt man eine chemische Reaktion in eine exotherme oder endotherme Reaktion ein. Hinzukommt, dass jede chemische Reaktion eine Aktivierungsenergie braucht (Abb. 6). Die Aktivierungsenergie ist also eine energetische Barriere, die bei einer chemischen Reaktion von den Reaktionspartnern überwunden werden muss. Wird diese Barriere überwunden, kommt es erst dann zur chemischen Reaktion. Allgemein gilt: Je niedriger die Aktivierungsenergie, desto schneller verläuft die Reaktion. Die besonders für das Leben wichtigen organischen Moleküle reagieren meist nicht einfach so miteinander. Die Aktivierungsenergie wäre zu hoch.
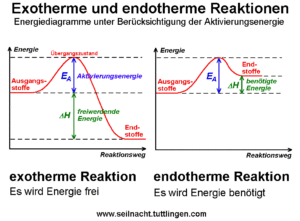
Abb. 6: Energieniveau von endothermen und exothermen Reaktionen.
Es gibt aber Möglichkeiten, diese Aktivierungsenergie zu reduzieren und zwar durch Katalysatoren. Die Katalysatoren in unseren Stoffwechselprozessen sind Enzyme. Doch Enzyme sind selbst Proteine, ihre katalytischen Wirkungen entfalten sie jedoch durch ihr aktives Zentrum: oft sind das Metall-Verbindungen. Und genau hier wird es jetzt interessant! Wir haben schon im letzten Beitrag erfahren, dass viele essentielle Enzyme Eisen-Schwefel-Verbindungen haben, die mit den Eisen-Schwefel-Verbindungen der hydrothermalen Quellen vergleichbar sind.
Thermophorese
Doch damit Verbindungen überhaupt miteinander reagieren können, müssen sie auch in Kontakt miteinander treten, sich also aufkonzentrieren. Und hier liefern die Weißen Raucher eine interessante Möglichkeit.
Wärmeströme durch mikroporöse Labyrinthe, wie sie bei den Weißen Rauchern auftreten, haben die bemerkenswerte Fähigkeit, organische Moleküle durch einen als Thermophorese bezeichneten Prozess auf extreme Werte zu konzentrieren, die das Tausend- oder sogar Millionenfache der Ausgangskonzentration betragen. Als Thermophorese wird die Bewegung von Teilchen aufgrund eines Temperaturgradienten innerhalb eines Fluids bezeichnet (Russel 2007, Baaske et al. 2007, Duhr & Braun 2005, Russel et al. 2013, Baun & Libchaber 2004, Mast & Braun 2010, Priye et al. 2017, Budin & Szostak 2010, Klussmann et al. 2006; Abb. 7 & 8). Bei höheren Temperaturen tanzen kleine Moleküle umher und haben eine gewisse Freiheit, sich in alle Richtungen zu bewegen. Wenn sich die hydrothermalen Flüssigkeiten vermischen und abkühlen, sinkt die kinetische Energie der organischen Moleküle, und ihre Bewegungsfreiheit nimmt ab. Das bedeutet, dass sie nicht mehr so leicht ausweichen können und sich daher in diesen Regionen mit geringerer kinetischer Energie ansammeln. Die Stärke der Thermophorese hängt zum Teil von der Molekülgröße ab: Große Moleküle, wie z. B. Nukleotide, werden besser zurückgehalten als kleinere. Kleine Endprodukte, wie z. B. Methan, gehen leicht aus dem Schlot verloren. Alles in allem sollte ein kontinuierlicher hydrothermaler Fluss durch mikroporöse Schlote die organischen Stoffe aktiv durch einen dynamischen Prozess konzentrieren. Gleichzeitig sorgt dieser Prozess dafür, dass die Wechselwirkungen zwischen den organischen Molekülen gefördert werden. So können spontan Fettsäuren in Bläschen ausfallen und möglicherweise Aminosäuren und Nukleotide zu Proteinen und RNA polmerisieren. Solche Wechselwirkungen sind eine Frage der Konzentration: Jeder Prozess, der die Konzentration erhöht, fördert chemische Wechselwirkungen zwischen Molekülen.
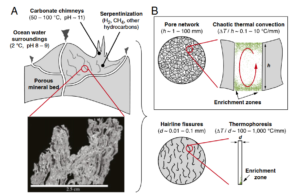
Abb. 7: Hydrothermale Förderanlagen auf der Grundlage chaotischer thermischer Konvektion. (A) Mineralformationen in der Nähe von alkalischen hydrothermalen Schloten, die den Meeresboden auskleiden, enthalten eingebettete Porennetzwerke mit Mikroumgebungen, die robuste thermische und geometrische Bedingungen schaffen, die interne konvektive Strömungsfelder aufrechterhalten können. Das Bild unten zeigt einen Querschnitt von Material, das aus dem Lost City-Schlot geborgen wurde und dessen innere Hohlraummorphologie veranschaulicht. (Maßstabsleiste, 2,5 cm.)
(B) Diese Schlotsysteme weisen eine charakteristische Porosität und thermische Gradienten auf, die mit chaotischer thermischer Konvektion einhergehen. Längenskalen und thermische Gradienten, die mit thermophoretischer Fokussierung einhergehen, sind zum Vergleich dargestellt. Quelle: Priye et al. (2017)
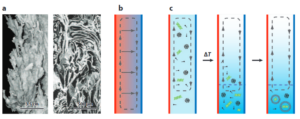
Abb. 8: Molekulare Konzentration durch thermische Diffusionssäulen in einem hydrothermalen Schlot. (a, links) Bild eines Schlots (bestehend aus Kalziumkarbonat) aus dem alkalischen Hydrothermalfeld Lost City. Mikroskopische Querschnittsaufnahmen (rechts) zeigen, dass das Gestein zahlreiche Poren und Kanäle enthält, die sich sowohl in der Nähe des heißen Schlotwassers als auch des kalten Meerwassers befinden. Es wurde vorgeschlagen, dass solche Strukturen als natürliche thermische Diffusionssäulen fungieren.
(b) Schematische Darstellung einer thermischen Diffusionssäule. Ein seitliches Temperaturgefälle in einem vertikalen Kanal führt aufgrund von Auftriebseffekten zu einer konvektiven Strömung (gestrichelte Pfeile). Die Thermophorese (durchgezogene Pfeile) tritt ebenfalls entlang der Richtung des Temperaturgradienten auf. Die Kopplung dieser beiden Prozesse kann zu einer erheblichen Konzentration ausgewählter molekularer Spezies am Boden des Kanals führen.
(c) Schematische Darstellung des Aufbaus zellähnlicher Strukturen aus einem verdünnten präbiotischen Reservoir in einer thermischen Diffusionssäule. Präbiotische chemische Prozesse erzeugen eine verdünnte Lösung, die einfache Lipide (schwarz), die bei niedrigen Konzentrationen als Monomere oder Mizellen vorliegen, und Nukleinsäuren (grüne Helices) enthält (links). Ein Temperaturgradient bewirkt, dass sich beide Komponenten aufkonzentrieren. Sobald ihre Konzentration einen charakteristischen Schwellenwert überschreitet (unterhalb der blauen gestrichelten Linie, Mitte), ordnen sich die Lipide selbst zu Doppelschichtbläschen an, die die konzentrierten Nukleinsäuren in der Lösung einkapseln Lösung einkapseln (rechts).
Die Chemie der frühen Ozeane
Die alkalischen hydrothermalen Schlote von Lost City beherbergen heute eine Menge Leben, wenn auch meist eher Bakterien und Archaeen (Russel & Hall 2006, Proskurowski et al. 2008, Kelley et al. 2001, 2005, 2007, Früh-Green et al. 2003) . Sie produzieren auch geringe Konzentrationen von organischen Stoffen, einschließlich Methan und Spuren von anderen Kohlenwasserstoffen. Aber diese Schlote bringen heute sicherlich keine neuen Lebensformen hervor und bilden auch kein reichhaltiges organisches Milieu. Das liegt zum Teil daran, dass die Bakterien, die dort bereits leben, alle Ressourcen sehr effektiv absaugen; aber es gibt auch grundsätzlichere Gründe.
So wie die Schwarzen Raucher vor 4 Milliarden Jahren nicht genau gleich waren, müssen auch die Weißen Raucher in ihrer Chemie unterschiedlich gewesen sein. Bestimmte Aspekte wären jedoch sehr ähnlich gewesen. Der Prozess der Serpentinisierung, welcher im letzten Beitrag erwähnt wurde (Russel et al. 2010, Sleep et al. 2004, 2011, Schulte 2006, Bach et al. 2006), selbst dürfte nicht anders verlaufen sein: dieselben warmen, wasserstoffreichen, alkalischen Flüssigkeiten hätten zum Meeresboden aufsteigen müssen. Aber die Chemie der Ozeane war damals ganz anders, und das dürfte die mineralische Zusammensetzung der alkalischen Schlote verändert haben. Heute besteht Lost City hauptsächlich aus Karbonaten (Aragonit), während andere ähnliche Schlote, die in jüngerer Zeit entdeckt wurden (wie Strýtan im Norden Islands), aus Tonen bestehen. Damals, in den Ozeanen vor 4 Milliarden Jahren, können wir nicht mit Sicherheit sagen, welche Art von Strukturen sich gebildet hätten, aber es gab zwei Hauptunterschiede, die einen großen Einfluss gehabt haben müssen: Es gab keinen freien Sauerstoff, und die CO2-Konzentration in der Luft und im Meer war viel höher. Diese Unterschiede dürften die alten Weißen Raucher als Strömungsreaktoren viel effektiver gemacht haben.
In Abwesenheit von Sauerstoff löst sich das Eisen im Wasser in seiner Reinform auf, tritt also nicht als Eisenoxid auf. Aus unseren älteren Beiträgen wissen wir, dass die frühen Ozeane voll von gelöstem Eisen waren (Vgl. Oschmann 2016, Prothero 2021, Prothero & Ott 2004, Arndt & Nisbet 2012). Ein großer Teil dieses gelösten Eisens stammte aus den Schwarzen Rauchern. Wir wissen auch, dass Eisen in alkalischen Weißen Rauchern ausgefallen wäre, schlicht und einfach, weil die Regeln der Chemie es vorschreiben; und wir können es im Labor simulieren. In diesem Fall wäre das Eisen als Eisenhydroxid und Eisensulfid ausgefällt worden. Eisenhydroxide und Eisensulfide bilden auch heute noch katalytische Cluster in Enzymen, die heute den Kohlenstoff- und Energiestoffwechsel antreiben – Proteine wie Ferredoxin. In Abwesenheit von Sauerstoff hätten also die mineralischen Wände der Weißen Raucher katalytische Eisenminerale enthalten, wahrscheinlich mit anderen reaktiven Metallen wie Nickel und Molybdän.
Jetzt nähern wir uns einem echten Strömungsreaktor: wasserstoffreiche Flüssigkeiten zirkulieren durch ein Labyrinth von Mikroporen mit katalytischen Wänden, die die Produkte konzentrieren und zurückhalten, während die Abfälle abgeführt werden. Aber was genau reagiert da? Hier kommen wir zum Kern der Sache, denn es kommt der hohe CO2-Gehalt ins Spiel. Die heutigen alkalischen Hydrothermalquellen sind relativ kohlenstoffarm, da ein Großteil des verfügbaren anorganischen Kohlenstoffs als Karbonat (Aragonit) in den Wänden der Quellen ausgefällt wird. Vor 4 Milliarden Jahren war der CO2-Gehalt wesentlich höher, vielleicht 100-1.000-mal höher als heute. Ein hoher CO2-Gehalt hätte nicht nur die Kohlenstoffbeschränkung der Urschlote aufgehoben, sondern auch den Säuregehalt der Ozeane erhöht, was wiederum die Ausfällung von Kalziumkarbonat erschwert hätte. (Dies bedroht heute die Korallenriffe, da das steigende CO2 die modernen Ozeane zu versauern beginnt.) Der pH-Wert der heutigen Ozeane liegt bei etwa 8, ist also leicht alkalisch. Im Erdaltertum waren die Ozeane wahrscheinlich neutral oder leicht sauer, vielleicht mit einem pH-Wert von 5-7. Die Kombination aus hohem CO2, leicht sauren Ozeanen, alkalischen Fluiden und dünnen, FeS-haltigen Schlotwänden ist entscheidend, weil sie eine Chemie fördert, die sich sonst nicht so leicht einstellen würde (Sojo et al. 2016, Lane 2017, Abb. 9).
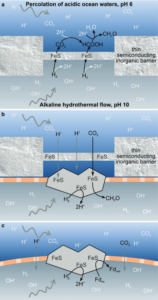
Abb. 9: Möglicher Mechanismus der vektoriellen CO2-Reduktion durch Schlotporen.
(a) H2 ist in alkalischer Lösung stärker reduzierend; sein Reduktionspotential fällt auf -600 mV bei pH 10 und -660 mV bei pH 11. Im Gegensatz dazu lässt sich CO2 in saurer Lösung leichter reduzieren, wobei das Reduktionspotenzial des CO2/CH2O-Redoxpaares bei pH 6 etwa -520 mV beträgt. Diese beiden Phasen stehen in alkalischen Hydrothermalquellen nebeneinander, in denen dünne, halbleitende Fe(Ni)S-Barrieren hydrothermale Flüssigkeiten von Ozeanwasser trennen. Die kontinuierliche Strömung und Vermischung der beiden Phasen an anderen Stellen des Systems sollte die Ansammlung von Ladung auf den Barrieren verhindern. Es ist jedoch zu beachten, dass CH2O in der sauren Phase gebildet wird, wo es anfällig für Oxidation ist. Es ist wahrscheinlich, dass sich die organischen Stoffe im Laufe der Zeit durch Thermophorese langsam im Schlot ansammeln, bis sie protocellartige Strukturen mit Polypeptiden und Fettsäuren bilden.
(b) Eine undichte Protozelle ohne Gene und Proteine, aber mit einer natürlich ausgefällten Fettsäuremembran (gestrichelt) und Polypeptiden, die aus Aminosäuren wie Cystein bestehen und die Oberflächen von FeS-Mineralien chelatisieren. Diese organischen Membranen erleichtern das Nebeneinander von sauren und alkalischen Phasen und fördern möglicherweise die Reduktion von CO2 zu organischen Stoffen, hier symbolisch als CH2O dargestellt, direkt innerhalb der Protozelle.
(c) Protozellen sind robuste Strukturen, die sich potenziell von den FeS-Barrieren lösen und direkt mit den beiden unterschiedlichen Phasen in den Schloten in Kontakt treten können, was einen schnelleren Fluss von H+ durch die Membranen ermöglicht, hier dargestellt bei der Reduktion eines Proto-Ferredoxins (Fd).
Fdox, Ferredoxin; Fdred, reduziertes Ferredoxin
Das Problem CO2 mit H2 reagieren zu lassen
In der Chemie gibt es zwei grundlegende Prinzipien: Thermodynamik und Kinetik.
Die Thermodynamik bestimmt, welche Zustände der Materie stabiler sind – welche Moleküle sich in unbegrenzter Zeit bilden werden. Die Kinetik bezieht sich auf die Geschwindigkeit – welche Produkte bilden sich in einer begrenzten Zeit. In Bezug auf die Thermodynamik reagiert CO2 mit Wasserstoff (H2) zu Methan (CH4). Dies ist eine exotherme Reaktion, das heißt, es wird Wärme freigesetzt. Das wiederum erhöht die Entropie der Umgebung, zumindest unter bestimmten Bedingungen, was die Reaktion begünstigt. Wenn die Möglichkeit besteht, sollte sie spontan ablaufen. Zu den erforderlichen Bedingungen gehören moderate Temperaturen und die Abwesenheit von Sauerstoff (vgl. hierzu und weiter Shock, 1990, 1992, Amend & Shock, 1998, 2001, Amend & McCollom 2009, Shock & Schulte 1998, Shock et al., 1998, Shock & Canovas 2010, Morowitz 1968, Nitschke & Russel 2009).
Ist die Temperatur zu hoch ist das CO2 stabiler als Methan. Wenn Sauerstoff vorhanden ist, reagiert er bevorzugt mit Wasserstoff und bildet Wasser. Vor vier Milliarden hätten die moderaten Temperaturen und anoxischen Bedingungen in alkalischen Schloten die Reaktion von CO2 mit H2 unter Bildung von Methan begünstigt. Auch heute noch produziert Lost City bei Anwesenheit von Sauerstoff eine geringe Menge Methan (Proskurowski et al. 2008). Die Geochemiker Jan Amend und Tom McCollom sind sogar noch weiter gegangen und berechneten, dass die Bildung von organischen Stoffen aus H2 und CO2 unter alkalischen hydrothermalen Bedingungen thermodynamisch begünstigt wird, solange kein Sauerstoff vorhanden ist (Amend & McCollom 2009).
Das bedeutet, dass sich organische Materie unter diesen Bedingungen spontan aus H2 und CO2 bilden sollte.
Aber – und das ist ein großes Aber – H2 reagiert nicht einfach so mit CO2. Es gibt eine kinetische Barriere, d. h. obwohl die Thermodynamik besagt, dass sie spontan reagieren sollten, läuft die Reaktion nicht automatisch ab, da sich H2 und CO2 zueinander gleichgültig verhalten. Um sie zu einer Reaktion zu zwingen, muss ihnen Energie zugeführt werden.
Das ist der Knackpunkt. Wenn es einfach wäre, CO2 auf wirtschaftliche Weise mit H2 reagieren zu lassen – ohne mehr Energie zuzuführen, als wir herausbekommen -, dann hätten wir es schon längst geschafft. Das wäre ein großer Schritt zur Lösung der Energieprobleme der Welt, und doch ist es uns noch nicht gelungen, diese einfache Reaktion wirtschaftlich zu betreiben. Das Paradoxe: die einfachsten Zellen tun das die ganze Zeit (Amend & Shock 2001, Lipp et al. 2008, Lever 2011, Takami et al. 2012, Menez et al 2012, Thauer 1998, Lyu et al. 2018, Liu & Whitman 2008, Enzmann et al. 2018, Thauer et al. 2008)! Methanogene zum Beispiel gewinnen die gesamte Energie und den gesamten Kohlenstoff, den sie für ihr Wachstum benötigen, aus der Reaktion von H2 mit CO2. Wie konnte das aber geschehen, bevor es überhaupt lebende Zellen gab? Wächtershäuser wies dies als unmöglich zurück: Leben könne nicht aus der Reaktion von CO2 und H2 entstehen, sagte er, sie würden einfach nicht reagieren. Selbst eine Erhöhung des Drucks, wie er in mehreren Kilometern Tiefe in hydrothermalen Schloten am Grund der am Grund der Ozeane zu finden sind, zwingt H2 nicht zur Reaktion mit CO2. Aber es gibt tatsächlich eine Möglichkeit.
Wie wir vorhin mitbekommen haben, werden bei Redoxreaktionen Elektronen von einem Donator auf einen Akzeptor übertragen. In unserem Fall würde H2 Elektronen abgeben, wird also oxidiert, und CO2 Elektronen aufnehmen, wird also reduziert. CO2 kann Elektronen aber nur paarweise aufnehmen. Die Addition von zwei Elektronen ergibt Formiat (HCOO–); zwei weitere ergeben Formaldehyd (CH2O); zwei weitere ergeben Methanol (CH3OH); und ein letztes Paar Elektronen ergibt das vollständig reduzierte Methan (CH4) (Russel et al. 2013, Russel & Nitschke 2009, Russel & Hall 2006, 2009, Lane 2017).
Die Bereitschaft eines Moleküls, seine Elektronen abzugeben, wird mit dem Begriff „Reduktionspotenzial“ umschrieben. Wenn ein Molekül seine Elektronen loswerden will, wird ihm ein negativer Wert zugeordnet; je mehr es seine Elektronen loswerden will, desto negativer ist das Reduktionspotenzial. Umgekehrt erhält ein Atom oder Molekül einen positiveren Wert, wenn es sich nach Elektronen sehnt und sie von fast überall her aufnehmen kann. Der Punkt ist, dass ein Molekül mit einem negativen Reduktionspotenzial dazu neigt, seine Elektronen loszuwerden und sie an ein anderes Molekül mit einem positiveren Reduktionspotenzial abgibt, aber nicht umgekehrt.
Das ist das Problem mit H2 und CO2. Bei neutralem pH-Wert (7,0) beträgt das Reduktionspotenzial von H2 technisch gesehen -414 mV. Wenn H2 seine beiden Elektronen abgibt, bleiben zwei Protonen, 2H+, zurück. Wenn CO2 diese Elektronen aufnehmen würde, würde es zu Formiat (HCOO–) werden. Formiat hat jedoch ein Reduktionspotenzial von -430 mV, ist also negativer als das H2. Das bedeutet, dass es dazu neigt, Elektronen an H+ abzugeben, um CO2 und H2 zu bilden. Also genau das Gegenteil, was wir wollen. Formaldehyd ist noch schlimmer. Sein Reduktionspotenzial liegt bei -580 mV. Es hält seine Elektronen nur äußerst ungern fest und gibt sie leicht an Protonen ab, um H2 zu bilden. Bei einem pH-Wert von 7 hat Wächtershäuser also recht: H2 kann kein CO2 reduzieren (Lane 2017, Herschy 2014, Herschy et al. 2014, Ooka et al. 2016; Abb. 11). Aber natürlich leben einige Bakterien und Archaeen von genau dieser Reaktion, also muss sie möglich sein. Und dies ist möglich, da diese Bakterien einen sogenannten Protonengradienten ausnutzen. Und das ist ein verdammt guter Anhaltspunkt (Lane et al. 2010, Lane 2017, Russel et al. 2013, Russel & Hall 1997, 2006, 2009 Nitschke & Russel 2009, Martin & Russel 2004, 2007, Yamaguchi et al. 2014).
Protonengradienten sind räumliche oder zeitliche Unterschiede in der Konzentration von Protonen (H+). Da die Konzentration der Protonen auch den pH-Wert bestimmt, führt eine Erhöhung der Protonenkonzentration zu einem sauren Milieu. Das Reduktionspotenzial eines Moleküls hängt oft vom pH-Wert ab, also von der Protonenkonzentration (Abb. 10).
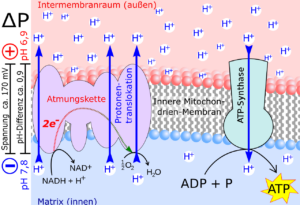
Abb. 10: Protonengradient
Der Grund dafür ist recht einfach. Durch die Übertragung eines Elektrons wird eine negative Ladung übertragen. Wenn das Molekül, das reduziert wird, auch ein Proton aufnehmen kann, wird das Produkt stabiler, da die positive Ladung des Protons die negative Ladung des Elektrons ausgleicht. Je mehr Protonen für den Ladungsausgleich zur Verfügung stehen, desto leichter kann eine Elektronenübertragung stattfinden. Dadurch wird das Reduktionspotenzial positiver – es wird leichter, ein Elektronenpaar aufzunehmen. Tatsächlich erhöht sich das Reduktionspotenzial um etwa 59 mV pro pH-Einheit des Säuregrads. Je saurer die Lösung ist, desto leichter ist es, Elektronen auf CO2 zu übertragen, um Formiat oder Formaldehyd zu erzeugen. Leider gilt das Gleiche auch für Wasserstoff. Je saurer die Lösung ist, desto leichter können Elektronen auf Protonen übertragen werden, um H2-Gas zu bilden. Eine einfache Änderung des pH-Werts allein hat also keinerlei Wirkung. Es bleibt unmöglich, CO2 mit H2 zu reduzieren.
Stellen wir uns nun aber einen Protonengradienten durch eine Membran vor (Abb. 10). Die Protonen Konzentration – der Säuregehalt – ist auf den gegenüberliegenden Seiten der Membran unterschiedlich. Genau der gleiche Unterschied findet sich in alkalischen Schloten. Alkalische hydrothermale Flüssigkeiten bahnen sich ihren Weg durch das Labyrinth der Mikroporen. Das Gleiche gilt für leicht saures Meerwasser. An einigen Stellen gibt es ein Nebeneinander von Fluiden, wobei saures CO2-gesättigtes Ozeanwasser durch eine dünne anorganische Wand, die halbleitende FeS-Minerale enthält, von alkalischen, H2-reichen Fluiden getrennt ist. Das Reduktionspotenzial von H2 ist unter alkalischen Bedingungen geringer: Es will unbedingt seine Elektronen loswerden, so dass sich das übrig gebliebene H+ mit dem OH– in den alkalischen Flüssigkeiten verbinden kann, um so das stabile Wasser zu bilden. Bei pH 10 beträgt das Reduktionspotenzial von H2 -584 mV: ist also stark reduzierend. Umgekehrt beträgt das Reduktionspotenzial von Formiat bei pH 6 -370 mV und für Formaldehyd -520 mV. Mit anderen Worten: Bei diesem Unterschied im pH-Wert ist es für H2 recht einfach, CO2 zu Formaldehyd zu reduzieren. Die einzige Frage ist: Wie werden die Elektronen physikalisch von H2 auf CO2 übertragen? Die Antwort liegt in der Struktur der Wände. FeS-Mineralien in den dünnen anorganischen Trennwänden der mikroporösen Schlote leiten Elektronen. Und so ist in der sollte die physikalische Struktur der alkalischen Schlote theoretisch die Reduktion von CO2 durch H2 vorantreiben, um organische Stoffe zu bilden (Abb. 11).
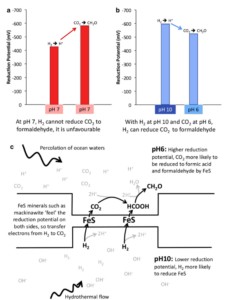
Abb. 11: a. Standard-Reduktionspotentiale von H2 und CO2 bei pH 7. Die Übertragung von Elektronen von H2 auf CO2 ist ungünstig, da das Reduktionspotential für CO2 bei diesem pH-Wert niedriger (negativer) ist als das von H2. b. Wenn H2 in Wässern mit einem pH-Wert von 10 und CO2 in Wässern mit einem pH-Wert von 6 gelöst ist, wird das Reduktionspotenzial von CO2 jedoch höher (positiver) als das von H2, was die Reduktion von CO2 begünstigt. Dies würde theoretisch die Reduktion von CO2 zur Bildung organischer Verbindungen wie Formiat, Formaldehyd, Methanol und Methan ermöglichen. c. Wie saure und alkalische Flüssigkeiten in hydrothermalen Schloten über dünne halbleitende Fe(Ni)S-Wände interagieren könnten, was zur Reduktion von CO2 zu Formaldehyd über Formiat führt.
Aber ist das wirklich so? Diese Frage wurde von mehreren Arbeitsgruppen um die Chemiker und Biochemiker Nick Lane, Barry Herschy, Alexandra Whicher und Eloi Camprubi untersucht, indem ein kleiner Tischreaktor gebaut wurde, mit dem diese Reaktionen durchgeführt werden (Herschy 2014, Herschy et al. 2014, Abb. 12 & 13).

Abb. 12: Foto des Tischreaktors mit Keramikschaum im Reaktorgefäß. Die Reaktionskammer hat einen offenen Durchfluss, so dass erhitzte alkalische Flüssigkeiten und kühle saure Flüssigkeiten in die Hauptkammer gepumpt werden können und oben in ein Auffanggefäß abfließen. An der Seite des Reaktors befinden sich mehrere Öffnungen, über die Flüssigkeiten zugeführt oder Proben entnommen werden können, während der Reaktor in Betrieb ist.

Abb. 13: Eine Reihe von Fotografien der Ausfällungen, die sich innerhalb des Reaktorbehälters im Laufe von 4 Stunden gebildet haben. a. Anfängliche Bildung der Ausfällungsstrukturen. b. Nach 20 Minuten bilden sich die Strukturen weiter, wobei die einzige Unterbrechung darin besteht, dass sie auf die Oberfläche der Flüssigkeit im Reaktor treffen. c. Nach 1 Stunde bilden sich immer noch Ausfällungen mit guter Struktur. d. Nach 4 Stunden werden die Ausfällungen um den Boden herum dicker, was wahrscheinlich die Reduktion über die Barriere verhindert.
Die Simulation dieses Stoffwechselvorgangs ist natürlich mit einigen Schwierigkeiten verbunden: die richtige Konzentration der Stoffe, die sauren bzw. basischen Bedingungen der Fluide, sowie die kolossalen Ausmaße der Schlote – doch es ist machbar. Und tatsächlich wurden Formiat, Formaldehyd und andere einfache organische Stoffe (einschließlich Ribose und Desoxyribose) hergestellt.
Wenn die Theorie stimmt und die Reaktion tatsächlich, wie vorhergesagt abläuft, sollte eine langsame, aber anhaltende Synthese von organischen Molekülen stattfinden. Welche das sind und wie genau sie gebildet werden, werden wir in einem anderen Beitrag erörtern; jetzt wollen wir nur festhalten, dass dies eine weitere einfache, überprüfbare Vorhersage ist. Nach ihrer Bildung sollten diese organischen Stoffe durch Thermophorese auf das Tausendfache ihrer Ausgangskonzentration aufkonzentriert werden, was die Bildung von Vesikeln und vielleicht Polymeren wie Proteinen fördert. Was bedeuten nun all diese Aussagen über Reduktionspotentiale?
Kann die Tatsache, dass das Reduktionspotenzial von Wasserstoff mit dem pH-Wert abnimmt, irgendeine große Bedeutung haben? Ja! Unter alkalischen hydrothermalen Bedingungen sollte H2 mit CO2 reagieren und organische Moleküle bilden. Unter fast allen anderen Bedingungen ist das nicht der Fall. Wir haben aus thermodynamischen Gründen festgestellt, dass für die Herstellung einer Zelle aus dem Nichts einen kontinuierlichen Fluss von reaktivem Kohlenstoff und chemischer Energie über rudimentäre Katalysatoren in einem eingeschränkten Durchflusssystem erfordert. Nur hydrothermale Schlote bieten die erforderlichen Bedingungen, und nur eine Untergruppe von Schloten – die alkalischen Weißen Raucher – erfüllen alle erforderlichen Bedingungen. Aber alkalische Schlote haben jedoch sowohl ein ernstes Problem als auch eine schöne Antwort auf dieses Problem.
Das ernste Problem besteht darin, dass diese Schlote reich an Wasserstoffgas sind, aber Wasserstoff reagiert nicht mit CO2 zu organischen Stoffen. Die schöne Antwort ist, dass die physikalische Struktur der alkalischen Schlote – natürliche Protonengradienten über dünne halbleitende Wände – (theoretisch) die Bildung von organischen Stoffen vorantreiben wird und diese sich dann konzentrieren.
Hinzu kommt die Tatsache, dass alles Leben auf der Erde Protonengradienten durch Membranen nutzt, um den Stoffwechsel anzutreiben. Und um genau darum wird es in den nächsten Beiträgen gehen. Die Stoffwechselprozesse der meisten Lebewesen sind etwas komplexer, also die bloße Reaktion von H2 mit CO2, daher ist es nicht nur notwendig, sich in der Vielfalt der Stoffwechselwege zu orientieren, sondern auch zu ergründen, welches die ursprünglicheren sind und wie diese die Grundlage für die weiteren Wege sind.
Literatur
Amend JP, McCollom TM. (2009): Energetics of biomolecule synthesis on early Earth. In Zaikowski L et al. eds. Chemical Evolution II: From the Origins of Life to Modern Society. American Chemical Society.
Amend, J.P., and Shock, E.L., 1998, Energetics of amino acid synthesis in hydrothermal ecosystems: Science, v. 281, p. 1659–1662,
Amend, J.P., and Shock, E.L., 2001, Energetics of overall metabolic reactions of thermophilic and hyperthermophilic Archaea and Bacteria: FEMS MicrobiologyReviews, v. 25, p. 175–243,
Arndt N, Nisbet E (2012): Processes on the young earth and the habitats of early life. Annual Reviews Earth Planetary Sciences 40: 521–49.
Baaske P, Weinert F, Duhr S, Lemke K, Russell MJ, Braun D (2007): Extreme accumulation of nucleotides in simulated hydrothermal pore systems. Proc Natl Acad Sci USA 104:9346–9351
Bach, W. et al. (2006): Unraveling the sequence of serpentinization reactions: petrography, mineral chemistry, and petrophysics of serpentinites from MAR 15ºN (ODP Leg 209, Site 1274). Geophys. Res. Lett. 33, L13306.
Branscomb E., Russell M. J. (2018a) Frankenstein or a Submarine Alkaline Vent: Who Is Responsible for Abiogenesis?: Part 1: What is life-that it might create itself? Bioessays. 40(7):e1700179. doi: 10.1002/bies.201700179. Epub 2018 Jun 5. PMID: 29870581.
Branscomb E, Russell MJ. (2018b): Frankenstein or a Submarine Alkaline Vent: Who is Responsible for Abiogenesis?: Part 2: As life is now, so it must have been in the beginning. Bioessays. 40(8):e1700182. doi: 10.1002/bies.201700182. Epub 2018 Jul 4. PMID: 29974482.
Braun D, Libchaber A. (2004) Thermal force approach to molecular evolution. Phys. Biol. 1, 1–8.
Budin, I., Szostak, J. (2010): Expanding Roles for Diverse Physical Phenomena During the Origin of Life. Annual review of biophysics. 39. 245-63. 10.1146/annurev.biophys.050708.133753.
Duhr, S. & Braun, D. (2005): Two-dimensional colloidal crystals formed by thermophoresis and convection Appl. Phys. Lett. 86, 131921
Enzmann, F. et al. (2018): Methanogens: biochemical background and biotechnological applications. AMB Express 8(1).
Früh-Green, G.L., Kelley, D.D., Bernascono, S.M., Karson, J.A.. Ludwig,K.A., Butterfeld, D.A., Boschi, C., and Proskurowski, G., 2003, 30,000 years of hydrothermal activity at the Lost City vent feld: Science, 301: 495–498, doi: 10.1126/science.1085582.
Herschy B. (2014): Nature ’s electrochemical flow reactors: Alkaline hydrothermal vents and the origins of life. Biochemist 36: 4–8.
Herschy B, Whicher A, Camprubi E, Watson C, Dartnell L, Ward J, Evans JRG, Lane N. (2014): An origin-of-life reactor to simulate alkaline hydrothermal vents. Journal of Molecular Evolution 79: 213–27.
Kelley, D. S. Früh-Green, G. L., Karson, J. A., Ludwig, K. A. (2007): The Lost City Hydrothermal Field Revisited. Oceanography. Band 20, Nr. 4, 2007, S. 90–99, doi:10.5670/oceanog.2007.09
Kelley DS, Karson JA, Blackman DK, et al. (2001): An off-axis hydrothermal vent field near the Mid-Atlantic Ridge at 30 degrees N. Nature 412: 145–49.
Kelley DS, Karson JA, Früh-Green GL, et al. A serpentinite-hosted submarine ecosystem: the Lost City Hydrothermal Field. Science 307: 1428–34 (2005).
Klussmann M, Iwamura H, Mathew SP, Wells DH Jr, Pandya U, et al. (2006) Thermodynamic control of asymmetric amplification in amino acid catalysis. Nature 441:621–23
Lane, N. (2010): Why Are Cells Powered by Proton Gradients? Nature Education 3(9):18
Lane, N. (2017): Der Funke des Lebens Energie und Evolution. Konrad Theis Verlag
Lever MA. (2011): Acetogenesis in the energy-starved deep biosphere: a paradox? Front. Microbiol. 2, 284. (doi:10.3389/fmicb.2011.00284)
Lipp JS, Morono Y, Inagaki F, Hinrichs K-U. (2008): Significant contribution of Archaea to extant biomass in marine subsurface sediments. Nature 454, 991–994. (doi:10.1038/nature07174)
Liu, Y., Whitman, W. B. (2008): Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea. Annals of the New York Academy of Sciences. 1125.
Lyu, Z., Shao, N., Akinyemi, T., Whitman, W. B. (2018): Methanogenesis. Current Biology 28(13): R727–R732.
Martin WF (2012): Hydrogen, metals, bifurcating electrons, and proton gradients: The early evolution of biological energy conservation. FEBS Letters 586: 485–93.
Martin W, Baross J, Kelley D, Russell MJ. (2008): Hydrothermal vents and the origin of life. Nature Reviews Microbiology 6: 805–14 (2008).
Martin, W., Russell, M. J. (2003): On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells. In: Philosophical Transactions of the Royal Society. Biological Sciences. 358 (1429):59–85, PMID 12594918, PMC 1693102
Martin W, Russell MJ. (2007): On the origin of biochemistry at an alkaline hydrothermal vent. Philosophical Transactions Royal Society B 367: 1887–1925.
Martin W, Sousa FL, Lane N. (2014): Energy at life’s origin. Science 344: 1092–93.
Mast CB, Braun D. (2010): Thermal trap for DANN replication. Phys. Rev. Lett. 104, 188102.
Me´nez B, Pasini V, Brunelli D. 2012 Life in the hydrated suboceanic mantle. Nat. Geosci. 5, 133–137. (doi:10.1038/ngeo1359)
Morowitz H. (1968): Energy Flow in Biology: Biological Organization as a Problem in Thermal Physics. Academic Press, New York.
Mortimer, C. E., Müller, U. (2020): Chemie. Das Basiswissen Chemie, 13. Auflage. Thimeverlag
Nitschke W, Russell MJ. (2009): Hydrothermal focusing of chemical and chemiosmotic energy, supported by delivery of catalytic Fe, Ni, Mo, Co, S and Se forced life to emerge. Journal of Molecular Evolution 69: 481–96.
Ooka, H. et al. (2019): Electrochemistry at Deep-Sea Hydrothermal Vents: Utilization of the Thermodynamic Driving Force towards the Autotrophic Origin of Life. ChemElectroChem 6, 1316
Oschmann, W. (2016): Evolution der Erde. Utb
Priye, A., Yu, Y., Hassan, Y., Ugaz, V. (2017): Synchronized chaotic targeting and acceleration of surface chemistry in prebiotic hydrothermal microenvironments. Proceedings of the National Academy of Sciences. 114. 201612924. 10.1073/pnas.1612924114.
Proskurowski G, Lilley MD, Seewald JS, Früh-Green GL, Olson EJ, Lupton JE, Sylva SP, Kelley DS. (2008): Abiogenic hydrocarbon production at Lost City hydrothermal field. Science 319, 604–607.
Prothero, D. (2021): The Evolving Earth. Oxford University Press
Prothero, D. & Dott, (2004): Evolution of the Earth, Seventh edition. McGrawHill
Russell, M. J. (2003): On the importance of being alkaline, Science, 302, 580–581.
Russell, M.J. (2007): The Alkaline Solution to the Emergence of Life: Energy, Entropy and Early Evolution. Acta Biotheor 55, 133–179. https://doi.org/10.1007/s10441-007-9018-5
Russell M (2011): Origins: Abiogenesis and the Search for Life. Cosmology Science Publishers, Cambridge MA
Russell, M. J., Daia, D. E., and Hall, A. J. (1998): The emergence of life from FeS bubbles at alkaline hot springs in an acid ocean, in Thermophiles: The Keys to Molecular Evolution and the Origin of Life, edited by: Wiegel, J., and Adams, M. W. W., Taylor and Francis, Washington, 77–126.
Russell MJ, Daniel RM, Hall AJ, Sherringham J. (1994): A hydrothermally precipitated catalytic iron sulphide membrane as a first step toward life. Journal of Molecular Evolution 39: 231–43.
Russell, M.J., Hall, A.J. (1997): The emergence of life from iron monosulphide bubbles at a submarine hydrothermal redox and pH front. J. Geol. Soc. (London) 154, 377–402
Russell, M.J., Hall, A.J. (2002): From geochemistry to biochemistry: chemiosmotic coupling and transition element clusters in the onset of life and photosynthesis. Geochem. News 113, 6–12
Russell MJ, Hall AJ. (2006): The onset and early evolution of life. In Evolution of early Earth’s atmosphere, hydrosphere and biosphere— constraints from ore deposits (eds SE Kesler, H Ohmoto), Memoir 198, pp. 1–32. Boulder, CO: Geological Society of America.
Russell MJ, Hall AJ (2009): A hydrothermal source of energy and materials at the origin of life. In: Chemical evolution II: from origins of life to modern society. American Chemical Society,
Russell MJ, Hall AJ, Cairns-Smith AG, Braterman PS. (1988): Submarine hot springs and the origin of life. Nature 336: 117.
Russell MJ, Hall AJ, Martin W. (2010): Serpentinization as a source of energy at the origin of life. Geobiology 8: 355–71.
Russell, M. J., Hall, A. J., Mellersh, A. R. (2003): On the dissipation of thermal and chemical energies on the early Earth: The onsets of hydrothermal convection, chemiosmosis, genetically regulated metabolism and oxygenic photosynthesis, in Natural and Laboratory-Simulated Thermal Geochemical Processes, edited by: Ikan, R., Dordrecht, Kluwer Academic Publishers, 325–388
Russell MJ, Martin W (2004): The rocky roots of the acetyl-CoA pathway. Trends Biochem Sci 29:358–363
Russell MJ, Nitschke W, Branscomb E. (2013): The inevitable journey to being. Philosophical Transactions Royal Society B 368: 20120254.
Schulte, M., Blake, D., Hoehler, T. & McCollom, T. M. (2006): Serpentinization and its implications for life on the early Earth and Mars. Astrobiology 6, 364–376.
Shock, E.L. (1990): Geochemical constraints on the origin of organic compounds in hydrothermal systems: Origins of Life and Evolution of the Biosphere, v. 20, p. 331–367, doi: 10.1007/BF01808115.
Shock, E.L. (1992): Chemical environments of submarine hydrothermal systems: Origins of Life and Evolution of the Biosphere, v. 22, p. 67–107, doi: 10.1007/BF01808019.
Shock E, Canovas P. (2010): The potential for abiotic organic synthesis and biosynthesis at seafloor hydrothermal systems. Geofluids 10: 161–92.
Shock, E.L., McCollom, T., Schulte, M.D. (1998): The emergence of metabolism from within hydrothermal systems, in Wiegel, J., and Adams, M.W.W., eds., Thermophiles: The keys to molecular evolution and the origin of life: Washington, Taylor and Francis, p. 59–76.
Shock, E.L., Schulte, M.D. (1998): Organic synthesis during fluid mixing in hydrothermal systems: Journal of Geophysical Research, v. 103E,p. 28513–28527, doi: 10.1029/98JE02142.
Sleep NH, Bird DK, Pope EC. (2011): Serpentinite and the dawn of life. Philosophical Transactions Royal Society B 366: 2857–69.
Sleep, N. H., Meibom, A., Fridriksson, T., Coleman, R. G., Bird, D. K. (2004): H2-rich fluids from serpentinization: geochemical and biotic implications. Proc. Natl Acad. Sci. USA 101, 12818–12823.
Sojo, V., Herschy, B., Whicher, A., Camprubí, E., & Lane, N. (2016). The Origin of Life in Alkaline Hydrothermal Vents. Astrobiology, 16(2), 181–197. doi:10.1089/ast.2015.1406
Takami H et al. (2012): A deeply branching thermophilic bacterium with an ancient acetyl-CoA pathway dominates a subsurface ecosystem. PLoS ONE 7, e30559. (doi:10.1371/journal.pone.0030559)
Thauer, R.K. (1998): Biochemistry of methanogenesis: A tribute to Marjory Stephenson: Microbiology, v. 144, p. 2377–2406.
Thauer, R. K., Kaster, A. K., Seedorf, H., Buckel, W., Hedderich, R. (2008): Methanogenic archaea: ecologically relevant differences in energy conservation. Nature Reviews Microbiology 6(8)
Yamaguchi A, Yamamoto M, Takai K, Ishii T, Hashimoto K, Nakamura R (2014): Electrochemical CO2 reduction by Nicontaining iron sulfides: how is CO2 electrochemically reduced at bisulfide-bearing deep sea hydrothermal precipitates? Electrochim Acta 141:311–318



